















Preview text:
BÀI GI NG HÓA HỌC ĐẠI C NG 1 LÊ TH S NH Khoa HÓA H C
Đ i H c Khoa H c Tự Nhiên - Đ i H c Qu c Gia tp HCM 2016 Aa 1 Ch ng 1 GIỚI THIỆU 1.1.
Đối tượng nghiên cứu của hóa học
Thế giới vật chất chung quanh chúng ta luôn luôn vận động và biến đổi. Hóa h c
ngày nay là khoa h c nghiên c u những quy luật liên quan tới các biến đổi c a vật chất
gắn liền với các sự thay đổi tính chất, thành phần, và cấu t o c a chúng. Do đó một
trong các vấn đề các nhà hóa h c quan tâm là gi i thích m i quan hệ giữa tính chất,
thành phần, và cấu t o c a vật chất. Ví dụ, điều gì làm cho kim c ơng c ng còn than chì
mềm, t i sao n ớc hòa tan đ ợc đ
ng mà không hòa tan đ ợc dầu, t i sao khi đ t
cháy than thì khí CO2 đ ợc t o thành đồng th i với sự phát nhiệt, v.v... Ngoài ra, chúng
ta ph i nhớ rằng tất c vật chất quanh ta, các chất s ng (từ tế bào tới động vật bậc cao)
và không s ng (đất đá, sông núi...) đều t o thành từ các hoá chất, do đó đ i t ợng quan
tâm c a các nhà hóa h c không ch là các vấn đề liên quan tới thế giới vô tri nh các
câu h i ví dụ trên, mà c thế giới các chất “s ng” quanh ta.
Không ch vậy, công việc quan tr ng c a các nhà hóa h c còn là nghiên c u để
tìm ra các ph ơng pháp và điều kiện để t o ra các chất mới, hoặc c i tiến ph ơng pháp
điều chế các chất đư biết. Trong lĩnh vực này, hóa h c liên quan rất mật thiết với cuộc
s ng c a chúng ta. Nh các công nghệ liên quan với hóa h c mà chúng ta có v i sợi,
thu c men, thực phẩm chế biến, phân bón, thu c trừ sâu…với vô s ch ng lo i thay đổi
theo nhu cầu c a cuộc s ng. Hóa h c hiện đ i còn nghiên c u để lắp ráp các phân tử
nh theo cách nào đó, t o thành những cấu trúc mới ch a từng biết tới trong tự nhiên, ví
dụ, các hợp chất với các lỗ x p có kích th ớc nhất đ nh để dùng trong các ngành công
nghiệp khác nhau. Hóa h c hiện đ i cũng tìm ra những ph ơng pháp mới để điều chế
hóa chất sao cho thân thiện với môi tr
ng hơn, h ớng nghiên c u này đ a tới một lĩnh
vực mới với tên g i là Hóa h c xanh (Green Chemistry)...
Trong quá trình nghiên c u tìm ra những chất mới, có không ít các chất đ ợc t o
thành mà không có giá tr thiết thực nào đ i với cuộc s ng, tuy nhiên điều đó không ph i
là hoàn toàn vô ích. Chính việc nghiên c u dẫn tới những chất “không thiết thực” đó góp
phần giúp các nhà hóa h c hiểu rõ hơn những yếu t liên quan tới sự biến đổi c a vật
chất, hoàn thiện hơn các kiến th c hóa h c. Các kiến th c đó không ch cho phép các
nhà hóa h c c i tiến, điều khiển các biến đổi hóa h c để hy v ng t o ra đ ợc những
chất mới đáp ng ngày càng t t hơn nhu cầu cuộc s ng c a chúng ta, mà còn giúp các
nhà khoa h c nghiên c u thế giới theo cách ngày càng hiệu qu hơn. 2
Nhiều kiến th c hóa h c tr ớc thế kỷ XVII đ ợc rút ra từ các thí nghiệm theo kiểu
“thử và sai”. Tuy nhiên, nếu tiến hành nghiên c u theo cách “thử và sai” không đ nh
h ớng thì vừa t n kém th i gian và công s c, vừa phung phí tiền b c. Ngày nay, kiến
th c hóa h c dựa trên các nguyên lý, các thuyết đ ợc rút ra từ sự khám phá thế giới
một cách có ph ơng pháp và hệ th ng, g i là ph ơng pháp nghiên c u khoa h c, sẽ
đ ợc giới thiệu trong phần tiếp theo sau đây. 1.2.
Phương pháp nghiên cứu khoa học
Galieo, Francis Bacon, Robert Boyle, và Isaac Newton là những ng i đầu tiên
khai sinh ph ơng pháp nghiên c u khoa h c vào thế kỷ XVII. Các nghiên c u theo
ph ơng pháp khoa h c luôn đ ợc bắt đầu bằng quan sát khách quan, không dựa trên
bất c đ nh kiến nào. Khi s l ợng quan sát đ lớn, ng
i ta có thể rút ra đ ợc các qui
luật chung để mô t các hiện t ợng quan sát đ ợc – g i là các đ nh luật (natural law).
Nhiều đ nh luật có thể đ ợc phát biểu d ới d ng các biểu th c toán h c. Ví dụ, đầu thế
kỷ XVI, Nicolas Copernicus quan sát cẩn thận sự di chuyển c a các hành tinh và kết
luận rằng trái đất và các hành tinh quay quanh mặt tr i theo những quỹ đ o tròn với
ph ơng trình nhất đ nh. Kết luận c a ông là ng ợc l i hẳn với những điều ng i ta tin
t ng th i đó, rằng trái đất là trung tâm c a vũ trụ, mặt tr i và các hành tinh khác quay
quanh trái đất. Giá tr c a đ nh luật là cho phép chúng ta dự đoán hiện t ợng sắp x y ra.
Ví dụ, các ph ơng trình c a Copernicus cho phép dự đoán đ ợc v trí c a trái đất trong
t ơng lai chính xác hơn các quan niệm th i bấy gi , nên có thể coi đ nh luật Copernicus
là một thành công. Tuy nhiên, ta cần nhớ rằng không ph i các đ nh luật luôn tuyệt đ i
đúng. Đôi khi kết qu từ các quan sát mới buộc chúng ta ph i điều ch nh đ nh luật. Ví dụ,
các qui luật c a Copernicus sau đó đư đ ợc điều ch nh b i Johannes Kepler, ng i cho
rằng các hành tinh chuyển động quanh mặt tr i trên những quỹ đ o hình elip. Để điều
ch nh đ nh luật – t c là điều ch nh kiến th c – các nhà khoa h c ph i thiết kế các thí
nghiệm để kiểm tra xem các kết luận tr ớc có luôn đúng với kết qu thực nghiệm không.
Bên c nh các qui luật chung đ ợc đ a ra d ng đ nh luật, các nhà khoa h c
cũng tìm cách gi i thích t i sao các hiện t ợng l i x y ra theo qui luật nh vậy. Các l i
gi i thích sơ kh i cho qui luật đ ợc g i là “gi thiết” (hypothesis). Khi có gi thiết, các
nhà khoa h c sẽ thiết kế các thí nghiệm để kiểm tra gi thiết. Nếu kết qu thực nghiệm
phù hợp với gi thiết, t c là gi thiết đúng, gi thiết sẽ đ ợc phát triển thành thuyết, hay
lý thuyết (model, theory). Nh vậy, thuyết chính là các l i gi i thích t i sao các hiện
t ợng tự nhiên x y ra theo qui luật nào đó. Nếu kết qu thực nghiệm mâu thuẫn với gi thiết, ng
i ta ph i điều ch nh gi thuyết, và tiến hành kiểm tra l i gi thuyết mới. Đôi khi 3
không có qui luật và l i gi i thích đúng cho tất c các hiện t ợng, khi đó gi thuyết phù
hợp nhất sẽ đ ợc giữ l i. Qua th i gian, các dữ kiện thực nghiệm mới đ ợc tích lũy,
một s lý thuyết và đ nh luật đ ợc điều ch nh, một s khác có thể b lo i b . Nói cách
khác, lý thuyết và đ nh luật không ph i là các kiến th c bất di bất d ch, mà chúng có thể
thay đổi khi có nhiều thông tin mới đ ợc thu thập. Trong khoa h c, kiến th c đ ợc tích
lũy và phát triển theo ph ơng pháp nghiên c u khoa h c, là chuỗi các quá trình quan sát
– đ a ra đ nh luật, gi thiết – thực nghiệm kiểm tra gi thiết và đ nh luật – đ a ra lý
thuyết. Chu trình đó đ ợc tóm tắt trong Hình 1.1.
Hình 1.1. Tóm tắt chu trình nghiên c u khoa h c
Nh vậy, các dữ kiện từ quan sát thực nghiệm là b ớc m đầu và cũng là tiêu
chuẩn để đánh giá giá tr c a các đ nh luật và lý thuyết. Do đó, chúng ta giới thiệu kỹ hơn
về quan sát: quan sát đ ợc tiến hành nh các giác quan c a con ng i và các công cụ mà con ng
i t o ra để n i dài các giác quan c a mình. Một s công cụ đơn gi n nhất
để quan sát mà chúng ta đều biết nh th ớc để đo độ dài, ng đong, lít để đo thể tích
chất l ng, cân để đo kh i l ợng, kính viễn v ng để thấy đ ợc những ngôi sao xa,
v.v… Việc quan sát trong nghiên c u hóa h c có thể tiến hành một cách đ nh tính hoặc
đ nh l ợng. Ví dụ, các quan sát cho thấy n ớc là chất l ng, dung d ch AgCl trộn với
dung d ch NaCl thì xuất hiện kết t a màu trắng, v.v… Đó là những quan sát đ nh tính.
Một s quan sát mang tính đ nh l ợng nh : n ớc nguyên chất đông đặc 0oC và sôi
100oC, chất kết t a màu trắng t o thành khi trộn dung d ch AgNO3 với dung d ch NaCl
ch a 75.27% b c và 24.73% clo theo kh i l ợng. Càng ngày con ng i càng tìm ra
nhiều công cụ mới để quan sát t t hơn thế giới tự nhiên, và đ nh luật cùng lý thuyết theo
đó cũng đ ợc điều ch nh. 4
Cũng l u ý rằng, đ nh luật và thuyết là hai s n phẩm lớn c a nghiên c u khoa
h c, nh ng đ nh luật khác với thuyết. Một cách ngắn g n có thể nói rằng đ nh luật tổng
kết những điều x y ra, còn lý thuyết gi i thích t i sao điều đó l i x y ra nh vậy. Điều
cần l u ý là lý thuyết là s n phẩm từ trí tuệ c a con ng
i. Bằng kinh nghiệm c a mình,
con ng i c gắng gi i thích thế giới tự nhiên qua các thuyết. Nói cách khác, lý thuyết là
ph ng đoán khoa h c c a con ng
i. Mu n ngày càng tiếp cận tới sự hiểu biết chính
xác hơn về thế giới tự nhiên, con ng
i ph i liên tục tiến hành những thực nghiệm mới
và điều ch nh các lý thuyết phù hợp với những hiểu biết mới.
Những điều ta vừa đề cập bên trên về ph ơng pháp nghiên c u khoa h c có thể coi là con đ ng lý t
ng nhất c a ph ơng pháp nghiên c u khoa h c. Thực tế con
đ ng đi tới kiến th c khoa h c không ph i bao gi cũng bằng phẳng và hiệu qu ,
không có đ m b o nào cho sự thành công c a nghiên c u khoa h c. Nh đư nói trên, gi thiết ch u nh h
ng c a quan sát, không những vậy, gi thiết còn luôn dựa trên
những nền t ng lý thuyết tr ớc đó, và trên hết, c gi thiết và quan sát dều do con
ng i tiến hành nên không tránh đ ợc sự ch quan c a con ng i. Các kết qu nghiên
c u tâm lý h c ch ra rằng, con ng i th
ng dễ thấy những điều theo h ớng ta mong
đợi hơn là nhận ra những điều ta không mong đợi. Nói cách khác, khi kiểm ch ng lý thuyết chúng ta th
ng tập trung vào những vấn đề đang xét, điều này là rất cần thiết,
nh ng cùng lúc, sự tập trung đó có thể làm ta không nhìn thấy các kh năng gi i thích
vấn đề theo các h ớng mới l hơn. Điều này có thể làm h n chế óc sáng t o c a chúng
ta, và cũng có thể ngăn c n chúng ta nhận th c vấn đề một cách toàn diện và sát với thực tế hơn. 1.3.
Nội dung và yêu cầu của môn Hóa học đǛi cương
Nh vừa nói trên, nghiên c u khoa h c đ ơc thực hiện theo trình tự quan sát –
đ nh luật và lý thuyết – áp dụng. Trong môn h c Hóa đ i c ơng, chúng ta sẽ quan tâm
ch yếu tới các đ nh luật và lý thuyết nền t ng đư đ ợc các nhà hóa h c công nhận. Nói
cách khác, môn h c Hóa đ i c ơng sẽ cung cấp cho sinh viên những nguyên lý cơ b n
nhất trong hóa h c thông qua các thuyết và đ nh luật. Các nguyên lý đó là cơ s để dự
đoán tính chất c a các chất cũng nh kh năng ph n ng c a chúng để chuyển hóa một
chất nào đó thành chất này hay chất khác.
H c xong môn Hóa h c đ i c ơng, chúng ta ph i nắm đ ợc nội dung c a các
thuyết và đ nh luật cơ b n trong hóa h c, vận dụng đ ợc thuyết và đ nh luật để gi i thích
cũng nh dự đoán đ ợc một s quá trình trong thực tế. Điều chúng ta cần l u ý là có
thể có nhiều thuyết cùng gi i thích một vấn đề, ví dụ thuyết liên kết cộng hóa tr (VB) và 5
thuyết vân đ o phân tử (MO) đều có thể gi i thích sự t o thành liên kết trong các hợp
chất, nh ng mỗi thuyết đều có mặt m nh và yếu khác nhau, do đó chúng ta ph i quan
tâm đến các mặt m nh yếu c a các thuyết và đ nh luật để sử dụng các chúng một cách hợp lý. 6 Ch ng 2
NGUYÊN TỬ – NGUYÊN TỐ HÓA HỌC – ĐỒNG VỊ 2.1.
Sơ lược lịch sử hóa học đến thế kỷ XIX
Vật chất quanh ta do đâu mà có, cấu t o thế nào, biến đổi gì đư x y ra khi ta đ t
lửa, hay n ớng quặng để thu kim lo i làm đồ trang s c, vũ khí, v.v… Các câu h i đó đư
đ ợc quan tâm từ thu sơ khai c a xã hội loài ng i. Từ đó đư có nhiều cách gi i thích
khác nhau về nguồn g c và cấu t o c a thế giới vật chất quanh ta. Kho ng 400 năm tr ớc công nguyên, ng i Hy L p là những ng
i đầu tiên đ a ra các gi i thích cho sự
thay đổi c a vật chất. H cho rằng tất c vật chất đ ợc t o thành từ b n nguyên t
chính: lửa, đất, n ớc, và không khí; các sự thay đổi c a vật chất là do sự kết hợp khác
nhau c a b n yếu t trên. Khác với ng
i Hy l p, Democrius, một nhà triết h c th i bấy
gi cho rằng vật chất đ ợc t o thành từ những h t rất nh không thể nhìn thấy hay phân
chia đ ợc nữa, ông g i các h t đó là nguyên tử (Democrius g i là atomos, ngày nay ta
g i là atom). Có thể coi đây là thuyết đầu tiên gi i thích cấu t o c a vật chất dựa trên
khái niệm nguyên tử. Tuy nhiên thuyết này xuất phát từ trực giác c a con ng i ch
không ph i từ kết qu thực nghiệm.
Hai ngàn năm tiếp theo là giai đo n gi kim thuật. Các nhà gi kim luôn luôn b
ám nh b i mong mu n chuyển các kim lo i rẻ tiền thành vàng. Mặc dù không thực hiện
đ ợc điều đó, các nhà gi kim đư khám phá ra một s nguyên t hóa h c nh th y
ngân, l u huỳnh, antimon, và biết cách điều chế một s acid vô cơ.
Nền móng c a hóa h c hiện đ i bắt đầu từ thế k XVI với sự phát triển c a luyện kim, do Georg Bauer (ng
i Đ c), và việc dùng các khoáng chất vào y h c b i Paracelus (ng
i Thụy Sĩ). “Nhà hóa h c” đầu tiên tiến hành các thực nghiệm mang tính
đ nh l ợng thực sự là Roberrt Boyle (1627 – 1691) với các thí nghiệm kh o sát m i quan
hệ giữa thể tích và áp suất c a các chất khí. Những nghiên c u đ nh l ợng trong vật lý
và hóa h c thực sự phát triển sau khi Boyle xuất b n cu n “The Steptical Chemist” vào
năm 1661. Bên c nh các nghiên c u chất khí, Boyle cũng nhận thấy rằng kim lo i tr
nên nặng hơn khi đ t cháy, từ đó ông cho rằng mỗi chất là một nguyên t , trừ khi nó b
bẻ gãy thành những nguyên t đơn gi n hơn. Sau đó, những chất khí đầu tiên nh oxy,
nitơ, carbonic, hydro dần dần đ ợc khám phá, và s nguyên t hóa h c đ ợc biết tăng
lên không ngừng. Các thí nghiệm xác nhận các nguyên t dần dần đ ợc chấp nhận rộng
rãi và thay thế hẳn thuyết “b n nguyên t ” c a ng
i Hy L p. Điều thú v là mặc dù
Boyle là nhà khoa h c xuất sắc, ông vẫn có những nhận đ nh sai lầm. Ông vẫn trung 7
thành với quan điểm c a các nhà gi kim thuật rằng kim lo i không là nguyên t thực sự,
và có thể tìm đ ợc cách chuyển kim lo i này thành kim lo i khác.
Chính các nghiên c u đ nh l ợng là tiền đề thúc đẩy sự ra đ i c a các đ nh luật
cơ s c a hóa h c. Antoine Lavoisier (1743 – 1794) cẩn thận nghiên c u tổng kh i
l ợng c a tác chất và s n phẩm trong các ph n ng hóa h c và nhận thấy kh i l ợng
c a chúng không tăng lên cũng không mất đi. Và từ đó, định luật bảo toàn khối lượng ra
đ i. Đây là đ nh luật đầu tiên đặt tiền đề cho sự phát triển hóa h c trong thế kỷ XIX.
Giai đo n thế kỷ XVIII – XIX là giai đo n tìm ra một lo t các đ nh luật khoa h c tự
nhiên làm tiền đề cho sự phát triển hóa h c. Joseph Proust (1754 – 1826) đư tìm ra định
luật thành phần không đổi khi nhận thấy rằng các chất dù đ ợc điều chế bằng cách nào
cũng đều ch a các nguyên t nh nhau với t lệ kh i l ợng bằng nhau. Jonh Dalton
(1766 – 1844) nghiên c u thành phần c a nguyên t trong các hợp chất và tìm ra định
luật tỷ lệ bội: khi hai nguyên t t o thành một chuỗi các hợp chất, t lệ kh i l ợng c a
nguyên t th hai kết hợp với 1 gam nguyên t th nhất luôn luôn chia chẵn cho một s
nh nhất. Ví dụ, kh i l ợng oxy kết hợp với 1 gam carbon trong hai hợp chất khí c a nó
là 1.33 g (hợp chất I) và 2.66 g (hợp chất II). Ta thấy hợp chất II giàu oxygen hơn hợp
chất I, t lệ kh i l ợng oxygen trong hai hợp chất trên là s nguyên, 2. Từ đó, Dalton cho
rằng nếu hợp chất I có công th c là CO thì hợp chất II ph i có công th c là CO2.
Dựa trên những kết qu thực nghiệm trong giai đo n này, năm 1808 Dalton đ a
ra thuyết nguyên tử, nội dung gồm các điểm sau:
Mỗi nguyên t đ ợc t o thành từ những h t rất nh không phân chia đ ợc, g i là nguyên tử.
Các nguyên tử c a cùng một nguyên t thì gi ng nhau. Các nguyên t khác nhau có nguyên tử khác nhau.
Các nguyên tử kết hợp với nhau t o thành các hợp chất. Mỗi hợp chất luôn có
một t lệ xác đ nh s nguyên tử các lo i t o thành nó.
Khi ph n ng hóa h c x y ra, có sự sắp xếp l i c a các nguyên t trong hợp chất.
Nói cách khác, các nguyên tử kết hợp với nhau theo cách khác để t o thành các
hợp chất mới, nh ng b n thân nguyên tử không thay đổi trong ph n ng hóa h c.
Từ đó các khái niệm về nguyên tử, nguyên t hóa h c, phân tử trong hóa h c dần
dần tr nên quen thuộc và rõ ràng hơn. Cũng từ những nghiên c u đ nh l ợng, các kiến
th c hóa h c tăng lên một cách mau chóng. Dựa vào kết qu đ nh l ợng tỷ lệ kh i
l ợng giữa các nguyên t trong hợp chất (ví dụ đ i với n ớc: c 1 kh i l ợng hydro thì 8
có 8 lần kh i l ợng oxy), Dalton là ng
i đầu tiên lập nên b ng kh i l ợng nguyên tử
t ơng đ i c a các nguyên t . Vì trong các hợp chất, H luôn có kh i l ợng nh nhất nên
kh i l ợng nguyên tử t ơng đ i c a H đ ợc quy ớc là 1. Từ đó, ng i ta suy ra kh i
l ợng nguyên tử c a các nguyên t khác. Vì lúc đó công th c phân tử c a nhiều chất
ch a đ ợc biết rõ nên có nhiều sai lầm trong b ng kh i l ợng t ơng đ i này. Ví dụ vì
ch a biết công th c phân tử c a n ớc, nên từ các kết qu đ nh l ợng Dalton cho rằng
kh i l ợng nguyên tử c a H là 1, c a O là 8. Tuy vậy, việc lập b ng kh i l ợng nguyên
tử c a Dalton là một b ớc qua tr ng cho những khám phá tiếp theo.
Khi nghiên c u đ nh l ợng các ph n ng giữa các chất khí, năm 1809 Gay –
Lussac nhận thấy c 2 lần thể tích khí hydro ph n ng với một thể tích khí oxy và t o 2
lần thể tích hơi n ớc, còn 1 thể tích khí hydro ph n ng với 1 thể tích khí clo t o 2 lần
thể tích khí hydro clorur.
Để gi i thích kết qu thí nghiệm c a Gay – Lussac, năm 1811 Amedeo Avogadro
đ a ra gi thiết rằng cùng nhiệt độ và áp suất, những thể tích bằng nhau c a các khí
khác nhau ch a cùng một s l ợng “h t” bằng nhau. Gi thiết này ch hợp lý nếu
kho ng cách giữa các h t trong thể tích khí rất lớn so với kích th ớc từng h t.
Từ gi thiết c a mình, Avogadro đư biểu diễn và gi i thích kết qu thí nghiệm c a Gay – Lussac nh sau:
2 thể tích hydro + 1 thể tích oxy → 2 thể tích n ớc ng với
2 phân tử hydro + 1 phân tử oxy → 2 phân tử n ớc
Các dữ kiện trên ch có thể gi i thích t t nhất nếu thừa nhận rằng các khí hydro,
oxy có phân tử nh nguyên tử: H2, O2, còn n ớc có công th c phân tử là H2O. Đáng tiếc
là những gi i thích c a Avogadro không đ s c thuyết phục các nhà hóa h c bấy gi .
Sau đó, Stanislao Cannizzaro tiến hành một lo t các thí nghiệm đo kh i l ợng
t ơng đ i c a các chất khí so với khí hydro trong cùng điều kiện nhiệt độ và áp suất. Ví
dụ, ông đo đ ợc t lệ kh i l ợng c a 1 lít oxy và 1 lít hydro là 16:
Tin t ng vào thuyết nguyên tử c a Dalton và gi thiết c a Avogadro,
Canmizzaro lập luận rằng nếu kh i l ợng phân tử c a hydro (H2) bằng 2, từ đó dễ dàng
suy ra kh i l ợng phân tử oxy (O2) là 32, kh i l ợng nguyên tử c a hydro (H) là 1, kh i
l ợng nguyên tử c a oxy (O) là 16. 9
B ng 2.1. Kh i l ợng t ơng đ i c a carbon trong các phân tử khác nhau Kh i l ợng % kh i l ợng C Kh i l ợng c a C Hợp chất phân tử trong hợp chất trong phân tử Methane 16 75 12 Ethane 30 80 24 Propane 44 82 36 Butane 58 83 48 Khí Carbonic 44 27 12
T ơng tự nh vậy, Cannizzaro đo đ ợc kh i l ợng phân tử c a khí carbonic là
44. Các thí nghiệm phân tích thành phần c a hợp chất này cho thấy carbon chiếm 27%
kh i l ợng. Từ đó tính đ ợc trong 44 gam carbon dioxide có (0.27) x (44 gam) = 12 gam
carbon, vậy oxy chiếm 32 gam, t c là có 2 nguyên tử O trong phân tử khí carbonic.
Cannizzaro cũng tiến hành xác đ nh kh i l ợng phân tử và kh i l ợng c a các nguyên
tử t o thành các chất khí ch a carbon khác nh methane, ethane, propane, butane…
Kh i l ợng c a carbon trong các phân tử từ lo t thí nghiệm trên luôn là bội s c a 12
(xem B ng 2.1). Các dữ liệu này thuyết phục m nh mẽ cho đề ngh kh i l ợng t ơng đ i
c a nguyên tử carbon là 12, và công th c phân tử c a khí carbonic là CO2.
Năm 1860, t i Hội ngh Hóa h c thế giới lần th nhất Đ c, trong các cuộc th o
luận trên diễn đàn lẫn ngoài hành lang, Cannizzaro đư dùng thuyết nguyên tử c a Dalton
cùng gi thuyết c a Avogadro để gi i thích các kết qu thí nghiệm c a mình. Với s
l ợng dữ liệu thực nghiệm đ nhiều, các gi i thích c a Cannizzaro đư thuyết phục hội
ngh , và từ đó hóa h c đư có quy ớc kh i l ợng nguyên tử th ng nhất. Cũng nói thêm
rằng, Cannizzaro không xác đ nh chính xác kh i l ợng nguyên tử mà ch xác đ nh đ ợc
các giá tr gần đúng c a kh i l ợng t ơng đ i c a các nguyên tử. Berzelius chính là
ng i tiến hành các thí nghiệm đ nh l ợng chính xác kh i l ợng t ơng đ i c a các nguyên tử.
Với những tiến bộ c a hóa h c trong th i gian này, vào đầu năm 1800, các nhà
hóa h c biết đ ợc 31 nguyên t hóa h c, nh ng đến năm 1860 s nguyên t đ ợc xác
đ nh kh i l ợng nguyên tử cũng nh tính chất hóa h c đư lên tới 60. Lúc đó các nhà
khoa h c đư nhận biết nhiều nguyên t có tính chất hóa h c t ơng tự nhau. Đến năm
1872, Mendeleev sắp xếp các nguyên t theo biến thiên tính chất c a chúng thành b ng phân lo i tuần hoàn, m đ
ng cho nghiên c u tính chất các nguyên tử và hợp chất
một cách có hệ th ng hơn. 10 2.2.
Các thí nghiệm khám phá cấu trúc nguyên tử
Từ các công trình nghiên c u c a Dalton, Gay – Lussac, Cannizzaro, v.v… các
khái niệm nguyên tử, nguyên t hóa h c, phân tử… dần dần tr nên có ý nghĩa trong
các nghiên c u và đ ợc thừa nhận rộng rưi. Tuy nhiên mưi đến cu i thế kỷ XIX, đầu thế
kỷ XX, b n chất và thành phần cấu t o c a nguyên tử mới dần dần đ ợc khám phá từ
thực nghiệm. Nhắc l i rằng, các kiến th c khoa h c mới luôn đ ợc xây dựng từ các kiến
th c tr ớc đó. Vì vậy, chúng ta cần nói qua rằng tr ớc khi khám phá ra thành phần
nguyên tử, các nhà khoa h c đư biết đến các hiện t ợng và tính chất điện – từ. H đư
biết hầu hết vật chất quanh ta trung hòa điện, nh ng chúng có thể tr thành tích điện
bằng cách nào đó. Ví dụ, khi chà m nh qu bóng cao su vào tấm v i, chúng tr thành tích điện khác nhau, th
ng g i là điện d ơng và âm. Các nhà khoa h c cũng biết rằng
các vật mang điện cùng dấu thì đẩy nhau, còn các vật mang điện trái dấu thì hút nhau.
2.2.1. Sự phát hiện ra electron
Hình 2.1. Cấu t o c a đèn âm cực
Thiết b quan tr ng góp phần khám phá cấu t o nguyên tử là đèn âm cực, còn g i
là đèn cathode (Cathode-ray tube, viết tắt là CRT). CRT không xa l với chúng ta, nó
đ ợc dùng làm đèn hình TV và máy tính cho đến những năm 2000, tr ớc khi đ ợc thay
thế bằng các màn hình tinh thể l ng (liquid crystal display, LCD). Michael Faraday (1791
– 1867) là ng i đầu tiên khám phá ra chùm tia âm cực vào giữa thế kỷ XIX. Ông thấy
rằng khi áp điện thế cao vào hai điện cực kim lo i đặt trong một ng chân không thì từ
cực âm c a ng (cathode) xuất hiện một chùm tia, sau này đ ợc g i là tia âm cực,
h ớng về phía cực d ơng (anode) c a ng. ng này đ ợc g i là CRT. Cấu t o c a
CRT đ ợc biểu diễn trong Hình 2.1. Bình th
ng chúng ta không thấy đ ợc tia âm cực
t o thành trong CRT, nh ng chúng phát quang khi va đập vào một s vật liệu, g i là vật 11
liệu phát quang, hay fluorescence. Vì vậy, bằng cách sơn các vật liệu gây phát quang
vào đầu anode c a đèn, ng i ta phát hiện đ ợc tia âm cực.
Hình 2.2. Chùm tia âm cực b lệch khi đi qua điện tr ng hoặc từ tr ng
Sau đó các nhà khoa h c biết thêm rằng, bình th ng chùm âm cực đi thẳng,
nh ng nếu đặt một tụ điện (điện tr ng) hoặc nam châm (từ tr ng) trên đ ng đi c a
chùm âm cực, tia âm cực sẽ b lệch về phía cực d ơng c a tụ điện hoặc nam châm
(xem Hình 2.2). Hiện t ợng này lặp l i khi thay cực âm c a CRT bằng nhiều kim lo i
khác nhau. Để gi i thích hiện t ợng này, năm 1897 J.J. Thomson cho rằng chùm âm
cực là chùm các h t mang điện tích âm, sau này đ ợc g i là các electron, hay điện tử. Bằng các phép đo c
ng độ từ tr ng áp vào và độ lệch c a chùm tia âm cực,
Thomson đư xác đ nh t s giữa kh i l ợng (m) và điện tích (e) c a electron là
m/e = – 5.6857 x 10–9 g/Coulomb.
Hình 2.3. Mô hình nguyên tử c a Thomson: nguyên tử nh một đám mây hình cầu tích
điện d ơng, các electron mang điện âm nằm r i rác trong đám mây
Vì hiện t ợng trên không phụ thuộc vào b n chất vật liệu làm cực âm c a CRT,
Rutherford cho rằng tất c các nguyên tử đều ch a electron. Hơn nữa, b n thân kim lo i
không tích điện, t c là nguyên tử trung hòa điện, nên nguyên tử cũng ph i có các h t
m ng điện d ơng. Từ lập luận này, ông nêu lên mô hình cấu t o nguyên tử đầu tiên từ
kết qu thực nghiệm đó, mô hình nguyên tử c a Thomson (Hình 2.3) là nguyên tử nh
một đám mây hình cầu tích điện d ơng, các electron mang điện âm nằm r i rác trong
đám mây đó. Khi nguyên tử mất một vài electron, ta có ion d ơng. 12
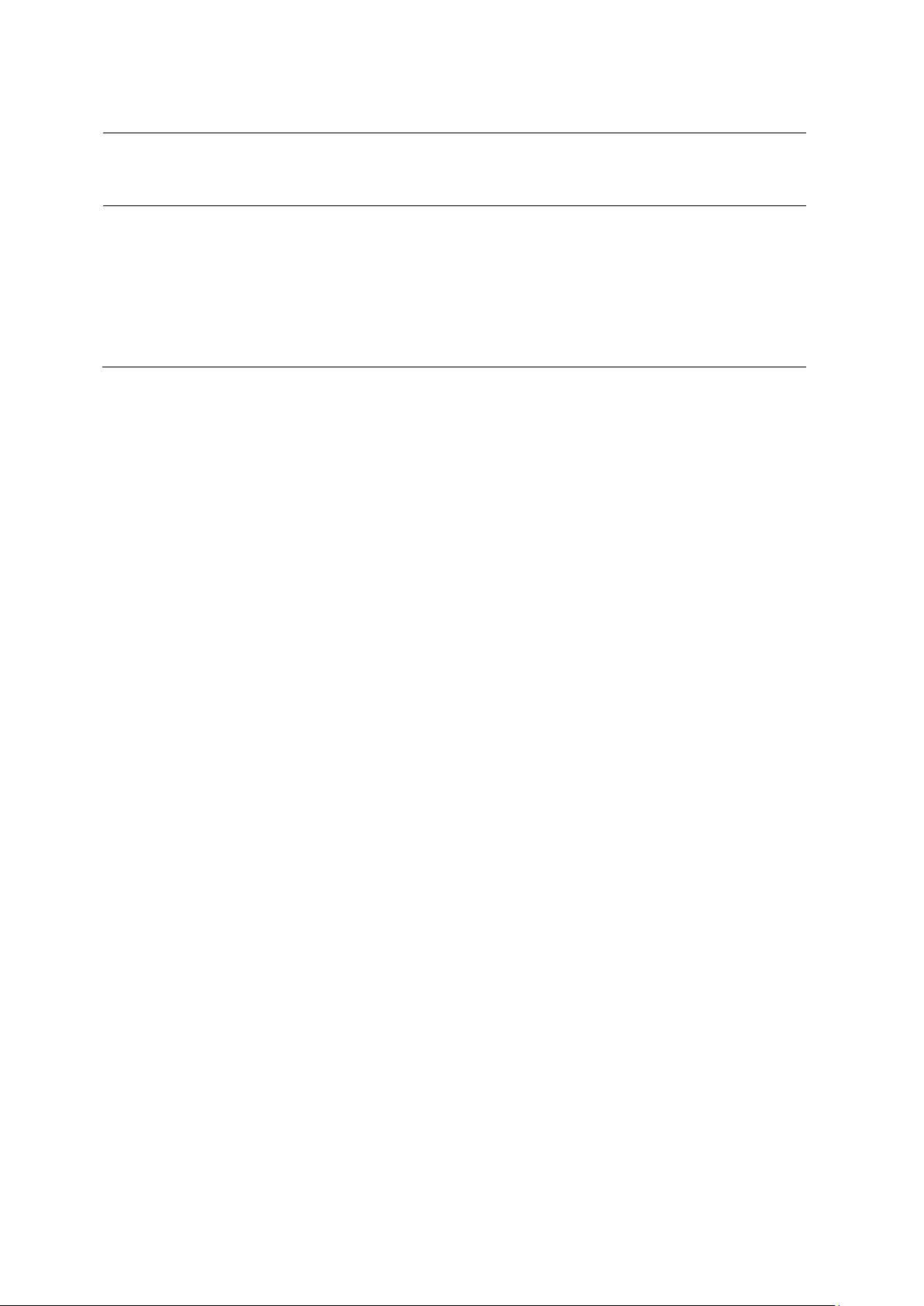
Năm 1909, Robert Millikan quan sát các gi t dầu nh tích điện rơi trong điện tr
ng. Khi không tích điện, các h t dầu ch rơi d ới tác dụng c a tr ng tr ng. Khi các
h t dầu đ ợc tích điện âm, chúng sẽ ch u nh h ng cùng lúc c a tr ng tr ng và điện tr
ng. Bằng cách đo cẩn thận kh i l ợng và t c độ rơi c a các h t dầu tích điện khi thay đổi điện tr
ng, Millikan phát hiện điện tích c a các h t dầu luôn là bội s c a
1.6 x 10–19 C. Điện tích đó đ ợc coi là đơn v điện tích và cũng là điện tích c a electron.
Kết hợp với kết qu thực nghiệm c a Thomson, kh i l ợng c a electron tìm đ ợc là
9.11 x 10–31 kg. Nh vậy, sự tồn t i c a electron trong nguyên tử đư đ ợc xác nhận.
Hình 2.4. Sơ đồ thí nghiệm gi t dầu rơi c a Millikan
2.2.2. Hiện tượng phóng xǛ tự nhiên
Vào thế kỷ XIX, Antoine Henri Becquerel là ng
i đầu tiên khám phá ra một s
hợp chất c a uranium tự phát ra các tia có kh năng làm đen giấy nh. Sau đó,
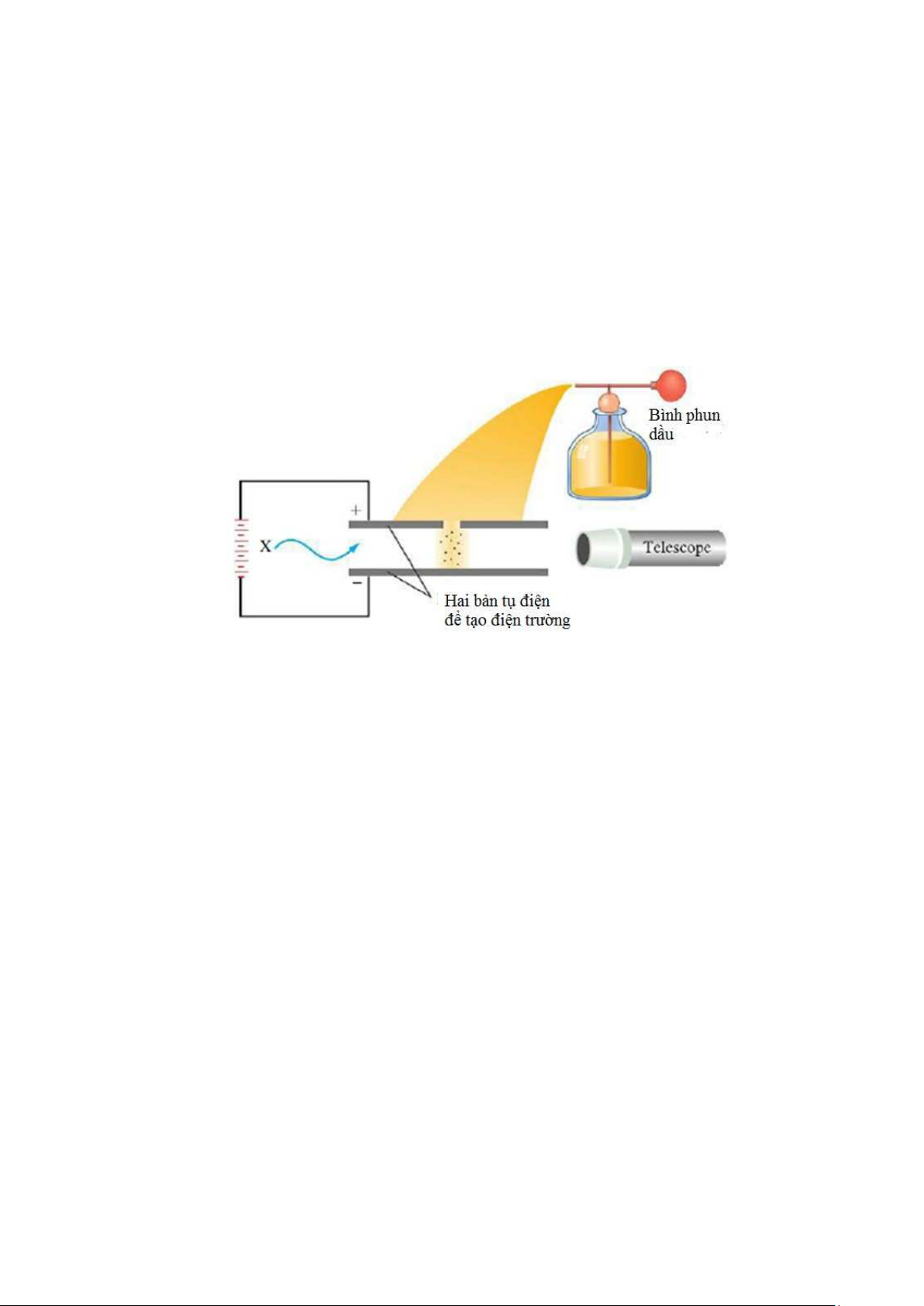
Rutherford và Paul Villard xác đ nh thành phần các tia phóng x là:
Tia alpha, , gồm các h t mang điện tích +2 (ng ợc dấu, có độ lớn gấp đôi điện
tích c a electron), sau này đ ợc biết là h t nhân c a nguyên tử Heli;
Tia beta, , là các electron có t c độ cao;
Tia gamma, , là sóng điện từ có năng l ợng cao.
Nh vậy sự tồn t i c a các electron mang điện tích âm cũng nh các h t mang
điện tích d ơng cũng đ ợc xác nhận trong hiện t ợng phóng x tự nhiên. 13
Hình 2.5. Thành phần và tính chất c a các tia phóng x tự nhiên
2.2.3. HǛt nhân nguyên tử
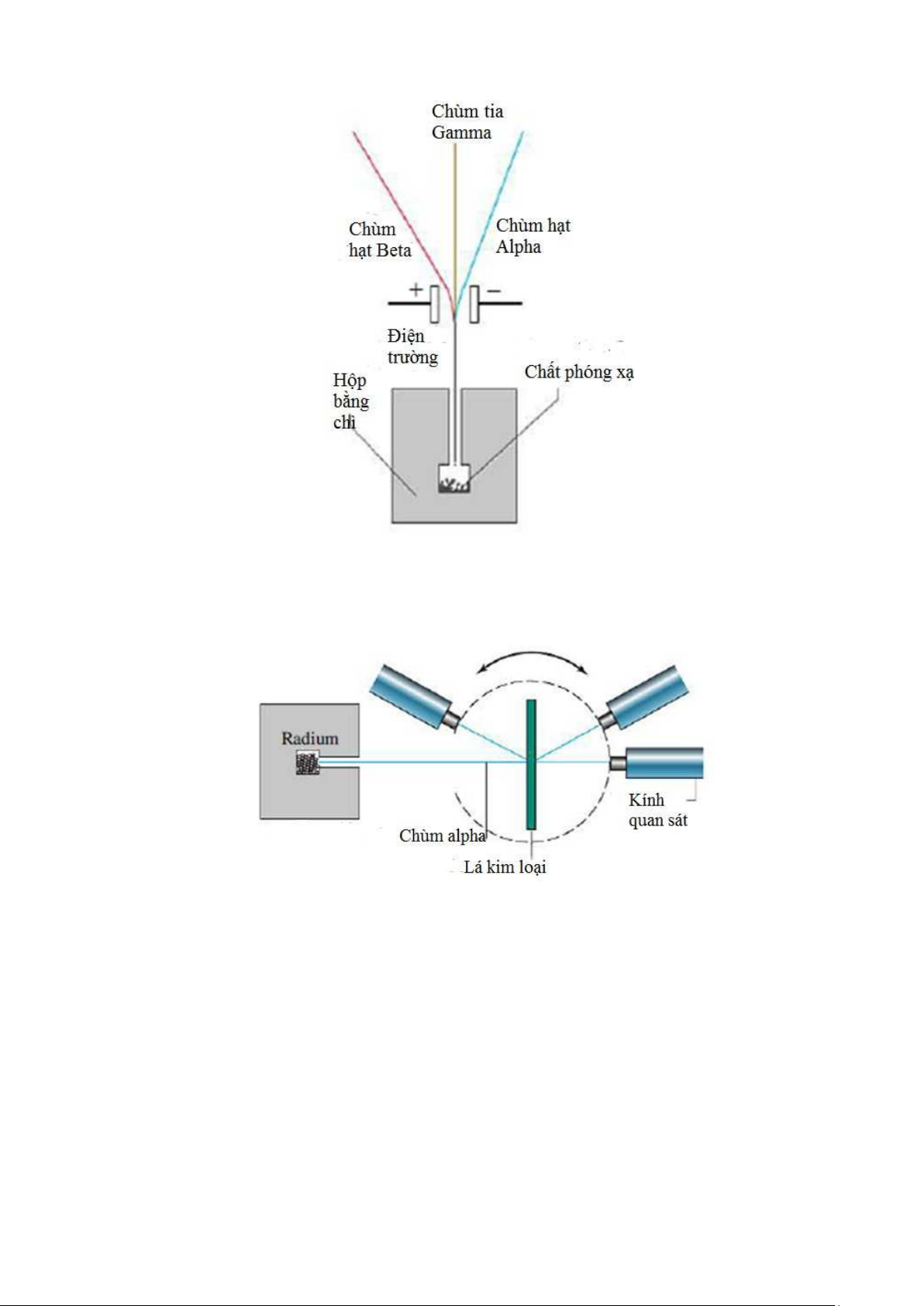
Hình 2.6. Sơ đồ thí nghiệm bắn h t vào tấm kim lo i c a Rutherford
Năm 1909, Emest Rutherford và phụ tá c a mình, Hans Geiger, thiết kế thí
nghiệm dùng chùm h t bắn vào các lá kim lo i m ng để nghiên c u sự phân b các
electron trong nguyên tử. Dựa vào mô hình nguyên tử c a Thomson, h dự đoán một
phần chùm sẽ b lệch h ớng nhẹ khi va ch m với các electron. Mô hình thiết b nghiên
c u đ ợc biểu diễn trong Hình 2.6, trong đó có thể theo dõi các h t sau khi bắn vào
tấm kim lo i bằng các ng kính có màn hình đ ợc sơn ZnS. Hans Geiger và Ernst
Marsden, một h c trò khác c a Rutherford, đư quan sát thấy (xem Hình 2.7): 14
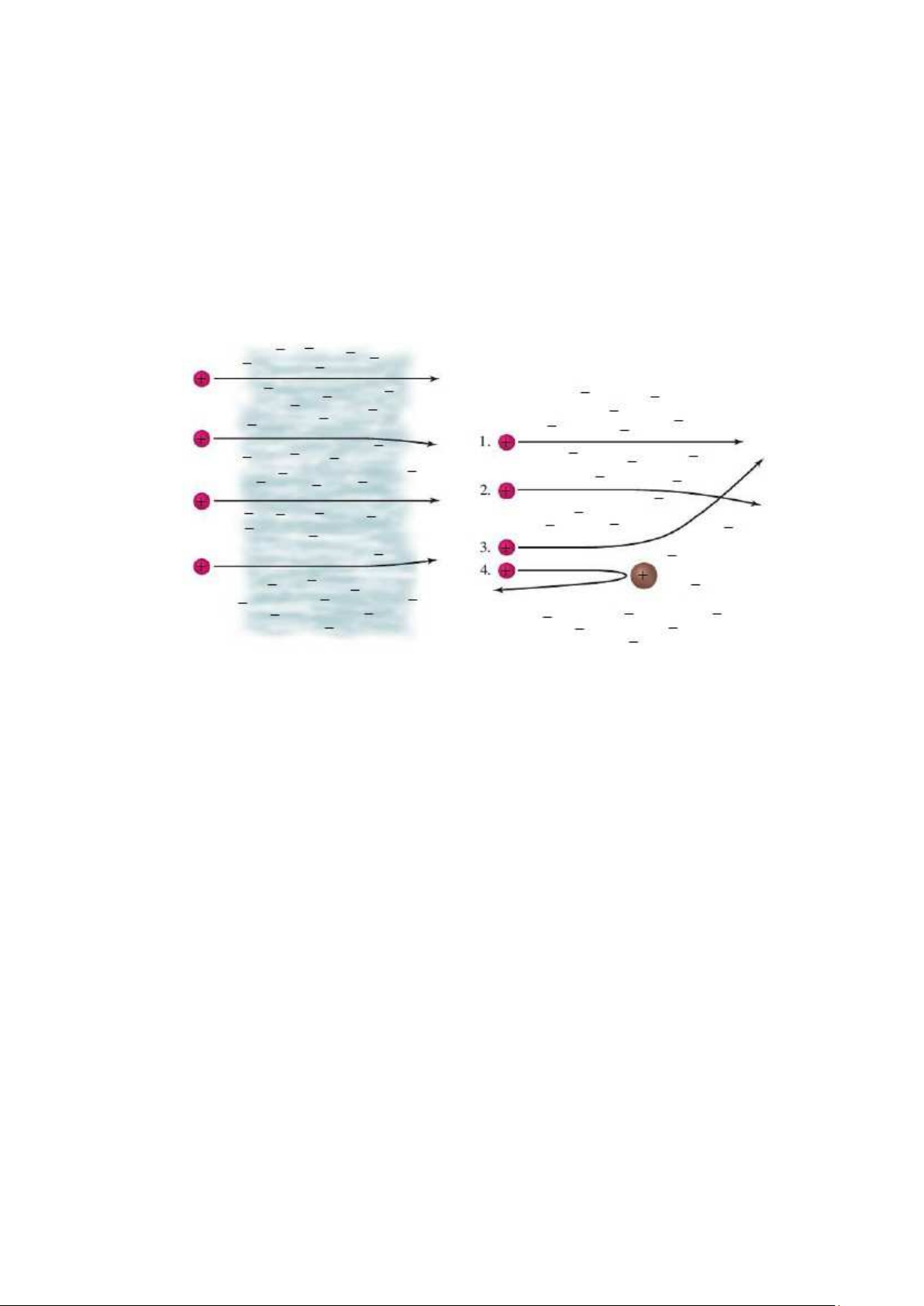
1. Phần lớn các h t trong chùm xuyên thẳng qua lá kim lo i mà không b chệch h ớng;
2. Một l ợng nh các h t b chệch h ớng nhẹ;
3. Một l ợng rất nh (kho ng 1/20000) các h t lệch h ớng đáng kể khi đập vào lá kim lo i;
4. Một l ợng kho ng 1/20000 h t khác không xuyên qua tấm kim lo i, mà b
dội ng ợc tr l i h ớng ban đầu.
Hình 2.7. Kết qu thí nghiệm c a Rutherford (xem chi tiết trong bài)
Rutherford cho rằng s ít các h t b ph n x ng ợc theo những h ớng khác
nhau do va ch m với các “h t” mang điện tích d ơng trong lá kim lo i. Kết qu này cho
thấy các h t mang điện tích d ơng tập trung vùng rất nh trong nguyên tử, mô hình
nguyên tử theo kiểu đám mây hình cầu tích điện d ơng c a Thomson là không hợp lý,
mà nguyên tử ph i “rỗng”. Năm 1911, Rutherford đ a ra mô hình nguyên tử mới nh sau:
- Nguyên tử gồm h t nhân mang điện tích d ơng, có kích th ớc rất nh nằm
tâm nguyên tử, phần không gian còn l i c a nguyên tử là rỗng;
- Điện tích d ơng c a h t nhân nguyên tử thay đổi từ nguyên tử này qua
nguyên tử khác, và bằng tổng điện tích âm c a các electron trong nguyên tử,
do đó nguyên tử trung hòa điện;
- Các electron mang điện tích âm chuyển động quanh nhân và kho ng cách khá xa so với nhân.
Mẫu nguyên tử c a Rutherford đư th a mãn các dữ kiện thực nghiệm lúc bấy gi
về cấu trúc chung c a nguyên tử, và mô hình chung này vẫn đ ợc dùng cho cấu trúc 15
nguyên tử hiện đ i (Hình 2.8). Tuy nhiên, các nhà khoa h c lúc đó vẫn không tr l i
đ ợc th a đáng cho câu h i: t i sao electron mang điện âm không rơi vào h t nhân mang điện tích d ơng?
2.2.4. Sự khám phá các hǛt trong nhân nguyên tử
Những khám phá mới về sự phân rã phóng x h t nhân nguyên tử đầu thế kỷ XX
khiến các nhà khoa h c nghĩ rằng h t nhân nguyên tử ph i đ ợc t o thành từ những h t
nh hơn. Khi Moseley nghiên c u tia X phát ra từ những nguyên tử khác nhau, ông đư
đo đ ợc điện tích h t nhân nguyên tử. Kết qu thú v là điện tích h t nhân c a các
nguyên tử khác nhau cách nhau từng đơn v một.
Năm 1918, Rutherford cho bắn chùm tia xuyên qua khí nitơ, ông thấy có t o
thành một đồng v c a oxy và các h t t ơng tự h t nhân c a nguyên tử H, ph n ng
đ ợc biểu diễn nh sau: 14N7 + 4He2 17O8 + 1H1; sự tồn t i c a h t proton (1H1) với
điện tích d ơng +1 đ ợc xác nhận.
Từ năm 1920, các nhà khoa h c đư nghi ng sự tồn t i c a các h t neutron
không mang điện trong nhân, nh ng việc ch ng minh nghi vấn trên bằng thực nghiệm
gặp khó khăn do tính trung hòa điện c a h t neutron. Năm 1932, khi dùng h t bắn phá
nhân nguyên tử Be, các nhà khoa h c thấy có sự phát ra b c x l ch a từng biết tới.
Joliot – Curie cho b c x l này bắn vào parafin thì thấy t o ra các h t proton. Bằng đ nh
luật b o toàn kh i l ợng, James Chadwick dự đoán b c x l đó là các h t neutron
không mang điện, có kh i l ợng hơi lớn hơn proton. Sau đó ông thiết kế các thí nghiệm
để ch ng minh đó là neutron. Nh vậy đến lúc đó ng i ta biết trong nhân nguyên tử có
hai lo i h t chính, là proton và neutron.
2.2.5. Cấu tǛo và các đặc trưng cơ bǝn của nguyên tử
Tóm l i, những kết qu thực nghiệm cu i thế kỷ XIX và đầu thế kỷ XX đư ch ng
t rằng nguyên tử đ ợc t o thành từ ba lo i h t chính mà các nhà hóa h c quan tâm:
proton, neutron, và electron. Ta nên biết rằng hiện nay các nghiên c u m c độ cơ b n
nhất cho thấy còn có một s lo i h t khác t o nên nguyên tử. Electron đ ợc coi là một
lo i h t cơ b n, tuy nhiên, vật lý hiện đ i cho rằng proton và neutron đ ợc t o từ một s h t cơ b n khác.
Đến nay, bằng các công cụ hiện đ i, các thông s đặc tr ng c a các h t proton,
neutron, và electron đư đ ợc xác đ nh chính xác. B ng 2.2 nêu các thông s vật lý cơ b n c a ba lo i h t này. 16
B ng 2.2. Các thông s vật lý cơ b n c a các h t proton, neutron, và electron Kh i l ợng Điện tích V trí trong H t Ký hiệu Qui ớc Tuyệt đ i (kg) Tuyệt đ i (C) Qui ớc nguyên tử (amu)* Electron e, e– 9.1094 x 10–31 0.000549 –1.602 x 10–19 –1 V Proton p, p+ 1.6726 x 10–27 1.0073 +1.602 x 10–19 +1 Nhân Neutron n, no 1.6749 x 10–27 1.0087 0 0 Nhân
Ghi chú: * Đơn v kh i l ợng quy ớc là u, hay amu (atomic mass unit); 1 amu =1/12 kh i
l ợng nguyên tử 12C (t c là 1.66.10–27 kg), sẽ đ ợc đề cập phần sau.
Về cấu t o nguyên tử, hiện nay các nhà khoa h c đồng ý rằng nguyên tử gồm hai
phần: (i) h t nhân nguyên tử có kích th ớc kho ng 1/10.000 kích th ớc nguyên tử, gồm
các h t proton mang điện d ơng và các neutron trung hòa điện, (ii) v nguyên tử gồm
các electron mang điện tích âm (Hình 2.8).
Hình 2.8. Mô hình cấu t o nguyên tử (c a nguyên tử He)
Các thí nghiệm sau này cho thấy s h t proton trong nhân nguyên tử đúng bằng
s h t electron v , nên nguyên tử trung hòa điện. Mỗi nguyên tử đều có kh i l ợng.
Một cách gần đúng, kh i l ợng nguyên tử xấp x bằng tổng kh i l ợng các h t t o thành
nguyên tử (điều này không chính xác, sẽ đề cập chi tiết trong mục 2.3.3). Vì kh i l ợng
electron nh hơn kh i l ợng proton và neutron kho ng 2000 lần nên có thể b qua kh i
l ợng electron trong kh i l ợng nguyên tử. Nói cách khác, có thể coi rằng kh i l ợng
nguyên tử gần bằng tổng kh i l ợng các h t proton và neutron. Do đó ng i ta dùng s
kh i A, bằng tổng s h t proton và neutron trong nguyên tử, để đặt tr ng cho kh i l ợng t ơng đ i c a nguyên tử.
S kh i c a nguyên tử (A) = s proton (Z) + s neutron (N) 17
Vậy mỗi nguyên tử d ợc đặt tr ng bằng điện tích h t nhân (Z) và s kh i (A) c a
nó. Nguyên tử đ ợc ký hiệu là: (trong đó X là ký hiệu nguyên tử). 2.3.
Nguyên tố hóa học, đồng vị, và nguyên tử lượng
2.3.1. Nguyên tố hóa học
Thực nghiệm cho thấy, tất c các nguyên tử có cùng điện tích hạt nhân, t c là
cùng s proton Z trong nhân và s electron lớp v , đều có tính chất hóa h c gi ng
nhau. Những nguyên tử đó t o thành một nguyên tố hóa học (th ng g i vắn tắt là
nguyên t ). Mỗi nguyên t đ ợc đặc tr ng b i số hiệu nguyên tử c a nguyên t đó,
cũng chính là điện tích h t nhân (Z) c a các nguyên tử t o nên nguyên t hóa h c, và
đ ợc đặt tên và ký hiệu riêng cho nguyên t . Đến nay, chúng ta đư biết hơn 110 nguyên
t hóa h c khác nhau. Các nguyên t có s hiệu nguyên tử cao hơn c a uranium
(Z = 92) không tồn t i trong tự nhiên, chúng đ ợc tổng hợp nhân t o từ các ph n ng h t nhân.
2.3.2. Đồng vị
Các nguyên tử c a cùng một nguyên t hóa h c có thể có kh i l ợng nguyên tử
khác nhau do có s neutron trong các nguyên tử khác nhau. Tập hợp các nguyên tử có
cùng kh i l ợng c a một nguyên t đ ợc g i là một đồng v c a nguyên t đó. Hầu hết
các nguyên t hóa h c đều có nhiều đồng v tự nhiên khác nhau. Tên g i “đồng v ” để
ch rằng các đồng v c a một nguyên t có cùng một v trí trong b ng phân lo i tuần
hoàn. Ví dụ, nguyên t neon gồm ba đồng v (ba lo i nguyên tử) khác nhau: , , và
. Trong tất c các nguyên tử neon có trong tự nhiên, có 90.51% nguyên tử là
, 0.27% là , và 9.22% là . L u ý rằng phần trăm đồng v luôn đo trên s
nguyên tử, không đo trên kh i l ợng. Một s nguyên t ch có một đồng v trong tự nhiên
nên không có phần trăm đồng v . Ví dụ, tất c các nguyên tử c a nhôm trong tự nhiên đều là .
Các đồng v c a một nguyên t có thể bền hoặc phóng x . H t nhân nguyên tử
c a các đồng v phóng x tự nhiên tự phân h y dần thành h t nhân c a các nguyên t
khác, đồng th i phát ra các tia phóng x . Sau này ng i ta thấy rằng các h t nhân
nguyên tử có Z > 83 (Bi) đều phóng x tự nhiên. Quan hệ giữa s neutron và proton
trong các đồng v bền đ ợc th ng kê và biểu diễn trong Hình 2.9. Để ý rằng các đồng v
bền luôn có t s N/Z 1. Các đồng v bền có N/Z = 1 ch gặp các nguyên t t ơng
đ i nhẹ; khi điện tích h t nhân nguyên tử tăng, tỷ s N/Z c a các đồng v bền tăng dần,
đ t kho ng 1.5 nguyên tử Bi (Z = 83). 18
Hình 2.9. Quan hệ giữa s neutron và proton c a các đồng v bền trong tự nhiên
2.3.3. Khối lượng của đồng vị
Hình 2.10. Sơ đồ máy kh i phổ dùng xác đ nh kh i l ợng các đồng v nguyên tử
Các nghiên c u sau này cho thấy không thể xác đ nh kh i l ợng chính xác c a
nguyên tử bằng cách cộng kh i l ợng c a tất c các proton, neutron, và electron trong
nguyên tử. Khi các proton và neutron kết hợp với nhau để t o thành h t nhân nguyên tử,
một phần nh kh i l ợng các h t ban đầu chuyển thành năng l ợng liên kết h t nhân,
do đó nguyên tử t o thành có kh i l ợng nh hơn tổng kh i l ợng các h t t o thành nó.



