













Preview text:
lOMoAR cPSD| 22014077 05/09/2023 1
Nhiệt động hóa học (Thermodynamics):
Nhiệt ộng học là một môn khoa học nghiên cứu các quy luật iều khiển sự trao ổi năng
lượng, ặc biệt là những quy luật có liên quan tới các biến ổi nhiệt năng thành các dạng
năng lượng khác và những biến ổi qua lại giữa những dạng năng lượng ó.
Nhiệt ộng học hoá học là khoa học nghiên cứu những ứng dụng của nhiệt ộng học vào
hoá học ể tính toán thăng bằng về năng lượng và rút ra một số ại lượng làm tiêu chuẩn
ể xét oán chiều hướng của một quá trình hóa học, hóa lí. 2 2 lOMoAR cPSD| 22014077 05/09/2023
I. Một số khái niệm cơ bản về nhiệt ộng học 1.1 Hệ và môi trường
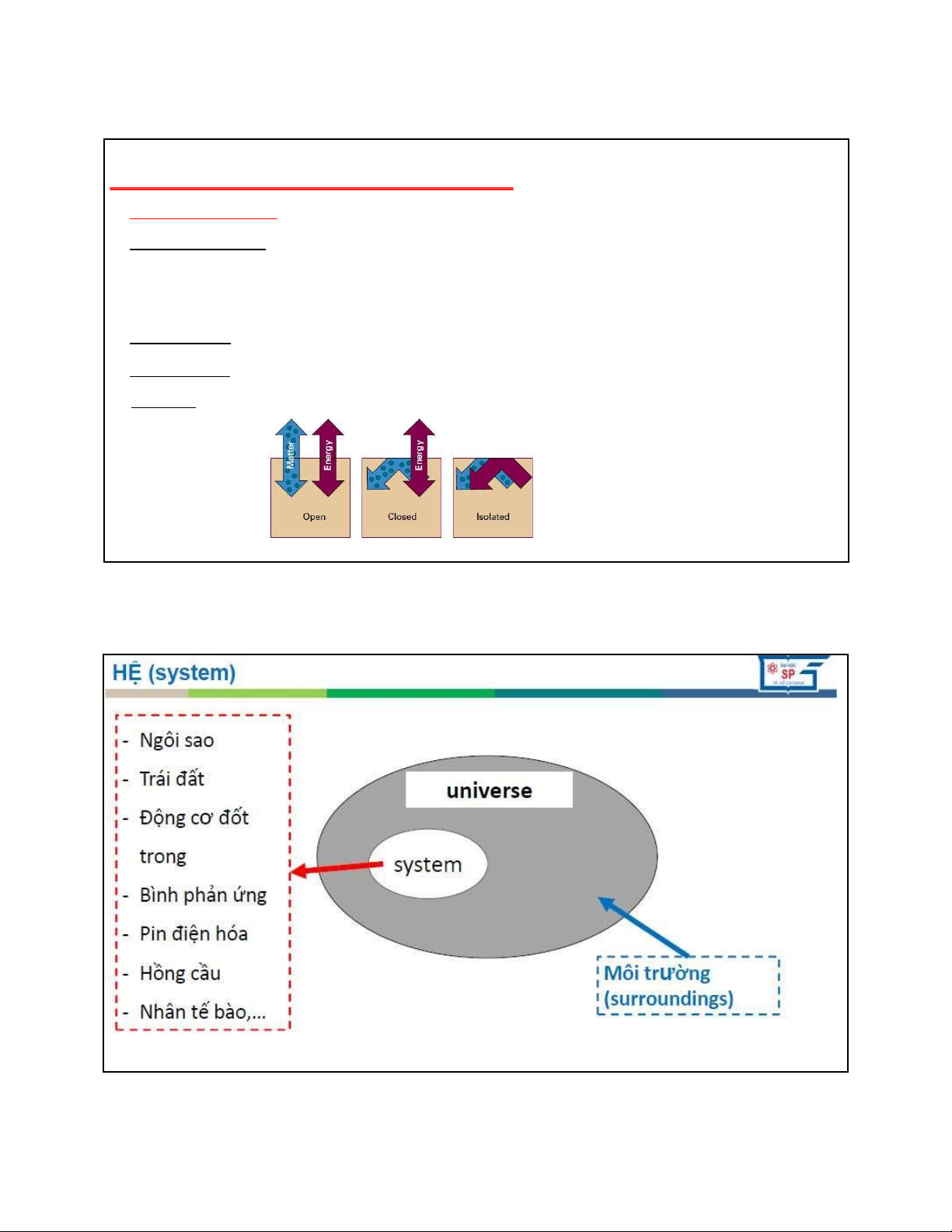
Hệ thống Nhiệt ộng (gọi tắt là Hệ): là một vật hay một nhóm vật gồm số lớn nguyên tử phân tử (một
phần của vũ trụ) lấy ra ể nghiên cứu. Phần còn lại gọi là môi trường.
Ranh giới giữa hệ và môi trường có thể là thực và cũng có thể là tưởng tượng.
Hệ mở (hệ hở): là hệ có trao ổi cả chất và năng lượng với môi trường ngoài qua ranh giới.
Hệ óng (hệ kín): là hệ không trao ổi chất nhưng có trao ổi năng lượng với môi trường ngoài
Hệ cô lập: là hệ không trao ổi chất và năng lượng với môi trường ngoài. 3 3 4 4 lOMoAR cPSD| 22014077 05/09/2023
I. Một số khái niệm cơ bản về nhiệt ộng học
1.2 Các thông số nhiệt ộng
Các yếu tố như áp suất (p), nhiệt ộ (T), thể tích (V), số mol (n) là các thuộc tính ộc lập ê ̉ xác ịnh trạng
thái của một hê ̣ ược gọi là các thông số trạng thái hoặc thông sô ́ nhiệt ộng (Thông số nhiệt ộng là
các ại lượng vĩ mô). Có 2 loại thông số nhiệt ộng: thông số cường ộ và thông số khuếch ộ 5 5
I. Một số khái niệm cơ bản về nhiệt ộng học a. Thông số cường ộ
Thông số nhiệt ộng không phụ thuộc vào khối lượng, kích thước của hệ, ặc trưng cho một trạng thái
chuyển ộng nào ó của các phần tử trong hệ ược gọi là thông số cường ộ.
Nó không có tính chất cộng tính.
Thí dụ: p, T, iện thế… (phệ = p1 = p2 =….= pi).
Chú ý: Riêng ối với hệ khí lý tưởng thì phệ = i pi. Khi ó p trở thành thông số khuếch ộ.(Theo Dalton). b. Thông số khuếch ô
Thông số phụ thuộc vào khối lượng, kích thước của hệ ược gọi là thông số khuếch ộ.
Nó có tính chất cộng tính.
Ví dụ: Khối lượng (m), thể tích(v), số mol, diện tích . mhệ = imi 6 lOMoAR cPSD| 22014077 05/09/2023 6
I. Một số khái niệm cơ bản về nhiệt ộng học
1.3. Hàm trạng thái. Hàm quá trình. Quá trình nhiệt ộng
Hàm trạng thái: Một hàm số nhiệt ộng mà sự biến ổi của nó chỉ phụ thuộc vào trạng thái ầu và trạng thái
cuối mà không phụ thuộc vào các diễn biến trung gian ược gọi là hàm trạng thái.
Về mặt toán học, hàm trạng thái X có biến thiên vô cùng nhỏ là một vi phân toàn phần, kí hiệu là dX.
Trong quá trình từ trạng thái 1 ến trạng thái 2, biến thiên của hàm ược tính theo công thức: 2 (1) X dX 2 X 1 X
Trong một chu trình, biến thiên ó 1 bằng không.
Hàm quá trình: là ại lượng xuất
hiện trong quá trình. Vì vậy, nó phụ
thuộc vào quá trình. Cùng i từ trạng thái 1 sang trạng thái 2 nhưng theo những quá trình khác nhau thì
hàm quá trình có các giá trị khác nhau.
Trong nhiệt ộng học hai hàm quá trình quan trọng là công (w) và nhiệt (q). 7 7 lOMoAR cPSD| 22014077 05/09/2023
I. Một số khái niệm cơ bản về nhiệt ộng học Quá trình nhiệt ộng
Quá trình chuyển hệ từ trạng thái này ến trạng thái khác ta nói hệ ã thực hiện một quá trình.
• Quá trình ẳng tích: là quá trình xảy ra ở thể tích không ổi.
• Quá trình ẳng áp : là quá trình xảy ra ở áp suất không ổi.
• Quá trình ẳng nhiệt : là quá trình xảy ra ở nhiệt ộ không ổi.
• Quá trình oạn nhiệt : là quá trình xảy ra không có sự trao ổi nhiệt với môi trường. 8 8
I. Một số khái niệm cơ bản về nhiệt ộng học
1.4 -Nội năng- Công - Nhiệt a-Nội năng (E hay U):
Năng lượng của hệ gồm 3 phần:
+ Động năng: có ược nếu hệ ang chuyển ộng
+ Thế năng: có ược nếu hệ nằm trong trường trọng lực
+ Nội năng: là ại lượng bao gồm toàn bộ năng lượng của các dạng chuyển ộng có trong hệ. Đó là
năng lượng của các dạng chuyển ộng tịnh tiến, chuyển ộng quay, chuyển ộng dao ộng của các
phân tử, nguyên tử, e và hạt nhân nguyên tử.
Không thể o ược giá trị tuyệt ối cuả nội năng. Người ta chỉ có thể xác ịnh biến thiên của nội năng
( U=Uf - Ui) trong các quá trình thông qua các ại lượng nhiệt ộng khác (nhiệt q và công w). 9 lOMoAR cPSD| 22014077 05/09/2023 9
I. Một số khái niệm cơ bản về nhiệt ộng học b-Nhiệt (q) - Công (w):
Khác với nội năng, nhiệt và công là hình thức khác nhau của sự truyền năng lượng từ hệ này sang
hệ khác hoặc giữa hệ với môi trường bên ngoài.
Nếu sự truyền năng lượng từ hệ này sang hệ khác gắn liền với sự chuyển ộng ịnh hướng của hệ thì
sự truyền ó ược thực hiện dưới dạng công. Công Nhiệt
Nếu sự truyền năng lượng có liên quan tới sự tăng cường ộ chuyển ộng hỗn loạn của các
phần tử trong hệ nhận năng lượng thì sự truyền ó ược thực hiện dưới dạng nhiệt.
Công và nhiệt là hàm của quá trình. 10 10 lOMoAR cPSD| 22014077 05/09/2023
I. Một số khái niệm cơ bản về nhiệt ộng học
Thí dụ 1: Khi khí giãn nở trong xilanh làm pittông chuyển ộng, khi ó khí ã truyền năng lượng cho
pittông dưới dạng công.
Thí dụ 2: Khi cho vật lạnh tiếp xúc với vật nóng, các phân tử chuyển ộng nhanh của vật nóng va
chạm với các phân tử chuyển ộng chậm hơn của vật lạnh và truyền cho chúng một phần ộng
năng của mình, làm tăng mức ộ chuyển ộng hỗn loạn của các phân tử trong vật lạnh. Sự truyền
năng lượng như vậy thực hiện dưới dạng nhiệt. 11 11
I. Một số khái niệm cơ bản về nhiệt ộng học
Đơn vị của nhiệt và công là joules (J) và nhiều khi vẫn quen dùng là calories (1 cal = 4,184J).
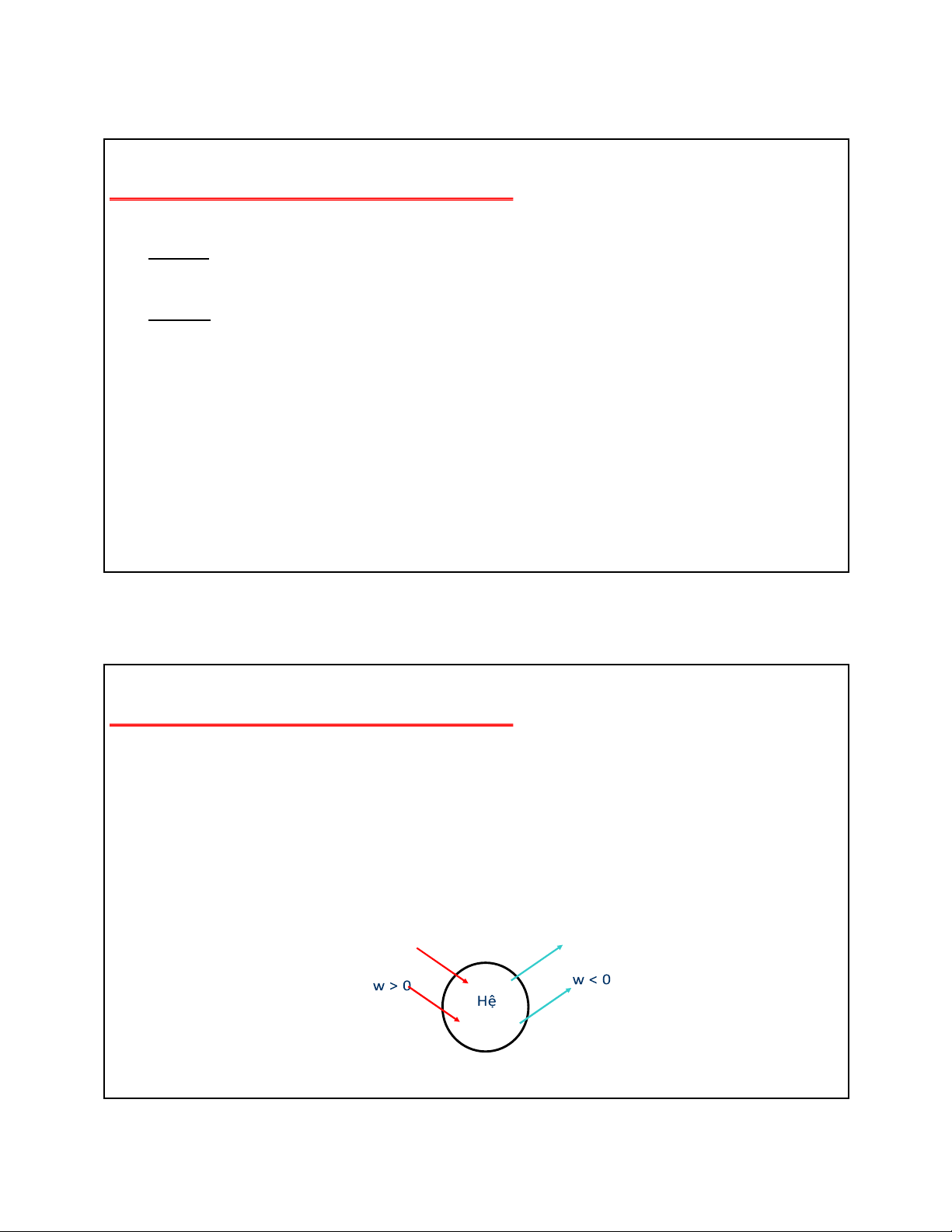
Trong Nhiệt ộng học quy ước:
- Công và nhiệt do hệ sinh ra làm giảm năng lượng của hệ nên ều ược quy ước là âm (w < 0) , q < 0).
- Công và nhiệt do hệ nhận vào làm tăng năng lượng của hệ nên ều ược quy ước là dương (w > 0) , q > 0). q > 0 q < 0 12 lOMoAR cPSD| 22014077 05/09/2023 12
Phân biệt giữa nhiệt (heat) và nhiệt ộ (Temperature) NHIỆT NHIỆT ĐỘ
Hình thức truyền năng lượng dưới dạng chuyển
Tính chất của hệ, xác ịnh trạng thái nhiệt của hệ
ộng hỗn loạn của phân tử
(nóng hay lạnh); cho biết xu hướng truyền năng
lượng khi hai vật tiếp xúc nhiệt với nhau.
Xác ịnh bằng nhiệt lượng kế, chỉ o ược khi có sự
Xác ịnh bằng nhiệt kế, có thể o mà không cần sự
truyền nhiệt hoặc trao ổi nhiệt truyền nhiệt Đơn vị: J, Calo
Đơn vị của nhiệt ộ: K, ℃, F
Không phải thuộc tính của hệ Là thuộc tính của hệ Là hàm quá trình
Là thông sô ́ trạng thái của hệ 13 13 Một số dạng công lOMoAR cPSD| 22014077 05/09/2023 1)
Khi một chất khí giãn nở thuận nghịch: pex = p 2)
Giãn nở trong chân không: p = 0 3)
Giãn nở đẳng nhiệt thuận nghịch: p = nRT/V
Tính công thực hiện ược khi 50 g
Fe phản ứng hết với hydrochloric acid HCl a) Trong một bình kín với thể tích không ổi
b) Trong một cốc không ậy nắp ở 25 ℃. 14 14 Ví dụ 2
Một mẫu khí chứa 1,00 mol Ar ược xem như khí lí tưởng ược giãn nởthuận nghịch tại nhiệt
ộ không ổi là 20,0 ℃ từthể tích 10,0 dm3 ến thể tích 30,0 dm3. Tính công trong trường hợp này. 15 15 lOMoAR cPSD| 22014077 05/09/2023 16
II. NGUYÊN LÍ I NHIỆT ĐỘNG HỌC (NĐH) U = q + w (2)
Đối với sự biến ổi vô cùng nhỏ, biểu thức của nguyên lí: dU = q + w
(3) dU là vi phân toàn phần của nội năng.Q và Alà vi phân riêng phần của công và nhiệt.
Công w bao gồm 2 loại công:
- Công giãn nở (chống lại áp suất bên ngoài pex): wexp = -∫ 𝑝 dV
- Công có ích wadd gồm tất cả các loại công khác mà hệ trao ổi với môi trường như công
iện, công hóa học, công cơ học… Khi ó biểu thức của nguyên lí I NĐH có dạng: U = q + wadd -∫ 𝑝 dV (4)
Biểu thức (2), (3), (4) là biểu thức toán học của nguyên lí I NĐH. 17 17 lOMoAR cPSD| 22014077 05/09/2023
II. NGUYÊN LÝ I NHIỆT ĐỘNG HỌC (NĐH)
1.3-Phát biểu nguyên lí I NĐH -
Biến thiên nội năng khi chuyển hệ từ một trạng thái này sang trạng thái khác ( U)
bằng tổng ại số năng lượng ã trao ổi với môi trường trong quá trình biến ổi này. -
Nội năng của một hệ cô lập luôn luôn ược bảo toàn (trong 1 hệ cô lập q = w = 0 thì U= 0 U = const ) 18 18
2 – ÁP DỤNG NGUYÊN LÍ I NĐH VÀO HÓA HỌC
2.1- Hiệu ứng nhiệt phản ứng hóa học
Hiệu ứng nhiệt của phản ứng hoá học là lượng nhiệt toả ra hay thu vào trong một phản ứng
hóa học khi có 1 mol chất ban ầu tham gia hoặc 1 mol chất sản phẩm ược tạo thành.
Đơn vị hiệu ứng nhiệt thường ược tính bằng J/mol, Calo/mol (hay kCal/mol).
Các quá trình hoá học thường ược xét là các phản ứng hoá học, các quá trình hoá lý như:
Quá trình chuyển pha, quá trình hấp phụ…
Thông thường, các quá trình hoá học diễn ra trong 2 trường hợp: Hoặc ẳng tích
(V = const), hoặc ẳng áp (p = const). 19 19 lOMoAR cPSD| 22014077 05/09/2023
2.2- Hiệu ứng nhiệt ẳng tích( qv) – Hiệu ứng nhiệt ẳng áp (qp)
a. Hiệu ứng nhiệt ẳng tích (qv) Theo nguyên lí I ta có:
U = q + wadd – ∫ 𝑝 dV q = U – wadd + ∫ 𝑝 dV
Trong quá trình ẳng tích thì V = const. Nếu hệ không thực hiện công có ích (wadd = 0), khi ó:(5)
Như vậy, hiệu ứng nhiệtẳng tích bằng biến thiên nội năng của hệ qv = U
b. Hiệu ứng nhiệt ẳng áp (qp)
Trong một quá trình ẳng áp p = const, nếu hệ không sinh công có ích (wadd = 0) ta có: qp= U + ∫ 𝑝 dV = U + p V
Thay U = U2 – U1; V= V2 – V1 ta có:
qp= U2 – U1 + p(V2 – V1) qp=U2+ pV2 – (U1+ pV1).
Đặt U + pV = H gọi là Enthalpy. Khi ó:(6) qp= H2 – H1 = H
Như vậy, hiệu ứng nhiệt ẳng áp bằng biến thiên enthalpy của hệ 20 20 lOMoAR cPSD| 22014077 05/09/2023 Hàm enthalpy
Từ biểu thức H = U + pV ta thấy: Enthalpy chính là năng lượng dự trữ của hệ gồm nội năng
và tích của áp suất với thê ̉ tích của hê.̣ Biến thiên enthalpy của hệ trong iều kiện ẳng áp
bằng với nhiệt trao ổi của hệ với môi trường.
Vì U, p, V là hàm trạng thái nên H cũng là hàm trạng thái và mang tính cộng tính. ∆H =∆U + ∆(pV) Trong
iều kiện áp suất không ổi: ∆H =∆U + p ∆V 21 21
c. Sự liên hệ giữa qv và qp pp= qv + p V
Ta có qp = H; qv = U(8) Mà ∆H = U + p V
- Với những phản ứng xảy ra giữa các chất ở trạng thái lỏng hoặc rắn thì V = 0. Khi ó: qp= qv (9)
- Với các phản ứng có chất khí tham gia. Từ phương trình trạng thái khí lí tưởng, p V = nRT, thay vào biểu thức (8) ta có: qp= qv + nRT (10)
+ Đối với các phản ứng mà n > 0 ( số phân tử khí tăng) thì qp > qv
+ Đối với các phản ứng mà n = 0 ( số phân tử khí không thay ổi) thì qp = qv
+ Đối với các phản ứng mà n < 0 ( số phân tử khí giảm) thì qp < qv lOMoAR cPSD| 22014077 05/09/2023 22
c. Sự liên hệ giữa qv và qp
- Đối với các phản ứng mà n > 0 ( số phân tử khí tăng trong phản ứng ) thì qp> qv
Thí dụ: CaC2(s) + H2O(l) Ca(OH)2(aq) + C2H2(g) n = 1 – 0 = 1
- Đối với phản ứng khi n = 0 (số phân tử khí không thay ổi) thì qp = qv
Thí dụ: H2(g) + Cl2(g) 2HCl(g) n = 2 – 2 = 0
-Đối với phản ứng khi n < 0 (số phân tử khí giảm trong phản ứng) thì qp < qv
Thí dụ : SO3(g) + H2O(l) H2SO4(aq) n = 0 – 1 = – 1. 23 23 lOMoAR cPSD| 22014077 05/09/2023 Ví dụ 3
Biến thiên nội năng khi 1,0 mol CaCO3 từ dạng calcite chuyển ổi thành dạng aragonite là 0,21 kJ.
Tính ộ chênh lệch giữa biến thiên enthalpy và biến thiên nội năng của 1,0 mol CaCO3 khi áp suất là
1,0 bar. Cho biết khối lượng riêng của các dạng chất rắn trên là 2,71 g cm-3 và 2,93 g cm-3. 24 24 25 lOMoAR cPSD| 22014077 05/09/2023
2.3 Định luật Hess a- Điều kiện áp dụng ịnh luật Hess
Trong iều kiện p = const, V = const, theo nguyên lí 1 NĐH, ta có: qV = ∆U, qp = ∆H
Mà U, H là những hàm trạng thái, chỉ phụ thuộc vào trạng thái ầu và trạng thái cuối, không phụ thuộc
vào ường i. b- Phát biểu ịnh luật Hess (Gext - Nga), 1836
“Hiệu ứng nhiệt của phản ứng hoá học chỉ phụ thuộc vào trạng thái ầu và trạng thái cuối của các chất tham gia và
các chất tạo thành sau phản ứng mà không phụ thuộc vào cách tiến hành phản ứng”
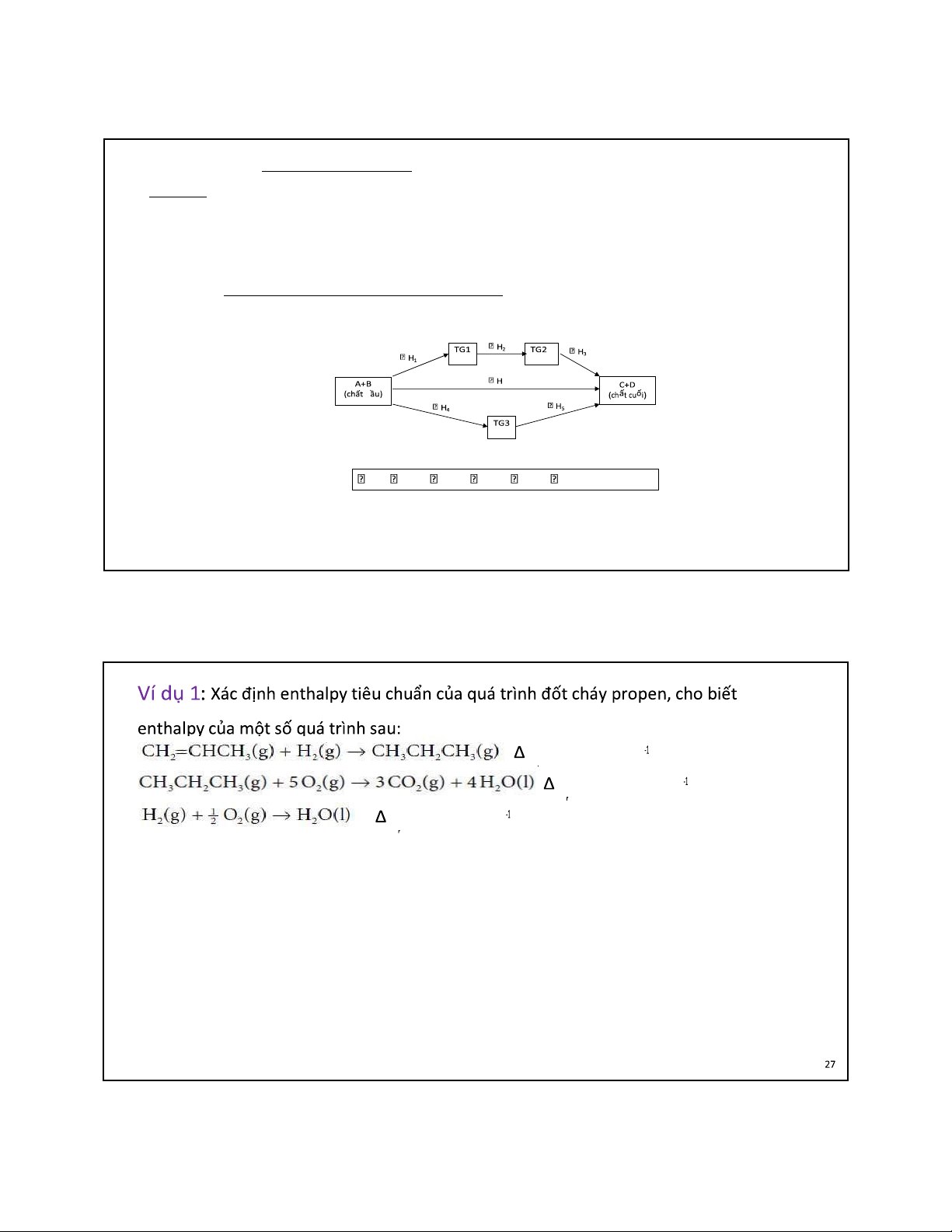
S ồ Hess có thể biểu diễn như sau:
Theo ịnh luật Hess ta có:
26 H = H 1 + H 2 + H 3 = H 4 + H 5 26 H = -124 kJ mol H = -2220 kJ mol H = -286 kJ mol 27 lOMoAR cPSD| 22014077 05/09/2023
c. Hệ quả ịnh luật Hess Hệ quả 1:
“ Hiệu ứng nhiệt của phản ứng thuận bằng hiệu ứng nhiệt của phản ứng nghịch nhưng ngược dấu” Hth= - Hng (11)
Hệ quả 2: Xác ịnh hiệu ứng nhiệt pư dựa vào sinh nhiệt (nhiệt tạo thành) của chất - Sinh nhiệt của chất:
“Sinh nhiệt hay nhiệt tạo thành của một chất là hiệu ứng nhiệt của phản ứng tạo thành 1 mol chất ó từ các
n chất ở trạng thái bền chuẩn (trạng thái ược quy ước bền nhất) của các nguyên tố tư ng ứng, trong iều
kiện ã cho về nhiệt ộ và áp suất”
Ở iều kiện chuẩn (25 oC, 1 bar) ược gọi là sinh nhiệt tiêu chuẩn và ược kí hiệu là ΔH f,298
Ví dụ: sinh nhiệt tiêu chuẩn của CaCO3 là hiệu ứng nhiệt của phản ứng hình thành CaCO3 từ Calcium kim loại,
carbon than chì và khí oxygen ở iều kiện tiêu chuẩn:
Ca (s) + Cgraphite(s) + 3/2O2(g) CaCO3(s) ; ΔH0f,298 1207,68 kJ/mol 28 28
Phát biểu hệ quả 2 của ịnh luật Hess
“Hiệu ứng nhiệt của một phản ứng hoá học bằng tổng sinh nhiệt của các chất cuối trừ i tổng sinh nhiệt
của các chất ầu (có nhân với hệ số của mỗi chất trong phư ng trình phản ứng)”
Công thức của hệ quả 2
Giả sử có phản ứng: mA + nB = pC + qD ; Hr = ?
Trong ó: A, B, C, D là các chất tham gia và chất tạo thành; m, n, p, q là hệ số tỉ lượng.
Khi ó hiệu ứng nhiệt phản ứng ược tính theo công thức: Hr
= (p Hf,C+ q Hf,D) - (m Hf,A + n Hf,B) (12) = Hf,product - Hf,reactant 29 29 lOMoAR cPSD| 22014077 05/09/2023
Hệ quả 3: Xác ịnh hiệu ứng nhiệt pư dựa vào thiêu nhiệt (nhiệt ốt cháy) của chất
Thiêu nhiệt của một chất
“Thiêu nhiệt (hay nhiệt ốt cháy) của một chất là hiệu ứng nhiệt của phản ứng ốt cháy 1
mol chất ó bằng oxygen phân tử ể tạo thành các dạng oxide cao nhất bền ở iều kiện ó”
Ở iều kiện chuẩn (25 oC, 1atm) ược gọi là thiêu nhiệt tiêu chuẩn và ược kí hiệu là ΔHc,298o
Đối với các chất hữu cơ hy rocacbon, oxit cao nhất là CO2 (k) và H2O (l)
Ví dụ: thiêu nhiệt tiêu chuẩn của methane là hiệu ứng nhiệt của các phản ứng sau tiến hành
ở iều kiện tiêu chuẩn:
CH4 (g) + 2O2 (g) CO2(g) + 2H2O (l), ΔHoc,298 890,34 kJ 30 30
Phát biểu hệ quả 3 của ịnh luật Hess
“Hiệu ứng nhiệt của một phản ứng hoá học bằng tổng thiêu nhiệt của các chất ầu trừ i tổng
thiêu nhiệt của các chất cuối (có nhân với hệ số của mỗi chất trong ptpư)”
Công thức của hệ quả 3
Giả sử có pư:mA + nB = pC + qD ; Hr=?
Trong ó: A, B, C, D là các chất tham gia và chất tạo thành; m,n,p,q là hệ số tỉ lượng. Khi ó hiệu ứng nhiệt pư
ược tính theo công thức: Hr
= (m Hc,A + n Hc,B) - (p Hc,C + q Hc,D) = (13) Hc,reactants - Hc,products 31 31 lOMoAR cPSD| 22014077 05/09/2023
Đ/S: -389.112 kJ Ví dụ 2: Tính nhiệt hình thành của SO3 biết:
a/ PbO(s) + S(s) + 3/2O2(g) PbSO4(s) ∆H1 = -692,452 kJ
b/ PbO(s) + H2SO4.5H2O(aq) PbSO4(2) + 6H2O(l) ∆H2 = -97,487 kJ c/
SO3(g) + 6H2O(l) H2SO4.5H2O(aq) ∆H3 = -205,853 kJ 32 32 C:
Biết rằng cũng ở nhiệt độ ấy ta có: 33 lOMoAR cPSD| 22014077 05/09/2023
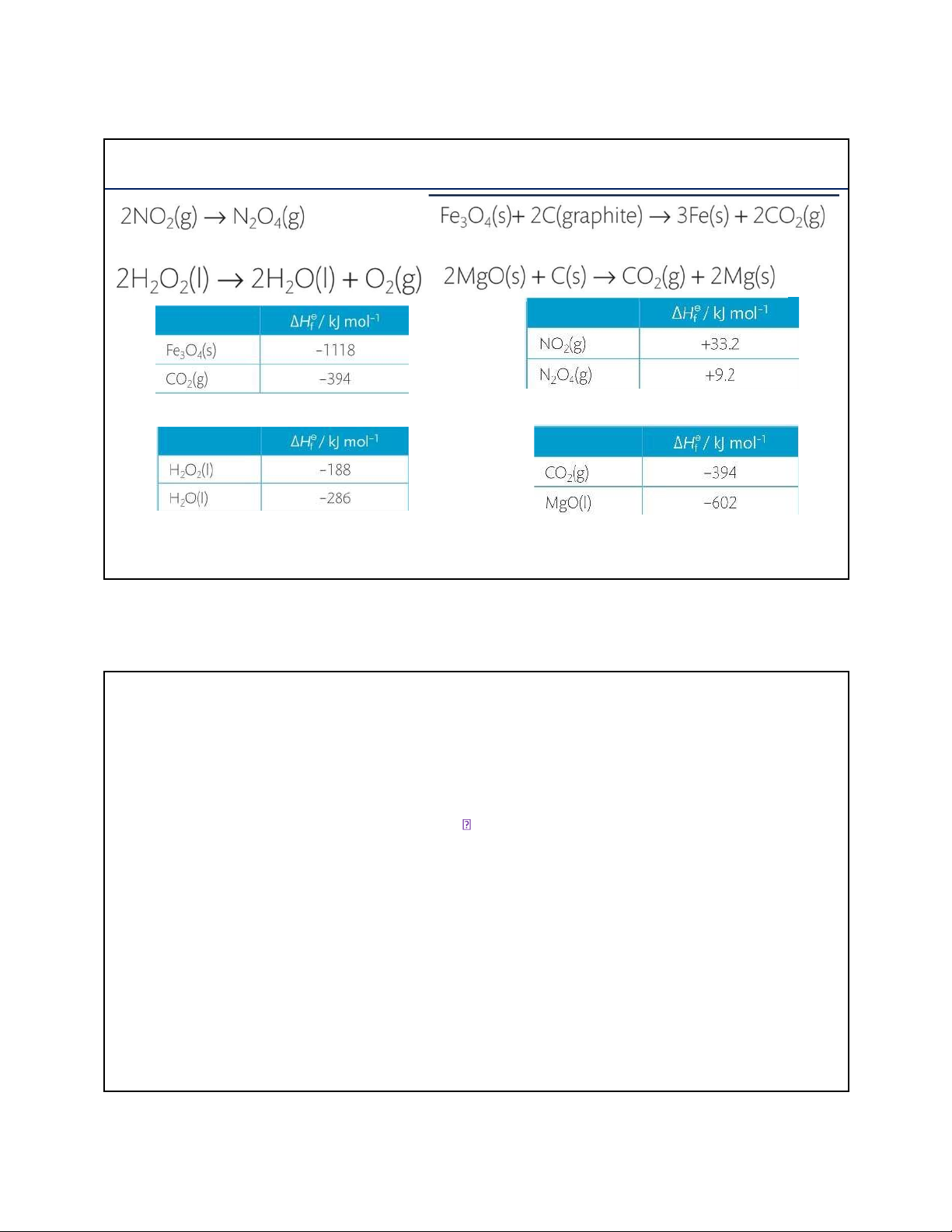
Ví dụ 4: Tính biến thiên enthalpy chuẩn các quá trình sau ở 298 K 34 34
- Trong sinh học: Định luật Hess giúp ta tính ược năng lượng giải phóng ra khí CO2 khi oxygen hoá các
chất dinh dưỡng trong cơ thể.
Chẳng hạn khi oxygen hoá 1 mol glucose:
C6H12O6 + 6O2 6CO2 + 6H2O + 675,8 Kcal
Dù quá trình oxygen hoá diễn ra trong cơ thể có phức tạp ến âu i chăng nữa thì sản phẩm cuối cùng
vẫn là CO2, H2O và giải phóng ra 1 lượng năng lượng là 675,8 Kcal. Năng lượng ó giúp cho cơ thể sinh
công, và 1 phần tạo nên thân nhiệt.
- Định luật Hess cũng áp dụng cho cả các quá trình hoà tan, hấp phụ, nóng chảy, hoá h i, thăng hoa…
- Định luật Hess và các hệ quả của nó có một ứng dụng rất lớn trong hoá học, nó cho phép tính hiệu ứng
nhiệt của nhiều phản ứng trong thực tế không thể o ược. (Ví dụ phản ứng tạo CO từ Cgraphite và O2). 35 35

