




Preview text:
lOMoAR cPSD| 22014077 CHƯƠNG 3
LIÊN KẾT HÓA HỌC VÀ CẤU TRÚC PHÂN TỬ
TS. NGUYỄN THANH BÌNH
Th.S TRẦN BỮU ĐĂNG
KHOA HÓA HỌC TRƯỜNG ĐẠI
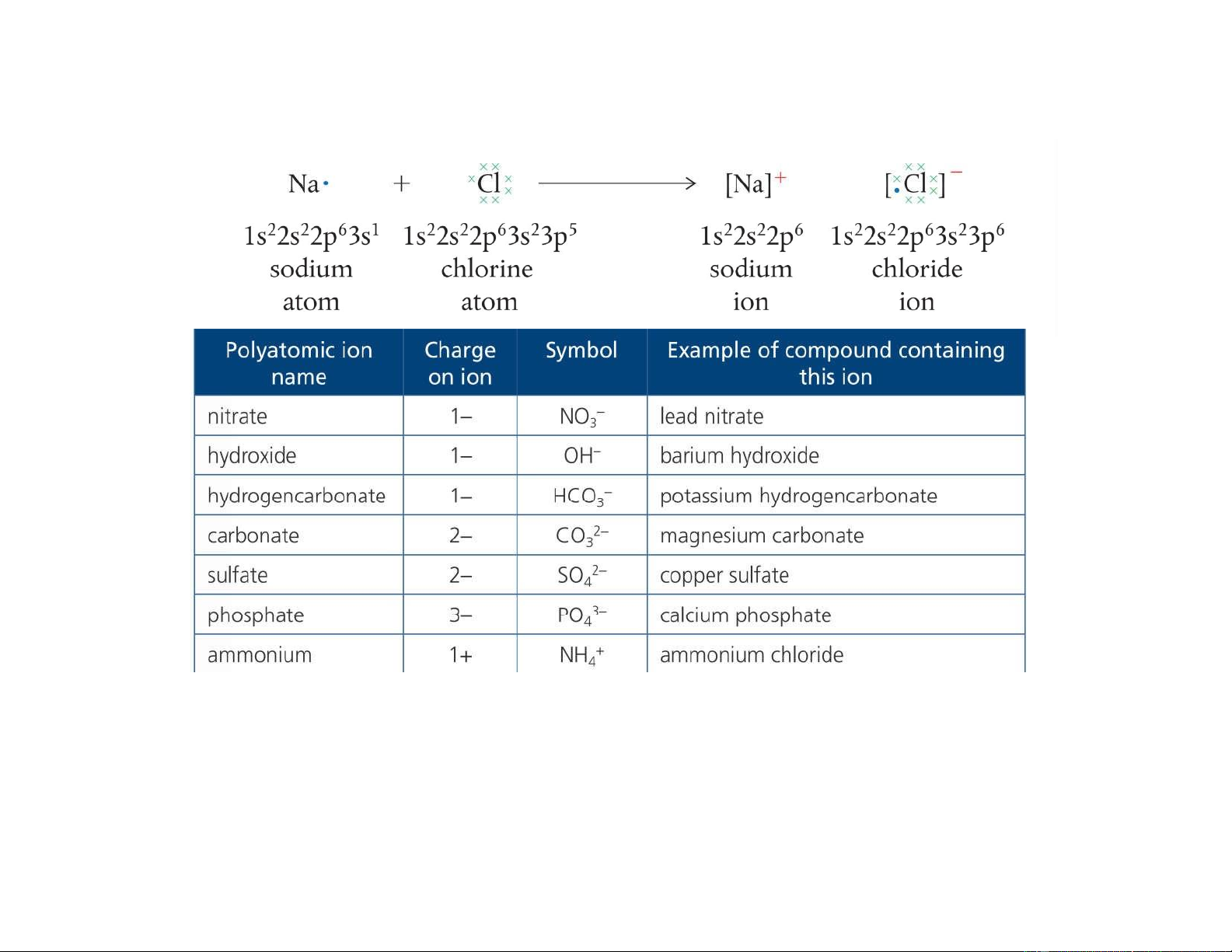
HỌC SƯ PHẠM Tp. HỒ CHÍ MINH Liên kết ion
Liên kết ion được hình thành bởi lực hút tĩnh điện của hai ion có điện tích trái dấu. lOMoAR cPSD| 22014077 11/6/2021 2 lOMoAR cPSD| 22014077 Liên kết ion
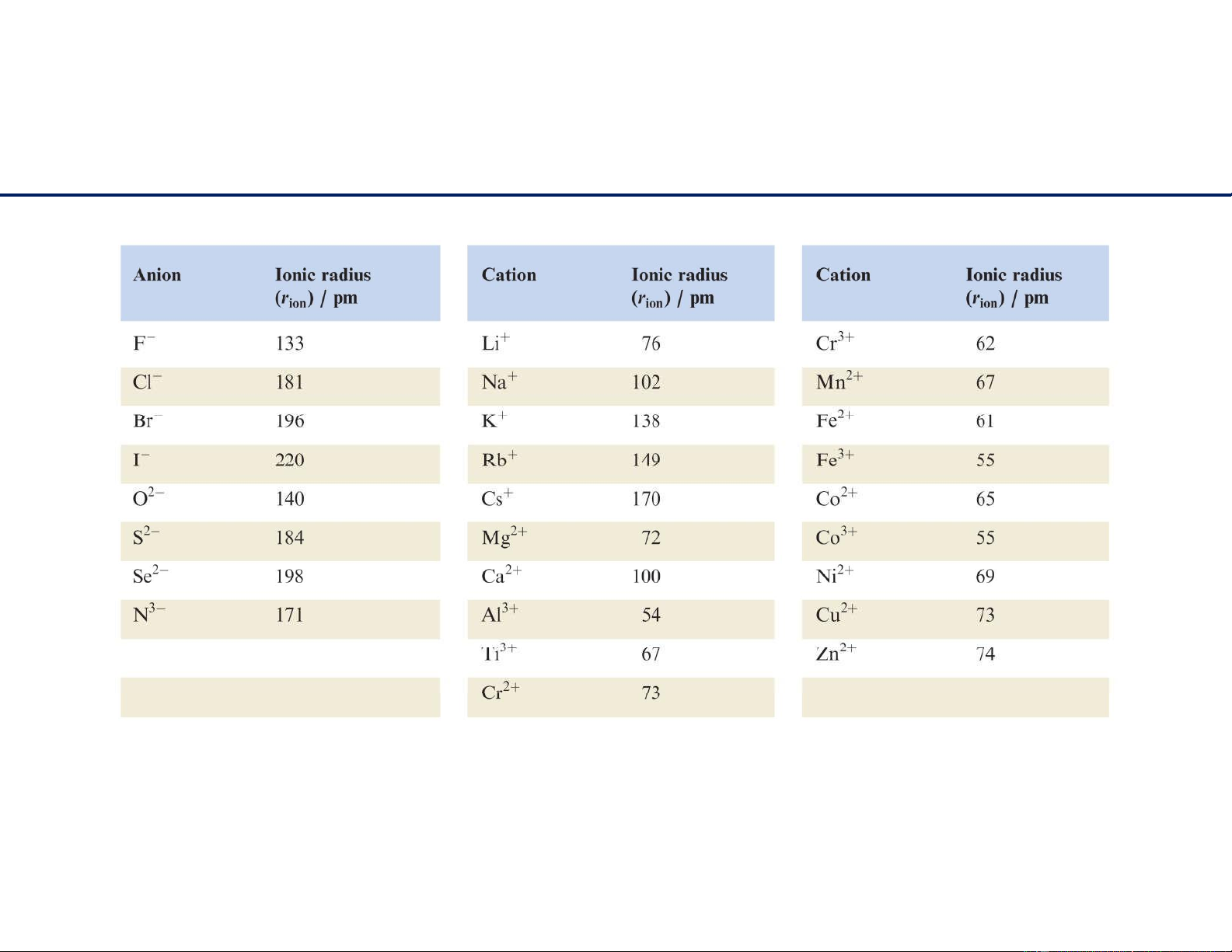
Giá trị bán kính ion 11/6/2021 3 lOMoAR cPSD| 22014077 Cấu trúc tinh thể
Mạng lưới tinh thể chất rắn
Đơn vị cấu trúc (motif) = nguyên tử,
nhóm các nguyên tử– đặc điểm của cấu trúc Mặt mạng
Mạng lưới = đặc điểm phân bố các
mạng c ơ sở
đơn vị cấu trúc, không cung cấp
thông tin CTHH, nhưng cho biết ô Cấu
trúc tinh thể = Mạng l ư ới + Motif Thông tin CTHH lOMoAR cPSD| 22014077
Mô tả sự sắp xếp nguyên tử. 11/6/2021 4 Cấu trúc tinh thể + Bài 1: Xác định a.
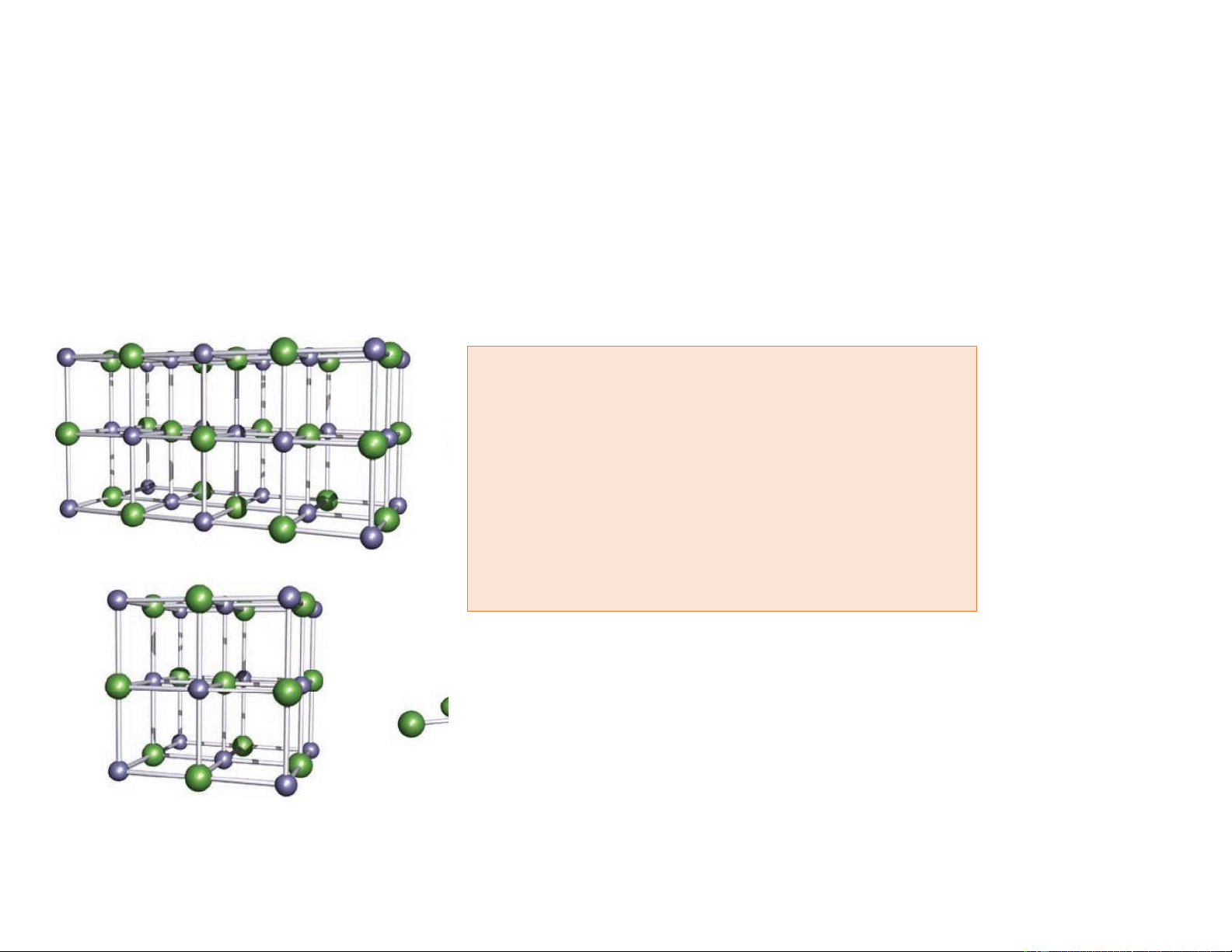
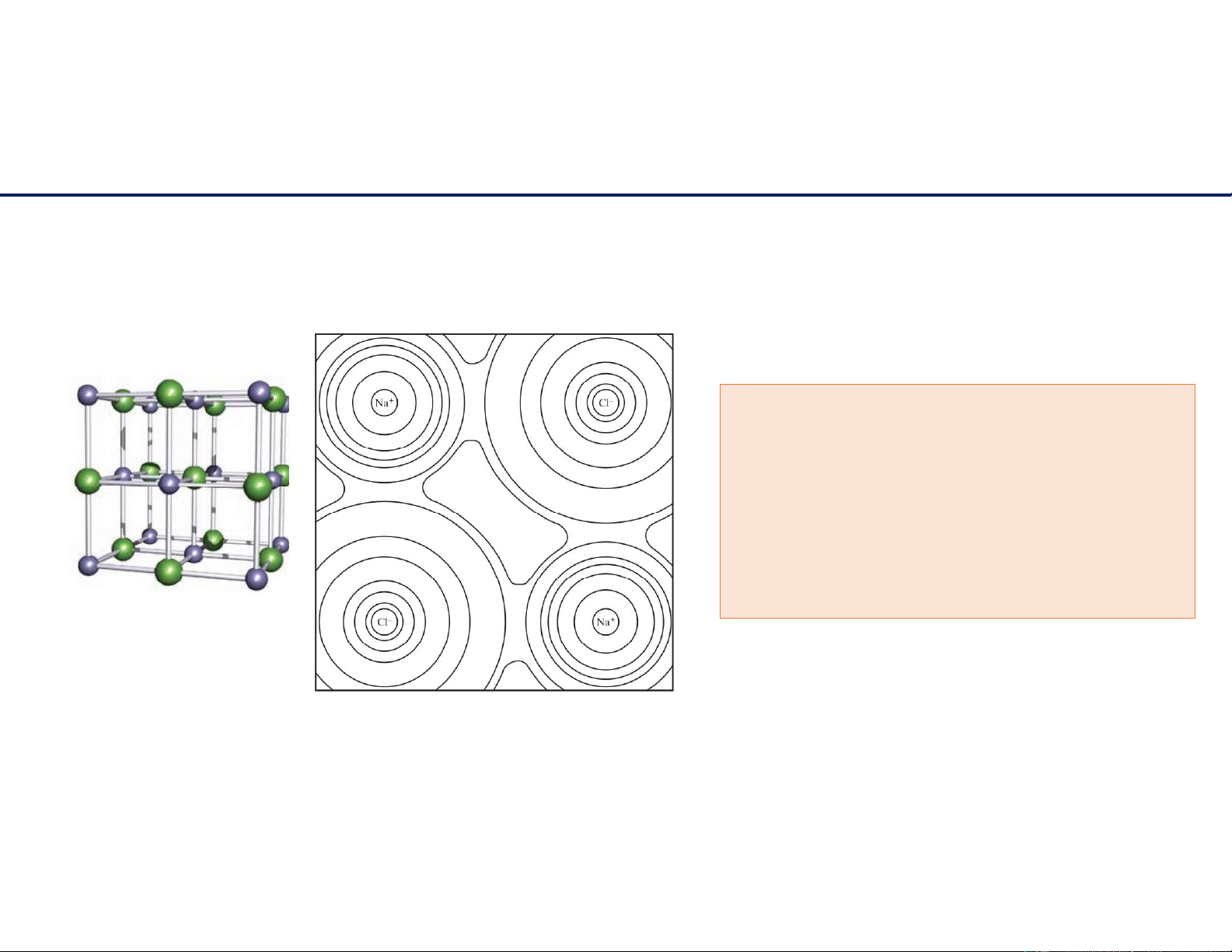
Số ion sodium và chloride có mặt trong ô mạng cơ sở. b.
Số phân tử sodium chloride trong ô mạng cơ sở. c.
Số phối trí của ion sodium và ion chloride. lOMoAR cPSD| 22014077
Ô mạng cơ sở NaCl – sodium chloride Na Cl- 11/6/2021 5 lOMoAR cPSD| 22014077 Cấu trúc tinh thể
Ô mạng cơ sở NaCl – sodium chloride + Bài 2:
2.1. Xác định mối liên hệ giữa bán kính
các ion và độ dài cạnh (a) ô mạng cơ sở NaCl.
2.2. Tính khối lượng riêng của NaCl biết
bán kính ion sodium và chloride lần lượt là 102 và 181 pm. Na Cl- lOMoAR cPSD| 22014077
G. Schoknecht (1957) Z. Naturforsch., Teil A, vol. 12, p. 983. 11/6/2021 6 lOMoAR cPSD| 22014077 Cấu trúc tinh thể
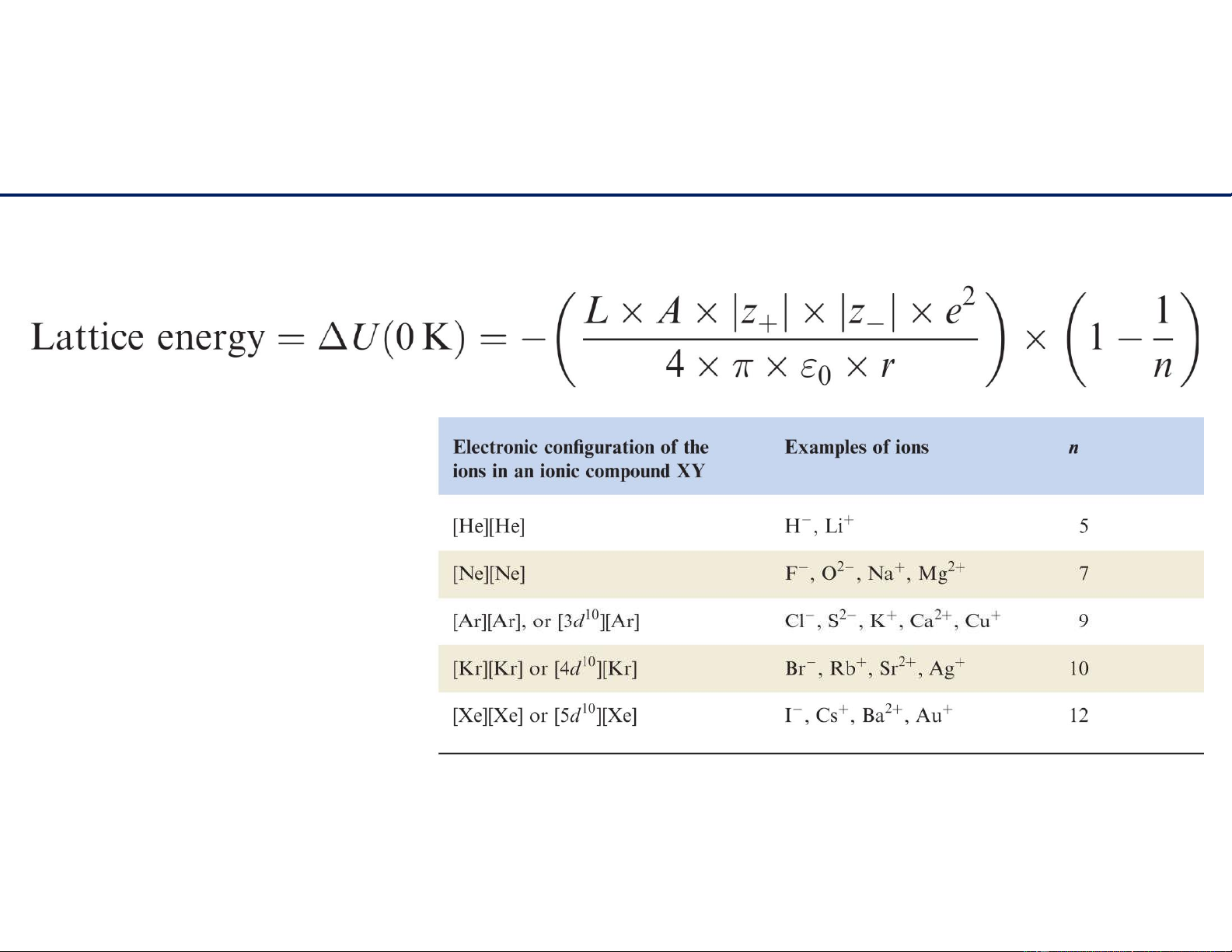
Công thức Born–Landé: năng lượng mạng lưới
Năng l ư ợng mạng l ư ới càng
bé thì hợp chất ion càng bền nhiệt .
Phụ thuộc vào hai yếu tố :
- Điện tích ions
- Khoảng cách liên nhân hai ions. 11/6/2021 7 lOMoAR cPSD| 22014077
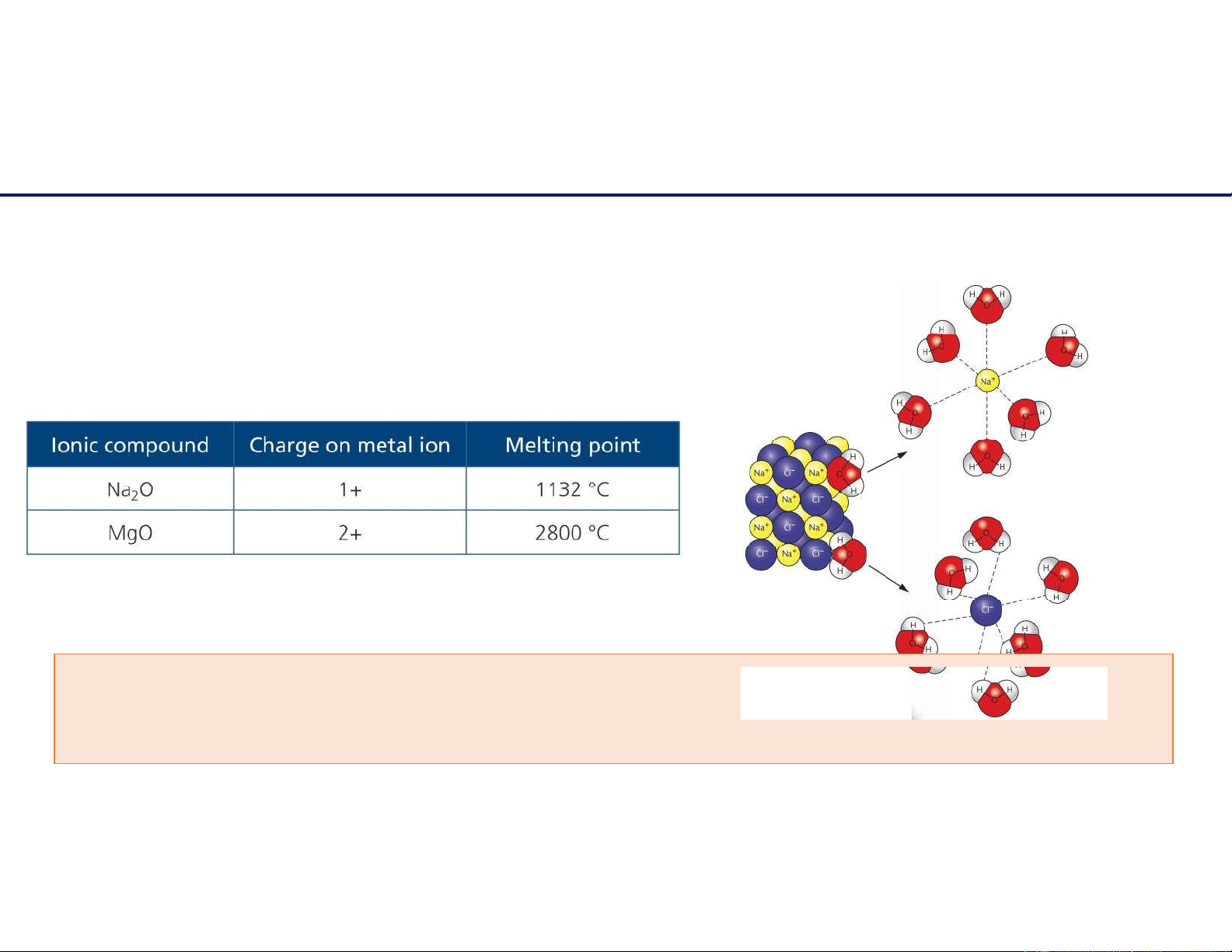
Tính chất hợp chất ion
Hợp chất ion có nhiệt độ sôi, nhiệt độ nóng chảy cao và kém hoặc không bay hơi, không dẫn
điện ở trạng thái rắn, dẫn điện ở trạng thái nóng chảy và giòn;
tan nhiều trong nước (hydrate hóa) và dung môi phân cực. 11/6/2021 8
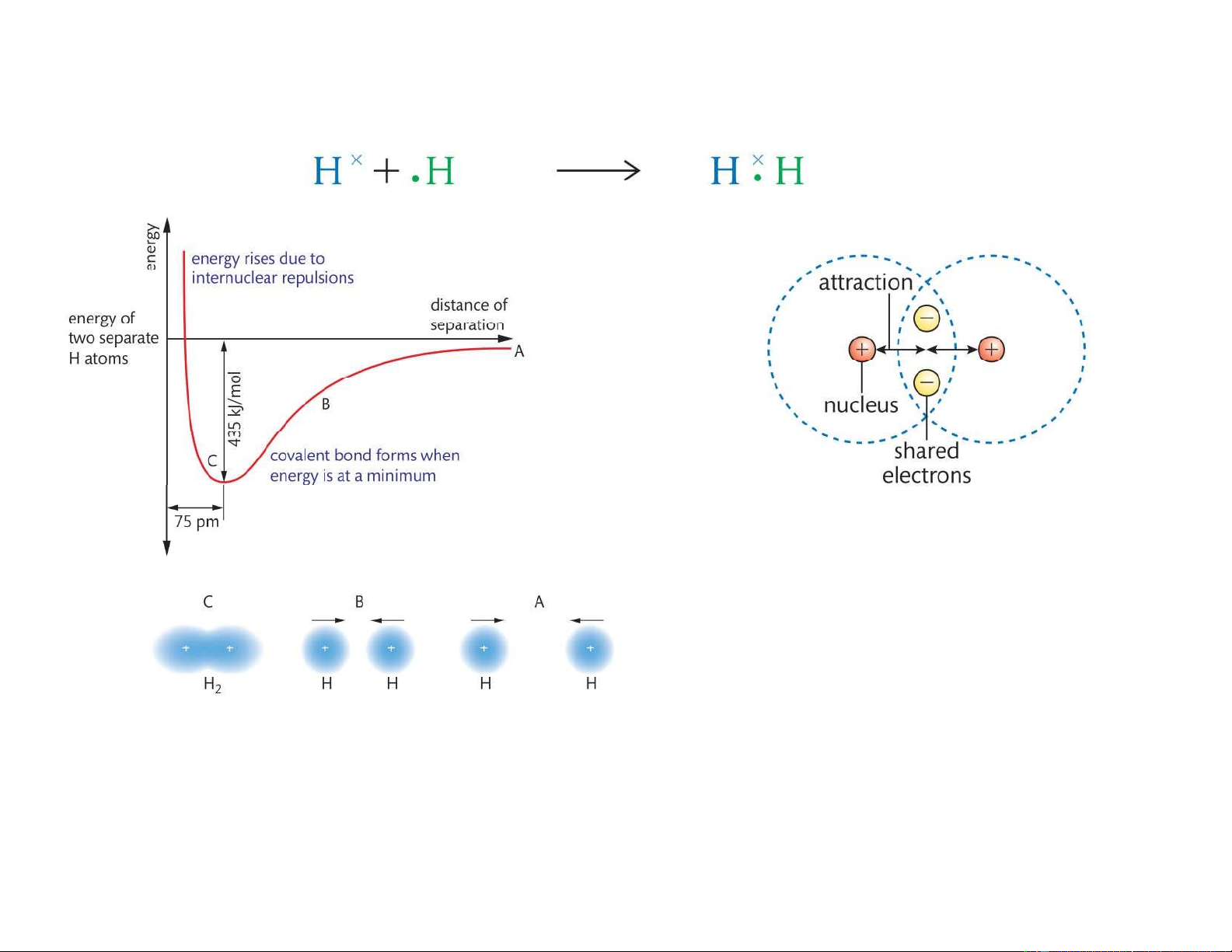
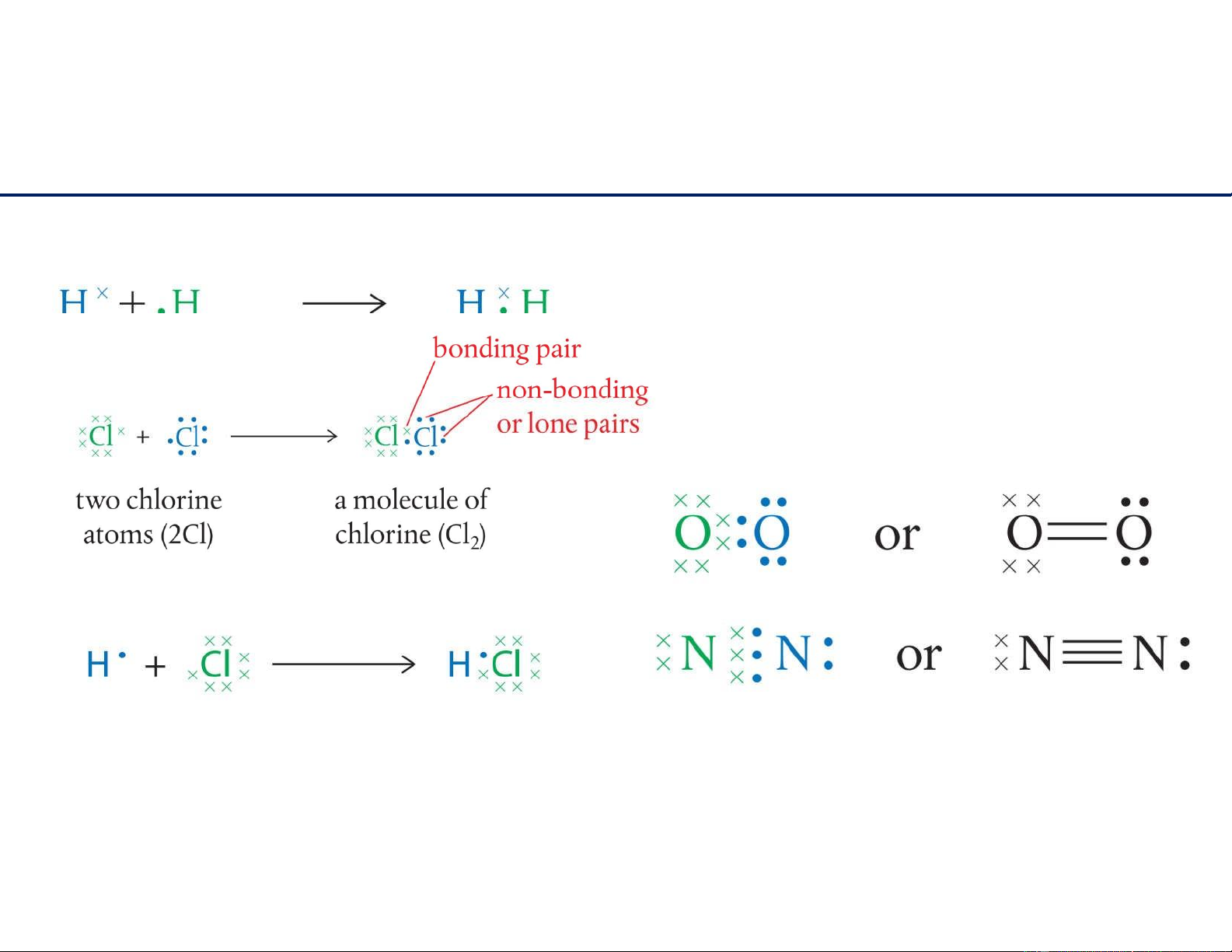
Liên kết cộng hóa trị Liên kết cộng hóa trị hình
thành khi hai nguyên tử dùng chung (sharing) electrons. Bài 2:
2.1. Giải thích số liệu thực nghiệm trên.
2.2. Tại sao hợp chất ion không dẫn điện ở trạng thái rắn, dẫn điện ở trạng thái nóng chảy? lOMoAR cPSD| 22014077
Bản chất là t ư ơng tác tĩnh điện
giữa các hạt nhân và electrons. 11 / 6/2021 9 lOMoAR cPSD| 22014077
Liên kết cộng hóa trị
Trừ hydrogen, các nguyên tử chu kì 2 khi phản ứng nhau đều đạt lớp vỏ 8 electron
Liên kết đôi (qui tắc bát tử) lOMoAR cPSD| 22014077
Liên kết ba Liên kết đơn 11/6/2021 10
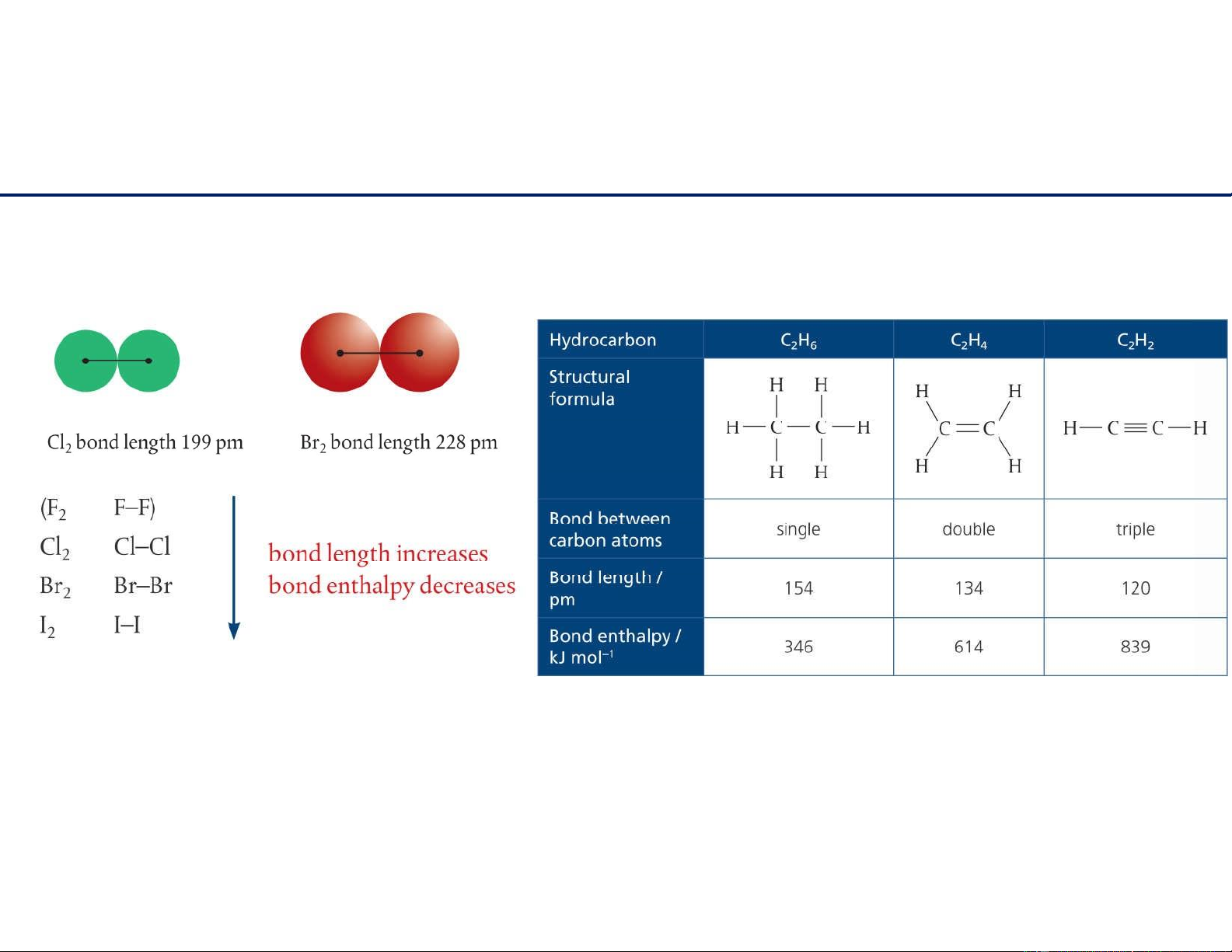
Liên kết cộng hóa trị
Đặc điểm liên kết: liên kết càng ngắn, năng lượng liên kết lớn, liên kết càng bền. lOMoAR cPSD| 22014077 11/6/2021 11
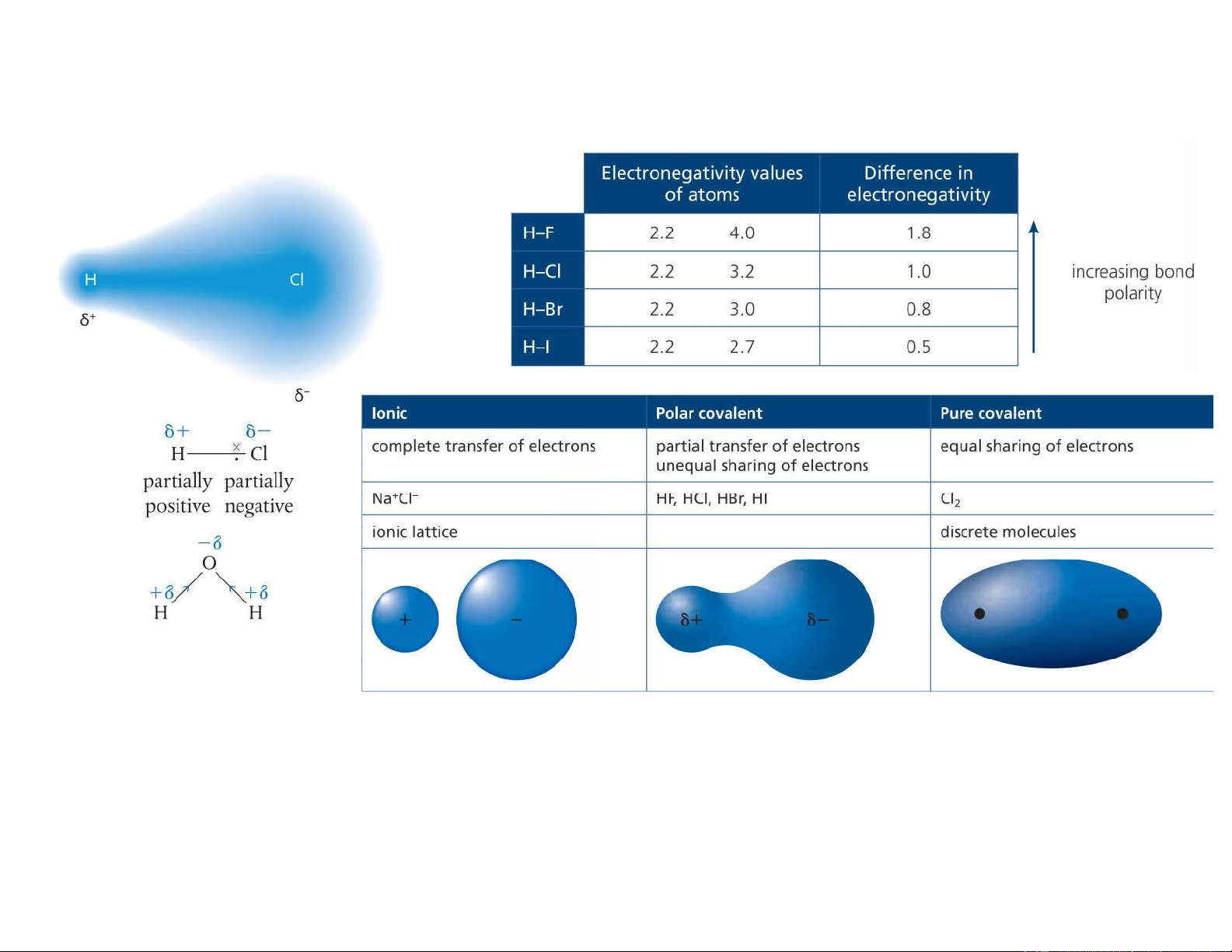
Liên kết cộng hóa trị
Liên kết bị phân cực do sự lệch mật độ electron dùng chung. lOMoAR cPSD| 22014077 11 / 6/2021 12
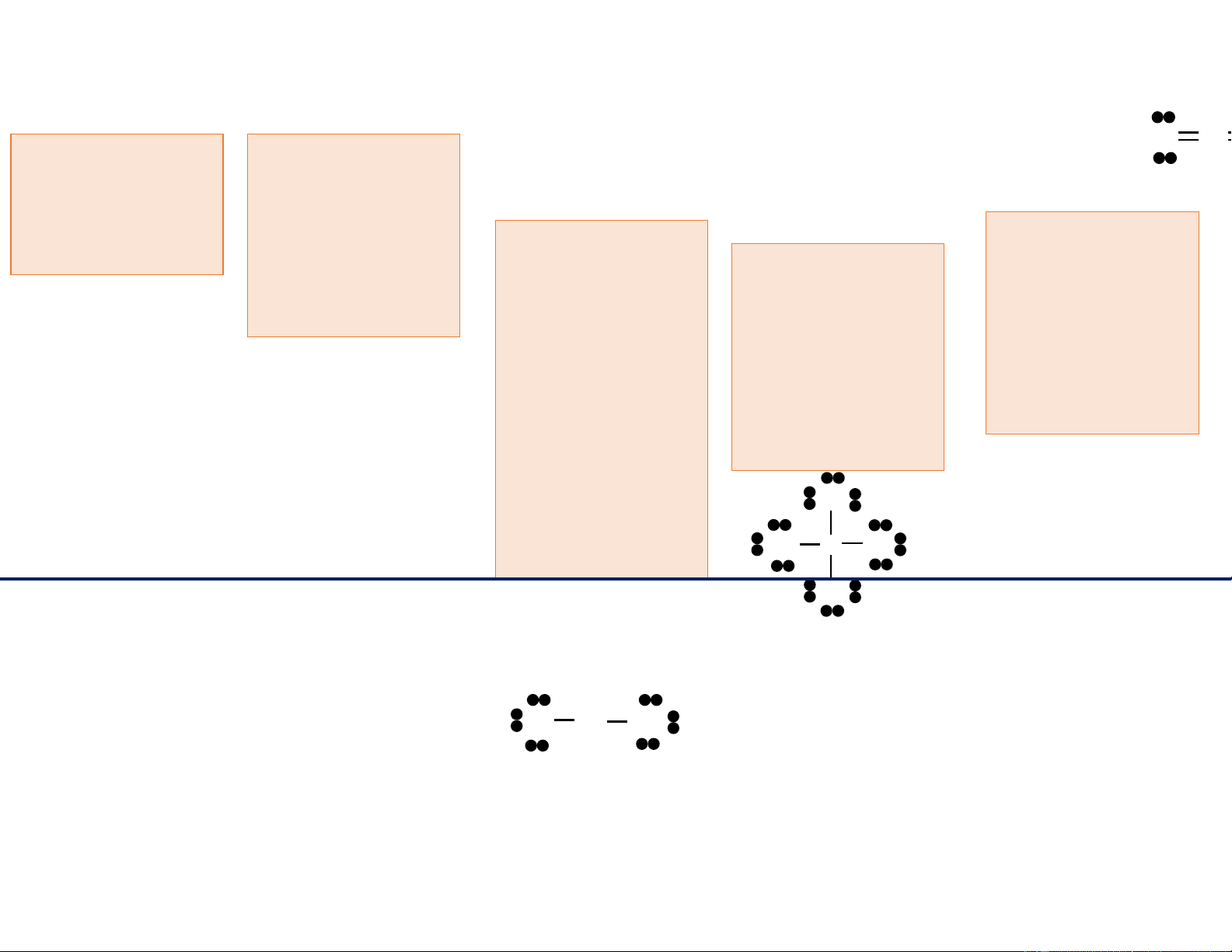
Cấu trúc phân tử cộng hóa trị: Công thức Lewis lOMoAR cPSD| 22014077
ông thức Lewis: CCl4 và CO2 O C Tính tổng số Vẽ cấu trúc electron hóa trị khung của phân 5 các nguyên tử tử; nguyên tử độ 3 4 Kiểm tra tổng số có trong phân tử Vẽ liên kết đơn âm điện thấp Nếu không đủ electron sau khi hơn là nguyên hình thành giữa 1 2 điều chỉnh và so 8e cho mỗi nguyên tử trung tâm. hai nguyên tử do tử, điều sánh với tổng số sự góp chung C chỉnh một số liên e tính ban đầu 2e; thêm e còn l kết đơn thành để hoàn tất công lại vào xung liên kết đôi hoặc thức Lewis. quang các ba. nguyên tử sao Cl Không liên kết: 6 cho thỏa mãn O Cl x 4 = 24 qui tắc bát tử Liên kết: 2 x 4 = 8 CCl C Cl 4 có 32 e C (trừ H) hóa trị á Cl C Cl Không liên kết: 4 c Cl x 2 = 8 h Cl Liên kết: 2 x 4 = 8 CO v 2 có 16 e hóa 13 trị ẽ O C O C O c 11/6/2021 lOMoAR cPSD| 22014077
Cấu trúc phân tử cộng hóa trị: Công thức Lewis
Bài 3: Vẽ công thức Lewis các phân tử sau:
a. CF3Cl, HF, NH3, H2O, BF3, BeCl2, NCl3, PCl3, PCl5, SCl2, SF6, N2H4, N2H2, O2F2, H2O2 b. H3O+, NH + - - -
4 , NO3 , NO+, NO2 , I3
c. POCl3, H2SO4, H3PO4, SO2Cl2
Điện tích hình thức ( FC) = Số electron hóa trị - số liên kết – số electron tự do
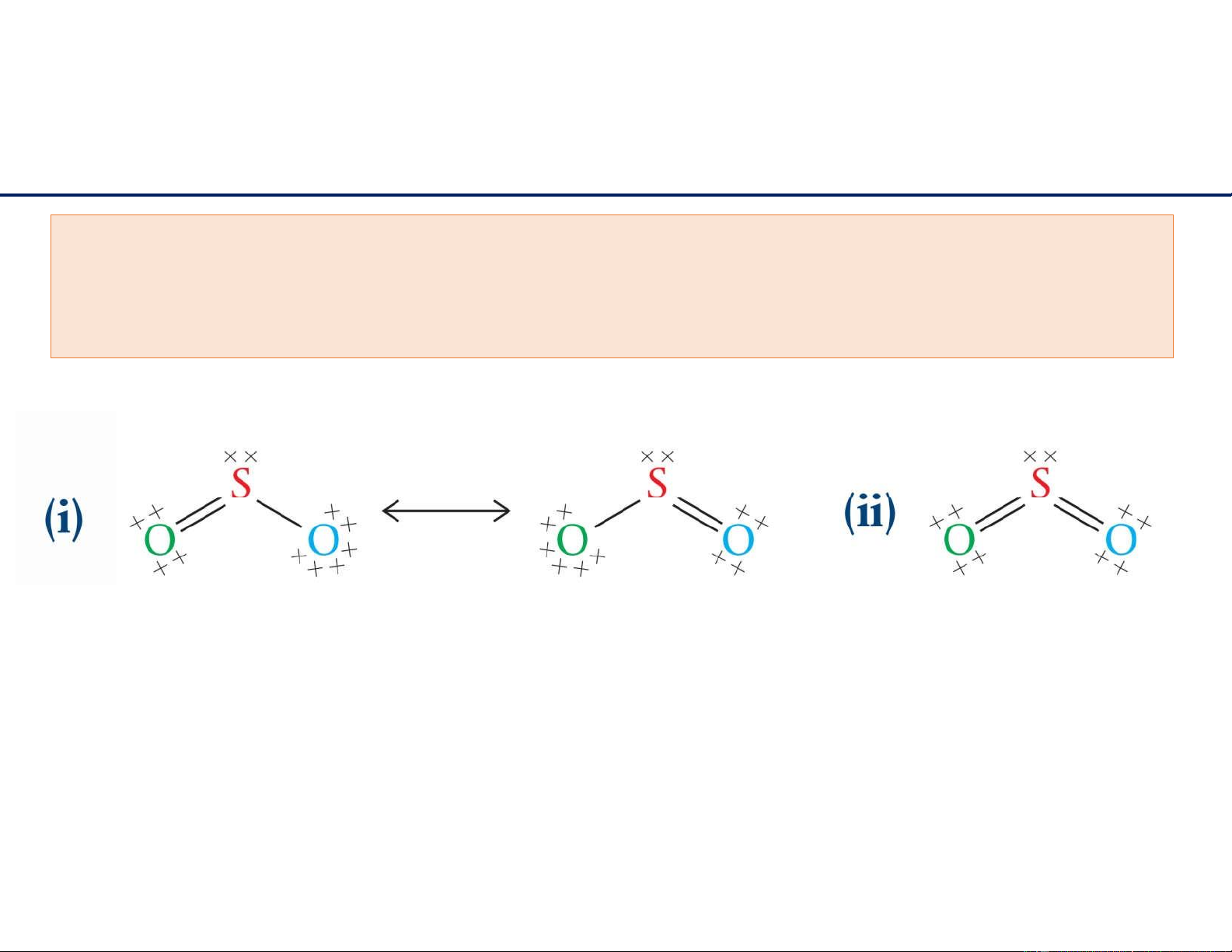
Dạng cộng h ư ởng
Vẽ công thức Lewis: SO2 FC(O) = 6-2-4 = 0 FC(O) = 6-2-4 = 0 FC(O) = 6-1-6 = -1 FC(O) = 6-2-4 = 0 FC(S) = 6-3-2 = +1 FC(S) = 6-4-2 = 0
Tổng điện tích = 0
Tổng điện tích = 0 lOMoAR cPSD| 22014077 11/6/2021 14 lOMoAR cPSD| 22014077
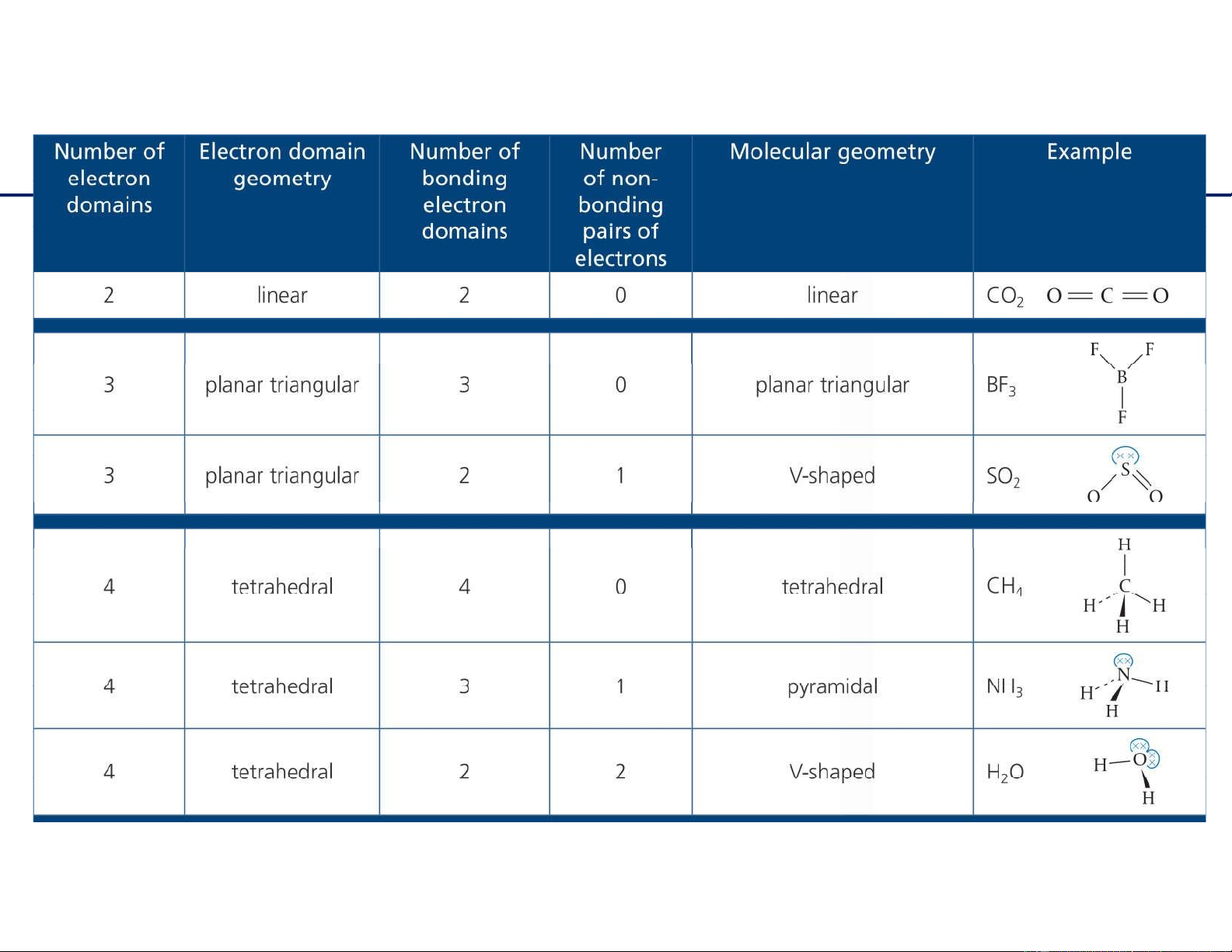
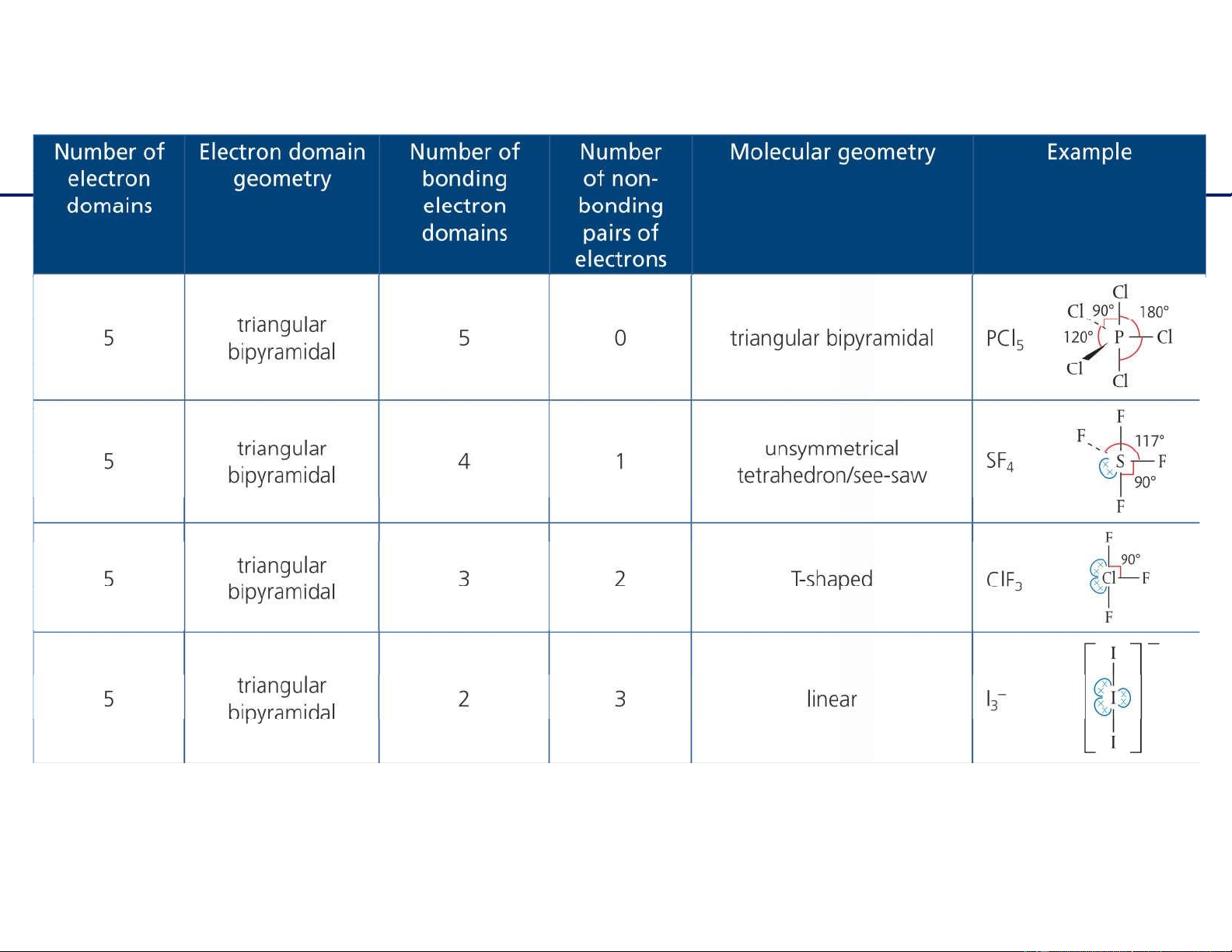
Dạng hình học phân tử : VSEPR 11 / 6/2021 15 lOMoAR cPSD| 22014077
Dạng hình học phân tử : VSEPR 11/6/2021
16 Bài 4: Dự đoán dạng hình học các phân tử sau:

