









Preview text:
03/13/20
2.2. Hằng số axit, hằng số bazơ, tích số ion
Chương 2: Phương pháp chuẩn độ axit-bazơ của nước
2.2.3. Tích số ion của nước – Knc
II.1. Cân bằng axit – bazơ trong nước
H O là một chất lưỡng tính: 2
2.1. Phản ứng axit – bazơ H O + H O ⇋ H O+ + OH- 2 2 3 •
Thuyết axit – bazơ của Bronsted-Lowry Hằng số cân bằng K : cb •
Cặp axit-bazơ liên hợp A/B [H O ].[OH ] 3 K cb 2 [H O] •
Phản ứng axit-bazơ là phản ứng trao đổi H+ 2
giữa 2 cặp axit-bazơ liên hợp
K .[H O]2 = [H O+].[OH-] = const = K cb 2 3 nc
K tích số ion của nước (phụ thuộc vào nhiệt độ) nc Ở 250C: K = 10-14 hay pK = 14 nc nc 39 42
2.2. Hằng số axit, hằng số bazơ, tích số ion
2.2. Hằng số axit, hằng số bazơ, tích số ion của nước của nước
2.2.1. Hằng số axit – K
2.2.4. Mối quan hệ giữa hằng số axit và hằng số a Xét một dung dịch axit:
baz ơ của một cặp axit-bazơ liên hợp A + H O ⇋ B + H O+ 2 3 Hằng số cân bằng K : [B].[ H O ] [ ] A .[ OH ] cb 3 14 [B].[H O ] K .K . K 10 a b nc 3 K (1 ) [ ] A [B] cb [ ]. A [H O] 2 [B].[H O ] K .[H O] 3 K pK + pK = 14 a b cb 2 a [ A]
Với một cặp axit-bazơ liên hợp, axit càng mạnh thì
K là hằng số axit; pK = -logK a a a
bazơ càng yếu và ngược lại
K đặc trưng cho độ mạnh, yếu của axit a 40 43
2.2. Hằng số axit, hằng số bazơ, tích số ion
2.3. Tính pH của các dung dịch axit-bazơ của nước
2.2.2. Hằng số bazơ – K
2.3.1. Phương trình bảo toàn proton b Xét một dung dịch bazơ:
Số mol proton các axit cho luôn bằng số mol B + H O ⇋ BH+ + OH- 2
proton các bazơ nhận Hằng số cân bằng K : cb
[BH ].[OH ] K (2 ) cb [B].[H O] 2 [BH ] OH .[ ] K .[H O] K cb 2 b [B]
K là hằng số bazơ; pK = -logK b b b
K đặc trưng cho độ mạnh, yếu của bazơ b 41 44 1 03/13/20 • Ví dụ 4: dung dịch NH • Ví dụ 1: 3 – Các cân bằng: H O + H O ⇋ H O+ + OH- 2 2 3 NH + H O ⇋ NH + + OH- 3 2 4
– PTBT proton: [H O+] = [OH-] 3 H O + H O ⇋ H O+ + OH- 2 2 3 – PTBT proton: (NH , H O) 3 2 + - H+ + H+ [OH-] = [NH ] + [H O+] 4 3 OH- H O 2 H O+ •
Ví dụ 5: dung dịch CN-, CH COO- 3 3 – Các cân bằng: CN- + H O ⇋ HCN + OH- 2
CH COO- + H O ⇋ CH COOH + OH- 3 2 3 H O + H O ⇋ H O+ + OH- 2 2 3
– PTBT proton: (CN-, CH COO-, H O) 3 2
[HCN] + [CH COOH] + [H O+] = [OH-] 3 3 45 48
2.3. Tính pH của các dung dịch axit-bazơ
• Ví dụ 2: dung dịch HCl có nồng độ C (mol/L)
2.3.2. pH của dung dịch hệ đơn axit-bazơ trong
– Trong dd tồn tại 2 cân bằng: nước HCl + H O Cl- + H O+ 2 3 H O + H O ⇋ H O+ + OH- 2 2 3 Cl-, OH- PTBT proton: - H+ [H O+] = [OH-] + [Cl-] 3 HCl, H O 2 = [OH-] + C + H+ H O+ 3 46 49
a. pH của dung dịch axit mạnh
• Ví dụ 3: dung dịch hỗn hợp HCl (C ) và CH COOH (C ) 1 3 2
– Giả sử dung dịch axit mạnh HA, nồng độ C :
– Các cân bằng trong dung dịch a HA + H O → A- + H O+ 2 3 HCl + H O H O+ + Cl- 2 3 H O + H O ⇋ H O+ + OH- 2 2 3
CH COOH + H O ⇋ CH COO- + H O+ 3 2 3 3
– Hoặc viết dưới dạng: H O + H O ⇋ H O+ + OH- 2 2 3 HA → A- + H+ H O ⇋ H+ + OH- Cl-, CH 2 3COO-, OH-
[H3O]+ = [OH-] + [Cl-] + [CH3COO-] – PT bảo toàn proton: - H+
[H+] = [A-] + [OH-] = C + [OH-] = C ≠ C a 1 2 K K H O 2 HCl, CH H O 2 [H ] C 3COOH, H2O [OH ] a [ H ] [H ] + H+ [ H ] 2 C .[ H ] K 0 a H O 2 (*) H O+ [ H ] ... 3 47 50 2 03/13/20
c. pH của dung dịch hỗn hợp axit-bazơ liên hợp
– Giả sử dung dịch chứa hỗn hợp axit yếu HA, nồng độ C và muối A
– Biện luận: [H+] = [A-] + [OH-] = C + [OH-] a NaA (A-) nồng độ CB
• Nếu C ≥ 10-6M → [OH-] « C khi đó:
– Trong dung dịch này có các cân bằng: a a [H+] = C NaA Na+ + A- a
• Nếu C ≤ 10-8M→ C « [OH-] khi đó: HA ⇋ H+ + A- a a [H+] = [OH-] = 10-7 H O ⇋ H+ + OH- 2
• Nếu 10-8M < C < 10-6M→ giải phương trình bậc – PT trung hòa điện: a 2 (*) [H+] + [Na+] = [A-] + [OH-]
– Pt bảo toàn khối lượng: C + C = [HA] + [A-]
• VD1: Tính pH của dung dịch HCl trong trường hợp 10- a b 3M, 10-7M, 10-9M – Pt hằng số axit:
[H ].[ A ] K
• VD2: Tính pH của dung dịch HCl 14% (d = 1,054 g/ml) a [ ] HA ĐS: pH = - 0,61 C [ H OH ] [ ]
[H ] K . A (CT TQ I I.1) a C [ H ] [ OH ] B 51 54
b. pH của dung dịch bazơ mạnh Biện luận: • BOH có nồng độ Cb
– Cân bằng trong dung dịch:
• Xét trường hợp dung dịch mang tính axit BOH → B+ + OH- C - Nếu A K
» 10-7 tức là [H+] » [OH-] thì: H O ⇋ H+ + OH- a 2 CB C [ H ] – PT bảo toàn proton:
[H ] K . A a C [ H ] [OH-] = [H+] + [B+] = [H+] + C B b K -
Nếu C ,C » [H+] » [OH-] thì: A B [ OH ] H O 2 [ H ] C C A A [ H ]2 C .[ H ] K 0 [H ] K . ha
y pH pK lg b H a a 2O C C (**) B B [ H ] ... 52 55 • Biện luận: Biện luận:
• Nếu C ≥ 10-6M → pOH = -logC
• Xét trường hợp dung dịch mang tính bazơ: b b C - Nếu A K
« 10-7 tức là [H+] « [OH-] thì:
• Nếu C ≤ 10-8M→ pOH = 7 a b CB • Nếu 10-8M< C
< 10-6M→ giải pt bậc 2 C OH C OH [ ] A [ ] B b [H ] K . hay [ OH ] K . a C [ OH ] b C [ OH ] B A (**) → giải pt bậc 2
• VD1: Tính pH của dung dịch NaOH trong trường hợp 10- 3M, 310-7M, 10-9M -
Nếu C , C » [OH-] » [H+] thì: A B
• VD2: Tính pH của dung dịch NaOH 9% (d = 1,098 g/ml) C C A A [H ] K . hay pH pK lg ĐS: pH = 14,39 a a C C B B 53 56 3 03/13/20
• VD1: Tính pH của dung dịch hỗn hợp CH COOH 10-4M 3
và CH COONa 10-3M. Biết axit CH COOH có K =10-4,75 3 3 a
• VD2: Hòa tan 9,20 g axit lactic (90,08 g/mol) và 11,15 g
• Ví dụ 1: Tính pH của dung dịch CH COOH 3
natri lactat (112,06 g/mol) trong nước và pha loãng tới 1 0,1M; pK = 4,75 a
lit. Tính pH của dung dịch, biết có axit lactic có K =1,38 a 10-4
• Ví dụ 2: Tính pH của dung dịch NH Cl 4 0,1M; biết NH có pK = 4,75 3 b
• Ví dụ 3: Tính pH của dung dịch axit salixilic 10-3M có pK = 3 a 57 60
d. pH của dung dịch đơn axit yếu
e. pH của dung dịch đơn bazơ yếu
– Giả sử dung dịch axit yếu HA, nồng độ C
– Giả sử dung dịch bazơ B, nồng độ C a b
– Dung dịch có cân bằng:
– Trong dung dịch có 2 cân bằng: HA ⇋ H+ + A- B + H O ⇋ BH+ + OH- 2 H O ⇋ H+ + OH- H O ⇋ H+ + OH- 2 2
– Áp dụng CTTQ II.1 với C = 0 ta có: B
- Áp dụng CTTQ II.1 với C = 0 ta có: A [ OH H C OH H ] [ ] [ ] [ ] C [ H OH [H ] K hay [ OH ] K B ] [ ] [H ] K a a b a
C [OH ] [H ] [OH ] [H ] [ H ] [ OH ] B
- Tương tự như trường hợp bazơ yếu, xét 58 61
d. pH của dung dịch đơn axit yếu
e. pH của dung dịch đơn bazơ yếu
• Nếu coi sự phân ly của axit và nước là không đáng kể tức là
• Nếu coi sự phân ly của bazơ và nước là không đáng kể tức [OH-] « [H+] « C là [H+] « [OH-] « C A B C C [ H ] K a [H ] K C . [ OH ] K B OH [ ] K C . a b [ H ] a a [ OH ] b B 1 1 1 pH ( pK log C ) pOH ( pK log C hay ) pH 7 ( pK log C ) 2 a a 2 b B 2 a B
• Nếu coi sự phân ly của nước là không đáng kể, [OH-] « [H+]
• Nếu coi sự phân ly của nước là không đáng kể, [H+] « [OH-] C [ H ] C OH [ ] [H ] K a [OH ] K b a b [ H ] [ OH ] → giải pt bậc 2 → giải pt bậc 2 59 62 4 03/13/20
f. pH của dung dịch hỗn hợp 2 axit
– Ví dụ 1: Tính pH của hỗn hợp gồm HCl 0,1M
• VD1: Tính pH của dung dịch NH 0,1M; 3 và CH COOH 0,1M; pK = 4,75 biết NH có pK = 4,75 3 a 3 b
• VD2: Tính pH của dung dịch NH 10-4M; 3 biết NH có pK = 4,75 3 b
• VD3: Tính pH của dung dịch natri
hipoclorit NaOCl 10-4M, biết HClO có Ka =3,010-8 63 66
f. pH của dung dịch hỗn hợp 2 axit
g. pH của dung dịch hỗn hợp axit-bazơ không liên hợp
– Giả sử dung dịch chứa hỗn hợp axit yếu HA , nồng độ C và
Hỗn hợp 2 axit mạnh: HA (C ) và HA 1 A 1 1 2
muối NaA (A -) nồng độ C 2 2 B (C )
– Trong dung dịch này có các cân bằng: 2 - – Trong dung dịch: NaA Na+ + A 2 2 ⇋ - [H+] = [H+] + [H+] + [H+] HA H+ + A 1 1 dd HA1 HA2 H2O A - + H+ ⇋ HA = C 2 2 1 + C2 + [H+]H2O H O ⇋ H+ + OH-
– Nếu C + C ≥ 10-6M → [H+] nhỏ, bỏ qua 2 1 2 H2O – PT BT proton: → pH = -log(C + C ) 1 2 [H+] + [HA ] = [A -] + [OH-] 2 1
– Nếu C + C ≤ 10-8M → [H+] nhỏ, bỏ qua Biện luận: 1 2 axit → pH = 7
– Nếu [H+] và [OH-] không đáng kể thì: [HA ] = [A -] 2 1
– Nếu 10-8M < C + C < 10-6M 1 2 hay: C [ H ] C K B A a
→ Giữ nguyên và giải pt bậc 2 1 K [ H ] K [ H ] a 2 a1 64 67
f. pH của dung dịch hỗn hợp 2 axit
g. pH của dung dịch hỗn hợp axit-bazơ không liên hợp
Hỗn hợp của một axit mạnh HA (C ) và một axit • Nếu C = C thì: A B 1 1 yếu HA (C , K ): 1 2 2 a [H ] K K hay pH ( pK pK ) a1 a 2 2 1 a a 2 [H+] = [H+] + [H+] + [H+] dd HA1 HA2 H2O • Nếu C và C = mC thì: A CB A B
– Thường trong dung dịch axit H+ do nước
phân ly không đáng kể → bỏ qua [H ] mKa1 K [ H ] K [ H ] a 2 a1 [H+] = C + [H+] 1 HA2
• Nếu C ≥ C → H+ do axit yếu phân ly không đáng 1 2 kể → bỏ qua [H+] = C dd 1
• Nếu C ≪ C → không bỏ qua axit yếu 1 2 65 68 5 03/13/20
a. pH của dung dịch chất lưỡng tính
- Trường hợp có thể coi các quá trình (2), (3) và (4)
là rất yếu thì chấp nhận [HA-] = C , ta có: 0
• VD1: Tính pH của dung dịch NH CN 0,1M; 4
K (K C K ) a1 a 2 0 [H ] nc biết pK = 4,75 và pK = 9,21 K C b,NH3 a,HCN a1 0 C K - Nếu 0 a1 1 [H ] K K ha y pH ( pK pK ) a1 a 2 a1 a 2 K C K 2 a 2 0 nc
• VD 1: Tính pH của dung dịch NaHCO 0,1M; axit 3 H CO có K = 10-6,35 và K = 10-10,33 2 3 a1 a2
• VD 2: Tính pH của dung dịch Na HPO 0,1M; axit 2 4 H PO có K = 10-2,15, K = 10-7,20 và K = 10-12,38 3 4 a1 a2 a3 69 72
2.3. Tính pH của các dung dịch axit-bazơ
2.3. Tính pH của các dung dịch axit-bazơ
2.3.3. pH của dung dịch hệ đa axit-bazơ trong
2.3.3. pH của dung dịch hệ đa axit-bazơ trong nước nước
b. pH của dung dịch đa axit •
Đa axit là axit mà phân tử phân ly lần lượt
theo nhiều nấc, ứng với mỗi nấc có một hằng số axit riêng. •
Nói chung proton tách ra khỏi tiểu phân của
nấc trước dễ dàng hơn ở nấc sau, do đó hằng
số phân li của nấc sau thường nhỏ hơn của nấc trước 70 73
a. pH của dung dịch chất lưỡng tính
b. pH của dung dịch đa axit
– Giả sử dung dịch chứa muối NaHA, nồng độ C và 2 hằng số axit
– Giả sử dung dịch đa axit H A, nồng độ C và các hằng số axit 0 n A của H A là K , K của H A là K , K , …, K 2 a1 a2 n a1 a2 an
– Trong dung dịch này có các cân bằng:
– Trong dung dịch này có các cân bằng: NaHA Na+ + HA- (1) H A ⇋ H+ + H A- K n n-1 a1 HA- ⇋ H+ + A2- (2) H A- ⇋ H+ + H A2- K n-1 n-2 a2 HA- + H+ ⇋ H A (3) … 2 H O ⇋ H+ + OH- (4) HA(n-1)- ⇋ H+ + An- K 2 an – Pt bảo toàn proton: H O ⇋ H+ + OH- K 2 nc [H+] + [H A] = [A2-] + [OH-] – Nếu: 2 K » K » … » K (103 lần) a1 a2 an [HA ] K [HA ][H ] [H ] nc K
thì coi đa axit là một đơn axit yếu với hằng số axit K . a 2 a1 [H ] [H ] Ka1 -
Trường hợp có thể coi các quá trình (2), (3) và (4) là rất yếu thì
chấp nhận [HA-] = C , ta có: 0 K K C K K a 2 a1 0 nc a1 [H ] K C a1 0 71 74 6 03/13/20
c. pH của dung dịch đa bazơ
2.4.3. Hệ gồm các dạng H A, H A-,… và An- n n-1
– Giả sử dung dịch đa axit NanA (An-), nồng độ CB và các hằng số
axit của H A là K , K , …, K
Hằng số phân ly theo từng nấc của axit H A là n n a1 a2 an
– Trong dung dịch này có các cân bằng: K , K , …, K và a1 a2 an An- + H O ⇋ HA(n-1)- + OH- K C = [H A]+ [H A-] +…+ [ An-] 2 b1 0 n n-1
HA(n-1)- + H O ⇋ H A(n-2)- + OH- K 2 2 b2 Tương tự ta có: … n [H ] [H A] C H A- + H O ⇋ H A + OH- K n 0 n n 1 n
[H ] K [H ]
K K [H ] 2 ... K K K ... n-1 2 n bn a1 a1 a 2 a1 a 2 an H O ⇋ H+ + OH- K n 1 2 nc K [H ] a [H A ] C 1 – Nếu: n 1 0 n n 1 n
[H ] K [H ]
K K [H ] 2 ... K K K ... a1 a1 a 2 a1 a2 an K » K » … » K (103 lần) n2 b1 b2 bn K K [H ] 2 a1 a [ A ] C 2 K = K /K n2 0 n n 1 n2 bi nc a(n+1-i)
[H ] K [H ] K K [H ] ... K K K ... a1 a1 a 2 a1 a 2 an
thì coi đa bazơ là một đơn bazơ yếu với hằng số bazơ K . b1 ... K K K ... n a1 a 2 an [ A ] C0 n n 1 n
[H ] K [H ]
K K [H ] 2 ... K K K ... a1 a1 a 2 a1 a 2 an 75 78
2.4. Tính nồng độ các thành phần của dung
2.5. Dung dịch đệm pH
dịch axit-bazơ ở pH xác định
2.4.1. Hệ gồm axit-bazơ đơn giản HA và A- 2.4.1. Định nghĩa HA ⇋ H+ + A-
- Dung dịch đệm là dung dịch có pH thay đổi
không đáng kể (pH ổn định) khi thêm một lượng
[H ].[ A ] K a
nhỏ axit mạnh hoặc bazơ mạnh. [ ] HA Đặt nồng độ chung, -
VD: dung dịch hỗn hợp CH COOH và 3 C = [HA] + [ A-] CH COONa 3 0 K -
Những dung dịch có khả năng đệm: C [HA 1 ]( a ) 0 [ H ]
Dung dịch chứa cặp axit-bazơ liên hợp [H ] [HA] C Dung dịch hỗn hợp muối của đa axit
0 [H ] Ka (NaH PO /Na HPO , …) 2 4 2 4 Ka
[ A ] C0 [H] Ka 76 79
2.4.2. Hệ gồm các dạng H A, HA- và A2- 2 2.4.2. Đệm năng
Hằng số phân ly của axit H A là K , K và 2 a1 a2
- Khả năng duy trì sự ổn định pH của một dung C = [H A]+ [HA-] + [ A2-] 0 2
dịch đệm được đặc trưng bởi thông số gọi là Tương tự ta có:
dung lượng đêm (đệm năng), kí hiệu là . 2 [H ] [H ] A C
- Đệm năng được định nghĩa bằng số mol của 2 0 2
[H ] K [H ] K K 1 a 1 a a 2
một bazơ mạnh (hoặc 1 axit mạnh) cần thêm vào K [H ] a1
1 lit dung dịch đệm để pH của nó tăng lên (hoặc [HA ] C0 2
[H ] K [H ] K K
giảm đi) 1 đơn vị. 1 a 1 a a2 K K 2 db da a1 a 2 [ A ] C 0 2
[H ] K [H ] K K dpH dpH a1 a1 a 2
Trong đó, db và da lần lượt là số mol bazơ mạnh
và axit mạnh cần cần thêm vào 1 lit dung dịch
đệm để pH của nó tăng lên hay giảm đi dpH. 77 80 7 03/13/20
3.1. Chất chỉ thị axit bazơ. 2.4.2. Đệm năng 3.1.1. Đặc điểm -
Với dung dịch đệm là hỗn hợp axit yếu HA nồng độ C
và bazơ liên hợp (muối) NaA A Chất chỉ thị nồng độ C ; axit– bazơ B C + C = C A B
và giả thiết C , C » [H+], [OH-] ta có: Axit hữu cơ Bazơ hữu cơ A B yếu (HIn) yếu CK [H ] C C a A B 3 , 2 3 , 2 2 Thay đổi Hệ quả: ([H ] K ) C a màu sắc • khi C = C = 0,5C theo pH max A B của dd •
Với C /C không đổi, tỉ lệ thuận với C A B Bazơ li Baz ên hợp ên •
Với C= const, tỉ số C /C càng khác 1 thì càng A B (In-) Axit liên hợp nhỏ 81 84 3.1.1. Đặc điểm
– VD 1: Tính nồng độ của hỗn hợp đệm (C)
Thường là các axit (bazơ) yếu
CH COOH + CH COONa có pH = 5 để khi 3 3
Màu axit khác màu bazơ liên hợp
thêm 0,25 mol HCl vào 1 lit dung dịch đệm
Màu chất phụ thuộc pH dung dịch
đó, thì pH của nó không giảm quá 0,5 đơn vị.
Kí hiệu: HInd hoặc IndOH
Trong nước, CCT có cân bằng phân ly như sau: HInd ⇋ H+ + Ind- Ka,HInd IndOH ⇋ Ind+ + OH- Kb,Ind 82 85
II.2. Chuẩn độ axit-bazơ
3.1.2. Khoảng pH đổi màu của chất chỉ thị
3.1. Chất chỉ thị axit –bazơ
Xét chất chỉ thị dạng HInd HInd ⇋ H+ + Ind- Màu dạng axit Màu dạng bazơ [ H ].[ Ind ] [HInd ] K pH pK log a,CCT [HInd ] a,CCT [ Ind ]
Khi pH thay đổi thì tỉ lệ [HInd]/[Ind-] thay đổi,
dung dịch có màu của dạng nào tồn tại chủ yếu trong dung dịch.
Mắt thường chỉ phân biệt được sự thay đổi màu
khi tỉ lệ [HInd]/[Ind-] trong khoảng 1/10 10.
pH = pKa,CCT 1, gọi là khoảng pH đổi màu của CCT 83 86 8 03/13/20
3.1.2. Khoảng pH đổi màu của chất chỉ thị
3.1.3. Một số chất chỉ thị thường gặp pH ≥ pK
+ 1: dd có màu của dạng bazơ
Đối với loại CCT chỉ có một màu, thì màu của HInd
dung dịch sẽ nồng độ của dạng mang màu quyết pH ≤ pK
– 1: dd có màu của dạng axit HInd định (HInd hoặc Ind-).
Chỉ số định phân pT là giá trị pH tại đó chất chỉ
Với CCT HInd nồng độ C , dạng axit HInd
thị đổi màu rõ nhất. Thường thấy, giá trị pT trùng 0
không màu; nếu gọi C là giá trị nồng độ Ind- cần
với giá trị pK của chất chỉ thị. a
đạt tới để ta nhận ra màu của nó, thì pH của dung
dịch tại đó màu của Ind- bắt đầu xuất hiện là: C C pH pK 0 log a,CCT C
Như vậy, pH làm đổi màu CCT phụ thuộc vào nồng độ CCT. 87 90
3.1.3. Một số chất chỉ thị thường gặp
3.1.4. Cách chọn chất chỉ thị
• Cách 1: Tính pH tại điểm tương đương của phép chuẩn
độ, sau đó chọn những chất chỉ thị có pT lân cận với pH tại ĐTĐ, hoặc pH
nằm trong khoảng đổi màu. ĐTĐ
• Cách 2: Xây dựng đường chuẩn độ để tìm ra bước nhảy
chuẩn độ sau đó chọn những chất chỉ thị có pT hoặc
khoảng đổi màu nằm trong bước nhảy chuẩn độ đó. pT càng gần với pH càng tốt. ĐTĐ
- Đường chuẩn độ axit- bazơ là đường biểu diễn sự biến
thiên pH theo lượng dung dịch chuẩn thêm vào trong
quá trình chuẩn độ (lượng dung dịch có thể tính theo V).
- Bước nhảy chuẩn độ là khoảng sai số cho phép của
phép chuẩn độ, thường là 0,1 hoặc 0,2 %. 88 91
3.1.5. Sai số trong phép chuẩn độ axit – bazơ
• Sai số do dụng cụ (pipet, buret, bình định mức) và sử dụng dụng cụ
• Sai số điểm cuối: xác định sai pH kết thúc chuẩn độ hay nói cách khác pH ≠ pH . c ĐTĐ
• Sai số chỉ thị: là sai số do pT của chất chỉ thị không trùng với pH
trường hợp do chọn sai CCT ĐTĐ 89 92 9 03/13/20
3.1.5. Sai số trong phép chuẩn độ axit – bazơ
II.2. Chuẩn độ axit-bazơ
• Thường dùng sai số điểm cuối để chỉ sai số của
3.2. Các trường hợp phép chuẩn độ (s),
chuẩn độ axit-bazơ NV N V
3.2.1. Chuẩn độ axit 0 0 s 100 . (F (%) 100 ). 1
mạnh bằng bazơ mạnh N V 0 0 và ngược lại Trong đó:
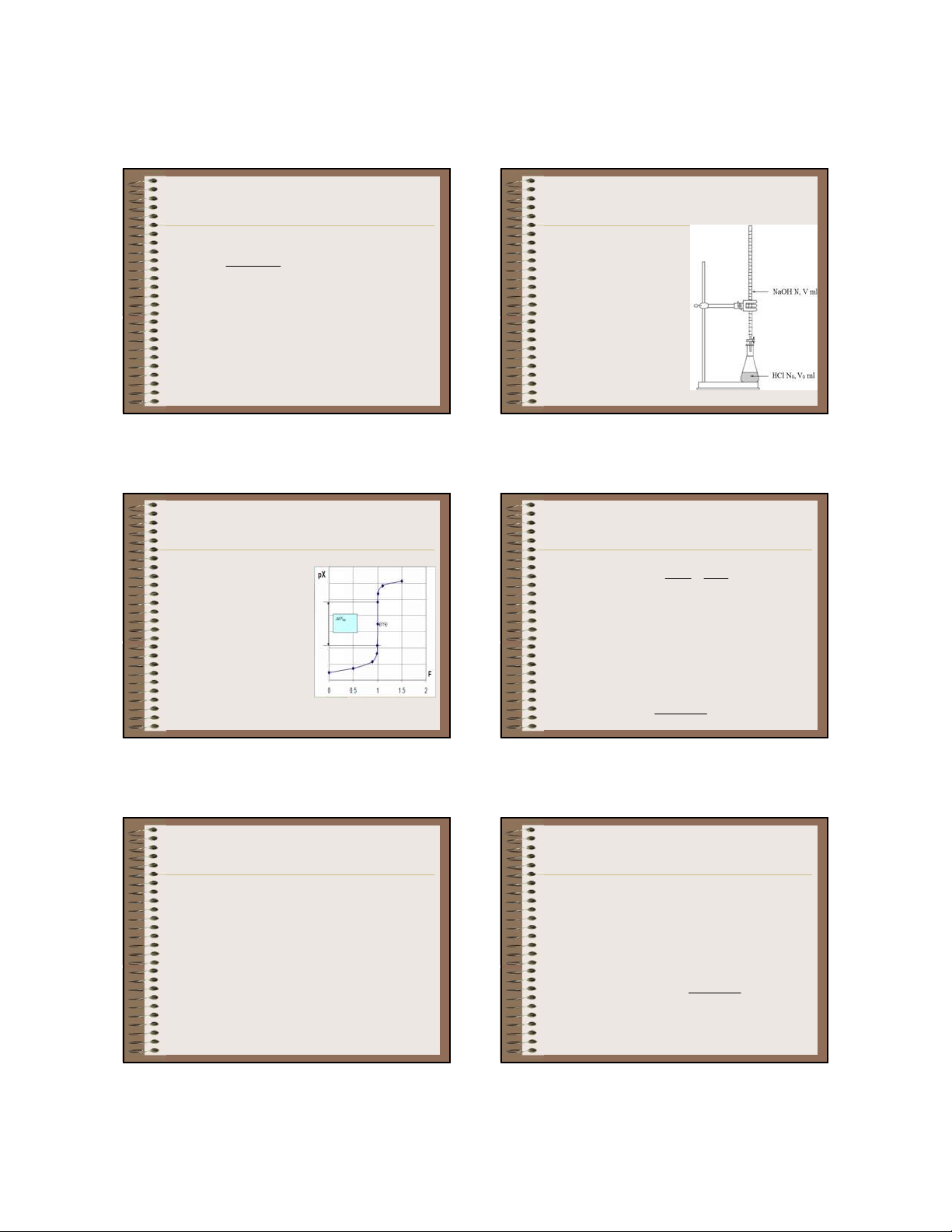
Giả sử chuẩn độ 100,0
- Đặt F = NV/N V , gọi là mức độ định phân (lượng 0 0
ml dung dịch HCl 0,1 N
chất cần xác định đã được chuẩn độ). bằng dung dịch NaOH
- V , N lần lượt là thể tích và nồng độ của dung dịch 0 0 0,1N. chất định phân.
- V, N lần lượt là thể tích và nồng độ của dung dịch chất chuẩn thêm vào. 93 96
3.1.5. Sai số trong phép chuẩn độ axit – bazơ
a. Khảo sát sự thay đổi pH trong quá trình
• Đường chuẩn độ: là đường biểu diễn sự biến thiên chuẩn độ
nồng độ của 1 cấu tử nào đó trong phản ứng chuẩn -
Phản ứng chuẩn độ
độ theo lượng dung dịch chuẩn thêm vào (thể tích HCl + NaOH = NaCl + H O 2 hoặc F). N V C V V 0 0 0 0 tđ N C
• VD: phản ứng chuẩn độ - Chưa định phân - aX + bR ⇋ cP + dQ K + V = 0 cb
- pX : bước nhảy chuẩn
+ Chất quyết định pH của dd: HCl đp + pH = -lgC
độ, là khoảng giá trị pX HCl -
Bắt đầu định phân đến trước ĐTĐ ứng với sai số cho phép + 0 < V < V của phép định phân, tđ
+ Chất quyết định pH của dd: HClcòn lại
s = 0,1% (0,2%) hay F = 0,999 (0,998) – 1,001 C V CV
+ pH lg C 0 0 lg (1,002). HCl V V 0 94 97
3.1.5. Sai số trong phép chuẩn độ axit – bazơ
a. Khảo sát sự thay đổi pH trong quá trình - ĐTĐ thuộc pX chuẩn độ đp pX phụ thuộc vào N , N và K - Tại ĐTĐ đp X R cb N , N càng nhỏ pX càng nhỏ và ngược lại + V = Vtđ X R đp
+ Chất quyết định pH của dd: NaCl K càng nhỏ pX càng nhỏ và ngược lại cb đp + pH = 7
- Bước nhảy chuẩn độ càng ngắn phát hiện ĐTĐ - Sau ĐTĐ
càng khó chính xác, CCT càng ít sai số của phép
phân tích càng lớn và ngược lại. + V > Vtđ
+ Chất quyết định pH của dd: NaOH
- Thường chuẩn độ với N , N trong khoảng 0,01 dư X R CV C V 0,1N
+ pH 14 lgC 14 0 0 lg NaOH V V 0 95 98 10 03/13/20
a. Khảo sát sự thay đổi pH trong quá trình
b. Đường chuẩn độ chuẩn độ -
Phản ứng chuẩn độ V
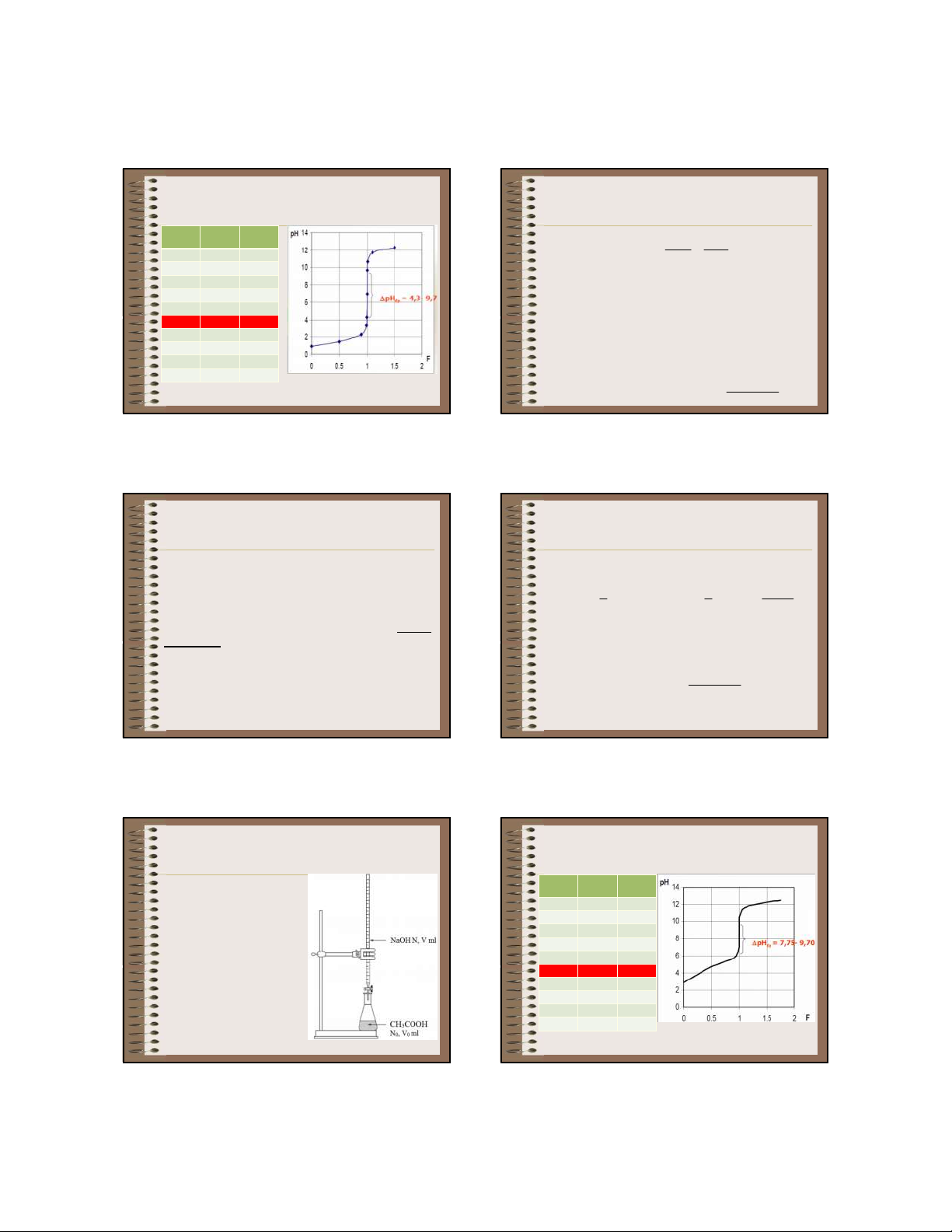
CH COOH + NaOH = CH COONa + H O NaOH pH F 3 3 2 (ml) N V C V V 0 0 0 0 0 1 0 tđ - N C Chưa định phân 50 1,5 0,5 90 2,3 0,9 + V = 0 99 3,3 0,99
+ Chất quyết định pH của dd: CH COOH 3 99,9 4,3 0,999 + pH = ½(pK -lgC ) 100 7 1 a a 100,1 9,7 1,001 -
Bắt đầu định phân đến trước ĐTĐ 101 10,7 1,01 + 0 < V < Vtđ 110 11,7 1,1
+ Chất quyết định pH của dd: CH COOH và 3 còn lại 150 12,3 1,5 CH COONa 3 tạo thành C V CV pH pK 0 0 lg + a CV 99 102
a. Khảo sát sự thay đổi pH trong quá trình
b. Đường chuẩn độ chuẩn độ - pH
phụ thuộc vào C, C : - Tại ĐTĐ đp 0
+ C, C càng nhỏ thì bước nhảy càng ngắn và ngược + V = V 0 tđ lại
+ Chất quyết định pH của dd: CH COONa 3
+ C, C < 10-4M thì không nhận ra được ĐTĐ 1 1 CV 0
+ pH 7 ( pK lg C ) 7 ( pK lg ) a B a c. Chất chỉ thị 2 2 V V 0
- Metyl da cam (pT = 4), metyl đỏ (pT = 5), phenol - Sau ĐTĐ
đỏ (pT = 7), phenolphthalein (pT = 9),… + V > Vtđ
+ Chất quyết định pH của dd: NaOHdư + CV C V
pH 14 lg C 14 0 0 lg NaOH V V 0 100 103
II.2. Chuẩn độ axit-bazơ
b. Đường chuẩn độ 3.2. Các trường hợp chuẩn độ axit-bazơ V pH F NaOH (ml)
3.2.2. Chuẩn độ axit yếu 0 2,88 0 bằng bazơ mạnh và 50 4,75 0,5 ngược lại 90 5,70 0,9 99 6,75 0,99
Giả sử chuẩn độ 100,0 99,9 7,75 0,999 ml dung dịch 100 8,72 1 CH COOH 0,1 N (pK 3 a 100,1 9,70 1,001
= 4,75) bằng dung dịch 101 10,70 1,01 NaOH 0,1N. 110 11,68 1,1 150 12,30 1,5 101 104 11 03/13/20
a. Khảo sát sự thay đổi pH trong quá trình
b. Đường chuẩn độ chuẩn độ - pH
phụ thuộc vào C, C : - Tại ĐTĐ đp 0
+ C, C càng nhỏ thì bước nhảy càng ngắn và ngược + V = V 0 tđ lại
+ Chất quyết định pH của dd: NH Cl 4
+ Ka càng nhỏ thì bước nhảy càng ngắn và ngược lại 1 1 CV + pH
( pK lg C ) ( pK lg ) a A a
+ C, C < 10-4M hoặc K < 10-9 thì không nhận ra 2 2 V V 0 0 a được ĐTĐ - Sau ĐTĐ + pH
> 7 nên chọn CCT có pT > 7 ĐTĐ + V > Vtđ c. Chất chỉ thị
+ Chất quyết định pH của dd: HCldư
- phenolphthalein (pT = 9), … + CV C V
pH lg C 0 0 lg A V V 0 105 108
II.2. Chuẩn độ axit-bazơ
b. Đường chuẩn độ 3.2. Các trường hợp chuẩn độ axit-bazơ V (ml) pH F HCl 0 11,13 0
3.2.3. Chuẩn độ bazơ 50 9,25 0,5
yếu bằng axit mạnh và 90 8,30 0,9 ngược lại 99 7,25 0,99
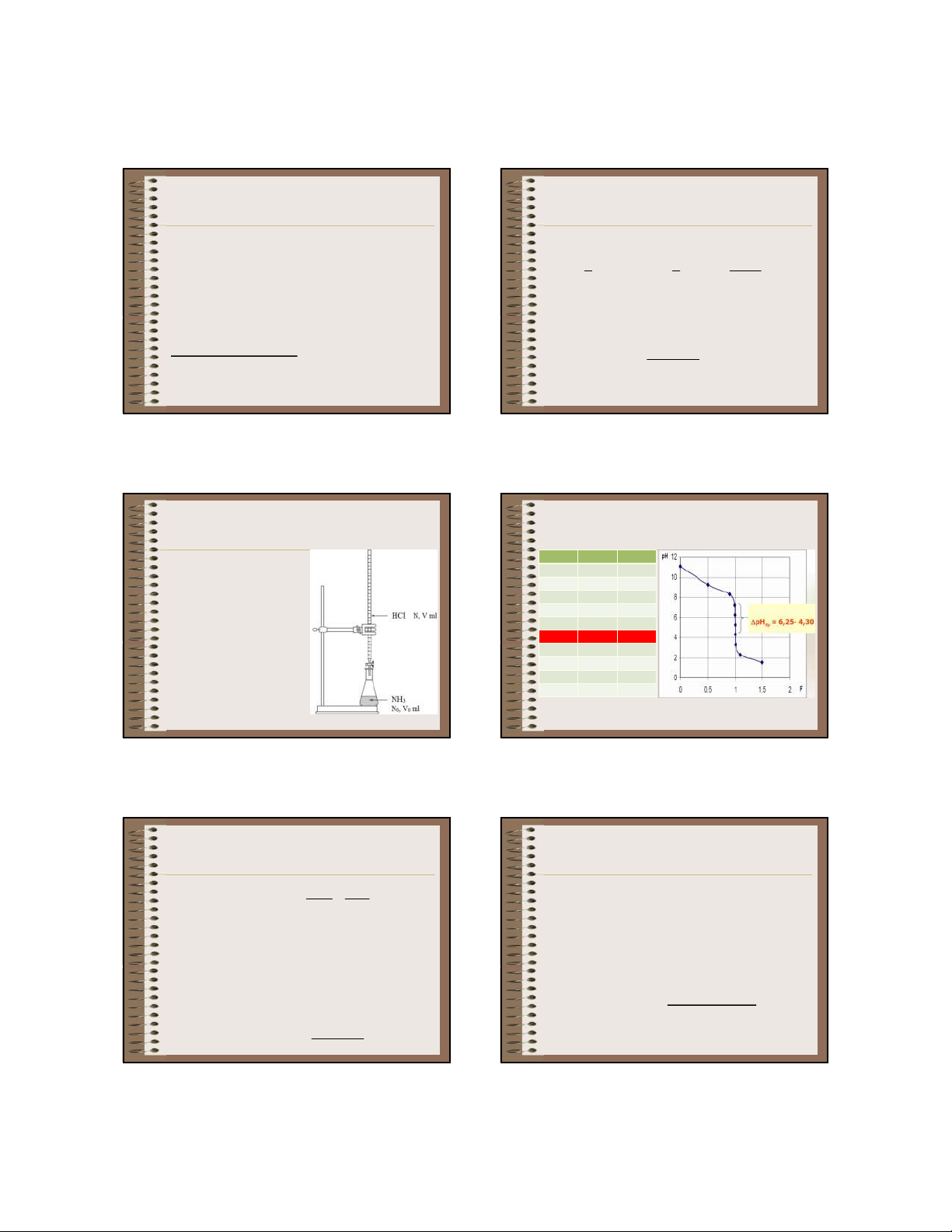
Giả sử chuẩn độ 100,0 99,9 6,25 0,999 ml dung dịch NH OH 100 5,28 1 4 100,1 4,30 1,001 0,1N (pK = 4,75) bằng b 101 3,30 1,01 dung dịch HCl 0,1 N. 110 2,28 1,1 150 1,52 1,5 106 109
a. Khảo sát sự thay đổi pH trong quá trình chuẩn độ
b. Đường chuẩn độ -
Phản ứng chuẩn độ - pH
phụ thuộc vào C, C : đp 0
NH OH + HCl ⇋ NH Cl + H O 4 4 2
+ C, C càng nhỏ thì bước nhảy càng ngắn và ngược N V C V 0 V 0 0 0 0 lại tđ N C - Chưa định phân
+ K càng nhỏ thì bước nhảy càng ngắn và ngược lại b + V = 0
+ C, C < 10-4M hoặc K < 10-9 thì không nhận ra 0 b
+ Chất quyết định pH của dd: NH OH được ĐTĐ 4 + pH = 7+ ½(pK + lgC ) + pH
< 7 nên chọn CCT có pT < 7 a B ĐTĐ -
Bắt đầu định phân đến trước ĐTĐ c. Chất chỉ thị + 0 < V < V
- Metyl da cam (pT = 4), Metyl đỏ (pT = 5), … tđ
+ Chất quyết định pH của dd: NH OH và 4 còn lại NH Cl CV 4 tạo thành pH pK lg a + C V CV 0 0 107 110 12 03/13/20
a. Khảo sát sự thay đổi pH trong quá trình
II.2. Chuẩn độ axit-bazơ chuẩn độ - Tại ĐTĐ1 3.2. Các trường hợp chuẩn độ axit-bazơ + V = Vtđ1
+ Chất quyết định pH của dd: H PO -
3.2.4. Chuẩn độ đa axit 2 4 1 + bằng bazơ mạnh và pH ( pK pK ) 2 a1 a 2 ngược lại -
Sau ĐTĐ1 và trước ĐTĐ2
Giả sử chuẩn độ 100,0 + V < V < V tđ1 tđ2 ml dung dịch H PO 3 4
+ Chất quyết định pH của dd: H PO -/HPO 2- 2 4 4 0,1M (pK = 2,15; pK a1 a2 - Tại ĐTĐ2 = 7,20; pK = 12,38) a3 + V = V bằng dung dịch NaOH tđ2
+ Chất quyết định pH của dd: HPO 2- 0,1 M. 4 1
+ pH ( pK pK ) 2 a2 a 3 111 114
a. Khảo sát sự thay đổi pH trong quá trình
a. Khảo sát sự thay đổi pH trong quá trình chuẩn độ chuẩn độ -
Phản ứng chuẩn độ -
Sau ĐTĐ2 và trước ĐTĐ3 + V < V < V
H PO + NaOH = NaH PO + H O (1) tđ2 tđ3 3 4 2 4 2
+ Chất quyết định pH của dd: HPO 2-/PO 3-
NaH PO + NaOH = Na HPO + H O (2) 4 4 2 4 2 4 2 - Tại ĐTĐ3
Na HPO + NaOH = Na PO + H O (3) 2 4 3 4 2 + V = Vtđ3 N V
+ Chất quyết định pH của dd: PO 3- V 0 0 4 tđ N + 1 1 C V pH 7 ( pK lg C ) 7 ( pK lg 0 0 ) a3 B a3 C V C 2 V C 3 V 2 2 V V0 V 0 0 ;V 0 0 ;V 0 0 tđ1 C tđ 2 C tđ 3 C - Sau ĐTĐ3 + V > Vtđ3
+ Chất quyết định pH của dd: PO 3-, NaOH 4 dư 112 115
a. Khảo sát sự thay đổi pH trong quá trình b. Chất chỉ thị chuẩn độ Thời điểm pH CCT - Chưa định phân ĐTĐ1 4,68
Metyl đỏ (pT = 5); Metyl da cam (pT = 4) + V = 0 ĐTĐ2 9,79 Phenolphthalein
+ Chất quyết định pH của dd: H PO (pT = 9) 3 4 1 + ĐTĐ3 12,39 pH ( pK lg C ) 2 1 a A
- Có 2 bước nhảy chuẩn độ tại ĐTĐ1 và ĐTĐ2; thể -
Bắt đầu định phân đến trước ĐTĐ1
tích NaOH tiêu tốn cho mỗi bước nhảy là như nhau. + 0 < V < Vtđ1
- Điều kiện để có bước nhảy pH khi chuẩn độ ĐTĐ(i)
+ Chất quyết định pH của dd: H PO /H PO - 3 4 2 4
đa axit H A bằng bazơ mạnh: n Ka(i) 4 10 Ka(i )1 và K 10-9. a(i) 113 116 13 03/13/20
a. Khảo sát sự thay đổi pH trong quá trình c. Bài tập chuẩn độ - Chưa định phân
Lấy 20,0 ml dd hỗn hợp HCl+H PO cho vào bình 3 4 nón. + V = 0 -
Thêm vài giọt CCT metyl đỏ rồi chuẩn độ bằng
+ Chất quyết định pH của dd: Na CO 2 3 1
NaOH 0,1 N đến khi dd chuyển từ hồng nhạt
+pH 7 ( pK lg C ) 1 a B
sang vàng thì tiêu tốn hết 25,2 ml NaOH. 2 -
Thêm vài giọt CCT phenolphthalein vào dung -
Bắt đầu định phân đến trước ĐTĐ1
dịch trên rồi chuẩn độ tiếp tục đến lúc dung dịch + 0 < V < V
chuyển vàng sang hồng nhạt thì tiêu tốn hết 10,2 tđ1
+ Chất quyết định pH của dd: HCO -/CO 2- ml NaOH. 3 3
a. Viết các phản ứng xảy ra trong quá trình chuẩn độ.
b. Tính nồng độ mol của HCl và H PO trong hỗn hợp 3 4 phân tích. 117 120
a. Khảo sát sự thay đổi pH trong quá trình
II.2. Chuẩn độ axit-bazơ chuẩn độ - Tại ĐTĐ1 3.2. Các trường hợp chuẩn độ axit-bazơ + V = Vtđ1
+ Chất quyết định pH của dd: HCO -
3.2.5. Chuẩn độ đa bazơ 3 1
+ pH ( pK pK ) bằng axit mạnh và 2 a1 a 2 ngược lại -
Sau ĐTĐ1 và trước ĐTĐ2
Giả sử chuẩn độ 100,0 + V < V < V tđ1 tđ2 ml dung dịch Na CO 2 3
+ Chất quyết định pH của dd: H CO /HCO - 2 3 3 0,1M (H CO có pK = 2 3 a1 - Tại ĐTĐ2 6,35; pK = 10,33) bằng a2 + V = Vtđ2 dung dịch HCl 0,1 M.
+ Chất quyết định pH của dd: H CO 2 3 1 1 C V
+ pH ( pK lg C ) ( pK lg 0 0 ) 2 a1 A 2 1 a V V0 118 121
a. Khảo sát sự thay đổi pH trong quá trình - Sau ĐTĐ3 chuẩn độ + V > V -
Phản ứng chuẩn độ tđ2
+ Chất quyết định pH của dd: H CO , HCl
Na CO + HCl = NaHCO + NaCl (1) 2 3 dư 2 3 3 b. Chất chỉ thị
NaHCO + HCl = H CO + NaCl (2) 3 2 3 Thời điểm pH CCT N V V 0 0 ĐTĐ1 8,34 Phenolphthalein (pT = 9) tđ N ĐTĐ2 3,91 Metyl da cam (pT = 4) C V C 2 V V 0 0 ;V 0 0 tđ1 C tđ 2 C
Có 2 bước nhảy chuẩn độ tại ĐTĐ1 và ĐTĐ2; thể pK = 14 – pK = 3,67
tích HCl tiêu tốn cho mỗi bước nhảy là như nhau. b1 a2 pK = 14 – pK = 7,65 b2 a1 119 122 14 03/13/20 c. Bài tập
Lấy 20,0 ml dd hỗn hợp NaOH+Na CO cho vào 2 3 bình nón. -
Thêm vài giọt CCT phenolphthalein rồi chuẩn độ
bằng HCl 0,1 N đến khi dd mất màu hồng thì tiêu tốn hết 32,5 ml HCl. -
Thêm vài giọt CCT metyl da cam vào dung dịch
trên rồi chuẩn độ tiếp tục đến lúc dung dịch
chuyển vàng sang da cam thì tiêu tốn hết 10,3 ml HCl.
a. Viết các phản ứng xảy ra trong quá trình chuẩn độ.
b. Tính nồng độ mol của NaOH và Na CO trong hỗn 2 3 hợp phân tích. 123 15



