












Preview text:
Phần thứ nhất
Nhiệt động lực học kỹ thuật Chương 1
Những khái niệm cơ bản,
phương trình trạng thái của chất khí
Các nội dung trọng tâm của Chương 1
1. Hiểu được các khái niệm, định nghĩa về Hệ cô lập, hệ
không cô lập, hệ kín, hệ hở, hệ đoạn nhiệt; chất môi giới;
nhiệt độ, áp suất, thể tích riêng, nội năng, enthalpy,
entropy, khí lý tưởng và khí thực. Lưu ý cách đổi đơn vị
đo các thông số trạng thái của hệ nhiệt động.
2. Phương trình trạng thái khí lý tưởng (Clapeyron),
phương trình trạng thái khí thực.
3. Phân tích bài toán đưa về phương trình trạng thái khí lý
1.1. Những khái niệm cơ bản
1.1.1. Đối tượng và phương pháp
nghiên cứu của nhiệt động học kỹ thuật
Nhiệt động học nghiên cứu những quy luật về biến
đổi năng lượng mà chủ yếu là nhiệt năng và cơ năng
nhằm tìm ra các biện pháp biến đổi có lợi nhất giữa nhiệt năng và cơ năng.
Phương pháp nghiên cứu: Nhiệt động học được
nghiên cứu bằng phương pháp giải tích, thực nghiệm hoặc kết hợp cả hai.
• Phương pháp giải tích: Ứng dụng các định luật vật lý
kết hợp với các biến đổi toán học để tìm ra công thức
thể hiện quy luật của các hiện tượng, các quá trình nhiệt động.
• Phương pháp thực nghiệm: Tiến hành các thí nghiệm
để xác định giá trị các thông số thực nghiệm, từ đó tìm
ra các quy luật và công thức thực nghiệm.
1.1.2. Hệ thống nhiệt động học
Hệ thống nhiệt động học thực hiện việc chuyển tải nhiệt từ
vùng này đến vùng khác hoặc biến đổi nhiệt thành công.
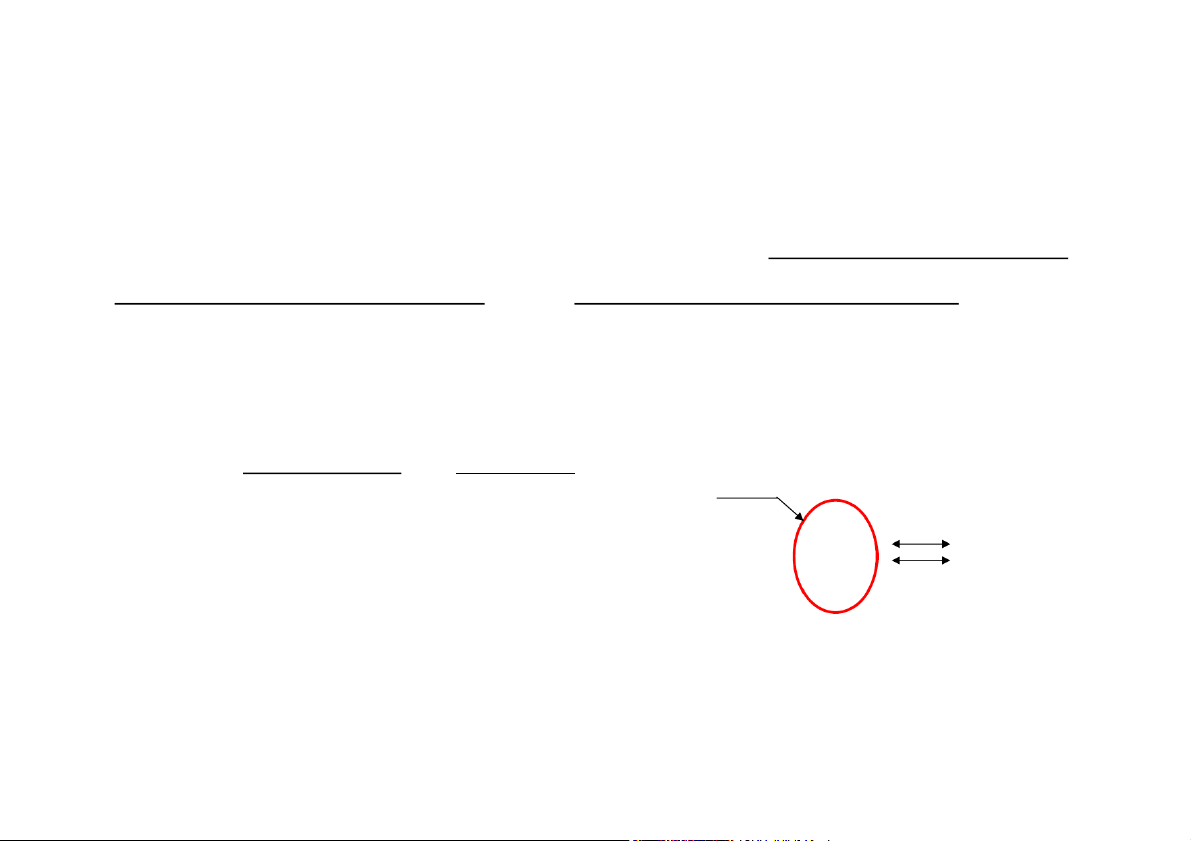
Hệ thống nhiệt động học: Là tập
hợp các vật thể có liên quan với
nhau về nhiệt năng và cơ năng. Biên giới
Môi trường xung quanh: Là tập
hợp các vật thể không nằm trong Hệ Môi trường Năng lượng thống xung quanh Vật chất
hệ thống nhiệt động học.
Biên giới: Là bề mặt ngăn cách
giữa hệ thống nhiệt động học và môi trường xung quanh.
* Phân loại hệ thống nhiệt động học:
Hệ cô lập là hệ thống nhiệt động (thường gọi tắt là hệ) không
trao đổi vật chất, nhiệt lượng và công với môi trường xung quanh.
Hệ không cô lập là hệ có khả năng trao đổi vật chất, nhiệt
lượng và công với môi trường xung quanh.
Hệ kín là hệ không trao đổi vật chất với môi trường xung quanh.
Hệ hở là hệ có trao đổi vật chất với môi trường xung quanh.
Hệ đoạn nhiệt là hệ không trao đổi nhiệt lượng với môi trường xung quanh.
1.1.3. Chất môi giới
Chất môi giới (còn gọi là môi chất hay chất công tác) là chất
trung gian dùng để thực hiện việc truyền tải nhiệt và chuyển
hoá nhiệt năng thành cơ năng hoặc ngược lại trong các thiết bị nhiệt.
Trong thực tế, môi chất thường ở thể lỏng, thể hơi hoặc thể khí
vì chúng dễ dàng nén, ép và có khả năng thay đổi thể tích lớn,
thuận lợi cho việc trao đổi công.
1.1.4. Các thông số trạng thái của một hệ nhiệt động
Trạng thái của vật chất trong một hệ nhiệt động là tâp hợp
các đại lượng đặc trưng cho tính chất cơ, lý của vật chất.
Trong nhiệt động kỹ thuật, thường dùng các thông số trạng thái sau đây:
Nhiệt độ tuyệt đối: T [K].
Áp suất tuyệt đối: p [Pa] hoặc [N/m2].
Thể tích riêng: v [m3/kg].
Nội năng riêng: u [J/kg].
Enthalpy riêng: h hoặc i [J/kg].
Entropy riêng: s [J/kg.độ].
• T, p, v có thể đo trực tiếp trên vật nên được gọi là thông số trạng thái.
• u, i, s không thể đo trược tiếp trên vật mà phải tính toán thông qua các thông số trạng
* Nhiệt độ tuyệt đối:
Nhiệt độ là một thông số trạng thái đặc trưng cho mức độ nóng
lạnh của vật chất, biểu thị giá trị động năng trung bình của các phân tử vật chất. m 2 T [K] k 3 Trong đó:
T : nhiệt độ tuyệt đối của vật [K],
m : khối lượng phân tử của vật [kg],
: vận tốc trung bình chuyển động tịnh tiến của các phân tử [m/s],
k : hằng số Bozman, k = 1,3805.10-23 [j/K].
Trong hệ thống SI thường dùng hai thang đo nhiệt độ:
Thang nhiệt độ bách phân: Nhiệt độ ký hiệu bằng chữ t, đơn vị
đo là độ Celcius [0C].
Thang nhiệt độ tuyệt đối: Nhiệt độ ký hiệu bằng chữ T, đơn vị
đo là độ Kelvin [K]. T [K] = t [0C] + 273,15
Ngoài ra, một số nước như Anh, Mỹ còn dùng thang nhiệt độ
Fahrenheit, đơn vị đo là 0F và thang nhiệt độ Renkine, đơn vị đo là 0R.
t [0C] = T [K] - 273,15 = 5/9(t [0F] - 32) = 5/9(t [0R]) - 273,15
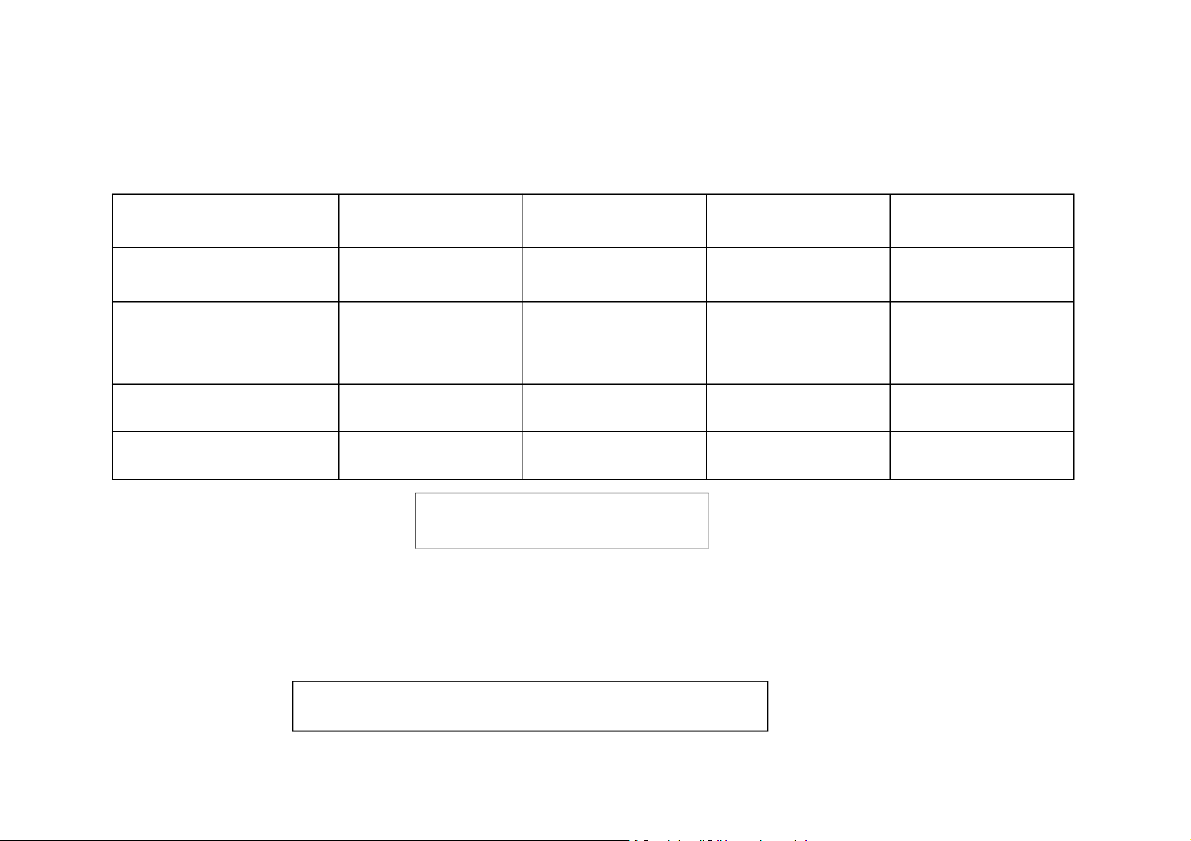
Bảng quy đổi các thang nhiệt độ thông dụng
Thang nhiệt độ Thang nhiệt độ Thang nhiệt độ Kelvin [K] Celcius [0C] Fahrenheit [0F]` Thang nhiệt độ t 32 T
T = t + 273,15 T F 273 1 , 5 Kelvin [K] 8 , 1 Thang nhiệt độ t 32 t = T - 273,15 t t F Celcius [0C] 8 , 1 Thang nhiệt độ t = 1,8(T - F t = 1,8t + 32 t 0 F F Fahrenheit [ F] 273,15) + 32
* Mỗi K trong thang đo (độ chia/nhiệt giai) Kelvin (1K) bằng một độ
trong thang đo Celsius (10C)
* Áp suất tuyệt đối:
Áp suất là lực tác dụng của môi chất theo phương vuông góc
lên một đơn vị diện tích của bề mặt tiếp xúc. F p [N/m2] S Trong đó:
p : áp suất tuyệt đối [N/m2] hoặc [Pa],
F : lực tác dụng của môi chất [N],
S : diện tích của bề mặt tiếp xúc [m2]
Đơn vị tiêu chuẩn đo áp suất là Pascal, ký hiệu là Pa 1Pa = 1N/m2, 1KPa = 103Pa, 1MPa = 106Pa.
Hiện nay trong các thiết bị kỹ thuật người ta còn dùng đơn vị đo khác như:
• Atmôtphe kỹ thuật [at] hay [kG/cm2] (1at = 1kG/cm2); • Bar [bar];
• Milimet cột nước [mmH O] 2 ;
• Milimet thuỷ ngân [mmHg]
Quan hệ giữa chúng như sau: 2 5 1 5 1 1 P 1 a N
1 / m 10 bar 10 at mmH O mmHg 9 , 0 81 8 , 9 1 2 133 3 , 2
Bảng quy đổi các thang áp suất thông dụng: Pa at mmH O mmHg 2 Pa 1 1,01937.10-5 1,01937 7,5024.10-3 At [kgf/cm2], 0,981.105 1 104 735,559 kG/cm2] mmH O 9,81 10-4 1 735,559.10-4 2 mmHg 133,322 1,35951.10-3 13,5951 1 1 psi = 0,069 bar
Khi đo áp suất bằng chiều cao cột thuỷ ngân với độ chính xác cao cần
phải quy về điều kiện nhiệt độ 00C vì có sự thay đổi thể tích thuỷ ngân
theo nhiệt độ. Công thức quy đổi như sau:
h(00C) = h(t).(1-0,000172.t) Với
h(00C): chiều cao cột thuỷ ngân ở 00C.
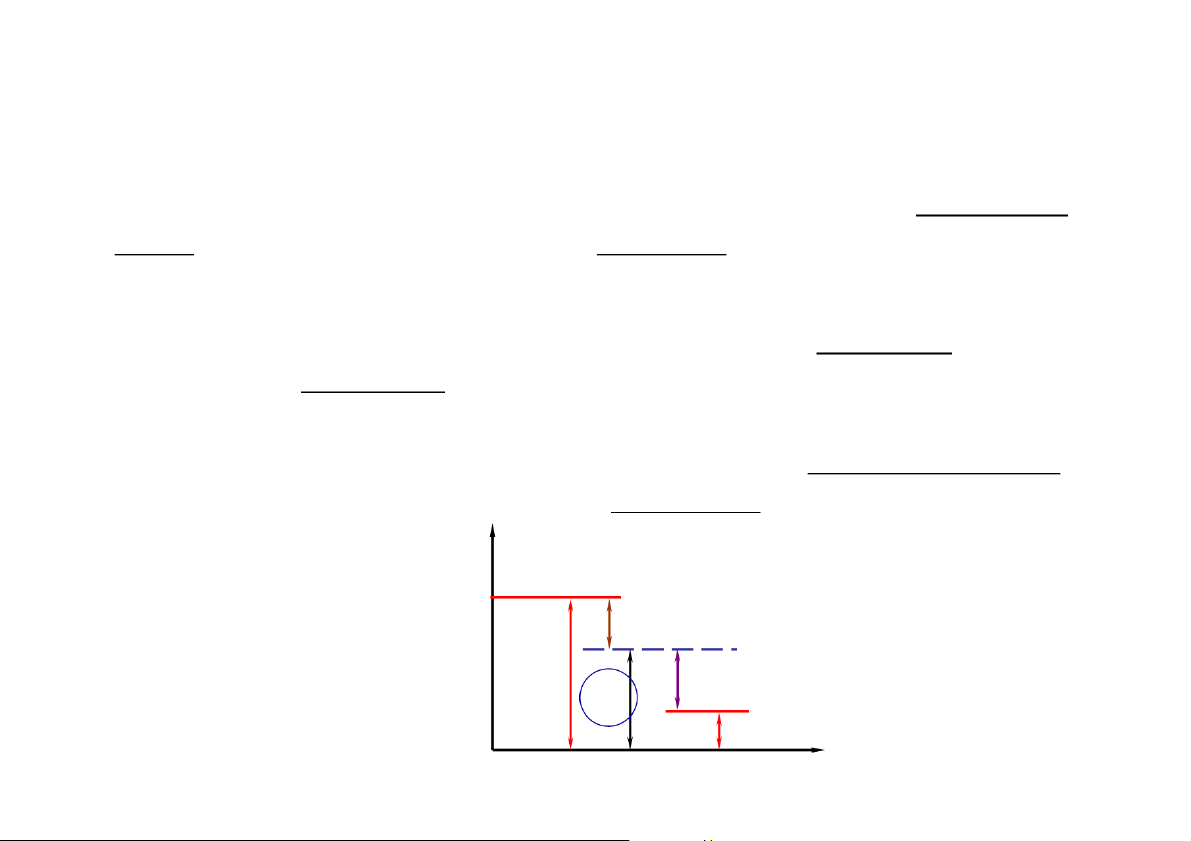
Quan hệ giữa các loại áp suất
Áp suất của không khí ngoài trời (ở trên mặt đất) gọi là áp suất khí
quyển, ký hiệu là p , đo bằng barometer. k hoặc B
Một chất khí chứa trong bình kín có áp suất tuyệt đối là p.
• Nếu áp suất p > pk thì hiệu giữa chúng được gọi là áp suất dư, ký hiệu
là pd, đo bằng manometer. pd = p - pk
• Nếu áp suất p < pk thì hiệu giữa chúng được gọi là áp suất chân không,
ký hiệu là pck, đo bằng chân không kế vacuumeter. pck = pk - p p p>pk pd p pck p p
k k p v
* Thể tích riêng:
Thể tích riêng là thể tích được chiếm bởi 1 đơn vị khối lượng của vật: V v [m3/kg] G Trong đó:
V là thể tích của vật, [m3].
G là khối lượng của vật, [kg]. Khối lượng riêng: G [kg/m3] V * Nội năng:
Nội năng của một vật là toàn bộ năng lượng bên trong vật đó,
gồm nội nhiệt năng, hoá năng và năng lượng nguyên tử.
Trong nhiệt động học, nội năng là nội nhiệt năng.
Nội năng bao gồm hai thành phần: Nội động năng và nội thế
năng, đơn vị đo nội năng là Joule [J]. U = Uđ + Ut [J].
Nội năng phụ thuộc vào nhiệt độ T và thể tích v: U = f(T, v)
Đối với khí lý tưởng: U = f(T) (vì lực tương tác giữa các phân tử bằng không)
Trong mọi quá trình, nội năng được xác định bằng: du = c dT hoặc v u = cv(T ) 2 - T1
cv : nhiệt dung riêng đẳng tích.
Ở một số quốc gia dùng các đơn vị đo khác như: KCal; KWh; Btu, …
Quan hệ giữa các đơn vị đó là:
1kJ = 0,239 kCal = 277,78.10-6 kWh = 0,948 Btu
Trong các quá trình nhiệt động, ta chỉ cần biết biến thiên nội năng mà
không cần biết giá trị tuyệt đối của nội năng, do đó có thể chọn điểm gốc
tuỳ ý mà tại đó nội năng bằng không.
Theo qui ước, đối với nước ta chọn u = 0 tại điểm có nhiệt độ t = 0,010C
và áp suất p = 0,0062 at (điểm 3 thể của nước). * Enthalpy:
Enthalpy là năng lượng toàn phần của vật chất, bằng tổng nội
năng U và ngoại năng W của vật, được ký hiệu là E, đơn vị đo enthalpy là Joule [J]: E = (U + U ) + (W + W đ t đ t) [J].
Wđ thay đổi không đáng kể. Wt = pV Do đó: E = U + pV [J].
Đối với Gkg, enthalpy thường được ký hiệu là I (hoặc H); đối
với 1kg, enthalpy được ký hiệu là i hoặc h (nhiệt lượng riêng),
và được định nghĩa bằng biểu thức:
I = G.i = G.(u + pv) = U + pV; [J] i = u + pv; [J/kg]




