





Preview text:
CHỮA BÀI TẬP CÂN BẰNG ACID – BASE Bài 12:
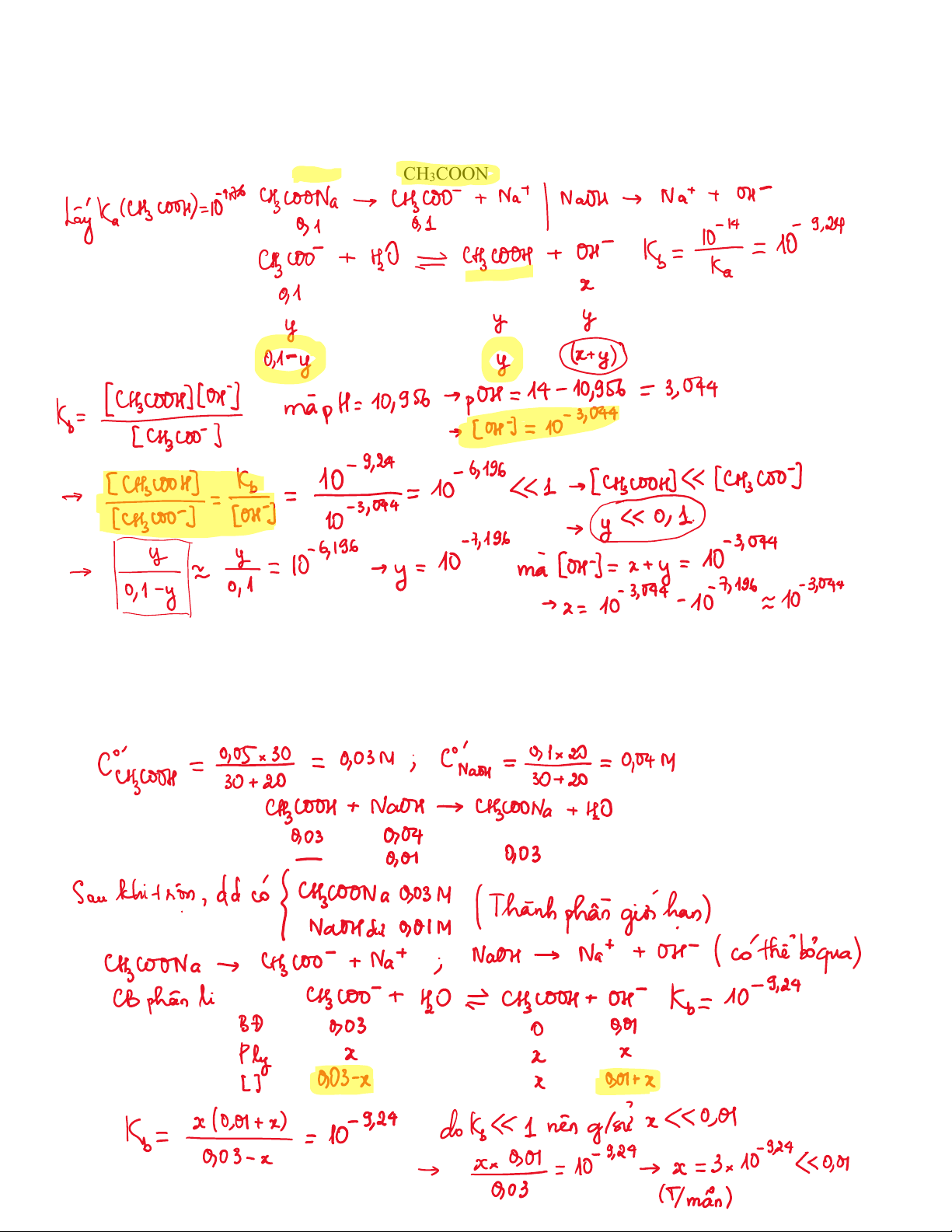
1. Cho dung dịch gồm hỗn hợp NaOH x M và CH3COONa 0,1M có pH = 10,956. Tính giá trị x.
2. Trộn 300 ml dung dịch có chứa NaOH 0,1M và Ba(OH)2 0,025M với 200 ml dung dịch H2SO4 x(M) thu
được m (g) kết tủa và 500 ml dung dịch có pH = 2. Tính m và x.
Bài 13: Tính pH của dung dịch thu được khi:
a) trộn 30 mL dung dịch CH3COOH 0,05M với 20 mL dung dịch NaOH 0,1M.
b) trộn 20 mL dung dịch CH3COOH 0,1M với 30 mL dung dịch NaOH 0,05M.
c) trộn 20 mL dung dịch CH3COOH 0,1M với 20 mL dung dịch NH3 0,1M.
DUNG DỊCH CHỨA 3 THÀNH PHẦN LÀ CH +
3COO-; NH4 ; H2O ĐỀU CÓ CÂN BẰNG PHÂN LI H+, OH-
NÊN PHẢI DÙNG BẢO TOÀN PROTON XÉT DUNG DỊCH CH3COONH4
d) hòa tan 0,73 gam HCl vào 10m3 nước.
e) trộn 50 mL dung dịch NH3 2.10-4M với 50 mL dung dịch HCl 2.10-4M Cho pK +
a của các chất là CH3COOH=4,76; HCOOH=3,75; NH4 =9,24
4. Tính pH của hệ đệm hoặc chất lưỡng tính
Bài 14: Xác định giá trị pH trong các dung dịch sau
a) dung dịch CH3COONH4 0,01M; b) dung dịch NaHCO3 0,05M c) dung dịch NH4HCO3 0,1M d) dung dịch NaH2PO4 0,1M e) Na2HPO4 0,1M.
biết pKa của H2CO3 lần lượt là 6,35 và 10,33; pKa của H3PO4 lần lượt là 2,23; 7,26 và 12,32.
Bài 15: Tính pH của dung dịch thu được khi trộn 25ml dung dịch axit axetic có pH = 3,0
với 15ml dung dịch KOH có pH = 11,0. Biết pKa của CH3COOH = 4,76.
Bài 16: Độ điện ly của dung dịch CH3COOH là 4,08%. Tính khối lượng của
CH3COONa cần cho vào 1 lít dd CH3COOH trên để độ điện ly của CH3COOH thay đổi
50% so với ban đầu, cho pKa = 4,76.
Bài 17: Một dung dịch đơn acid yếu HA nồng độ 0,1 mol/L có pH = 2,38.
a) Hãy tính giá trị Ka của HA.
b) Cần thêm bao nhiêu gam muối NaA (giả sử MNaA=67,8 g/mol) vào 100 mL dung dịch
HA nồng độ 0,1 mol/L để thu được dung dịch có pH = 4,0?
c) Trộn 10 mL dung dịch HA nồng độ 0,1 mol/L với V mL dung dịch NaOH 0,1M (dư) thu
được (10+V) mL dung dịch có pH = 11,7. Tính giá trị V.
Bài 18: Tính pH của dung dịch thu được khi trộn 10ml dung dịch axit axetic có pH
= 3,0 trộn với 10ml dung dịch axit fomic (HCOOH) có pH = 3,0. Biết pKa của
CH3COOH và HCOOH lần lượt là 4,76 và 3,75
Sau khi trộn: Co’CH3COOH = 0,02925M ; Co’HCOOH = 3,31.10-3M



