
















Preview text:
BoYte-Hoaphantich Page1 of225 BỘ Y TẾ HÓA PHÂN TÍCH TẬP 1
(DÙNG CHO ĐÀO TẠO DƯỢC SĨ ĐẠI HỌC) MÃSỐ:Đ.20.Y.14 NHÀ XUẤT BẢN GIÁO DỤC HÀ NỘI 2007 Chỉ đạo biên soạn :
VỤKHOAHỌCVÀĐÀOTẠOBỘYTẾ Chủ biên :
PGS.TS.VÕTHỊBẠCHHUỆ
Những người biên soạn :
PGS.TS.VÕTHỊBẠCHHUỆ
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page2 of225
ThS.PHÙNGTHẾĐỒNG
ThS.TRẦNTHỊTRÚCTHANH ThS.PHANTHANHDŨNG
ThS.NGUYỄNHỮULẠCTHUỶ
Tham gia tổ chức bản thảo : ThS.PHÍVĂNTHÂM
TS.NGUYỄNMẠNHPHA
Bản quyền thuộc Bộ Y tế (Vụ Khoa học và Đào tạo)
874 - 2007/CXB/ 5 - 1918/GD Mã số : 7K725 M7- DAI Lời giới thiệu
Thực hiện một số điều của Luật Giáo dục, Bộ Giáo dục & Đào tạo và Bộ Y tế đã ban hành
chương trình khung đào tạo Dư
. Bộ Y tế tổ chức biên ợc sĩ đại học
soạn tài liệu dạy - học các môn cơ
sở và chuyên môn theo chương trình trên nhằm từng bước xây dựng bộ sách đạt chuẩn chuyên môn
trong công tác đào tạo nhân lực y tế.
Sách HOÁ PHÂN TÍCH được biên soạn dựa trên chương trình giáo dục của Trường Đại học Y
Dược Thành phố Hồ Chí Minh trên cơ sở chương trình khung đã được phê duyệt. Sách được các tác
giả PGS.TS. Võ Thị Bạch Huệ, ThS. Phùng Thế Đồng, ThS. Trần Thị Trúc Thanh, ThS. Phan Thanh
Dũng, ThS. Nguyễn Hữu Lạc Thủy biên soạn theo phương châm : Kiến thức cơ bản, hệ thống ; nội
dung chính xác, khoa học ; cập nhật các tiến bộ khoa học, kỹ thuật hiện đại và thực tiễn ở Việt Nam.
Sách HOÁ PHÂN TÍCH đã được Hội đồng chuyên môn thẩm định sách và tài liệu dạy - học
chuyên ngành Dược sĩ đại học của Bộ Y tế thẩm định năm 2007. Bộ Y tế quyết định ban hành là tài
liệu dạy - học đạt chuẩn chuyên môn của ngành trong giai đoạn hiện nay. Trong thời gian từ 3 đến 5
năm, sách phải được chỉnh lý, bổ sung và cập nhật.
Bộ Y tế xin chân thành cảm ơn các tác giả và Hội đồng chuyên môn thẩm định đã giúp hoàn
thành cuốn sách ; Cảm ơn GS.TS. Từ Vọng Nghi, PGS.TS. Trần Tử An đã đọc và phản biện để cuốn
sách sớm hoàn thành kịp thời phục vụ cho công tác đào tạo nhân lực y tế.
Lần đầu xuất bản, chúng tôi mong nhận được ý kiến đóng góp của đồng nghiệp, các bạn sinh
viên và các độc giả để lần xuất bản sau sách được hoàn thiện hơn.
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page3 of225
VỤKHOAHỌCVÀĐÀOTẠO-BỘYTẾ LỜI NÓI ĐẦU
HOÁPHÂNTÍCHlàmộtmônhọcdànhchocáchọcviênthuộcngànhHoá.ỞkhoaDượccủa
TrườngĐạihọcYDượcThànhphốHồChíMinh,mônnàyđượcgiảngdạycho:
-sinhviênDượcnămthứ3(hệchínhquy5năm)
-sinhviênDượcnămthứ2(hệtậptrung4năm)
nhằmtrangbịcáckiếnthứccơbảnvềhoáhọcphântíchđểtừđósinhviênDượchiểurõhơ ncác
mônBàochế,Dượcliệu,Hoádược,Dượclực,Kiểmnghiệmthuốclàcácmônnghiệpvụsẽđược
họctậpởcácnămkếtiếp.
Hoáphântíchcũnglàmộttrongnhữngmônhọcnhằmcungcấpcáckiếnthứcnềntảngrấtquan
trọngđểsaukhitốtnghiệp,dùlàmviệcởbấtkỳcácvịtrínàothìDượcsĩcũngxácđịnhđượcnhiệm
vụcủamìnhlàtrựctiếphaygiántiếpgópphầnlàmchothuốcphảiđúngvềchấtlượngvàđủvềsố
lượngkhitớitayngườisửdụng.
Vớimụcđíchtrên,bộmônHoáPhântích–KiểmnghiệmđãbiênsoạnsáchHoáphântích,tập
1,chosinhviênngànhDượctheochỉđạocủaBộYtếvàBộgiáodục–đàotạo.
NộidungsáchHoáphântích,tập1,gồmcácphầnsau:
Phần I:làphầnđạicươnggồmcácchươngtổngquátđềcậpđến:
-Đốitượng,chứcnăngvàphânloạicủahoáhọcphântích.
-Cácloạiphảnứnghoáhọc,kháiniệmvàcácyếutốảnhhưởngđếncânbằnghoáhọc,hằngsố
cânbằngvàđịnhnghĩavềhoạtđộ,nồngđộ.
- Các khái niệm về sai số và ứng dụng toán thống kê để xử lýcác kếtquả thu được từ thực
nghiệmnhằmđảmbảođộchínhxáctheoyêucầucủangànhDược.
Phần II:làphầnđịnhlượnggồmcácchươngviếtvề:
- Cáchbiểu thịvà tínhtoánnồng độdung dịchcủamộtchấtđược sửdụngthườngxuyên khi phântích.
-Nguyêntắcvàcáchthểhiệncácbướcđểtiếnhànhphântíchkhốilượng.
-Nguyêntắc,phânloại,giảithíchcáckháiniệm,cơchếcũngnhưcácứngdụngcủacácphương
phápphântíchthểtích:acid–base;oxyhoá–khử;kếttủavàtạophứcchủyếusửdụngtrongngành Dược.
Cáccánbộgiảngcủabộmônđãcốgắngcậpnhậthoákiếnthứcđểbiênsoạnvàvẫnluônmong
giáotrìnhsẽmanglạichohọcviênkiếnthứcbổích,chínhxác.
Chúngtôikínhmongquýthầycô,quýđồngnghiệp,quýđộcgiảvàcácsinhviênđọckỹvànêu
nhữngýkiếnđónggóp,chỉgiúpcácthiếusótđểchúngtôihoànthiệnhơntàiliệugiảngdạynày.
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page4 of225
Chânthànhcảmơnvàmongnhậnđượcnhữngýkiếnđónggópquýbáucủaquývị. Chủ biên
PGS.TS.VÕTHỊBẠCHHUỆ Phần I ĐẠI CƯƠNG Chương 1
ĐẠI CƯƠNG HOÁ PHÂN TÍCH MỤC TIÊU
Trình bày được đối tượng, chức năng và phân loại của hoá học phân tích.
Nêu được nội dung của hoá học phân tích.
Giải thích được các bước thực hiện của quy trình phân tích. NỘI DUNG 1. MỞ ĐẦU
Hoáphântíchlàkhoahọcvềcácphươngphápxácđịnhthànhphầnhoáhọccủachấtvàcấutrúc
củacáchợpphầncótrongchấtphântích.
CácphươngphápcủaHoáphântíchchophépxácđịnhđịnhtínhmộtchất,nghĩalàcóthểxác
địnhxemchấtphântíchđượccấutạobởinhữngnguyêntốnào,nhómchứ cnào,vàphântíchxem
cácnguyêntốvàcácnhómchứcđóđượcsắpxếpvàliênkếtvớinhaunhưthếnào(phântíchcấu trúc).
Hoáphântíchnghiêncứucácphươngphápphântíchđịnhlượng,dùngcácphươngphápđóđể
xácđịnhthànhphầnđịnhlượngcủacácnguyêntố,cáchợpchấthoáhọctrongchấtphântích.
NóivềHoáphântích,ngườitachorằngđâylàkhoahọcvềcácphươngphápvàphươngtiệncủa
phântíchhoáhọcvàtrongmứcđộnhấtđịnhxácđịnhcấutrúchoáhọc.Vềphươngtiệncóthểhiểu
đólà:dụngcụ,thuốcthử,chấtchuẩn,...Phươngphápvàphươngtiệncủaphântíchthayđổithường
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page5 of225
đưaranhững hướngmới,sửdụngnhữngnguyêntắcmới,cảnhữnghiệntượngtừ nhữnglĩnh
vựccótừxaxưa.Thídụ,trongthựcnghiệmphântíchhoáhọchiệnnayphươngphápvậtlýgiữvai
tròquantrọngđólà–phươngphápquangphổvàvậtlýhạtnhân.
Cầnphânbiệtkháiniệm"hoáhọcphântích"và"phântíchhoáhọc".Hoáphântíchlàkhoahọc
vềcácphươngphápphântích,cònphântíchhoáhọclànhữngphươngphápđượcdùngtrongthựctế
đểxácđịnhthànhphầnhoáhọccủachấtphântích.
Ngườitacònphânbiệtkháiniệm“kỹthuậtphântích”và“phươngphápphântích”.
Kỹthuậtphântíchlàdựatrêncáchiệntượngkhoahọcđểthuthậpthôngtinvềthànhphầnhoá
họccủachấtphântích.Thídụnhưkỹthuậtsắckýlỏnghiệunăngcao,kỹthuậtcựcphổ.
Phươngphápphântíchlàứngdụngcụthểcủamộtkỹthuậtphântíchđểgiảiquyếtmộtvấnđề
phântích.Phươngphápcủaphântíchđólàphươngcách(cách)xácđịnh,luậnchứngrõràng,đánh
giátoàndiệncócăncứđểxácđịnhthànhphầncủađốitượngphântích.Thídụphươngphápphân
tíchvitaminCbằngkỹthuậtcựcphổ,phươngphápxácđịnhphenoltrongnướcsôngdùngkỹthuật sắcký.
2. CHỨC NĂNG CỦA HOÁ PHÂN TÍCH HIỆN ĐẠI
Cóthểchiaralàm3chứcnăng(lĩnhvựckhoahọc):
2.1. Giải quyết các vấn đề chung của phân tích
Thídụ:pháttriểnvàhoànthiệnnhữngluậnthuyếtvềcácphươngphápphântích.
2.2. Nghiên cứu các phương pháp phân tích
2.3. Giải quyết các nhiệm vụ cụ thể của phân tích
Thídụ:sựthànhlậpchuyênngànhHoáphântíchvềthuốcphòngchốngdịchbệnh.
Cấutrúcsâucủamônhọcnàycóthểchiaraphântíchđịnhtínhvàphântíchđịnhlượng.Phân
tíchđịnhtính giảiquyếtvấn đềlàcáchợp phầnnàocótrongđối tượngphântích,phântíchđịnh
lượngchobiếtvềhàmlượngcủatấtcảhaycủatừnghợpphần. 3. PHÂN LOẠI
3.1. Phân loại theo đường lối phân tích
-Tổngthể-Cụcbộ
-Trựctiếp-Giántiếp
-Phânhủy-Khôngphânhủy
-Giánđoạn-Liêntục
3.2. Phân loại dựa theo thể tích và khối lượng chất phân tích
-Phântíchthô:lượngmẫuthửchấtrắn0,1-1g,lượngmẫuthửdungdịchtừ1-100ml.
-Phântíchbánvilượng:lượngmẫuthửtừ0.01-0,1g,dungdịchtừ0,1-0,3ml.
-Phântíchvilượng:lượngmẫuthửtừ10-3-10-2g,dungdịchtừ10-2-10-1ml.
-Phântíchsiêuvilượng:lượngmẫuthửtừ10-6-10-12g,dungdịchtừ10-3 -6 -10 ml.
3.3. Phân loại dựa trên bản chất của các hợp phần của chất cần xác định
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page6 of225
- Phân tích đồng vị:chuyênngànhtrongphântíchítsửdụng,nhưngphântíchnàythườngdùng
trongvậtlý,mỏ,sinhhọc.Thídụnhư:xácđịnhnướcdeuteriumtrongnướcthường,cũngnhưcủa
oxy"nặng"(đồngvịoxy18)tronghỗnhợpvớisựđồngvịphổbiếnoxy16.Phântíchđồngvịcần
thiếtkhinghiêncứucácnguyêntốnhântạo.
- Phân tích nguyên tố (nguyên tử - ion):phântíchnhững nguyêntốnàocótrongđốitượng
nghiêncứu,hàmlượnglàbaonhiêu.
- Phân tích phân tử:đâylàsựpháthiệnvàxácđịnhhợpchấthoáhọcđượcđặctrưngbằngkhối
lượngphântửxácđịnh.Thídụ:phântíchhỗnhợpkhí,xácđịnhtrongkhôngkhínhữngthànhphần
chính(N ,O ,CO ,O ,khítrơ).Mộttrongnhữngphươngphápphântíchphântửngườitasửdụ 2 2 2 3 ng phươngpháp sắcký.
-Phân tích nhóm chức:Đốivớiphântíchhoáhữucơcòncómộtdạngphântíchởgiữaphân
tíchnguyêntốvàphântử-đólàphântíchnhómchức.Phântíchnàytrướchếtxácđịnhnhómchức,
nghĩalàxácđịnhtừngnhómhữucơriêngbiệtnhưnhómcarboxyl,hydroxyl,amin,...
- Phân tích chất:Trong phântíchchấtngười taxácđịnh trongdạngnàocómặt hợpphầnta
quantâmtrongđốitượngphântíchnàyvàhàmlượngcủanhữngdạngnày.Thídụ:trongmức độ
nàocủasựoxyhoácómặtnguyêntốAs(III)hayAs(V),trongtrạngtháihoáhọcnàocómặtnguyên
tố(thídụđồngtrongkhoángchấtcóthểởdạngoxydhaysulfithayhỗnhợpnhữnghợpchấtnày).
Phântíchchấtcónhiềucáichungvớiphântíchphântửhaytướng.
- Phân tích tướng (pha):đólàphântíchđốitượngtronghệdịthể.Thídụ:sunfitvàoxydkẽm
phân bố trong khoáng chất không đồng thể mà tạo những tướng khác nhau. Người ta dùng các
phươngphápkhácnhauđểtáchvàxácđịnhcáchệdịthểthamgiatrongthànhphầncấutrúc(các
tướng)riêngbiệt,khácnhauvềtínhchất,vềcấutrúcvậtlývàphântáchnhaubởigiớihạnbềmặt.
3.4. PHÂN LOẠI THEO BẢN CHẤT CỦA PHƯƠNG PHÁP
Xácđịnhtheođặctínhcủatínhchấtđohaytheokhảnăngghinhậntínhiệutươngứng. Cóthểchiara:
- Phương pháp hoá học:làphươngphápdựatrênnhữngphảnứnghoáhọc.Thídụ:phảnứng
acid-base,oxyhoá-khử,kếttủa-hòatan,tạophức.
- Phương pháp hoá lý, vật lý:phươngphápvậtlýdựatrênnhữnghiệntượngvàquátrìnhvậtlý
nhưphươngphápquangphổ,phươngphápsomàu,vậtlýhạtnhân,...
- Phương pháp sinh học: dựatrênnhữnghiệntượngcủacuộcsống(traođổichất,tăngtrưởng,
ứcchếcủavisinhvật...),thídụnhưphươngphápphântíchvisinhvậtlàdựavàoquátrìnhtraođổi
chấtcủavisinhvật.Bằngphươngphápvisinhvậtngườitađịnhlượngcácthuốckhángsinh,kháng nấm,vitamin,...
4. PHÂN TÍCH ĐỊNH TÍNH VÀ PHÂN TÍCH ĐỊNH LƯỢNG
4.1. Phân tích định tính
Phântíchđịnhtínhlàxácđịnhcácnguyêntố,cácion,cácphântửcótrongthànhphầnchấtphân tích.
Đểtiếnhànhphươngphápđịnhtínhngườitadùngnhiềuphươngphápcóbảnchấtkhácnhau,
cáckỹthuật,cácđườnglốikhácnhau:phươngpháphoáhọc,vậtlývàhoálý.
4.1.1. Phương pháp hoá học
Phươngpháphoáhọclànhữngphươngphápđịnhtínhdựatrêncácphản ứnghoáhọc.Những
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page7 of225
phươngpháptrongphântíchđượcsửdụngrộngrãitrongthựctế,phươngphápnàykhôngđòi
hỏitrangbịphứctạpnhưngcòncómộtsốnhượcđiểmlà:trongtrườnghợpcầnphảitáchchấtra
khỏicáctạpchấtvàphảitáchởdạngtinhkhiếtthườngrấtkhókhăn,đôikhikhôngthựchiệnđược,
khôngpháthiệnđượcnhữnglượngchấtrấtnhỏ.
4.1.2. Phương pháp vật lý và hoá lý
Phươngphápvậtlývàhoálýlànhữngphươngphápdựatrêncáctínhchấtvậtlýcủacácchất cầnphântích.
Thí dụ:Sựnhuộmmàungọnlửađènkhíkhôngmàuthànhmàuđặctrưngdocáchợpchấtbay
hơicủamộtsốnguyêntốhoáhọcNa+,K+,...
Phươngphápsomàungọnlửa:NgọnlửaNa+cómàuvàng,K+cómàutím,Ba2+cómàuxanh lụcnhạt.
Phương pháp phân tích quang phổ hồng ngoại, phương pháp đo quang (quang phổ hấp thụ),
phươngphápcựcphổ,phươngphápsắckýv.v...
Dùngphươngphápvậtlývàhoálýcóthểtáchđượccácnguyêntốmàchúngkhóbịtáchbởicác
phươngpháphoáhọc,phươngphápvậtlývàhoálýcóđộnhạyvàđộchínhxáccaonhưngphảicó
trangbịphứctạp,máymócđắttiềnkhôngphảitấtcảcáccơsởđềutrangbịđượcnênphươngpháp
hoáhọcvẫnđóngvaitròquantrọngtrongcôngtácphântích.
4.2. Phân tích định lượng
Phântíchđịnhlượngchophépxácđịnhthànhphầnvềlượngcáchợpphầncủahợpchấtđãcho
hoặccủahỗnhợpcácchất.Khácvớiphântíchđịnhtính,phântíchđịnhlượngchokhảnăngxácđịnh
hàmlượngcủa cáchợp phầnriêngrẽ củachấtphân tíchhoặchàmlượngchung củachấtcầnxác
địnhtrongchấtnghiêncứu.
Cácphươngphápdùngtrongphântíchđịnhlượng:
4.2.1. Phương pháp phân tích hoá học
-Phântíchtrọnglượng(phântíchkhốilượng)
Phươngphápnàydựavàophảnứngkếttủacácchấtcầnđịnhlượngvớithuốcthử.Kếttủađược
táchrakhỏidungdịch,rửathậtsạchrồinunghoặclàmkhôsauđóđemcân.Từkhốilượngcủakết
tủataxácđịnhđượckhốilượngcủachấtcầnđịnhlượng.
Phươngphápnàymấtnhiềuthờigiannhưngkháchínhxác.
-Phântíchthểtích(chuẩnđộ)
Phươngphápnàydựatrênsựđothểtíchdungdịchthuốcthửđãbiếtchínhxácnồngđộcầndùng
chophảnứngvớichấtcầnđịnhlượng.Phươngphápnàyrấtphổbiến,dựatrêncácphảnứngtrung
hòa,tạophức,tạokếttủa,oxyhoá-khử,...
4.2.2. Phương pháp phân tích vật lý và hoá lý (phương pháp phân tích dụng cụ)
-Phươngphápphântíchvậtlý
Các phươngpháp phân tích địnhlượng cho phépxác địnhthành phần của chất cần phântích
khôngdùngđếncácphảnứnghoáhọc.Đểxácđịnhthànhphầnchấtcầnphântíchcóthểđocácchỉ
sốvềcáctínhchấtvậtlýnhư:hệsốkhúcxạ,độdẫnđiện,nhiệt,...
-Phươngpháphoálý
Cácphươngphápphântíchdựatrênsựthayđổitínhchấtvậtlýcủamộthệcầnphântích,sự
thayđổiđóxảyradocácphảnứnghoáhọcxácđịnh.Cácphươngphápvậtlý,hoálýthườngdùng:
cácphươngphápsắcký,cácphươngphápđoquang,phươngphápđiệnhoá,cựcphổ,điệndi,...
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page8 of225
5. CÁC BƯỚC THỰC HIỆN CỦA MỘT QUY TRÌNH PHÂN TÍCH
5.1. Mẫu thử - xác định đối tượng
Đầutiênphảixácđịnhrõmụctiêu(cầnnhữngthôngtingì)vàyêucầuphântích(địnhtínhhay
địnhlượng).Thuthậpthôngtinvềmẫuthử:bảnchất,nguồngốc,cáchlấymẫu,tìnhtrạngmẫuvà bảoquảnmẫu.
5.2. Lựa chọn phương pháp
Lựa chọn phương pháp phân tích dựa trên những thông tin có trước như: cỡ mẫu phân tích,
phươngtiệnphântích,yêucầuphântích,..Đểđạtkếtquảphântíchtốtphụthuộcnhiềuvàosựlựa chọnphươngpháp. 5.3. Lấy mẫu thử
Đâylàbướcquantrọngnhấttrongcảquytrìnhphântích.Chọnmẫuđạidiệncóthànhphầnphản
ánhđúngthànhphầnmẫucầnphântích.Từmẫuđạidiệnchọnvàchuẩnbịmẫulàmthínghiệmvà
phântíchtheoyêucầu. 5.4. Xử lý mẫu thử
Đểphântích,mẫuthửphảiđượcxửlýlàtáchcácchấtcảntrởrakhỏihỗnhợptrướckhiđo.Đây
làgiaiđoạnquantrọngtrongphântích.
5.5. Tiến hành đo các chất phân tích
Sửdụngnhữngdụngcụ,máymócthíchhợpđểđochấtcầnphântích.
5.6. Tính toán - xử lý kết quả phân tích
Cácdữliệuthuđượcxửlýtheotoánthốngkêđểđánhgiáđộtincậycủakếtquảđođược.Các
bướctrênliênquanmậtthiếtvớinhauvàảnhhưởnglẫnnhau.Trongthựctế,tuỳtheotừngtrường
hợpcụthể,các bướctiến hànhtrên đượcđơngiảnhoáhoặcbỏ quamộtsốbước, hoặcthựchiện
đúngcácbướctrên.
6. HOÁ PHÂN TÍCH LIÊN QUAN TỚI CÁC KHOA HỌC KHÁC
Hoáphântíchkhôngthểvàkhôngchỉlàmộtphầncủangànhhoáhọcmànóliênquanmậtthiết
vớicácngànhkhácnhư:vậtlývàkỹthuật.Phântíchhoáhọcphầnlớndựatrêncácthànhtựucủa
quangphổ(quanghọc,phóngxạ...),vậtlýhạtnhânvànhiềuphầnkháccủavậtlý.
Cácphươngphápphântíchhoáhọcđượcsửdụngtrênnềntảngcácthànhtựucủacácngànhhoá
khácnhư:lýthuyếtvềcânbằnghoáhọc,điệnhoá,độnghoáhọc,hoávôcơ,hoáhữucơ,hoákeo.
NgoàiraHoáphântíchcònliênquantớitoánhọcvàsinhhọc.
NhưvậycóthểnóirằngHoáphântíchlàđặctrưngcủakhoahọcgồmnhiềungành,khoahọc liênquan.
7. HOÁ PHÂN TÍCH VỚI NGÀNH DƯỢC
TrongngànhDược,Hoáhọcphântíchgiữvaitròquantrọng.Nócómặttrongsuốtquátrìnhsản
xuất(kiểmnghiệmnguyênliệu,bánthànhphẩm,vàsảnphẩmcuốicùng),bảoquản,lưuthôngvàsử
dụngthuốc.Cácphươngphápphântíchsửdụngrấtphongphúvàđadạngthuộccáclĩnhvực:vậtlý,
hoáhọcvàsinhhọc.Hiệnnayngườitacònquantâmnhiềutớicácphươngphápkiểmnghiệmdùng
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page9 of225
trongđốitượngsinhhọc,(thídụnhưphântíchmáu,nướcbọt,dịchnãotủy,gópphầnvàocác
nghiêncứusinhdượchọcvàdượcđộnghọc).
8. ỨNG DỤNG VÀ HƯỚNG PHÁT TRIỂN CỦA HOÁ PHÂN TÍCH 8.1. Ứng dụng
Hoáphântíchđóngvaitròquantrọngtrongsựpháttriểnkhoahọckỹthuậtvànhiềumônkhoa
họctựnhiên:hoáhọc,địachất,địalý,khoángvậthọc,vậtlý,sinhhọc,sinhhoá,nônghoá,ydược
học.Trongnhữnglĩnhvựcnàyđểthựchiệncáccôngtrìnhnghiêncứukhoahọcđềuđòihỏiphảiáp
dụngcácphươngphápphântích.Dựavàocácthôngtincủaphântíchhoáhọcmàcácnhàđịachất
tìmkiếmcáckhoángchất.Dựavàokếtquảphântíchmáucácthầythuốcchẩnđoánđượctìnhtrạng
sứckhỏecủaconngười.SựđịnhlượngcácionK+,Ca2+,Na+trongdịchtếbàođộngvậtchophép
cácnhàsinhlýhọcnghiêncứuvaitròcủacácionnàytrongsựdẫntruyềnluồngthầnkinhcũngnhư
trongcơchếcovàduỗicủacáccơ.Cácnhàhoáhọcgiảithíchcáccơchếphảnứnghoáhọcnhờvào
việcnghiêncứuvậntốcphảnứng,nhờcócácphươngphápphântíchhiệnđạimàngườitatổnghợp
đượccácchấthoáhọcmới,... 8.2. Hướng phát triển
NgàynayvớisựpháttriểncủakhoahọckỹthuậttiêntiếnđòihỏichuyênngànhHoáphântích
ngàymộthoànthiện,đểđápứngnhucầutrênHoáphântíchtiếntớiphảigiảiquyếtđược5vấnđề sau:
8.2.1. Xác định và giải quyết những khó khăn trong Hoá phân tích
Cầnphảixácđịnhcácthôngtincụthể(địnhtính,địnhlượng,tínhchất,chứcnăng).
Xácđịnhtìnhhuốngcụthể.
8.2.2. Thiết kế một quy trình phân tích
Thiếtlậptiêuchuẩnchomộtquytrìnhphântích(độchínhxác,độđúng,độnhạy,chiphí,quy
môthựchiện,tiếnđộthựchiện...)
Xácđịnhcácyếutốcảntrở.
Lựachọnphươngpháp.
Thiếtlậpcáctiêuchuẩnthẩmđịnh. Cáchlấymẫu.
8.2.3. Thực hiện và thu thập dữ liệu
Kiểmđịnhdụngcụvàtrangthiếtbị.
Chuẩnhoáthuốcthử.
Thuthậpdữliệu. 8.2.4. Xử lý dữ liệu
-Giảmhoặcbiếnđổidữliệu.
-Đánhgiákếtquả.
-Phântíchthốngkê.
-Biểuthịkếtquả.
8.2.5. Thực hiện đánh giá của cơ sở bên ngoài
Kiểmtrađánhgiálạikếtquảởphòngthínghiệmcủacơsởbênngoài.
Tuỳđi ềukiệnthựctế,tìnhhìnhcụthểcủacơsởcóthểkhônggiảiquyếtđượcngayh ếtcácvấn
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page10 of225
đềmàtừngbướcgiảiquyếttiếntớihoànchỉnhnhưcácyêucầuđặtra.
HiệnnayởnướctangànhDượcđangpháttriển,cácxínghiệpDượccổphầntrongnướcvàliên
doanhđã rađời, bên cạnhđó cácphòng bào chế ởcác khoa Dượccác bệnhviện cũng phát triển
không ngừng, ngoàira các nguồn thuốc nhập khẩucũngrấtphong phútừ các nướcphát triển và
đangpháttriển.Đểđảmbảochấtlượngthuốcsảnxuấtvàthuốcxuấtnhậpkhẩuđếntayngườitiêu
dùng, công tác kiểm nghiệm thuốcngày càng được quan tâm, vì vậy người Dược sĩ cần trangbị
nhữngkiếnthứcvữngvàngvềHoáhọcphântích.Ngoàicôngtáckiểmnghiệmthuốc,cáccôngtác
kháctrongcácphòngthínghiệmhoádược,dượclý,dượcliệu,dượclâmsàng,sinhhoá,độcchất,...
cũngđòihỏinhữngkiếnthứcvềHoáhọcphântích. TỪ KHOÁ
-Hoáhọcphântích -Phântíchchất
-Phântíchđịnhlượng
-Phântíchvilượng,bánvilượng,siêuvilượng
-Phântíchphântử
-Phântíchnguyêntố
-Phântíchđịnhtính
-Quytrìnhphântích CÂU HỎI LƯỢNG GIÁ
1.Chobiếtđốitượngcủahoáhọcphântích.SựliênquancủahoáhọcphântíchvớingànhDược
vàcácmônkhoahọckhác.
2.Thếnàolàphântíchđịnhtính?Nêucácphươngphápphântíchtrongphântíchđịnhtính.
3.Nêucácphươngphápdùngđểphântíchđịnhlượng.
4.Trìnhbàycácbướcthựchiệncủamộtquytrìnhphântích. CÂU HỎI TRẮC NGHIỆM
Hãychọntừngữthíchhợpđiềnvàochỗtrốngtrongcáccâu1và2saochophùhợp:
1.Hoáphântíchlàkhoahọcvềsựxácđịnh.........củachấtphântích
a.phảnứnghoáhọc c.thànhphần
e.tínhchấthoáhọc
b.thànhphầnhoáhọc d.nhómchức
2.Phântíchđịnhlượngchophépxácđịnh.....củacáchợpphầntrongchấtnghiêncứu: a.cấutrúc c.thểtích e.hàmlượng b.thànhphần d.trọnglượng
3.Phươngpháphoáhọclàphươngphápdựatrên
a.tínhchấthoáhọc
c.phảnứnghoáhọc
e.cấutrúchoáhọc
b.thànhphầnhoáhọc
d.hiệntượnghoáhọc
4.Hoáphântíchđóngvaitròquantrọngtrongsựpháttriểncủamônkhoahọc
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page11 of225 a.ydượchọc
c.khoángvậthọc e.chỉcâua,b b.địachất
d.tấtcảcáccâutrên
5.Cómấybướcchủyếucủamộtquytrìnhphântích a.3 c.5 e.7 b.4 d.6 Chương 2 CÂN BẰNG HOÁ HỌC MỤC TIÊU
Trình bày được định nghĩa và phân loại phản ứng hoá học.
Trình bày được khái niệm về sự cân bằng hoá học.
Trình bày được cách tính các hằng số cân bằng hoá học.
Diễn tả được sự khác biệt giữa hoạt độ và nồng độ.
Giải được một số bài tập cân bằng hoá học. NỘI DUNG 1. PHẢN ỨNG HOÁ HỌC 1.1. Định nghĩa
Phảnứnghoáhọclàphảnứngkhiliênkếtmộthaynhiềuhơn2nguyêntốthìcácliênkếthoá
họctrongchấtthamgiaphảnứngthayđổivàtạorachấtmới(sảnphẩm).Quátrìnhnàyluônkèm
theo1sựthayđổinănglượngvàtuântheođịnhluậtbảotoànnănglượng.Phảnứnghoáhọckếtthúc
khicósựcânbằngphảnứnghoáhọchaycácchấtthamgiaphảnứngđãđượcchuyểnđổihoàntoàn.
1.2. Các loại phản ứng hoá học
Cáctàiliệuvềphảnứnghoáhọchiệnnayphânloạinhiềukiểuphảnứngtheocáccơchếnhưng
chủyếutậptrungcácloạisau:
1.2.1. Phản ứng kết hợp (synthesis reaction)
Trongphảnứngnày,2haynhiềuchấtđơngiảnsẽkếthợpđểtạonênchấtphứctạphơn.
Dạng c ơ bản: A + X AX
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page12 of225
Thí dụ:khíhydrokếthợpvớikhíoxycóthểtạonênchấtphứctạphơnlànước 2H +O H O 2 2 2
Thídụ1:kimloại+oxyoxidkimloại*:
2Mg(r)+O2(k)2MgO(r)
Thídụ2:phikim+oxyoxidphikim:
C(r)+O2(k)CO (k) 2
Thídụ3:oxidkimloại+nướchydroxidkimloại
MgO(r)+H O(l) Mg(OH) (r) 2 2
Thídụ4:oxidphikim+nướcacid:
CO2(k)+H2O(l)H CO (nước) 2 3
Thídụ5:kimloại+phikimmuối:
2Na(r)+Cl2(k)2NaCl(r)
Thídụ6:Vàiphikimkếthợpvớinhữngchấtkhác:
2P(r)+3Cl2(k)2PCl (k) 3
Có 2 phản ứng thuộc loại này cần ghi nhớ
N2(k)+3H2(k)2NH (k) 3
NH3(k)+H2O(l)NH OH(nước) 4
1.2.2. Phản ứng phân hủy (decomposition reaction)
Phảnứngphânhủylàmộtphảnứnghoáhọctáchrờidomộtchấttựhủyhaychiarathànhcác đơnchất*
Dạng cơ bản: AX A + X 2H O 2H +O 2 2 2
Thí dụ 1:carbonatkimloại,khiđunnóngtạothànhcácoxidkimloạivàkhíCO (k). 2
CaCO3(r)CaO(r)+CO (k) 2
Thí dụ 2:Hầuhếtcáchydroxidkimloại,khiđunnóngphânhủythànhoxidkimloạivànước.
Ca(OH)2(r)CaO(r)+H O(k) 2
*Kýhiệu(k=thểkhí=gaz);(l=thểlỏng=liquid);(r=thểrắn=solid);(nước=dungmôi,nước=aqueous)
Thí dụ 3:Cáccloratkimloạikhiđunnóngphânhủythànhcloridkimloạivàoxy.
2KClO3(r)2KCl(r)+3O2(k)
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page13 of225
Thí dụ 4:Mộtsốacidkhiđunnóngphânhủythànhoxidphikimvànước
H2SO4H2O(l)+SO3(k)
Thí dụ 5:Mộtsốoxidkhiđunnóngphânhủy:
2HgO(r)2Hg(l)+O2(k)
Thí dụ 6:Mộtsốphảnứngphânhủyđượcsảnxuấtdođiệnphân
2H2O(l)2H (k)+O (k) 2 2
2NaCl(l)2Na(r)+Cl2(k)
1.2.3. Phản ứng trao đổi (replacement reaction)
Dạng cơ bản: A + BX AX + B hay AX + Y AY + X
Thí dụ 1:Traođổi1kimloạicủa1chấtbằngkimloạicóhoạttínhhơn
Fe(r)+CuSO4(nước)FeSO (nước)+Cu(r) 4
Thí dụ 2:Traođổinguyêntửhydrocótrongnướcbằngkimloạicóhoạttính
2Na(r)+2H2O(l)2NaOH(nước)+H (k) 2
Mg(r)+H2O(k)MgO(r)+H (k) 2
Thí dụ 3:Traođổinguyêntửhydrocótrongacidbằngkimloạicóhoạttính
Zn(r)+2HCl(nước)ZnCl2(nước)+H2(k)
Thí dụ 4:Traođổiphikimbằngkimloạicóhoạttínhhơn.
Cl2(k)+2NaBr(nước)2NaCl(nước)+Br (l) 2
a)Phảnứngtraođổiđơn(singlereplacementreaction)
Phảnứngtraođổiđơnlàmộtphảnứnghoáhọccủamộtđơnchấtvớiacid.Trongphảnứngtrao
đổiđơnthìmộtnguyêntốkhôngkếthợpsẽthaythếnguyêntốkháctrongmộthợpchất.Haichất
thamgiaphảnứngnhườngchỗcho2sảnphẩm.
Thídụ:Natrikếthợpvớiacidhydrochloricthìnatrisẽthaythếhydro
2Na+2HCl2NaCl+H2
b)Phảnứngtraođổikép(doublereplacementreaction)
Trongphảnứngtraođổiképthì2hợpchấtchuyểnvịtríđểtạothành2hợpchấtmới.Haichất
thamgiaphảnứngnhườngchỗcho2sảnphẩmmới.
Thí dụ:Bạcnitratkếthợpvớinatricloridsẽtạo2hợpchấtmớilàbạccloridvànatrinitrat
AgNO3+NaClAgCl+NaNO3
Fe O +6HCl 2FeCl +3H O 2 3 3 2
c)Phảnứngtraođổiion
Phảnứngtraođổiionlàphảnứnghoáhọcxảyragi ữacáciontrongdungdịchnước.Mộtphản
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page14 of225
ứngsẽxảyrakhicặpioncùngnhautraođổiđểtạothànhítnhấtmộttrongnhữngchấtsau:kết
tủa,khí,nướchaychấtkhôngionhoákhác.
Dạng cơ bản: AX + BY AY + BX
Thí dụ 1:Phảnứngtạotủa
NaCl(nước)+AgNO3(nước)NaNO (nước)+AgCl(r) 3
BaCl2(nước)+Na2SO4(nước)2NaCl(nước)+BaSO (r) 4
Thí dụ 2:Phảnứngtạokhí
HCl(nước)+FeS(r)FeCl2(nước)+H2S(k)
Thí dụ 3:Phảnứngtạonước.(Nếuphảnứnggiữaacidvàbasethìgọilàphảnứngtrunghòa)
HCl(nước)+NaOH(nước)NaCl(nước)+H2O(l)
Thí dụ 4:Phảnứngtạoramộtsảnphẩmphânhủy
CaCO3(r)+HCl(nước)CaCl (nước)+CO (k)+H O(l) 2 2 2
1.2.4. Phản ứng oxy hoá – khử
Chấtthamgiaphảnứngbịoxyhoá(mấtmộthaynhiềuelectron)vàcácchấtthamgiakhácbị
khử(nhậnmộthaynhiềuelectron).
Cácthídụchungcủacácphảnứngoxyhoá-khửliênquanđếnoxylàsựsétrỉcủakimloạinhư
sắt(cáckimloạibịoxyhoábởioxycủakhíquyển),sựđốtcháyvàchuyểnhoánănglượngtrongcơ thể.
C10H8+12O210CO +4H O+ 2 2 nhiệt
CH2S+6F2CF +2HF+SF + 4 6 nhiệt
Mộtthídụcủaphảnứngoxyhoá-khửkhôngliênquanđếnoxycủakhíquyểnlàphảnứngtạo
điệntrongbìnhacquy: Pb+PbO 2–
2+4H++2SO4 2PbSO +2H O 4 2
2. KHÁI NIỆM VỀ SỰ CÂN BẰNG HOÁ HỌC
Khikhảosátcácphảnứnghoáhọcngườitanhậnthấycórấtítphảnứnghoáhọcdichuyểnchỉ
theomộtchiều.Đasốcácphảnứnghoáhọcđềudichuyểnthuậnnghịch.Khibắtđầucósựtạothành
sảnphẩmlàcóphảnứngtheochiềungượclạihaycóthểnóingaytừlúccónhữngphântửsảnphẩm
xuấthiệnlàbắtđầucóphảnứngnghịch.
Khitốcđộcủaphảnứngdichuyểntheochiềuthuậnvàtheochiềunghịchbằngnhauvànồngđộ
củachấtthamgiaphảnứngvàcủanồngđộsảnphẩmkhôngthayđổitheothờigiannữalàcânbằng
hoáhọcđãđạtđến.
Cânbằnghoáhọclàmộtquátrìnhcânbằngđộng.Hãytưởngtượngnhưnhữngngườiđangtrượt
tuyếttrên1dốcthoải.Lượngngườiđangđilênvàtrượtxuốngliêntụcnốitiếpnhauthayđổinhưng
tổngsốngườithamdựtrượttuyếttừđỉnhtớichândốckhôngthayđổi.
Khinóiđếncân bằng hoá họclànóiđếncóítnhất2chấtkhácnhau:chấtthamgiaphảnứngvà sảnphẩ m.
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page15 of225
Khinóiđếncân bằng vật lýlàchỉđềcậpđếnmộtchấtcótrong2pha(thể)khácnhauvàsựthay
đổisảnphẩmchỉlàthayđổivềlýtính.ThídụtrongsựbayhơinướcsốmolH Othoátrakhỏith 2 ể
lỏngbằngvớisốmolH Ochuyểnthànhthểkhí: 2 H O(k) 2O(l) H2
Mộtthídụđiểnhìnhcủacânbằnghoáhọclàphảnứng:
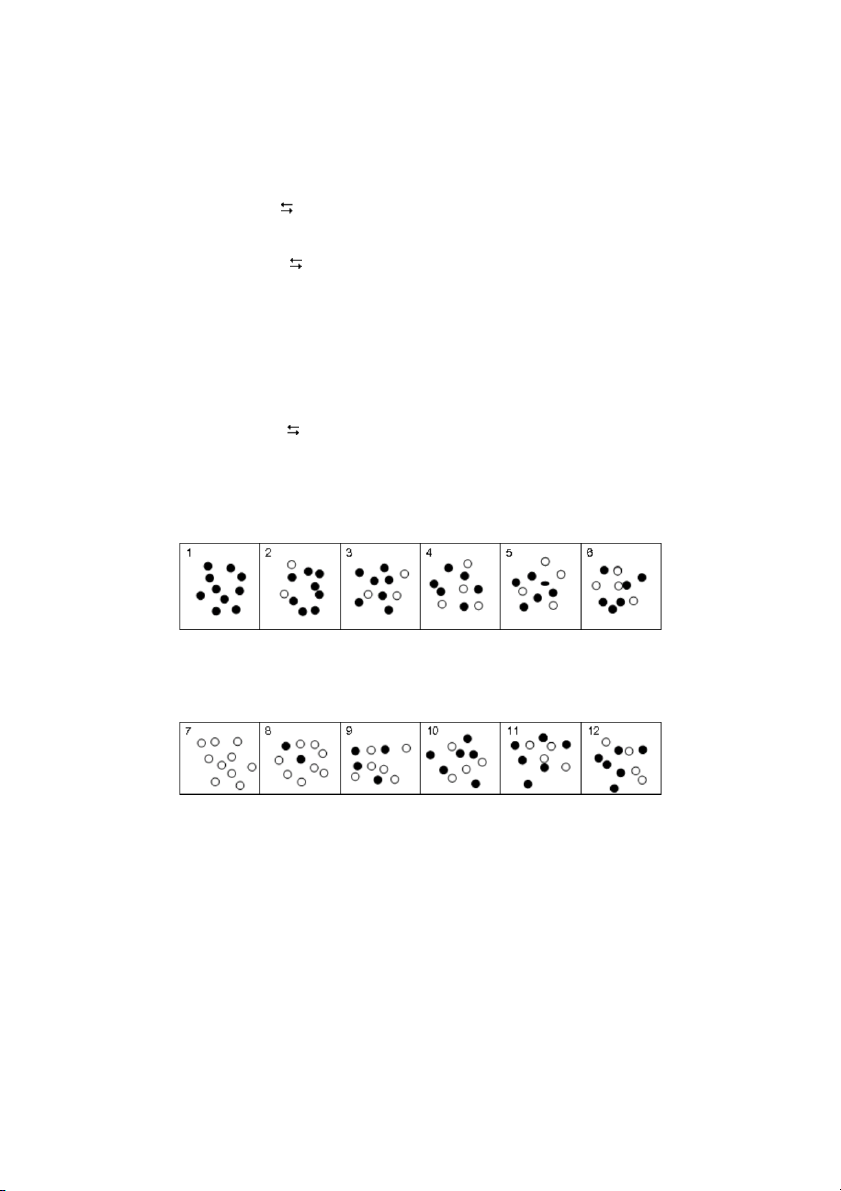
N2O4(k) 2NO2(k) (2.1)
Đâylàphảnứngtạothànhkhínitơdioxyd(NO )từkhídinitơtetraoxyd(N 2
2O4).Cóthểtheodõi
diễnbiếncủaphảnứngnàydễdàngdoN O làkhíkhôngcómàutrongkhiNO cómàunâuđậ 2 4 2 m.
NếubơmmộtlượngchínhxácN O vàomộtbìnhcầutrongđólàchânkhôngthìmàunâucủas 2 4 ẽ
xuấthiệnngaychứngtỏlàNO cómặt.MàunâusẽđậmdầndoN O tựphânly.Đếnkhiđạ 2 2 4 tcân
bằngthìmàukhôngđổinữa.
Đốivớiphảnứngngượcvớiphảnứng(2.1) 2NO2(k) N2O4 (k) (2.2)
Trongcáchìnhminhhọa2.1và2.2vòngmàunâuđenđạidiệnchokhíNO vàvòngtrắngđạ 2 i diệnchokhíN O . 2 4
NếubắtđầuvớiNO ,cóthểminhhọacânbằngđạtđếnnhưsau: 2
Hình 2.1. Chuyển 2NO (k) N O (k), hệ thống cân bằng ở các ô 4, 5 và 6 2 2 4
NếubắtđầuvớiN O ,ởcùngnhiệtđộcóthểminhhọacânbằngđạtđếnlà 2 4
Hình 2.2. Chuyển N O (k) 2NO (k), hệ thống cân bằng ở các ô 10, 11 và 12 2 4 2
TuỳtheonhiệtđộvàkhốilượngbanđầucủaN O (cóthểcólẫnNO haykhông)đãsửdụ 2 4 2 ng
mànồngđộcủaNO vàN O ởtrạngtháicânbằngcủahệnàysẽkháchệkhác. 2 2 4 Chúý:
-Mộthệthốngcânbằngkhôngcầnbấtcứnănglượngnàođểduytrìsựcânbằng.
-Khôngnênlẫnlộntrạngtháicânbằngvàtrạngtháitĩnh.Trạngtháitĩnhlàtrạngtháimàcác
nồngđộđềukhôngđổitheothờigian.
-Cânbằnghoáhọclàtrạngtháiđộngtrongđóchấ tthamgiaphảnứngvàsảnphẩmchuyểnđổi
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page16 of225
liêntụcchonhau.Tốcđộmấtđivàxuấthiệncủachúngbằngnhau.
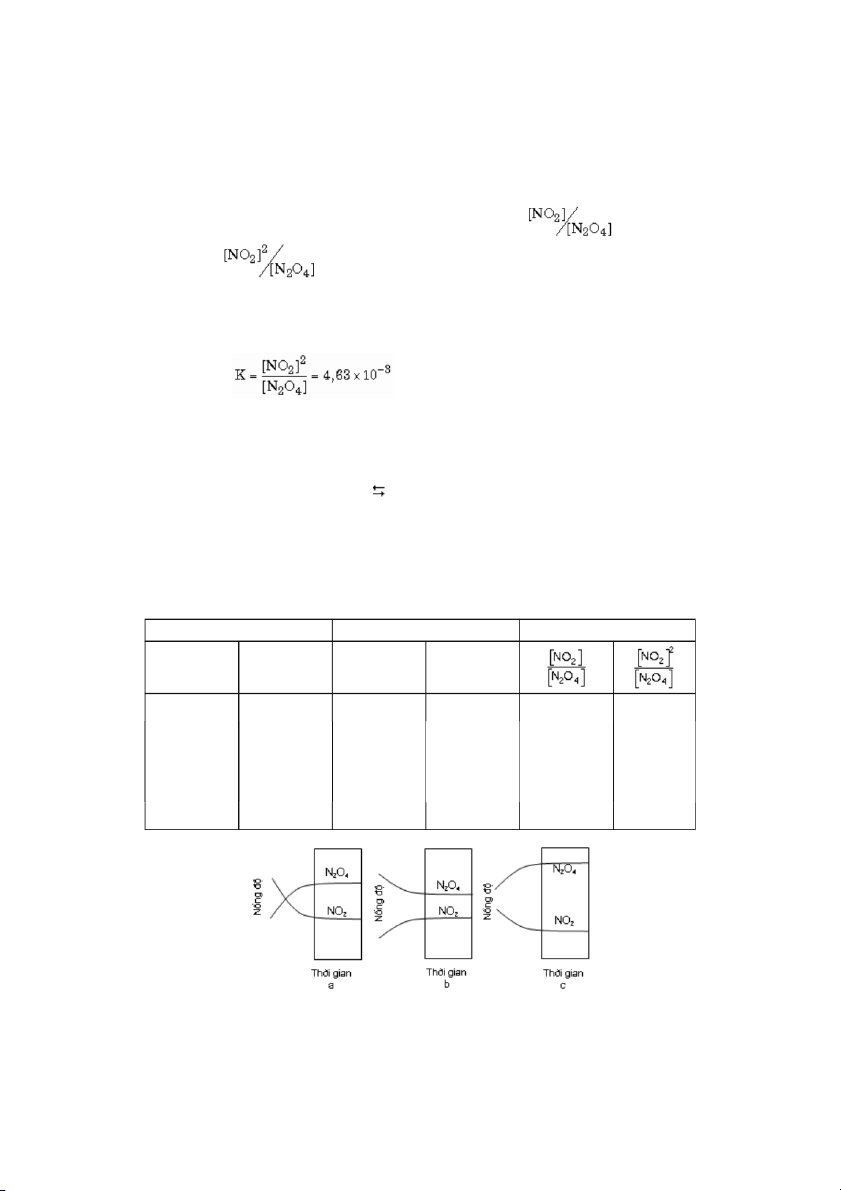
Bảng2.1nêuvàidữliệuthựcnghiệmliênquanđếnphảnứngnàyở25độC.Nồngđộcủakhí
đượcdiễntảbằngnồngđộmolvàđượctínhtừsốphântửcủakhícómặttừlúcphảnứngbắtđầu
chođếnlúcphảnứngcânbằngxảyratrong1thểtíchcủabìnhcầu(tínhbằnglít).
Phântíchcácdữliệutừsựcânbằngsẽchothấytrongkhitỷsố
chonhữnggiátrị
thayđổithìtỷsố
lạigầnnhưhằngđịnhvàtrungbìnhlà4,63x10-3.
GiátrịtrungbìnhnàygọilàhằngsốcânbằngKđốivớiphảnứngnàyở25độC.
BiểuthứctoánhọccủahằngsốcânbằngđốivớihệNO -N O là 2 2 4
Cũngcầnchúýlàsốmũ2của[NO2]trongbiểuthứctrênbằnghệsốcânbằngtỷlượngcủaNO2
trongphươngtrình(2.1).
Kháiniệmnàythuđượckhixétphươngtrìnhcủaphảnứngthuậnnghịch: A+B C+D (2.3)
A,B:Cácchấtthamgiaphảnứng
C,D:Sảnphẩmtạothành.
Phươngtrình(2.3)làbiểuthứctoánhọctuântheođịnhluậttácdụngkhốilượng.
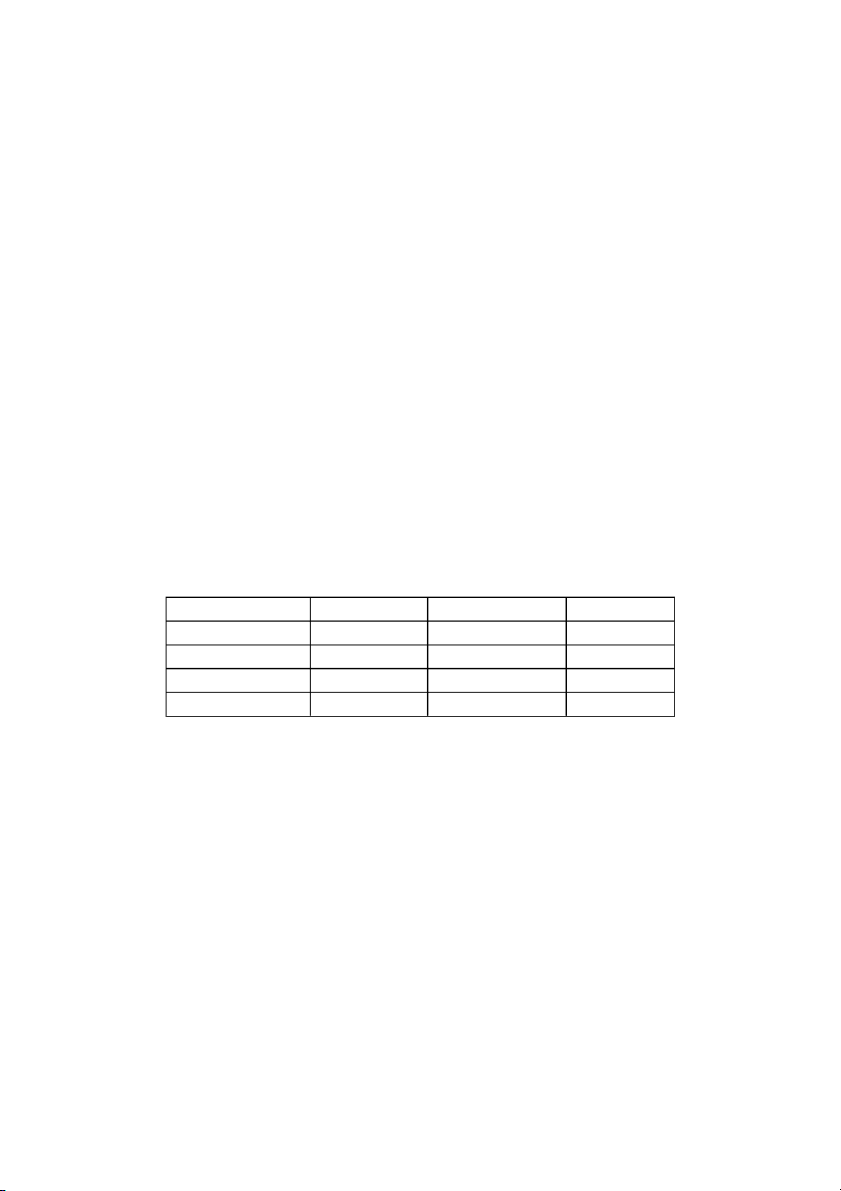
Bảng 2.1. Giá trị các tỷ số nồng độ của NO và N O 2 2 4 Nồng độ ban đầu (M)
Nồng độ cân bằng (M)
Giá trị các tỷ số nồng độ [NO ] [N O ] [NO ] [N O ] 2 2 4 2 2 4 0,000 0,670 0,0547 0,643 0,0851 4,65 10-3 0,0500 0,446 0,0457 0,448 0,102 4,66 10-3 0,0300 0,500 0,0475 0,491 0,0967 4,60 10-3 0,0400 0,600 0,0523 0,594 0,0880 4,60 10-3 0,200 0,000 0,0204 0,0898 0,227 4,63 10-3
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page17 of225
Hình 2.3. Biến đổi nồng độ của NO và N O theo thời gian 2 2 4
a) Lúc đầu chỉ có NO ; b) Lúc đầu chỉ có N O ; c) Lúc đầu có hỗn hợp NO và N O 2 2 4 2 2 4
3. HOẠT ĐỘ VÀ NỒNG ĐỘ
Khinóiđếnhoạtđộvànồngđộcầnxácđịnhrõ2loạinồngđộ:
-Nồngđộmol/l(phântửgam/l)chỉsốphântửgamchấttan(chấttancóthểlàphântử,ion)có
trongmột1000mldungdịch.
-Nồngđộmolanchỉsốphântửgamchấttancótrongmột1000gamdungdịch.
KháiniệmhoạtđộvàhệsốhoạtđộdonhàhoálýngườiHoaKỳLewisđưara(1907).Đểhiểurõ
hơnsẽxétthídụởbảng2.2
BiểuthứcđểtínhpHlàpH=-lg[H+](làmộtcôngthứcrấtquenthuộcđểdiễntảsựliênquan
giữapHvànồngđộmolcủaionH+).
Theobảng2.2,nếusosánhpHtínhtoántheocôngthứcvàpHđođượcquathựcnghiệmthìsẽ
nhậnthấycósaisốgiữagiátrịpHlýthuyếtvàthựcnghiệm.
LýdocósaisốnhưđãthấylàdobiểuthứcpH=-lg[H+]chỉchínhxáctrongmộtgiớihạnpha
loãngvàpHthậtsựtínhtheohoạtđộionhydrochứkhôngtínhtheonồngđộ.
NghĩalàpH=-lgaH+ Hoạtđộa
củaionhydrocótrongmộtdungdịchđãchocóthểđượcxácđịnhbằngcáchđơ H+ n giảnlàđopH.
Bảng 2.2. Sự khác biệt về pH tính theo lý thuyết và thực nghiệm Nồng độ mol của HCl pH theo lý thuyết pH theo thực nghiệm Sai số pH 0,00050 3,30103 3,31 -0,00897 0,0100 2 2,04 -0.04 0,100 1 1,10 -0,1 0,4 0,39794 0,52 -0,12206
Mộtcáchtổngquát,giữahoạtđộvànồngđộcómốiliênquantheocôngthức:
a=Chaya=fC
vớia:hoạtđộ;(hoặcf):hệsốhoạtđộ;C:nồngđộmol;
Hoạtđộdựatrêncácnồngđộđãchođượcápdụngtốtđốivớicácdungdịchkhôngđiệnly(hay
cáchợpchấtphântử).Trongdungdịchphaloãng,hệsốhoạtđộthường=1chonênhoạtđộ=nồng độ.
Trongdungdịchđiệnly,docáctácđộngtươnghỗcủađiệntíchnêncầnquantâmđếnvàiyếutố
đặcbiệtđểtínhđượchệsốhoạtđộnhư:
- Lực ion:Khibànđếndungdịchionthìítnhấtphảibiếtvềlựcioncủadungdịchnàyvìngười
tatinrằnglựcionsẽảnhhưởngđếnhoạtđộion.ĐạilượngnàyđượckýhiệulàI
MộtchấtđiệnlyM Xmđượcphânlythành: x M m m+ x- xX =xM +mX
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page18 of225
CáciondươngMm+vàcácionâmXx-phảicùngcómặttrongmộtdungdịchvàkhôngcócách
nàođểtáchriênghoạtđộcủacáciondươngvàâm.Dovậy,thườngdùngđạilượnghoạtđộiontrung bình(a) a=C(MmXx)-(m+x)
Đối với cả 2 ion dương và âm, C là nồng độ tỷ lượng của chất điện ly (stoichiometric concentration).
Trườnghợpnàyhệ số hoạt độ trung bìnhđượctínhtheobiểuthức:
Trongđó+và-lầnlượtlàsốcationvàaniontrong1đơnvịcôngthứccủachấtđiệnly.
Ngoàira,phươngtrìnhDebyeHuckelmởrộng(cảitiếntừđịnhluậtgiớihạncủaDebyeHuckel)
cũnglàbiểuthứccócơsởchắcchắnđểlàmnhẹđicáchtínhnồngđộkhitínhtheohệsốhoạtđộ trungbình:
TrongđóAlàhằngsốtuỳthuộcvàotínhchấtcủadungmôi(A=0,5085đốivớinướcở25oC),
z+vàz-làcácđiệntíchion,Ilàlựcionđượcxácđịnhtheophươngtrình: I=½z 2 i mi
trongđóm lànồngđộcủaioni.Tómlại,Iđượctínhđếntấtcảcácioncóthểcótrongdungdị i ch này.
Đốivớicácdungdịchđậmđặc,việcsửdụngnồngđộtínhtheotrọnglượngcủadungmôi(nồng
độmolan)thườngcóthểcungcấpmộtướclượngtốthơnlàdùngnồngđộtínhtheothểtích(nồngđộ mol).
4. HẰNG SỐ CÂN BẰNG (HSCB)
4.1. Cách tính hằng số cân bằng
Địnhluậttácdụngkhốilượnglàđịnhluậtbiểudiễnmốiliênquangiữanồngđộ(hoạtđộ)của
cácchấtphảnứngvàcủasảnphẩmphảnứngởtrạngtháicânbằng.
Địnhluậttácdụngkhốilượngchỉápdụngđượcvớicácdungdịchlýtưởnglàdungdịchcủacác
chấtkhôngđiệnlyvàcácchấtđiệnlyyếuvớinồngđộrấtloãng(hoạt độ).Trongthựctế,thường
thườngnồngđộcủacácdungdịchkhôngtuântheođộphaloãngmộtcáchchínhxác.
Trongtrườnghợpcácchấtđiệnlymạnhhoặccácchấtđiệnlyyếunhưngnồngđộcaothìsựsai
lệchrấtlớn,đâylàgiớihạncủađịnhluậttácdụngkhốilượng.Vìthếkhiápdụngđịnhluậttácdụng
khốilượngchỉnhậnđượccáckếtquảgầnđúng.Tuyvậy,trongnhiềutrườnghợpđộchínhxácnày
vẫnchấpnhậnđượcvớicácmụcđíchthựctiễn.
Thídụ:đốivớiphảnứngởtrạngtháicânbằng
mA+nB pC+qD (2.4) Nếu tính theo hoạt độ
Khimộtphảnứngđạttrạngtháicânbằngthìtỉsốgiữatíchcáchoạtđộcủacácsảnphẩmphản
ứng(đượcnângluỹthừavớisố mũbằnghệsốtỉlượngtrongphươngtrìnhphảnứng)vàtíchtương
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page19 of225
ứngcủacácchấtphảnứnglàmộthằngsố(ởnhiệtđộchosẵn).
Khiđạtcânbằngthìtỉsố ( 2.5)
K đượcgọilàHSCB,trongđóa ,a ,a ,a làhoạtđộcânbằngcủacácchấtphảnứ a A B C D ng(A,B)
vàcácsảnphẩmphảnứng(C,D);m,n,p,qlàcáchệsốtỉlượngtươngứng. Nếu tính theo nồng độ
Thaychohoạtđộ,HSCBcũngcóthểbiểudiễnquanồngđộC ,ápsuấtriêngP hoặcphầ i i nmol
X củacáccấutửitươngứng.TrongcáctrườnghợpnàyHSCBđượckíhiệuK ,K ,K . i c p x
K -hằngsốcânbằng: c (2.6)
Trongphươngtrình2.6
[A],[B],[C],[D]:nồngđộcânbằngtươngứngcủachấtphảnứngvàsảnphẩm,
m,n,p,q:cáchệsốcânbằng(cáchệsốtỉlượngtươngứng).
Nếucoi(2.4)làphảnứngcơbản(xảyratrongmộtgiaiđoạn,mộtvachạm)theochiềutừtrái
sangphảithìtốcđộphảnứngtheochiềuthuậnđượcbiểudiễnbằngphươngtrình: (2.7)
Trongđó,V làtốcđộphảnứng;m,nlàcáchệsốtỉlượng; 1
K :hằngsốtốcđộ;[A]và[B]lànồngđộtươngứngcủachấtphảnứngAvàBởthờiđiểmkhả 1 o sát.
Nếucoi(2.4)làphảnứngcơbảnhaichiều,thuậnvànghịch,V làtốcđộphảnứngxả 2 yratheo
chiềungượclại.PhảnứngđượcđặctrưngbằnghaihằngsốtốcđộK vàK với 1 2 (2.8)
KhiphảnứngđạttớitrạngtháicânbằngthìV =V 1 2
NghĩalàK [A]m 1 [B]n=K2[C]p[D]q (2.9)
Trênthựctế,(2.4)thườngbiểudiễnmộtphảnứngphứctạp(baogồmnhiềugiaiđoạn,quanhiều
vachạm)thìbiểuthức(2.6)nóichungkhôngđúng.Trongtrườnghợpnàyhàmtốcđộphảnứngphụ
thuộcnồngđộcódạngphứctạp.Chỉtrongmộtsốtrườnghợptốcđộphảnứngcóthểbiểudiễnbằng hàm mũ: (2.10)
Trongđón1vàn2tươngứnglàbậcphảnứngtheocáccấutử1và2.C:nồngđộcủacácchất
thamgiahoặcsảnphẩmtạ othànhsauphảnứ ng.
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013
BoYte-Hoaphantich Page20 of225 Nhưvậy,n1 mvàn2
n.Bậcphảnứnglàđạilượngđượcxácđịnhbằngthựcnghiệm,không
liênquanđếncáchệsốtỉlượng.Bậccóthểlàsốnguyên,phânsốhaysốkhông.
4.2. Hằng số cân bằng của các phản ứng hay sử dụng trong hoá học phân tích
4.2.1. Hằng số cân bằng của các phản ứng phân ly (HSPL)
Làhằngsốcânbằngcủaphảnứngphânlymộtchất.
Thídụ:đốivớiphảnứngphânlyacidyếuHA: HA=H++A-
K đượcgọilàHSPLnhiệtđộng;a:hoạtđộcủaionhoặcphântử;g:hệsốhoạtđộ.Trongnhữ a ng
trườnghợp,khicóthểchấpnhậnhệsốhoạtđộkhôngđổi:
K' đượcgọilàHSPLđiềukiện.K phụthuộcnhiệtđộ,khôngphụthuộcnồngđộ;cònK' ph a a a ụ
thuộccảnồngđộvànhiệtđộ.BêncạnhK ngườitacòndùngkháiniệmpK =-lgK . a a a
Thídụ.ĐốivớiacidaceticCH3COOHở25oC,Ka=1,754.10-5vàpKa=4,76.
Tronghằngsốphânlyngườitacóthểlàmrõhơnvàihằngsốkháclà:
a) Hằng số phân ly acid (phản ứng acid –base)
Phảnứngcủamộtacidvớidungmôi(nhưnước)đươcgọilàphảnứngphânlyacid.Acidchia làm2loại:
-AcidmạnhnhưlàHClchuyểnhếtprotoncủanóchodungmôi.
-Acidyếunhưacidacetickhôngthểchohếtprotonacidcủanóchodungmôi.Thayvàođóhầu
hếtacidcònlạikhôngphânly,chỉmộtphầnnhỏhiệndiệndướidạngbaseliênhợp
CH3 COOH(nước)+H2O(l) H3O+(nước)+CH3COO-(nước) (2.11)
HằngsốcânbằngcủaphảnứngnàyđượcgọihằngsốphânlyacidK .K củ a a aacidaceticlà1,75 x10-5
Chúý:nồngđộcủanướccóthểbỏquatrongbiểuthứctínhK vìgiátrịquálớnkhôngbịả a nh
hưởngbởiphảnứngphânly. ĐộlớncủaK cungcấpthôngtinvềlựctươngđối củaacidvớiK a a
càngnhỏthìacidcàngyếu.(trìnhbàytrong chương7)
b) Hằng số phân ly base (phản ứng acid –base):
Hằngsốphânlybaselàhằngsốcânbằnggiữabaseyếuvàprotonmàbasenhậnđểtạonênacid vàacidđó.
file://C:\Windows\Temp\kwcjklckqa\hoa_phan_tich.htm 04/01/2013