


Preview text:
BÀI: XÁC ĐỊNH HÀM LƯỢNG ĐẠM TOÀN PHẦN CÓ TRONG NƯỚC MẮM
II. Nguyên tắc
Nguyên tắc của quá trình là dựa trên cơ sở phương pháp Kjeldahl đế xác định hàm
lượng đạm toàn phần trong mẫu. Mẫu được vô cơ hoá trong môi trường H2SO4 đậm đặc, có mặt chất xúc tác, để chuyển toàn bộ các dạng nitơ hữu cơ về dạng muối ammonium.
Dùng NaOH đẩy ra một lượng NH3 tương đương; lượng NH3 này được hấp thu vào lượng dư chính xác dung dịch chuẩn H2SO4. Chuẩn độ lượng H2SO4 dư bằng dung dịch chuẩn NaOH với chỉ thị Tashiro.
H2SO4 đđ NaOH 40%
Protid (NH4)2SO4 NH3
Xúc tác
Phản ứng hấp thụ: NH3 + H2SO4 dư → (NH4)2SO4
Phản ứng chuẩn độ: H2SO4 + NaOH → Na2SO4 + H2O
III. Dụng cụ, thiết bị và hoá chất
3.2. Hóa chất
HÓA CHẤT | CÁCH PHA | VAI TRÒ |
H2SO4 đậm đặc và H2SO4 0.1N | Pha 100mL H2SO4 0.1N từ H2SO4 đậm đặc. có C% = 96%, d = 1.84 g/mL |
mẫu
|
C ×V×Đ×100 C ×V×M V= N = N C%×d×1000 C%×d×10× | z | |
NaOH 0.1N | Pha dung dịch NaOH 0.1N có MNaOH = 40, z = 1, p = 96% CN ×V mL ×Đ×100 CN ×V mL ×M mcân(g)= 1000×p = 10×p×z | Chất chuẩn |
Hỗn hợp xúc tác CuSO4 + K2SO4 theo tỉ lệ khối lượng 1/10 | Cân 10 g CuSO4 và 100 g K2SO4 cho vào cối sứ, nghiền và trộn đều, cho vào chai thủy tinh để sử dụng dần | Xúc tác cho phản ứng chuyển nito về dạng amoni sunfat, làm tăng điểm sôi |
H2C2O4 0.1N | Pha 100mL H2C2O4 0.1N từ dung dịch H2C2O4.2H2O, có P = 99.5%, z = 2. CN ×V mL ×Đ×100 CN ×V mL ×M mcân(g)= 1000×p = 10×p×z | Chất chuẩn gốc chuẩn lại NaOH |
NaOH 40% | C%×V mct= p (g) | Dung dịch phải phóng NH4+ thành NH3 |
Chỉ thị Tashiro | 0.2 g MR + 0.1gam Metylen xanh hòa tan trong 200mL ethanol. | Chỉ thị |
IV. Quy trình thực nghiệm
4.1. Chuẩn độ lại nồng độ NaOH bằng dung dịch chuẩn gốc H2C2O4
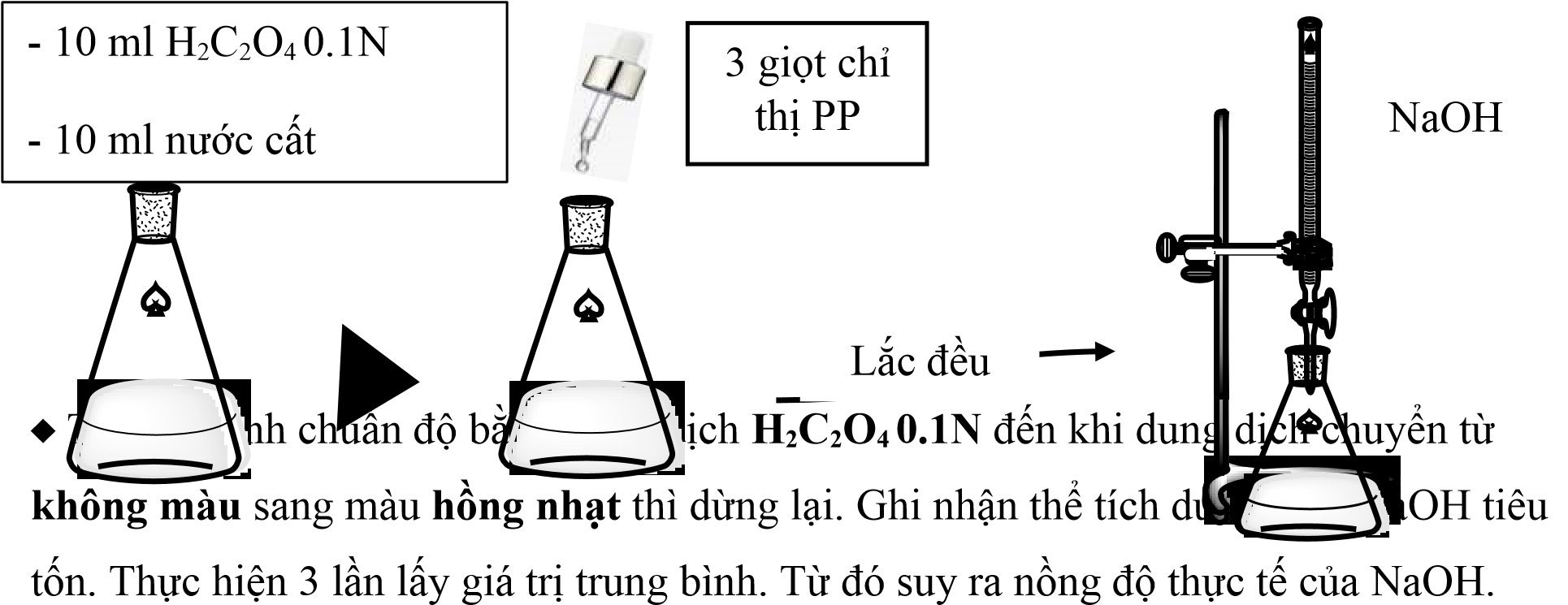
¨ Phản ứng chuẩn độ:
H2C2O4 + 2OH- = C2O−4¿¿+ 2H2O
4.2. Giai đoạn vô cơ hóa mẫu
- Hút 10mL nước mắm định mức 250ml, lấy 10ml cho vào ống kendan
- Thêm 5g xúc tác. 10mL sunfuric đậm đặc
- chương trình nhiêt: H=60% trong 20ph, H=80% trong 40ph đến khi dung dịch xanhtrong suốt.
4.3. Chưng cất và chuẩn độ
- Erlen: 25ml sunfuric 0.1N, vài giọt Tashiro hấp thu đến khi hết NH3 ( giấy quỳkhông còn màu xanh) thì dừng
- chuẩn độ bằng NaOH 0.1N từ màu tím sang xanh lục.
V. Tính toán kết quả
5.2. Công thức tính hàm lượng đạm toàn phần trong mẫu theo gN/L
gN/L=¿¿
Công thức tính hàm lượng đạm toàn phần trong mẫu theo %N
%N=¿¿
Trong đó:
Vbđm: Thể tích bình định mức
Vh: Thể tích mẫu hút cho vào ống Kjeldahl
Vm: Thể tích mẫu ban đầu
DN: Đương lượng gram của nito
d: Tỷ trọng của mẫu trong nước mắm
VI. Trả lời câu hỏi
6.1. Cho biết thành phần và cách pha chỉ thị Tashiro?
- Chỉ thị Tashiro gồm hỗn hợp Methyl đỏ (MR) và Methyl xanh (MX) có pT = 5,4 vàkhoảng không đổi màu rất hẹp 5,2 - 5,6.
+ Khi pH ≤4,4: “chàm lục” + “đỏ” → Tím
+ Khi pH ≥6,2: “chàm lục” + “vàng” → Lục
- Cách pha: Trộn hai thể tích bằng nhau của dung dịch MR 0,2% trong rượu và Methylxanh 0,1% trong rượu.
+ Khi 4,4 < pH < 6,2: “chàm lục” + “ cam” → Không màu
+ Từ Tím→ Lục, có độ tương phản cao nên rất rõ ràng.
6.2. Công thức tính hàm lượng đạm toàn phần trong mẫu theo gN/L
gN mN nN' ×ĐN CN ×V L ×ĐN
= L = mL −3= mL −3
L V mẫu V mẫu ×10 V mẫu×10
¿¿¿
¿¿¿
mN nN' ×Đ N CN ×V L ×Đ N
%N=×100= ×100=×100 mmẫu mmẫu mmẫu
¿¿¿
6.3. Ngoài phương pháp trên còn có phương pháp hấp thu NH3 bằng H3BO3 (Chuẩn độ trực tiếp)
Nguyên tắc:
+ NH3 được hấp phụ vào dung dịch H3BO3 bão hõa. Sau đó dung dịch H2BO3được chuẩn độ bằng dung dịch chuẩn H2SO4 đến pH = 5,4 với chỉ thị thích hợp.
+ H3BO3 là acid rất yếu (Ka = 5,8.10-10), dung dịch H3BO3 bão hòa (0,65M) có pH = 4,7. Khi hòa hết 20% H+ bằng NH3 thì pH tăng lên 8,6. Với 25 mL dung dịch có thể tương ứng 48 mgN.




