


Preview text:
BÀI 1: XÁC ĐỊNH HÀM LƯỢNG OXY HÒA TAN (DO) TRONG MẪU NƯỚC
(TCVN 5499-1995 và ISO 5813:1983)
I. Nguyên tắc
- Phương pháp Winler cải tiến dựa trên sự oxi hóa Mn2+¿¿ thành Mn4+¿¿ bởi lượng oxi hòa tan trong nước.
- Khi cho MnSO4 và dung dịch iodide kiềm (NaOH + NaI ) và mẫu có hai trường hợp xảy ra:
+ Nếu không có oxi hiện diện, kết tủa Mn(OH)2 có màu trắng
Mn2+ + 2OH− → Mn(OH)2 ( tủa trắng)
+ Nếu mẫu có oxi, một phần Mn2+ bị oxi hóa thành Mn4+, tủa có màu nâu.
Mn2+ + 2OH− + 1/2O2 → MnO2 + H2O
- Mn4+ có khả năng khử I− thành I2 tự do trong môi trường acid. Như vậy, lượng I2 được giải phóng tương đương với lượng oxi hòa tan có trong nước. Lượng iod này được xác định theo phương pháp chuẩn độ bằng Na2S2O3 với chỉ thị hồ tinh bột. Điểm tương đương chuyển từ màu xanh sang không màu. Vì trong mẫu nước thải thường có Fe3+ sẽ gây ra sai số dư, để hạn chế người ta dùng H3PO4 để che. Sự có mặt của NO2− cũng gây ra sai số dư, để hạn chế ảnh hưởng của ion nitrit cần thêm NaN3 trước khi axit hóa.
MnO2 + 2I− + 4H+ → Mn2+ + I2 + H2O
2Na2S2O3 + I2 → Na2S4O6 + 2NaI ( không màu )
II. Hóa chất, dụng cụ và thiết bị
3.1. Hóa chất
Dung dịch kiềm
Azur
Hòa tan 160 gam NaOH trong 150 mL
nước cất, làm lạnh. Hòa tan 300 gam
NaI (hoặc 286 gam KI) trong 200 mL
nước cất. Hòa tan 5 gam NaN
3
trong
mL nước cất. Trộn ba dung dịch
50
này và thêm nước cất tới vạch định
mức của bình 500 mL. Nếu có kết tủa
nâu thì phải lọc bỏ bằng giấy lọc băng
xanh.
Che sự ảnh hưởng của
ion nitrit
Dung dịch chuẩn
Na
2
S
2
O
3
N
0.025
Hòa tan 6.267g Na
2
S
2
O
3
.5
H
2
O vào
mL nước cất, thêm 0.1g Na
900
2
CO
3
,
mL isobutanol định mức đến vạch
10
1000
mL.
m
c ân
=
C
N
×V
mL
×Đ×
100
1000
×p
=
C
N
×V
mL
×Đ
10
×p
=
Dung dịch chuẩn xác
định lại chính xác nồng
độ của I
2
Dung dịch hồ
tinh bột
Chất chỉ thị
Có sẵn
Dung dịch H
3
PO
4
đậm đặc
Có sẵn
Che sự ảnh hưởng của
Fe
3+
Tên hóa chất
Cách pha
Vai trò
Dung dịch Mn
2+
Hòa tan 300 gam MnCl
2
.4
H
2
O (hoặc
MnSO
4
)
trong khoảng 300 mL nước cất
đun nóng cho đến khi tan hết), để nguội
(
rồi chuyển vào bình định mức 500 mL,
dùng nước cất định mức tới vạch.
Chất khử phản ứng
với oxy hòa tan trong
mẫu
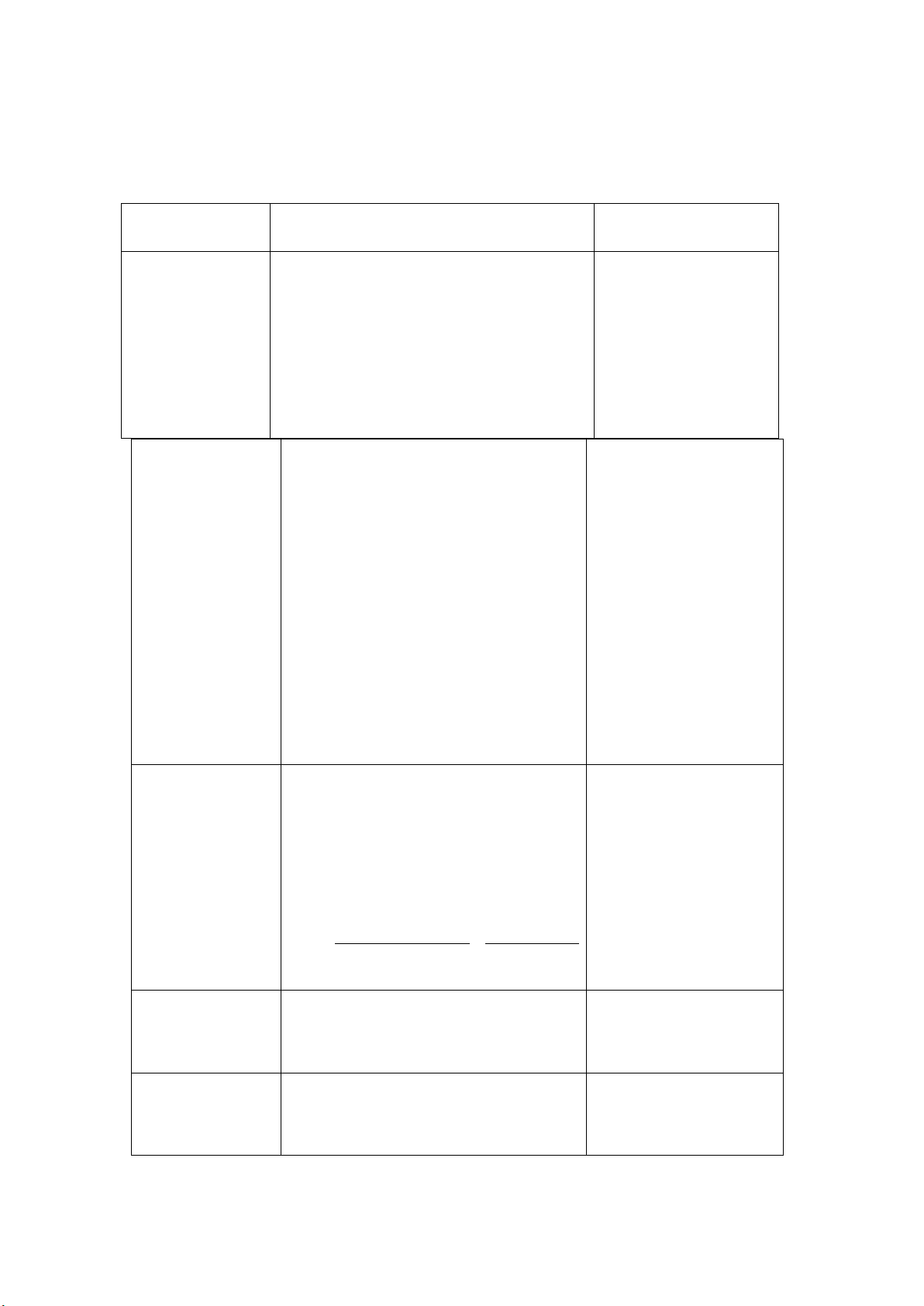
Dung dịch K2Cr2O7 0.025N | C ×V mL ×Đ×100 C ×V mL mc ân= N 1000×p = N10×p×z×M Cân m(g) K2Cr2O7, hòa tan, định mức thành 100 mL | =Dung dịch chuẩn gốc xác định nồng độ chính xác của Na2S2O3 |
III. Tiến hành thực nghiệm
4.1. Xác định lại nồng độ dung dịch chuẩn Na2S2O3 bằng dung dịch chuẩn gốc K2Cr2O7
►
Thực hiện 3 lần thí nghiệm.
Tí
nh thể tí
h Na
2
S
2
O
3
trung
bìn
h, suy ra nồng độ đương
lượng Na
2
S
2
O
3
-
Phản ứng thế
:
Cr
2
O
7
2
−
¿
+
6
I
dư
−
¿
+
14
H
+
¿
→Cr
3
+
¿
+
3
I
2
+
7
H
2
¿
¿
¿
¿
O









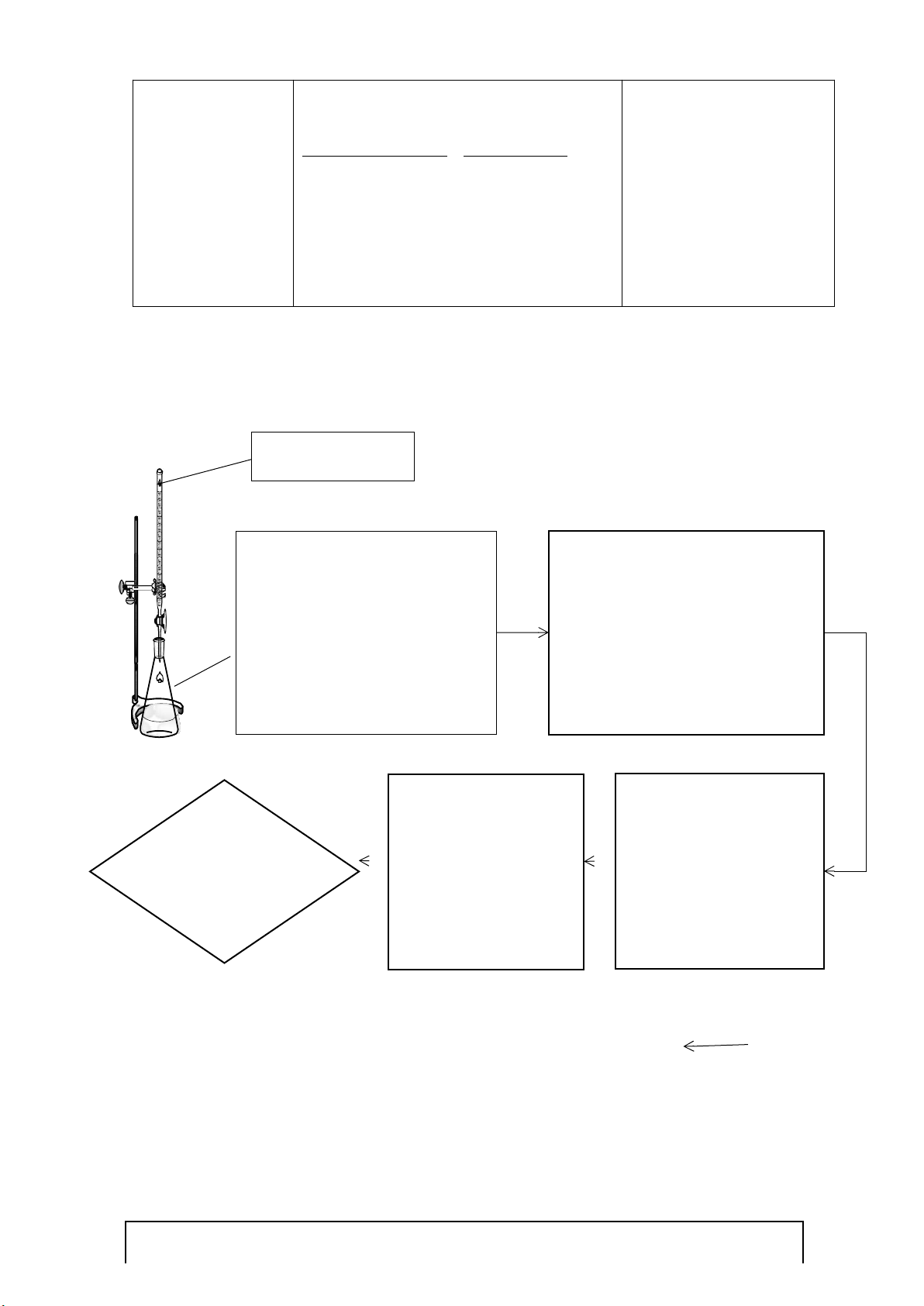
10
ml K
2
Cr
2
O
7
0.025
N
5
mL KI 10%
5
mL H
2
SO
4
4N
10
mL nước cất
Đậy kín để trong tối 10 phút
Na
2
S
2
O
3
0.025N
Chuẩn độ Na
2
S
2
O
3
0.025N đến
khi dung dịch có màu vàng rơm
Cho 3 giọt chỉ thị hồ
tinh bột (dung dịch
xuất hiện màu xanh
tím)
Tiếp tục chuẩn độ đến
khi mất màu xanh tím
Ghi nhận
V
Na
2
S
2
O
3
)
mL
(
- Phản ứng chuẩn độ:
2−¿¿
I−¿+2S2O23−¿↔2I−¿+S4O6 ¿¿¿
3
4.2. Xác định hàm lượng oxy hòa tan DO
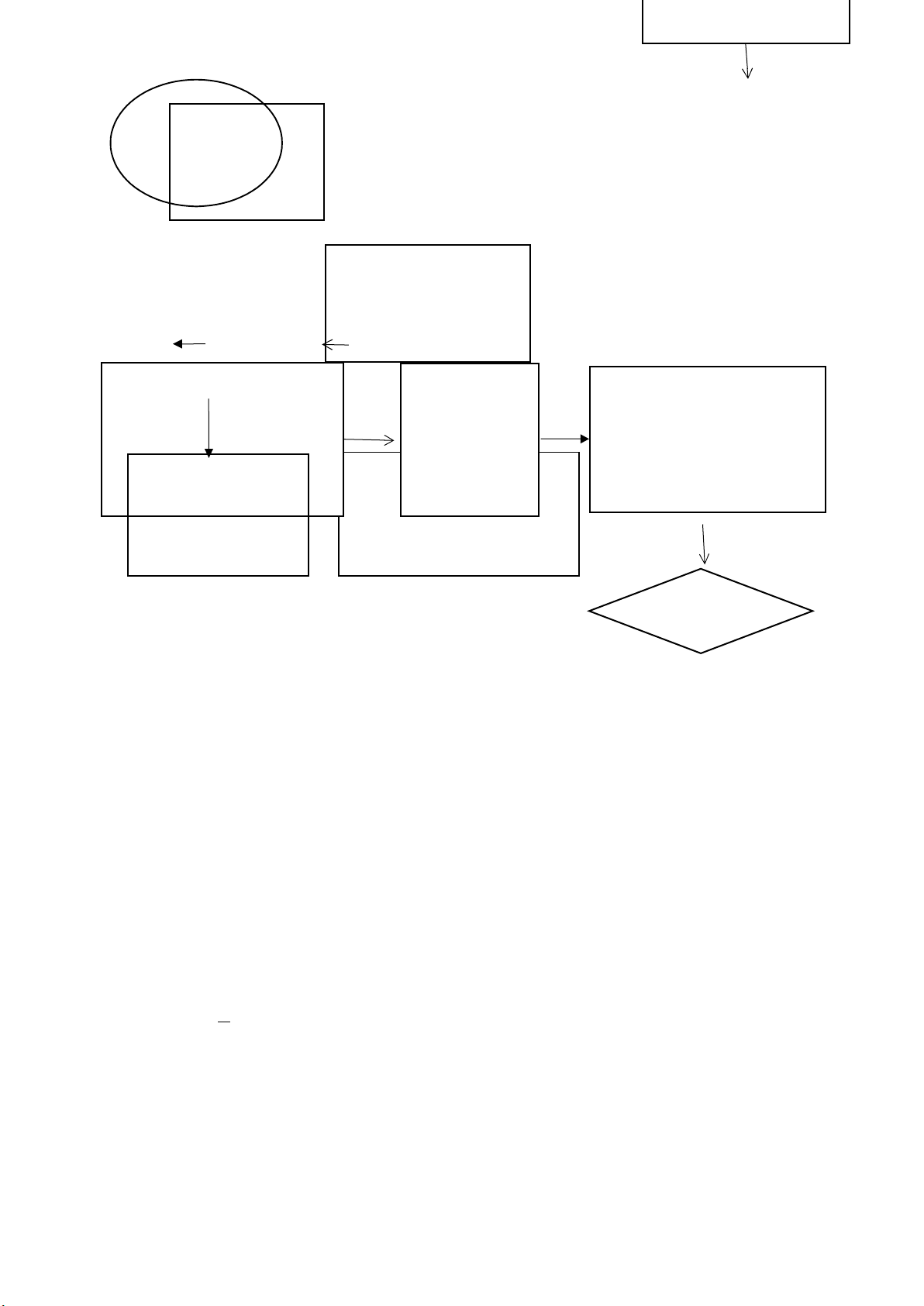
Thêm 2 mL MnSO4 , 2 mL kiềm
Azur
Lấy mẫu đầy chai DO |
| |||
| ||||
Để yên kết tủa lắng hoàn
toàn
Rót bỏ 97 mL
Đậy nút, rửa chai, đảo chai
để kết tủa tan hoàn toàn
Chuẩn độ phần còn lại bằng
Na
2
S
2
O
3
0.025N, cho vào đó
vài giọt chỉ thị hồ tinh bột
Để kết tủa lắng thêm
2
mL H
2
SO
4
đậm đặc
V
Na
2
S
2
O
3
5.2. Xác định hàm lượng oxy hòa tan DO
Hàm lượng oxy hòa tan (DO) trong mẫu được xác định như sau:
DO(mg/L)=¿¿¿
Trong đó: CN: Nồng độ đương lượng của Na2S2O3 (N)
V: Thể tích trung bình của Na2S2O3 (mL)
DO: Số đương lượng của oxi
Vm = 203: Thể tích dung dịch mẫu (mL)
IV. Trả lời câu hỏi
6.1.Viết đầy đủ các phương trình phản ứng trong bài thực hành
Mn2+ + 2OH− → Mn(OH)2 ( tủa trắng)
Mn2+ + 2OH− + 1/2O2 → MnO2 + H2O
MnO2 + 2I− + 4H+ → Mn2+ + I2 + H2O
2Na2S2O3 + I2 → Na2S4O6 + 2NaI ( không màu )
3+¿+3 I +7 H ¿ 2 2
- Phản ứng thế: Cr2O27−¿+6I−dư¿+14H+¿→Cr ¿¿¿O
2−¿¿
- Phản ứng chuẩn độ: I−3¿+2S2O23−¿↔2I−¿+S4O6 ¿¿¿
6.2. Giải thích vai trò của từng hóa chất đã sử dụng trong bài thực hành
- Dung dịch Mn2+: Chất khử phản ứng với oxy hòa tan trong mẫu
- Dung dịch kiềm Azur: Che sự ảnh hưởng của ion nitrit
- Dung dịch K2Cr2O7 0.025N: Dung dịch chuẩn gốc xác định nồng độ chính xác của Na2S2O3 0.025N
- Dung dịch hồ tinh bột: Chất chỉ thị để nhận biết điểm tương đương
- Dung dịch H3PO4 đậm đặc: Che sự ảnh hưởng của Fe3+
6.3. Chứng minh công thức tính DO
2 mL MnSO4 Đậy nắp 2 mL H2SO4 Đậy nắp
Mẫu 304 mL 300 mL 302 mL 300 mL
2 mL kiềm
203 mL Azur Rót bỏ 97 mL
Ta có: ¿¿(1)
¿¿(2)
¿¿(3)
Từ (1), (2), (3) ¿¿
'
O2(mg/L)=VmmẫuO2 ×F1×F2=nV ×O2 ×D10−O32 ×F1×F2(mg/L)
¿¿¿¿
Mà: ¿¿ O2(mg/L)=¿¿
0.025×V Na2S2O3
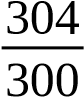
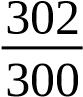
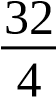 ¿ −3 ×××=1×V Na2S2O3(mg/L)
¿ −3 ×××=1×V Na2S2O3(mg/L)
203×10
Vậy 1 mL Na2S2O3 0,025N đã dùng = 1 mg oxi/lít.



