

Preview text:
BÀI: XÁC ĐỊNH HÀM LƯỢNG NITROGEN - NITRIT (N -
NO2) TRONG MẪU NƯỚC
- Nguyên tắc
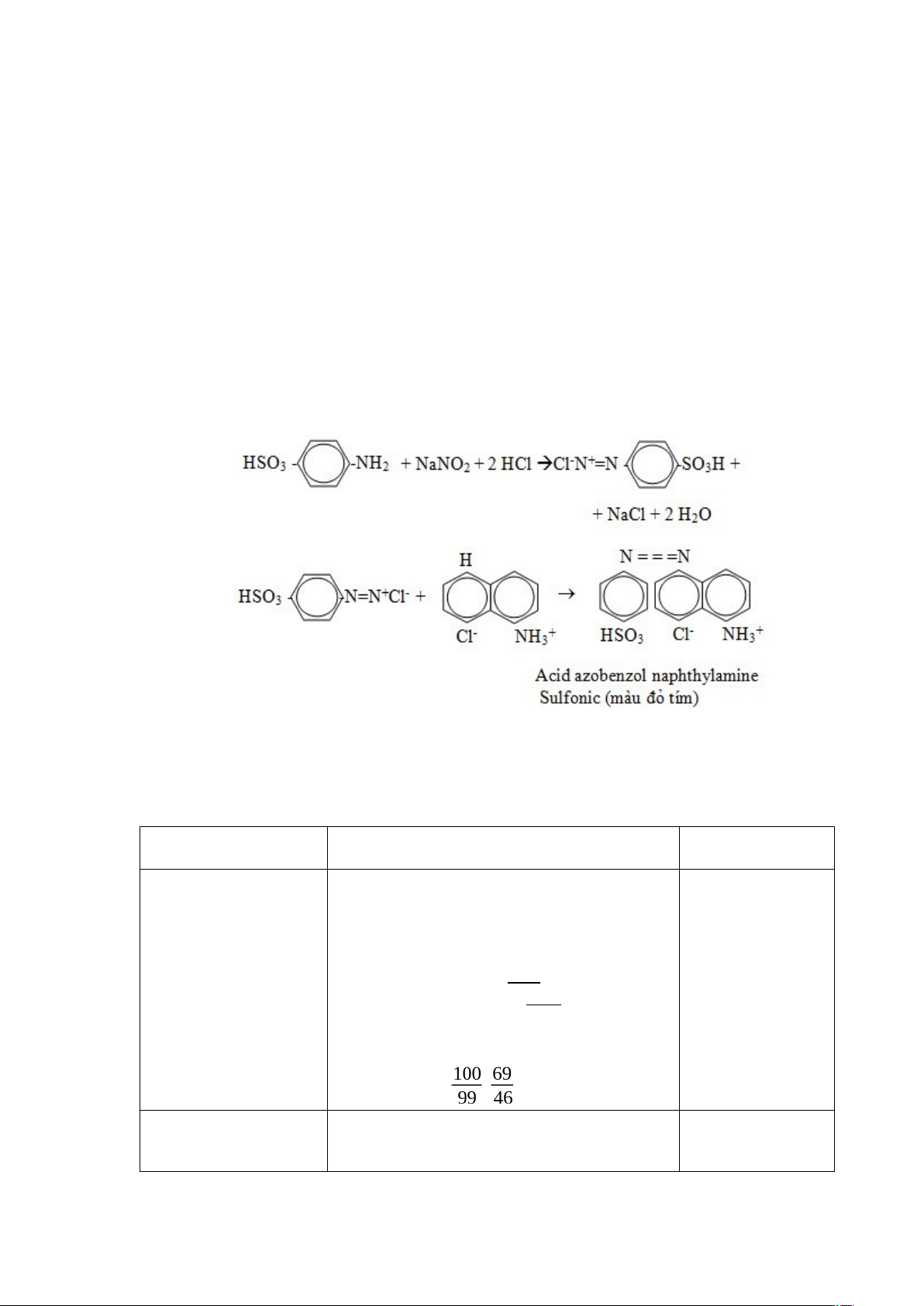
Trong môi trường acid, NO2- được giải phóng sẽ diazo hóa acid sunfanilic. Chất diazo hình thành sẽ kết hợp với α-naphtylamin thành α-naphtylamin azobenzen sunfonic có màu hồng đỏ ở pH = 2 - 2.5 và hấp thu cực đại ở bước sóng 520 nm. Hàm lượng nitrit tỉ lệ với cường độ màu của hợp chất diazo, bằng cách xây dựng đường chuẩn ta có thể xác định được hàm lượng nitrit có trong mẫu. Phương pháp diazo thích hợp khi xác định hàm lượng N - NO2 từ 1 – 25 mg/g.
- Hóa chất, dung cụ và thiết bị
3.1. Hóa chất
Tên hóa chất | Cách pha | Vai trò |
Dung dịch chuẩn gốc NO−2 ¿100μg/m L¿ | Cân m(g) NaNO2 tinh khiết, hòa tan, định mức đến 1000mL bằng nước cất. 100 M m=C ppm×V dd× p × Mionpt ×10−6 ¿100×100× | Dung dịch chất chuẩn gốc |
Dung dịch chuẩn làm việcNO−2 ¿1μg/m L¿ | Hút V(mL) dung dịch chuẩn gốc, hòa tan, định mức đến 1000mL bằng nước | Dung dịch chuẩn làm việc |
1
cất. C ×V V2= 1C2 1=1×1001000=10(mL) | ||
Thuốc thử α−naphtylamin | Hòa tan 0.6g trong 100mL CH3COOH 6M | Thuốc thử tạo màu để xác định Nitrit |
Dung dịch Acid sulfanilic 1% | Cân m(g) acid sulfanilic, hòa tan trong 32.5 mL HCl đậm đặc và định mức đến 500 mL bằng nước cất. C%×m mcân= 100 dd =1×10500=5(g) | Phản ứng với nitrit tạo hợp chất trung gian (azo) |
Dung dịch độn acetat | Cân 16.4 (g) CH3COONa, hòa tan định mức đến 100mL bằng nước cất. C×V × Đ mcân= 10× p | Tạo môi trường pH = 2 -2.5 |
- Tiến hành thí nghiệm
Bình định mức 50 mL | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
Dung dịch chuẩn 1μg/ mL NO2- | 0 | 0.5 | 1 | 2 | 4 | 6 | 10 |
Bình mẫu (mL) | 20 - 35 | ||||||
Dung dịch Sulfanilamide (mL) | 1 | ||||||
Lắc đều dung dịch, để yên 10 phút | |||||||
Dung dịch α-Napthylamin 0,04 M (mL) | 1 | ||||||
Dung dịch độn acetat, mL | 1 | ||||||
Lắc đều để yên 20 phút và định mức 50 ml bằng nước cất | |||||||
Đo ở bước sóng 520nm Dựng đồ thị A= f(C) xác định được hàm lượng C nitrit có trong mẫu | |||||||
5.2. Phân tích mẫu
2
v Ta có: Hàm lượng NO2 được tính theo công thức sau:
V đm
NO2(mg/L)=Cx × V xđ
Trong đó: Cx là hàm lượng NO2- suy ra từ dãy chuẩn
v Mẫu:
V mẫu (mL) VVđm đo (mL)
v Chuẩn: Tạo phức
Vchuẩn (mL) VVđm đo (mL)
Tạo màu
Giả sử phương trình đường hồi quy có dạng A = bC + a, mg/L
CVđo= Axb−a ,mg/L
CVhút=CVđo × VVmẫuđo = Axb−a ×VVmẫuđo ,mg/L
► Kết luận: Theo QCVN 01:2009/BYT, hàm lượng NO2 cho phép trong nước không vượt quá 3mg/L. Hàm lượng NO2 (mg/L) có trong mẫu nước tính được từ thực nghiệm là 0.0214 mg/L nên suy ra chất lượng nước đạt yêu cầu.
VI. Trả lời câu hỏi
6.1. Phân tích một mẫu nước ngầm, kết quả hàm lượng nitrit cao có thể kết luận gì?
- Theo QCVN 09-MT-2015/BTNMT– quy chuẩn về chất lượng nước dưới đất – quy định hàm lương Nitrit trong nước không vượt quá 1 mg/L, nếu hàm lượng nitrit cao thì
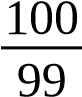 ×
×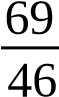 ×10−6 = 0.0152g
×10−6 = 0.0152g


