

Preview text:
Ca 4-5, thứ 5, Nhóm 1
Nguyễn Văn Phương-22000473 Nguyễn Lương Mỹ-22000457 Trịnh Thu Minh-18001959 Đỗ Thị Thuỷ-22000484
Trần Thị Hồng Nhung-22001129
BÁO CÁO THỰC HÀNH SINH LÝ HỌC THỰC VẬT
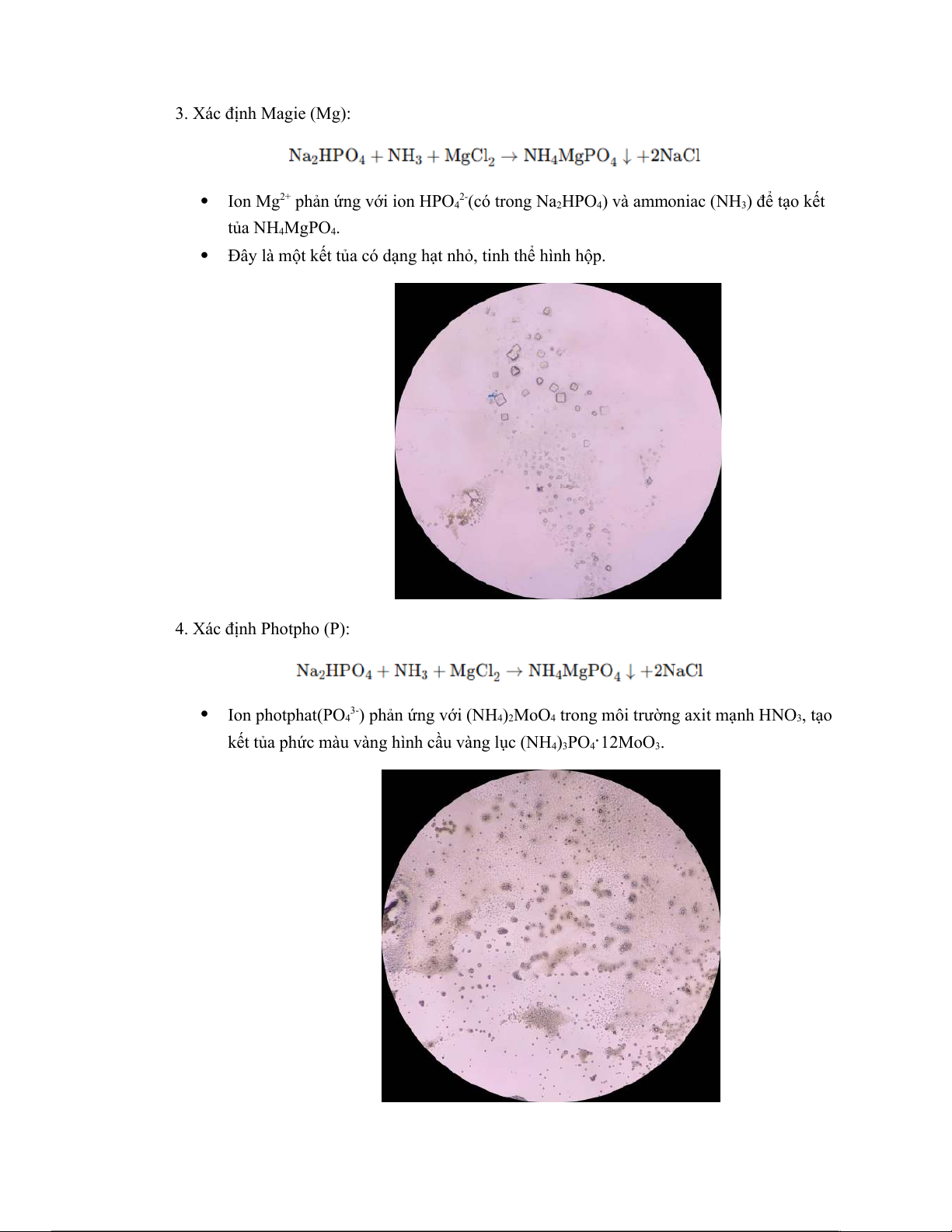
Bài 7: Định tính khoáng trong lá thuốc lá bằng phương pháp hoá học 1. Xác định Kali (K):
Muối Na2PbCu(NO2) là một phức chất nitrit chứa ion Pb và Cu. Khi KCl đượ 6 c thêm
vào, ion K+ thay thế Na+ trong phức tạo ra Na2PbCu(NO2) .6
Phức mới có màu sắc đặc trưng (đa giác sẫm màu), giúp xác định sự hiện diện của ion K+. 2. Xác định Canxi (Ca):
Khi axit sulfuric phản ứng với muối canxi (như CaCl ), ion Ca2+ 2 kết hợp với ion SO 2-
4 để tạo kết tủa CaSO . 4
CaSO4 là một chất rắn ít tan trong nước (độ tan thấp), tạo ra hiện tượng kết tủa trắng(bó kim vô sắc). 3. Xác định Magie (Mg):
Ion Mg2+ phản ứng với ion HPO 2- 4 (có trong Na2HPO ) và amm 4 oniac (NH3) để tạo kết tủa NH4MgPO .4
Đây là một kết tủa có dạng hạt nhỏ, tinh thể hình hộp. 4. Xác định Photpho (P): Ion photphat(PO 3-
4 ) phản ứng với (NH4)2MoO trong môi trường axit mạnh HNO 4 , tạo 3
kết tủa phức màu vàng hình cầu vàng lục (NH4)3PO4∙12MoO .3 5. Xác định Sulfur (S): Ion sunfat(SO 2- 2+
4 ) phản ứng với ion stronti(Sr ) trong dung dịch, tạo kết tủa trắng SrSO4.
SrSO4 là một muối không tan, có cấu trúc tinh thể hình cầu màu trắng đục. 6. Xác định Sắt (Fe): Hexacyanoferrat (II) kali (K 3+
4[Fe(CN)6]) phản ứng với ion Fe trong muối sắt(III)
clorua(FeCl3) tạo phức Fe [Fe(CN) 4 6] . 3
Phức này có màu xanh đặc trưng, dễ dàng nhận ra bằng mắt thường.



