





Preview text:
BÁO CÁO THÍ NGHIỆM BÀI 6
ĐIỆN HÓA HỌC – PHẢN ỨNG OXY HÓA KHỬ Ngày TN: 15/05/2022 Lớp: 07CLC Nhóm: 03
Họ tên thành viên: Nguyễn Thu Hương – 21128305
Huỳnh Văn Khang – 21128306
Quách Hiếu Thảo – 21128075
1. KẾT QUẢ THÍ NGHIỆM:
1.1. Thí nghiệm 1 – Chiều của phản ứng oxy hóa khử Cách tiến hành:
a) Cho vào ống nghiệm 5 – 6 giọt dung dịch KMnO4 0,05N + 2 – 3 giọt dung dịch H2SO4
2N. Sau đó cho từng giọt dung dịch NaNO2 0,1N. Quan sát sự đổi màu của dung dịch,
nếu dung dịch mất màu tím, chứng tỏ phản ứng xảy ra.
b) Cho vào ống nghiệm 5 – 6 giọt KMnO4 0,05N + 2 – 3 giọt dung dịch H2SO4 2N. Sau
đó cho từng giọt dung dịch FeSO4 0,1N. Quan sát sự đổi màu của dung dịch, nếu dung
dịch bị mất màu tím, chứng tỏ phản ứng xảy ra.
c) Cho vào ống nghiệm 5 – 6 giọt dung dịch FeCl3 0,1N + 2 – 3 giọt dung dịch KBr
0,1M. Lắc nhẹ, quan sát hiện tượng và giải thích.
Kết quả thí nghiệm: Ống nghiệm Hiện tượng Phản ứng- Giải thích N5+/N3+ = 0,94V Mn7+/Mn2+ = 1,51V
Dung dịch KMnO4 từ Áp dụng quy tắc α thì Mn7+ có E0 lớn hơn nên 1
màu tím chuyển dần sang sẽ oxy hóa N3+ tạo thành Mn2+ và N5+ không màu.
2KMnO4 + 5NaNO2 +3H2SO4 5NaNO3 +K2SO4 +2MnSO4 +3H2O Fe3+/Fe2+ = 0,77V Mn7+/Mn2+ = 1,51V Dung dịch KMnO4 từ
Áp dụng quy tắc α thì Mn7+ có E0 lớn hơn nên
màu tím chuyển sang nhạt 2
sẽ oxy hóa Fe3+ tạo thành Mn2+ và Fe2+ dần và chuyển sang màu vàng.
2KMnO4+10FeSO4+8H2SO4 5Fe(SO4)3+ K2SO4 +2MnSO4+8H2O Fe3+/Fe2+ = 0,77V Br
Không có hiện tượng gì 2/Br- = 1,06V 3
xảy ra, dung dịch vẫn giữ Áp dụng quy tắc α do Fe3+ có EO nhỏ hơn màu vàng.
nên không thể oxy hóa Br -
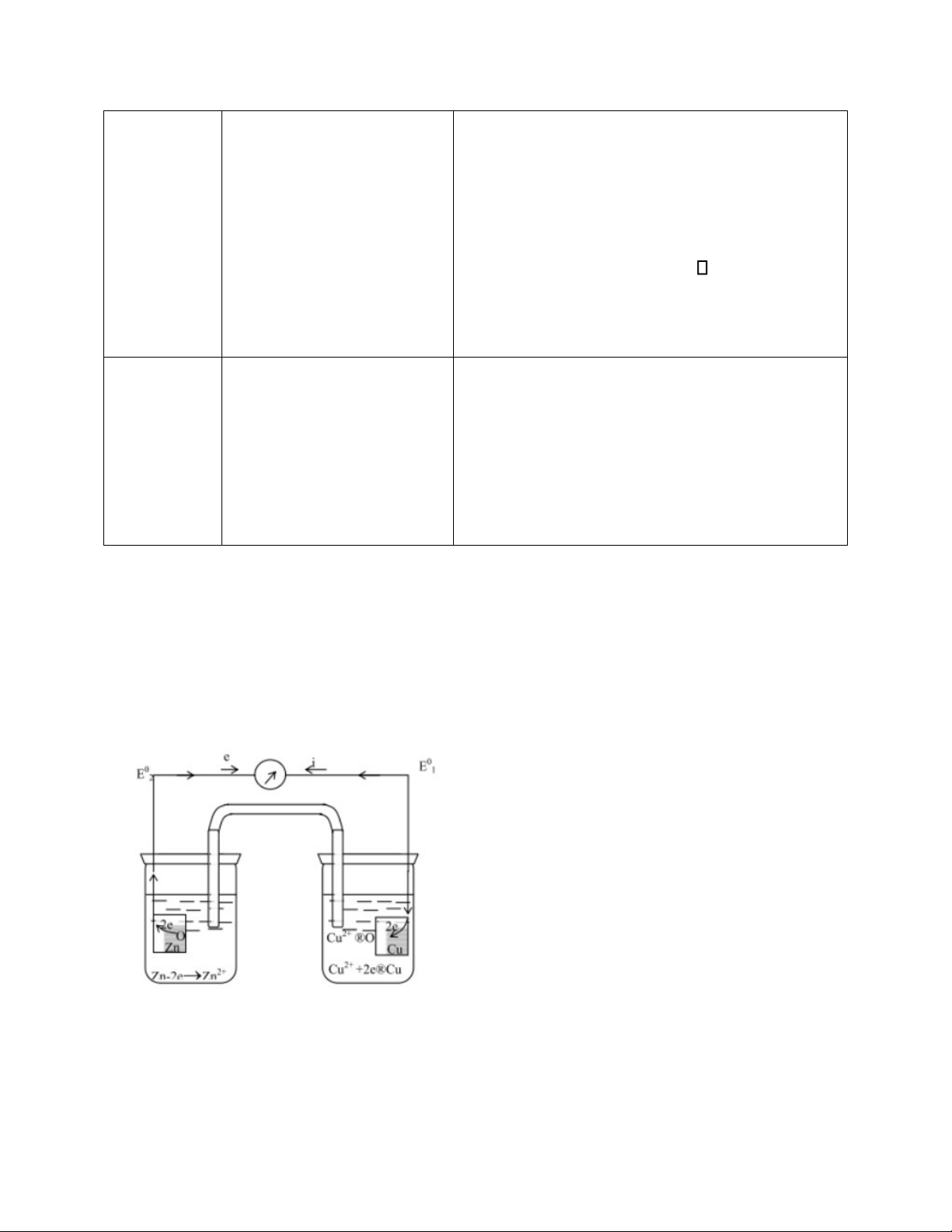
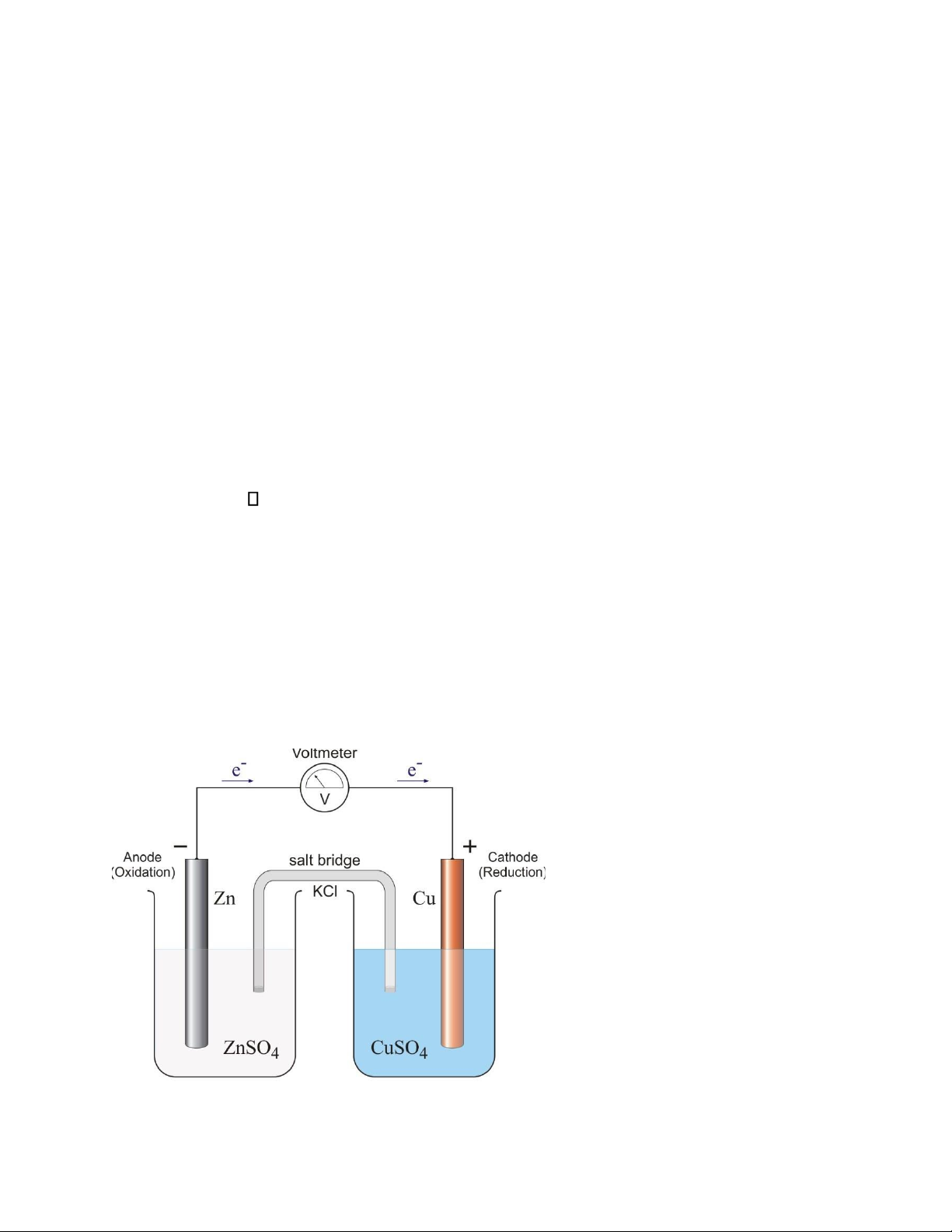
1.2. Thí nghiệm 2 – Sức điện động của nguyên tố Galvanic Cu – Zn: Cách tiến hành:
-Rửa sạch 2 điện cực đồng và kẽm bằng nước, dùng giấy lọc thấm khô. -Lắp pin như hình vẽ:
Ở thí nghiệm này, dùng cực đồng cắm vào ống nghiệm chứa dd CuSO4 1M, ống nghiệm
kia dùng cực kẽm cắm vào dd ZnSO4 1M.
Nối 2 ống nghiệm bằng 1 ống thủy tinh cong chứa KCl bão hòa. Tránh không để bọt khí bên trong ống.
-Dùng volt kế đo sức điện động của pin Cu – Zn.
-So sánh kết quả thực nghiệm với lý thuyết. Viết sơ đồ mạch điện và giải thích sự hoạt động của pin.
Kết quả thí nghiệm: *E (V) đo: 1,05V
*So sánh kết quả thực nghiệm với lý thuyết – Giải thích:
+Sức điện động lý thuyết: E = E0Cu2+/Cu – E0Zn2+/Zn = +0,34V – (-0,76V) = +1,1V
+So sánh: Sức điện động của nguyên tố Galvanic Cu – Zn thực nghiệm thấp hơn so
với lý thuyết. E = 0,05V
+Giải thích: Kết quả thực nghiệm nhỏ hơn lý thuyết vì:
Dung dịch pha không chuẩn
Nhiệt độ đo không chuẩn
Vôn kế có độ chính xác không cao
*Ký hiệu pin: (-)Zn|Zn2+(1)||Cu2+(1)|Cu(+) *Sơ đồ mạch điện:
*Giải thích sự hoạt động của pin:
-Cấu tạo: Nguyên tố Galvanic được cấu tạo từ hai điện cực nối với nhau bằng một cầu
muối. Điện cực 1 gồm 1 thanh Zn nhúng trong dung dịch ZnSO4. Điện cực 2 gồm 1
thanh Cu nhúng trong dung dịch CuSO4. -Hoạt động của pin:
Ở điện cực kẽm: xảy ra quá trình oxy hóa kẽm,được biểu diễn bằng bán phản ứng: Zn - 2e→ Zn2+
Ở điện cực đồng: xảy ra quá trình khử ion Đồng ,được biểu diễn bằng bán phản ứng: Cu2+ + 2e→ Cu
Trong toàn bộ nguyên tố Galvanic diễn ra phản ứng: Zn + Cu2+ →Zn2+ + Cu
Dòng e tại Zn chạy Cu tạo thành 1 pin.
Vai trò của cầu muối: để duy trì quá trình hoạt động của pin điện hóa, trung hòa điện tích
của 2 dung dịch: các ion dương Na+ và Zn2+ di chuyển qua cầu muối để đến cốc đựng dung dịch CuSO 2-
4. Ngược lại, các ion SO4 di chuyển qua cầu muối đến dung dịch ZnSO4.
1.3. Thí nghiệm 3 – Pin nồng độ: Cách tiến hành:
Chuẩn bị 4 ống nghiệm và lần lượt cho vào 4 ống nghiệm 0, 1, 2, 3 những lượng hóa chất như bảng sau: Ống 0 1 2 3 CuSO4 1M, mL 15 12 9 6 H2O, mL 0 3 6 9
Đo sức điện động của nguyên tố Galvanic tạo thành giữa ống 0 (tạo bởi điện cực Cu
nhúng trong dung dịch CuSO4 1M) với lần lượt các ống 1, 2 và 3 (dùng điện cực Cu).
Kết quả thí nghiệm:
-So sánh kết quả thực nghiệm với lý thuyết – Giải thích: Pin 1 2 3 E (mV) 0 – 1 0 – 2 0 – 3 Eo , thực tế, V 0,01 0,005 0,0094 Eo , lý thuyết, V 2.86.10-3 6,55.10-3 0,012 Sai số. % -Sơ đồ mạch điện:
-Giải thích hoạt động của pin:
Ở anod: xảy ra quá trình oxy hóa đồng,được biểu diễn bằng bán phản ứng: Cu - 2e→ Cu2+
Ở catod: xảy ra quá trình khử ion đồng ,được biểu diễn bằng bán phản ứng: Cu2+ + 2e→ Cu
Dòng e chạy từ Cu ở anod sang Cu ở catod tạo thành 1 pin.
1.4. Thí nghiệm 4 – Điện phân dung dịch NaCl: Cách tiến hành
Dụng cụ điện phân là 1 ống chữ U, điện cực sử dụng là điện cực than graphite.
Đổ dung dịch NaCl 1M vào ống chữ U đến khi ngập qua các điện cực. Nhỏ vào mỗi
nhánh của ống chữ U 1 giọt phenolphtalein.
Nối 2 cực với nguồn điện 1 chiều.
Quan sát kỹ hiện tượng xảy ra ở 2 cực (có bọt khí thoát ra hay không? Màu sắc xung quanh 2 điện cực.
Kết quả thí nghiệm:
a) Mô tả hiện tượng: -Tại cực (-): Na+ , H2O 2H2O + 2e H2 + 2OH-
Phenolphtalein hóa hồng, có bọt khí bay lên. -Tại cực (+): Cl- , H2O 2Cl- - 2e Cl2 Có bọt khí bay lên.
b) Viết sơ đồ điện phân: NaCl Catod (+) Anod (-) Cl- , H2O Na+ , H2O 2Cl- - 2e Cl2 T H2O + e H2 T + OH- 2NaCl + 2H2O 2NaOH + Cl2 + H2
1.5. Thí nghiệm 5 – Điện phân dung dịch CuSO4 Cách tiến hành:
Làm sạch và làm khô 2 điện cực than. Dùng cân 4 số lẻ ghi nhận khối lượng của điện cực làm catot.
Làm lại thí nghiệm giống thí nghiệm 3.4 nhưng thau NaCl bằng CuSO4. Thực hiện điện
phân trong thời gian chính xác khoảng 1 – 2 phút cho đến khi Cu bám đều trên catot.
Quan sát hiện tượng. Làm khô điện cực bằng giấy lọc và xác định khối lượng Cu bám lên trên điện cực.
Kết quả thí nghiệm:
a) Mô tả hiện tượng:
Tại cực âm (-): Cu2+, H2O Cu2+ + 2e Cu
Có lớp đồng bám lên bề mặt điện cực Tại cực dương (+): 4 SO 2- 2 , H O H2O – e 2H+ + 1/2O2 T Có bọt khí thoát lên
b) Viết sơ đồ điện phân CuSO4 Catod (+) Anod (-) SO 2- 4 , H2O Cu2+ , H2O H2 O – e 2H+ + 1/2O 2 T Cu2+ + 2e Cu
➔ CuSO4 + H2O Cu + H2SO4 + 1/2O2
1.6. Thí nghiệm 6 – Điện phân dung dịch CuSO4 với điện cực hòa tan: Cách tiến hành:
Làm lại thí nghiệm giống thí nghiệm 3.4 nhưng thay NaCl bằng CuSO4. Để yên cho đến
khi Cu bám đều trên một điện cực than.
Đổi điện cực từ (-) thành (+) và ngược lại. (Lưu ý: đổi dây điện chứ không phải đổi vị trí
các điện cực). Quan sát hiện tượng.
Kết quả thí nghiệm:
a) Mô tả hiện tượng khi đảo cực:
Tại cực âm (-): Cu bám tại cực âm tan dần, có bọt khí thoát ra
Tại cực dương (+): Ngưng sủi bọt khí, Cu bám vào điện cực
b) Viết sơ đồ điện phân: CuSO4 Catod (+) Anod (-) Cu2+ + 2e Cu Cu – 2e Cu2+ 2O2- - 4e O2 2. CÂU HỎI:
2.1. Phương trình Nernst cho thế điện cực. Công thức tính sức điện động của nguyên tố Galvanic?
-Phương trình Nernst cho thế điện cực:
E = Eo + (RT/nF) ln([dạng Oxy hóa]a/[dạng Khử]b)
Trong đó E0: thế điện cực tiêu chuẩn ở 250C và nồng độ các dạng khử và oxy hóa bằng 1.
Ở 25oC thì E = Eo + (0,059/n) lg([Oxy hóa]/[Khử]). Với n là số electron trao đổi.
Đối với kim loại ta có: E= EO +(0,059/n) lg[Mn+]
-Công thức tính sức điện động của nguyên tố Galvanic: E = E(+) - E(-)
2.2. Tại sao trong điện phân không thể dùng dòng điện xoay chiều?
Không thể dùng dòng điện xoay chiều vì trong dòng điện xoay chiều không thể xác định
được cực âm, cực dương Không thể xác định được chiều dòng điện đi như nào.
2.3. Các yếu tố nào có thể gây ra sai số trong Thí nghiệm 3 và Thí nghiệm 5?
Các yếu tố gây sai số là:
-Dòng điện không ổn định -Thời gian điện phân
-Cân khối lượng Cu khi Cu chưa khô
2.4. Tại sao Thí nghiệm 4 phải tiến hành trong tủ Hood?
Vì trong quá trình điện phân, ở catod có sinh ra khí clo, đây là khí độc gây khó thở, ảnh
hưởng đến phối nên cần phải tiến hành trong tủ Hood.