




Preview text:
TRƯỜNG ĐẠI HỌC BÁCH KHOA
ĐẠI HỌC QUỐC GIA TPHCM
------------------------
Giáo viên hướng dẫn: Võ Nguyễn Lam Uyên Nhóm: 8
L ớ p : HC17HC07
Thành viên:
Nguyễn Thị Thanh Ngân (1712287)
Nguyễn Thị Thu Ngân (1712288)
Nguyễn Khánh Linh (1711962)
Năm học: 2017 – 2018
Báo cáo thí nghiệm Hóa Đại cương
BÀI 2: NHIỆT PHẢN ỨNG I. Thực hành:
1. Xác định nhiệt dung của nhiệt lượng kế:
- Công thức cần dùng: Q = (moco + mc) Δt (2.1) - Trong đó:
moco: nhiệt dung của nhiệt lượng kế (cal/độ)
mc: nhiệt dung của dung dịch trong nhiệt lượng kế (cal/độ) - Chú ý: m: cân/đo thể tích c: tra sổ tay
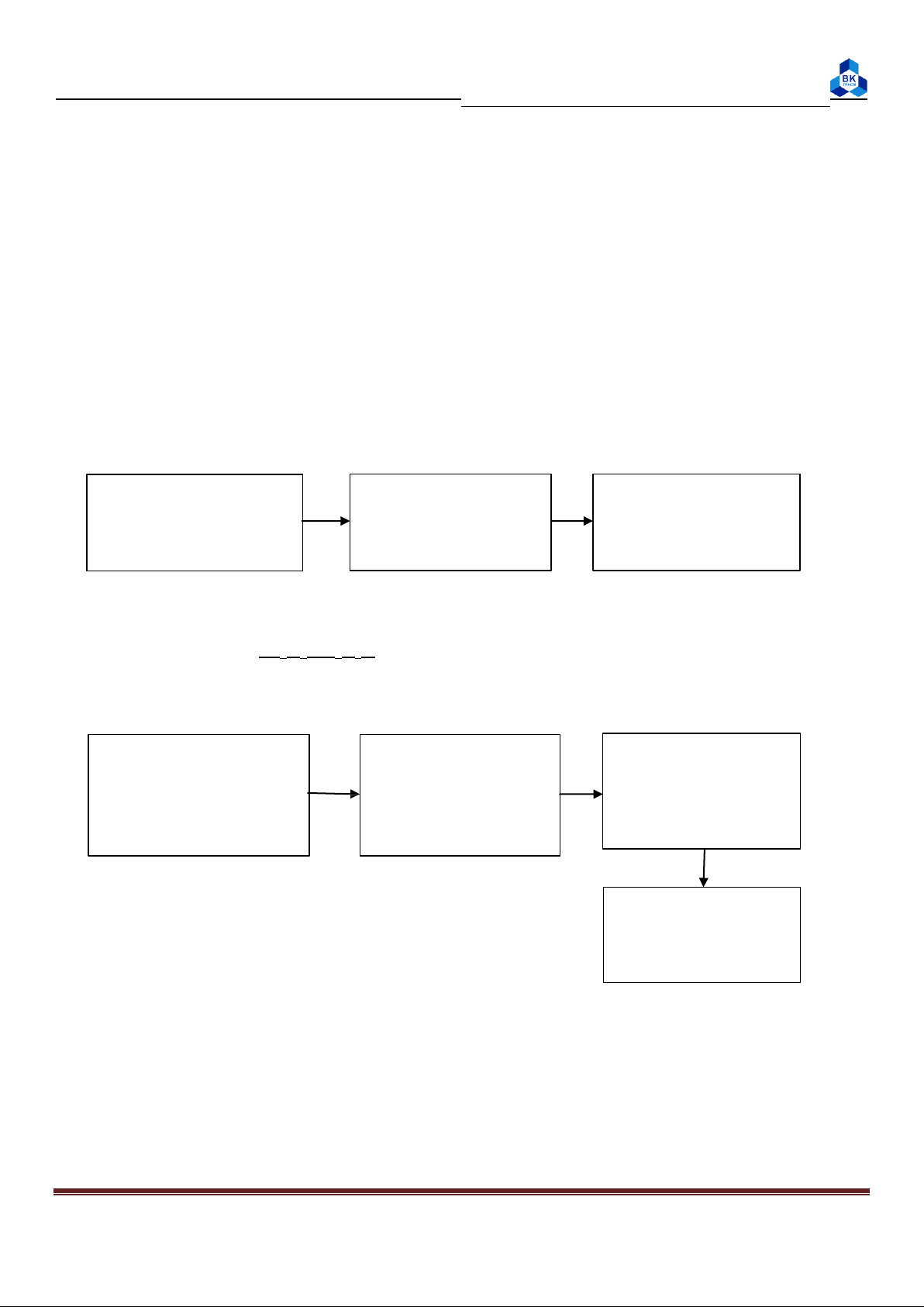
moco: xác định bằng thực nghiệm - Các xác định moco: t1 t2 t3
50ml nước ở nhiệt độ 50ml nước ở 60 oC Dùng phễu đổ t1 vào phòng cho vào becher cho vào NLK 2 t , để 2 phút 2
Khi đó: Nhiệt do nước nóng và becher tỏa ra = nhiệt nước lạnh hấp
thu (mc + moco)(t2 – t3) = mc(t3 – t1) ((t3-t1)-(t2-t3)) moco = mc
(2.2) trong đó: m – khối lượng 50ml nước (t2-t3)
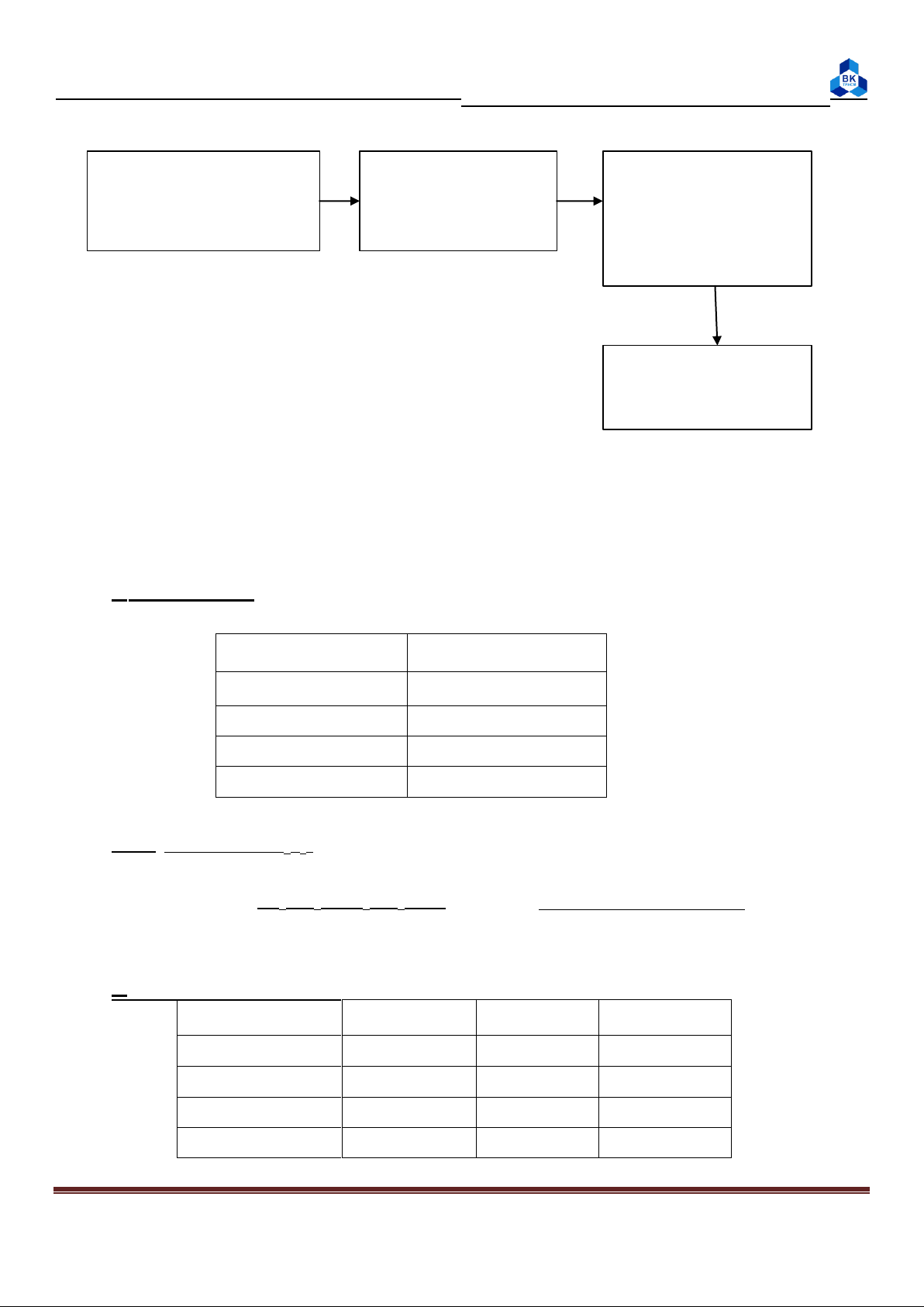
2. Xác định hiệu ứng nhiệt của phản ứng trung hòa HCl và NaOH: t1 t2 t3 Dùng buret lấy 25ml Dùng buret lấy Dùng phễu đổ dd NaOH vào becher 25ml dd HCl 1M nhanh t1 vào t2, 100ml vào NLK khuấy đều Tìm Q theo công thức C (2.1) ΔH
muối 0,5M = 1 cal/độ, D = 1,02 g/ml Page 2
Báo cáo thí nghiệm Hóa Đại cương
3. Xác định nhiệt hòa tan CuSO4 khan – kiểm tra định luật Hess: t1 t2 Cho 50ml nước vào Cân 4g CuSO4 Cho nhanh 4g NLK khan CuSO4 vào NLK, khuấy đều Tìm Q theo công thức (2.1) ΔHht
4. Xác định nhiệt hòa tan NH4Cl
Tương tự mục 3 nhưng thay CuSO4 bằng NH4Cl
II. Kết quả thí nghiệm
Thí nghiệm 1: Xác định nhiệt dung riêng của nhiệt lượng kế. Nhiệt độ oC Lần 1 t1 29 t2 62 t3 46 moco (cal/độ) 3,125
Tính giá trị moco: moco=
mc. (t3 – t1) – (t2 – t3)
= 50.1. (46 – 29) – (62 – 46) =3,125 t2 – t3 62 - 46
Thí nghiệm 2: Xác định hiệu ứng nhiệt của phản ứng trung hòa HCl và NaOH. Nhiệt độ oC Lần 1 Lần 2 Lần 3 t1 29 29 29 t2 29 29 29 t3 31 31 31 Q (cal) 106,25 106,25 106,25 Page 3
Báo cáo thí nghiệm Hóa Đại cương Q trungbinh (cal) 106,25 ΔH (cal/mol) 4250 4250 4250 Q = (m c + m c + m c ) (t (t - 1 + t2) (29 + 29) ) = (3,125 + 25 + 25)(31 - ) o o HCl HCl NaCl NaCl 3 2 2 = 106,25 (cal) Q 106.25 ΔH = = = 4250 (cal/mol) n 0.025 (t Nếu 1 + t2)
t1 ≠ t2 thì Δt tính bằng hiệu số giữa t3 và 2 (Tính mẫu 1 giá trị Q)
Thí nghiệm 3: Xác định nhiệt hòa tan CuSO4 khan, kiểm tra định luật Hess: Nhiệt độ oC Lần 1 Lần 2 Lần 3 t1 29 29 29 t2 34 34 34 Q (cal) 285,625 285,625 285,625 Q trungbinh (cal) 285,625 ΔH (cal/mol) -11425 -11425 -11425 Q = (m –
oco + mH2OcH2O + mCuSO4cCuSO4)(t2 t1) = (3,125 + 50 + 4)(34 – 29) = 285,625 (cal) Q 285.625 ΔH = = = 11425 (cal/mol) n 0.025
Do đây là quá trình tỏa nhiệt nên ΔH mang dấu “ – “.
Thí nghiệm 4: Xác định nhiệt độ hòa tan NH4Cl: Nhiệt độ oC Lần 1 Lần 2 Lần 3 t1 29 29 29 t2 25 25 25 Q (cal) -228,5 -228,5 -228.5 Q trungbinh (cal) -228,5 ΔH (cal/mol) 3056,188 3056,188 3056,188 Page 4
Báo cáo thí nghiệm Hóa Đại cương Q = (m –
oco + mH2OcH2O + mNH4ClcNH4Cl) (t2 t1)
= (3,125 + 50 + 4)(25 – 29) = -228,5 (cal) Q -228.5 ΔH = = = -3056,188 (cal/mol) n 8 107
Do đây là quá trình thu nhiệt nên H mang dấu “+”. III. Câu hỏi: 1. ΔH
O sẽ được tính theo số mol HCl hay
th của phản ứng HCl + NaOH NaCl + H2
NaOH khi cho 25ml dung dịch HCl 2M tác dụng với 25ml dung dịch NaOH 1M? Tại sao? Trả lời: nNaOH = 0,025 mol nHCl = 2.0,025 = 0,05 mol NaOH + HCl NaCl + H2O 0,025 0,025
NaOH phản ứng hết, tính theo NaOH.
2. Nếu thay HCl 1M bằng HNO3 1M thì kết quả thí nghiệm 2 có thay đổi hay không? Trả lời:
Không thay đổi vì HCl và HNO3 đều là axit mạnh, phân li hoàn toàn và đây là phản ứng trung hòa.
3. Tính ΔH3 bằng lí thuyết theo định luật Hess. So sánh với kết quả thí nghiệm. Hãy xem
6 nguyên nhân có thể gây ra sai số trong thí nghiệm này:
- Mất nhiệt do nhiệt lượng kế. - Do nhiệt kế.
- Do dụng cụ đong thể tích hóa chất.
- Do sunfat đồng bị hút ẩm.
- Do lấy nhiệt dung riêng dung dịch sunfat đồng bằng 1 cal/mol.độ.
Theo em, sai số nào là quan trọng nhất? Còn nguyên nhân nào khác không? Trả lời:
- Theo định luật Hess:
ΔH3 = ΔH1 + ΔH2 = -18,7 + 2.8 = -15,9 kcal/mol = -15900 cal/mol - Theo thực nghiệm: Page 5
Báo cáo thí nghiệm Hóa Đại cương ΔH3 = -11425 cal/mol Chênh lệch quá lớn
- Theo em mất nhiệt lượng do nhiệt lượng kế là quan trọng nhất, do quá trình thao
tác không chính xác, nhanh chóng dẫn đến thất thoát nhiệt ra bên ngoài.
- Sunfat đồng khan bị hút ẩm, lấy và cân không nhanh và cẩn thận dễ làm cho
CuSO4 hút ẩm nhanh ảnh hưởng đến hiệu ứng nhiệt CuSO4.5H2O.
BÀI 4: XÁC ĐỊNH BẬC PHẢN ỨNG I. Thực hành:
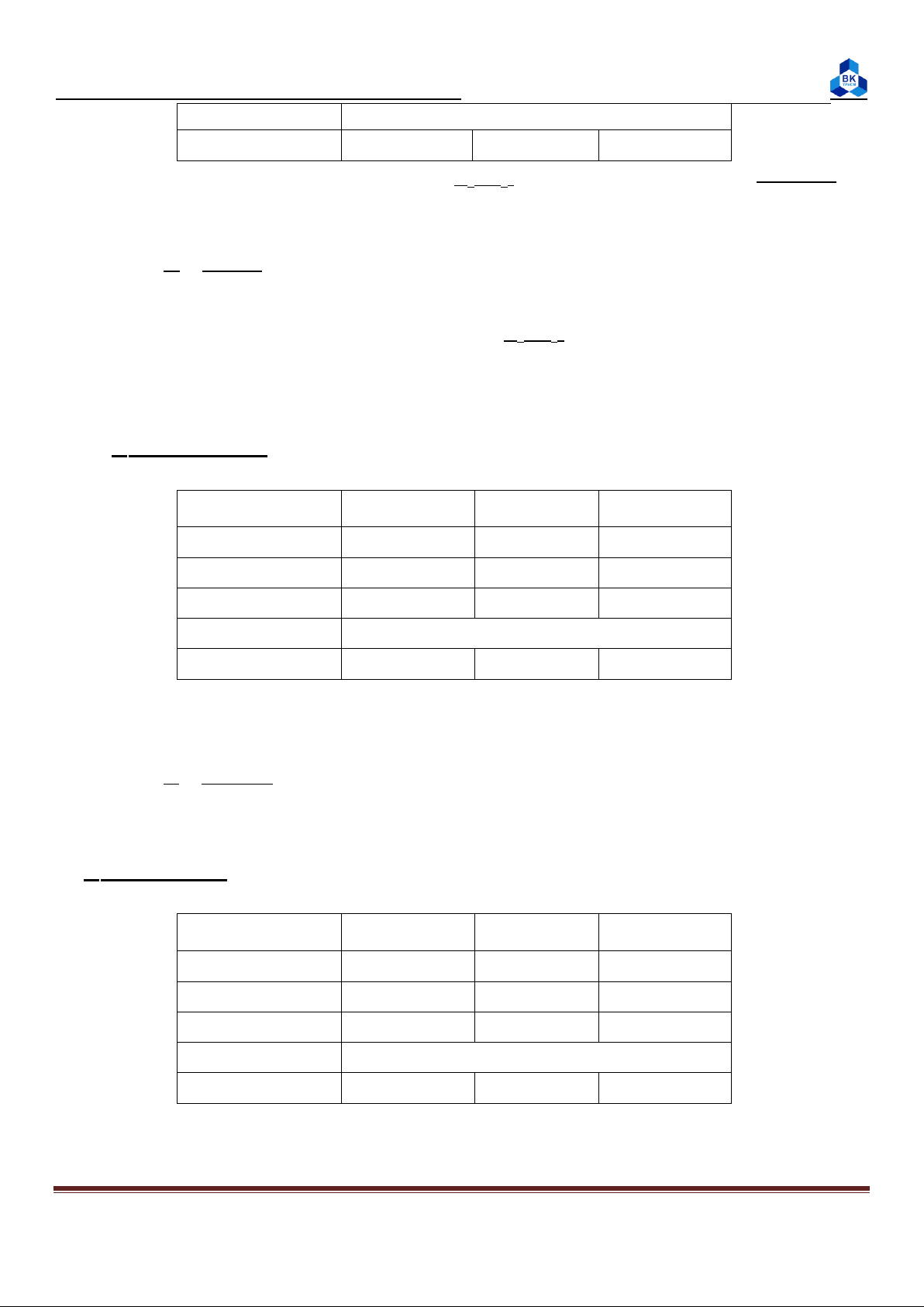
1. Xác định bậc phản ứng theo Na2S2O3: TN Ống nghiệm Erlen V (ml) H2SO4 0,4M V (ml) Na2S2O3 0,1M V (ml) H2O 1 8 4 28 2 8 8 24 3 8 16 16
- Dùng pipet vạch lấy axit cho vào ống nghiệm.
- Dùng puret cho nước vào 3 erlen.
- Sau đó tráng buret bằng Na2S2O3 0,1M rồi tiếp tục dùng puret cho Na2S2O3 vào 3 erlen.
- Lần lượt cho phản ứng từng cặp ống nghiệm và erlen như sau:
o Đổ nhanh axit trong ống nghiệm vào erlen.
o Bấm đồng hồ (khi 2 dung dịch tiếp xúc nhau).
o Lắc nhẹ sau đó để yên quan sát, khi vừa thấy dung dịch chuyển sang đục thì bấm đồng hồ.
- Lặp lại TN lấy giá trị trung bình.
2. Xác định bậc phản ứng theo H2SO4:
Làm tương tự thí nghiệm 1 với lượng axit và Na2S2O3 theo bảng sau: TN Ống nghiệm Erlen V (ml) H2SO4 0,4M V (ml) Na2S2O3 0,1M V (ml) H2O 1 4 8 28 2 8 8 24 3 16 8 16 Page 6
Báo cáo thí nghiệm Hóa Đại cương
II. Kết quả thí nghiệm:
1. Bậc phản ứng theo Na2S2O3: TN
Nồng độ ban đầu (M) Δt1 Δt2 ΔtTB Na2S2O3 H2SO4 1 0,1 0,4 121 123 122 2 0,1 0,4 62 63 63 3 0,1 0,4 29 31 30
Từ ΔtTB của TN1 và TN2 xác định m1 (tính mẫu): t1 lg m t2 0,953 1 lg 2
Từ ΔtTB của TN2 và TN3 xác định m2: t lg 2 t3 m 1,070 2 lg 2 m m 0,953 1,07 1 2
Bậc phản ứng theo Na2S2O3 = 1,0115 2 2
2. Bậc phản ứng theo H2SO4: TN [Na2S2O3] [H2SO4] Δt1 Δt2 ΔtTB 1 0,1 0,4 69 67 68 2 0,1 0,4 63 63 63 3 0,1 0,4 57 56 57
Từ ΔtTB của TN1 và TN2 xác định n1: t1 lg n t2 0,110 1 lg 2
Từ ΔtTB của TN2 và TN3 xác định n2: t lg 2 t3 n 0,144 2 lg 2 Page 7
Báo cáo thí nghiệm Hóa Đại cương 0,110 0,144
Bậc phản ứng theo H 0,127 2SO4 2 2
III. Trả lời câu hỏi:
1. Trong TN trên, nồng độ của Na2S2O3 và của H2SO4 đã ảnh hưởng thế nào lên vận tốc
phản ứng? Viết lại biểu thức tính vận tốc phản ứng. Xác định bậc của phản ứng. Trả lời:
- Nồng độ Na2S2O3 tỉ lệ thuận với tốc độ phản ứng, nồng độ H2SO4 hầu như không
ảnh hưởng đến tốc độ phản ứng.
- Biểu thức tính vận tốc:
V = k.[Na2S2O3]1,0115.[H2SO4]0,127
- Bậc của phản ứng: 1,0115 + 0,127 = 1,1385
2. Cơ chế của phản ứng trên có thể được viết như sau:
H2SO4 + Na2S2O3 Na2SO4 + H2S2O3
H2S2O3 H2SO3 + S
Dựa vào kết quả TN có thể kết luận phản ứng (1) hay (2) là phản ứng quyết định vận
tốc phản ứng tức là phản ứng xảy ra chậm nhất không? Tại sao? Lưu ý trong các TN
trên, lượng axit H2SO4 luôn luôn dư so với Na2S2O3. Trả lời:
- (1) là phản ứng trao đổi ion nên tốc độ phản ứng xảy ra rất nhanh.
- (2) là phản ứng tự oxi hóc khử nên tốc độ phản ứng xảy ra rất chậm.
Phản ứng (2) là phản ứng quyết định tốc độ phản ứng.
3. Dựa trên cơ sở của phương pháp thí nghiệm thì vận tốc xác định được trong các thí
nghiệm trên được xem là vận tốc trung bình hay vận tốc tức thời? Trả lời:
- Vận tốc được xác định bằng ΔC/Δt vì ΔC~0 (biến thiên nồng độ của lưu huỳnh
không đáng kể trong khoảng thời gian Δt ) nên vận tốc trong các thí nghiệm trên
được xem là vận tốc tức thời.
4. Thay đổi thứ tự cho H2SO4 và Na2S2O3 thì bậc phản ứng có thay đổi hay không? Tại sao? Trả lời:
- Thay đổi thứ tự cho H2SO4 và Na2S2O3 thì bậc phản ứng không thay đổi. Ở một
nhiệt độ xác định bậc phản ứng chỉ phụ thuộc vào bản chất của hệ (nồng độ, nhiệt
độ, diện tích bề mặt, áp suất) mà không phụ thuộc vào thứ tự chất phản ứng. Page 8
Báo cáo thí nghiệm Hóa Đại cương
BÀI 8: PHÂN TÍCH THỂ TÍCH I. Thực hành: 1. Thí nghiệm 1:
- Xây dựng đường cong chuẩn độ 2. Thí nghiệm 2:
- Chuẩn độ axit – bazo với thuốc thử phenol phtalein
- Tráng buret bằng NaOH 0,1N, cho NaOH 0,1N vào buret.
- Dùng pipet 10ml lấy 10ml dd HCl cho vào erlen 150ml, thêm 10ml nước cất + 2 giọt phenol phtalein. - Tiến hành chuẩn độ 3. Thí nghiệm 3:
- Tương tự thí nghiệm 2, thay phenol phtalein bằng metyl orange (đỏ cam) 4. Thí nghiệm 4:
- Tương tự thí nghiệm 2, thay HCl bằng axit axetic
- Làm thí nghiệm 4 lần, 2 lần đầu: phenol phtalein, 2 lần sau: metyl orange.
II. Kết quả thí nghiệm:
Xử lí kết quả thí nghiệm: 1. Thí nghiệm 1:
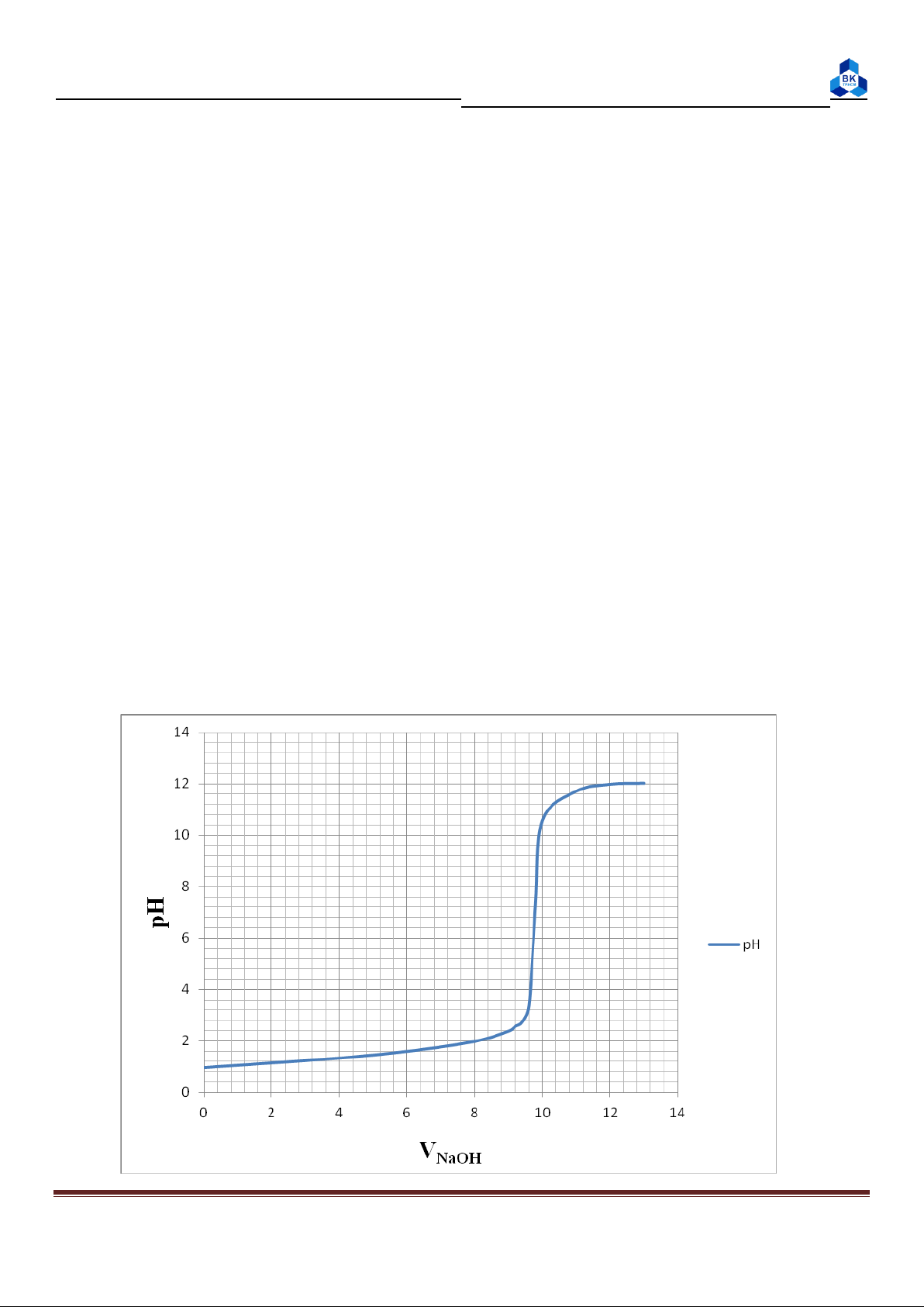
Xác định đường cong chuẩn độ HCl bằng NaOH. Page 9
Báo cáo thí nghiệm Hóa Đại cương Xác định:
pH điểm tương đương: 7,26.
Bước nhảy pH: từ pH 3,36 đến pH 10,56.
Chất chỉ thị thích hợp: phenolphthalein. 2. Thí nghiệm 2:
Điền đầy đủ các giá trị vào bảng sau: Lần VHCl (ml) VNaOH (ml) CNaOH (N) CHCl (N) Sai số 1 10 9,7 0,1 0,097 0,00 2 10 9,7 0,1 0,097 0,00 CtbHCl = 0,097 N 3. Thí nghiệm 3:
Điền đầy đủ các giá trị vào bảng sau: Lần VHCl (ml) VNaOH (ml) CNaOH (N) CHCl (N) Sai số 1 10 9,6 0,1 0,096 0,0005 2 10 9,7 0,1 0,097 0,0005 4. Thí nghiệm 4:
Điền đầy đủ các giá trị vào bảng sau: Lần Chất chỉ thị VCH3COOH VNaOH (ml) CNaOH (N) CCH3COOH (ml) (N) 1 Phenol phtalein 10 10,5 0,1 0,105 2 Metyl orange 10 3,4 0,1 0,034
III. Trả lời câu hỏi:
1. Khi thay đổi nồng độ HCl và NaOH, đường cong chuẩn độ có thay đổi hay không? Tại sao? Trả lời:
- Khi thay đổi nồng độ HCl và NaOH, đường cong chuẩn độ không thay đổi do
phương pháp chuẩn độ HCl bằng NaOH được xác định dựa trên phương trình: HCl + NaOH NaCl + H2O
CHCl.VHCl = CNaOH.VNaOH
- Với VHCl và CNaOH cố định nên khi CHCl tăng hay giảm thì VNaOH cũng tăng hay
giảm theo. Từ đó ta suy ra, dù mở rộng ra hay thu hẹp lại thì đường cong chuẩn độ không đổi. Page 10
Báo cáo thí nghiệm Hóa Đại cương
- Tương tự đối với trường hợp thay đổi nồng độ NaOH.
2. Việc xác định nồng độ axit HCl trong các thí nghiệm 2 và 3 cho kết quả nào chính xác hơn? Tại sao? Trả lời:
- Xác định nồng độ axit HCl trong thí nghiệm 2 cho kết quả chính xác hơn. Vì
phenol phtalein giúp ta xác định màu chính xác hơn, rõ ràng hơn, do chuyển từ
không màu sang hồng nhạt , dễ nhận thấy hơn từ màu đỏ sang da cam.
3. Từ kết quả thí nghiệm 4, việc xác định nồng độ dung dịch axit axetic bằng chỉ thị màu
nào chính xác hơn? Tại sao? Trả lời:
- Phenol phtalein chính xác hơn metyl orange vì axit axetic là axit yếu nên điểm định
mức lớn hơn 7 nên dùng phenol phtalein thì chính xác hơn metyl orange (bước
nhảy 3,0 – 4,4 cách quá xa).
4. Trong phép phân tích thể tích, nếu đổi vị trí của NaOH và axit thì kết quả có thay đổi không? Tại sao? Trả lời:
- Không thay đổi vì đây cũng chỉ là phản ứng cân bằng.
----------------HẾT---------------- Page 11




