









Preview text:
lOMoARcPSD|46342985 lOMoARcPSD|46342985
ĐẠI HỌC QUỐC GIA TP. HỒ CHÍ MINH
TRƯỜNG ĐH BÁCH KHOA
BÁO CÁO THÍ NGHIỆM HOÁ ĐẠI CƯƠNG
GVHD: Đỗ Thị Minh Hiếu Tổ 12 Lớp L12
Trần Mỹ Quyên – 2011941
Đỗ Nguyễn Tấn Tài – 2011993
TP. HỒ CHÍ MINH – 16/10/2021 lOMoARcPSD|46342985 BÁO CÁO THÍ NGHIỆM
BÀI 2: NHIỆT PHẢN ỨNG
Ngày TN: 24 tháng 9 năm 2021 Tổ: 12 - Lớp: L12 Thực hiện: Cả nhóm I.
KẾT QUẢ THÍ NGHIỆM:
Thí nghiệm 1: Xác định nhiệt dung của nhiệt lượng kế Nhiệt độ oC Lần 1 Lần 2 t1 30 30 t2 63.5 63 t3 47.5 47 moco (cal/độ) 4.6875 3.125
Ta có: m = 50 (g); c = 1 (cal/g.độ) => m.c = 50 (cal/độ) moco TB ≈ 3.906 cal/độ Lần 1: (47.5 − 30) − (63.5 − ( 3 − 1 ) − ( 2 − 3 ) 47.5) moco = mc = 50 = 4.6875 (cal/độ) ( 2− 3) (63.5 − 47.5)
Thí nghiệm 2: Xác định hiệu ứng nhiệt của phản ứng trung hòa HCl và NaOH Nhiệt độ oC Lần 1 Lần 2 t1 29.5 29.5 t2 30.5 31 t3 36.5 37.5 Q(cal) 384.342 439.248 Q (cal) trung bình 411.795 ∆H (cal/mol) -16471.8
Ta có: cNaCl 0.5M = 1 (cal/g.độ); ρNaCl 0.5M = 1.02 (g/ml) lOMoARcPSD|46342985
VNaOH 1M = 25 (ml); VHCl 1M = 25 (ml) => nNaCl = 0.025 (mol) Lần 1:
m = ( VNaOH + VHCl )*1.02 = ( 25 + 25 )*1.02 = 51 (g) ∆H=- = -
= - 16471.8 (cal/mol) < 0 => phản ứng tỏa nhiệt Q 411.795
Q1 = (moco TB + mc)(t3 – t1) = (3.906 + 51*1)( 36.5 – 29.5) = 384.342 (cal) n 0.025
Thí nghiệm 3: Xác định nhiệt hòa tan của CuSO4 khan - kiểm tra định luật Hess Nhiệt độ oC Lần 1 Lần 2 t1 30 30 t2 35.5 36 Q (cal) 318.318 348.516 ∆H (cal/mol) -12835.4 -13340.33 ∆Htb (cal/mol) -13087.865 Lần 1:
cCuSO4 = 1 (cal/g.độ) ; mCuSO4 = 3.97 (g); mH2O = 50 (g) 3.9716 n 0 ≈ 0,0248 (mol) CuSO4 =
Q = (mocoTB+mH2OcH2O+mCuSO4cCuSO4)(t2 – t1)
= (3.906Q + 31850+.318.97)( 35.5 – 30 ) = 318.318 (cal)
∆H = - n = - 0.0248 ≈ - 12835.4 (cal/mol) < 0 => phản ứng tỏa nhiệt. lOMoARcPSD|46342985
Thí nghiệm 4: Xác định nhiệt hòa tan của NH4Cl Nhiệt độ oC Lần 1 Lần 2 t1 30 30 t2 26 26.5 Q (cal) -231.864 -202.321 ∆H (cal/mol) 3054.862 2775.429 ∆Htb (cal/mol) 2915.1455 Lần 1: = 1 (cal/g.độ); m cNH4Cl NH4Cl = 4.06(g); mH2O = 50(g); 4.06 nNH4Cl = 53.5 ≈ 0.0759 (mol)
Q = (mocoTB + mH2OcH2O +mNH4ClcNH4Cl)(t2 - t1) ∆H=- = -
= 3054.862 (cal/mol) >0 => phản ứng thu nhiệt. (− 231.864)
= (3.906 + 50 + 4.0 )(26 – 30) = -231.864 (cal) 0.0759 II. TRẢ LỜI CÂU HỎI: 1.
∆Htb của phản ứng HCl + NaOH ➔ NaCl + H2O sẽ được tính theo số mol HCl
hay NaOH khi cho 25 ml dd HCl 2M tác dụng với 25 ml dd NaOH 1M. Tại sao?
Ta có: nHCl = 0.05 mol, nNaOH = 0.025 mol.
Mà tỉ lệ phản ứng của phương trình là 1:1 suy ra NaOH sẽ phản ứng hết và dư HCl
=> ta lấy ∆Htb tính theo số mol NaOH. 2.
Nếu thay HCl 1M bằng HNO3 1M thì kết quả thí nghiệm 2 có thay đổi hay không?
Không đổi vì HNO3 cũng là 1 axit mạnh giống HCl và tỉ lệ đương lượng khi thay đổi
axit vẫn là như nhau. 3.
Tính ∆H3 bằng lý thuyết theo định luật Hess. So sánh với kết quả thí nghiệm. lOMoARcPSD|46342985
Hãy xem 6 nguyên nhân có thể gây ra sai số trong thí nghiệm này: -
Mất nhiệt độ do nhiệt lượng kế - Do nhiệt kế -
Do dụng cụ đong thể tích hóa chất - Do cân -
Do sunfat đồng bị hút ẩm -
Do lấy nhiệt dung riêng sunfat đồng bằng 1 cal/mol.độ
Theo em sai số nào là quan trọng nhất, giải thích? Còn nguyên nhân nào khác không?
• Theo định luật Hess: ∆H3 = ∆H1 + ∆H2 = -18.7 +2.8 = -15.9 (kcal/mol)
• Theo thực nghiệm: ∆H3 = - 13.088 (kcal/mol)
➢ Theo em nguyên nhân quan trọng nhất gây ra sai số là do sunfat đồng hút ẩm
CuSO4 (khan) + 5H2O → CuSO4.5H2O tiếp tục tạo ∆H1, hoặc do ở dạng ngậm nước
nên tạo ra lượng nhiệt ít hơn so với lí thuyết. Mặt khác. CuSO4 hút ẩm thì số mol
sẽ khác so với tính toán trên lí thuyết (CuSO4 khan).
➢ Nguyên nhân gây ra sai số khác có thể là do trong quá trình thí nghiệm, thao tác
không chính xác, nhanh chóng dẫn đến thất thoát nhiệt ra môi trường ngoài. lOMoARcPSD|46342985 BÁO CÁO THÍ NGHIỆM
BÀI 4: XÁC ĐỊNH BẬC PHẢN ỨNG
Ngày TN: 8 tháng 10 năm 2021
Tổ: 12 - Lớp: L12
Thực hiện: Cả nhóm I.
KẾT QUẢ THÍ NGHIỆM 1.
Bậc phản ứng theo Na2S2O3 TN
Nồng độ ban đầu (M) t t t Na ∆ 2S2O3 H2SO4 1 ∆ 2 ∆ TB 1 0.01 0.08 111 117 114 2 0.01 0.08 51 52 51.5 3 0.01 0.08 26 25 25.5
Từ TTB của TN1 và TN2 xác định m1:
Ta có biểu thức tính vận tốc phản ứng tức thời: = ± = =>2 ∆ ) 1 0.02 => lg( ∆ 1 = m.lg(2) = 2 1 = ∆ 2 = 0.01 ∆ 2 lg => m 1 ⁄ ∆ (114/51.5) 1 = lg (∆ 2) = 1.1464 ≈ lg (2) lg (2)
Từ TTB của TN2 và TN3 xác định m2: lg m (51.5/25.5) 2 =l g (∆ 2 ⁄ ∆ 3) = ≈ 1.0141 lg (2) lg (2) 2 2 =
Bậc phản ứng theo Na 1.1464+1.014 2S2O3 = 1 + 2 = 1.08 1 lOMoARcPSD|46342985 2.
Bậc phản ứng theo H2SO4 TN [Na t 2S2O3] [H2SO4] t1 t2 TB 4 0,02 0,04 54 56 55 ∆ ∆ ∆ 5 0,02 0,08 51 52 51.5 6 0,02 0,16 43 44 43.5
Từ TTB của TN4 và TN5 xác định n1:
Ta có biểu thức tính vận tốc phản ứng tức thời: = ± = =>5 ∆ ) 4 0.08 => lg( ∆ 4 = n.lg(2) = 2 4 = ∆ 5 = 0.04 ∆ 5 lg => n 4 ⁄ ∆ (55/51.5) 1 = lg (∆ 5) = 0.0949 ≈ lg (2) lg (2)
Từ TTB của TN5 và TN6 xác định n2: n2 = l g (∆ 5 ⁄ ∆ 6) =lg (51.5/43.5) ≈ 0.2436 lg (2) lg (2) 2 ≈ 2 = 0.0949
Bậc phản ứng theo H +0.2436 2SO4 = 1 + 2 0.17 II. TRẢ LỜI CÂU HỎI: 1.
Trong thí nghiệm trên, nồng độ của Na2S2O3 và của H2SO4 đã ảnh hưởng thế
nào lên vận tốc phản ứng? Viết lại biểu thức tính vận tốc phản ứng. Xác định
bậc của phản ứng.
Nồng độ của Na2S2O3 tỉ lệ thuận với vận tốc phản ứng.
Nồng độ của H2SO4 tăng có xu hướng làm tăng vận tốc phản ứng, nhưng hầu như
rất nhỏ không đáng kể.
Biểu thức tính vận tốc phản ứng: V = k [ Na2S2O3]1.08 . [H2SO4]0.17
Bậc của phản ứng: 1.08 + 0.17 = 1.25 lOMoARcPSD|46342985
2.Cơ chế của phản ứng trên có thể được viết như sau:
H2SO4 + Na2S2O3 → Na2SO4 + H2S2O3 (1) H →H 2S2O3 2SO3 +S↓ (2)
Dựa vào kết quả TN có thể kết luận phản ứng (1) hay (2) là phản ứng quyết
định vận tốc phản ứng tức là phản ứng xảy ra chậm nhất không? Tại sao? Lưu
ý trong các TN trên, lượng axit H2SO4 luôn luôn dư so với Na2S2O3.
Phản ứng quyết định vận tốc phản ứng, tức là phản ứng xảy ra chậm nhất, là phản
ứng (2) vì đây là phản ứng tự oxy hoá khử nên xảy ra rất chậm. Phản ứng (1) là phản
ứng trao đổi ion nên xảy ra rất nhanh so với phản ứng (2). 3.
Dựa trên cơ sở của phương pháp TN thì vận tốc xác định được trong các TN
trên được xem là vận tốc trung bình hay vận tốc tức thời?
Biểu thức tính vận tốc phản ứng trung bình là V = ±
, mà trong thí nghiệm này ta cố
định C bằng cách ghi nhận thời gian T từ lúc bắt đầu phản ứng đến lúc dung dịch bắt
đầu chuyển sang đục nên vận tốc phản ứng trong thí nghiệm này là vận tốc tức thời. 4.
Thay đổi thứ tự cho H2SO4 và Na2S2O3 thì bậc phản ứng có thay đổi không, tại sao? = ± =
Biểu thức tính vận tốc phản ứng
nên hệ phụ thuộc vào hằng số tốc
độ phản ứng K , nồng độ, áp suất và diện tích tiếp xúc, trong đó K phụ thuộc vào
nhiệt độ, chất xúc tác và bản chất phản ứng. Do đó, thay đổi thứ tự cho H2SO4 và
Na2S2O3 không làm thay đổi hệ, và không làm thay đổi bậc phản ứng. III. KẾT LUẬN:
Qua thí nghiệm này, ta đã chứng minh được nồng độ của các chất tham gia có ảnh hưởng đến
vận tốc phản ứng (nồng độ của Na2S2O3 tỉ lệ thuận với vận tốc phản ứng ứng), và bậc phản
ứng không thay đổi khi ta thay đổi thứ tự cho H2SO4 và Na2S2O3. Bằng thực nghiệm, ta xác
định được bậc của phản ứng phân huỷ Na2S2O3 trong môi trường axit bằng 1,15 1. lOMoARcPSD|46342985 BÁO CÁO THÍ NGHIỆM
Bài 8: PHÂN TÍCH THỂ TÍCH
Ngày TN: 1 tháng 10 năm 2021
Tổ: 12 - Lớp: L12
Thực hiện: Cả nhóm I.
KẾT QUẢ THÍ NGHIỆM
Xử lí kết quả thí nghiệm 1. Thí nghiệm 1
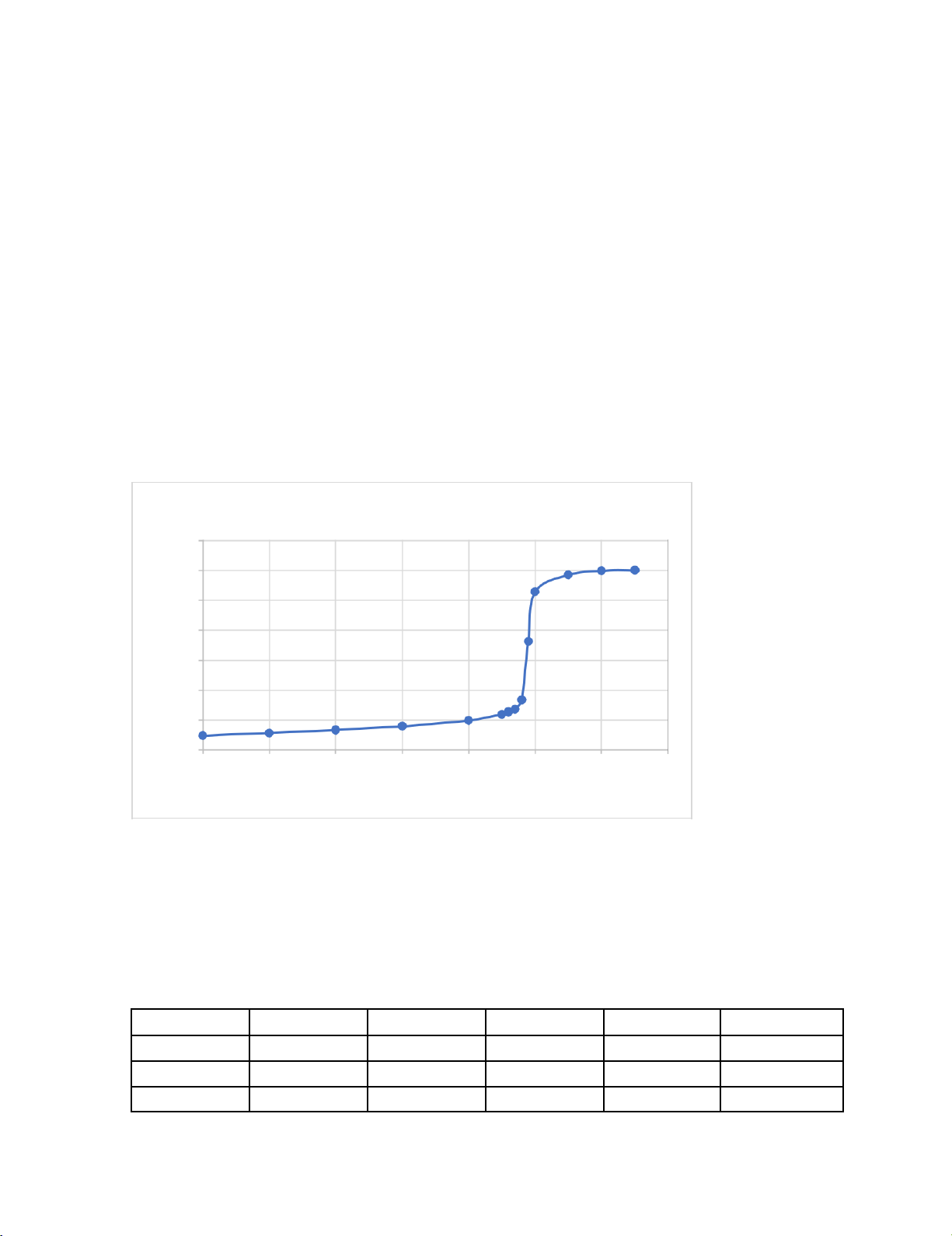
Đường cong chuẩn độ HCL bằng NaOH 14 12 10 8 H p 6 4 2 0 0 2 4 6 8 10 12 14 VNAOH (ML) Xác định:
pH điểm tương đương 7
Bước nhảy pH: từ pH 3.36 đến 10.56 2. Thí nghiệm 2 Lần VHCl (ml) VNaOH (ml) CNaOH (N) CHCl (N) Sai số 1 10 11.5 0.1 0.115 0.8621% 2 10 11.6 0.1 0.116 0% 3 10 11.7 0.1 0.117 0.8621% lOMoARcPSD|46342985
. VNaOH; Sai số = |CHCl - ̅HCl|/ ̅HCl HCl . VHCl = CNaOH C C C C
̅HCl = 0.116; Sai số của ̅HCl: 0.8621% 3. Thí nghiệm 3 Lần VHCl (ml) VNaOH (ml) CNaOH (N) CHCl (N) Sai số 1 10 11.6 0.1 0.116 0.572% 2 10 11.6 0.1 0.116 0.572% 3 10 11.8 0.1 0.118 1.143% 4. Thí nghiệm 4 V C Lần Chất chỉ thị (N) C (N) CH3COOH VNaOH (ml) NaOH CH3COOH (ml) 1 10 7.2 0.1 0.072 2 Phenol phtalein 10 7.3 0.1 0.073 3 10 7.4 0.1 0.074 1 10 1.6 0.1 0.016 2 Metyl orange 10 1.8 0.1 0.018 3 10 1.7 0.1 0.017 II. TRẢ LỜI CÂU HỎI 1.
Khi thay đổi nồng độ HCl và NaOH, đường cong chuẩn độ có thay đổi hay không, tại sao?
Khi thay đổi nồng độ HCl và NaOH thì đường cong chuẩn độ không thay đổi vì
đương lượng phản ứng của các chất không thay đổi, chỉ có bước nhảy là thay đổi.
Nếu dùng nồng độ nhỏ thì bước nhảy nhỏ và ngược lại. 2.
Việc xác định nồng độ axit HCl trong các thí nghiệm 2 và 3 cho kết quả chính xác hơn, tại sao?
Việc xác định nồng độ axit HCl trong các thí nghiệm 2 và 3 thì thí nghiệm 2 cho ta
kết quả chính xác hơn. Vì phenol phtalein có bước nhảy pH trong khoảng 8 - 10 còn
metyl organe là 3.1 - 4.4 mà điểm tương đương của hệ là 7, do đó phenol phtalein sẽ
giúp ta xác định màu tốt hơn, rõ ràng hơn. lOMoARcPSD|46342985 3.
Từ kết quả thí nghiệm 4, việc xác định nồng độ dung dịch axit acetic bằng chỉ
thị màu nào chính xác hơn, tại sao?
Từ kết quả thí nghiệm 4, việc xác định nồng độ dung dịch axit acetic bằng phenol
phtalein chính xác hơn, Vì trong môi trường axit phenol phtalein không có màu, và
chuyển sang màu hồng trong môi trường bazơ, nên ta có thể phân biệt được dễ dàng
và chính xác hơn. Còn metyl orange chuyển từ màu đỏ trong môi trường axit, sang
màu vàng cam trong môi trường bazơ vì thế ta sẽ khó phân biệt được chính xác.
Ngoài ra còn vì phenol phtalein có bước nhảy pH trong khoảng 8 - 10 còn metyl
organe là 3.1 - 4.4 mà điểm tương đương của hệ >7. 4.
Trong phép phân tích thể tích, nếu đổi vị trí của NaOH và axit thì kết quả có
thay đổi không, tại sao?
Trong phép phân tích thể tích nếu thay đổi vị trí của NaOH và axit thì kết quả vẫn
không thay đổi vì bản chất của phản ứng vẫn là phản ứng trung hòa và chất chỉ thị
cũng vẫn sẽ đổi màu tại điểm tương đương. III. KẾT LUẬN
Qua những thí nghiệm trên, ta nhận thấy phenol phtalein sẽ giúp ta xác định nồng độ dễ
dàng hơn và tốt hơn là metyl orange. Do phenol phtalein độ pH trong khoảng 8 - 10 mà
điểm tương đương của hệ là 7, hơn nữa chất này sẽ chuyển từ không màu trong môi
axit sang màu hồng trong môi trường bazơ do đó bằng mắt thường sẽ dễ dàng nhận
biết được sự chuyển màu này.




