
















Preview text:
TRƯỜNG ĐẠI HỌC BÁCH KHOA TP. HỒ CHÍ MINH ----------
BÁO CÁO THÍ NGHIỆM HÓA HỌC
Bài 4. Chuẩn độ phản ứng oxy hóa –khử
Bài 5. Thí nghiệm về ăn mòn Nhóm C8 Nguyễn Thành Danh 1410496 Phan Minh Trí Võ Trường Giang BÀI 4
CHUẨN ĐỘ BẰNG PHẢN ỨNG OXY HÓA KHỬ
1. Mục đích thí nghiệm:
Xác định nồng độ một dung dịch oxy hóa ( hoặc khử ) bằng cách quan sát màu trước
và sau điểm tương đương khi chuẩn độ dung dịch này bằng dung dịch khử (hay oxy hóa)
khác có nồng độ đã biết. 2. Chuẩn bị: 1/ Dụng cụ: 3 pipette 10ml 3 burette 25ml 6 bình tam giác 100ml 6 becher 50ml Quả bóp cao su
1 bình xịt nước cất Giấy lọc 2/ Hóa chất: 1 chai Fe2+ 0.11M 1 chai KMnO4 x mol/l 1 chai I2 y mol/l 1 chai Na2S2O3 0,07 mol/l 1 chai Fe2+ z mol/l 1 chai Ce4+ 0.01M
1 bình nhỏ giọt O-Phenantrolin
1 bình nhỏ giọt hồ tinh bột
3. Tiến hành thí nghiệm: 3.1.
Chuẩn độ ion permanganat bằng ion sắt(II): 3.1.1 Lý thuyết:
1) Phương trình phản ứng: + 5 + 8 à + 5 + 4 . 2) Hằng số cân bằng: Ta có: ( / ) = 1,51V ( ) ( / ) = 0,77V ( ) + 5 à → = 5 + 1 à → = 1 → = 5 ( ) ( , , ) K = 10 , = 10 , = 10 , .
3) Phương trình tương quan tỉ lượng tại điểm tương đương:
Xét tại điểm tương đương: . = 5. . đ
4) Rút biểu thức tính nồng độ: Phương trình phản ứng: + 5 + 8 à + 5 + 4 = 10 , > 10
Phản ứng xảy ra hoàn toàn Ta có: = 0,11 (mol/l) = 10 (ml) = 0,01(l) = . = 0,11.0,01 = 1,1. 10 (mol) , = = = 2,2 x 10 (mol) , = .10 = (mol/l) 3.1.2. Thực hành
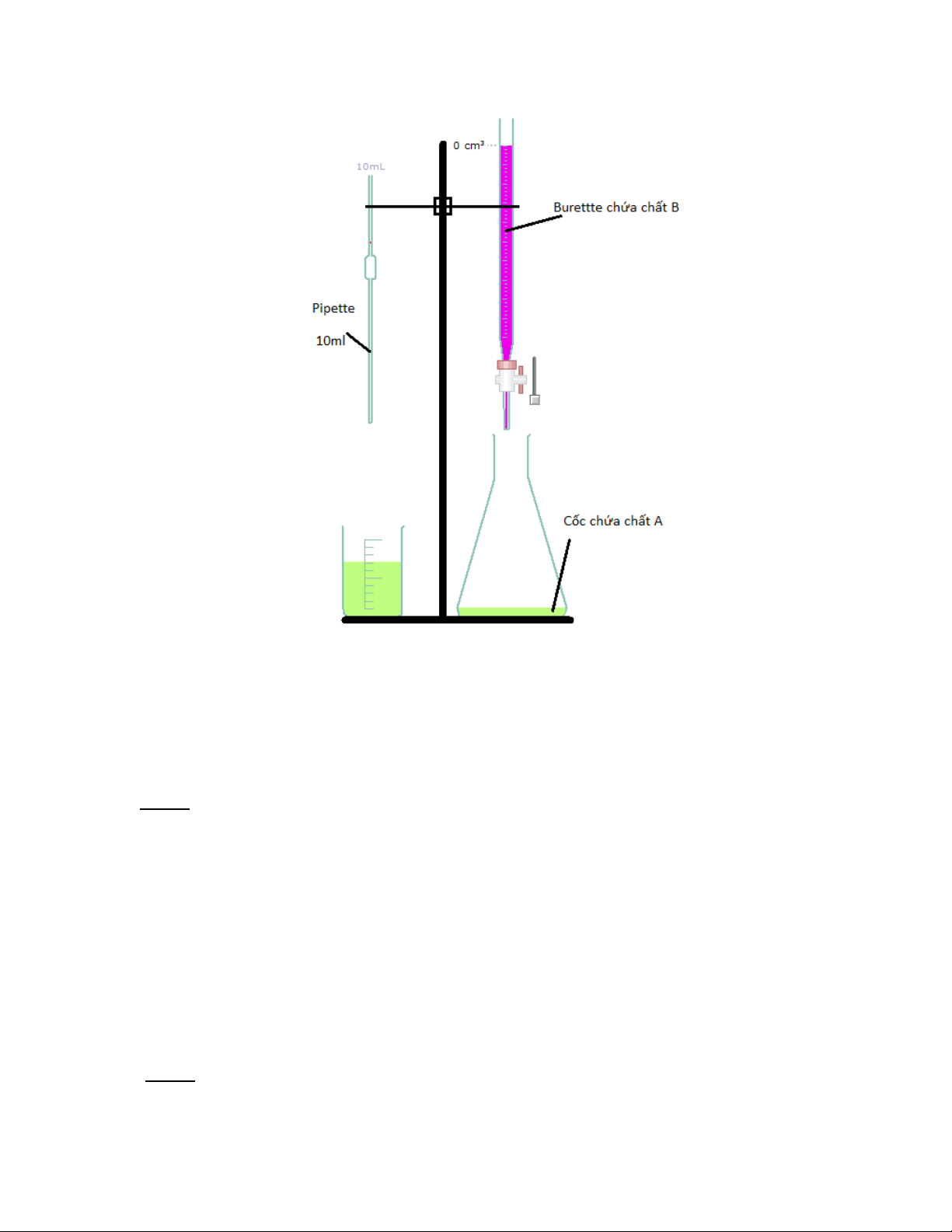
Sơ đồ thí nghiệm:
Sơ đồ thí nghiệm chuẩn độ ion permanganat bằng ion sắt (II) (crocledile) Chuẩn độ:
Tiến hành lần lượt 2 phép chuẩn độ:
Lần 1:Chuẩn độ gần đúng: Xác định vùng thể tích chứa .
1) Lấy vào bình tam giác 10ml chất A ( ) bằng pipette.
2) Thêm vào bình tam giác từng 1ml chất B (
) từ burette rồi lắc đều.
3) Quan sát màu của dung dịch, kết quả thí nghiệm ta có khoảng thể tích xảy ra sự thay đổi màu là: Màu vàng nhạt tới = 11ml. Màu tím tới = 12ml.
Lần 2:Chuẩn độ chính xác:Xác định chính xác thể tích (giữa và ).
1) Lấy vào bình tam giác 10ml chất A ( ) bằng pipette. 2) Cho vào bình tam giác − 0,5 = 10,5 ml dung dịch từ burette rồi khuấy đều.
3) Thêm từng giọt permanganate cho đến khi đạt được sự thay đổi màu.
4) Kết quả thí nghiệm ta có giá trị chính xác thể tích = 11,6 ml.
3.1.3. Kết quả và tính toán:
Kết quả: Chuẩn độ bằng ( ):
Chuẩn độ gần đúng: o Màu vàng nhạt tới = 11ml o Màu tím tới = 12ml
Chuẩn độ chính xác: = 11,6 ml Tính toán: Ta có: = 11,6ml. , = .10 = = 0,0191(mol/l) , 3.2.
Chuẩn độ iot bằng thiosulfat: 3.2.1. Lý thuyết:
1) Phương trình phản ứng: + 2 à 3 + .
2) Hằng số cân bằng: Ta có: ( / ) = 0,545V ( ) ( / ) = 0,09V ( ) + 2 à 3 → = 2 + 2 à 2 → = 2 → = 2
(bội số chung nhỏ nhất) ( ) ( , , ) → K = 10 , = 10 , = 10 , .
3) Phương trình tương quan tỉ lượng tại điểm tương đương:
Xét tại điểm tương đương: . đ = 2 .
4) Rút biểu thức tính nồng độ: Phương trình phản ứng: + 2 à 3 + . = 1015,423 > 103
→ Phản ứng xảy ra hoàn toàn Ta có: = 0,07(mol/l); = a (ml) = 10 (ml) = 0,01 (l); → = . = 0,07. = 0,07a.10 (mol) , → = = (mol) , . = = = 3,5a . 10 (mol/l) . , 3.2.2. Thực hành:
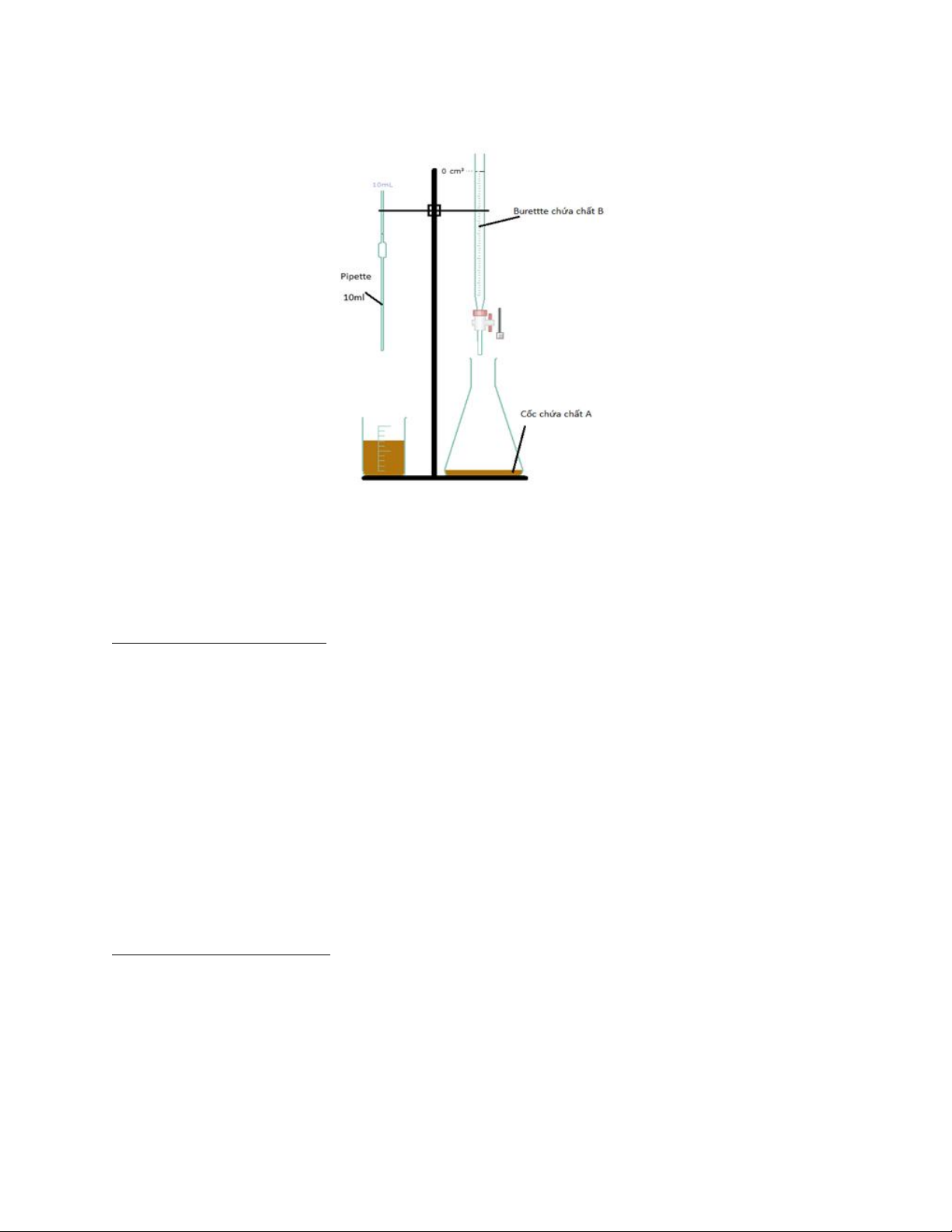
Sơ đồ thí nghiệm:
Sơ đồ thí nghiệm chuẩn độ iot bằng thiosulfat (vẽ bằng crocledile) Chuẩn độ
Tiến hành lần lượt 2 phép đo chuẩn độ:
Lần 1: Chuẩn độ gần đúng:Xác định vùng chứa thể tích tương đương .
1) Lấy vào bình tam giác 10ml chất A ( ) bằng pipette.
2) Thêm vào bình tam giác từng 1ml chất B (thiosulfat) từ burette rồi lắc đều. 3) Quan sát màu:
Kết quả thí nghiệm ta có khoảng thể tích xảy ra sự thay đổi màu: Màu vàng nhạt tới = 11ml. Không màu tới = 12ml.
Lần 2: Chuẩn độ chính xác: Xác định chính xác thể tích .
1) Lấy vào bình tam giác 10ml chất A ( ) bằng pipette. 2) Cho vào bình tam giác − 0,5 = 10,5 ml dung dịch từ burette rồi khuấy đều.
3) Thêm từng giọt thiosulfat cho đến khi dung dịch có màu vàng nhạt, cho vào vài giọt
hồ tinh bột để dễ dàng quan sát sự thay đổi màu. Cho thêm từng giọt thiosulfat cho
đến khi đạt được sự thay đổi màu trong khoảng một giọt.
4) Kết quả thí nghiệm ta có giá trị chính xác thể tích = 11,2ml.
3.2.3. Kết quả và tính toán:
Kết quả: Chuẩn độ bằng .
Chuẩn độ gần đúng: o Màu vàng nhạt tới = 11ml o Không màu tới = 12 ml
Chuẩn độ chính xác: = 11,2ml Tính toán: Ta có: = 11,2ml. , . = = = 3,5 . 11,2 . 10 = 0,0392 (mol/l) . , 3.3.
Chuẩn độ ion sắt (II) bằng ion ceri (IV): 3.3.1. Lý thuyết:
1) Phương trình phản ứng: ( ) + ( ) à ( ) + ( )
2) Hằng số cân bằng: Ta có: ( / ) = 1,44V ( ) ( / ) = 0,77V ( ) + 1 à → = 1 + 1 à → = 1 → = 1
(bội số chung nhỏ nhất) ( ) ( , , ) →K = 10 , = 10 , = 10 ,
3) Phương trình tương quan tỉ lượng tại điểm tương đương:
Xét tại điểm tương đương: . đ = .
4) Rút biểu thức tính nồng độ:
Phương trình phản ứng: ( ) + ( ) à ( ) + ( ) = 10 , > 10
→Phản ứng xảy ra hoàn toàn Ta có: = 0,01(mol/l); = b (ml) = 10 (ml) = 0,01 (l); → = . = 0,01. = 0,01b.10 (mol) → = = 0,01b . 10 (mol) , . = = = . 10 (mol/l) , 3.3.2. Thực hành.
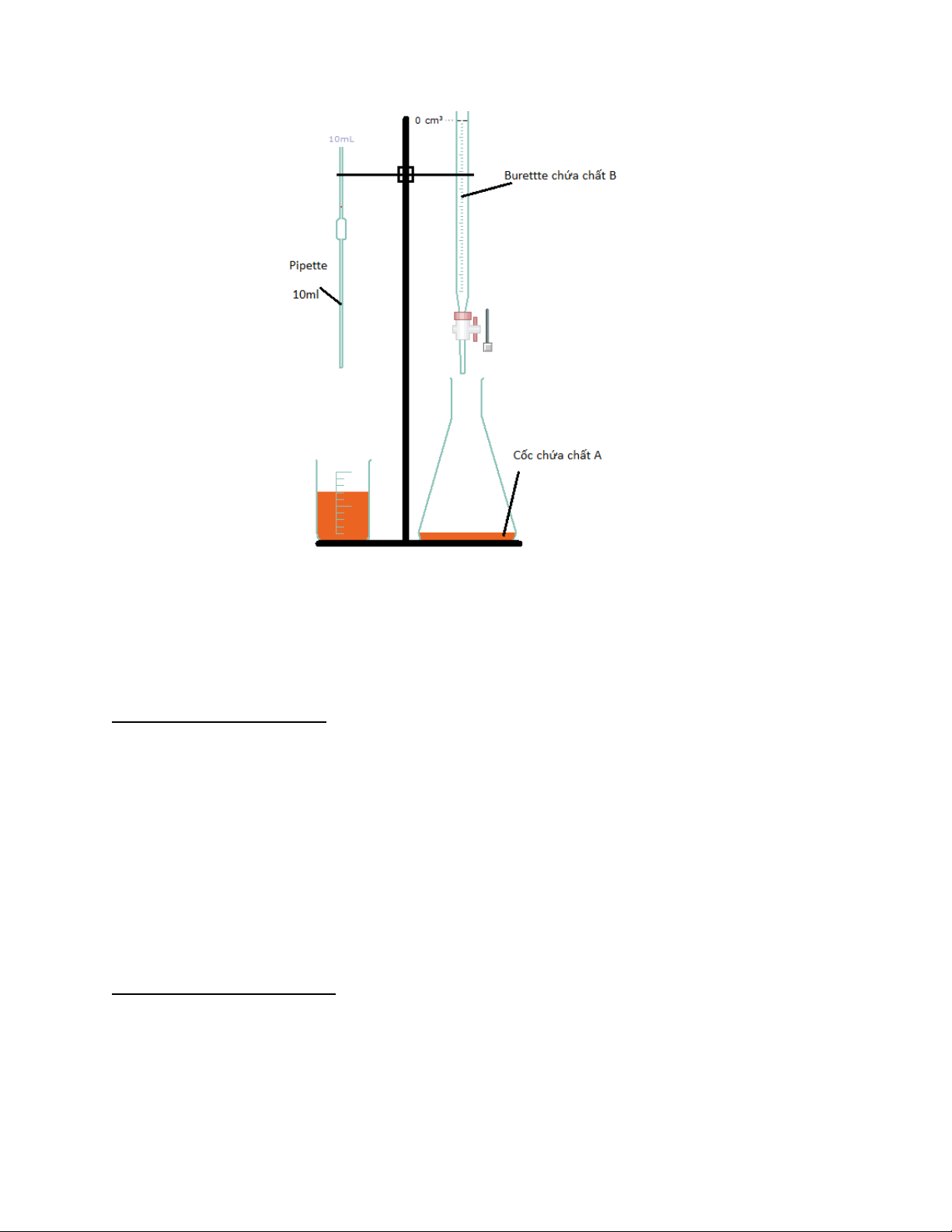
Sơ đồ thí nghiệm.
Sơ đồ thí nghiệm chuẩn độ ion sắt (II) bằng ion ceri (IV) (vẽ bằng crocledile) Chuẩn độ.
Tiến hành lần lượt 2 phép đo chuẩn độ:
Lần 1: Chuẩn độ gần đúng: Xác định vùng chứa thể tích tương đương .
1) Lấy vào bình tam giác 10ml chất A (
) bằng pipette và 2 giọt chất chỉ thị orthophenantrolin.
2) Thêm vào bình tam giác từng 1ml chất B (
) từ burette rồi lắc đều.
3) Quan sát màu. Kết quả thí nghiệm ta có khoảng thể tích xảy ra sự thay đổi màu là: Màu cam tới = 8 ml. Màu xanh lơ tới = 9 ml.
Lần 2: Chuẩn độ chính xác: Xác định chính xác thể tích .
1) Lấy vào bình tam giác 10ml chất A (
) bằng pipette và 2 giọt chất chỉ thị orthophenantrolin. 2) Cho vào bình tam giác − 0,5 = 7,5 ml dung dịch từ burette rồi khuấy đều. 3) Thêm từng giọt (
) cho đến khi đạt được sự thay đổi màu trong khoảng một giọt.
4) Kết quả thí nghiệm ta có giá trị chính xác thể tích = 8,9ml.
3.3.3. Kết quả và tính toán.
Kết quả: Chuẩn độ Fe (II) bằng Ceri (IV)
Chuẩn độ gần đúng: o màu cam tới = 8ml o màu xanh tới = 9ml
Chuẩn độ chính xác: =8,9ml Tính toán: Ta có: = 8,9ml. , . = = = . 10 = 8,9.10 (mol/l) , 4. Sai số:
_ Sai số người dùng: 1 giọt. _ Sai số dụng cụ : 0,05 ml.
Chuẩn độ ion permanganat bằng ion Fe(II): → = 11,60 ± 0,05 (ml) → = 0,0191 ± 5 . 10 (mol/l)
Chuẩn độ bằng . → = 11,20 ± 0,05 (ml) → = 0,0392 ± 5 . 10 (mol/l)
Chuẩn độ Fe(II) bằng Ceri(VI) → = 8,90 ± 0,05 (ml) → =8,9.10 ± 5. 10 (mol/l) 5.
Trả lời câu hỏi:
Câu hỏi:Tại sao lúc thì chất cần chuẩn độ ở burrette, có lúc lại để chất cần chuẩn độ ở cốc? Trả lời:
Do ở thí nghiệm này ta dựa trên sự thay đổi màu của hóa chất làm sao để
dễ nhận biết sự thay đổi màu nhất.
Mặt khác, phản ứng chuẩn độ phải là phản ứng chính và ta phải tìm cách hạn
chế xuất hiện các phản ứng gây nhiễu khác trong quá trình chuẩn độ. Cụ thể:
Trong phản ứng chuẩn độ ion
bằng ion Fe(II): cần để dung
dịch kalipermanganat ở buret bởi vì ta có phản ứng: 2 + 3 + 6 → 5 + 4
Vì vậy nếu ta cho kalipermanganat ở bình thì nó có thể phản ứng với các ion
xuất hiện trong quá trình chuẩn độ. Đây là một phản
ứng làm nhiễu kết quả chuẩn độ nếu để kalipermanganat ở trong bình.
Phản ứng này sẽ có thể bỏ qua được nếu kalipermanganat ở burette.
Chuẩn độ bằng
: do phản ứng trên có ion I - 3 thể hiện màu
vàng rơm khi dung dịch loãng có màu rất nhạt, ta khó nhận biết được
sự chuyển màu ở điểm tương đương. Vì vậy, để nhận biết dễ dàng ta
dùng hồ tinh bột cho vào lúc phản ứng chuẩn độ cận điểm tương
đương để dễ dàng nhận biết sự đổi màu (không thể cho từ đầu hồ tinh
bột vào dung dịch chứa ion I -
3 vì sẽ tạo phức gây nhiễu phản ứng
chuẩn độ). Đây chính là lý do ta cho I -
3 vào bình tam giác.
Chuẩn độ Fe(II) bằng Ceri(VI): vì cả 2 dung dịch đều không màu.
Ta dựa vào tính chất sau: dùng chất chỉ thị màu orthophenantrolin
sắt, chất chỉ thị này cho màu đỏ da cam trong môi trường sắt(II) và
chuyển sang xanh lơ nhạt trong môi trường ion Ce(IV). Vì vậy, ta
cần cho Fe(II) ở bình tam giác và ion Ce(IV) ở burette. BÀI 5
THÍ NGHIỆM VỀ ĂN MÒN
1. Mục đích thí nghiệm:
Khảo sát quá trình ăn mòn sắt trong môi trường ẩm. Sắt được nghiên cứu ở đây là các cây đinh sắt.
2. Chuẩn bị thí nghiệm: 2.1.
Hóa chất và dụng cụ thiết bị: Hoá chất: 100g nước sôi 1g aga 1g NaCl
Các dung dịch: dung dịch HCl ~ 4%, dung dịch NaOH ~ 5%, dung dịch Fe2+.
1 bình nhỏ giọt phenolphtalein, 1 bình nhỏ giọt hexacyanoferrat III kali.
Thiết bị thí nghiệm: 1 becher 250ml 2 ống nghiệm. 5 cây đinh sắt
Giấy nhám, giấy lọc
1 sợi dây đồng và 1 sợi dây kẽm 1 cái kìm 2 hộp petri
1 bình xịt nước cất 2.2.
Nhận diện các ion được giải phóng do ăn mòn:
Lấy bình xịt nước cất cho vào 2 ống nghiệm, mỗi ống khoảng 2 ml nước cất rồi 2
giọt phenolphtalein và 1 giọt hexacyanoferrat III kali.
Sau đó cho vào ống thứ nhất (bên phải) vài giọt dung dịch Fe2+ và ống thứ hai
(bên trái) vài giọt dung dịch OH- (dung dịch NaOH).
Hiện tượng: Ống thứ nhất chuyển sang màu xanh đậm và ống thứ 2 chuyển sang màu hồng.
Hình ảnh biểu thị sự chuyển màu ở 2 ống nghiệm
(Ống nghiệm bên trái chứa Fe2+ -màu xanh; ống nghiệm bên phải chứa OH- - màu hồng)
Kết luận: Các ion Fe2+ và OH- được phát hiện nhờ vào các phản ứng tạo màu. Nhờ
đó, ta nhận biết được hiện tượng xảy ra trong dung dịch ăn mòn.
3. Tiến hành thí nghiệm: 3.1.
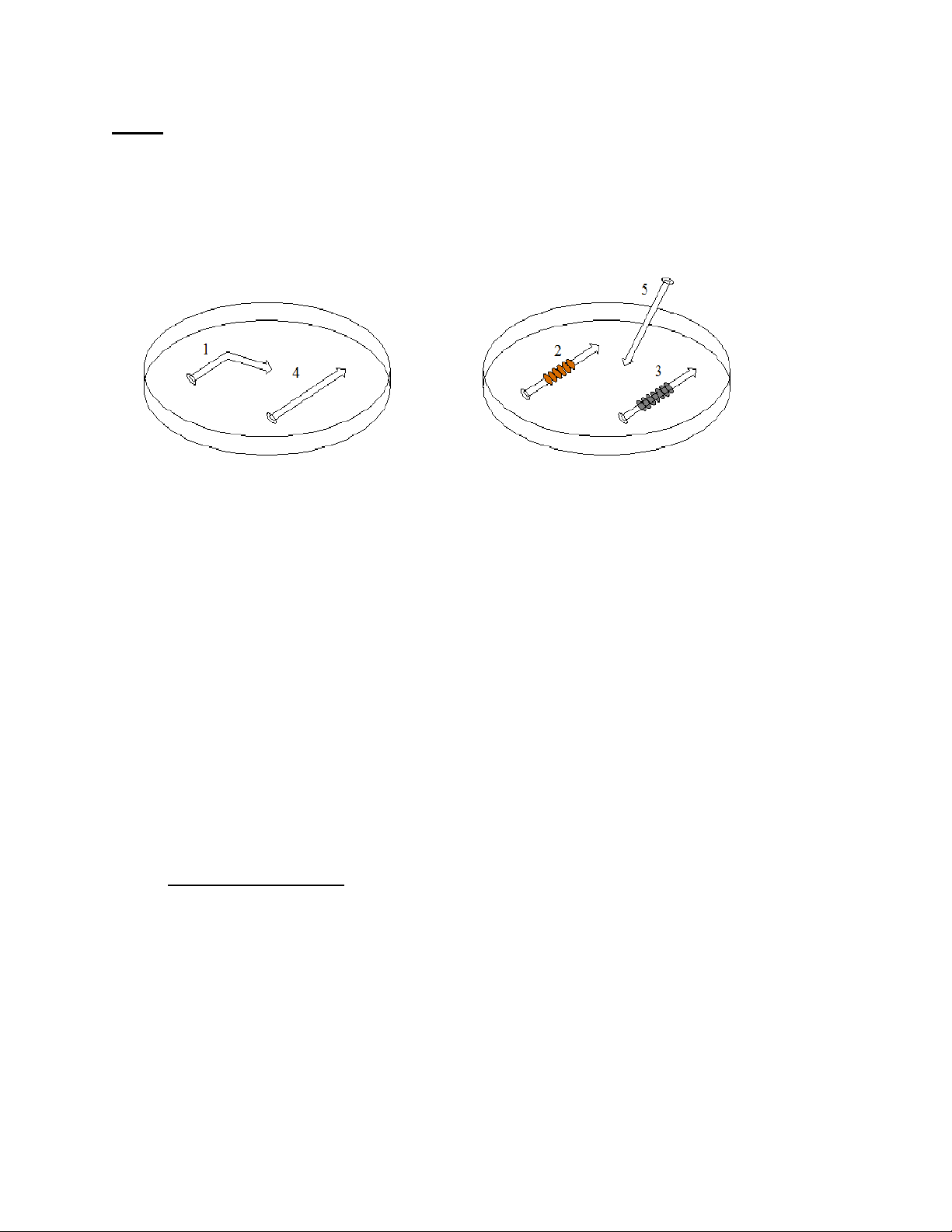
Chuẩn bị 5 cây đính sắt:
Dùng giấy nhám đánh sạch 5 cây đinh sắt, sau đó rửa sạch bằng nước rồi dùng giấy lọc lau khô. Chuẩn bị:
Đinh số 1: gấp khúc tại một chỗ trên thân đinh, dùng kìm bấm tạo vết đứt
chỗ gấp khúc. (không làm đinh gãy đôi, chỉ bấm tạo khớp)
Đinh số 2: quấn xung quanh thân đinh bằng một sợi dây đồng.
Đinh số 3: quấn xung quanh thân đinh bằng một sợi dây kẽm.
Đinh số 4 và 5: để nguyên.
Chú ý: Khi quấn dây đồng (hoặc kẽm) xung quanh thân đinh, dùng kìm quấn thật chặt,
quấn các vòng sát nhau và quấn ở giữa thân đinh.
Lấy 2 hộp petri và sắp xếp đinh theo đúng sơ đồ sau: 3.2.
Chuẩn bị dung dịch ăn mòn:
Rót vào becher 100 gam nước sôi rồi cho vào 1 gam aga và khuấy đều.
Cho tiếp 1 gam NaCl và 1 giọt HCl.
Nhỏ vào dung dịch trên 20 giọt phenolphthalein và 10 giọt hexacyanoferrat III kali. 3.3.
Rót dung dịch ăn mòn:
Rót dung dịch ăn mòn còn nóng vào 2 hộp petri sao cho ngập phủ các đinh. Riêng
đinh số 5 để gác lên thành hộp, chỉ nhúng một đầu vào dung dịch.
Quan sát sự thay đổi của các cây đinh trong 2 hộp petri và ghi nhận lại.
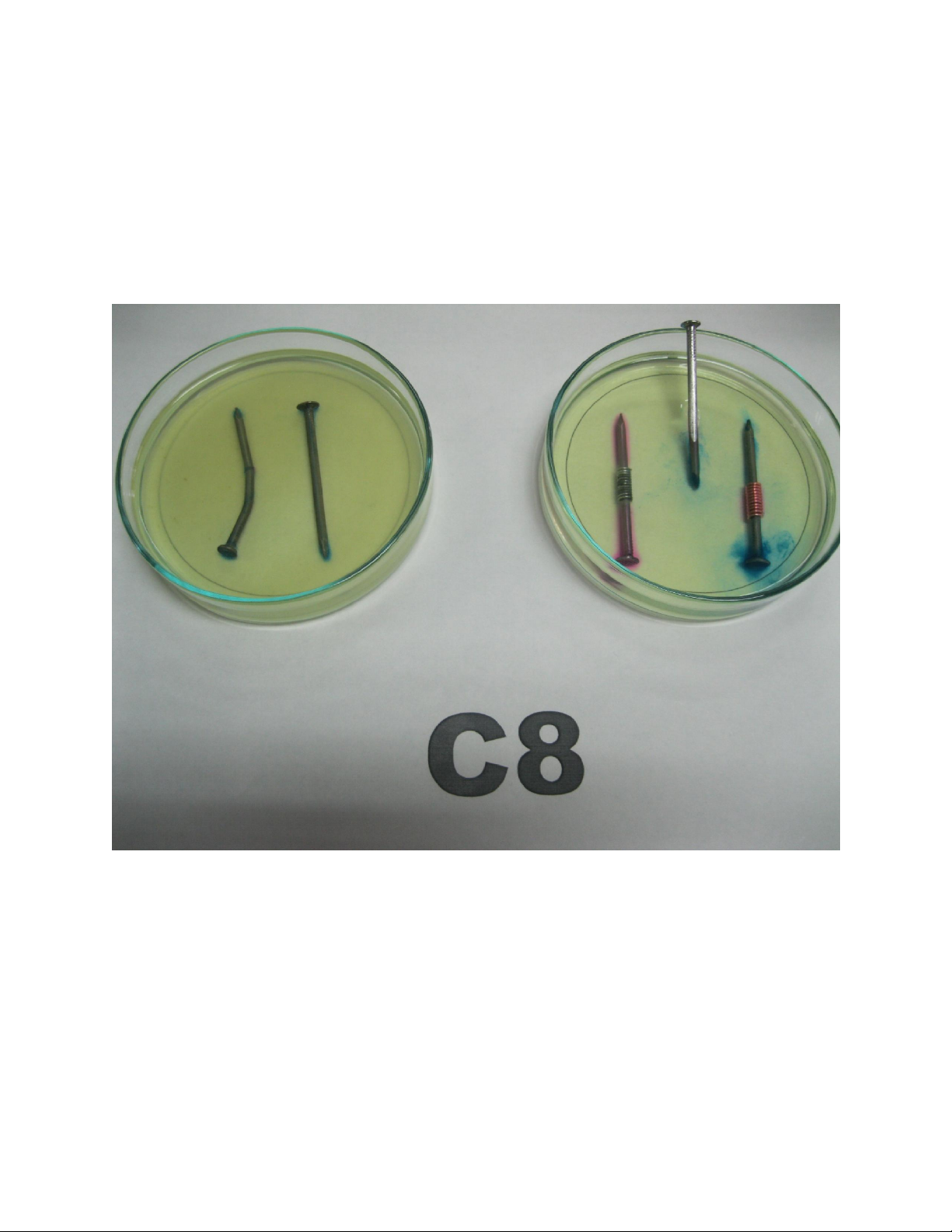
4. Quan sát hiện tượng:
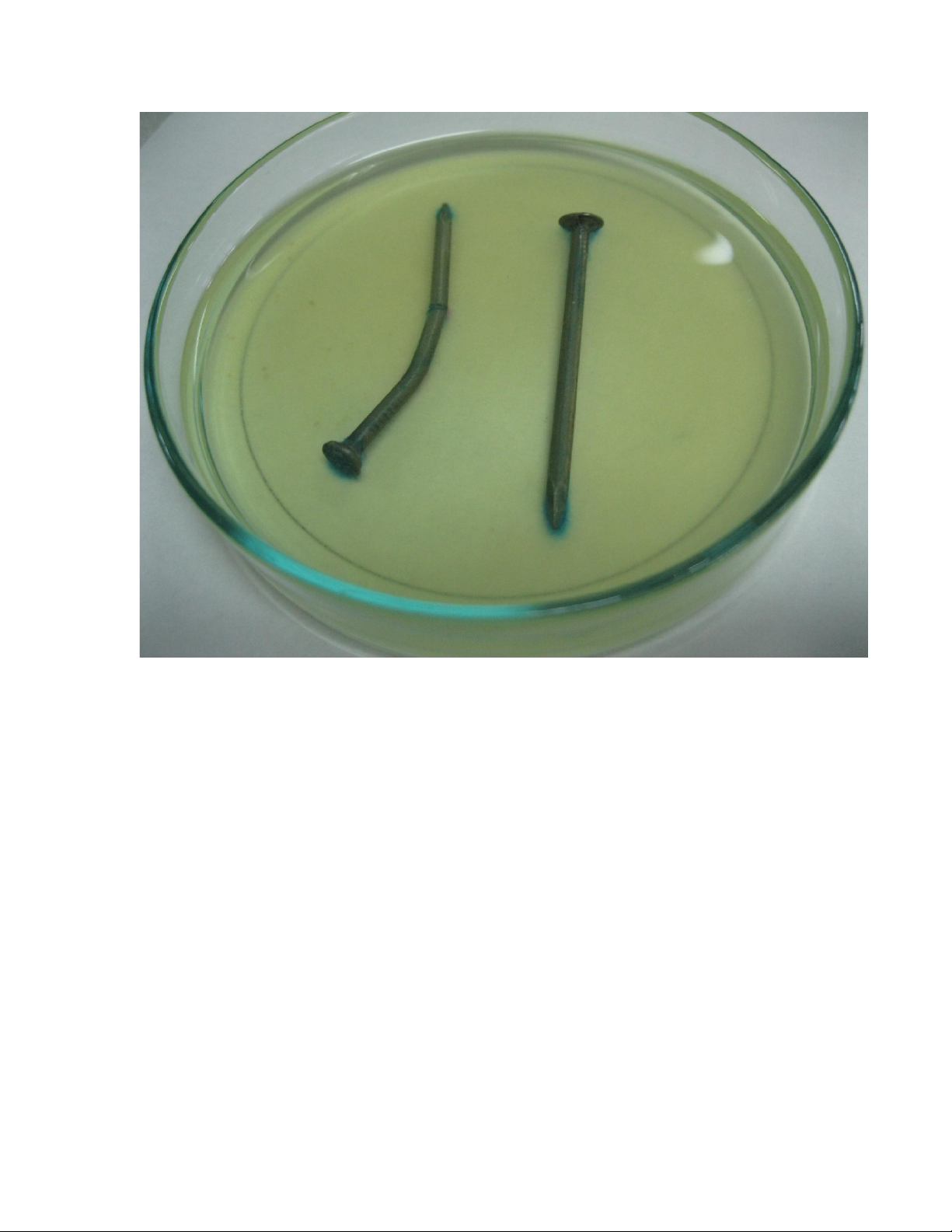
Đinh số1: Có sự xuất hiện màu xanh nhiều ở nơi đinh bị bẻ cong, bị kìm bấm vào
tạo vết trầy xước, ở đầu và mũi đinh
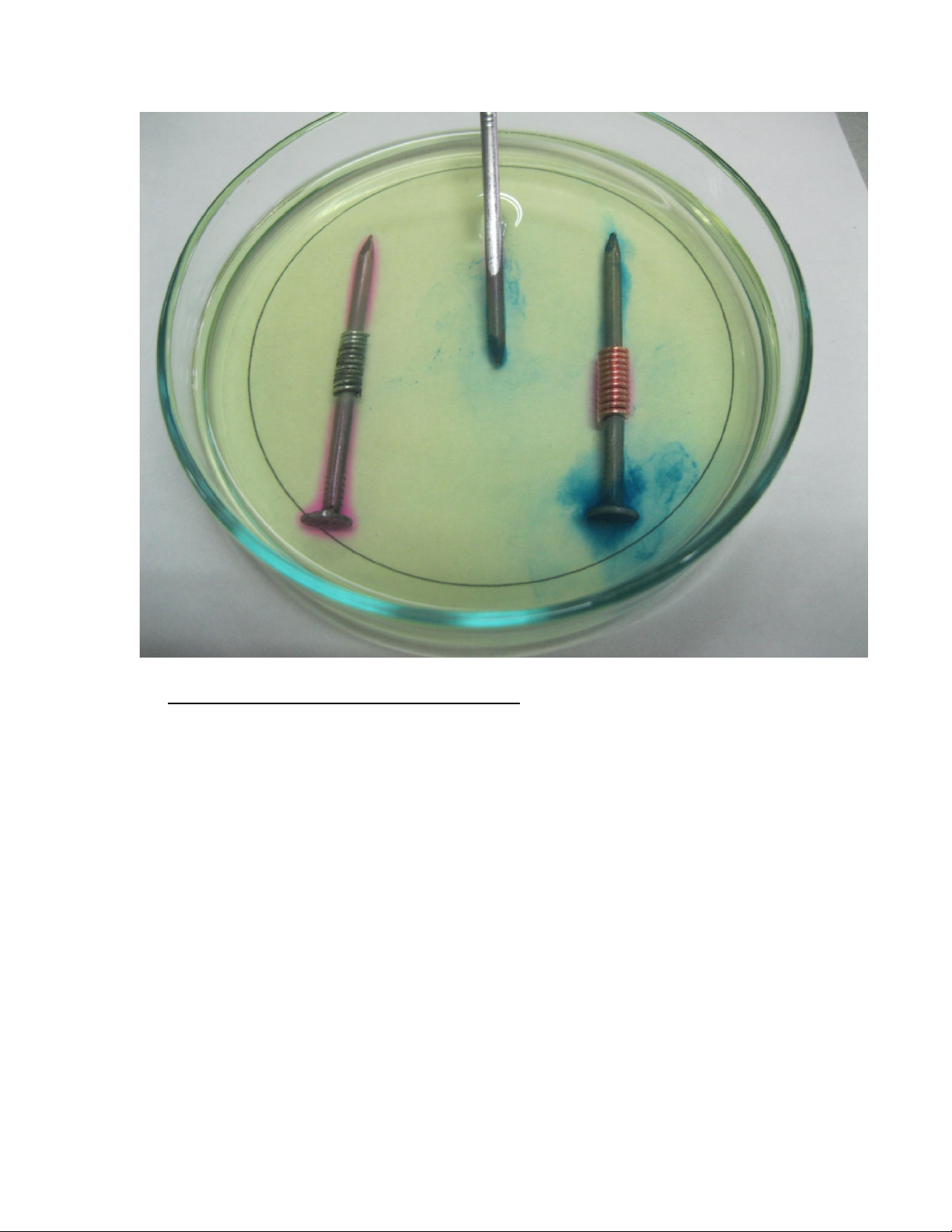
Đinh số 2: Xuất hiện màu xanh nhiều ở nơi tiếp xúc giữa sắt với đồng, ở đầu và mũi đinh.
Đinh số 3: Xuất hiện màu hồng ở đầu cũng như thân đinh ngoại trừ chỗ quấn dây
kẽm, xuất hiện màu xanh ở mũi đinh.
Đinh số 4:Đinh có màu xanh, nhất là phần đầu đinh và thân đinh. Ngoài ra đầu đinh hơi có màu hồng.
Đinh số 5: Màu xanh xuất hiện nhiều ở phần mũi đinh ngập trong dung dịch ăn mòn,
ở bề mặt dung dịch ăn mòn xuất hiện màu hồng nhạt và phần đinh ở ngoài không
khí không xảy ra hiện tượng gì.
5. Giải thích hiện tượng – So sánh lý thuyết: 5.1. Đinh số 1:
Do xảy ra sự ăn mòn không đồng đều đồng thời có sự tiếp xúc bề mặt tốt
giữa dung dịch ăn mòn (do ta tạo vết xước và bẻ cong thân đinh)
Ở 2 đầu đinh và chỗ gãy, Fe đóng vai trò là anod xảy ra sự oxi hoá Fe làm
xuất hiện màu xanh: → +
Xảy ra hiện tượng này tạo ra là do sự gia công và các ứng lực cơ học bổ
sung do sự rèn nguội ở đầu và mũi đinh, đồng thời do ta tạo sự khuyết tật
bề mặt làm tăng diện tích tiếp xúc làm phản ứng ăn mòn xảy ra mạnh mẽ và
nhanh hơn. Vì vậy, ta thấy hiện tượng ở đinh này xuất hiện rất nhanh.
Ở các vùng khác trên thân đinh, có sự tự khử nước hoặc tự khử oxi hoà
tan trong dung dịch tạo thành catod với sự có mặt OH- làm xuất hiện màu
hồng theo phản ứng: + → + + + →
Các electron di chuyển từ vùng oxi hoá Fe tới vùng khử oxi sâu dần bên
trong miếng kim loại trong khi sự di chuyển của các ion dẫn tới sự đóng kín mạch điện.
Sự có mặt của các ion Na+ và Cl- trong dung dịch ăn mòn làm cho dung dịch
dẫn điện mạnh hơn đẩy nhanh sự ăn mòn kim loại
Cơ cấu trên là cơ cấu của một vi pin. 5.2. Đinh số 2:
Ở vùng quấn dây đồng, Fe có tính khử mạnh hơn Cu nên Fe sẽ bị ăn mòn trước
đóng vai trò là anod làm xuất hiện màu xanh theo phản ứng: → +
Ta có thể kết luận nếu lớp phủ là một kim loại có tính khử yếu hơn sắt thì sắt sẽ bị ăn mòn nhanh hơn. 5.3. Đinh số 3:
Ở vùng quấn dây kẽm, do kẽm có tính khử mạnh hơn sắt nên trong trường hợp
này kẽm đóng vai trò là anod và xảy ra phản ứng: → +
Nhưng vì ion Zn2+ không tạo ra màu trong dung dịch này nên ta không thấy có hiện tượng gì.
Ở vùng khác trên thân đinh, tương tự cũng có sự tự khử nước hoặc tự khử oxi
hoà tan trong dung dịch tạo thành catod với sự có mặt OH- làm xuất hiện màu hồng theo phản ứng: + → + + + →
Ở mũi đinh xuất hiện màu xanh, do xảy ra sự oxi hoá Fe làm xuất hiện màu xanh: → +
Ta kết luận nếu lớp phủ là một kim loại có tính khử mạnh hơn sắt thì sắt sẽ được
bảo vệ, sự bảo vệ này được đảm bảo đến khi nào mà lớp bảo vệ chưa bị phá hoại hoàn toàn. 5.4.
Đinh số 4: Vẫn xảy ra sự ăn mòn không đồng đều
Ở đầu, mũi và thân đinh, Fe đóng vai trò là anod xảy ra sự oxi hoá Fe làm xuất hiện màu xanh: → +
Xảy ra hiện tượng này tạo ra là do đinh bị trầy xước ở thân, sự gia công và các ứng
lực cơ học bổ sung do sự rèn nguội ở đầu và mũi đinh nên chúng nhạy cảm hơn với sự ăn mòn.
Ở các vùng khác trên thân đinh, có sự tự khử nước hoặc tự khử oxi hoà tan trong
dung dịch tạo thành catod với sự có mặt OH- làm xuất hiện màu hồng theo phản ứng: + → + + + →
Các electron di chuyển từ vùng oxi hoá Fe tới vùng khử oxi sâu dần bên trong
miếng kim loại trong khi sự di chuyển của các ion dẫn tới sự đóng kín mạch điện.
Sự có mặt của các ion Na+ và Cl- trong dung dịch ăn mòn làm cho dung dịch dẫn
điện mạnh hơn đẩy nhanh sự ăn mòn kim loại
Cơ cấu trên là cơ cấu của một vi pin. 5.5. Đinh số 5:
Ở vùng mũi đinh, , Fe đóng vai trò là anod xảy ra sự oxi hoá Fe làm xuất hiện màu xanh: → +
Xảy ra hiện tượng này tạo ra là do sự gia công và các ứng lực cơ học bổ sung do
sự rèn nguội ở đầu và mũi đinh nên chúng nhạy cảm hơn với sự ăn mòn.
Ở mặt phân cách giữa dung dịch aga và môi trường, sự tự khử nước hoặc tự
khử oxi hoà tan trong dung dịch tạo thành catod với sự có mặt OH- làm xuất hiện
màu hồng theo phản ứng: + → + + + →
Do có tiếp xúc môi trường giàu oxi nên có xu hướng xảy ra phản ứng 2 nhiều hơn
phản ứng 1 và ở mặt phân cách ta thấy có sự xuất hiện màu hồng nhạt.
Sự có mặt của HCl để góp phần trung hoà sự xuất hiện quá nhiều của OH- làm mờ
nhạt màu xanh thể hiện sự có mặt của ion Fe2+. 5.6. Nhận xét:
Hiện tượng quan sát có thể khác biệt so với lý thuyết do nhiều nguyên nhân khác nhau:
o Đồng có thể bị quấn quanh chưa sát hoặc đinh sắt chưa được chà nhám kĩ.
o Thời gian chưa đủ lâu
o Dung dịch ăn mòn chưa đủ mạnh




