












Preview text:
ĐẠI HỌC QUỐC GIA THÀNH PHỐ HỒ CHÍ MINH
TRƯỜNG ĐẠI HỌC BÁCH KHOA
BÁO CÁO THÍ NGHIỆM
MÔN HÓA ĐẠI CƯƠNG LỚP L12 - HK212 Ngày nộp: 13/5/2022
Giảng viên hướng dẫn: Võ Nguyễn Lam Uyên
Sinh viên thực hiện Mã số sinh viên Phân công Phạm Hoàng San 2011965 Bài 1 và 2 Lê Quốc Quyền 2112155 Bài 4 Đỗ Ngọc Quý 2114595 Bài 8
Thành phố Hồ Chí Minh – 2022 MỤC LỤC
BÁO CÁO SỐ LIỆU THÍ NGHIỆM .................................................................................... 1
BÀI 1: KĨ THUẬT PHÒNG THÍ NGHIỆM ....................................................................... 3
BÀI 2: NHIỆT PHẢN ỨNG .................................................................................................. 7
BÀI 4: XÁC ĐỊNH BẬC PHẢN ỨNG..............................................................................17
BÀI 8: PHÂN TÍCH THỂ TÍCH.......................................................................................21
BÁO CÁO SỐ LIỆU THÍ NGHIỆM 1 2
BÀI 1: KĨ THUẬT PHÒNG THÍ NGHIỆM
I. GIỚI THIỆU DỤNG CỤ
1. Nhóm dụng cụ chứa hóa chất
Cốc thủy tinh (Becher) Mục đích
Cách sử dụng - Chứa, đựng hóa chất - Rửa sạch - Hòa tan - Tráng nước cất - Tráng hóa chất
2 . Nhóm dụng cụ phản ứng
Bình tam giác (Erlen) Mục đích
Cách sử dụng
- Nơi các loại hóa chất gặp nhau và - Rửa sạch xảy ra phản ứng - Tráng nước cất - Chưng cất
3 . Nhóm dụng cụ lấy hóa chất 3.1. Ống đong 3.2. Pipet
Gồm có 2 loại: Pipet vạch, Pipet bầu. 3.3 Buret
Mục đích và cách sử dụng của nhóm dụng cụ lấy hoá chất: Mục đích
Cách sử dụng Xác định thể tích - Rửa sạch - Tráng nước cất - Tráng hóa chất
4. Dụng cụ pha hóa chất: Bình định mức Mục đích:
Cách sử dụng: Pha loãng dung dịch - Rửa sạch - Tráng nước cất 3
5. Dụng cụ hỗ trợ
Quả bóp, đĩa cân, đũa khuấy, phễu, pipet nhựa, Bình tia,…
6. Thiết bị: Cân kỹ thuật
Cách sử dụng:
Bước 1: Khởi động cân bằng cách nhấn nút ON, đợi cân ổn định, lúc này trên màn hình hiện lên số 0,00g.
Bước 2: Đặt dĩa cân nhựa lên.
Bước 3: Nhấn nút Tare để trả khối lượng cân về 0g.
Bước 4: Cân và đọc kết quả.
Bước 5: Nhất nút OFF để tắt cân.
Lưu ý: Khối lượng tối đa cân đo được là 200g.
II. TIẾN HÀNH THÍ NGHIỆM
1. Thí nghiệm 1: Sử dụng Pipet
- Dùng pipet lấy 10ml nước từ becher cho vào erlen (hút nước bằng quả bóp cao su vàilần).
- Lặp lại phần thực hành trên. Cách cầm Pipet:
- Tay thuận cầm Pipet, dùng ngón tay trỏ giữ đầu trên cây Pipet.
- Tay còn lại dùng quả bóp cao su.
- Dùng quả bóp hút hóa chất.
- Chỉnh thể tích bằng ngón trỏ.
Cách đọc thể tích: Đọc mặt cong nhất của dung dịch chạm vạch thể tích cần xác định.
Lưu ý: Đối với Pipet bầu, ta cần phải lấy đến giọt cuối cùng.
Cách 1: Giữ pipet thẳng, bình tam giác nghiêng, xoay pipet và chấm trên miệng bình tam
giác đến khi dung dịch không rơi xuống nữa.
Cách 2: Giữ bình tam giác nghiêng, để dung dịch nghiêng qua một bên bình, xoay pipet
và chấm dưới đáy bình tam giác đến khi dung dịch không rơi xuống nữa. 4
2. Thí nghiệm 2: Sử dụng buret
- Dùng becher 50ml cho nước vào buret.
- Chờ cho đến khi không còn bọt khí sót lại trong buret.
- Dùng tay trái mở nhanh khóa buret sao cho dung dịch lấp đầy phần cuối của buret.
- Chỉnh buret đến mức 0.
- Dùng tay trái điều chỉnh khóa buret để cho 10ml nước từ buret vào becher. Cách sử dụng:
- Rửa sạch Tráng nước cất Tráng hóa chất. - Cho hóa chất lên buret. - Chỉnh bọt khí.
- Chỉnh buret đến mức 0.
- Dùng tay trái điều chỉnh khóa buret. (vị trí khóa đóng song song với mặt đất, vị tríkhóa
mở vuông góc với mặt đất)
Cách đọc thể tích: Đọc mặt cong nhất (hoặc mặt phẳng) của dung dịch chạm vạch thể
tích. Tuy nhiên cần đọc đồng bộ chỉ mặt cong (hoặc mặt phẳng) trong toàn bộ quá tình đọc thể tích.
3. Thí nghiệm 3: Chuẩn độ oxy hóa – khử
- Cân 0,6g axit oxalic cho vào cốc + nước cho vào bình định mức 100ml (tráng cốc,tráng đũa, tráng phễu).
- Cho nước vào bình định mức đến khi mặt cong nhất chạm vạch đậy nắp, lắc đềucho ra
ngoài cốc dung dịch B (dung dịch axit oxalic).
- Lấy buret đã rửa sạch, tráng nước cất, sau đó tráng bằng hóa chất 0,1N.
Cho dung dịch 0,1N vào buret.
- Rửa sạch, tráng nước cất bình tam giác. Pipet bầu 10ml được rửa sạch, tráng nướccất, tráng bằng dung dịch B.
- Dùng pipet hút 10ml dung dịch B + 10ml nước + 2ml vào bình tam giác. 5
- Mở khóa buret, để dung dịch vào bình tam giác và phản ứng với dung dịch B, khitạo
dung dịch màu hồng nhạt bền và còn ấm thì dừng lại. Đọc thể tích đã dùng trên buret.
4. Thí nghiệm 4: Pha loãng dung dịch
- Hút 10ml dung dịch HCl 1M bằng pipet bầu, cho vào bình định mức 100ml.
- Thêm nước vào bình định mức đến khi mặt cong nhất chạm vạch.
- Đóng nắp, lắc lên, thu được dung dịch A. Theo lý thuyết, ta có:
5. Thí nghiệm 5: Kiểm tra nồng độ dung dịch axit đã pha loãng
- Lấy buret đã rửa sạch, tráng nước cất, sau đó tráng bằng hóa chất NaOH 0,1M
Cho dung dịch NaOH 0,1M vào buret.
- Rửa sạch, tráng nước cất bình tam giác. Pipet bầu 10ml được rửa sạch, tráng nướccất, tráng bằng dung dịch A.
- Dùng pipet hút 10ml dung dịch A + 10ml nước + 2 giọt phenol phtalein vào bình tamgiác.
- Mở khóa buret, để dung dịch NaOH vào bình tam giác và phản ứng với dung dịch A,khi
tạo dung dịch màu hồng nhạt bền thì dừng lại. Đọc thể tích NaOH đã dùng trên buret. 6
BÀI 2: NHIỆT PHẢN ỨNG
I. MỤC ĐÍCH THÍ NGHIỆM
Trong thí nghiệm này, chúng ta sẽ đo hiệu ứng nhiệt của các phản ứng khác nhau và
kiểm tra lại định luật Hess
II. TIẾN HÀNH THÍ NGHIỆM
1. Thí nghiệm 1: Xác định nhiệt dung của nhiệt lượng kế
1.1 Mô tả thí nghiệm:
- Lấy 50ml nước cho vào becher dùng nhiệt kế để đo
- Lấy 50ml nước nóng cho vào nhiệt lượng kế, cắm nhiệt kế
- Đồng thời, lấy nhiệt kế ra và trả về nhiệt độ phòng + dùng phễu cho nước ở nhiệt
độthường vào và đóng nắp cắm nhiệt kế vào, lắc lên 1.2 Công thức: moco = mc Trong đó:
m: Khối lượng 50ml nước
c: Nhiệt dung riêng của nước (1 cal/g.độ)
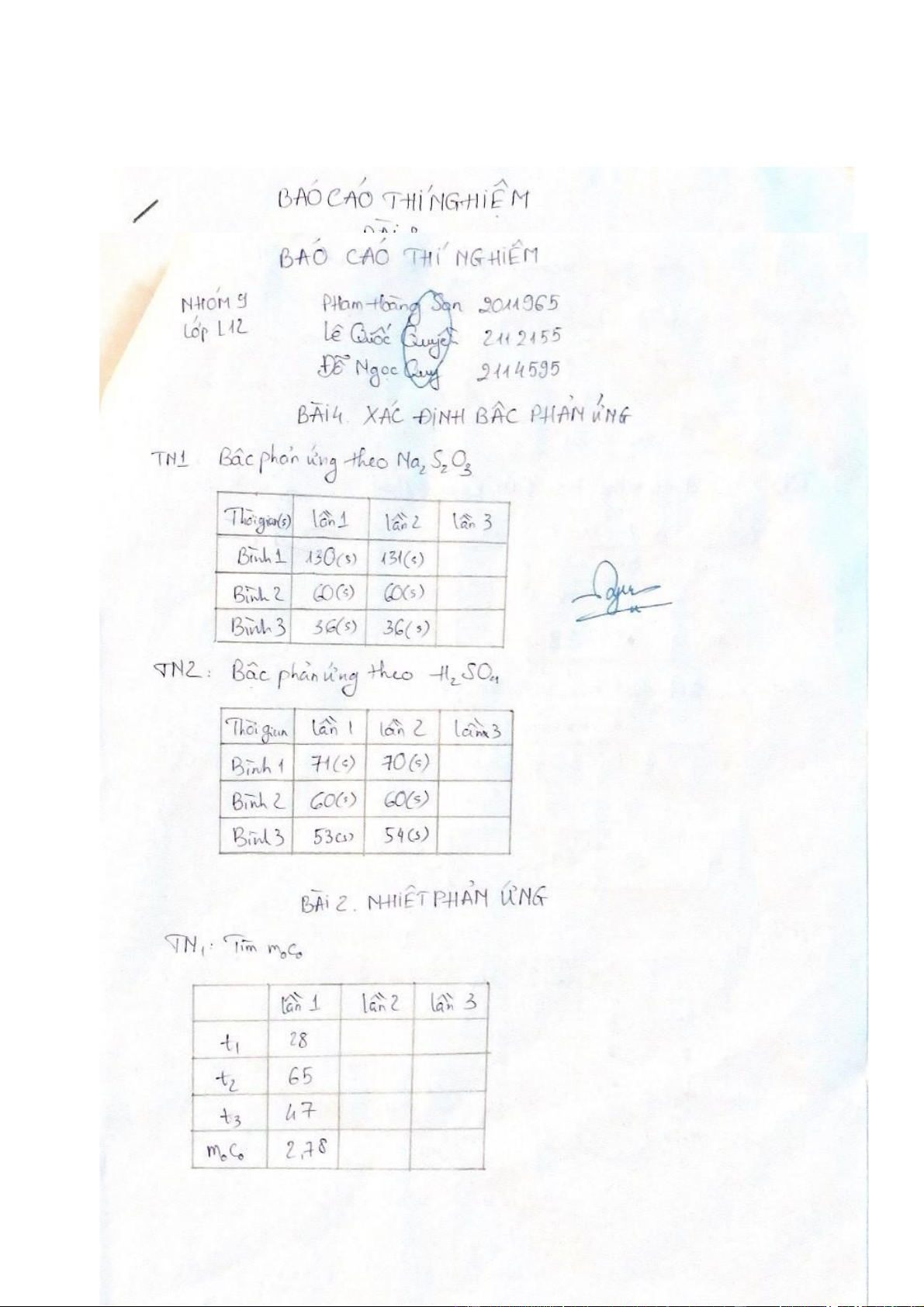
1.2 Kết quả thí nghiệm
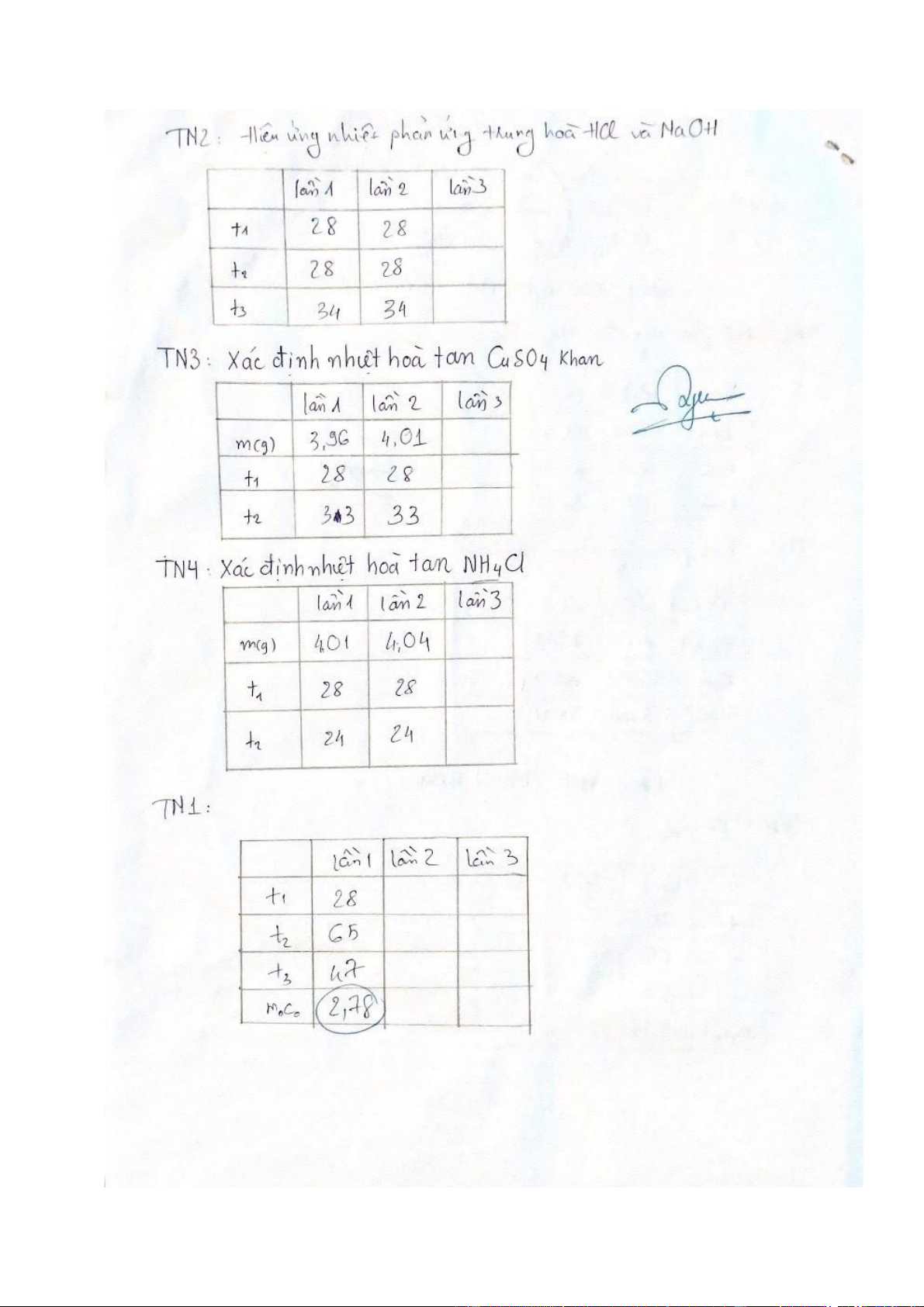
Nhiệt độ o C Lần 1 t 1 28 t 2 65 t 3 47
m o c o ( ) cal/độ 2 , 78
- Với m = 50 g và c = 1 cal/g.độ - Lần 1: cal/độ Suy ra:
2. Thí nghiệm 2: Xác định hiệu ứng nhiệt của phản ứng HCl và NaOH
2.1. Mô tả thí nghiệm:
Phương trình hóa học: 7 NaOH + HCl NaCl+ HCl
- Buret rửa sạch, tráng nước cất, tráng bằng dung dịch NaOH 1M cho dung dịchNaOH
vào chỉnh bọt khí chỉnh về vạch 0. Dùng buret lấy 25ml NaOH 1M cho vào cốc.
- Cắm nhiệt kế. Đo nhiệt độ
- Cách sử dụng buret tương tự như trên. Dùng buret lấy 25ml HCl 1M cho vào bìnhnhiệt lượng kế.
- Rửa nhiệt kế, cắm nhiệt kế vào bình nhiệt lượng kế. Đo nhiệt độ
- Lắp phễu vào bình nhiệt lượng kế, rót dung dịch NaOH vào Đóng nắp Lắp nhiệt kếvào,
lắc đều Đo nhiệt độ .
- Lặp lại thí nghiệm 3 lần (Nếu 2 lần làm thí nghiệm cho kết quả chênh lệch giữa nửa
độ thì không cần làm lần thứ 3). 2.2. Công thức: Trong đó:
m0c0: Nhiệt dung của nhiệt lượng kế (cal/độ) mc: Nhiệt
dung của dung dịch trong nhiệt lượng kế (cal/độ) =
2.3. Kết quả thí nghiệm 8
Nhiệt độ o C Lần 1 Lần 2 t 1 28 28 t 2 28 28 t 3 34 34 Q (cal) 316.68 316.68
Q TB (cal) 316.68 ∆H -12667,2 ( cal/mol )
- Với m = 50g; c = 1 cal/g.độ; n = 0,025 mol và - Lần 1: 2.4. Kết luận: Qtrung bình = 316.68 (cal) = - 12667,2 (cal/mol)
Phản ứng tỏa nhiệt (∆H < 0)
3. Thí nghiệm 3: Xác định nhiệt hòa tan khan – kiểm tra định luật Hess
3.1. Mô tả thí nghiệm
- Dùng ống đong lấy 50ml nước cho vào bình nhiệt lượng kế, cắm nhiệt kế . - Cân , ghi khối lượng
- Mở nắp bình nhiệt lượng kế, trút hết chất rắn vào nhiệt lượng kế, lắc tròn bình Đonhiệt độ . 9 3.2. Công thức = 1 (cal/g.độ)
Q = mct = ( TB + mnướccnước + )(t2 – t1) H =
3.3 . Kết quả thí nghiệm
Nhiệt độ o C Lần 1 Lần 2 m(g) 3 96 , 4 , 04 t 1 28 28 t 2 33 33 Q (cal) 283,7 284,1 ∆H (cal/mol) -11439,5 -11229,2
ΔH TB (cal/mol) -11334,35
Tính toán lý thuyết:
- Với m = 50 + = 50 + 4 = 54g ; c = 1 cal/g.độ; n = mol và Lần 1:
- Với m = 50 + mCuSO4 = 50 + 3.96 = 53,96g ; c = 1 cal/g.độ; n = mol và Lần 2:
- Với m = 50 + mCuSO4 = 50 + 4,04= 54,04g ; c = 1 cal/g.độ; n = mol và Sai số = 3.4. Kết luận: 10 -11356 0,2% (cal/mol)
Phản ứng tỏa nhiệt (∆H < 0)
4. Thí nghiệm 4: Xác định nhiệt hòa tan
4.1. Mô tả thí nghiệm
- Dùng ống đong lấy 50ml nước cho vào bình nhiệt lượng kế, cắm nhiệt kế . - Cân ghi khối lượng
- Mở nắp bình nhiệt lượng kế, trút hết chất rắn vào nhiệt lượng kế, lắc tròn bình Đonhiệt độ . 4.2. Công thức = 1 (cal/g.độ)
Q = mct = ( TB + mnướccnước + )(t2 – t1) H =
4.3 . Kết quả thí nghiệm
Nhiệt độ o C Lần 1 Lần 2 m(g) 4 01 , 4 , 04 t 1 28 28 t 2 24 24 Q (cal) -227,16 -227,28 ∆H (cal/mol) 3028,93 2990,53
ΔH TB (cal/mol) 3009,73
Tính toán lý thuyết:
- Với m = 50 + = 50 + 4 = 54g ; c = 1 cal/g.độ; n = mol và Lần 1:
- Với m = 50 + = 50 + 4.01 = 54,01g ; c = 1 cal/g.độ; n = mol và 11 Lần 2:
- Với m = 50 + = 50 + 4,04= 54,04g ; c = 1 cal/g.độ; n = mol mol và Sai số = 4.3 Kết luận: 3009,73 0,6% (cal/mol)
Phản ứng thu nhiệt (∆H > 0)
III. TRẢ LỜI CÂU HỎI
1. của phản ứng HCL + NAOH NACL +H2O sẽ được t1inh theo số mol HCl hay
NaOH khi cho 25 ml dd HCL 2M tác dụng với 25 ml dd NAOH 1M? tại sao? Trả lời: HCl + NaOH NaCl + H2O Ban đầu: 0,05 0,025 (mol)
Phản ứng: 0,025 0,025 (mol) Còn lại: 0,025 0 (mol)
Ta thấy NaOH hết và HCl còn dư, nên ∆Hth của phản ứng tính theo NaOH. Vì lượng
HCl dư không tham gia phản ứng nên không sinh nhiệt.
2. Nếu thay HCl 1M bằng HNO3 1M thì kết quả thí nghiệm 2 có thay đổi hay không? Trả lời:
- Về bản chất của thí nghiệm sẽ không thay đổi vì hai axit này là như nhau,
đều là axit mạnh, phản ứng trung hòa giữa axit và bazơ.
- Lúc này muối thu được là , có nhiệt dung riêng khác, nhiệt lượng phản ứng
tỏa ra cũng sẽ khác do năng lượng liên kết trong khác HCl, khác NaCl , từ đó
làm cho ∆t thay đổi dẫn đến kết quả thay đổi.
3. Tính ∆H bằng lý thuyết theo định luật Hess. So sánh với kết quả thí nghiệm.
Hãy xem 6 nguyên nhân có thể gây ra sai số trong thí nghiệm này: 12
+ Mất nhiệt do nhiệt lượng kế. + Do nhiệt kế
+ Do dụng cụ đong thể tích hóa chất + Do cân
+ Do sunphat đồng bị ẩm
+ Do lấy nhiệt dung riêng dung dịch sunphat đồng bằng 1 cal/mol.độ.
Theo em sai số nào là quan trong nhất, giải thích? Còn nguyên nhân nào khác không? Trả lời:
+ Theo em kết quả thí nghiệm sẽ bé hơn và chênh lệch nhiều so với trên lý thuyết.
+ Trong 6 nguyên nhân trên, nguyên nhân quan trọng nhất là do sunfat đồng bị hút ẩm.
Vì ở điều kiện thường độ ẩm cũng khá cao, chúng ta sử dụng ở dạng khan nên ngay khi
tiếp xúc không khí nó sẽ hút ẩm ngay lập tức và tỏa ra một nhiệt lượng đáng kể, đủ để
làm lệch đi giá trị t2 chúng ta đo ở mỗi lần thí nghiệm.
+ Theo nhóm em còn hai nguyên nhân khác làm cho kết quả sai khác nhau:
− Sự chính xác của cân điện tử, lượng chất mỗi lần chúng ta lấy là khác nhau cũng gây ra
sự biến đổi nhiệt đáng kể.
− Lượng trong phản ứng có thể không tan hết làm mất đi một lượng đáng kể phải được
sinh ra trong quá trình hòa tan.
BÀI 4: XÁC ĐỊNH BẬC PHẢN ỨNG
I. MỤC ĐÍCH THÍ NGHIỆM:
- Nghiên cứu ảnh hưởng của nồng độ đến vận tốc phản ứng.
- Xác định bậc của phản ứng phân hủy Na2S2O3 trong môi trường axit.
II. TIẾN HÀNH THÍ NGHIỆM: 13
1. Xác định bậc phản ứng theo Na2S2O3
1.1. Mô tả thí nghiệm: T Ống nghiệm V Erlen N (ml) H 2 SO 4 0,4M V ( ml ) V (ml) H 2 O Na 2 S 2 O 3 0,1M 1 8 4 28 2 8 8 24 3 8 16 16
Mỗi thí nghiệm nhỏ làm đồng thời hai bình giống nhau
Thí nghiệm 1:
a) Lấy hóa chất: - Lấy H 2SO4:
+ Rửa pipet, thấm khô, tráng H2SO4 qua pipet
+ Đặt mắt ngang vạch số 8, dùng quả bóp cao su hút H2SO4 vào pipet vượt qua
vạch 0, rồi thả sao cho mặt cong nhất chạm vạch 0
+Thả H2SO4 từ vạch 0 đến vạch 8 vào ống nghiệm, ta được 8ml H2SO4 -
Lấy Na 2S2O3 và nước vào bình tam giác:
+ Rửa buret, khóa buret bằng tay trái
+ Cho H2O đầy cây buret, chỉnh hết bọt khí, chỉnh về 0, thả từ vạch 0 đến vạch 25
vào bình tam giác rồi khóa lại. Lấy H2O đầy buret lần nữa, căn chỉnh như trên, tiếp
tục thả từ vạch 0 đến vạch 3 vào bình tam giác ta được 28ml H2O.
+ Rửa buret, tráng nước cất, tráng Na2S2O3 rồi đổ bỏ, khóa buret bằng tay trái.
+ Cho Na2S2O3 đầy cây buret, chỉnh hết bọt khí, chỉnh về 0, thả từ vạch 0 đến vạch
4 vào bình tam giác rồi khóa lại, ta được 4ml Na2S2O3
b) Tiến hành: Làm đồng thời 2 bình:
- Gá ống nghiệm H2SO4 trên miệng bình tam giác, cùng lúc đổ H2SO4 vào bình tam giác
và bấm giờ, lắc nhẹ bình tam giác. 14
- Đến khi dung dịch bắt đầu chuyển sang đục thì bấm đồng hồ lần nữa thì thu được t1 t
- Lấy trung bình 1 của hai bình.
Thí nghiệm 2: Tương tự TN1, nhưng dung dịch gồm 8ml H2SO4, 24ml H2O và 8ml t Na 2 2S2O3, thu được
Thí nghiệm 3: Tương tự TN1, nhưng dung dịch gồm 8ml H2SO4, 16ml H2O và 16ml
Na2S2O3, thu được t3
1.2 . Kết quả thí nghiệm
Nồng độ ban đầu (M) TN
NA 2 S 2 O 3
H 2 SO 4 1 0,1 0,4 130 131 130,5 2 0,1 0 , 4 60 60 60 3 0,1 0 , 4 36 36 36
Từ của TN1 và TN2 xác định :
Từ của TN2 và TN2 xác định : = 0,73
Bậc phản ứng theo Na2S2O3 = 0,93
2. Xác định bậc phản ứng của H2SO4
2.1. Mô tả thí nghiệm: 15
- Thao tác tương tự phần 1 với lượng axit và NA2S2O3 theo bảng sau: Ống nghiệm V Erlen T ( ml) H 2 SO 4 0,4M V (ml) Na 2 S 2 O 3 V (ml) N 0 ,1M H 2 O 1 4 8 28 2 8 8 24 3 16 8 16
2.2. Kết quả thí nghiệm: Tính nồng độ ban đầu: TN 1 , 0 1 , 0 4 71 70 , 70 5 2 0 , 1 0 , 4 60 60 60 3 0 ,1 0 ,4 53 54 53,5
Kết luận bậc phản ứng: Từ của TN1 và TN2 xác định n12. Từ của TN2 và TN3 xác định n23
Bậc phản ứng theo: = 0,2
III. Trả lời câu hỏi:
1. Trong TN trên nồng độ của Na2S2O3 (A) và của H2S04 (B) đã ảnh hưởng thế nào
lên vận tốc phản ứng.Viết lại biểu thức tính tốc độ phản ứng. Xác định bậc của phản ứng.
• Nồng độ của Na2S2O3 tỉ lệ thuận với tốc độ phản ứng.
• Nồng độ của H2SO4 hầu như không ảnh hưởng đến tốc độ phản ứng.
• Biểu thức tính tốc độ phản ứng: v=k [Na2S2O3]0,93[H2SO4]0,2, trong đó: m, n là hằng
số dương xác định bằng thực nghiệm.
• Bậc phản ứng: m+ n = 1,13
2. Cơ chế của phản ứng trên có thể được viết lại như sau:
H2SO4 + Na2S2O3 →Na2SO4 + H2S2O3 (1) 16 H2S2O3 →H2SO3 + S↓ (2)
Dựa vào kết quả thí nghiệm có thể kết luận phản ứng (1) hay (2) là phản ứng quyết
định vận tốc phản ứng là phản ứng xảy ra chậm nhất không? Tại sao? Lưu ý trong
các thí nghiệm trên, lượng axit H2SO4 luôn luôn dư so với Na2S2O3.
• Phản ứng (1) là phản ứng trao đổi ion nên tốc độ phản ứng xảy ra nhanh.
• Phản ứng (2) xảy ra chậm hơn.
→ Phản ứng (2) quyết định tốc độ phản ứng và là phản ứng xảy ra chậm nhất vì bậc của
phản ứng là bậc của phản ứng (2).
3. Dựa trên cơ sở của phương pháp TN thì vận tốc xác định được trong các TN
trênđược xem là vận tốc trung bình hay là vận tốc tức thời?
• Dựa trên cơ sở của phương pháp TN thì vận tốc xác định được trong các TN trên
được xem là vận tốc tức thời vì vận tốc phản ứng được xem bằng tỉ số △C/△T .
Vì △C=0 (do lưu huỳnh thay đổi không đáng kể nên △C= dC ).
4. Thay đổi thứ tự cho H2SO4 và Na2S2O3 thì bậc của phản ứng có thay đổi không? Tại sao?
Bậc phản ứng không thay đổi vì bậc phản ứng chỉ phụ thuộc vào nhiệt độ và bản chất của
phản ứng mà không phụ thuộc vào quá trình tiến hành.
BÀI 8: PHÂN TÍCH THỂ TÍCH
I. MỤC ĐÍCH THÍ NGHIỆM
Lập đường cong chuẩn độ giữa:
- Axit mạnh và bazơ mạnh.
- Axit yếu và bazơ mạnh.
Từ đó giúp ta lựa chọn chỉ thị phù hợp với phản ứng và mục đích thí nghiệm.
II. TIẾN HÀNH THÍ NGHIỆM
1. Thí nghiệm 1: Xây dựng đường cong chuẩn độ axit mạnh bằng bazơ mạnh 17
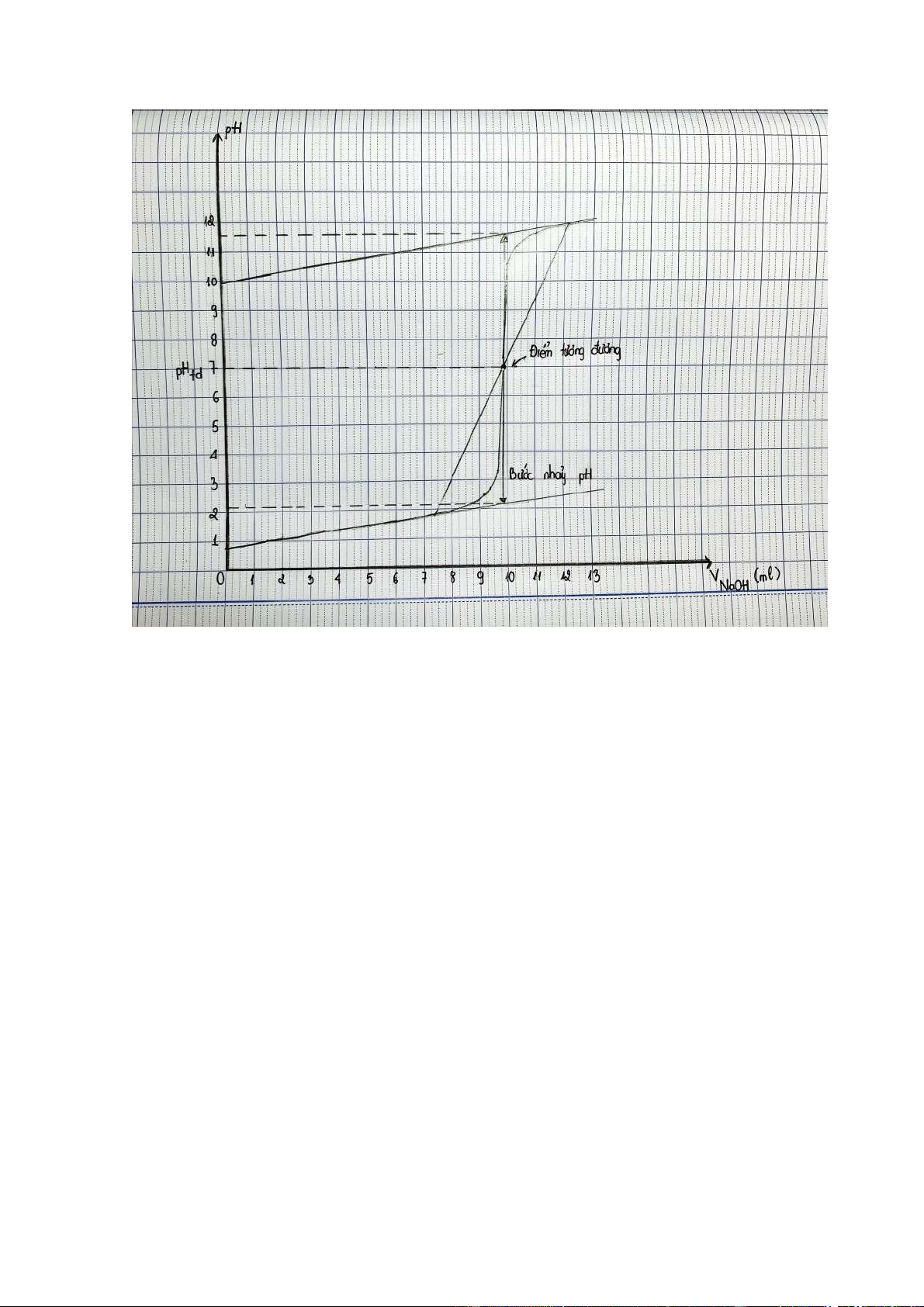
Đường cong chuẩn độ HCl bằng NaOH
- pH điểm tương đương: 7.
- Bước nhảy pH: từ 2,2 đến 11,6.
2. Thí nghiệm 2: Chuẩn độ axit mạnh - bazơ mạnh bằng chỉ thị phenolphtalein
2.1. Tiến hành thí nghiệm
- Buret được rửa sạch, tráng nước cất, tráng bằng dung dịch NaOH 0,1N Cho dungdịch
NaOH 0,1N vào buret Chỉnh bọt khí Chỉnh về vạch 0.
- Pipet rửa sạch, tráng nước cất, tráng HCl. Dùng pipet hút 10ml dung dịch HCl
(chưabiết nồng độ), cho vào bình tam giác + nước + 2 giọt phenolphtalein.
- Mở khóa buret cho NaOH nhỏ từ từ xuống bình tam giác, vừa nhỏ vừa lắc nhẹ
dungdịch trong bình chuyển sang màu hồng nhạt bền. Đọc thể tích NaOH đã dùng.
2.2. Kết quả thu được 18




