







Preview text:
BỘ GIÁO DỤC VÀ ĐÀO TẠO
ĐẠI HỌC ĐÀ NẴNG KHOA Y DƯỢC
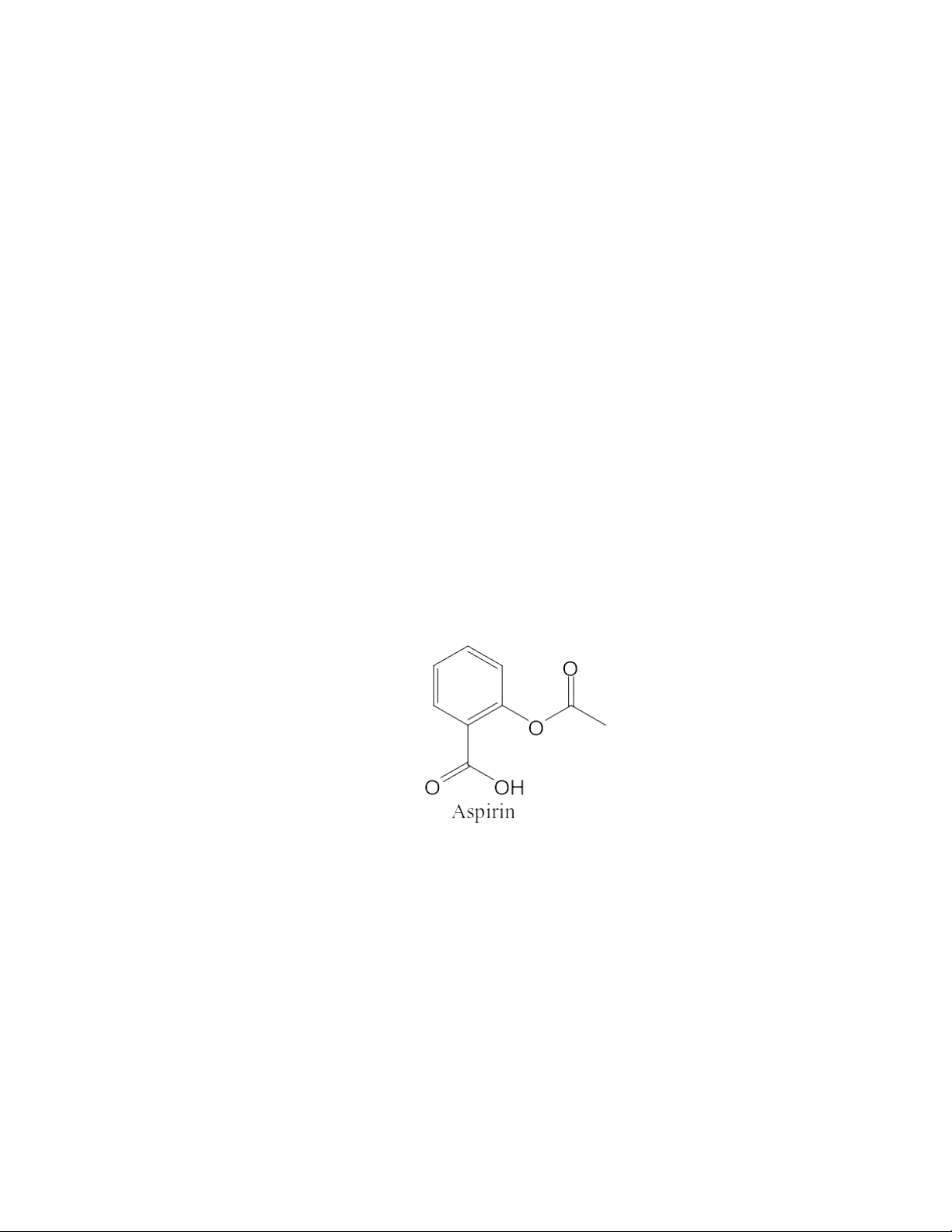
BÁO CÁO THỰC HÀNH HÓA DƯỢC 2 KIỂM ĐỊNH ASPIRIN
Giáo viên hướng dẫn: ThS. DS. Trương Phú Chí Hiếu
Tổ 2 – Nhóm 1 – Lớp D20 Sinh viên thực hiện 1.
Lê Thị Thúy Trâm – Lớp D20 – MSSV: 207720201160 2.
Trần Thị Vân Nhi – Lớp D20 – MSSV: 197720201142 3.
Phan Vũ Như Huyền – Lớp D20 – MSSV: 207720201136 4.
Hoàng Phương Lan – Lớp D20 – MSSV: 207720201139 5.
Nguyễn Thị Như – Lớp D20 – MSSV: 207720201145
Đà Nẵng – 2023 Mục lục
I) Mục tiêu......................................................................................... . . . . . . . . . . . . . . 1
II) Cơ sở lý thuyết................................................................................................. . . . . .1
1. Tính chất. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..............1
2. Tác dụng dược lý. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .......................2
3. Tác dụng phụ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .........................2
III) Thực hành..................................................................................................... . . . . . .2
1. Định tính Aspirin. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .....................2
1.1 Hóa chất và dụng cụ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .........................2
1.2 Tiến hành. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ........2
2. Thử tinh khiết. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..............................6
2.1 Giới hạn chloride. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..............7
2.1.1. Dụng cụ, hóa chất. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ......7
2.1.2. Tiến hành. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ................................7
2.2 Giới hạn sulfate. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ............................8
2.2.1. Dụng cụ, hóa chất. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ......8
2.2.2. Tiến hành. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ................................9
2.3 Giới hạn salicylic tự do. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ...10
2.3.1 Dụng cụ, hóa chất. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .......10
2.3.2 Tiến hành. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .................................10
3. Định lượng. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ...........12
3.1 Nguyên tắc. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ....12
3.2 Cách tiến hành. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..................12
3.3 Tính toán kết quả. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ................12
IV) Pha hóa chất............................................................................. . . . . . . . . . . . . . . .12 KIỂM ĐỊNH ASPIRIN (ACID ACETYL SALICYLIC) I) Mục tiêu - Định tính Aspirin
- Thử tinh khiết Aspirin qua + giới hạn chloride + giới hạn sulfate
+ giới hạn salicylic tự do
- Định lượng Aspirin qua tính độ tinh khiết của chế phẩm
II) Cơ sở lý thuyết
- Công thức phân tử : C9H8O4 - Phân tử lượng: 180,16 - Công thức hóa học: 1. Tính chất
+ Tinh thể không màu hay bột kết tinh trắng.
+ Không mùi hoặc có thể có mùi dấm (do bị phân hủy trong không khí ẩm).
+ Độ tan: khó tan trong nước, dễ tan trong ethanol 96%, tan trong ether, chloroform, tan
trong dd kiềm (do tính acid).
+ Điểm chảy: khoảng 1430C. 1
2. Tác dụng dược lý
- Giảm đau, hạ sốt, chống viêm
- Tăng thải trừ acid uric qua nước tiểu
- Tác dụng chống kết tập tiểu cầu 3. Tác dụng phụ - Ức chế tim
- Kích ứng dạ dày: dùng dạng đặc biệt (viên bao tan trong ruột) hay dạng muối (canxi acetyl salicylat, muối nhôm)
- Ức chế co bóp tử cung làm trì hoãn chuyển dạ III) Thực hành
1. Định tính Aspirin
1.1 Hóa chất và dụng cụ Hóa chất Dụng cụ Chế phẩm 0.3g Bếp cách thủy Dd NaOH 10% Phễu, giá, giấy lọc Dd H2SO4 10% Đũa thủy tinh Dd FeCl3 10% Cốc có mỏ Ca(OH)2 0,5g Pipet Dd nitrobenzaldehyde 0,05ml Bếp cồn Dd HCl loãng Ống nghiệm thủy tinh Kẹp gỗ 1.2 Tiến hành
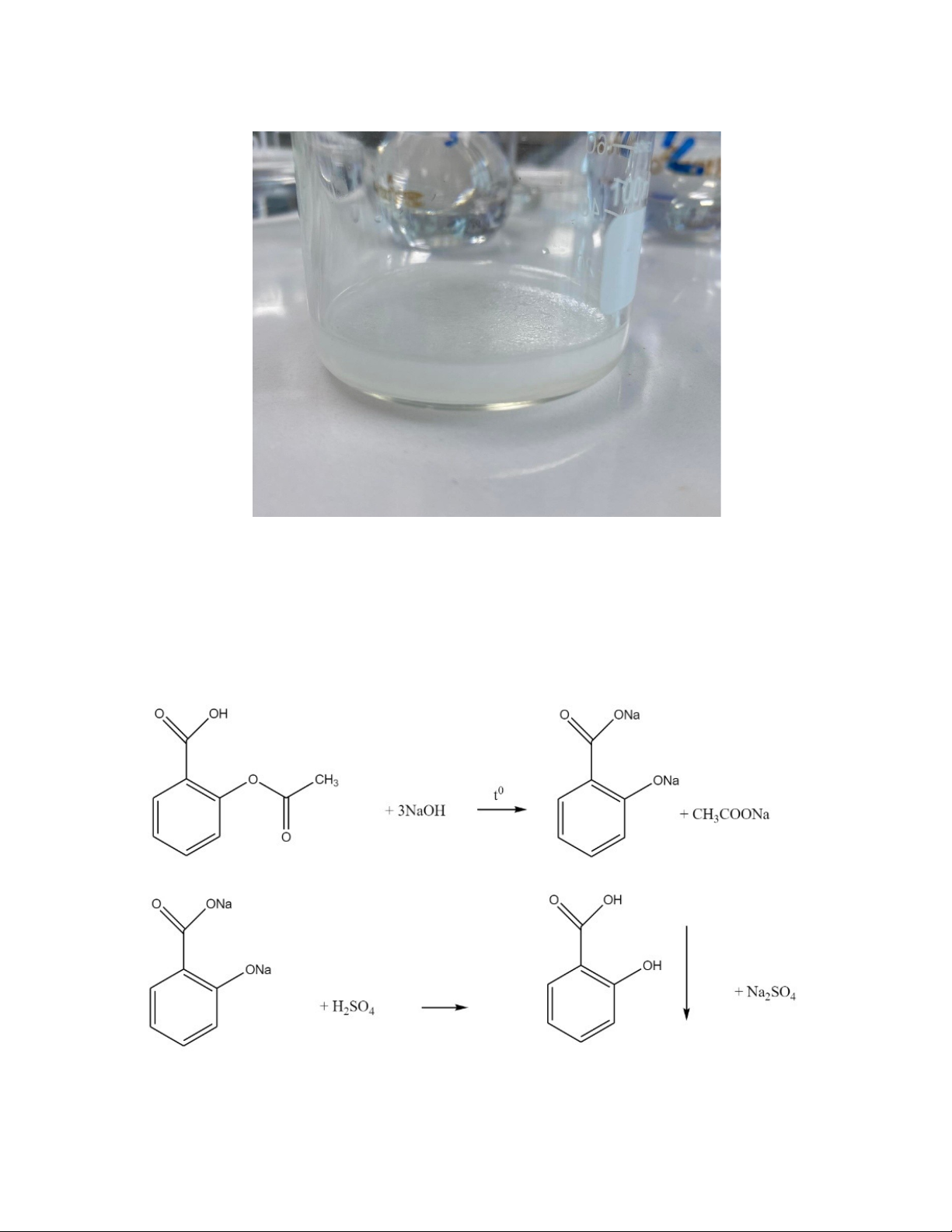
- Đun 0,2 g chế phẩm với 4 ml dung dịch NaOH 10% trong 3 phút, để nguội và acid hóa
bằng 5 ml dung dịch H2SO4 10%
+ Hiện tượng: có kết tủa dạng tinh thể xuất hiện. Kết tủa này sau khi được lọc, rửa với nước
và sấy khô có điểm chảy từ 156-161 0 C. 2
Hiện tượng kết tinh + Kết quả: Đạt
+ Giải thích: Cho NaOH vào aspirin khi đun tạo thành 2 muối Natri salicylat và Natri acetat,
thêm H2SO4 vào sẽ tạo ra acid salicylic (kết tủa trắng) 3
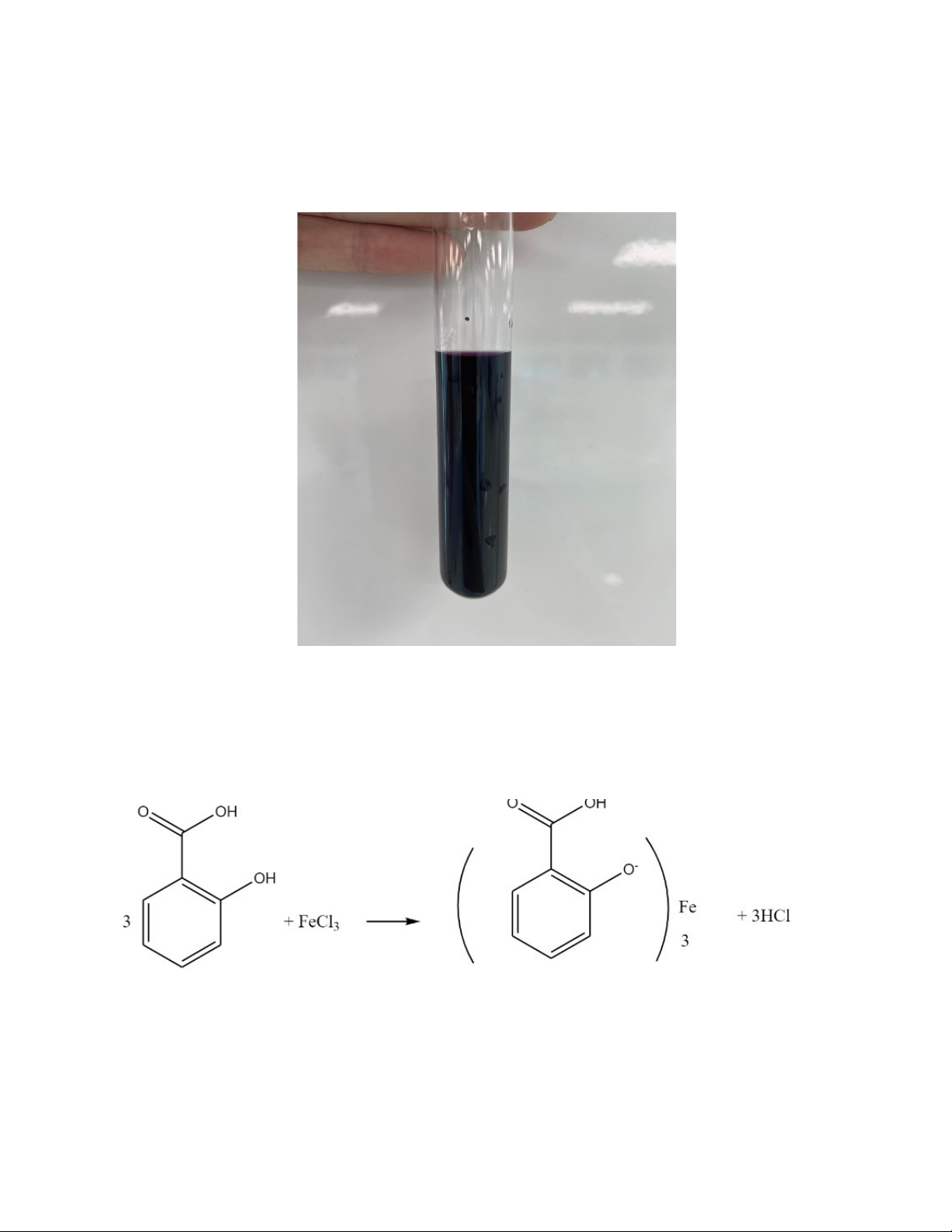
-Hòa tan bằng cách đun nóng khoảng 20 mg kết tủa thu được từ thí nghiệm trên với 10 ml
nước cất và làm nguội. Thêm 1 giọt dung dịch FeCl3 10%:
+Hiện tượng: xuất hiện phức có màu tím. + Kết quả: Đạt
+ Giải thích: Acid acetic khi phản ứng với sắt III sẽ tạo phức có màu tím.
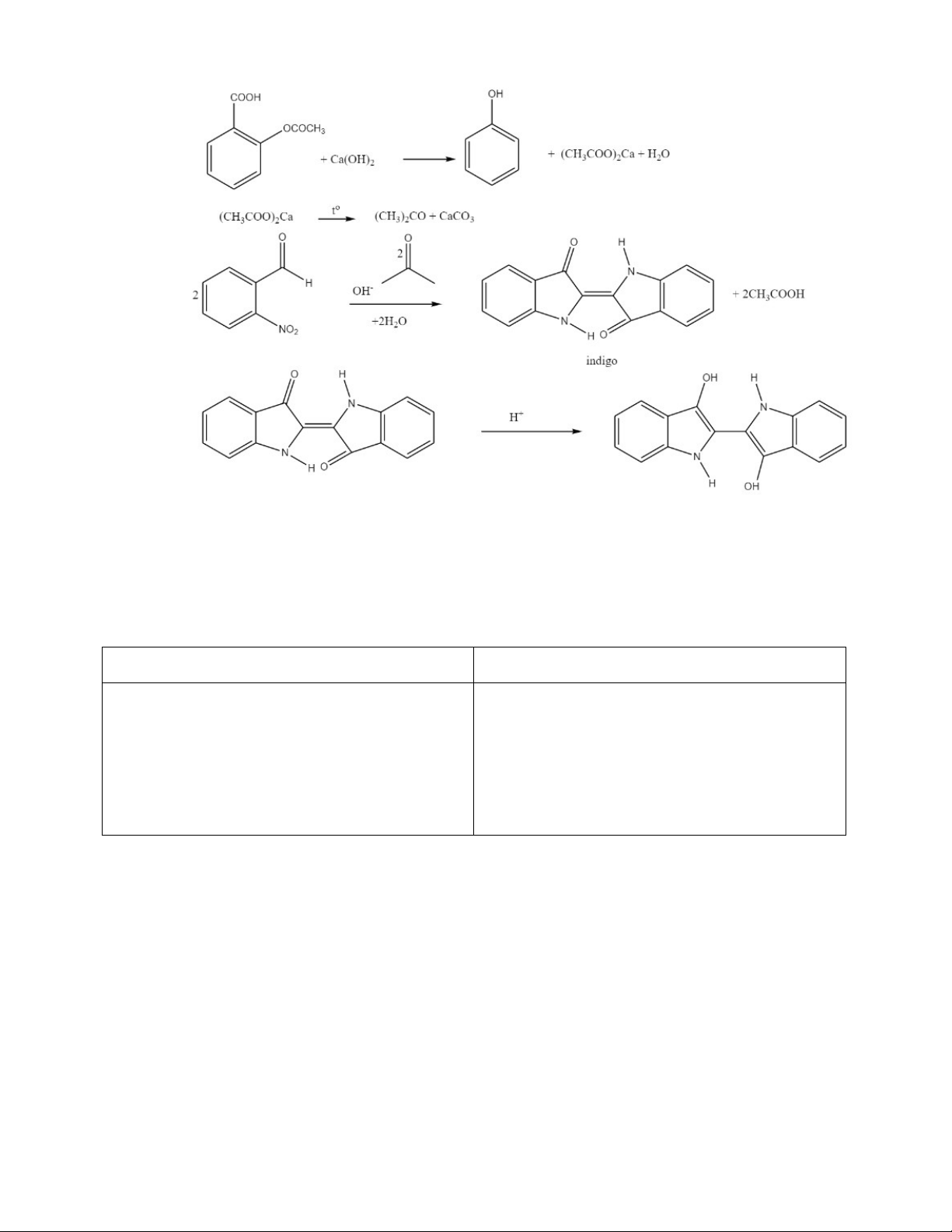
-Trong một ống nghiệm, trộn 0,1 g chế phẩm với 0,5 g Ca(OH)2. Đun nóng hỗn hợp và cho
khói tạo thành tiếp xúc với giấy lọc tẩm 0,05 ml dung dịch nitrobenzaldehyde 4
+ Hiện tượng: Xuất hiện màu vàng ánh lục (xanh lá cây hơi vàng) hoặc xanh lam ánh lục
(xanh lá cây hơi xanh dương). Làm ẩm tờ giấy lọc với dung dịch HCl loãng, màu sẽ chuyển thành xanh lam. + Kết quả: Đạt
+ Giải thích: Aspirin tác dụng với Ca(OH)2 tạo ra (CH3COO)2Ca, nhiệt phân tạo ra acetone.
Acetone tác dụng với nitrobenzaldehyde tạo ra hợp chất indigo có màu xanh lá hơi vàng,
hợp chất này có màu xanh dương trong môi trường axit nên khi làm ẩm giấy lọc bằng dung
dịch HCl loãng ta thấy được màu xanh lam trên giấy lọc. 5 2. Thử tinh khiết
Dụng cụ, hóa chất pha dung dịch A Dụng cụ Hóa chất Becher 100ml Aspirin 1g Bình định mức 50ml Nước cất Giấy lọc Ống đong 50ml
Pha dung dịch A: cho khoảng 1,0 g chế phẩm vào cốc có mỏ, thêm 25 ml nước cất, đun sôi
trong 5 phút, để nguội rồi lọc lấy dịch lọc vào bình định mức 50 ml. Dùng nước cất tráng
giấy lọc, hứng vào bình định mức vừa đủ đến vạch thu được dung dịch A, dùng để làm các kiểm định sau: *Lưu ý:
+ Đun để hòa tan các tạp Cl- và SO 2-
4 vào trong nước, tráng giấy lọc bằng dung dịch cần lọc, bỏ 10ml dịch lọc đầu 6
+ Để tránh hiện tượng các chất (Aspirin, Acid salicylic) kết tủa trong bình định mức thì phải
để nguội rồi mới lọc
2.1 Giới hạn chloride Không được quá 0,015%
2.1.1. Dụng cụ, hóa chất Dụng cụ Hóa chất Ống nghiệm Dung dịch A Pipet
Dung dịch chuẩn chloride 5ppm HNO3 30% AgNO3 2% 2.1.2. Tiến hành -
Ống thử: lấy 8,3 ml dung dịch A, thêm nước cất vừa đủ 16 ml. -
Ống chuẩn: lấy 10 ml dung dịch chuẩn chloride 5 ppm, thêm nước cất vừa đủ 16 ml. -
Cho vào mỗi ống 0,5 ml dung dịch HNO3 30%, 0,5 ml dung dịch AgNO3 2%, lắc đều.
Sau 5 phút, so sánh độ đục của hai ống: ống thử không được đục hơn ống chuẩn. - Hiện tượng:
+ Xuất hiện kết tủa trắng
+ Ống thử không đục hơn ống chuẩn 7 Ống chuẩn Ống thử -Kết luận: Đạt - Giải thích:
+ Xuất hiện kết tủa trắng do ion Cl- tác dụng với ion Ag+ tạo ra AgCl.
+ Ống thử không được đục hơn ống chuẩn vì giới hạn clorid không được vượt quá 0.015% PTPỨ: Ag+ + Cl-AgCl
2.2 Giới hạn sulfate Không được quá 0,04%.
2.2.1. Dụng cụ, hóa chất Dụng cụ Hóa chất Ống nghiệm Dung dịch A Pipet Nước cất
Dung dịch chuẩn sulfate 10 ppm HCl 3M 8 BaCl2 5% 2.2.2. Tiến hành -
Ống thử: lấy 9,4 ml dung dịch A, thêm nước cất vừa đủ 16 ml. -
Ống chuẩn: lấy 15 ml dung dịch chuẩn sulfate 10 ppm, thêm nước cất vừa đủ 16 ml. -
Cho vào mỗi ống 0,5 ml dung dịch HCl 3M, 1 ml dung dịch BaCl2 5%, lắc đều. Sau 5
phút, so sánh độ đục của hai ống: ống thử không được đục hơn ống chuẩn. - Hiện tượng:
+ Xuất hiện kết tủa trắng
+ Ống thử không đục hơn ống chuẩn Ống thử Ống chuẩn -Kết luận: Đạt - Giải thích:
+ Xuất hiện kết tủa trắng do ion SO 2-
4 tác dụng với ion Ba2+ tạo ra BaSO4. 9
+ Ống thử không được đục hơn ống chuẩn vì giới hạn sunfate không được vượt quá 0.04% PTPỨ: Ba2+ + SO 2- 4 BaSO4
2.3 Giới hạn salicylic tự do Không được quá 0,1%.
2.3.1 Dụng cụ, hóa chất Dụng cụ Hóa chất Ống nghiệm Acid salicylic 10mg Pipet Acid acetic băng 0.1ml Bình định mức 100ml Ethanol 960 Aspirin 0.1g Nước cất lạnh FeCl3 0,5% 2.3.2 Tiến hành
Pha dung dịch acid salicylic chuẩn: hòa tan 10 mg acid salicylic, 0,1 ml acid acetic băng và
ethanol 960 cho vừa đủ 100 ml. -
Ống thử: hòa tan 0,1 g chế phẩm trong 5 ml ethanol 960, lắc đều rồi thêm ngay 15 ml nước cất lạnh. -
Ống chuẩn: lấy 1 ml dung dịch acid salicylic chuẩn, 4 ml ethanol 960 và 15 ml nước cất lạnh. -
Cho vào mỗi ống 0,05 ml dung dịch FeCl3 0,5%, lắc đều. Sau 1 phút, so màu hai ống:
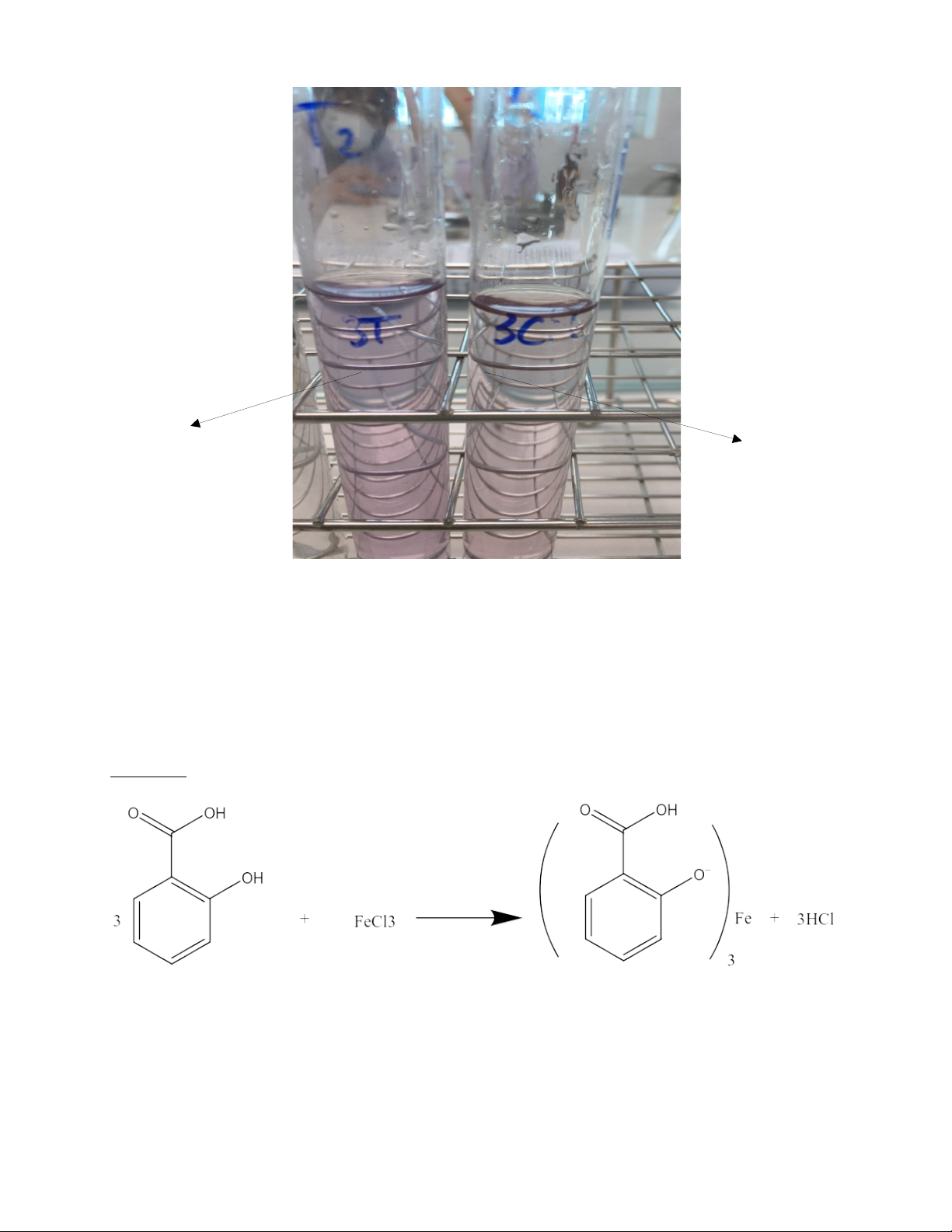
ống thử không được thẫm màu hơn ống chuẩn. -Hiện tượng:
+ Xuất hiện phức chất có màu tím
+ Ống thử thẫm màu hơn ống chuẩn 10 Ống thử Ống chuẩn -Kết luận: Không đạt - Giải thích
+ Vì acid salicylic có nhóm –OH phenol nên sẽ tạo ra phức có màu tím
+ Ống thử thẫm màu hơn ống chuẩn vì giới hạn salicylic tự do vượt quá 0.1% PTPỨ: Lưu ý:
+ Nên pha ống chuẩn trước ống thử để đảm bảo nước cất vẫn còn lạnh tránh sự thủy phân Aspirin thành Acid salicylic. 11
+ Dùng ethanol 960vì Aspirin dễ tan trong cồn cao độ. 3. Định lượng 3.1 Nguyên tắc 3.2 Cách tiến hành
3.3 Tính toán kết quả IV) Pha hóa chất
Pha dung dịch NaOH 10%
10g NaOH cho vào bình định mức 100ml, thêm nước cất đến vạch.
Pha dung dịch NaOH 2M
8g NaOH cho vào bình định mức 100ml, thêm nước cất đến vạch.
Pha dung dịch NaOH 0,5N
2g NaOH cho vào bình định mức 100ml, thêm nước cất đến vạch.
Pha dung dịch H2SO4 10%
6ml H2SO4 đậm đặc cho vào bình định mức 100ml, thêm nước cất đến vạch.
Pha dung dịch FeCl3 10%
10g FeCl3 cho vào bình định mức 100ml, thêm nước cất đến vạch.
Pha dung dịch FeCl3 0,5%
Lấy 5ml dung dịch FeCl3 10% cho vào bình định mức 100ml, thêm nước cất đến vạch
Pha dung dịch HCl loãng 3M
Lấy 13,75ml HCl 36% cho vào bình định mức 50ml sau đó thêm nước cất đến vạch.
Pha dung dịch HCl loãng 0,5N
Hút 21,25ml dung dịch HCl loãng 3M vào bình định mức 500ml sau đó thêm nước cất đến vạch
Pha dung dịch nitrobenzadehyde
Thêm 0,6 g bột mịn nitrobenzadehyde vào 50 ml dung dịch natrihvdroxyd 2 M. Lắc
đều. Để yên 10 min, thỉnh thoảng lắc, lọc.
Pha dung dịch chuẩn chloride 5ppm 5ppm = 5.10-6 g/ml 12
Lấy 0,25 g NaCl pha trong bình định mức 500ml, định mức tới vạch bằng nước cất.
Sau đó hút 1ml từ bình 500ml trên pha trong bình định mức 100ml, định mức tới vạch bằng nước cất.
Pha dung dịch chuẩn sulfate 10ppm 10ppm = 10-5 g/ml
Lấy 0,5g MgSO4 nhưng dạng ban đầu là MgSO4.7H2O (x (mol ))
246x -7.18x = 0,5 → x = 0,00416 → m (MgSO4.7H20) = 1,025 g
Lấy 1,025 g MgSO4.7H20 pha trong bình định mức 500ml, định mức tới vạch bằng
nước cất. Sau đó hút 1ml từ bình 500ml trên pha trong bình định mức 100ml, định
mức tới vạch bằng nước cất.
Pha dung dịch AgNO3 2%
Lấy 1g AgNO3 cho vào bình định mức 50ml, thêm nước cất đến vạch.
Pha dung dịch HNO3 30%
Lấy 19ml HNO3 65% cho vào bình định mức 50ml, sau đó thêm nước cất đến vạch.
Pha dung dịch BaCl2 5%
5g BaCl2 cho vào bình định mức 100ml, thêm nước cất đến vạch. 13
Document Outline
- I) Mục tiêu
- II) Cơ sở lý thuyết
- 1. Tính chất
- 2. Tác dụng dược lý
- 3. Tác dụng phụ
- III) Thực hành
- 1. Định tính Aspirin
- 1.1 Hóa chất và dụng cụ
- 1.2 Tiến hành
- 2. Thử tinh khiết
- 2.1 Giới hạn chloride
- 2.1.1. Dụng cụ, hóa chất
- 2.1.2. Tiến hành
- 2.2 Giới hạn sulfate
- 2.2.1. Dụng cụ, hóa chất
- 2.2.2. Tiến hành
- 2.3 Giới hạn salicylic tự do
- 2.3.1 Dụng cụ, hóa chất
- 2.3.2 Tiến hành
- 2.1 Giới hạn chloride
- 3. Định lượng
- 3.1 Nguyên tắc
- 3.2 Cách tiến hành
- 3.3 Tính toán kết quả
- 1. Định tính Aspirin
- IV) Pha hóa chất