























































Preview text:
BỘ ĐỀ THI OLYMPIC HÓA 10
CÓ ĐÁP ÁN VÀ LỜI GIẢI CHI TIẾT
TRƯỜNG TRUNG HỌC PHỔ THÔNG PLEIKU – GIA LAI Câu 1: (4 điểm)
1. Một mẫu rađon (Rn), ở thời điểm t = 0, phóng ra 7,0.104 hạt α trong 1 giây, sau 6,6 ngày mẫu đó
phóng xạ ra 2,1.104 hạt α trong 1 giây. Hãy tính chu kỳ bán hủy của rađon.
2. Sự phá vỡ các liên kết I – I trong một mol iot đòi hỏi một năng lượng bằng 150,48 kJ. Năng lượng
này có thẻ sử dụng dưới dạng ánh sáng. Hãy tính bước sóng (nm) của ánh sang cần sử dụng trong
quá trình đó. Cho: tốc độ ánh sáng c = 3.108 m.s-1; hằng số Planck h = 6,625.10-34 J.s; hằng số
Avogađro NA = 6,023.1023 mol-1.
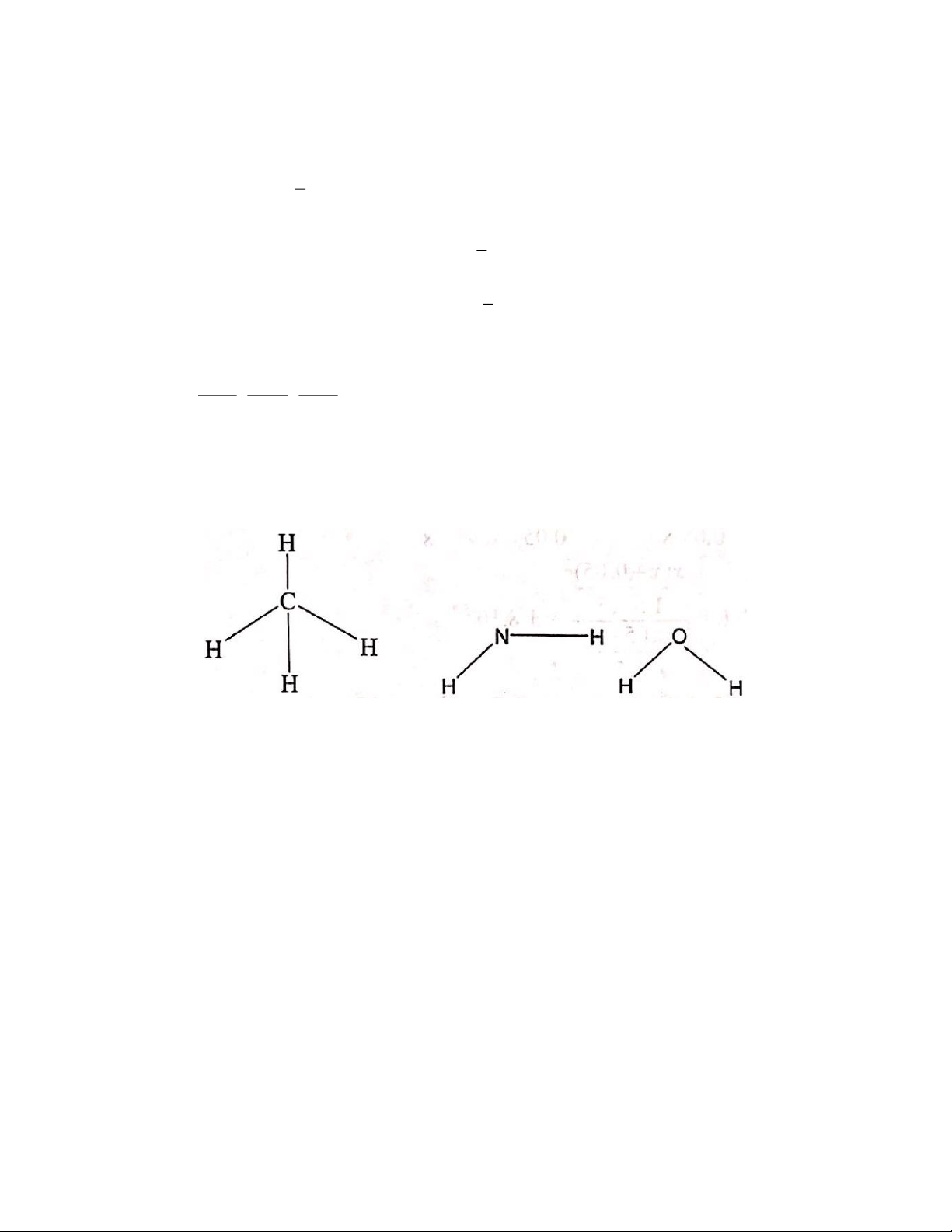
3. Bằng thực nghiệm người ta đã xác định được một cách gần đúng góc liên kết HCH trong phân tử
fomanđehit bằng 1200 . Giá trị momen lưỡng cực của các liên kết lần lượt là: = 0,4 D; C −H
C= = 2,3 D. Từ các dữ kiên trên hãy xác định giá trị momen lưỡng cực (D) của phân tử fomanđehit O Cho: o C H Câu 2: (4 điểm)
1. Bê tông được sản xuất từ hỗn hợp xi măng, nước cát và đá dăm (đá nhỏ). Xi măng chủ yếu là canxi
silicat và canxi aluminat tạo thành khi nung nghiền đất sét với đá vôi. Trong các bước tiếp theo của
việc sản xuất xi măng người ta thêm một lượng nhỏ gypsum, CaSO4.2H2O, để tăng sự đông cứng
của bê tông. Sử dụng nhiệt độ tăng cao trong giai đoạn cuối của sản xuất có thể dẫn đến sự tạo thành
1 hemihidrat không mong muốn là CaSO4.1/2H2O. Xét phản ứng sau:
CaSO4.2H2O (r) → CaSO4.1/2H2O (r) + 3/2H2O (k)
Các số liệu nhiệt động học sau đo tại 25℃, áp suất tiêu chuẩn 1,00 bar: Hợp chất Ho / (KJ.mol-1) So / (JK-1.mol-1) CaSO4.2H2O (r) - 2021,0 194,0 CaSO4.1/2H2O (r) - 1575,0 130,5 H2O (k) - 241,8 188,6
Hằng số khí: R = 8,314 J.mol-1.K-1 = 0,08314 L. bar . mol-1.K-1 O℃ = 273,500K
a) Hãy tính ∆H0 (theo KJ) của sự chuyển hóa 1,00 kg CaSO4.2H2O (r) thành CaSO4.1/2H2O (r).
Phản ứng này là tỏa nhiệt hay thu nhiệt?
b) Hãy tính áp suất hơi nước (theo bar) tại cân bằng trong một bình kín có chứa CaSO4.2H2O (r),
CaSO4.1/2H2O (r) và H2O (k) tại 25℃.
c) Hãy tính nhiệt độ tại đó áp suất hơi nước tại cân bằng là 1,00 bar trong hệ được mô tả ở câu 2.
Giả thiết răng ∆H0 và ∆S0 không phụ thuộc nhiệt độ.
2. Ở 500℃ độ phân li của α của HI bằng 0,50 theo phản ứng: 2HI (k) H2(k) + I2(k) Hãy tính:
- Hằng số cân bằng K của phản ứng ở 500℃
3. Độ phân ly α’ và số mol I2 được hình thành trong điều kiện sau: đưa 0,1 mol HI vào bình dung dịch
4,1 lít có chứa H2 với áp suất bằng 0,774 atm ở 500℃. Nhiệt độ được duy trì 500℃. Câu 3: (4 điểm)
1. Tính pH của dung dịch NaOH 1,5.10-7 M.
2. Tính pH của dung dịch NaHCO3 0,01M, biết K1, K2 của H2CO3 lần lượt là: 10-6,35 và 10-10,33
3. Tính hằng số cân bằng của phản ứng hòa tan Mg(OH)2 bằng NH4Cl. Cho 1 − 1 9 − ,25 T =1.10 ; K = + 10
. Hãy rút ra kết luận từ hằng số tính được. Mg(OH) 2 NH4
4. Thực hiện phản ứng sau: 3+ 2 Fe 2H O Fe(OH) + H O+ + + 2 3
Ka của Fe3+ là 10-2,2. Hỏi ở nồng độ nào của FeCl3 thì bắt đầu có kết tủa Fe(OH)3. Tính pH của dung dịch đó biết rằng 38 T 10− = . Fe(OH)3 Câu 4: (4 điểm):
1. Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron:
a) Cr2S3 + Mn(NO3)2 + K2CO3 → K2CrO4 + K2SO4 + K2MnO4 + NO + CO2
b) P + NH4ClO4 → H3PO4 + N2 + Cl2 + H2O
c) FexOy + HNO3 → Fe(NO)3 + NnOm + H2O
2. Bạc kim loại có khả năng đẩy được H2 ra khỏi dung dịch HI 1M được không (25℃)?
Cho tích số tan của điều kiện xét là
KS = 8,3.10-17 và Ag+ + e → Ag có E0 = 0,80 V. Câu 5: (4 điểm)
1. Có 1 pin điện được thiết lập trên cơ sở điện cực Cu nhúng vào dung dịch Cu(NO3)2 0,1M và điện
cực Ag nhúng vào dung dịch AgNO3 0,1M. Biết: 0 E = + 0,34V và 0 E 2+ + = +0,80V. Cu /Cu Ag / Ag
a. Tính suất điện động của pin ở 25℃.
b. Tính nồng độ mol/lit các ion trong dung dịch khi pin ngừng hoạt động.
2. Một loại phèn nhôm có công thức MAl(SO4)2.nH2O, trong đó M là kim loại kiềm. Lấy 7,11 gam
phèn nung tới khối lượng không đổi thu được 3,87 gam phèn khan. Mặc khác, lấy 7,11 gam phèn
hòa tan vào nước và cho tác dụng với dung dịch BaCl2 dư thu được 6,99 gam kết tủa. Xác định công
thức phân tử của phèn nhôm. Giả sử không có sự thủy phân của các ion.
3. Hòa tan 55 gam hỗn hợp gồm Na2CO3 và Na2SO3 bằng 500 ml dung dịch H2SO4 1M (lượng axit vừa
đủ) thu được hỗn hợp khí A (đktc) và dung dịch chứa một muối trung hòa duy nhất.
a. Cho hỗn hợp khí A vào bình kín dung tích 5 lít. Hãy tính áp suất trong bình ở nhiệt độ 27,3℃.
b. Bơm tiếp V lít khí X vào bình trên, thu được hỗn hợp khí B có tỉ khối so với hiđro là 25,3333.
Tính V lít khí X (ở đktc). Biết X có thể là một trong các khí: O2 , N2 , N2O , CH4 , SO2 , CO2
TRƯỜNG TRUNG HỌC PHỔ THÔNG PLEIKU – GIA LAI Câu 1: (4 điểm) 4 N A 7, 0.10 1. Ta có: 0 0 = = 4 N A 2,1.10 Mặt khác: ln 2.t T1 − t kt .ln 2 6, 6.ln 2 2 N = N .e = N .e → T = = = 3,7997 ngày 0 0 1 4 2 N0 7.10 ln ln 4 N 2,1.10
2. Năng lượng dùng để phá vỡ liên kết I – I trong 1 phân tử I2 là 3 150, 48.10 = (J) NA Mặt khác: 3 − 4 8 c h.c 6, 625.10 .3.10 23 = h → = .N = .6, 023.10 = 795,5019 (nm). A 3 150, 48.10 3. H HCH C=O C O G120o H - Tính HCHO : 0 120 Ta có: = = HCH = 2 C-H cos 2.0, 4.0,5 0,4 D 2
Hướng của C=O theo hướng 0, vậy của phân tử là:
HCHO = HCH + C=O = 0,4 + 2,3 = 2,7 D Câu 2: (4 điểm) 1. a) 3 H = H + H − H 1 . 2 ( ) 4 .2 2 ( ) 4 2 2 H O K CaSO H O r CaSO H O 2 − 3 = 1 − 575,0 + ( 2 − 41,8) − ( 2 − 021,0) = 83,3KJmol 2 1000 Số mol CaSO = = 4.2H2O(r) 5,808 (mol) 172,18
∆Hpư = 5,808 x 83,3 = 483,8 KJ > 0 – Phản ứng thu nhiệt b) 0 0 0 S = S + S − S 1 . ( ) 4 .2 2 ( ) 4 2 2 2 H O K CaSO H O r CaSO H O 3 130,5 +188, 6. −194,0 = 219,4 JK-1.mol-1 2 1 G H T S 83300 298,15 219, 4 17886 J.mol− = − = − = G 17886 G = −RT ln K → ln K = = = 7 − 21,553 −RT 0 − ,08314.298,15 3/ 2 K = P H2O K = 7,35.10-4 (bar) 3 P 8,15.10− = bar H2O c) P = 1 bar → K = 1,00 H2O ∆G0 = -RTlnK = 0 ∆G = ∆H - T∆S 0 = 83300 – T x 219,4 →T = 380K hay 107℃ 2. 2HI(k) H (k) + I (k) 2 2 Ban đầu a mol Phản ứng a α 0,5aα 0,5aα Cân bằng a (1- α) 0,5aα 0,5aα
Do ∆n = 0 KC = KP = KN = Kn 2 2 2
K = (nH .nI ) / (nHI) = (0, 5a) / [a(1− )] = 0,25 2 2
Số mol khí H2 trong bình = (PV)/RT
= (4,1.0,773)/(0,082.773) = 0,05 (mol) nHI = 0,1 mol (giả thiết) 2HI(k) H (k) + I (k) 2 2 Ban đầu 0,1 mol 0,05 Phản ứng 0,1 α’ 0,05α’ 0,05α’ [ ] 0,1 (1- α’) 0,05(1+α’) 0,05α’ 2 2
K = (nH .nI ) / (nHI) = 0, 05(1+ ').0, 05 '/ [0,1(1− ')] = 0,25 2 2 α’ = 1/3 tức 33,33%.
nI2 = 0,05(1/3) = 0,0167 (mol) Câu 3: (4 điểm)
1. Vì nồng độ của NaOH bé hơn cho nên ta phải kể nồng độ OH- của nước. NaOH → Na+ + OH- 1,5.10-7M H2O H+ + OH-
Theo định luật bảo toàn điện tích [OH-] = [H+] + [Na+]
[OH-] =(10-14 /[OH-] + 1,5.10-7
[OH-]2 - 1,5.10-7 [OH-] - 10-14 = 0 → [OH-] = 2.10-7 M (chọn) [OH-] = -5.10-8 M (loại) pOH = -log(2.10-7) = 6,6987
→ pH = 14 – 6,6987 = 7,301. 2. NaHCO - - 3 → Na+ + HCO3 (1) HCO - 2- 3 + H2O CO3 + H3O+ (2) HCO - 3 + H2O H2CO3 + OH- (3) H2O + H2O H3O+ + OH- (4) HCO - - 2- 3 + HCO3 CO3 + H2CO3 (5) H - 2CO3 HCO3 + H+ (6)
Vì Ka.C và Kb.C >> 10-14, nên trong dung dịch cân bằng (5) là chủ yếu Khi cân bằng [CO 2- 3 ] =[H2CO3] Vì thế đối với H2CO3 [H+ ][HCO− ] + 2 [H ][CO − ] 3 K = và 3 K = 1 H CO 2 [HCO− ] 2 3 3 + 2 K K = [H ] 1 2 + 6 − ,35 1 − 0,33 8 − ,34 [H ] = K K = 10 .10 =10 M pH = 8, 34 1 2 3. NH + 4Cl → NH4 + Cl- 2+ − 1 − 1 Mg(OH) Mg + 2OH T =1.10 2 Mg(OH)2 + + 9 − ,25 NH NH + H K = + 10 4 3 NH4 + 2 2H 2OH 2H O K− + 2 W Mg(OH) + 2 NH + Mg2+ + 2NH 2 K K− 2 4 3 + 2H2O K = T . + 2 NH w 4 11 − 9 − ,25.2 28 1 − ,5 = 10 .10 .10 =10
Kết luận: K không lớn, cũng không nhỏ, suy ra có thể chuyển dịch cân bằng cả hai phía
4. Gọi nồng độ ban đầu của FeCl3 là C (M). Fe3+ + 2H2O Fe(OH)2+ + H3O+ (1) Ban đầu: C 0 0 Cân bằng C-x x x
Ka = x2/(C-x) [Fe3+] = C-x = x2.Ka-1 (2)
Khi bắt đầu kết tủa Fe(OH)3 thì [Fe3+] = 10-38/[OH-]3 (3)
Mặt khác, [OH-]3 = (10-14/x)3 = 10-43/x3 (4)
Thay (4) vào (3): [Fe3+] = 104/x3 (5) So sánh (2) và (5) 104/x3 = x2.Ka-1 = x2.102,2 x = [H+] = 10-1,8M pH = 1,8
Từ (5): [Fe3+] = 104x3 = 104(10-1,8)3 = 10-1,4M
Theo (2) C= [Fe3+] + x = 10-1,4 + 10-1,8 = 5,56.10-2M Câu 4: (4 điểm)
1. a) Cr2S3 + Mn(NO3)2 + K2CO3 → K2CrO4 + K2SO4 + K2MnO4 + NO + CO2 2Cr+3 → 2Cr+6 + 6e 3S-2 → 3S +6 + 24e Cr2S3
→ 2Cr+6 + 3S +6 + 30e | x1 (a) Mn+2 → Mn+6 + 4e 2N+5 + 6e → 2N+2
Mn(NO3)2 + 2e → Mn+6 + 2N+2 | x 15 (b) Cộng (a) và (b)
Cr2S3 + 15Mn(NO3)2 → 2Cr+6 + 3S +6 + 15Mn+6 + 30N+2
Hoàn thành: Cr2S3 + 15Mn(NO3)2 + 20K2CO3 → 2K2CrO4 + 3K2SO4 + 15K2MnO4 + 30NO + 20CO2
b) P + NH4ClO4 → H3PO4 + N2 + Cl2 + H2O 2N-3 → 2NO + 6e 2Cl+7 + 14e → 2ClO 2NH4ClO3 + 8e → 2NO + 2ClO | x5 PO → P+5 + 5e | x8
10NH4ClO3 + 8PO → 8P+5 + 10NO + 10ClO + 16H2O
10NH4ClO3 + 8P → 8H3PO4 + 5N2 + 5Cl2 + 8H2O
c) FexOy + HNO3 → Fe(NO)3 + NnOm + H2O xFe+2y/x
→ xFe+3 + (3x -2y)e | (5n – 2m)
nN+5 + (5n – 2m)e → nN+2m/n | (3x – 2y)
x(5n – 2m)Fe+2y/x + n(3x – 2y)N+5 → x(5n – 2m)Fe+3 + n(3x – 2y)N+2m/n Hoàn thành:
(5n – 2m)FexOy + (18nx – 6my – 2ny)HNO3 →
→ x(5n – 2m)Fe(NO)3 + (3x – 2y)NnOm + (9nx – 3my – ny)H2O 2. HI → H+ + I- 1M 1M 1M AgI Ag+ + I- 17 K 8,3.10− + S 17 [Ag ]= = = 8,3.10− (M) [I− ] 1 0 + 1 − 7 E = + = + = − + E + 0, 059 lg[Ag ] 0,80 0, 059 lg 8, 3.10 0,149V 0, 00V (vì [H+] = 1,0 M). Ag / Ag Ag / Ag
Nên phản ứng xảy ra: 2Ag + 2H+ → 2Ag+ + H2. Câu 5: (4 điểm)
1. a. PTHH của phản ứng xảy ra trong pin khi pin hoạt động: Cu + 2Ag+ → Cu2+ + 2Ag E = E − + E 2+ pin Ag / Ag Cu /Cu 0, 059 + 0, 059 0 0 2 (E + = + − + = + lg[ Ag ]) (E + lg[Cu ]) 0, 4305 V 2 Ag / Ag Cu /Cu 1 2
b. Pin ngừng hoạt động: E = E − = + E + 0 2 pin Ag / Ag Cu /Cu 0, 059 + 0, 059 0 0 2 (E + + − + = + lg[ Ag ]) (E + lg[Cu ]) 0 2 Ag / Ag Cu /Cu 1 2 0 0 + 2 2.(E − + E + ) 2 [Ag ] Ag / Ag Cu /Cu → lg = − = 1 − 5,5932 2 [Cu + ] 0, 059
Gọi x là nồng độ của Ag+ giảm đi trong quá trình hoạt động [Ag+ → ] = 0,1− x .
Nồng độ Cu2+ tăng x/2 đơn vị 2 [Cu + → ] = 0,1− (x / 2). + 2 2 [Ag ] (0,1− x) Ta có: 1 − 5,5932 = =10 → x 0,1 2 [Cu + ] (0,1+ 0,5x) 2+ + 1 − 5,5932 9
→ [Cu ] 0,15M; [Ag ] = 10 .0,15 6,1865.10− M
2. Viết phản ứng phân hủy khi nung phèn: 0 MAl(SO ⎯⎯ t → 4)2.nH2O MAl(SO4)2 + nH2O
Phương trình phân li khi hòa tan phèn vào nước: MAl(SO 2- 4)2.nH2O ⎯⎯ → M+ + Al3+ + 2SO4 + nH2O
Phản ứng xảy ra khi cho tác dụng với dung dịch BaCl2 (viết dạng ion hoặc phân tử). 6,99 n = = 0,03(mol) BaSO4 233 Ba2+ + 2SO 2 4 ⎯⎯ → BaSO4 0,03 0,03 0,03 (mol) 1 1 Ta có: n = n = = − mol MAl( . .0, 03 0, 015 ( ) S 4 O ) 2 .12H2O 2 4 2 SO 2 7,11− 3,87
Vậy số phân tử nước trong phèn: n = = 12 phân tử 0, 015.18 7,11 M ( = M + 435 =
= 474 M = 39 M là kali (K) MAl SO .12 H O 4 ) 2 2 0, 015
Vậy CTPT của phèn là: KAl(SO4)2.12H2O
3. a. Phương trình phản ứng (dạng ion hoặc phân tử) Na2CO3 + H2SO4 ⎯⎯ → Na2SO4 + CO2 + H2O (1) Na2SO3 + H2SO4 ⎯⎯ → Na2SO4 + SO2 + H2O (2)
Từ (1) và (2) ta có: nhh khí A = n = 0,5 mol H2S 4 O
Áp xuất trong bình được tính . P V P .V .5 P 1.0,5.22, 4 0 0 = = P = 2,464 (atm) T T 273 + 27,3 273 0 44.0, 4 + 64.0,1 b. M = = 48 A 0, 4 + 0,1 44.0, 4 + 64.0,1+ M .n X X M = = 25,3333.2 = 50,6666 (*) B 0, 4 + 0,1+ nX
M − M = 50,6666 − 48 = 2,6666 B A 44.0, 4 + 64.0,1+ M .n X X M = − 48 = 2,6666 B 0, 4 + 0,1+ nX nX(MX – 48) = 2,6666
MX > 48 (Vì nX > 0)
Do đó X chỉ có thể là khí SO2 Thay M
= 64 g/mol vào (*) ta được: n = 0,1 (mol) 2 SO 2 SO
Do đó V = 0,1.22,4 = 2,24 (lít) 2 SO
TRƯỜNG THPT NGUYỄN TRÃI – NINH THUẬN Câu 1: (4 điểm)
1. Cho X, Y là hai phi kim, trong nguyên tử X và Y có số hạt mang điện nhiều hơn số hạt không
mang điện lần lượt là 14 và 16. Biết trong hợp chất XYn:
- X chiếm 15,0486% về khối lượng. - Tổng số proton là 100 - Tổng số nơtron là 106
Xác định tên hai nguyên tố X, Y và viết cấu hình electron nguyên tử của chúng. Xác định công
thức của hợp chất XYn.
2. Cho các phản ứng hóa học sau: Al O +3COCl →3CO + 2 AlCl H = 232 − , 24 kJ 2 3(r) 2(k ) 2(k ) 3(r ) 1 CO + Cl → COCl H = 112 − , 4 kJ (k) 2(k ) 2(k) 2 2Al +3 / 2 O → Al O H = 166 − 8, 2 kJ (r ) 2(k ) 2 3 3
Tính nhiệt tạo thành 1 mol AlCl3 biết:
- Nhiệt tạo thành của CO H = 110 − , 4 kJ 4
- Nhiệt tạo thành của CO = − 2 H 393,13 kJ 5 Câu 2: (4 điểm)
1. Cho phản ứng xảy ra ở 25℃: CO + H ⎯⎯ → ⎯ ⎯ CO + H O 2 2 2 ∆H0 (kJ/mol) -393,5 0 -110,5 -241,8 ∆S0 (kJ/mol) 213,6 131 197,9 188,7
a) Tính ∆H0, ∆S0, ∆G0 của phản ứng và nhận xét phản ứng có tự xảy ra theo chiều thuận ở 25℃ không?
b) Xác định nhiệt độ (0C) để phản ứng thuận bắt đầu xảy ra (bỏ qua sự biến đổi của ∆H0, ∆S0 theo nhiệt độ) Câu 3: (4 điểm)
1. Cân bằng các phương trình sau theo phương pháp ion – elecctron và hoàn thành các phương trình phản ứng.
a) K2Cr2O7 + ? + H2O → Cr(OH)3 + S + NH3 + KOH
b) K2Cr2O7 + Na2SO3 + H2SO4 → ? + Na2SO4 +K2SO4 + H2O
2. Tính pH của csc dung dịch sau:
a) Dung dịch (X) gồm 2 axit HCl 0,001 M và CH3COOH 0,1M.
b) Hòa tan 2,04 gam NaOH vào 1 lít dung dịch (X) thu được dunh dịch (Y) biết hằng số axit của CH3COOH là 1,8.10-5. Câu 4: (4 điểm)
1. Có 5 lọ hóa chất khác nhau, mỗi lọ chứa một dung dịch của một trong các hóa chất sau: NaOH,
HCl, H2SO4, BaCl2, Na2SO4. Chỉ được dùng thêm phenolphtalein (các điều kiện và dụng cụ thí
nghiệm có đủ), hãy trình bày phương pháp hóa học nhận biết 5 hóa chất trên và viết các phương
trình phản ứng xảy ra (nếu có).
2. Chọn 7 chất rắn khác nhau mà khi cho mỗi chát đó tác dụng với dung dịch H2SO4 đặc nóng, dư
đều cho sản phẩm là Fe2(SO4)2 , SO2 và H2O. Viết các phương trình hóa học. Câu 5: (4 điểm)
1. Nung hỗn hợp gồm a gam bột sắt và b gam bột lưu huỳnh trong điều kiện không có không khí
thu được chất rắn A. Cho A vào dung dịch H2SO4 0.9M loãng, dư thu được hỗn hợp khí B có tỉ
khối so với H2 bằng 7, dung dịch C và còn lại 3,2 gam một chất rắn không tan. Sục toàn bộ khí B
vào dung dịch Pb(NO3)2 dư thu được 43,02 gam kết tủa. Tính các giá trị a,b.
2. Đốt cháy hoàn toàn muối sunfua của một kim loại có công thức MS trong khí O2 dư thu được
oxit kim loại. Hòa tan oxit này vào một lượng vừa đủ dung dịch H2SO4 loãng 29,4% thu được
dung dịch muối sufat nồng độ 34,483%. Tìm công thức MS?
TRƯỜNG THPT NGUYỄN TRÃI – NINH THUẬN Câu 1:
a) Gọi ZX, Zy lần lượt là số proton của X và Y.
Gọi NX, Ny lần lượt là số nơtron của X và Y.
Ta có: ZX + n Zy = 100 và NX + nNy = 106 → AX + nAy = 206 (1) A x = 0,150486 (2) A + nA x y
Từ (1) và (2) → AX = ZX + NX (3) Mặt khác: 2 ZX - NX = 14 (4)
Thay ZX và NX vào hệ thức trên ta được: n(NY – ZY) = 5 (5) Ngoài ra: 2 ZY – NY = 16 (6) (5) và (6) → ZY = 16 + 5/n
Do ZY là số nguyên nên n =1 hoặc 5.
Nếu n = 1 → ZY = 21 (Sc): loại.
Nếu n = 5 → ZY = 17 (Cl): nhận. Và ZX = 15 (P) Cấu hình electron của P: 2 2 6 2 3 1s 2s 2p 3s 3p
Cấu hình electron của Cl: 2 2 6 2 5 1s 2s 2p 3s 3p
Công thức của hợp chất cần tìm là PCl5.
b) Ta có các quá trình sau: Al O +3COCl →3CO + 2 AlCl H 2 3(r) 2(k ) 2(k ) 3(r ) 1 3CO + 3Cl → 3COCl 3H (k) 2(k ) 2(k) 2 2Al +3 / 2 O → Al O H (r ) 2(k ) 2 3 3 3C + 3 / 2 O → 3CO 3H (r) 2(k ) 4 3CO → 3C +3O 3(−H ) 2(k) (r) 2(k ) 5
Phương trình phản ứng: 2Al(r) + 3Cl2(k) → 2AlCl3 2∆H Ta có: 2∆H = H
+ 3H + H + 3H +3(−H )= -1389,45 kJ 1 2 3 4 5
Vậy nhiệt tạo thành 1 mol AlCl3 là -694,725 kJ/mol Câu 2:
1. a. ∆H0 của phản ứng = -110,5-241,8-(-393,5)=41,2 kJ/mol
∆S0 của phản ứng = (197,9+188,7)-(213,6+131)=42 J/mol
∆G0 của phản ứng = ∆H0 - T∆S0 = 41200 – 298.42 = 28684 J/mol > 0
Vậy phương tình không tự xảy ra theo chiều thuận 25℃
b) Phản ứng thuận xảy ra khi ∆G0 < 0 hay T > ∆H0/∆S0
T > 980,95K hay t > 707,95℃
2. a) Tại thời điểm cân bằng 2 K = p / p =0,17 (1) p NO2 N2O4 mà p + p = 1 (2) NO2 N2O4
Từ (1) và (2) giải được p = 0,336 atm và p = 0,664 atm NO2 N2O4 Hay % p =33,6% và % p =66,4% NO2 N2O4 b) N O ⎯⎯ → ⎯ ⎯ 2NO 2 2 2 Ban đầu (mol) 1 Phản ứng x 2x Lúc cân bằng 1-x 2x
Ta có: [46.2x + 92(1-x)]/(1+x) = 66,8 → x = 0,3772 hay 37,72% Câu 3:
1. Cân bằng các phương trình sau theo phương pháp ion – electron và hoàn thành các phương trình phản ứng . − 2
Cr O − + 7H O + 6e ⎯⎯
→ 2Cr OH + 8OH 2 7 2 ( ) 3 3x 2 S − ⎯⎯ → S + 2e
K2Cr2O7 + 3(NH4)2S + H2O → 2Cr(OH)3 + 3S + 6NH3 + 2KOH 2− + 3 Cr O
+1 4H + 6e ⎯⎯ → 2Cr + + 7H O 2 7 2 3x 2− 2 SO ⎯⎯
→ SO − + 2H + + 2e 3 4
K2Cr2O7 + 3Na2SO3 + 4H2SO4 → Cr2(SO4)3 + 3Na2SO4 +K2SO4 + 4H2O
2. a. Dung dịch (X) gồm 2 axit HCl 0,001 M và CH3COOH 0,1M. HCl → H+ + Cl- CM 0,001 0,001 0,001 CH3COOH ⎯⎯ → ⎯ ⎯ H+ + CH3COO- CM 0,1 x x x Cân bằng 0,1 – x x x − (0, 001+ x)x 5 1,8.10 = 0,1− x
Giải sử: x << 0,1 → x2 + 0,001x – 1,8.10-6 = 0
Giải phương trình ta có x = 9,3.10-4 (M)
[H+] = 10-3 + 9,3.10-4 = 1,93.10-3 (M) pH 2, 7
b. Hòa tan 2,04 gam NaOH vào 1 lít dung dịch (X) thu được dung dịch (Y)
nNaOH = 0,051 mol; [NaOH] = 0,051M NaOH + HCl → NaCl + H2O 0,001 0,001 0,001
NaOH + CH3COOH → CH3COONa + H2O 0,05 0,05 0,05
Dung dịch (Y) gồm NaCl (0,001M); CH3COOH (0,05M); CH3COONa (0,05M) Phương trình điện li: CH3COONa → CH3COO- + Na+ 0,05 0,05 0,05 CH3COOH ⎯⎯ → ⎯ ⎯ CH3COO- + H+ 0,05 x x x (0,05 – x) x+0,05 x − (0, 05 + x)x 5 1,8.10 = 0, 05 − x Giả sử x << 0,05 4 − ,75 x =10 (M ) pH = 4,75 Câu 4: (4 điểm)
1. Lấy một lượng vừa đủ mỗi mẫu hóa chất cho vào ống nghiệm riêng biệt rồi đánh số thứ tự.
Nhỏ từ từ dung dịch phenolphtalein vào ống nghiệm chứa các hóa chất nói trên.
+ Nếu ống nghiệm nào hóa chất làm phenolphtalein từ không màu chuyển màu hồng là NaOH.
+ Ống nghiệm còn lại không có hiện tượng gì là HCl, H2SO4, BaCl2 và Na2SO4.
Nhỏ từ từ lần lượt vài giọt dung dịch có màu hồng ở trên vào 4 ống nghiệm còn lại.
+ Ống nghiệm làm mất màu hồng là các dung dịch axit HCl và H2SO4. (Nhóm I)
+ Ống nghiệm không làm mất màu hồng là các dung dịch muối BaCl2 và Na2SO4 (Nhóm II). PTHH: NaOH + HCl ⎯⎯ → NaCl + H2O 2NaOH + H2SO4 ⎯⎯ → Na2SO4 + H2O
Nhỏ vài giọt dung dịch của một dung dịch ở nhóm I vào hai ống nghiệm chứa dung dịch nhóm II
+Nếu không có hiện tượng gì thì hóa chất đó là HCl. Chất còn lại của nhóm I là H2SO4.
Nhỏ dung dịch H2SO4 vào hai ống nghiệm chứa hóa chất nhóm II
- Nếu thấy ống nghiệm nào kết tủa trắng thì ống nghiệm đó chứa dung dịch BaCl2.
- Ống nghiệm còn lại không có hiện tượng gì đó là hóa chất Na2SO4 .
+ Nếu thấy ống nghiệm nào có kết tủa ngay thì dung dịch ở nhóm I là hóa chất H2SO4, ống
nghiệm gây kết tủa BaCl2, ống nghiệm còn lại không gây kết tủa chứa hóa chất Na2SO4 .
Hóa chất còn lại ở nhóm I là HCl. PTHH: H2SO4 + BaCl2 ⎯⎯
→ BaSO4 (kết tủa trắng) + 2HCl
2. Các chất rắn có thể chọn: Fe; FeO; Fe O ; Fe(OH) ; FeS; FeS ; FeSO 3 4 2 2 4 Các PTHH: 0 2Fe + 6 H ⎯⎯ t → 2SO4(đặc) Fe2(SO4)3 + 3SO2 + 6H2O 0 2FeO + 4 H ⎯⎯ t → 2SO4(đặc) Fe2(SO4)3 + SO2 + 4H2O 0 2Fe ⎯⎯ t → 3O4 + 10 H2SO4(đặc) 3Fe2(SO4)3 + SO2 + 10H2O 0 2Fe(OH) ⎯⎯ t → 2 + 4 H2SO4(đặc) Fe2(SO4)3 + SO2 + 6H2O 0 2FeS + 10 H ⎯⎯ t → 2SO4(đặc) Fe2(SO4)3 + 9SO2 + 10H2O 0 2FeS ⎯⎯ t → 2 + 14 H2SO4(đặc) Fe2(SO4)3 + 15SO2 + 14H2O 0 2Fe ⎯⎯ t → 2SO4 + 2 H2SO4(đặc) Fe2(SO4)3 + SO2 + 2H2O Câu 5: 1. Fe + S → FeS (1) Fe + H2SO4 → FeSO4 + H2 (2) FeS + H2SO4 → FeSO4 + H2S (3) Chất rắn không tan là S H2S + Pb(NO3)2 → PbS + HNO3 (4) Ta có: H2 2 20 5 =14 H2S 34 12 3
Theo (1), (3) và (4) ta có n = n = n
= 0,18 n = 0,3mol Fe H2S PbS H2
S chưa phản ứng n = 0,1mol S
Vậy theo (1), (2), (3) và (4) ta có n
= 0,18 + 0,3 = 0, 48(mol) Fe n = n
+ n = 0,18 + 0,1 = 0, 28(mol) S H2S S a = mFe = 0,48.56 = 26,88 gam b = mS = 0,28.32 = 8,96 gam
2. Giả sử ta có 100 gam dd H2SO4 29,4%
khối lượng H2SO4 = 29,4 gam hay 0,3 mol
- Gọi công thức của oxit kim loại sản phẩm là M2On
- Phản ứng: M2On + nH2SO4 → M2(SO4)n + nH2O 0,3 mol
Số mol M2On = số mol M2(SO4)n = 0,3/n (mol) 0, 3 (2M + 96n) n
100 = 34, 483 M = 18,67n M = 56 hay MS là FeS 0, 3 (2M +16n) n
TRƯỜNG THPT CHUYÊN TRẦN HƯNG ĐẠO – BÌNH THUẬN Câu 1: (4 điểm)
1. Sự phân hủy phóng xạ của 232 Th tuân theo phản ứng bậc 1. Nghiên cứu về sự phóng xạ của thori
đioxit, người ta biết chu kì bán hủy của 232Th là 1,39.1010 năm. Hãy tính số hạt α bị bức xạ trong 1
giây cho 1 gam thori đioxit tinh khiết.
Cho tốc độ ánh sáng c = 3.108 m.s-1; hằng số Planck h = 6,625.10-34 J.s; hằng số Avogađro NA = 6,022.1023 mol-1.
2. X là nguyên tố thuộc nhóm A, hợp chất với hidro có dạng XH3. Electron cuối cùng trên nguyên tử X
có tổng 4 số lượng tử bằng 4,5.
a. Xác định nguyên tố X, viết cấu hình electron của nguyên tử.
b. Ở điều kiện thường XH
3 là chất khí. Viết công thức cấu tạo, dự đoán trạng thái lai hóa của nguyên tử
trung tâm trong phân tử XH3, oxit bậc cao nhất, hidroxit bậc cao nhất của X. r
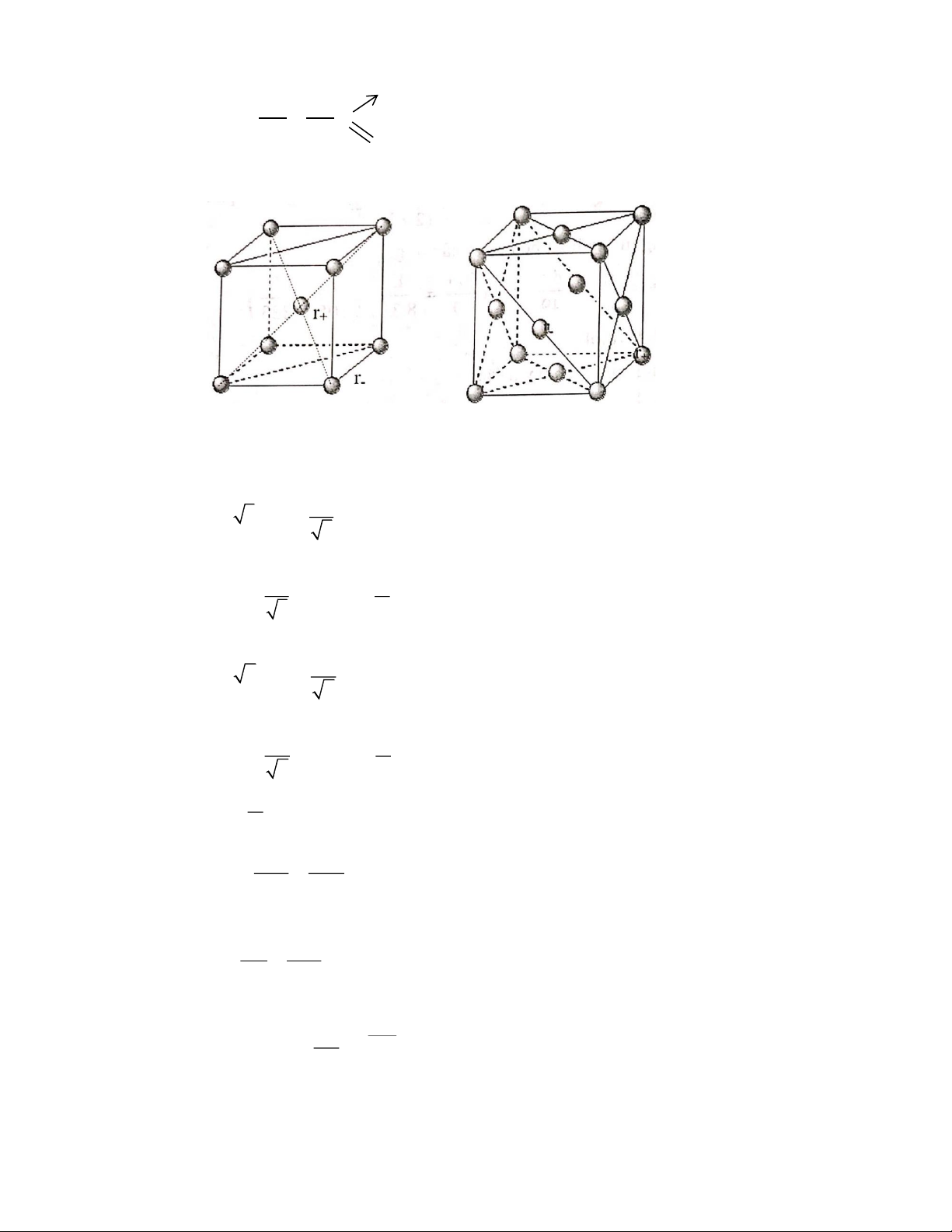
3. Hãy tính tỉ số + cho trường hợp là lập phương tâm khối và lập phương tâm diện với giả thiết rằng − r
bán kính cation và anion trong tinh thể tiếp giáp nhau. Cho r r r r 2+ = 0,65 Å ; − = 1,45 Å ; + = 1,67 Å; − = 2,19 Å; Mg 2 O Cs I r
Dựa vào tỉ số + hãy cho biết dạng tinh thể của MgO và CsI. − r Câu 2: (4 điểm)
1. Cho phản ứng: C H I + NaOH → C H OH + NaI 2 5 2 5
Nồng độ ban đầu của hai chất phản ứng bằng nhau. Để một nửa lượng ban đầu các chất phản ứng
chuyển thành sản phẩm ở 32℃ cần 906 phút.
a. Tính thời gian để một nữa lượng ban đầu các chất phản ứng chuyển thành sản phẩm ở 60℃ biết hệ số
nhiệt độ của phản ứng là 2,83.
b. Tính năng lượng hoạt hóa của phản ứng.
c. Tính hằng số tốc độ k ở hai nhiệt độ trên, biết rằng phản ứng là bậc 2 (bậc 1 đối với mỗi chất) và nồng
độ ban đầu của mỗi chất đều bằng nhau 0,050 M.
2. Entanpi sinh tiêu chuẩn của CH4(k) vaf C2H6(k) lần lượt bằng -74,80 và -84,60 kJ/mol. Tính entanpi
tiêu chuẩn của C4H10(k). Biện luận về kết quả thu được. Cho biết entanpi thăng hoa của than chì và
năng lượng liên kết H–H lần lượt bằng 710,6 và -431,65 kJ/mol.
3. Cho cân bằng dị thể sau: C(k) + H2O CO(k) + H2(k) - Tại 1000K, KP = 4,1
a) Tính độ chuyển hóa (α) khi ban dầu người ta cho vào 1 bình phản ứng dung dịch 10 lít một hỗn hợp
gồm 24 gam C và 54 gam H2O. Nhiệt độ trong bình phản ứng là 1000K.
b) Nếu tăng thể tích bình lên 100 lít. Xác định thành phần của các khí ở trong bình sau phản ứng. Tại
1000K. Các phản ứng trong phương trình phản ứng được coi là lý tưởng. Câu 3: (4 điểm)
1. Cho các dung dịch sau: NaH2PO4 0,01 (A); Na2HPO4 0,01M (B); HCl 0,01M (C)
a. Trình bày vắn tắt cách xác định pH của các dung dịch và cho biết chất chỉ thị nào sau đây tốt nhất sử
dụng để phân biệt các dung dịch đó. Nêu rõ hiện tượng xảy ra?
(1) Metyl dacam (khoảng chuyển màu từ 3,1 – 4,4: pH <3,1 màu đỏ; pH > 4,4 màu vàng)
(2) Metyl đỏ (khoảng chuyển màu từ 4,4 – 6,2: pH <4,4 màu đỏ; pH > 6,2 màu vàng)
(3) Quỳ (khoảng chuyển màu từ 5,0 – 8,0: pH <5,0 màu đỏ; pH > 8,0 màu xanh)
(4) Phenolphtalein (khoảng chuyển màu từ 8,2 – 10,0 : pH <8,2 không màu; pH > 10 màu đỏ)
b. Nhỏ từ từ đến hết V lít dung dịch NaOH 0,03M vào V lít dung dịch H3PO4 0,02M có thêm vài giọt
quỳ tím, thu được dung dịch X. Viết phương trình phản ứng xảy ra và cho biết sự thay đổi màu sắc của dung dịch.
Cho biết H3PO4 có pKa1 = 2,15; pKa2 = 7,21; pKa3 = 12,32; pKw = 14;
2. Tích số tan của CaF2 là 3,4.10-11, hằng số phân li HF là 7,4.10-4. Tính độ tan của CaF2 trong dung dịch có pH=3,3.
3. Dung dịch A chứa NH3 0,2M; Na2C2O4 0,1M; Na2SO4 0,08M.
a. Tính pH của dung dịch A.
b. Thêm dần CaCl2 vào dung dịch A vào 10ml dung dịch A đến C = 0,18M. Tính [C 2- 2-
2O4 ], [SO4 ], [Ca2+]? (Coi như thể tích dung dịch không thay đổi không đáng kể) Cho pK + -
a: NH4 (9,24); HSO4 (2,00); H2C2O4 (1,25;4,27) pK =
s: CaSO4 (4,26); CaC2O4 (8,75); * + 10-12,6 (CaOH ) Câu 4: (4 điểm)
1. Hòa tan hoàn toàn FenOm trong dung dịch H2SO4 đặc, nóng dư được dung dịch A1, khí B. Cho B vào
dung dịch KMnO4 được dung dịch A2. Cho dung dịch A1 tác dụng với NaOH dư, lọc lấy kết tủa đem
nung trong không khí đến khối lượng không đổi được chất rắn C1. Trộn C1 với bột nhôm rồi nung ở
nhiệt độ cao được hỗn hợp C2 gồm 2 oxit, trong đó FexOy. Hòa tan hoàn toàn C2 trong dung dịch
HNO3 loãng thu được khí NO.
a. Viết phương trình phản ứng xảy ra.
b. Cân bằng các phản ứng oxi hóa – khử theo phương háp thăng bằng ion – electron.
2. Dung dịch H2O2 3% được dùng để sát trùng trong y học, trạng thái bền của nó so sánh với O2 và H2O theo giãn đồ sau: 0 + ,68V 1 + ,77V
O ⎯⎯⎯→ H O ⎯⎯⎯→ H O 2 2 2 2
a. Hãy so sánh độ bền giữa các dạng oxi hóa – khử và từ đó cho biết cần lưu ý gì khi sử dụng dung dịch H2O2. b. Tính 0 E 0 + và E − O ,H / H O O /OH 2 2 2 Câu 5: (4 điểm)
1. Viết các phương trình hóa học của các phản ứng sau:
a. X1 + X2 + X3 → CuSO4 + Na2SO4 + NO + K2SO4 + H2O
b. S + NaOH (đặc nóng) → c. HClO3 + FeSO4 + H2SO4 → d. Cl2 + Br2 + H2O →
2. Sục khí Cl2 vào dung dịch NaOH loãng thu được dung dịch A, hòa tan I2 vào dung dịch NaOH
laoxng thu được dung dịch B (các thí nghiệm được tiến hành ở nhiệt độ phòng).
a. Viết phương trình hóa học của các phản ứng xảy ra và cho nhận xét.
b. Nêu hiện tượng và viết phương trình hóa học các phản ứng xảy ra khi cho lần lượt các dung
dịch hỗn hợp HCl và FeCl2, dung dịch Br2, H2O2 vào dung dịch A (không có Cl2 dư).
3. Hòa tan hoàn toàn 0,8120 gam một mẫu quặng sắt gồm FeO, Fe2O3 và 35% tạp chất trơ trong
dung dịch HCl (dư), thu được dung dịch X. Sục khí SO2 vào dung dịch X, thu được dung dịch Y.
Dung dịch Y phản ứng vừa đủ với 22,21 ml dung dịch KMnO4 0,10 M. Mặt khác, hòa tan hết
1,2180 gam mẫu quặng trên trong dung dịch HCl (dư) rồi thêm ngay dung dịch KMnO4 0,10
Mvào dung dịch thu được cho đến khi phản ứng xảy ra hoàn toàn, thì hết 15,26 ml dung dịch KMnO4 0,10 M.
a. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính thể tích SO2 (ở điều kiện tiêu chuẩn) đã dùng và thành phần phần trăm theo khối lượng
của FeO, Fe2O3 có trong mẫu quặng.
TRƯỜNG THPT CHUYÊN TRẦN HƯNG ĐẠO – BÌNH THUẬN Câu 1: (4 điểm)
1. Vì thori phân hủy phóng xạ theo phản ứng bậc 1 nên chu kỳ bán hủy được tính theo biểu thức: 0, 693 0, 693 t = hay k = 1/ 2 k t1/2 0, 693 Vậy hằng số tốc độ 1 − 8 1 k 1,58.10 (s− = = ) 10 1,39.10 .365.24.3600
Trong 264 gam ThO2 tinh khiết chưa 6,022.1022 hạt 232 Th .
Vậy trong 1 gam ThO2 tinh khiết chứa: 2 2 6, 022.10 .1 21 = 2,28.10 hạt 232Th . 2 4 6
Tốc độ phân hủy của Th (trong ThO2) được biểu diễn bằng biểu thức: dN v = − = kN dt
Do vậy số hạt α bị bức xạ trong 1 giây bởi 1 gam thori đioxit tinh khiết sẽ là: dN 1 − 8 21 3 1 v 1,58.10 .2, 28.10 3, 60.10 (s− = − = = ) dt Nghĩa là có 3
3, 60.10 hạt α bị bức xạ trong 1 giây.
2.a. Với hợp chất hidro có dạng XH3 nên X thuộc nhóm IIIA hoặc nhóm VA.
TH1: X thuộc nhóm IIIA, ta có sụ phân bố e theo obitan: ↑↓ ↑ Vậy e cuối cùng có:
1=1, m=-1, ms = +1/2. Mà n + 1 + m + ms =4,5 → n = 4
Cấu hình e nguyên tử: 1s22s22p63s23p63d104s24p1 (Ga)
TH2: X thuộc nhóm VA, ta có sụ phân bố e theo obitan: ↑↓ ↑ ↑ ↑ Vậy e cuối cùng có:
1=1, m=1, ms = +1/2. Mà n + 1 + m + ms =4,5 → n = 2
Cấu hình e nguyên tử: 1s22s22p3 (N)
b. Ở điều kiện thường XH3 là chất khí nên nguyên tố phù hợp là Nitơ.
Công thức cấu tạo các hợp chất: N H H H
Nguyên tử N có trạng thái lai hoá sp3. Oxit cao nhất: O O N O N O O
Nguyên tử N ở trạng thái lai hóa sp2. Hidroxit với hóa trị cao nhất: O H O N O
Nguyên tử N ở trạng thái lai hóa sp2. 3.
Mạng lập phương tâm khối (a)
Mạng lập phương tâm diện (b)
* Theo hình vẽ mạng lập phương tâm khối (a) ta có: 2 2r + 2r = a 3 a = (r + r ) + − + − 3
Mặt khác muốn đạt được sự cực tiểu về năng lượng thì phải có điều kiện: 2 r 2r a 2r (r + r ) + 0,732 (1) − − + − 3 r−
* Theo hình vẽ mạng lập phương tâm diện (b) ta có: 2 2r + 2r = a 2 a = (r + r ) + − + − 2
Mặt khác muốn đạt được sự cực tiểu về năng lượng thì phải có điều kiện: 2 r 2r a 2r (r + r ) + 0,414 (2) − − + − 2 r− r
Dựa vào tỉ số + ở (1) và (2) ta lập được tỉ số tương ứng từ thực nghiệm: − r r + Đố 2 Mg 0, 65 i với MgO: = = 0,448 r − 1, 45 2 O
MgO có mạng lập phương tâm diện. r Đố + 1, 67 i với CsI: Cs =
= 0,762 CsI có mạng lập phương tâm khối. r − 2,19 I Câu 2: (4 điểm) T −T 2 1 k
1. a. Áp đụng công thức: 2 T 10 = kT1 Mặt khác: ln 2 kT t 1 2 1 k = = t = t . t = 49 phut 2 1 60−32 2 t k t 1/ 2 T1 2 10 (2,83)
b. Tính năng lượng hoạt hóa của phản ứng: v k t 906 906 E 1 1 2 2 1 a = = = ln = . . v k t 49 48 8,314 305 333 1 1 2 E = 88 kJ / mol a
c. Tính hằng số tốc độ phản ứng: 1 1 2 − 1 − 1 t k 2, 2.10 mol .1.ph− = = = (ở 320C) 1/ 2 1 k.[A] 906.0, 050 0 1 1 − 1 − 1 k 4,1.10 mol .1.ph− = = 2 49.0, 050 2.* (1) C 0 = − than chì + 2H2(k) → CH4(k) H 74,8kJ S,CH4 (2) C = than chì → C(k) 0 H 710, 6kJ th (3) H = 2(k) → 2H(k) 0 H 431, 65 kJ lk
Lấy (1) – [(2) + 2.(3)] ta được: C 0 = − (k) + 4H(k) → CH4(k) H 16481, 7 (kJ / mol) S,ng/ tu,CH4
Năng lượng liên kết trung bình của liên kết C – H là: 1 ( 1 − 648,7) = 4 − 12,175 (J/ mol) 4 *(4) 2C 0 = − than chì + 3H2 → C2H6(k) H 84, 6 (kJ / mol) S(C2H6 ,K)
Lấy (4) – [2.(2) + 3.(3)] ta được: 2C 0 = − (k) + 6H(k) → C2H6(k) H 2800, 75 (kJ / mol) S,ng/ tu,C2H6
Coi EC – H trong CH4 và C2H6 như nhau thì:
EC – C = -2800,75 – 6(-412,175)=-327,7 (kJ/mol)
*Coi EC – H ; EC – C trong các chất CH4 và C2H6, C4H10 đều như nhau thì: 0 H = 3E +10.E − 3. 32
− 7,7 +10. −412,75 = −5110,6 (kJ / mol) S,ng/ tu,C H C−C C−H ( ) ( ) 4 10 *(5) 4C 0 = − (k) + 10H(k) → C4H10(k) H 5110, 6 (kJ / mol) S,ng/ tu,C4 1 H 0
Lấy (2).4 + (3).5 + (5) ta được: 4C 0 = −
than chì + 5H2(k) → C4H10(k) H 109, 95 (kJ / mol) S,C4 1 H 0
* Kết quả thu được chỉ là gần đúng do đã coi ELK(C – H) ; E LK(C – C) trong mọi trường hợp là
như nhau. Và vì vậy sẽ không tính rõ 0
H của các đồng phân khác nhau. S RT 0, 082 . 1000 3. a) Ta có 0 P = n = 3. = 24,6 (atm) H O(k) 2 V 10
C(r) + H2O(k) → CO(k) + H2(k) Kp = 4,1 Ban đầu: 24,6 Cân bằng: 24,6 – x x x 2 P .P x Ta có: CO H2 K = = = 4,1 p P 24, 6 − x H O 2 2
x + 4,1x −100,86 = 0 x = 8, 2 (atm) Độ x 8, 2 chuyển hóa = = = 0,333 2 P 24, 6 H O 2
b) Tăng thể tích bình lên 100 lít 0, 082.1000 P
+ P + P = n . = 0,82n 2 2 H O CO H 2 2 n 100 n
C(k) + H2O(k) → CO(k) + H2(k) Ban đầu: 3mol Cân bằng 3- x x x n
= 3 − x + 2x = 3 + x P = 0,82(3 + x) 2 n T = = x P P . P = 0,82 ; x CO H T 2 3 + x 3 − x P =
. P = 0,82 (3 − x) H O T 2 3 + x P P x CO H ( )2 2 . 0,82 . 2 K = = = 4,1 P P 0,82 (3 − x) H2O 2 2
x = 15 − 5 x + 5x −15 = 0 x = 2,11 (mol) 2
Khi tăng lên 100 lít, cân bằng đã bị phá vỡ Số mol khí trong bình: n = n = 2mol ; n =1 mol CO H2 H2O 0, 082 . 1000 P = 5. = 4,1 (atm) T 1000 Câu 3: (4 điểm) pKa + pKa 1. a. Dung dịch A: 1 2 pH = = 4,68 A 2 pKa + pKa Dung dịch B: 3 2 pH = = 9,765 B 2
Dung dịch C: [H+] = 0,01M pHC = 2
Chất chỉ thị hợp nhất là metyl đỏ, khi đó: du dịch C có màu đỏ; dung dịch A có màu da cam; dung dịch B có màu vàng.
b. Nồng độ ban đầu của NaOH 0,015M; H3PO4 0,01M Phản ứng xảy ra: H - 3PO4 + OH- → H2PO4 + H2O 0,01 0,015 - 0,015 0,01 H - 2- 2PO4 + OH- → H2PO4 + H2O 0,01 0,005 5.10-3 - 5.10-3
Dung dịch thu được là một dung dịch đệm có dạng axit và bazơ liên hợp cùng nồng độ mol. Do đó: pHX = pKa2 = 7,21.
Hiện tượng: dung dịch chuyển từ màu đỏ sang màu tím. 2. 2 − CaF ⎯ ⎯ Ca + 2F− ⎯⎯ → + 11 K = 3, 4.10 (1) 2 s H+ + F− ⎯⎯ → ⎯ ⎯ HF 1 − 3 K =1.35.10 (2) a
Gọi độ tan của CaF2 trong dung dịch axit là s(M). Ta có: C − = = + − 2s F HF F − + + F H K + − [ ].[ ] − [H ] s K a − 2 . 2s = F + 2s = [F ]. [F ] = a K K K + [ + H ] a a a 2 2 + − − . s 4s .K Ta có: 2 2 11 a 1 − 1 K =[Ca ].[F ] = 3, 4.10 = 3,4.10 s + 2 (K + [H ]) a
Thay Ka, [H+] = 10-3.3 → s = 2,88.10-4M 3. a. Xét các cân bằng: + − 4 − ,76 NH + H O NH + OH K = 10 (1) 3 2 4 b 2− − − 9 − ,73 C O + H O HC O + OH K = 10 (2) 2 4 2 2 4 b1 − − 12 − ,75 HC O + H O H C O + OH K = 10 (3) 2 4 2 2 2 4 b2 2− − − 12 SO H O HSO OH K 10− + + = (4) 4 2 4 b '
Do Kb >> Kb1 >> Kb2, Kb’ nên cân bằng (1) là chủ yếu + − 4 − ,76 NH + H O NH + OH K = 10 (1) 3 2 4 b C 0,2 [] 0,2-x x x 2 x 4 − ,76 3 10 x 1,856.10− = = pH = 11,27. (0, 2 − x) b. Dung dịch A: NH 2- 2-
3 (0,2M); C2O4 (0,1M); SO4 (0,08M)
Xét điều kiện hình thành kết tủa: K (CaSO ) Muốn có ↓CaSO s 4 4 − = 4: C + 6,87.10 2 Ca C 2− 4 SO K ( a C C O ) Muốn có ↓CaC s 2 4 7 − ,75 = 2O4: C + 10 2 Ca C 2− 2 C 4 O
Vậy ↓CaC2O4 xuất hiện trước. Các phản ứng xảy ra: 2+ 2 Ca C O − + → C C a O 2 4 2 4 0,18 0,1 Còn 0,08 - 2+ 2 Ca SO − + → CaSO 4 4 0,08 0,08 Còn - -
TPGH: CaC2O4 , CaSO4 , NH3 (0,2M) NH H O NH+ OH− + + 4 − ,76 K = 10 (1') 3 2 4 b 2+ 2 CaSO Ca SO − + 4 − ,26 K = 10 (2 ') 4 4 s1 2+ 2 CaC O Ca C O − + 8 − ,75 K = 10 (3') 2 4 2 4 s 2
So sánh Ks1, >> Ks2 Cân bằng (1’) và (2’) là chủ yếu.
Cân phần (1’) đó xét ở phần a: pH = 11,27 Xét cân bằng (2’): 2+ 2 CaSO Ca SO − + 4 − ,26 K = 10 (2 ') 4 4 s1 S S Các quá trình phụ: 2 Ca + H O CaOH+ H+ + + 1 − 2,6 * = + 10 (4’) 2 (CaOH ) 2 SO − H O HSO− OH− + + Kb’ = 10-12 (5’) 4 2 4
Do môi trường bazơ (pH = 11,27) nên có thể bỏ qua cân bằng nhận proton của 2 SO − (cân bằng (5’)) 4 Vậy S = [ 2 SO − ] 4
Và S = [Ca2+] + [CaOH+] = [Ca2+].(1 + *β . [H+]-1 ) + S 2 Ca = 1 − 1 * . H + + 2 S Vậy K 2- = s1 = [Ca2+].[SO4 ] 1 1 + * − . H +
Thay [H+] = 1011,27, *β , Ks1 ta tính được S = 7,6.10-3 Kết quả: [SO 2-
4 ] = S = 7,6.10-3 ; [Ca2+] = 7,25.10-3 K [C 2- s 2 − = = 2O4 ] 7 2, 45.10 2 [Ca + ] Câu 4: (4 điểm)
4.1 a. 2FenOm + (6n – 2m) H2SO4đ → nFe2(SO4)3 + (3n – 2m)SO2 + (6n – 2m) H2O (1)
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4 (2)
H2SO4 + 2NaOH → Na2SO4 + 2H2O (3) 0 2Fe(OH) t ⎯⎯→ 3 Fe2O3 + 3H2O (4) 0 3xFe t ⎯⎯→ 2O3 + (6x – 4y) Al 6FexOy + (3x – 2y) Al2O3 (5)
Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O (6)
3FexOy + (12x – 2y) HNO3 → 3xFe(NO3)3 + (3x – 2y)NO + (6x – y)H2O (7) b. Phương trình (1):
2 . FenOm + 2mH+ → nFe3+ + (3n – 2m)e + mH2O (3n – 2m) 2
SO − + 2e + 4H+ → SO 4 2 + 2H2O
2FenOm + (12m – 4) H+ + (3n – 2m) 2
SO − → 2nFe3+ + (3n – 2m) SO 4 2 + (6n – 2m) H2O Phương trình (2): 5. SO2 + 2H2O → 2 SO − + 2e + 4H+ 4
2. MnO− + 5e + 8H+ → Mn2+ + 4H 4 2O 5SO2 + 2 MnO− + 2H SO − + 2 Mn2+ + 4H+ 4 2O → 5 2 4 Phương trình (8):
3. FexOy + 2yH+ → xFe3+ + (3x – 2y)e + yH2O
(3x – 2y) NO− + 3e + 4H+ → NO + 2H 3 2O
3FexOy + (12x – 2y) H+ + (3x – 2y) NO− → 3x Fe3+ + (3x – 2y)NO + (6x – y) H 3 2O 4.2. a. Vì 0 0 E E
nên tính oxi hóa H2O2 mạnh hơn O2 và tính khử H2O2 mạnh hơn H2O 2 O / H2 2 O H2 2 O / H2O Phản ứng tự xảy ra:
2H2O2 → O2 +2H20 E0 = 1,77 – 0,68 = +1,09V K = 1036,95 (lớn)
Vậy H2O2 là dạng kém bền so với 2 dạng O2 và H2O
*Lưu ý: Khi sử dụng xong phải đậy nắp ngay b. Tính 0 E + O ,H / H O 2 2 2.1,68 O 2H+ + + 2e H O (1) 0,059 K = 10 2 2 2 1 2.1,77 H O 2H+ + + 2e 2H O (2) 0,059 K = 10 2 2 2 2 O 4H+ + + 4e 2H O K = K 2 2 1 . K2 0 4E 2. (0,68 1,77) + + O ,H /H O 2 2 0,059 0,059 K = 10 =10 1 0 E = + = + + (0, 68 1, 77) 1, 225V O2 ,H /H2O 2 + Tính 0 E − : O ,OH 2 4.1,225 O 4H+ + + 4e 2H O 0,059 K = 10 2 2 1 4H O 4H+ 4OH− + 4 1 − 4 4 (K ) = (10 ) 2 W O 2H O 4e 4OH− + + (4) K 2 2 4 = K1 (KW)4 56 . 0, 059 0 E = (1,225 − ) = 0 + ,399V O /H O 2 2 4 Câu 5: (4 điểm) 1.
a. 3Cu + 2NaNO3 + 8KHSO4 → 3CuSO4 + Na2SO4 + 2NO + 4K2SO4 + 4H2O 0 b. 3S + 6NaOH (đặc) t
⎯⎯→ 2Na2S + Na2SO3 + 3H2O
c. HClO3 + 6FeSO4 + 3H2SO4 → HCl + 3Fe2(SO4)3 + 3H2O
d. Cl2 + Br2 + H2O → HCl + HBrO3
2. a. Ở nhiệt độ thường: 2NaOH + Cl2 → NaCl + NaClO + H2O
6NaOH + 3I2 → 5NaI + NaIO3 +3H2O
Trong môi trường kiềm tồn tại cân bằng: 3XO− 2X− XO− + 3
Ion ClO- phân hủy rất chậm ở nhiệt độ thường và phân hủy nhanh khi đun nóng, ion IO- phân hủy ở
tất cả các nhiệt độ.
b. Các phương trình hóa học:
Ion ClO- có tính oxi hóa rất mạnh, thể hiện trong các phương trình hóa học:
- Khi cho dung dịch FeCl2 và HCl vào dung dịch A có khí vàng lục thaots ra và ding dcihj từ
không màu chuyển sang màu vàng nâu:
2FeCl2 + 2NaClO + 4HCl → 2FeCl3 + Cl2 + 2NaCl + 2H2O
- Khi trong dung dịch Br2 vào dung dịch A, dung dịch brom mất màu:
Br2 + 5NaClO + H2O → 2HBrO3 + 5NaCl
- Khi cho H2O2 vào dung dịch A, có khí không màu, không mùi thoát ra:
H2O2 + NaClO → H2O + O2 + NaCl
5.3.a FeO + 2HCl → FeCl2 + H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
2FeCl3 + 2H2O + SO2 → 2FeCl2 + H2SO4 + 2HCl (3)
5FeCl2 + KMnO4 + 8HCl → 5FeCl3 + MnCl2 + KCl + 4H2O (4)
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4 (5)
(Lượng HCl dùng để hòa tan quặng không được cho quá dư, chỉ đủ để làm môi trường cho phản ứng (4)) b. Từ (1) và (4) ta có: n 3 − 3 − = = =
FeO (trong 1,2180 gam mẫu)= n + 5.n − 5.0,10.15, 26.10 7, 63.10 (mol) 2 Fe MnO4 3 7, 63.10− .0,8120 → n 3 − = FeO (trong 0,8120 gam mẫu)= 5, 087.10 (mol) 1, 2180 → m 3 − = = FeO (trong 0,8120 gam mẫu) 72 . 5, 087.10 0, 3663 (mol) Và m = − = Fe (trong 0,8120 gam mẫu) 0,8120.0, 65 0, 3663 0,1615 (g) 2O3 → 0,1615 n 3 1, 01.10− = (mol) Fe (trong 0,8120 gam mẫu) 2O3 160
Tương tự, từ (3) và (5) ta có: n = n + n SO2 SO2 (3) SO2 (5) Trong đó: 1 n = . n SO (3) FeCl (trong 0,8120 gam mẫu) 2 3 2 = n
(trong 0,8120 gam mẫu) = 1,01.10-3 (mol) Fe2O3 5 5 1 n = n = − − ( n − n 2 SO (5) + 2 MnO4 (5) MnO4 Fe 2 2 5 Với n = n n 2+
FeO (trong 0,8120 gam mẫu) + 2. (trong 0,8120 gam mẫu) Fe Fe2O3 5 1 → n = (n − − (n n ) SO (5)
FeO (trong 0,8120 gam mẫu) + 2. Fe O (trong 0,8120 gam mẫu) ) 2 MnO4 2 5 2 3 5 − 1 3 3 − 3 − 3 → n =
0,10.22, 21.10 − (5, 087.10 + 2.1, 01.10 ) 2.10− (mol) SO 2 (5) 2 5 − − Vậy: 3 3
n = 3,01.10 (mol) → V = 22,4 . 3,01.10 = 0,0674 (lit) SO2 SO2 0,3663 %FeO = .100 = 45,11% 0,8120
%Fe O = 65% − 45,11% = 19,89% 2 3
TRƯỜNG THPT CHUYÊN NGUYỄN DU – ĐĂL LAWK Câu 1: (4 điểm)
1. Cho các phân tử XeF2, XeF4, XeOF4.
a. Viết công thức cấu tạo Li – uy (Lewis) cho từng phân tử.
b. Dự đoán cấu trúc hình học của các phân tử đó.
c. Hãy cho biết kiểu lai hóa của nguyên tử trung tâm trong mỗi phân tử trên.
2. Cho kim loại A tồn tại ở cả 2 dạng lập phương tâm khối và lập phương tâm diện. Khi A tồn tại ở dạng
lập phương tâm khối thì khối lượng riêng của A là 15g/cm3. Hãy tính khối lượng riêng của A ở dạng
lập phương tâm diện. Cho rằng bán kính của A như nhau trong cả 2 loại tinh thể.
3. Một trong các chuổi phân hủy phóng xạ tự nhiên bắt đầu với 238 U và kết thúc bằng đồng vị bền 206 Pb 92 82 .
a. Tính số phân hủy của α và ᵦ xảy ra trong toàn chuổi.
b. Tính năng lượng được giải phóng trong toàn chuỗi.
c. Trong một mẫu đá chứa 13,33µg 238 U và 3,09µg 206 Pb . Tính tuổi của mẫu đá, biết t 92 82 1/2=4,51.109 năm.
Biết: 4 He = 4, 0026u, 206 Pb = 205, 9744u, 238 U = 238, 0508u, 1u = 931,5 MeV/c2. 2 82 92 Câu 2: (4 điểm)
1. Tính nhiệt tạo thành FeCl2 (rắn) biết:
Fe(r) + 2HCl (dd) → FeCl2 (dd) + H2 (k) ∆ H1 = -21,00 Kcal
FeCl2 (r) + H2O → FeCl2 (dd) ∆ H2 = -19,5 Kcal HCl (k) + H2O → HCl (dd) ∆ H3 = -17,5 Kcal H2 (k) + Cl2 (k) → 2HCl (k) ∆ H4 = -44,48 Kcal
Ký hiệu (r): rắn; (k): Khí; (dd): dung dịch
2. Trong bình kín ở nhiệt độ T, áp suất 2 atm có cân bằng sau: AB A + B (1) (k ) (k ) (k )
Giả thiết các khí đều là khí lí tưởng.
a. Thiết lập biểu thức liên hệ giữa hằng sô cân băng Kp với độ chuyển hóa α và áp suất chung P.
b. Xác định Kp, KC, Kx và ∆G0 của phản ứng (1) ở 3500C nếu biết α = 0,98.
c. Xác định ∆H, ∆S của phản ứng (1) ở 3500C. Cho biết ở 4000C có Kp= 54,4
d. Độ phân li α thay đổi như thế nào khi P từ 2 atm giảm còn 0,8 atm? Sự thay đổi đó có phù hợp với
nguyên lí chuyển dịch cân bằng Lơsatơlie không? Câu 3: (4 điểm)
1. Một dung dịch X gồm hỗn hợp HNO3 0,001M và H3PO4 0,001M.
a. Tính pH của dung dịch X.
b. Thêm 50 ml dung dịch NaOH 0,002M vào 50ml dung dịch X thu được dung dịch Y. Tính pH của dung dịch Y.
Biết các hằng số axit của H3PO4 lần lượt là: pK
= 2,15; pK = 7, 21; pK =12,32; a1 a 2 a 3
2. Dung dịch X gồm Na2S 0,010M, KI 0,060M, Na2SO4 0,050M.
a. tính pH của dung dịch X.
b. Thêm dần Pb(NO3)2 vào dung dịch X cho đến nồng độ 0,090M thì thu được kết tủa A và dung dịch B.
- Cho biết thành phần hóa học của kết tủa A và dung dịch B.
- Tính nồng độ các ion trong dung dịch B (không kể sự thủy phân của các ion, coi thể tích dung dịch
không thay đổi khi thêm Pb(NO3)2 Cho pK axit: H − = = = 2S pK 7, 00; pK 12, 90; HSO pK 2, 00; a1 a 2 4 Tính số tan: 26 − 7 − ,8 7 − ,6 PbS = 10 ; PbSO = 10 ; PbI = 10 . 4 2 Câu 4: (4 điểm)
1. Cho giản đồ thể khử chuẩn Mn trong môi trường axit: − ? 2− 2 + ,27V 0. + 95V 3+ ? 2 Mn MnO MnO Mn Mn + ⎯⎯ → ⎯⎯⎯→ ⎯⎯⎯→ ⎯⎯ → 4 4 2 +1,7v +1,23v + +
a. Tính thế khử chuẩn của cặp: − 2 MnO / MnO − và 3 2 Mn / Mn 4 4
b. Hãy cho biết các tiểu phân nào không bền với sự dị phân. Hãy tính hằng số cân bằng của các phản ứng dị phân đó.
2.a. Hãy biểu diễn sơ đồ pin, tính sức điện động của pin và viết phương trình phản ứng xảy ra trong pin + + +
(khi hoạt động) được tạo thành từ các cặp điện cực 3 2 Fe / Fe và 2 Cu
/ Cu ở điều kiện tiêu chuẩn.
b. Tính nồng độ các ion còn lại trong dung dịch khi pin ngừng hoạt động. Giả sử nồng dộ ban đầu của
ion có trong dung dịch làm điện cực pin đều bằng 0,010M (Bỏ qua quá trình thủy phân của các ion). RT Cho 0 0 E = = = + + 0, 771V, E + 0,337V, 0, 059 tại 250C 3 2 2 Fe /Fe Cu /Cu F Câu 5: (4 điểm)
1. X là hợp chất tạo bởi kim loại M và lưu huỳnh. Hòa tan hoàn toàn 24 gam X trong dung dịch H2SO4
đặc, nóng dư thì thu được dung dịch A và 33,6 lít khí E duy nhất (ở đktc). Cho dung dịch NaOH dư
vào A thì thấy tạo thành 21,4 gam kết tủa. Xác định công thức phân tử X?. (Cho S = 32;
O = 16; H= 1; Cu= 64; Al = 27, Fe = 56; Ag = 108; Mg = 24; Cb = 112)
2. Chất lõng A trong suốt, không màu; về phần khối lượng, A có chứa 8,3% hiđro; 59,0% oxi còn lại là
clo; khi đun nóng A đến 1100C thấy tách ra khí X đồng thời khối lượng giảm đi 16,8% khi đó chất
lỏng A trở thành chất lỏng B. Khi làm lạnh A ở dưới 00C, thoạt đầu tách ra tinh thể Y không chứa
clo, còn khi làm lạnh chậm ở nhiệt độ thấp hơn nữa sẽ tách ra tinh thể Z chứa 65% clo về khối
lượng. Khi làm nóng chảy tinh thể Z có thoát ra khí X. Cho biết công thức và thành phần khối lượng của A, B, X, Y, Z.
TRƯỜNG THPT CHUYÊN NGUYỄN DU – ĐĂK LĂK Câu 1: (4 điểm)
1.a. Công thức cấu tạo Li-uy (Lewis): F O | F X e F F X e F F Xe F | F F F b. Cấu trúc hình học: XeF2: Thẳng XeF4: vuông phẳng XeOF4: tháp vuông
c. Kiểu lai hóa của nguyên tử trung tâm Xe: XeF2: sp3d XeF4: sp3d2 XeOF4: sp3d2
2. Một ô mạng lập phương tâm khối: - Cạnh a1 = 4r / 3
- Khối lượng riêng d1 = 15g/cm3
- Số dơn vị nguyên tử: n1 = 8.1/8 + 1 =2
• Một ô mạng lập phương tâm diện: - Cạnh a2 = 2r / 2
- Khối lượng riêng d2 (g/cm3)
- Số đơn vị nguyên tử: n2 = 8.1/8 + 6.1/2 =4 • d = nM/(NA. V); V = a3 Do đó: 3 3 3 3
d : d = (n .a ) : (n .a ) = [2.(2r / 2) ] :[4.(4r / 2) ] =0,919 1 2 1 2 2 1 3 d =16,32g / cm 2
3.a. – Gọi x, y lần lượt là số phân hủy α và β trong toàn chuỗi. 238 206 4 0
- Ta có phản ứng tổng quát: U → Pb + x He + y e 92 82 2 1 −
- Áp dụng định luật bảo toàn điện tích và bảo toàn số khối ta có: 4.x + 206 = 238 x = 8 2.x – y + 82 = 93 y = 6
Vậy có 8 phân tử α và 6 phân hủy β trong toàn chuỗi. b. 238 206 4 0 U → Pb + 8 He + 6 e 92 82 2 1 −
Năng lượng giải phóng trong toàn chuổi W = ( 2 m − m −8m .c 238 206 4 92 U 82 Pb 2 He )
= (238,0508 – 205,9744 – 8.4,0026).931,5 = 51,7914 MeV
c. Tính tuổi của mẫu đá: 238 206 4 0 U → Pb + x He + y e 92 82 2 1 − m m 238 206
- Từ phương trình ta có tỉ lệ: U Pb = M M 238 206 U Pb m 206 3, 09 m Pb = .M = .238, 0508 = 3,57 g 238 phản ứng U 238 U M 205,9744 206 Pb
m238 ban đầu = 13,33 + 3,57 = 16,90 μg U N m 238 238 Ta có: 0 0 ln = ln = k.t (m0: khối lượng
U ở thời điểm ban đầu, m: khối lượng U N m 92 92
ở thời điểm đang xét) 9 t m 4,51.10 16,90 1/2 0 9 t = .ln = . t =1,544.10 (năm) ln 2 m ln 2 13,33 Câu 2: (4 điểm)
1. Fe(r) + 2HCl (dd) → FeCl2 (dd) + H2 (k) ∆ H1 = -21,00 Kcal FeCl2 (r) → FeCl2 (dd) - ∆ H2 = +19,5 Kcal
H2 (k) + Cl2 (k) → 2HCl (k) ∆ H4 = -44,48 Kcal 2HCl (k) → 2HCl (dd) -2∆ H3 = -35 Kcal Fe (r) + Cl k → Fe l C r ∆H 2 ( ) 2 ( ) Cộng theo vế ta được:
∆H = -21 + 19,5 - 44,48 – 35 = -80,98 Kcal
2.a. Gọi a là số mol AB tại thời điểm ban đầu AB A + B K (1) (k ) (k ) (k ) p Ban đầu: a 0 0
Cân bằng: a(1-α) α a α a Từ (2), ta có:
+ Tổng số mol tại cân bằng hóa học là a(1-α). P P + Hằng số cân bằng .
K : K = A B P P PAB
Trong đó Pi = xi.P (Pi là áp suất riêng phần, P là áp suất toàn phần của hệ, xi là phần mol), Thay Pi vào (1), ta được: a a .P .P 2 a(1+ ) a(1+ ) K = = .P (I) P 2 a(1+ ) 1− .P a(1+ )
b. Thay α = 0,98; P = 2 atm ta được KP = 48,51 K
K / (RT ) n ; K K / P n = = với ∆n = 1 + 1 – 1 = 1 C P x P Thay số thu được KC = 0,9496; Kx = 24,255 0 G = −RT ln K = 20 − 106,101 (J/ mol) P
c. Theo phương trình của Van-Hop, ta có K P(T ) H 1 1 1 ln = − ( − ), K R T T P(T ) 1 2 2 Thay số ta được H = 7989,245(J/ mol) Mặt khác ta có, G = H −T S
nên ∆S = 45,097(J.mol-1.K-1)
d. Khi P = 0,8 atm, theo công thức (I), KP không thay đổi, α = 0,992, phù hợp với nguyên lí chuyển dịch cân bằng Lơsatơlie. Câu 3: (4 điểm)
1.a. Tính pH của dung dịch X HNO H+ NO− ⎯⎯ → + 3 3 0,001M 0,001M H PO H+ H PO− + (1) Kal= 10-2,15 3 4 2 4 − + 2 H PO H HPO − + (2) Ka2= 10-7,21 2 4 4 − + 3 HPO H PO − + (3) Ka3= 10-12,32 4 4 H O H+ OH− + (4) Kw= 10-14 2
Do Ka1 >> Ka2 >> Ka3 và Kw nên cân bằng (1) chủ yếu H PO H+ H PO− + (1) Kal= 10-2,15 3 4 2 4 Co: 0,001M 0,001M [ ]: 0,001-x 0,001 + x x +
Theo ĐLTDKL ta có: x(0,001 x) 2 − ,15 =10 0, 001− x 4 − + 4 − 3 x 7, 975.10 [H ]= 0,001 + 7,975.10 1, 7975.10− = = M
Vậy pH của dung dịch X = 2,75
b. Tính pH của dung dịch Y − − Tính lại nồng độ: 4 4 C = 0,001M; C = 5.10 M; C = 5.10 M NaOH HN 3 O H3PO4 Pư: NaOH + HNO ⎯⎯ → NaNO + H O 3 3 2 5.10-4 5.10-4 NaOH + H PO ⎯⎯ → NaH PO + H O 3 4 2 4 2 5.10-4 5.10-4 5.10-4 DD Y: NaH PO : 5.10-4 M 2 4 + − NaH PO → Na + H PO 2 4 2 4 − + 2 H PO H HPO − + Ka2= 10-7,21 2 4 4 H PO− H+ + H PO (Ka)-1 = 102,15 2 4 3 4 H O H+ OH− + Kw= 10-14 2
Điều kiện proton mức không: H PO− , H 2 4 2O + − 2 H = OH + HPO − − H PO 4 3 4 H PO− 2 4 − − 1 h = K / h + K . − (K ) .h.[H PO ] w a 2 a1 2 4 h K [H PO− ]+K a 2 2 4 w h = ( ) 1 1+ (K )− [H PO− ] a1 2 4
Coi gần đúng: [H PO− ] = C 2 4 − = 5.10-4 M H PO 2 4 K − a2. [H PO ] >> K 2 4 w 7 − ,21 4 − 1 − 4 10 .5.10 +10 6 − = = h 5,367.10 pH của dd Y = 5,27 2.15 4 1+10 .5.10−
2.a. Tính pH của dung dịch Na2S → 2 Na+ + S2- 0,01 0,01 KI → K+ + I- 0,06 0,06 Na 2- 2SO4 → 2Na+ + SO4 0,05 0,05 2 S − H O HS− OH− + + K 2 b(1)=10-1,1 (1) 2 SO − H O HSO− OH− + + K 4 2 4 b(2)=10-12 (2)
Kb(1) >> Kb(2) nên cân bằng (1) quyết định pH của dung dịch: 2 S − H O HS− OH− + + K 2 = 10-1,1 [] (0,01-x) x x 2 x 1 − ,1 2 3, − 1 3 10 x 0, 0794x 10 0 x 8,94.10− = → + − = → = 0, 01− x → [OH-] = 8,94.10-3 → pH = 11,95 b. 2+ 2 Pb S − + →PbS 0,09 0,01 2+ 2 Pb SO − + → PbSO ( 1 K− =10 S ) 7,8 4 4 0,08 0,05 2 Pb + 2I− + → PbI ( 1 K− = 10 S ) 7,6 2 0,03 0,06
Thành phần hỗn hợp: ↓A: PbS, PbSO4, PbI2
Dung dịch B: K+ 0,06M Na+ 0,12M + − − Ngoài ra còn có các ion 2 2 2 Pb ; SO ; S do kết tủa tan ra. 4 Độ tan của PbI 7 − ,6 2 − ,7 7 − ,8 3 − ,9 = = = 2: 3 3 10 / 4 10 PbSO : S 10 4 10 4 − − 26 13 PbS : S = 10 =10
Bởi vì độ tan của PbI2 là lớn nhất nên cân bằng chủ yếu trong dung dịch là cân bằng tan của PbI2. 2 PbI Pb + 2I− + Ks 2
Do đó [Pb2+] = 10-47 = 2.10-3M và [I-] = 4.10-3M. 7 − ,8 − 10 2 5 − ,8 6 − 2 SO 5.10 7,9.10 M [Pb + = = = ] 4 3 2.10− 26 − 10− 2 − 4 2 2 S 5.10 [ b P + ] = = 3 2.10− Có nồng độ SO 2-
4 , S2- đều rất bé so với nồng độ Pb2+, như vậy nồng độ Pb2+ do PbS và PbSO4 tan ra
là không đáng kể nên cách giải gần đúng trên là hoàn toàn chính xác. Câu 4: (4 điểm)
1.a. Mỗi cặp oxi hóa khử tính đúng được + +
Thế khử chuẩn của cặp: − 2 MnO / MnO − và 3 2 Mn / Mn 4 4 2 MnO − 4H+ + + 2e MnO + 2H O (1) 4 2 2 MnO− 4H+ + + 3e MnO + 2H O (2) 4 2 2 Lấy (2) trừ (1) ta có: − 2 MnO e MnO − + (3) 4 4 0 0 0 G = G − G 3 2 1 0 0 0 −FE = 3 − FE − ( 2 − FE ) 3 2 1 0 E = 0 + ,56V 3 + 3 MnO e 4H Mn + + + + 2H O (4) 2 2 + 2 MnO e 4H Mn + + + + 2H O (5) 2 2 Lấy (5) trừ (4) ta có: 3+ 2 Mn 1e Mn + + (6) 0 0 0 G = G − G 6 5 4 0 0 0 −FE = 2 − FE − (−FE ) 6 5 4 0 E = 1 + ,5V 6 b. 2 MnO − và 3
Mn + không bền với sự dị phân. 4 2 MnO − 4H+ + + 2e MnO + 2H O 0 E = 2 + , 27V 4 2 2 1 2 MnO − MnO− + 2e - 0 E = 0 − ,56V 4 4 3 2 3MnO − 4H+ 2MnO− + + MnO + 2H O (7) 4 4 2 2 0 0 0 0 G = G
− G = −2FE = −3, 42F 0 nên phản ứng (7) tự diễn biến. 7 1 3 7 0 2 E 7 lgK = = 57,966 K 7 7 = 9,25.1057 0, 059 3+ 2 Mn e Mn + + 0 E = 1 + ,51V 6 + + 3 Mn + 2H O MnO + 4H + e 0 −E = +0,95V 2 2 4 3+ + 2 2Mn 2H O MnO 4H Mn + + + + (8) 2 2 0 0 0 0 G = G
− G = −FE = −0,56F 0 nên phản ứng (8) tự diễn biến. 8 6 4 8
2.a. Sơ đồ pin: (-) Cu| Cu2+ (1M) || Fe3+(1M), Fe2+(1M) |Pt (+)
Sức điện động chuẩn của pin: 0 0 0 E = E − = + + E + 0, 434V 3 2 2 Pin Fe / Fe Cu /Cu
Phản ứng xảy ra khi pin hoạt động: 3+ 2+ 2 2Fe Cu 2Fe Cu + + + K = 1014,66
b. K rất lớn nên xem như phản ứng xảy ra hoàn toàn. 3+ 2+ 2 2Fe Cu → 2Fe Cu + + + C0 0,01 0,01 0,01 C 0 0,02 0,015 Xét cân bằng: 2+ 2+ 3+ 1 − 14 − ,66 2Fe + Cu → 2Fe + Cu K =10 C0 0,02 0,015 0 CB 0,02-2x 0,015-x 2x − − (2x)2 (2x)2 1 14,66 K = K = 10 = = CB (0,02 − 2x)2 .(0,015− x) 2 0, 02 .0, 015
(do KCB bé nên giả thiết x << 0,02) X = 5,714.10-11 <<0,02 [Fe3+]= 2x = 1,189.10-10 [Fe2+]= 0,02-2x = 0,02 [Cu2+]= 0,015 - 2x = 0,015 Câu 5:
1. Đặt CT: MxSy số mol : a (M.x + 32.y)a = 24 (I) Phản ứng:
X + H2SO4 (đặc nóng) E là SO2
2MxSy + (2nx + 4y) H2SO4 → xM2(SO4)n + (nx + 6y)SO2 + (2nx + 4y)H2O ax a (nx + 6y) a mol 2 2
M2(SO4)n +2nNaOH → 2M(OH)n ↓ + n Na2SO4 ax mol ax mol 2 Ta có: n =1,5 a(nx + 6y) = 3 (II) SO2
m = (M +17n)ax = 21,4 (III)
Giải hệ (I), (II), (III): ya = 0,4; nxa = 0,6; Mxa = 11,2 M 53 = n 3 n 1 2 3 M / / 56 x 1
Vậy M là sắt Fe; n = 3 => xa = 0,2 mà ya = 0, 4 = y 2 Vậy CT của X: FeS2
2. Đặt tỉ lệ số nguyên tử H: O : Cl trong A là a: b : c.
Ta có: (8,3/1): (59/16): (32,7/35.5) = 8,3: 3,69: 0,92 = 9: 4: 1
Không tồn tại chất ứng với công thứ H9O4Cl.
Tuy nhiên, do tỉ lệ H : O là 9 : 4 gần với tỉ lệ của các nguyên tố trong phân tử H2O.
- Có thể suy ra chất lỏng A là dung dịch của HCl trong H2O với tỉ lệ mol là 1 : 4 với
C%HCl = 36,5.100%/(36,5+18.4) = 33,6%
- Khi tăng nhiệt độ tan của khí, hợp chất X thoát ra từ A là khí hiđro clorua HCl.
- Do giảm HCl C%HCl còn lại = (33,6-16,8).10%/(100-16.8)=20,2%
chất lỏng B là dung dịch HCl nồng độ 10,2%.
(Dung dịch HCl ở dưới 00C có thể tách ra tinh thể nước đá Y,
- Khi làm lạnh ở nhiệt độ thấp hơn tách ra tinh thể Z là HCl.nH2O.
- Tinh thể Z có khối lượng mol phân tử là 35,5/0,65=54,5 g/mol thành phần tinh thể Z là HCl.H2O
ĐỀ THI OLYMPIC TRUYỀN THỐNG 30/4 LẦN XXII – NĂM 2016 ĐỀ CHÍNH THỨC
Cho NTK: H=1, O=16, Na=23, Mg=24, S=32, K=39, Fe=56, Br=80, I=127 Câu 1: (4 điểm)
1. R là nguyên tố thuộc nhóm A, hợp chất với hiđro có dạng RH3. Electron cuối cùng trên nguyên tử R
có tổng số lượng tử chính và số lượng tử từ bằng 3.
a. Hãy viết cấu hình electron của nguyên tử R.
b. Ở điều kiện thường, cho RH3 là một chất khí. Viết công thức cáu tạo, dự đoán trạng thái lai hóa của
nguyên tử nguyên tố tring tâm trong phân tử RH3, oxit cao nhất, hiđroxit tương ứng R.
2. Giả sử có thể ciết cáu hình electron của 2 Ni + như sau: - Cách 1: 2 2 6 2 6 8
1s 2s 2 p 3s 3 p 3d - Cách 2: 2 2 6 2 6 8 2
1s 2s 2 p 3s 3 p 3d 4s
Áp dụng phương pháp gần đúng Slater hãy tính năng lượng electron của 2
Ni + với mỗi cách viết trên
(theo đơn vị eV). Cách viết nào phù hợp với thực tế? Vì sao?
3. Cho X, Y, R, A, B theo thứ tự là 5 nguyên tố liên tiếp trong bảng tuần hoàn, có tổng số đơn vị điện
tích hạt nhân là 90 (X có số đơn vị điện tích hạt nhân nhỏ nhất).
a. Xác định số đơn vị điện tích hạt nhân của X, Y, R, A, B.
b. Viết cấu hình electron của X2-, Y-, A+, B2+ . So sánh bán kính của chúng và giải thích.
c. Trong phản ứng oxi hóa – khử, X2-, Y- thể hiện tính chất cơ bản gì? Vì sao?
4. Trong mạng tinh thể của Beri borua, nguyên tử Bo kết tinh ở mạng tinh thể lập phương tâm mặt và
trong đó tất cả các hốc tứ diện đã bị chiếm bởi nguyên tử Be, khoảng cách ngắn nhất giữa 2 nguyên tố Bo là 3,29 Å.
a. Tính số nguyên tử B và số nguyên tử Be có trong 1 ô mạng cơ sở?
b. Tính độ dài cạnh a của ô mạng cơ sở va fkhoois lượng riêng của Beri borua theo đơn vị g/cm3? Biết
nguyên tử khối của B = 10,81; Be = 9,01; và số Avogadro NA = 6,022.1023 Câu 2: (4 điểm)
1. Biết giá trị nhiệt động của các chất sau ở điều kiện tiêu chuẩn (298 K) là: Chất Fe O2 FeO Fe2O3 Fe3O4 0 H (kcal.mol-1) 0 0 – 63,7 – 169,5 – 266,9 s S0 (cal.mol-1.K-1 6,5 49,0 14,0 20,9 36,2
Tính biến thiên năng lượng do Gibbs (∆G0) của sự tạo thành các oxit sắt, từ các đơn chất ở điều kiện
chuẩn. Từ đó hãy cho biết ở điều kiện chuẩn oxit sắt nào bền nhất?
2. Bằng thực nghiệm người ta đã thu được những số liệu của phản ứng giữa NO và H2 ở nhiệt độ 7000C như sau:
2NO (k) + 2H2 (k) → 2H2O (k) + N2 (k) Nồng độ ban đầu H2 Nồng độ ban đầu NO Tốc độ ban đầu TN (M) (M) M.s-1 1 0,0100 0,0250 2,4.10-6 2 0,0050 0,0250 1,2.10-6 3 0,0100 0,0125 0,6.10-6
a. Xác định bậc của phản ứng.
b. Xác định hằng số tốc độ phản ứng.
c. Hai cơ chế được đề xuất cho phản ứng trên được trình bày dưới đây, xác định cơ chế nào phù hợp
với qui luật động học thực nghiệm? Cơ chế 1: 2NO (k) k1 ⎯⎯→ N2O2 (k) nhanh N k ⎯⎯→ 2O2 (k) + H2 (k) 2 2HON (k) nhanh HON (k) + H k ⎯⎯→ 2 (k) 3 H2O (k) + HN (k) chậm HN (k) + HON (k) k4 ⎯⎯→ + N2 (k) + H2O (k) nhanh Cơ chế 2: 2NO (k) N2O2 (k) Kcb nhanh N k ⎯⎯→ 2O2 (k) + H2 (k) 5 N2O (k) + H2O (k) chậm N k ⎯⎯→ 2O (k) + H2 (k) 6 N2 (k) + H2O (k) nhanh Câu 3: (4 điểm)
1. Dung dịch A gồm có H2SO4 0,05M; HCl 0,18M và CH3COOH 0,02M.
Thêm NaOH vào dung dịch A đến nồng độ của NaOH bằng 0,23M thì dừng, ta thu được dung dịch A1
(xem thể tích của dung dịch A1 bằng thể tích dung dịch A). Tính pH của dugn dịch A1. Cho Ka -
2(HSO4 ) = 10-2; Ka (CH3COOH) = 10-4,75
2. Tính nồng dộ cân bằng của các ion trong dung dịch gồm Cu(NO3)2 1,0M và NaCl 1,0.10-3M. Cho các hằng số bền: 2,80 4,40 4,89 5,62 8 − ,0 = = = = = + 10 ; 10 ; − 10 ; − 10 ; * + 10 ; 2 CuCl CuCl 2 CuCl CuCl CuOH 3 4
3. Trị số pH của dung dịch bão hòa magie hiđroxit trong nước tại 25℃ là 10,5.
a. Tính độ tan của magie hiđroxit trong nước.
b. Tính tích số tan của magie hiđroxit.
c. Tính độ tân của magie hiđroxit trong dung dịch NaOH 0,01M tại 25℃
d. Trộn hỗn hợp gồm 10 gam magie hiđroxit và 100 ml dung dịch HCl 0,10M tại 25℃. Tính pH của
dng dịch thu được (xem nhưng thể tích dung dịch sau pha trộn không đổi). Câu 4: (4 điểm) RT Cho
ln = 0,05921g (ở 25℃); F = 96485C.mol-1. F
1. Bổ túc cân bằng các phản ứng oxi hóa khử sau:
a. Cu2FeSx + O2 → Cu2O + Fe3O4 + ...........
(phương pháp thăng bằng electron)
b. OCl- + I- + H2O → ......+ I2 + OH-
(phương pháp thăng bằng ion - electron)
c. Na2SO3 + KMnO4 + H2O → .......+..........+ KOH
(phương pháp thăng bằng ion - electron)
d. KI + KClO3 + H2SO4 → KCl + I2 + ......+ H2O
(phương pháp thăng bằng ion - electron)
2. Ở 25℃, hãy cho biết MnO− có thể oxi hóa ion nào trong số các ion Cl− , Br− , I− ở các giá trị pH lần 4
lượt bằng 0; 3; 5 (biết các chất khác nhau đều xét ở điều kiện chuẩn)? Cho: 0 0 0 0 E = + = + = + = + − + 1, 51V; E − 1, 36V ; E − 1, 08V ; E − 0, 62V. 2 MnO / Mn Cl /Cl Br / Br I / I 4 2 2 2
3. Ăn mòn kim loại thường đi kèm với các phản ứng điện hóa. Việc thép bị ăn mòn tạo gỉ sắt trên bề
mặt cũng theo cơ chế này. Thế chuẩn ở 25℃: Fe2+(dd) + 2e → Fe(r) E0 = -0,44V O2 + 2H2O + 4e → 4OH- (dd) E0 = +0,40V
a. Tính E0 của phản ứng ở 25℃.
b. Viết phản ứng xảy ra ở hai nửa pin và toàn bộ phản ứng, từ đó viết sơ đồ pin trên.
c. Tính KC của phản ứng.
d. Phản ứng trên xảy ra trong 24 giờ có thể tạo dòng điện có cường độ I = 0,12A.
Tính khối lượng Fe chuyển thành Fe2+ sau 24 giờ. Biết oxi dư.
e. Tính E cuả phản ứng biết:
[Fe2+] = 0,015M; pHnửa pin phải = 9,00; p(O2) = 0,70 atm. Câu 5: (4 điểm)
1. Hãy cho biết các oxit của clo: Cl2O, ClO2, Cl2O6 là anhiđrit của các axit nào? Viết phương trình hóa học minh họa.
2. Hoàn thành các phản ứng hóa học sau: Na2S2O3 + Cl2 + H2O → Na2S2O3 + H2SO4 → F2 + NaOHloãng → I2 + KOH →
3. Hòa tan 0,835 gam hỗn hợp X gồm NaHSO3 và Na2SO3 trong dung dich H2SO4 dư, đun nóng. Cho
tất cả lượng khí sinh ra hấp thụ trong 500 ml dung dịch Br2 thu được 500 ml dung dịch A. Thêm KI
vào 50 ml dung dịch A, lượng I -
3 sinh ra tác dụng vừa đủ với 12,5 ml dung dịch Na2S2O3 0,01M. Nếu
sục khí N2 để đuổi hết Br2 dư trong 25 ml dung dịch A thì thu được dung dịch. Để trung hòa dung
dịch B cần dùng 15 ml dung dịch ,NaOH 0,1M.
a. Tính nồng độ mol của dung dịch Br2 ban đầu.
b. Tính % khối lượng các muối trong hỗn hợp X.
ĐÁP ÁN ĐỀ THI OLYMPIC 30/4 Câu 1: (4 điểm)
1. a. Với hợp chất hidro có dạng RH3 nên R thuộc nhóm IIIA hoặc nhóm VA.
TH1: R thuộc nhóm IIIA, → cấu hình e lớp ngoài cùng có dạng ns2np1
Vậy e cuối cùng có: l=1, m=-1, ms = +1/2. Mà n + 1 + m + ms =4,5 → n = 4
Cấu hình e nguyên tử: 1s22s22p63s23p63d104s24p1
TH2: R thuộc nhóm VA, → cấu hình e lớp ngoài cùng có dạng ns2np3
Vậy e cuối cùng có: l=1, m=1, ms = +1/2. Mà n + 1 + m + ms =4,5 → n = 2
Cấu hình e nguyên tử: 1s22s22p3 (N)
b. Ở điều kiện thường RH3 là chất khí nên nguyên tố phù hợp là Nitơ.
Công thức cấu tạo các hợp chất: N H H H Oxit cao nhất: O O N O N O O
Nguyên tử N có trạng thái lai hoá sp3.
Hidroxit với hóa trị cao nhất: O H O N O
Nguyên tử N ở trạng thái lai hóa sp2. 2. - Ứng với cấu hình: 2 2 6 2 6 8 1s 2s 2p 3s 3p 3d (1) * Z = 28 – 1.0,3 = 27,7 1s 2 22, 7 E = 1 − 3,6 = 1 − 0435,1 eV 1s 2 1 * Z
= 28 – 2.0,85 – 7.0,35 = 23,85 2s,2p 2 23,85 E = 1 − 3,6 = 1 − 934 eV 2s,2p 2 2 * Z
= 28 – 2.1 – 8.0,85 – 7.0,35 = 16,75 3s,3p 2 16, 75 E = 1 − 3,6 = 4 − 24 eV 3s,3p 2 3 * Z
= 28 – 18.1 – 7.0,35 = 7,55 3d 2 7,55 E = 1 − 3,6 = 8 − 6,1 eV 3d 2 3 E = 2.E + 8.E + 8.E + 8.E = − 40423 eV (1) 1s 2s,2p 3s,3p 3d - Ứng với cấu hình: 2 2 6 2 6 6 2 1s 2s 2p 3s 3p 3d 4s * Z
= 28 – 18.1 – 5.0,35 = 8,25 3d 2 8, 25 E = 1 − 3,6 = 1 − 02,85 eV 3d 2 3 * Z
= 28 – 10.1 – 14.0,85 = 5,75 eV 4s 2 5, 75 E = 1 − 3,6 = 3 − 2,85 eV 4s 2 3, 7 E = 2.E + 8.E + 8.E + 6.E + 2.E = − 40316,5 eV (2) 1s 2s,2p 3s,3p 3d 4s
Vì E(1) < E(2) (1) bền hơn (2).
Vậy trạng thái cơ bản cấu hình Ni2+ phù hợp là: 2 2 6 2 6 8 1s 2s 2p 3s 3p 3d
3. a) Gọi Z là số điện tích hạt nhân của X
Số điện tích hạt nhân của Y, R, A, B lần lượt
(Z + 1), (Z + 2), (Z + 3), (Z + 4)
Theo giả thiết: Z + (Z + 1) + (Z + 2) + (Z + 3) + (Z + 4) = 90 Z = 16 → X; Y; R; A; B 16 17 18 19 20 (S) (Cl) (Ar) (K) (Ca)
b) S2-, Cl-, K+, Ca2+ đều có cấu hình e: 2 2 6 2 6 1s 2s 2p 3s 3p
Số lớp e giống nhau r phụ thuộc điện tích hạt nhân. Điện tích hạt nhân càng lớn thì bán kính r càng nhỏ. r − r − r + r 2 2+ S Cl K Ca
c) Trong phản ứng oxi hóa – khử, ion S2-, Cl- luôn luôn thể hiện tính khử vì các ion này có số oxi hóa thấp nhất. 1 1
4. a) Số nguyên tử B trong 1 ô mạng cơ sở là: 8. + 6. = 4 nguyên tử. 8 2
Vì các hốc tứ diện đã bị chiếm bởi nguyên tử Be số nguyên tử Be là 8
b) Gọi a là độ dài cạnh 1 ô mạng cơ sở. Các nguyên tử B tiếp xúc trên đường chéo mặt mạng, nên: 4r = a 2 a 2 = 3,29 →a , 4 65 Å 2 Khối lượng riêng: M.N 8.9, 01+ 4.10,81 3 d = = 1,9gam / cm 8 − 3 23 N .V (4, 65.10 ) .6, 022.10 A Câu 2: (4 điểm) 1 1. Fe + O → FeO (1) 2 2 0 1 H 63700 cal.mol− = − 1 1 0 0 0 0 1 − 1 S S (S S ) 17 cal.mol .K− = − + = − 1 FeO Fe O2 2 0 0 0 1 G H T S 58634 cal.mol− = − = − 1 1 1 3 Fe + O → Fe O (2) 2 2 3 2 0 1 H 169500 cal.mol− = − 2 3 0 0 0 0 1 − 1 S S (2.S S ) 65,5cal.mol .K− = − + = − 2 Fe O Fe O 2 3 2 2 0 0 0 1 G H T S 149951, 2 cal.mol− = − = − 2 2 2 2Fe + 2O → Fe O (3) 2 3 4 0 1 H 266900 cal.mol− = − 3 0 0 0 0 1 − 1 S S (3.S 2.S ) 81, 3cal.mol .K− = − + = − 3 Fe3O4 Fe O2 0 0 0 1 G H T S 242672, 6 cal.mol− = − = − 3 3 3
2. a) Phương trình động học có dạng: v = k.[NO]x.[H2]y
Thay các giá trị thực nghiệm vào ta có: v1 = 2,4.10-6 =k.0,025x.0,01y v2 = 1,2.10-6 =k.0,025x.0,005y v3 = 0,6.10-6 =k.0,0125x.0,01y Suy ra: x = 2; y = 1.
Vậy bậc toàn phần của phản ứng là 3.
b) Hằng số tốc độ phản ứng là: k = 0,384 (mol/l)-2s-1
c) Giai đoạn chậm nhất quyết định tốc độ phản ứng:
Theo cơ chế 1: v = k.[HON].[ H2] d[N O ] 1 2 2 2 = k .[NO] − k [H ][N O ]=0 1 2 2 2 2 dt 2 2 k [NO] 1 → [N O ]= (1) 2 2 2k [H ] 2 2
d[HON] = 2k .[H ][N O ]− k [HON][H ]−k [HON][HN] = 0 (2) 2 2 2 2 3 2 4 dt
d[HN] = k .[HON][H ]− k [HON][HN] = 0 (3) 3 2 4 dt k [N O ] (2) – (3) ta được: 2 2 2 [HON]= (4) k3 2 (1) thay vào (4) ta đượ k [NO] c: 2 [HON]= (5) 2k [H ] 3 2 2 k [NO]
Thay (5) vào biểu thức v ta được 1 2 v = = k[NO] 2
Cơ chế này không phù hợp với qui luật động học thực nghiệm
Theo cơ chế 2: v = k5.[ N2O2].[ H2] = k.Kcb.[ NO]2.[ H2] = k’[ NO]2.[ H2]
Cơ chế này phù hợp với qui luật động học thực nghiệm Câu 3.
1. Vì nấc H2SO4 điện li hoàn toàn nên: H - 2SO4 → H+ + HSO4 0,05 0,05 0,05 HCl → H+ + Cl- 0,18 0,18 0,18 NaOH → Na+ + OH- 0,23 0,23 0,23 H+ + OH- → H2O 0,23 0,23 0,23 Dung dịch A -
1 : HSO4 0,05M; CH3COOH 0,02M; Na+ 0,23M; Cl- 0,18M HSO - 2- 4 H+ + SO4 (1) 0,05M 0,05-x x x CH3COOH H+ + CH3COO- (2) 0,02M H2O H+ + OH- (3) 2 Ka 10− 2 =
= 555 100 (1) là chủ yếu 4 − ,75 Ka 10 2 − 14 Ka . C 10 .0, 05 10− =
bỏ qua sự điện li của H 2 2O Xét cân bằng (1) 2 x 2 Ka 10− = =
x = 0,018 và pH = -lg0,018 = 1,74 2 0, 05 − x 2. Do C
C nên trong hệ xảy ra quá trình tạo phức CuCl+ là chính: 2+ − Cu Cl Cu2+ + Cl- → CuCl+ C0 1 0,001 C 0,999 - 0,001
TPGH: Cu2+ 0,999M ; CuCl+0,001M
Đánh giá quá trình tạo phức hidroxo − Cu2+ + H = 2O CuOH+ + H+ 8,0 * + 10 CuOH C 0,999 [] 0,999-x x x 2 x 8 10− = 0,999 − x + 5 − 2 [CuOH ] x 9, 995.10 [Cu + → = =
] = 0, 999 − x = 0, 999, nghĩa là quá trình tạo phức hidroxo của Cu2+ là không đáng kể.
Do phức CuCl+ là chính nên trong hệ có cân bằng chủ yếu: CuCl+ Cu2+ + Cl- k = 10-2.8 C 0,001 0,999 [] 0,001-y 0,999 + y y (0, 999 + y) y 2 − ,8 =10 0, 001− y y = [Cl-] = 1,58.10-6M; [Cu2+]=0,999M
Và [CuCl+] = 0,001 – 1,58.10-6 = 9,98.10-4 M
Từ giá trị Cu2+ và Cl- tính được, ta có: 2+ − 2 4,4 6 − 2 8 [CuCl ]= [Cu ][Cl ] 10 .0, 999(1, 58.10 ) 6, 26.10− M [CuCl+ = = ] 2 2 − 2+ − 3 4,89 6 − 3 1 − 3 [CuCl ]= [Cu ][Cl ] 10 .0, 999(1, 58.10 ) 3, 06.10 M [CuCl+ = = ] 3 3 − 2+ − 4 5,62 6 − 4 18 [CuCl ]= [Cu ][Cl ] 10 .0, 999(1, 58.10 ) 2, 60.10− M [CuCl+ = = ] 4 4 3. a) 2 Mg(OH) Mg + 2OH− + 2
pH = 10,5 pOH = 3,5 [OH-] = 3,16.10-4 (M) [OH− + ] 2 4 [Mg ] 1,58.10− = = (M) 2
b) Tích số tan KS = [Mg2+].[OH-]2 = 1,58.10-11 c) NaOH → Na+ + OH- 0,01 0,01 (M) Mg(OH)2 Mg2+ + 2OH- [ ] S S 0,01 + 2S (M)
KS = [Mg2+].[OH-]2 = S(0,01 + 2S)2 = 1,58.10-11 S = 1,58.10-7 (M)
d) Số mol Mg(OH)2 = 0,1724 ? (0,01/2) mêm HCl bị tring hòa hết theo phản ứng
Mg(OH)2 + 2 H+ → Mg2+ + 2H2O
Xem thể tích không đổi = 100 ml thì nồng độ C 2+ Mg = 0,05M Khi đó: Mg(OH)2 Mg2+ + 2OH- [ ] S’ S’ + 0,05 2S’
Vì KS << Coi: S’ + 0,05 0,05 11 K − 1,5810− K sp 5 − = = S = [Mg2+].[OH-]2 [OH ]= 1, 78.10 (M) 2 [Mg + ] S'+ 0, 05 pOH = 4,75 pH = 9, 25 Câu 4:
1. a) Cu2FeSx + O2 → Cu2O + Fe3O4 + ........(thăng bằng electron) 8 + /3 2 + 4 + 2
3Cu FeS → 3 Fe + 6 Cu + 3x S + (12 x+14) e 2 x o 2 − (6x +7) O + 4e → 2 O 2
6Cu2FeSx + (6x +7)O2 → 6Cu2O + Fe3O4 + 6xSO2
b) OCl- + I- + H2O → ......+ I2 + OH- (ion – electron)
1x OCl- + H2O + 2e → Cl- + 2OH- 1x I- → I2 + 2e
OCl- + 2I- + H2O → Cl- + I2 + OH-
c) Na2SO3 + KMnO4 + H2O → .......+..........+ KOH (ion – electron) 4 + 4 + 3x 2− − 2 S O 2OH S O − + → + H O + 2e 3 4 2 7 + 4 + 2x MnO− 2H O 3e MnO 4OH− + + → + 4 2 2
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
d) KI + KClO3 + H2SO4 → KCl + I2 + ......+ H2O (ion – electron) o 3x 2I− → I + 2e 2 5 + 1x ClO− 6H+ 6e Cl− + + → + 3H O 3 2
6KI + KClO3 + 3H2SO4 → 3K2SO4 + 3I2 + KCl + 3H2O 2. − + 2 MnO 8H 5e Mn + + + → + 4H O 4 2 − + 8 0, 0592 [MnO ][H ] 0 4 E = E + lg 2 5 [Mn + ] pH = 0, 0 0 E = + = + − + 1, 51V E − 1, 36V ; 2 MnO / Mn Cl /Cl 4 2
Như vậy: MnO− oxi hóa được cả Cl−, Br−, I− 0 0 E = + = + − 1, 08V ; E − 0, 62V. 4 Br / Br I / I 2 2 pH = 3, 0 E − = + − − − + 1, 23V
MnO chỉ oxi hóa được Br , I 2 4 MnO / Mn 4 pH = 5, 0 E − = + − + 1, 04V
MnO chỉ oxi hóa được I− 2 4 MnO / Mn 4 3. a) o E = E0 (pin)
phải - E0trái = 0,40 – (-0,44) = 0,84V
b) Phản ứng xảy ra ở hai nửa pin: Trái: 2Fe → 2Fe2+ + 4e
Phải: O2 + 2H2O + 4e → 4OH-
Toàn bộ phản ứng: 2Fe + O2 + 2H2O → 2Fe2+ + 4OH-
Sơ đồ pin: -Fe(r) | Fe2+ || OH- | O2(k), C(r) + c) K = [Fe2+]2[OH-]4/p(O2) 0 0 56 G = −nFE = −RT ln K →K = 5,7.10 (pin) d) Q = ne.F = It = 10368 (C). ne = Q/F = 0,1075 mol
→ m = (0,1075 : 2).56 = 3,01 (g). Fe 2 4 2 F + − 0, e OH 0592 e) 0 E = E − lg (1) pin pin n pO2
pH = 9,00 → [H+] = 10-9M và [OH-] = 10-5M
Thay E0 = 0,84; p(O2) = 0,70 atm; [Fe2+] = 0,015M; n = 4 vào (1) 2 5 − 4 0, 0592 0, 015 .(10 ) → E = 0,84 − lg pin 4 0, 7 → E = 1,188(V) Câu 5: 1. Các oxit tương ứng:
• Cl2O là anhidrit của axit hipoclorơ HClO
• ClO2 là anhidrit hỗn tạp của axit clorơ HClO2 và axit cloric HClO3.
• Cl2O6 là anhidrit hỗn tạp của axit cloric HClO3 và axit cloric HClO4 Phản ứng minh họa: Cl2O + 2KOH → 2KClO + H2O
2ClO2 + 2KOH → KClO2 + KClO3 +H2O Cl2O6 + H2O → HClO3 +HClO4
2. 4Cl2 + Na2S2O3 + 5H2O → 2NaHSO4 + 8HCl
Na2S2O3 + H2SO4 → S + SO2 +Na2SO4 + H2O
2F2 + 2NaOHloãng → 2NaF + OF2 + H2O
3I2 + 6KOH → 5KI + KIO3 + 3H2O
3. a) Tính nồng độ dung dịch Br2: Các PTPƯ xảy ra: HSO - 3 + H+ → H2O + SO2 (1) x mol x mol SO 2- 3 + 2 H+ → H2O + SO2 (2) y mol y mol Br 2- 2 + 2H2O + SO2 → SO4 + 2Br- + 4H+ (3) 3I- + Br - 2 → I3 + 2Br- (4) I - 2- 2- 3 + 2S2O3 → S4O6 + 3I- (5) H+ + OH- → H2O (6)
Ta có: nNaOH = 0,015.0,1 = 0,0015 (mol)
→ n + (25ml ddA) = 0,0015 (mol) H
→ n + (500ml ddA) = 0,0015.500/25 = 0,03 (mol) H
→ n (3) = 0,03: 4 = 0,0075 (mol) 2 Br Ta có: n
= 0,0125.0,01 = 1,25.10-4 (mol) Na2 2 S O3
→ n (50ml ddA) = 1,25.10-3. ½ = 6,25.10-5 (mol) 3
→ n (500ml ddA) = 6,25.10-5.500 : 50 = 6,25.10-4 (mol) 3
→ n (4) = 6,25.10-4 (mol) 3
Vậy: số mol Br2 ban đầu = 0,0075 + 6,25.10-4 = 8,125.10-3 (mol)
CM(Br2) = 8,125. 10-3/0,5 = 0,01625 (M)
b) Tính % khối lượng các muối trong hỗn hợp X (0,5đ)
Gọi x và y lần lượt là số mol của NaHSO3 và Na2SO3
→ mhỗn hợp = 104x + 126y = 0,835 (I)
Từ phản ứng (1), (2), (3) ta có:
Số mol SO2 = 1/4 số mol H+ (500ml ddA) = 0,03.1/4 = 0,0075 (mol) → x + y = 0,0075 (II)
Giải (I) và (II): x = 0,005; y = 0,0025
%NaHSO3 = 62,27% ; %Na2SO3 = 37,73%
TRƯỜNG THPT CHU VĂN AN – ĐĂK LĂK Câu 1: (4 điểm)
1. Cho hai nguyên tố A, B đứng kế tiếp nhau trong bảng hệ thống tuần hoàn có tổng số (n + 1) bằng
nhau: trong đó số lượng tử chính của A lớn hơn số lượng tử chính của B. Tổng đại số của 4 số lượng
tử của electron cuối cùng trên B là 4,5.
a. Hãy xác định bộ 4 số lượng tử của electron cuối cùng trên A, B.
b. Hợp chất X tạo bởi A, Cl, O có thành phần phần trăm theo khối lượng lần lượt là 31,83%;
28,98%; 39,18%. Xác định công thức của X.
2. So sánh, có giải thích: độ lớn góc liên kết của các phân tử: a) CH4; NH3, H2O. b) H2O; H2S. Câu 2: (4 điểm)
Cho các phản ứng sau với các dữ kiện nhiệt động của các chất ở 25°C: CO + H ⎯⎯ → ⎯ ⎯ CO + H O 2 2 2 CO H CO H O 2 2 2 0 H KJ / mol −393,5 0 −110,5 −241,8 298 ( ) 0 S J / mol 213,6 131,0 197,9 188,7 298 ( ) a. Hãy tính 0 H , 0 S và 0 G
của phản ứng và nhận xét phản ứng có tự xảy ra theo chiều thuận 298 298 298 ở 25°C hay không? b. Giả sử 0
H của phản ứng không thay đổi theo nhiệt độ. Hãy tính 0 G
của phản ứng thuận ở 1273 1000°C và nhận xét.
c. Hãy xác định nhiệt độ (°C) để phản ứng thuận bắt đầu xảy ra (giả sử bỏ qua sự biến đổi 0 0 H ,S theo nhiệt độ). Câu 3: (4 điểm)
1. Chuẩn độ một dung dịch CH COOH 0,1M bằng dung dịch NaOH 0,1M. Khi có 50% lượng axit 3
trong dung dịch được trung hòa thì độ pH của dung dịch thu được là bao nhiêu? Biết axit axetic có 5 K 1,8.10− = . a
2. Tính pH của các dung dịch sau: a) dung dịch HCl 7 2.10− M. b) dung dịch KOH 7 2,5.10− M. Câu 4: (4 điểm)
1. Cân bằng phản ứng sau theo phương pháp ion-electron:
a. KMnO + K SO + H O → MnO + K SO + KOH 4 2 3 2 2 2 4
b. H S + KMnO + H SO → S + ?+ ?+ H O 2 4 2 4 2
c. H O + KMnO + H SO → O + ?+ ?+ ? 2 2 4 2 4 2
2. Hãy cho biết trường hợp nào sau đây có xảy ra phản ứng? Biết 0 0 E = = − + 1,52(v); E − 1,36(v) 2 MnO / Mn Cl / 2Cl 4 2
a. Cho dung dịch KMnO vào dung dịch HCl ở điều kiện chuẩn. 4
b. Cho dung dịch KMnO 1M vào dung dịch HCl 0,01M. 4
(coi nồng độ các ion khác đều bằng 1M) Câu 5: (4 điểm)
Hòa tan m gam KMnO trong dung dịch HCl đặc dư được dung dịch A và V lít khí D (đktc). Pha 4
loãng dung dịch A được 500ml dung dịch B.
- Để trung hòa axit dư trong 50ml dung dịch B cần dùng vừa đủ 24ml dung dịch NaOH 0,5M.
- Thêm AgNO dư và 100ml dung dịch B để kết tủa hoàn toàn ion clorua thu được 17,22 gam kết 3 tủa.
a. Viết phương trình hòa học của các phản ứng xảy ra.
b. Tính nồng độ mol/lít các chất tan trong B.
c. Tính m, V và thể tích dung dịch HCl 36,5% (D = 1,18g/ml) đã dùng.
TRƯỜNG THPT CHU VĂN AN – ĐĂK LĂK Câu 1: (4 điểm)
1.a) Đề cho A, B đứng kế tiếp nhau trong bảng hệ thống tuần hoàn có tổng số (n + 1) bằng nhau,
n n ⇒ cấu hình ngoài cùng: A B A:(n + ) 1 1 s 1
n +1+1− = 4,5 n = 3 . 6 B: np 2 1
Vậy bộ 4 số lượng tử của A ( n = 4,l = 0, m = 0,s = ) 2 1 B ( n = 3,l = 1, m = 1,s = − ) 2
b) Gọi công thức của hợp chất là K Cl O x y z 31,83 28,98 39,18 x : y : z = : : =1:1:3 39 35,5 16
Vậy công thức của hợp chất là KClO . 3
2. a. CH NH H O 4 3 2 Giải thích:
Số cặp e chưa tham gia liên kết càng nhiều càng đẩy nhau, góc liên kết càng nhỏ. b. H O H S 2 2
Giải thích: Vì độ âm điện của O S , độ âm điện của nguyên tử trung tâm càng lớn sẽ kéo mây của
đôi e− liên kết về phía nó nhiều hơn làm tăng độ lớn góc liên kết. Câu 2: (4 điểm) a. 0 0 H , S và 0 G 298 298 298 Pt phản ứng: CO + H ⎯⎯ → ⎯ ⎯ CO + H O 2 2 2 Ta có: 0 0 0 0 0 H = H + H − H + H 298(p ) 298 (CO) 298(H O 298 CO 298 H O 2 ) ( 2 ) ( 2 ) = ( 110 − ,5 − 241,8) − ( 393 − ,5) = 41, 2KJ / mol 0 0 0 0 S = S + S − S = 42J / mol 298(p ) 298 (CO) 298(H O 298 CO 2 ) ( 2 ) 0 0 0 G = H − T S
= 41200 − 298 42 = 28684J / mol 298(p ) 298(p ) 298(p ) Vì 0 G
0 nên phản ứng không tự diễn ra theo chiều thuận ở 25°C. 298(p ) G G
b. Áp dụng công thức: T T 2 1 0 = + H (1/ T −1/ T 2 1 ) T T 2 1 Thay số tìm ra 0 G
=127328684 / 298 + 41200 1/1273 −1/ 298 = −12266J / mol 1273 ( ) Vì 0 G
0 nên phản ứng tự diễn ra theo chiều thuận ở 1000°C. 1273
c. Để phản ứng tự diễn ra theo chiều thuận thì: 0 0 T H / S
= 41200 / 42 = 980,95K tức ở 707,95 C Câu 3: (4 điểm)
1. Xét 1 lít dung dịch CH COOH 0,1M, số mol CH COOH ban đầu là 0,1 mol. 3 3 CH COOH CH COONa H O 3 + NaOH → 3 + 2 0,05 → 0,05 0,05
Thể tích dung dịch sau thí nghiệm 1 + 0,5 = 1,5 (l) CH COONa → CH COO− 3 + 3 Na+ 0,05 → 0,05 0,05 CH COOH CH COO− 3 + 3 H+ 0,05 0,05 x x x 0,05 – x 0,05 + x x x (x + 0,05) 1,5.1,5 Ta có: 5 K = =1,8.10− 0, 05 − x 1,5 5 − x 2, 7.10− = và 5 pH = lg(2,7.10 ) = 4,57
2. a) Vì dung dịch HCl nồng độ quá bé nên ta xét các quá trình: HCl → H+ + Cl− H O 2 H+ + OH− H+ = H+ + H+ = H+ + OH− HCl H O HCl 2 14 − 2 + − 10 7 + 7 − + 1 − 4 H = 2.10 +
H − 2.10 H −10 = 0 H+
Giải phương trình trên ta có nghiệm + 7 H 2, 414.10− =
(nhận), loại nghiệm âm. pH = 6, 62
b) Lập luận tương tự câu 1: − 7 OH 2,85.10− = M pOH = 6,545 pH = 7, 455 Câu 4: (4 điểm)
1. Dành cho bạn đọc 2. a. − + − 2 MnO H Cl Mn + + + → + Cl + H O (1) 4 2 2
Được hình thành từ các bán phản ứng sau: − + 2+ 0 MnO + 8H + 5e ⎯⎯ → ⎯ ⎯ Mn + 4H O E − 2 4 2 + MnO / Mn 4 − 0 Cl + 2e ⎯⎯ → ⎯ ⎯ 2Cl E 2 − Cl / 2Cl 2
Ở điều kiện tiêu chuẩn ta có: 0 0 0 E = E − E =1,52 −1,36 = 0,16(v) 2 p − + − MnO / Mn Cl / 2Cl 4 2 Nhận thấy 0 0 E 0 G
0 nghĩa là có xảy ra phản ứng (1) theo chiều thuận. p p b. − + − 2 MnO H Cl Mn + + + → + Cl + H O (2) 4 2 2 − + 2 MnO + 8H + 5e ⎯⎯ → ⎯ ⎯ Mn + + 4H O E − 2 4 2 + MnO / Mn 4 Cl + 2e ⎯⎯ → ⎯ ⎯ 2Cl− E 2 − Cl / 2Cl 2
Ở điều kiện bài toán ta có: 8 MnO− H+ 0, 059 4 0 E = + − + E − + lg 2 2 MnO + 4 / Mn MnO4 /Mn 2 5 Mn 8 0,059 1.0,01 =1,52 + lg =1,3312(v) 5 1 0,059 1 0 E = + − E − lg Cl / 2Cl Cl / 2Cl 2 2 2 2 Cl− 0,059 1 =1,36 + lg =1,478(v) 2 2 0,01 Khi đó ta có: E = E − E =1,3312 −1,478 = 0 − ,147(v) 2 p − + − MnO / Mn Cl / 2Cl 4 2 Nhận thấy E 0 G
0 nghĩa là phản ứng (2) không xảy ra theo chiều thuận, mà xảy ra theo p p chiều nghịch. Câu 5: (4 điểm)
a) Các phương trình phản ứng: 2KMnO + 16HCl
→ 2MnCl + 2KCl + 5Cl + 8H O (1) 4 (®Æc) 2 2 2
Dung dịch A chứa KCl, MnCl và HCl dư ⇒ dung dịch B chứa KCl, MnCl và HCl. 2 2
• Trung hòa axit trong B bằng NaOH: HCl + NaOH → NaCl + H O (2) 2
• B tác dụng với AgNO dư: 3
AgNO + HCl → AgCl +HNO (4) 3 3
AgNO + KCl → AgCl +KNO (5) 3 3
2AgNO + MnCl → 2AgCl +Mn NO (6) 3 2 ( 3 )2
Đặt số mol HCl, KCl trong 50ml dung dịch B lần lượt là x, y (mol).
Theo phương trình phản ứng (1): n = n = y mol MnCl KCl 2
Theo phương trình phản ứng (2): x = n = n = 0,024.0,5 = 0,012 mol C = 0,24M HCl NaOH M(HCl) Theo 100ml dung dịch B: n = 2x mol; n = n = 2y mol HCl MnCl KCl 2
Theo phương trình phản ứng (3),(4),(5) : n = n + n + 2.n AgCl HCl KCl MnCl2
2x + 2y + 2.2y =17,22 :143,5 = 0,12 mol
x + 3y = 0,06 mol y = 0,016 mol.
Vậy nồng độ mol của các chất trong B là: C = C = 0,32M M(KCl) M(MnCl2 ) Theo (1) ta có: n = n =10y = 0,16 mol KMnO4 KCl(500 ml dd B) m = m = 0,16.158 = 25,28 gam. KMnO ban ®Çu 4 ( ) 5 n = n
= 0,4 mol V = 0,4.22,4 = 8,96 lít. Cl KMnO 2 4 2
TRƯỜNG THPT CHUYÊN BẠC LIÊU – BẠC LIÊU Câu 1.
1. Silic có cấu trúc tinh thể giống kim cương.
a. Tính bán kính nguyên tử silic. Cho khối lượng riêng của silic tinh thể bằng 3 2,33g.cm− ; khối lượng
mol nguyên tử của Si bằng 1 28,1g.mol− .
b. So sánh bán kính nguyên tử của silic với cacbon ( r = 0,077nm ) và giải thích. C
2. Sử dụng thuyết VB hãy viết công thức của phân tử O và C . Nghiên cứu tính chất của O và C 2 2 2 2
người ta thu được các kết quả thực nghiệm sau:
Phân tử Năng lượng liên kết, kJ/mol Độ dài liên kết, pm Từ tính O 2 495 131 thuận từ C 2 620 121 nghịch từ
a. Kết quả thực nghiệm này có phù hợp với cấu tạo phân tử đưa ra bởi thuyết VB không biết rằng: E C H = 615kJ / mol , E C H = 812kJ / mol , và E H O = 142kJ / mol . C= trong C 2 4 C trong C 2 2 O− trong O 2 2
b. Sử dụng thuyết MO hãy giải thích kết quả thực nghiệm thu được. Liên kết hóa học Câu 2.
1. Sự phân hủy axeton diễn ra theo phương trình: CH COCH → C H + H + CO 3 3 2 4 2
Theo thời gian phản ứng, áp suất chung của hệ đo được như sau: t [phút] 0 6,5 13 19,9 p [mmHg] 312 408 488 562
Bằng phương pháp giải thích hãy chứng tỏ phản ứng là bậc 1 và tính hằng số tốc độ.
2. Thực hiện phản ứng: 2NOCl( 2NO + Cl k ) (k) 2(k)
a. Ban đầu cho vào bình phản ứng NOCl, thực hiện phản ứng ở 300°C. Khi hệ đạt trạng thái cân
bằng thấy áp suất trong bình là 1,5 atm. Hiệu suất của phản ứng là 30%. Tính hằng số cân bằng của phản ứng.
b. Ở nhiệt độ 300°C, phản ứng có thể tự xảy ra được không? Vì sao?
c. Thực hiện phản ứng và duy trì áp suất của hệ phản ứng ở điều kiện đẳng áp: 5 atm. Tính phần
trăm số mol của các khí ở trạng thái cân bằng?
d. Một cách cẩn thận, cho 2,00 gam NOCl vào bình chân không có thể tích 2,00 lít. Tính áp suất
trong bình lúc cân bằng ở 300°C. Câu 3.
1. Trộn 100ml dung dịch AgNO 2
5, 0.10− M với 100ml dung dịch NaCl 0,10M ở 25°C được dung dịch 3 A.
a. Tính thế của điện cực Ag nhúng trong dung dịch A, biết 10 K 2,5.10− = và 0 E = + + 0,80V . s,AgCl Ag / Ag
b. Thêm vào dung dịch A 100,00ml dung dịch Na S O 0,20M. Kết tủa AgCl tan hoàn toàn tạo 2 2 3 −
thành ion phức Ag (S O ) 3 2 3 2
và thế của điện cực đo được là 0,20V. Tính hằng số tạo thành tổng hợp của ion phức. 2
Các quá trình phụ có thể bỏ qua.
2. Dung dịch A gồm Fe( NO 0,05M; Pb( NO 0,10M; Zn ( NO 0,01M. 3 ) 3 ) 3 )3 2 2
a. Tính pH của dung dịch A.
b. Sục khí H S vào dung dịch A đến bão hòa ( H S = 0,10 M), thu được hỗn hợp B. Những kết tủa nào 2 2
tách ra từ hỗn hợp B? Cho: 3+ 2 Fe + H O⎯⎯ FeOH + + H+ ⎯⎯ → lg* = 2 − ,17 2 1 2+ + 2 Pb + H O ⎯⎯ → ⎯ ⎯ PbOH + H lg* = 7, − 80 2 2 2 Zn + + H O ⎯ ⎯ ZnOH+ + H+ ⎯⎯ → lg* = 8 − ,96 2 3 0 E = 0 = 0 = − + + 0, 771 V; E 0,141 V; E + 0,126 V; 3 2 Fe / Fe S/ H S 2 2 Pb / Pb Ở RT 25 C : 2,303 ln = 0,0592lg F pK ( = 26,6;pK = 21,6;pK =17,2 S PbS) ( S ZnS) ( S FeS)
( pK = − lg K , với K là tích số tan). S S S pK = 7,02;pK =12,90 ; a ( 1 H S a 2 H S 2 ) ( 2 ) pK = = + 9, 24; pK 4, 76 a ( NH ) a(CH COOH 3 ) 4 Câu 4.
1. Có hai bình chứa dd HNO loãng cùng nồng độ cùng thể tích. Người ta cho vào bình thứ nhất một 3
lượng kim loại M, vào bình thứ hai một lượng kim loại N. Cả hai kim loại đều tan hoàn toàn và ở hai
bình đều thoát ra khí duy nhất NO có thể tích bằng nhau trong cùng điều kiện. Sau đó người ta làm hai thí nghiệm:
Thí nghiệm 1: Mắc nối tiếp hai bình rồi điện phân thì thấy khối lượng kim loại bám ở catốt bình thứ
nhất so với bình thứ hai luôn luôn là 27/14.
Thí nghiệm 2: Trộn hai bình lại rồi điện phân cho đến khi khối lượng các điện cực không đổi nữa thì
thấy tiêu hao một điện lượng 7720 Coulomb và hiệu số khối lượng hai điện cực là 6,56 gam.
a) Tính khối lượng ban đầu của mỗi kim loại, xác định N, M. Biết rằng điện phân có vách ngăn, điện
cực trơ khối lượng các điện cực bằng nhau và tất cả các quá trình H% = 100%.
b) Viết phương trình phản ứng xảy ra trong quá trình hòa tan kim loại. Nếu ban đầu dùng dung dịch
HNO 1M (loãng) để hòa tan 2 kim loại thì tổng thể tích cần dùng là bao nhiêu? 3
2. Cân bằng các phản ứng oxi hóa khử sau bằng phương pháp thăng bằng ion – electron. a. C H + KMnO + ... → C H OH + KOH + ... n 2n 4 n 2n ( )2 b. Cr S + Mn NO
+ K CO → K CrO + K MnO + K SO + NO + CO 2 3 ( 3 ) 2 3 2 4 2 4 2 4 2 2 Câu 5.
1. Nung hỗn hợp A gồm sắt và lưu huỳnh sau một thời gian được hỗn hợp rắn B. Cho B tác dụng với
dung dịch HCl dư, thu được V lít hỗn hợp khi C. Tỉ khối của C so với hiđro bằng 10,6. Nếu đốt 1
cháy hoàn toàn B thành Fe O và SO cần V lít khí oxi. 2 3 2 2
a. Tìm tương quan giá trị V và V (đo ở cùng điều kiện). 1 2
b. Tính hàm lượng phần trăm các chất trong B theo V và V . 1 2
c. Hiệu suất thấp nhất của phản ứng nung trên là bao nhiêu phần trăm.
d. Nếu hiệu suất của phản ứng nung trên là 75%, tính hàm lượng phần trăm các chất trong hỗn hợp B.
Cho biết S = 32, Fe = 56,O = 16 .
2. ClO là chất hóa chất được dùng phổ biến trong công nghiệp. Thực nghiệm cho biết: 2
a) Dung dịch loãng ClO trong nước khi gặp ánh sáng sẽ tạo ra HCl, HClO . 2 3
b) Trong dung dịch kiềm (như NaOH) ClO nhanh chóng tạo ra hỗn hợp muối clorit và clorat natri. 2
c) ClO được điều chế nhanh chóng bằng cách cho hỗn hợp KClO , H C O tác dụng với H SO 2 3 2 2 4 2 4 loãng.
d) Trong công nghiệp ClO được điều chế bằng cách cho NaClO tác dụng với SO có mặt H SO 2 3 2 2 4 4M.
Hãy viết phương trình phản ứng và nói rõ đó là phản ứng oxi hóa – khử hay phản ứng trao đổi? Tại
sao? (phân tích từng phản ứng a, b, c, d).
TRƯỜNG THPT CHUYÊN BẠC LIÊU – BẠC LIÊU Câu 1.
1.a. Từ công thức tính khối lượng riêng n.M D = → V = (8.28, ) 1 / ( 23 2,33.6,02.10 ) 3 =16,027 cm . 1 N .V « A 8 − 8 − 8 a 5, 43.10 cm;d a. 3 5, 43.10 .1,71 9.39.10− = = = = cm ;
Bán kính của nguyên tử silic là: −8 r = d / 8 = 1,17.10 cm ; b. Có r 0,117nm r
0, 077nm . Điều này phù hợp với quy luật biến đổi bán kính nguyên tử trong Si ( ) C ( ) một phân nhóm chính
2.a. Cấu tạo phân tử O và C theo thuyết VB: 2 2 Kết quả thực nghiệm:
Phân tử Năng lượng liên kết, kJ / mol Độ dài liên kết, pm Từ tính O 495 131 thuận từ 2 C 620 121 nghịch từ 2 C H E = 615 2 4 C=C C H E = 812 2 2 CC H O E =142 2 2 O−O
- Phân tử C : Theo VB, hai nguyên tử C liên kết với nhau bởi liên kết 4, nhưng năng lượng liên kết 2
thực nghiệm là 620, bé hơn so với E = 812 và gần bằng với E
= 615 . Do đó bậc liên kết không phù CC C=C hợp.
- Phân tử O : phù hợp về mặt năng lượng liên kết nhưng theo V, phân tử O không còn electron độc 2 2
thân nên không giải thích được tính thuần từ của O . 2
b. Theo thuyết MO, cấu hình electron của phân tử O và C lần lượt là: 2 2
O : ( ) ( )2 ( ) ( )2 ( )2 2 2 ( )2 ( )2 * * ( *)( * 2 1s 1s 2s 2s 2p 1 2 1 2 )1
C : ( ) ( )2 ( ) ( )2 2 2 ( )2 ( )2 * * 2 1s 1s 2s 2s 1 2
- Độ bội liên kết của phân tử C hay O đều là 2. Điều này phù hợp với thực nghiệm. 2 2
- Về mặt từ tính, C nghịch từ còn O thuận từ cũng phù hợp với thực nghiệm. 2 2
- Sự có mặt của hai electron ở MO phản liên kết trong phân tử O làm cho liên kết đôi O = O trở nên 2
kém bền hơn so với liên kết đôi C = C cho dù d (O = O) d (C = C) . Câu 2.
1. Để chứng minh phản ứng phân hủy axeton là bậc 1 ta sử dụng phương pháp thế các dữ kiện vào
phương trình động học bậc 1 xem các hằng số tốc độ thu được có hằng định hay không.
- Vì áp suất tỉ lệ với nồng độ nên trong phương trình động học, nồng độ axeton được thay bằng áp suất riêng phần.
- Gọi p là áp suất đầu của axeton: 0 CH COCH → C H + H + CO 3 3 2 4 2 t = 0 p 0 t p − x 0 x x x
- Áp dụng chung của hệ là: p = p − x + 3.x = p + 2x 0 0 p − p p − p 3p − p 0 0 0 x = p − x = p − = 0 0 2 2 2
- Hằng số tốc độ của phản ứng 1 chiều bậc 1 là: 1 p 1 2p 0 0 k = ln ; k = ln t p − x t 3p − p 0 0
- Thay các giá trị ở các thời điểm ta có: 1 2.312 2 − k ln 2,57.10− = = (phút 1 ) 1 6,5 3.312 − 408 1 2.312 2 − k ln 2,55.10− = = (phút 1 ) 2 13 3.312 − 488 1 2.312 2 − k ln 2,57.10− = = (phút 1 ) 3 19,9 3.312 − 562
- Ta thấy các giá trị của hằng số tốc độ không đổi. Vậy phản ứng trên là phản ứng bậc 1.
- Hằng số tốc độ của phản ứng: 1 ( ) 1 k . k k k .( 2 − 2 − 2 2,57.10 2,55.10 2,57.10− = + + = + + 1 2 3 ) 3 3 2 − 2,56.10− = (phút 1 ) 2. a. Phản ứng: 2NOCl( 2NO + Cl k ) (k) 2(k) x x − 2a 2a a
suy ra tổng áp suất của hệ: x + a = 1,5 và H = 2a / x = 0,3 .
Ta có: a = 0,196 và x = 1,304 K = 0,036 . P
b. Ta có K 1 suy ra ln K 1 nên 0
G 0 . Vậy phản ứng không tự xảy ra. c. Ta có K = 0,036 suy ra 4 K 7, 661.10− = . (vì K = K . RT ) P C ( ) n P C C
= P / RT = 5 / 0,082.573 = 0,106 b® Phản ứng: 2NOCl( 2NO + Cl k ) (k) 2(k) 0,106 0,106 − 2a 2a a a.(2a)2 Suy ra 4 − = = = ( Vậy a 0, 011. 0,106 − 2a ) K 7,661.10 2 C
Phần trăm NOCl: 71,8%; Cl : 9,4%; NO : 18,8%. 2 d. Phản ứng 2NOCl( 2NO + Cl k ) (k) 2(k) 0,717 0,717 − 2a 2a a a.(2a)2 Suy ra = = ( 0,717 − 2a ) K 0,036 2 P Vậy a = 0,125 .
Áp suất trong bình khi hệ đạt trạng thái cân bằng là 0,842 atm. Câu 3. 1.a. 3 n − = = + 5.10 mol; n − 0,01 mol Ag Cl Phản ứng: Ag+ + Cl− → AgCl Ban đầu 3 5.10− 0,01 [] − 3 5.10− 3 5.10− − 2 Cl = = 2,5.10− M 0, 2 10 K 2,5.10− + S 8 Ag = = =1,0.10− M − 2 − Cl 2,5.10 0 E + = + + E + 0,059lg Ag Ag / Ag Ag / Ag 8 0,80 0,059lg10− = + = 0,33 V b. n = 0,02 mol Na S O 2 2 3 − Phản ứng: AgCl + 2Na S O → Ag(S O 2 3 ) 3 2 2 3 2 + NaCl + 3Na+ mol 3 5.10− 2 10− 3 5.10− − − Ag(S O ) 3 3 5,0.10 2 = =1,67.10− 2 3 2 M 0,30 + + 11 E − = = + = + 0, 2 0,80 0,059lg Ag Ag 6,77.10 Ag / Ag M
Nồng độ Ag+ rất bé nên có thể coi toàn bộ Ag+ nằm trong phức chất. n − − = = mol 2− tạo phức 3 2 2.5.10 10 S O 2 3 n = − = mol
2− tự do trong dung dịch 0, 02 0, 01 0, 01 S O 2 3 − 0,01 2 2 S O 3,33.10− = = 2 3 M 0,3 −
Ag+ + 2S O − → Ag (S O ) 3 2 2 3 2 3 2 2 − Ag(S O ) 3 2 − 2 3 2 1, 67.10 10 = = = 7,4.10 2 2 + 2− 11 Ag . S O 6, 77.10− . ( 2 3,33.10− 2 3 )2 2 2. a. 3+ 2+ + 2 − ,17 Fe + H O ⎯⎯ → ⎯ ⎯ FeOH + H * =10 (1) 2 1 2+ + + 7 − ,80 Pb + H O ⎯⎯ → ⎯ ⎯ PbOH + H * = 10 (2) 2 2 2+ + + 8 − ,96 Zn + H O ⎯⎯ → ⎯ ⎯ ZnOH + H * =10 (3) 2 3 H O ⎯ ⎯ OH− H+ ⎯⎯ → + 14 K 10− = (4) 2 w So sánh ( ) 1 → (4) :* .C + * .C + * .C + K → tính pH theo (1): 3 2 2 1 2 3 w Fe Pb Zn A ⎯⎯ → 3 Fe + +H O ⎯ ⎯ 2 * 10− = (1) 2 FeOH + + H+ 2,17 1 C 0,05 0,05 − x x x H+ = x = 0,0153 M → pH = 1,82 A b. Do 0 E = 0 = + + 0, 771 V E 0,141 V nên: 3 2 Fe / Fe S/ H S 2 1/ 3 2Fe + + H S → 2 K = 10 2 2Fe + + S + 2H+ 21,28 1 0,05 − 0,05 0,05 2/ 2 Pb + + H S → K = 10 2 PbS + 2H+ 6,68 2 0,10 0,05 − 0,25 ⎯⎯ → 3/ 2 Zn + + H S ⎯ ⎯ K = 10 2 ZnS + 2H+ 1,68 3 ⎯⎯ → 4/ 2 Fe + + H S ⎯ ⎯ K 10− = 2 FeS + 2H+ 2,72 4
K và K nhỏ, do đó cần phải kiểm tra điều kiện kết tủa của ZnS và FeS: 3 4 Vì môi trường axit / → C = = / = = = + C + 0, 010 M; C + C + C + 0, 050 M. 2 2 Zn Zn 2 2 3 Fe Fe Fe Đối với H S, do 7,02 K K 10− =
nhỏ → nhỏ năng phân li của H S trong môi trường axit không 2 a 2 a1 2
đáng kể, do đó chấp nhận H+ = C = / + 0, 25
M → C − theo cân bằng: H 2 S 2− + 1 − 9,92 H S ⎯⎯ → ⎯ ⎯ S + 2H K .K =10 2 a1 a 2 H S − 0,1 / 2 19,92 1 − 9,72 C = = = − K .K 10 10 . 2 a1 a 2 S 2 H+ (0,25)2 Ta có: / / C → + .C − K ZnS không xuất hiện 2 2 Zn S ( S ZnS) Tương tự: / / C → + .C − K FeS không tách ra. 2 2 Fe S ( S FeS)
Như vậy trong hỗn hợp B, ngoài S, chỉ có PbS kết tủa. Câu 4.
1. Các quả trình oxi hóa khử xảy ra như sau M → m M + + me x mx (mol) N → n N + + ne y ny (mol)
Vì thể tích NO sinh ra trong hai thí nghiệm bằng nhau nên mx = ny (1) Mx 27
Khối lượng catot bình 1 và 2 luôn tỉ lệ 27/14 nên ta lại có: = (2) Ny 14
Trộn hai bình lại rồi điện phân thì khối lượng bình chênh nhau chính là khối lượng kim loại bám trên catot: Mx + Ny = 6,56 (3)
Điện lượng tiêu hao 7720C nên số mol electron trao đổi là 7720 n = mx + ny = = 0,08 (4) e 96500
Giải hệ (2) và (3) ta có khối lượng của M là Mx = 4,32 gam và khối lượng của N là Ny = 2, 24 gam 0,04
Từ (1) và (4) ta có mx = ny = 0,04 x = y = m
Thay x, y vào Mx, Ny ta được M =108m và N = 56n m = 1, M = 108(Ag) n = 2, N = 112(Cd)
b. Phương trình phản ứng:
3Ag + 4HNO → 3AgNO + NO + 2H O 3 3 2 3Cd + 8HNO → 3Cd NO + 2NO + 4H O 3 ( 3) 2 2
Tổng thể tích HNO cần dùng là 106,67ml 3 2.a. 3C H + 2KMnO + 4H O → 3C H OH + 2KOH + 2MnO n 2n 4 2 n 2n ( ) 2 2 b. Cr O +15Mn NO + 20K CO 2 3 ( 3 ) 2 3 2
→ 2K CrO + 3K SO +15K MnO + 30NO + 20CO 2 4 2 4 2 4 2 Câu 5. 1. Fe + S ⎯⎯ →FeS .
Thành phần B gồm có FeS, Fe và có thể có S. FeS + 2HCl → FeCl + H S 2 2 Fe + 2HCl → FeCl + H 2 2
Vậy trong C có H S và H . Gọi x là % của H trong hỗn hợp C. 2 2 2
(2x +34(100− x)) /100 =10,6.2 = 21,2 → x = 40%
Vậy trong C, H = 40% theo số mol; H S = 60% . 2 2 a) Đốt cháy B: 4FeS + 7O = 2Fe O + 4SO 2 2 3 2 4Fe + 3O = 2Fe O 2 2 3 S + O = SO 2 2
Thể tích O đốt cháy FeS là: (3V / 5 . 7 / 4 = 21V / 20 . 1 ) ( ) 2 1
Thể tích O đốt cháy Fe là: (2V / 5 . 3 / 4 = 6V / 20 . 1 ) ( ) 2 1
Tổng thể tích O đốt cháy FeS và Fe là: 21V / 20 + 6V / 20 = 27V / 20 . 2 1 1 1
Thể tích O đốt cháy S là: V − 27V / 20 = V −1,35V . Vậy V 1,35V . 2 ( 1 ) 2 2 1 2 1 3V1 88100 b) 5 %FeS = 3V 2V 1 1 88 + 56 + 32(V −1,35V 2 1 ) 5 5 5280V 165V 1 1 = = % 75, 2V + 32 V −1,35V V + V 1 ( 2 1 ) 2 1 2V1 56100 70V 5 1 %Fe = ( = % 32 V + V V + V 2 1 ) 2 1
32(V −1,35V 100 100V −135V 2 1 ) 2 1 %S = ( = % 32 V + V V + V 2 1 ) 2 1
c) Nếu dư S so với Fe thì tính hiệu suất phản ứng theo Fe. Trường hợp này H = 60% . Nếu dư Fe so với S
tính hiệu suất phản ứng theo S. Trường hợp này H 60% . Vậy hiệu suất thấp nhất của phản ứng nung trên là 60%.
d) Nếu H = 75% có nghĩa là n = 3n dư. n tỷ lệ 3V / 5 FeS S FeS 1
Vậy n tỷ lệ với V / 5 . S 1 5280V 5280V 1 1 %FeS = = = 64,7% 32V1 81, 6V1 75, 2V + 1 5 2240V1 %Fe = = 27,45% 81, 6V1
%S = 100 − (64,7 + 27, 45) = 7,85%
5.2. a) 6ClO + 3H O = HCl + 5HClO 2 2 3
Đây là phản ứng oxi hóa, tự khử vì 4 Cl+ trong + −
ClO vừa là chất oxi hóa ( 4 Cl
+ 5e → Cl ) vừa là chất 2 khử ( 4 + 5 Cl Cl+ → + e)
b) 2ClO + 2NaOH = NaClO + NaClO + H O 2 2 3 2
Bản chất của phản ứng này tương tự bản chất phản ứng a) trên.
c) 2KClO + H C O + 2H SO = 2ClO + 2KHSO + 2CO + 2H O 3 2 2 4 2 4 2 4 2 2
Đây cũng là phản ứng oxi hóa khử, trong đó 5 Cl+ trong + + KClO là chất oxi hóa ( 5 4 Cl + e → Cl trong ClO ) 3 2 3 C + trong + + H C O là chất khử ( 3 4 C → C + e trong CO ) 2 2 4 2
d) 2NaClO + SO + H SO = 2ClO + 2NaHSO 3 2 2 4 2 4
Trong phản ứng oxi hóa khử này, 5
Cl+ trong NaClO là chất oxi hóa; 4 S+ trong SO là chất khử 3 2 ( +4 +6 S → S + 2e trong NaHSO ). 4
TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔ – KHÁNH HÓA Câu 1: (4 điểm)
1. Ở trạng thái cơ bản, nguyên tử nguyên tố X, Y, và Z có electron cuối cùng ddawsccj trưng bằng bốn số lượng tử:
X: n = 2; = 1; m = 1; m = 1 + / 2 s Y: n = 2; = 1; m = 1 − ;m = 1 − / 2 s Z: n = 3; = 1; m = 1 − ;m = 1 − / 2 s
a. Xác định nguyên tố X, Y, Z. Qui ước: số lượng tử từ nhận giá trị từ thấp đến cao.
b. Xác định trạng thái lai hóa của nguyên tử trung tâm cà dạng hình học của các phân tử, ion sau: 2
XY ; ZY ; ZY − 2 2 4
c. Hãy giải thích các dữ kiện thực nghiệm sau:
• XY có thể đime hóa thành X Y , trong khi ZY không có khả năng này 2 4 2 2
• Các liên kết giữa nguyên tử Z và Y trong ion 2
ZY − có độ dài lớn hơn độ dài liên kết Z = 4
Y và nhỏ hơn độ dài liên kết Z – Y trong phân tử axit tương ứng.
2. 32P phân rã − với chu kì bán hủy 14,28 ngày, được điều chế bằng phản ứng giữa nơtron với hạt nhân 32S
a. Viết các phương trình phản ứng hạt nhân để điều chế 32P và biểu diễn sự phân rã phóng xạ của 32P
b. Có hai mẫu phóng xạ 32P được kí hiệu là mẫu I và mẫu II. Mẫu I có hoạt động phóng xạ 20
mCi được lưu giữ trong bình đặt tại buồng làm mát có nhiệt độ 10 0C . Mẫu II có hoạt động
phóng xạ 2 Ci bắt đầu được lưu giữ cùng thời điểm với mẫu I nhưng ở nhiệt độ 20 0C . Khi
hoạt độ phóng xạ của mẫu II chỉ còn 1
5.10− Ci thì lượng lưu huỳnh xuất hiện trong bình
chứa mẫu I là bao nhiêu gam?
Trước khi lưu giữ, trong bình không có lưu huỳnh. Cho 1 Ci = 10
3, 7.10 Bq (1Bq = 1 phân rã/giây); Số Avogađro 23 1 N 6, 02.10 mol− =
; hoạt động phóng xạ A = .N ( là hằng số tốc dộ phân A
rã, N là số hạt nhân phóng xạ ở thời điểm t). Câu 2: (4,0 điểm)
1. Một nguyên tố kim loại M có bán kính nguyên tử R = 143 pm và đơn chất kết tinh theo
cấu trúc lập phương tâm diện, có khối riêng D = 2,7 g/cm3. Xác định kim loại M.
2. Có thể viết cấu hình electron của 2 Ni + là: Cách 1: 2 Ni + 2 2 6 2 6 8 1
s 2s 2 p 3s 3p 3d Cách 2: 2 Ni + 2 2 6 2 6 6 2 1
s 2s 2 p 3s 3p 3d 4s
Áp dụng phương pháp gần đúng Slater (Xlâytơ) tính năng lượng electron của 2 Ni + với mỗi
cách viết trên (theo đơn vị eV). Cách viết nào phù hợp với thực tế? Tại sao? Câu 3: (4,0 điểm)
1. Nghiêu cứu về động học của một phản ứng dẫn đến những thông tin quan trọng về chi
tiết của một phản ứng hóa học. Sau đây sẽ xem xét sự hình thành NO và phản ứng
của nó với oxy. Sự hình thành NO xảy ra theo phản ứng sau: 2NOCl ⎯⎯ → ⎯ ⎯ 2NO + Cl (k) (k ) 2(k ) − −
Hằng số tố độ phản ứng cho bảng: (Hằng số khí R = 8,314 1 1 J .mol .K T(K) 300 400 − − K ( 1 1 L.mol .s ) 2,6.10-8 4,9.10-4
a) Áp dụng phương trình Arrhenius tính năng lượng hoạt hóa của phản ứng.
b) Phản ứng giữa NO và O2 xảy ra theo phương trình: 2NO + O ⎯⎯ → ⎯ ⎯ 2NO (k) 2(k ) 2(k )
Đối với phản ứng này người ta đề nghị cơ chế như sau: k1 NO + O NO (k) 2(k ) 3(k ) k 1 − k2 + ⎯⎯→ NO NO 2NO 3(k) (k) 2( k )
Dựa vào cơ chế trên hãy viết biểu thức tốc độ phản ứng:
2. Trong công nghiệp NH3 được tổng hợp theo phản ứng sau: N + 3H 2NH 0 2(k) 2 3(k)
a. Dựa vào nguyên lí chuyển dịch cân bằng Lơ Satơliê, hãy cho biết những điều kiện
thực hiện phản ứng trên trong công nghiệp để tăng hiệu suất tổng hợp NH3. Giải thích.
b. Dùng hỗn hợp ban đầu theo tỉ lệ số mol N2 : H2 = 1 : 3 để thực hiện phản ứng: P * Đặt NH 3 a = , trong đó P
là áp suất riêng phần của NH3 và P là áp suất của P NH 3
hỗn hợp ở trạng thái cân bằng. Thiết lập công thức tính liên hệ giữa a, P và KP.
* Tính a ở 5000C và P = 300 atm, biết rằng ở nhiệt độ này KP = 1,5.10-5. Từ đó tính
hiệu suất chuyển hóa của N2 (hoặc H2) thành NH3 khi cân bằng. Câu 4: (4,0 điểm) 1. Tính o E 2−
− . Thiết lập hồ sơ đồ pin và viết phương trình phản ứng xảy ra CrO /CrO 4 2 trong pin đượ − − c ghép bởi cặp và 2 CrO
/ CrO và NO− / NO ở điều kiện 4 2 3 tiêu chuẩn. − Cho biết: Cr(OH ) 3 Cr + + 3OH − 29,8 K = 10 3 S Cr(OH )
H + + CrO − + H K − = 3 2 2O 14 10 o E = − − − 0,13V ; 2 CrO
/Cr (OH ) ,OH 4 3 RT o E = = ở − + 0,96V ; 2,303 0,0592 250C; KW = 10-14. NO ,H / N O 3 F
4.2. Hãy tính pH của dung dịch A gồm KCN 0,120M; NH3 0,150M và KOH
0,005M. Cho biết pKa của HCN là 9,35; của NH + là 9,24. 4 Câu 5: (4 điểm)
1. Chất A khi để trong bóng tối không có mùi, để ngoài ánh sáng có mùi nhẹ, chiếu sáng mạnh A
chuyển thành chất rắn B và khí C có màu vàng. Chất B hòa tan trong dd đậm đặc của D tạo ra
ddE và khí G. Bằng tác dụng khí H (có mùi xốc, có tính axit) ddE chuyển thành ddD.
Khí H có thể được tạo ra khi cho khí C tác dụng với Hidro. Khí C tác dụng ddE lại tạo ra chất A.
Trộn khí C với khí G và nước tạo được dd có 2 chất D và H. Hãy xác định CTHH của chất A →
H và pthh các phản ứng xảy ra.
2. Hình vẽ sau mô tả cách lắp dụng cụ điều chế oxi trong phòng thí nghiệm.
a. Tìm điểm lắp dụng cụ sai trong hình vẽ
trên. Giải thích và nêu cách lắp dụng cụ đúng nhất.
b. Phương pháp thu khí ở trên dựa vào tính chất nào của oxi?
c. Khi kết thúc thí nghiệm, tại sao phải tháo ống
dẫn khí ra trước khi tắt đèn cồn?
d. Nếu khí Oxi có lẫn hơi nước, có thể dùng chất nào sau đây để làm khô khí Oxi? A. Al2O3. B.H2SO4 đặc. C. Dd Ca(OH)2. D.dd HCl.
e. Nếu các chất KMnO4 và KClO3 có khối lượng bằng nhau thì chọn chất nào có thể điều chế
được oxi nhiều hơn. Hãy giải thích bằng cách tính toán trên cơ sở PTHH (Mn = 55; K= 39; Cl= 35,5; O = 16)
TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN – KHÁNH HÒA Câu 1: (4,0 điểm)
1.a. X: có phân lớp ngoài cùng là 2p3(N)
Y: có phân lớp ngoài cùng là 2p4(O)
Z: có phân lớp ngoài cùng là 3p4(S)
b. XY2: NO2: nguyên tử N lai hóa sp2, phân tử có dạng chữ V (dạng góc).
ZY2: SO2: nguyên tử S lai hóa sp2, phân tử có dạng chữ V (dạng góc). − − 2 2 ZY : SO
: nguyên tử S lai hóa sp2, ion có dạng tứ diện đều. 4 4
c. NO2 có thể đime hóa thành N2O4 do trên nguyên tử N còn 1 electron độc thân O O O O + O O O O
Trong khi đó, với SO2, nguyên tử S còn 1 cặp electron nên không có khả năng đime hóa. Trong ion 2
SO − , các electron π giải tỏa đều trên cả 4 liên kết làm cho 4 liên kết này trở thành trung gian 4
giữa liên kết đôi S=O và liên kết đơn S-O. Do đó, độ dài liên kết trong 2
SO − lớn hơn liên kết S=O 4
và nhỏ hơn liên kết S-O trong H2SO4. 2- O S O O O
2. a. Phương trình phản ứng hạt nhân điều chế 32P: 32 1 32 1 S + n → P + p 16 0 15 1
Và phân rã phóng xạ của 32 32 32 P : P → S + 15 16 t / t 1 − 1/2 A 510 C i 1 1 b. = = = → t / t = 2 → t = 2 t 1/2 1/2 A 2 C i 4 2 0
Vậy thời gian đã lưu giữ là 2 chu kỳ bán hủy.
Tốc độ phân rã phóng xạ không phụ thuộc vào nồng đầu và nhiệt độ, nên sau thời gian đó lượng 32P của
mẫu I cũng chỉ còn lại ¼ so với lúc đâu → độ giảm hoạt độ phóng xạ trong mẫu I là: 3 3 − 10 7 20 C i =15 C
i =1510 3,710 Bq =153,710 Bq 4
• Số hạt nhân biến đổi phóng xạ là: 7 A A t
5 3, 7 10 14, 28 24 3600 1/ 2 14 N = = = = 9,910 nguyên tử ln 2 0, 693
Khối lượng 32P đã phân rã là: 14 32 9,910 − − 8 2 m = = 5,310 (g) = 5,310 ( g ) 32p 23 6, 0210
Khi bỏ qua sự hụt khối của phân rã phóng xạ, khối lượng 32S tạo thành đúng bằng khối lượng 32P đã
phân rã: m (32S) = 5,3.10-2µg. Câu 2: (4 điểm)
1. Trong một số mạng cơ sở lập phương tâm diện, số nguyên tử bằng: 1 1 Z = 8 + 6 = 4 8 2
Gọi a là độ dài cạnh ô mạng cơ sở. Khoảng cách ngắn nhất giữa các nguyên tử là trên đường chéo của mặt nên: a 2 4143 R = a = = 404pm 4 2 M m Z N Z Từ A d = = 3 V a 3 3 1 − 0 3 23 1 d a N (2, 7 g/ cm ) (404.10 cm) (6, 02.10 mol− ) A M = = Z 4
M = 26,79g / mol. Vậy M là Al
2. Với cách viết 1 [Ar]3d8: 2 2 = 1
− 3,6(28 − 0,3) /1 = −10435,1 eV 1s 2 2
= −13,6 (28 − 0,85 2 − 0,35 7) / 2 1s 2 2 = 19 − 34,0 − = 13
− ,6(28 −1 2 − 0,858 − 0,357) / 3 3s,3p 2 2 = 4
− 24,0 − = −13,6 (28 −118 − 0,35 0 − ,357) / 3 3d = 8 − 6,1− E = 2 + 8 + 8 + 8 = 4 − 0423, 2 eV 1 1s 2s,2p 3s,3p 3d
Với cách viết 2 [Ar]3d64s2: ,
có kết quả như trên. Ngoài ra: 1s 2s,2p 3s,3d 2 2 = 13
− ,6 (28 −118 − 0,355) / 3 3d 2 2 = 1
− 3,6(28 −110 − 0,8514 − 0,35) / 3,7 = 3 − 2,8 4s Do đó E2 = -40417,2 eV
E1 thấp (âm) hơn E2, do đó cách viết 1 ứng với trạng thái bền hơn. Kết quả thu được phù hợp với thực tế
là ở trạng thái cơ bản ion Ni2+ có cấu hình eletron [Ar]3d8. Câu 3: (4,0 điểm)
1.a. Phương trình Arrhenius có dạng: lgk = lgA – Ea/2,3RT. Ta có: lgk1 = lgA - Ea/2,3RT1 (1) lgk2 = lgA - Ea/2,3RT2 (2)
Trừ (1) cho (2) ta được: E 1 1 1 1 k a 1 lgk − lgk = − − E = 2 − ,3R − lg 1 2 a 2,3R T T T T k 1 2 1 2 2
Thay số vào ta tính được Ea = 98,225kJ.mol-1.
b. Giai đoạn chậm quyết định tốc độ, đó là giai đoạn thứ hai: d NO2 = k NO NO 2 3 dt k NO 1 3 K = =
NO = K NO O k NO O 1 − 2 3 2
Thay biểu thức NO vào biểu thức tốc độ phản ứng ta thu được: 3 v = k2.K[NO]2[O2]
2.a. Phản ứng tổng hợp NH3 trong công nghiệp: N + 3H 2NH ÄH < 0 (1) 2(k ) 2(k ) 3(k )
Các điều kiện cần thiết của phản ứng (1) là: t0 5000C; P 300 atm; có bột Fe làm xúc tác, tỉ lệ mol N2:H2 = 1:3
- P cao phù hợp với của nguyên lí Lơ Satơliê là làm cân bằng chuyển dịch theo chiều thuận,
vì chiều thuận là chiều làm giảm số mol khí.
- Nhiệt độ cao cân bằng chuyển dịch theo chiều nghịch (chiều làm giảm hiệu suất) vì
ÄH < 0, do vậy theo nguyên lý Lơ Satơliê là không thuận lợi cho việc tổng hợp NH3, nhưng vì tốc
độ phản ứng chậm (hoặc không phản ứng) khi ở nhiệt độ thấp, nên cần tăng nhiệt độ và dùng chất
xúc tác. Tỉ lệ mol N2:H2 = 1:3 để sự chuyển N2 và H2 thành NH3 là lớn nhất. b. Theo bài cho ta có: * P = a.P; P = 3P ; mà P + P + P = P NH3 H2 N2 H2 N2 NH3 P(1− a) 3.P(1− a) → 4P + aP = P → P = ; P = N N H 2 2 2 4 4
Theo (1) và kết quả trên ta có công thức liên hệ giữa a, P và Kp là: 2 2 2 P aP NH 256a 3 ( ) K = = = P 3 3 2 4 P P P N H P
− a P − a 27 (1− a) 1 3 1 2 2 ( ) ( ) 3 4 4 a Hay = (1) P ( KP 1− a) 0,325 2
*Theo đbài cho và kết quả trên ta có:
+Nếu P = 300 atm thì a = 0,226
+ Nếu P = 600 atm thì a = 0,334
Xét cân bằng sau, gọi số mol N2, H2 tương ứng là 1 mol , 3 mol (vì cân bằng lượng chất theo đúng tỉ lượng): N + 3H 2NH ÄH < 0 (2) 2(k ) 2(k ) 3(k ) Câu bằng: 1-α 3(1-α) 2α Từ (2), ta có:
Tổng số mol các khí lúc cân bằng là n = (4-2 α)mol
Theo biểu thức Pi = xi.P (áp suất riêng phần bằng phần mol của chất đó nhân với áp suất của hệ 2 2a P = P = P = aP → = NH3 4 − 2 2 − 1+ a
Nếu a = 0,226 → α % = 36,87%
Nếu a = 0,334 → α % = 50,07%
Vậy qua kết quả tính ở trên cho thấy khi P tăng thì α cũng tăng, điều này phù hợp với nguyên
lí Lơ Satơliê. Nhưng áp suất mà quá cao thì không đảm bảo sản xuất được an toàn. Mặt khác trong
quá trình sản xuất NH3 được ngưng tụ tách khỏi môi trường phản ứng. Câu 4: (4,0 điểm) 3.( 0 − ,13) 2.1. 2 CrO − 4H O 3 e Cr(OH) 5 OH− + + + 0,0592 K = 10 4 2 3 1 Cr(OH) H+ CrO− + + H O 14 K 10− = 3 2 2 2 H+ OH− + H O 1 − 14 K =10 2 w 3.Ex 2 CrO − 2 H O 3 e CrO− 4 OH− + + + 0,0592 K = 10 4 2 2 3 +Ta có: 1 − 0 2 K K .K .K E CrO − / CrO− = = 0 − ,13V 3 1 2 w 4 2 + Do o 0 E 0,13 V E NO− = − / NO = 0, 96 V cặp 2
CrO − / CrO− là anot và cặp NO− / NO là catot. x 3 4 2 3 + Sơ đồ pin: 2
( )Pt | CrO − 1M; CrO− 1M; OH−1M | NO− 1M; H+ − 1M | NO, p =1atm (+) 4 2 3 NO
+ Phản ứng xảy ra trong pin: Tại catot: NO− 4H+ + + 3e NO + 2H O 3 2 Tại anot: − − 2 CrO 4OH CrO − + + 2H O + 3e 2 4 2 4 HOH H+ OH− + − − 2 NO CrO CrO − + + NO 3 2 4 2. CN− + H O ⎯ ⎯ HCN + OH− ⎯⎯ → 4,65 K 10− = (1) 2 b1 NH + H O ⎯ ⎯ NH+ + OH− ⎯⎯ → 4,76 K 10− = (2) 3 2 4 b 2 H O ⎯ ⎯ H+ OH− ⎯⎯ → + 14 K 10− = (3) 2 W
So sánh (1) → (3), tính pH theo ĐKP áp dụng cho (1) và (2): OH− = C + HCN + NH+ KOH 4 K CN− − − b1 K NH 3 b2 3
Đặt OH = x → x = 5.10 + + x x 2 3 → x − 5.10− x − (K CN− + K NH ) = 0 b1 b2 3 Chấp nhận [CN− ]=C = = − 0,12M; [NH ]=C − 0,15M. 3 CN NH3 → Ta có: 2 3 − 6 − − 3 − 2 − ,23 x − 5.10 x − 5, 29.10 = 0 → x = [OH ]=5,9.10 M=10 M + 1 − 1,77 → H =10 M 9 − ,35 − 10 Kiểm tra: CN = 0,12 0,12M; 9 − ,35 1 − 1,77 10 +10 10− NH 9,24 = 0,15 0,15M; 3 9 − ,24 1 − 1,77 10 +10
Vậy cách giải gần đúng trên có thể chấp nhận được → pH = 11,77. Câu 5: (4,0 điểm)
1. A phải là chất dễ bị ánh sáng phân tích tạo ra khí có mùi, có màu vàng (halogen)
→ A là AgCl; (B là Ag; C là Cl2)
- D có thể là HNO3 đặc → G là NO2 ↑ → E là AgNO3
Hoặc H2SO4 đặc → G là SO2 ↑ → E là Ag2SO4 (loại vì không tan trong dd đậm đặc) - Khí H và HCl as 2AgCl ⎯⎯ → 2Ag + Cl 2
Ag + 2HNO3 → AgNO3 + NO2 + H2O
AgNO3 + HCl → AgCl↓ + HNO3
Cl2 + 2H20+2NO2 → 2HNO3 + 2HCl
Cl2 + AgNO3 + H2O → AgCl↓ + HNO3 +HclO
2.a. Điểm sai trong cách lắp bộ dụng cụ điều chế oxi là ống nghiệp đựng KMnO4 hướng lên. Ống
nghiệm chứa KMnO4 kẹp trên giá phải hơi chúc miệng xuống để trách hiện tượng khi đun KMnO4
ẩm, hơi nước bay lên đọng lại trên thành ống nghiệm chảy xuống đáy làm vỡ ống.
b. Phương pháp thu khí dựa vào tính chất oxi tan ít trong nước.
c. Khi kết thúc thí nghiệm, phải tháo ống dẫn khí ra trước khi tắt đèn cồn để tránh hiện tượng nước chảy
ngược từ chậu sang ống nghiệm đang nóng làm vỡ ống nghiệm.
d. B(H2SO4 đặc vì nó háo nước và không tác dụng với oxi)
e. Nếu dùng cùng một khối lượng KMnO4 và KClO3 thì KClO3 điều chế được oxi nhiều nhất.