
Preview text:
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
1. Cấu tạo tinh thể của hợp kim 2. Giản đồ ồ ph p a
3. Giản đồ pha Fe – C (Fe – Fe3C)
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
Khái niệm: Hợp kim là vật thể của nhiều nguyên tố và mang Phân loại:
tính kim loại. Ng.tố chính là KL (>50%) + Ng.tố khác (KL/á kim).
Hợp kim sắt (hợp kim đen): thành phần chủ yếu là sắt
Hợp kim đơn giản (2 nguyên tố) & hợp kim phức tạp (>2 ng.tố)
Hợp kim màu: hợp kim của các kim loại khác ngoài sắt. Ví dụ:
đồng thau (Cu-Zn), Silumin (Al-Si), vàng tây (Au-Ni, Pd, Cu, Ag) ...
Biểu thị thành phần hợp kim: bằng phần trăm khối lượng wt%
Hợp kim bột, hợp kim gốm: WC-TiC-TaC-Co, MgO – Al O , 2 3
(nếu là phần trăm nguyên tử at% thì phải nói rõ) ZrO - Al O , … 2 2 3 Ví d í ụ d : : Gang, Thé T p hé (F ( e F -C - ), ) L , a L tông t (C ( u-Z - n) Z n) … Hợp ợ p k im i Hợp kim sắt Hợp kim phi sắt Hợp kim bột, (hợp kim đen) (hợp kim màu) hợp kim gốm Thép Gang
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
Tính ưu việt của hợp kim so với KL nguyên chất:
Một số khái niệm:
Ðộ bền cao, chịu được tải trọng cao, không quá cứng để dẫn đến
Cấu tử: là các nguyên tố (hoặc hợp chất hoá học bền vững) phá huỷ giòn
Hệ: dùng để chỉ một tập hợp các vật thể riêng biệt của HK trong
Tính công nghệ đa dạng (cắt gọt, GCAL, đúc, NL...) →chế tạo sản điều kiện xác định phẩm với năng suất cao
Pha: là phần đồng nhất của hệ có cùng cấu trúc và các tính chất
Nhiều trường hợp nấu HK dễ và rẻ hơn nấu KL nguyên chất
cơ-lý-hoá tính xác định. Giữa các pha có bề mặt phân chia pha. Hợp ợ k im i Pb P -Sn vớ v i ớ 2 p ha α va v ̀ a β
⇒Thực tế trong chế tạo Cơ Khí chỉ dùng Hợp Kim,
ít dùng Kim Loại nguyên chất (Màu sáng) (Màu tối)
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
Một số khái niệm (tiếp theo):
Phân loại các tương tác trong hợp kim:
Trạng thái cân bằng (ổn định): P, T và thành phần xác định →
Các cấu tử không tương tác với nhau: Các
năng lượng tự do nhỏ nhất → cấu trúc, tính chất của hệ không phụ
cấu tử không hoà tan, đan xen vào nhau →giữ thuộc thời gian.
nguyên các kiểu mạng của các cấu tử thành
Trạng thái không cân bằng (không ổn định): P, T hoặc thành
phần → các hạt của 2 pha riêng rẽ nằm cạnh
phần thay đổi →năng luợng tự do lớn →luôn có xu huớng về trạng nhau
thái năng lượng thấp hơn. Tuy nhiên đôi khi diễn ra chậm. Có tương tác: Cá không t c nguyên tử (ion) đan xen ương tác
Có tương tác: Các nguyên tử (ion) đan xen Tr T ạng n th t ái h giả gi ổn đị đ n ị h n : h : P, P T , T và thà t nh phần xác định đị , nh h , ệ có th t ể tồ t n ồ
vào nhau tạo ra pha duy nhất:
tại ở trạng thái năng lượng cao hơn ttcb ổn định
- Hoà tan vào nhau tạo dung dịch rắn G Không ổn định
(giữ nguyên kiểu mạng của 1 cấu tử nền) →
tổ chức 1 pha như KL nguyên chất Giả ổn định
- Phản ứng hoá học tạo hợp chất với kiểu có tương tác
mạng khác các cấu tử thành phần Ổn định
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
Dung dịch rắn: Là pha đồng nhất có cấu trúc mạng của dung
A. Dung dịch rắn thay thế: nguyên tử chất tan thay thế vào một số
môi (nguyên tố chính), cấu tử được giữ lại kiểu mạng gọi là dung
nút mạng trong mạng tinh thể dung môi
môi, nguyên tử của cấu tử hòa tan sắp xếp trong mạng dung môi
Điều kiện: Sai khác đường kính ng.tử của các ng.tố ≤15%
ngẫu nhiên và đều đặn. Thành phần đuợc thay đổi trong một phạm
Sự thay thế thường chỉ là có hạn → giới hạn hòa tan
- Điều kiện hòa tan vô hạn của một cặp nguyên tố A và B là:
vi mà vẫn giữ được tính đồng nhất của pha
• tương quan về kiểu mạng: phải cùng kiểu mạng Ký hiệ ý hi u: A( A B ( ); ) B ; (A ( ); ; α; α ; β.... β → → mạ m n ạ g n của ủ A a , đ , ặ đ c t í t n í h h của A a
• tương quan về kích thu h ớc: sai kh k ác về̀ d <8% ng.tử
Phân loại: tùy vào sự sắp xếp của nguyên tử hòa tan vào trong
• tương quan về nồng độ điện tử: có cùng điện tử hóa trị
mạng tinh thể của dung môi: dd rắn thay thế và dd rắn xen kẽ
• tương quan về tính âm điện: gần nhau - Ví dụ:
• Au - Ag: có kiểu mạng A1, ∆r= 0,2%, nhóm IB
• Cu - Ni: có kiểu mạng A1, ∆r= 2,7%, nhóm IB và VIII • Fe - Cr α
: có kiểu mạng A2, ∆r= 0,7%, nhóm VIB và VIII
dd rắn thay thế dd rắn xen kẽ
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
B. Dung dịch rắn xen kẽ: nguyên tử chất tan nằm xen kẽ vào các
Các đặc tính của dung dịch rắn:
lỗ hổng trong mạng tinh thể dung môi
Kim loại nền có kiểu mạng tinh thể đơn
Điều kiện: các ng.tử của ng.tố hoà tan phải có kích thuớc nhỏ để
giản và xít chặt A1, A2…
nằm lọt trong các lỗ hổng của dung môi
Tăng độ cứng, độ bền, tính chống mài
Sự xen kẽ chỉ là có hạn → giới hạn hòa tan
mòn rõ rệt so với KL nguyên chất. Ví dụ: Ví dụ:
hiệu quả hóa bền của các ng.tố hợp kim tr t ong r Cu • Một ộ số cá c c nguyên tố t có d
nhỏ như: N, C, H, B → có thể
ng.tử nhỏ như: N, C, H, B → có thê
chui vào mạng của một số KL chuyển tiếp có d
Dẫn điện, nhiệt kém hơn KL nguyên chất,
ng.tử lớn: Fe, Cr, W, Mo…
thay đổi điện thế điện cực →khả năng
chống ăn mòn điện hoá của VL thay đổi Feα(C) Feβ(C)
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
Pha trung gian (hợp chất hóa học):
Pha trung gian (hợp chất hóa học): Đặc điểm: Pha xen kẽ:
- Có thể biểu diễn bằng công thức xác định AmBn
- Tạo nên giữa các KL chuyển tiếp M (có D lớn) với á kim X (có nt
- Có Tonc xác định, toả nhiệt khi được tạo thành
D nhỏ: C,N,H,B) → tạo Cacbit, Nitrit, Hydrit, Borit nt
- Có kiểu mạng tinh thể phức tạp, khác hẳn các
DX/DM <0,59 Mạng kiểu đơn giản: A1, A2, A3 nguyên tố thành phần
Hợp chất có công thức: M X, M X, MX 4 2 - Tín í h n chấ h t kh k ác h hẳ h n ẳ so v o ới ớ các nguyên t n ố t thà t nh Ví dụ
dụ: Fe N, Fe N, Mo N, Cr N… 4 2 2 2 phần, thường giòn
DX/DM >0,59 Mạng phức tạp
- Trong HK: Pha trung gian thuờng chỉ chiếm 10%,
Hợp chất có công thức: M X, M X , M X 3 7 3 23 6
còn lại là dung dịch rắn
Ví dụ: Fe C, Mn C, Cr C , Cr C … 3 3 7 3 23 6
Phân loại các pha trung gian trong HK thường gặp:
Đặc điểm của pha xen kẽ:
- Pha trung gian xen kẽ: thường gặp
- Có T chảy rất cao (>2000-3000oC), rất cứng (HV>2000- 5000) & - Pha trung gian điện tử
giòn →có vai trò rất lớn trong hóa bền, nâng cao khả năng chống - Pha trung gian Laves
mài mòn và chịu nhiệt của hợp kim - Pha σ, λ, δ, µ …
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
Giản đồ pha: Công cụ biểu thị mối quan hệ giữa nhiệt độ, thành
phần và số lượng các pha của hệ ở trạng thái cân bằng (nguội
rất chậm hoặc ở trạng thái ủ) →Là công cụ quan trọng để khảo sát hợp kim và ceramic Lỏng ộ đ 10850C t ộ iệ đ h t ệ Rắn N Cr i h N Cu Fe Ni Fe (100%) Thành n ph p ần (100%) Ni Loại 1 cấu tử Loại 2 cấu tử Loại 3 cấu tử TRỊNH VĂN TRUNG
CHƯƠNG III: CẤU TẠO CỦA HỢP KIM VÀ GIẢN ĐỒ TRẠNG THÁI 17
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
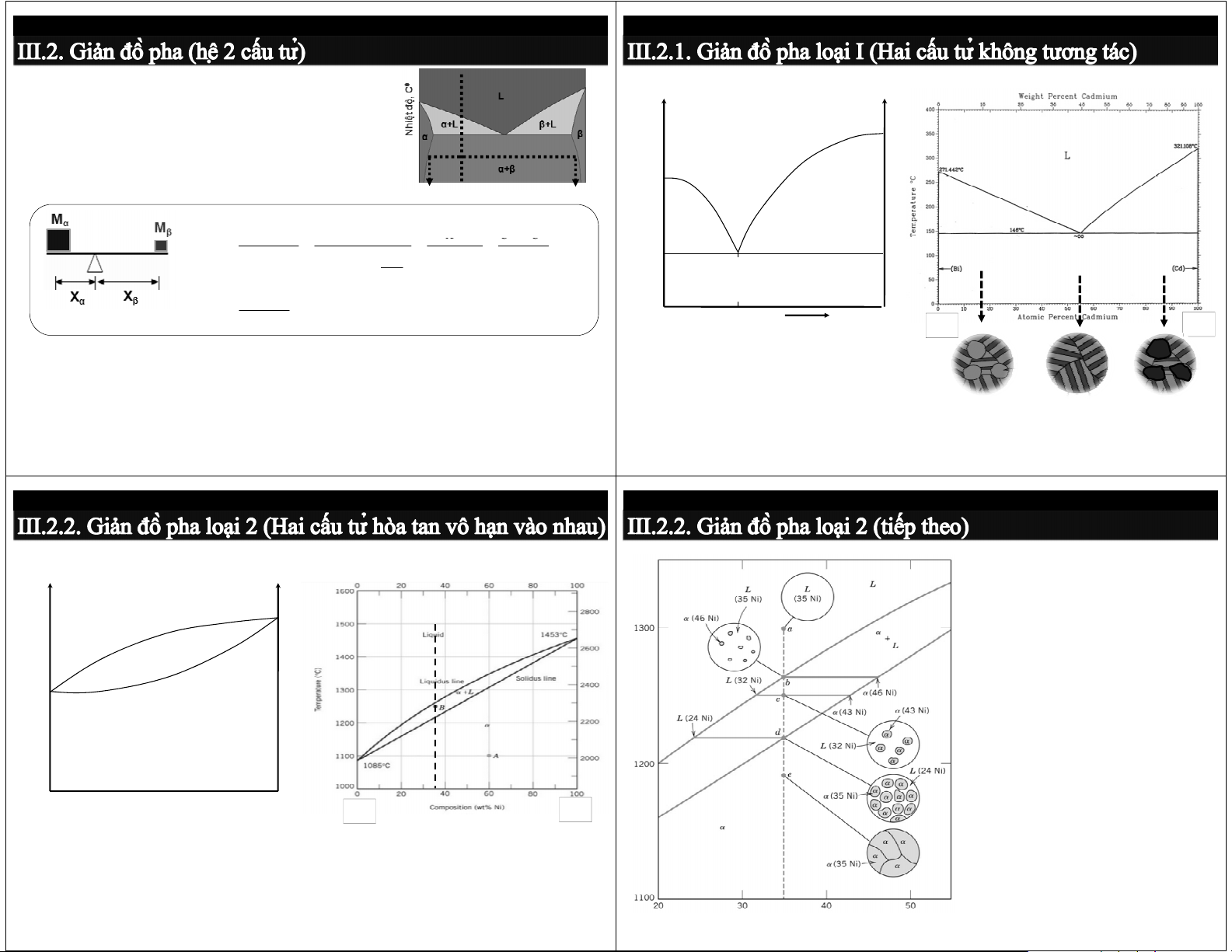
Ứng dụng của giản đồ pha: Dạng tổng quát
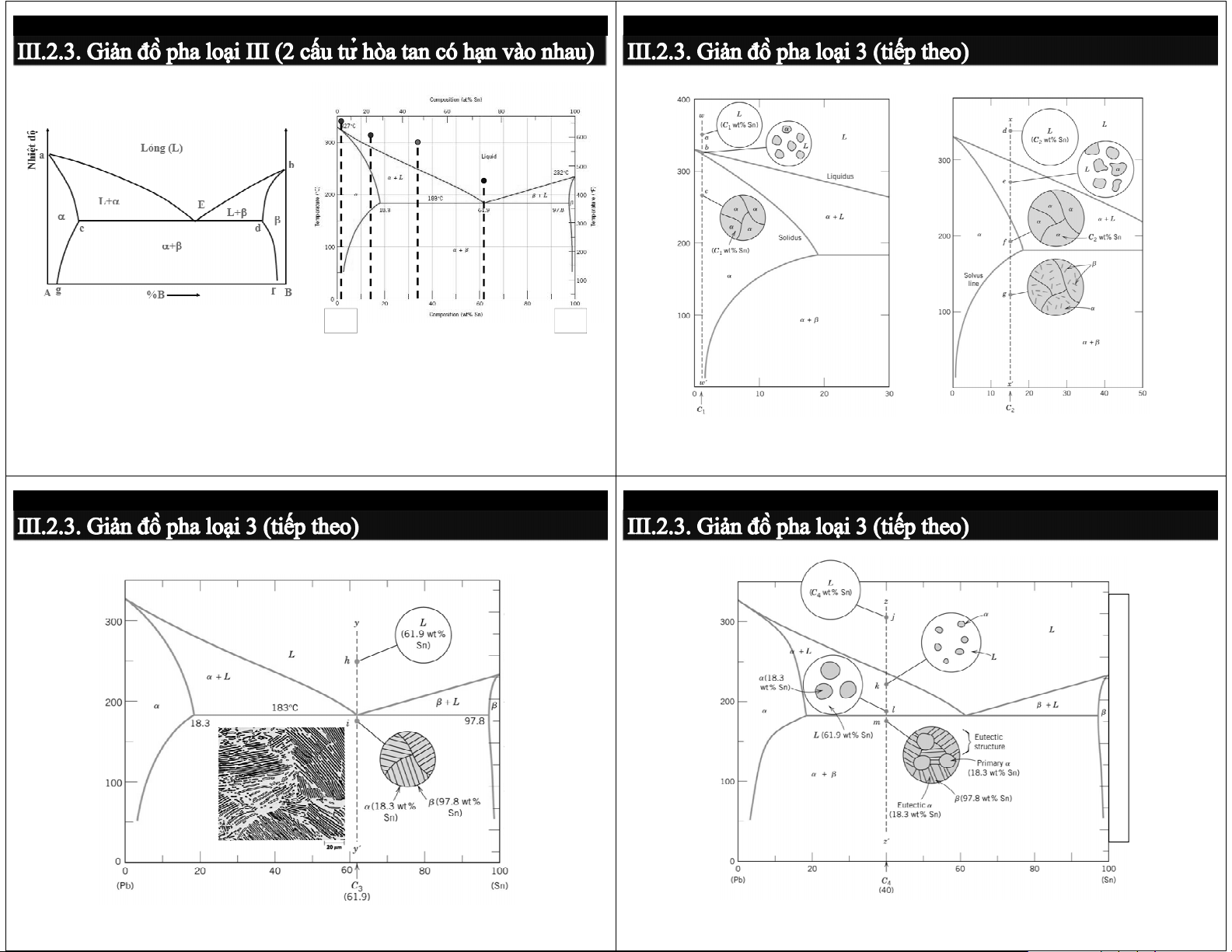
Ví dụ: Hệ Pb-Sb, Cd-Bi ộ
- Các pha tồn tại: 1 pha hay 2 pha - Thành phần pha: hiệtđ b To N Lỏng (L)
• Vùng 1 pha → % pha = % HK đã chọn a
• Vùng 2 pha → quy tắc cánh tay đòn Cα C C o β L+B A+L E M M X C − C %α α α β β α = = = = o = ×100 % M + M X + X C − C c d α β X α β β α α M + M ) α α B X A+(A+B) (A+B)+B β + (A C − C % β o α = ×100 % = 1 ( − %α ) M . X = M . X C − C A F %B B Bi Cd α α β β β α Thành phần - Các chuyển biến pha Bi Cd
a, b → nhiệt độ chảy của A và B
- Nhiệt độ chảy, nhiệt độ rèn, nhiệt độ nhiệt luyện, nhiệt độ hàn… (Bi+Cd) aEb → đường lỏng
- Suy đoán tính chất (P) của hợp kim: P = Σ %pha . P hk pha cEd → đường đặc
- Dự đoán tổ chức tạo thành ở trạng thái không cân bằng
E → điểm cùng tinh: L → (R1 + R2)
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C Dạng tổng quát Ví dụ: Au-Ag, Cu-Ni
Với điều kiện nguội vô cùng ộ
chậm, quá trình kết tinh của Lỏng (L) m b Cu-35%Ni hiệtđ
hợp kim được mô tả: N L+α a → 100% L (35%Ni) a n
b → bắt đầu tiết pha rắn α Rắn (α) c → tồ t n ồ tạ t i 2 pha 2 : : x % % L
(32%Ni) và y% α (43%Ni) d → hết pha lỏng A B Thành phần Cu Ni e → 100% α (35%Ni)
a, b → nhiệt độ chảy của A và B
Bài toán: mô tả quá trình kết amb → đường lỏng
tinh của hợp kim Cu-35%Ni Tính x, y = ? Cu Ni anb → đường đặc
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C Dạng tổng quát Ví dụ: Hệ Pb-Sn Hợp kim X1 Hợp kim X2 X1 X2 X3 1 pha X4 1 pha pha 1 Pb Sn
aEb → đg lỏng, acdb → đg đặc
α → dung dịch rắn hoà tan A(B)
β → dung dịch rắn hoà tan B(A)
Bài toán: mô tả quá trình kết tinh Pb Sn Pb Sn
cg và df → đường giới hạn hòa tan
của hợp kim X1, X2, X3, X4
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C Hợp kim X4 Hợp kim X3
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
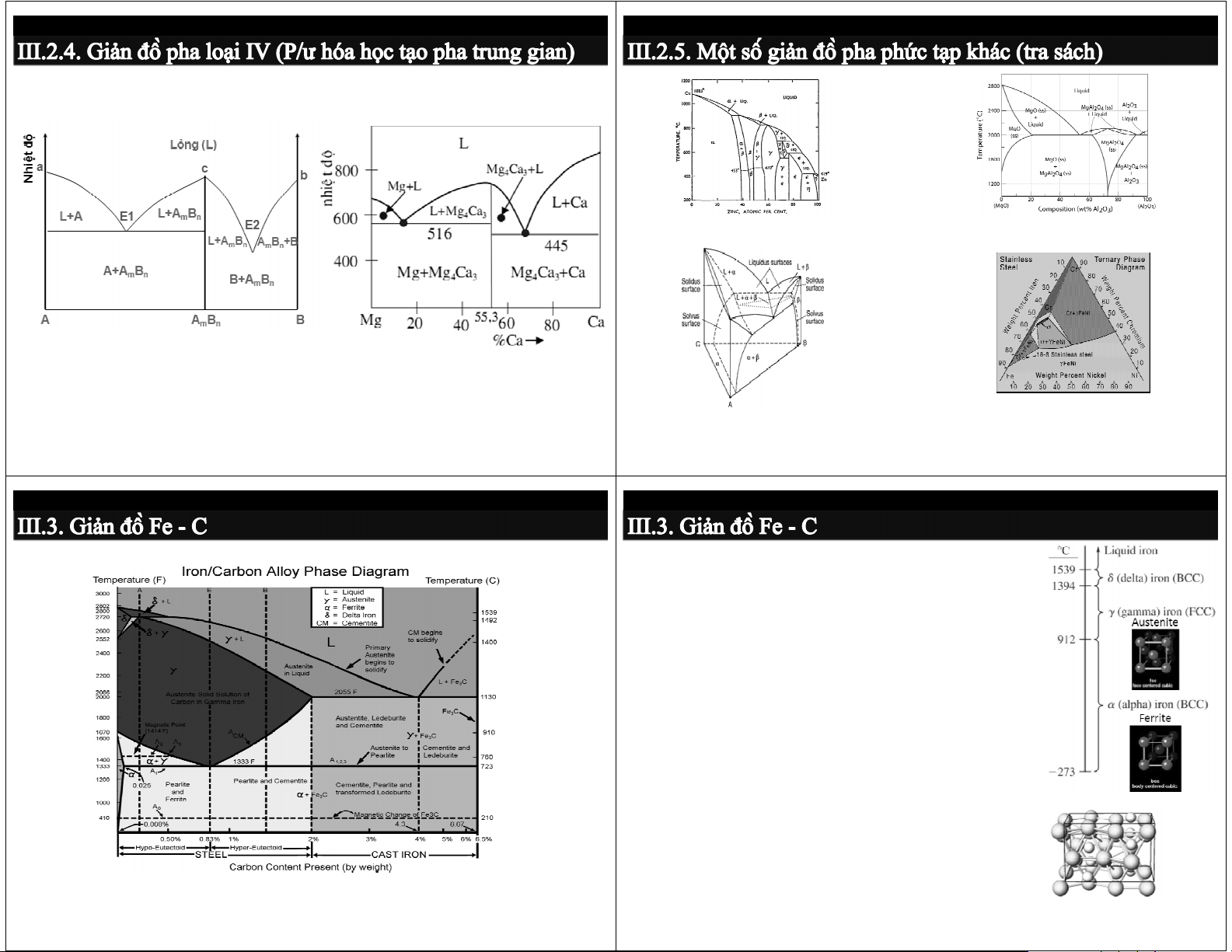
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C Dạng tổng quát Ví dụ: Hệ Mg-Ca
Giản đồ hệ Cu-Zn (Brass-đồng thau)
Giản đồ pha hệ gốm MgO-Al O 2 3
Có dạng ghép của 2 giản đồ loại I: Mg+Ca → Mg A-A B và A B -B 4Ca3 m n m n
Giản đồ hệ 3 cấu tử (dạng không gian)
Giản đồ hệ 3 cấu tử (ở To xác định)
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
3.3.1. Tương tác giữa Fe và C
a. Sự hoà tan của C vào Fe: dạng dung dịch rắn
xen kẽ (do r = 0.077 nm << r = 0.1241 nm) C Fe - Fe : α A2, r
= 0.0364 nm → hoà tan rất ít (0,02%C) lh - Fe : γ
A1, r = 0.052 nm → hoà tan nhiều (2,14%C) lh - Fe F : : A 2, r = = 0 . 0 0364 nm nm → hoà ta t n í n t í (0 ( , 0 1% 1 C % ) δ lh Fe (C), Fe (C), Fe (C) α γ δ
b.Tương tác hoá học giữa Fe và C: tạo cacbit Fe:
Fe3C (Xementit, với 6,67%C) Fe + C → Fe3C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
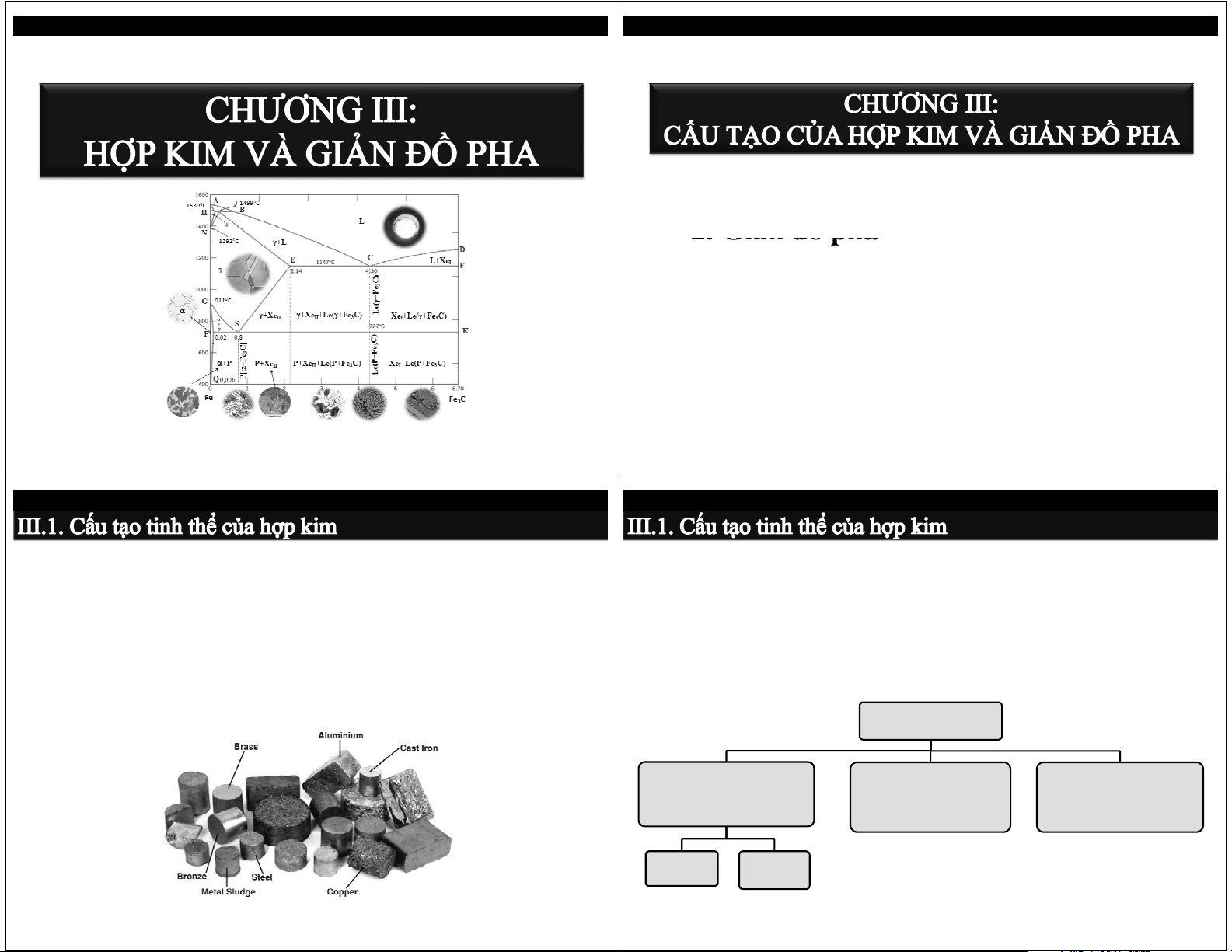
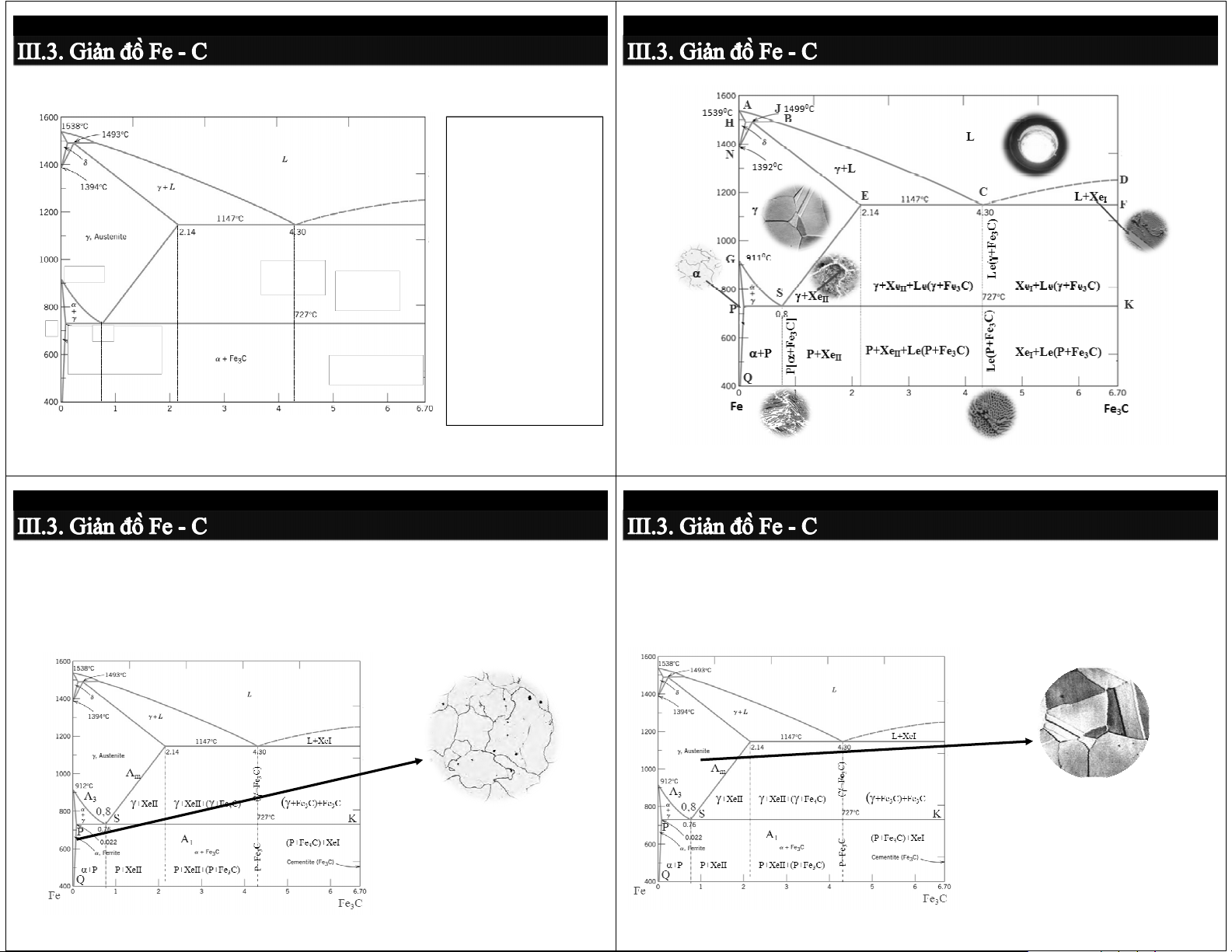
3.3.2. Giản đồ pha Fe-Fe
3.3.2. Giản đồ pha Fe-Fe3C 3C ABCD: đường lỏng A H J B AHJECF: đường đặc ES: giới hạn hòa tan C D trong Feγ E C L+Xe F I PQ: giới hạn hòa tan C trong Fe ) α A C m e 3 911 oC F Chuyển biến cùng tinh: G A γ+ 3 γ ( (11470 C, %C > 2,14) +Xe γ+Xe +(γ+Fe C) (γ+Fe C)+Fe C II II 3 3 3 Đườ S A ng cùng tinh ECD 1 K α L C) 4,3 ( γ + Fe3 P 0.8 ) ] C C e 3 Chuyển biến cùng tích: e 3 F F + (7270 C, %C > 0,022) α+P + P+Xe P+Xe +(P+Fe C) (P+Fe C)+Xe II II 3 (P 3 I [α đường cùng tích PSK Q Fe γ C] Fe 0,8 [α + Fe3 3C (100%) (100%)
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
3.3.3. Các tổ chức một pha trên GĐP Fe-Fe3C
3.3.3. Các tổ chức một pha trên GĐP Fe-Fe3C
A. Ferít (F, α, Fe ):
B. Austenit (A, γ, Fe (C)): α
Dung dịch rắn hoà tan của C trong Feα (giới γ
Dung dịch rắn hoà tan của C trong Feγ
hạn hoà tan 0,02%C tại 7270C). Chiếm tỷ lệ lớn trong thép C.
(giới hạn hoà tan 2,14%C tại 11470C). Có vai trò lớn trong biến
Dẻo, mềm, kém bền. BCC – A2
dạng nóng và nhiệt luyện. Dẻo, mềm ở nhiệt độ cao. FCC – A1 Tổ chức tế vi: Tổ chức tế vi:
Hạt sáng, các đường song tinh Hạt sáng, đa cạnh
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
3.3.3. Các tổ chức một pha trên GĐP Fe-Fe3C
3.3.3. Các tổ chức 2 pha trên GĐP Fe-Fe3C
C. Xêmentit (Xe, Fe3C ): Cứng và giòn D. Peclit (P, [Fe +Fe α
3C ]): hỗn hợp cùng tích của 88%F và 12%Xe
-XeI: sinh ra từ Lỏng (%C>4,3, To >
được sinh ra từ Austenit tại 727 oC và 0,76 %C.
1147oC). Dạng thẳng, thô to trong tổ
Có 2 loại Peclit: P tấm dạng vân(bền, cứng) và P hạt (mềm, dẻo) chức
- XeII: sinh ra từ Feγ do giảm nồng Peclit dạng tấm:
độ C trong γ (0,8<%C<2,14, To >
tối mỏng là Xe, sáng dày là Ferit
727oC). Có thể tạo lưới bao quanh
biên hạt γ giảm dẻo dai của hợp kim
- XeIII: sinh ra từ Feα do giảm nồng độ C trong α, tỷ lệ
nhỏ → khó phát hiện trong tổ chức Peclit dạng hạt:
- Xe cùng tích: tạo thành từ chuyển biến cùng tích hạt Xe trong nền Ferit
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
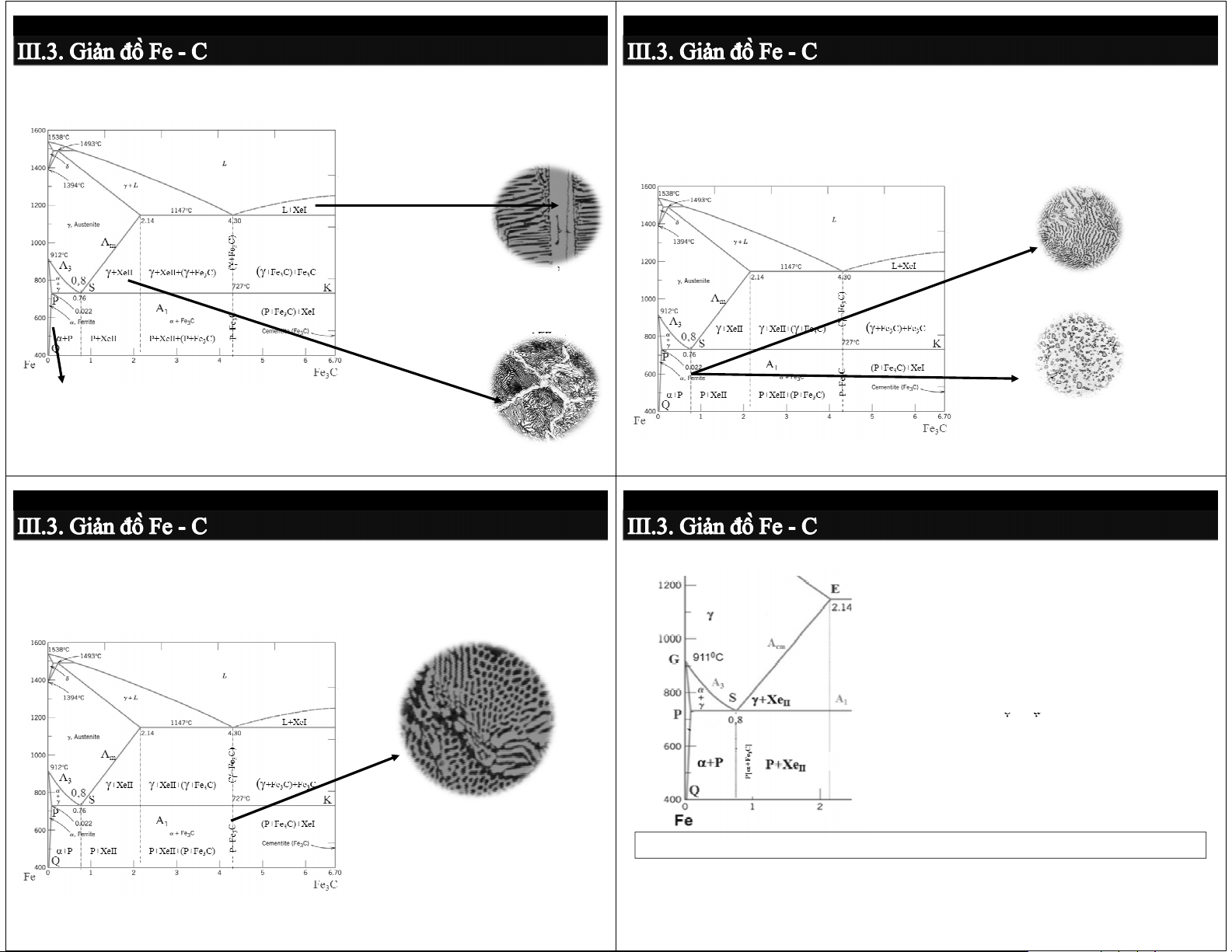
3.3.3. Các tổ chức 2 pha trên GĐP Fe-Fe
Các điểm tới hạn của thép 3C
E. Lêđêburit (Le, (γ+Xe), (P+Xe)): hỗn hợp cùng tinh của
Các điểm tới hạn - tương ứng
Austenit và Xe tạo thành từ pha lỏng tại 4,43%C và 11470C
với các chuyển biến pha trong
thép, kí hiệu bằng chữ A với chỉ
số 0, 1, 2, 3, 4, và cm.
- A1 (PSK - 727oC): γ ↔ P [α+Xe] có c t rong m ọ m i loại ạ t hép é .
- A3 (GS - 911 ÷ 727oC): γ ↔ γ + α
chỉ có trong thép trước cùng tích.
- Acm (ES - 1147 ÷ 727oC): γ ↔ γ + XeII
chỉ có trong thép sau cùng tích.
Dạng da báo: Peclit tấm (các
hạt tối nhỏ) trên nền Xe (sáng)
A1 = 727oC; A3 = 727 + 230.(0,8-x) oC; Acm = 727 + 313.(y – 0,8) oC; x,y là %C
Nung nóng thêm chữ “c”, Làm nguội thêm chữ “r” Ac1 > A1 > Ar1;
Ac3 > A3 > Ar3; Accm > Acm > Arcm
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
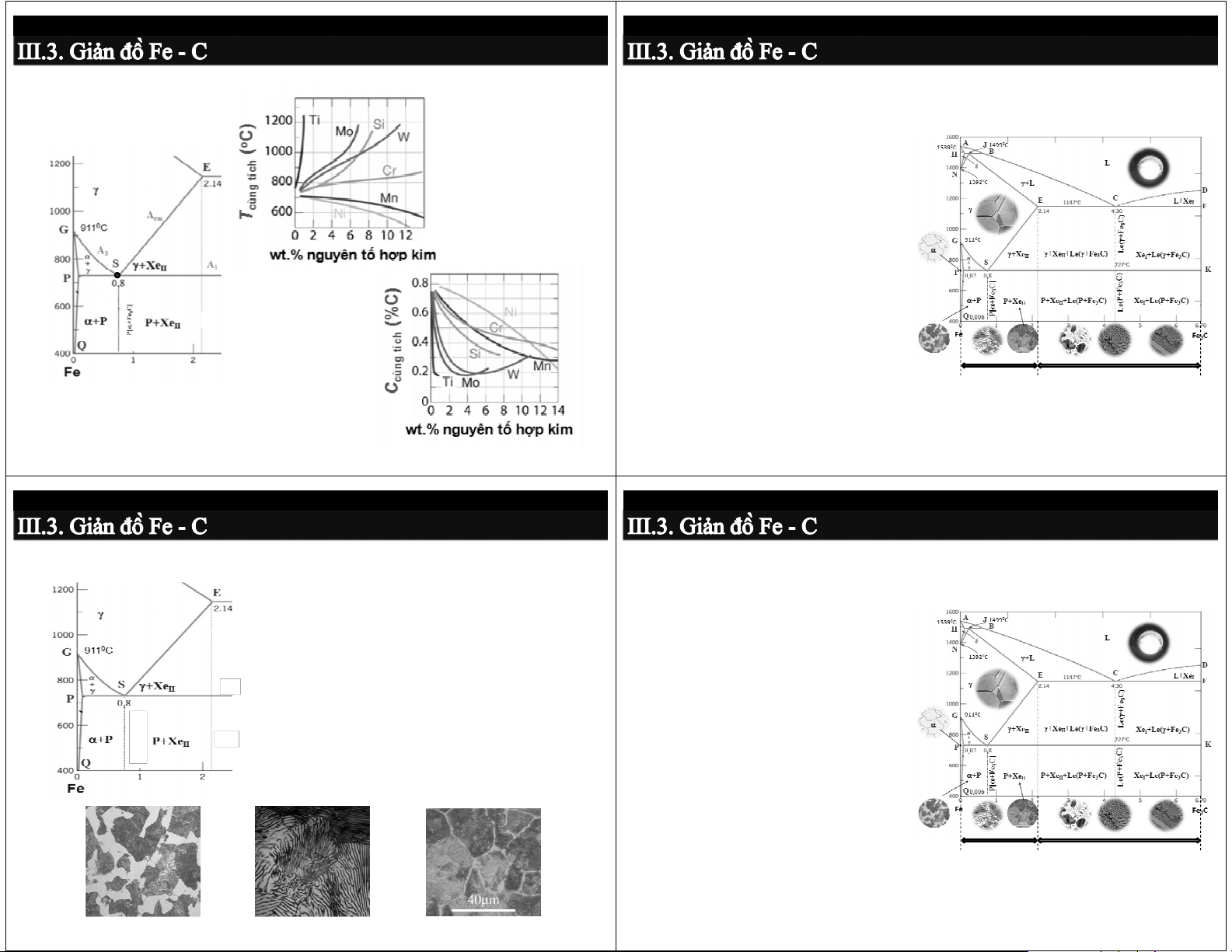
Ảnh hưởng của nguyên tố hợp kim đến điểm cùng tích (S)
3.3.4. Phân loại gang và thép
Thép: hợp kim Fe-C (%C < 2,14) →(trước điểm E) Đặc điểm:
- Khi nung nóng đạt tổ chức một
pha duy nhất γ → có độ dẻo cao,
dễ biến dạng → cung cấp dưới dạng dạ bán thà t nh hà phẩ h m
- Nhiệt độ chảy cao → tính đúc kém Phân loại:
- Thép trước cùng tích - Thép cùng tích Thép Gang - Thép sau cùng tích
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
3.3.4. Phân loại gang và thép
3.3.4. Phân loại gang và thép
Thép: theo GĐP được chia làm 3 loại:
Gang: hợp kim Fe-C (%C > 2,14) →(sau điểm E)
a) Thép trước cùng tích (%C<0,8): Đặc điểm: tổ chức F(sáng)+ P
- Khi nung nóng không đạt tổ
b) Thép cùng tích (%C=0,8%):
chức một pha duy nhất γ →
tổ chức 100%P [F+Xe]
không thể biến dạng nguội, nóng ẻ ủ ] (t ( í t nh í dẻo c a gang ké ng m) m C c) Thé T p sau cùng tí t c í h (% ( C % >0 > ,8 , %) % : ) : e 3 F + [α tổ chức P + Xe
- To chảy thấp và có khả năng điền P II
đầy khuôn tốt → tính đúc cao →
chỉ cung cấp dưới dạng vật đúc Phân loại gang: - Gang trước cùng tinh Thép Gang - Gang cùng tinh - Gang sau cùng tinh a b c
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
III.1. Cấu tạo của hợp kim III.2. Giản đồ pha III.3. Giản đồ Fe-C
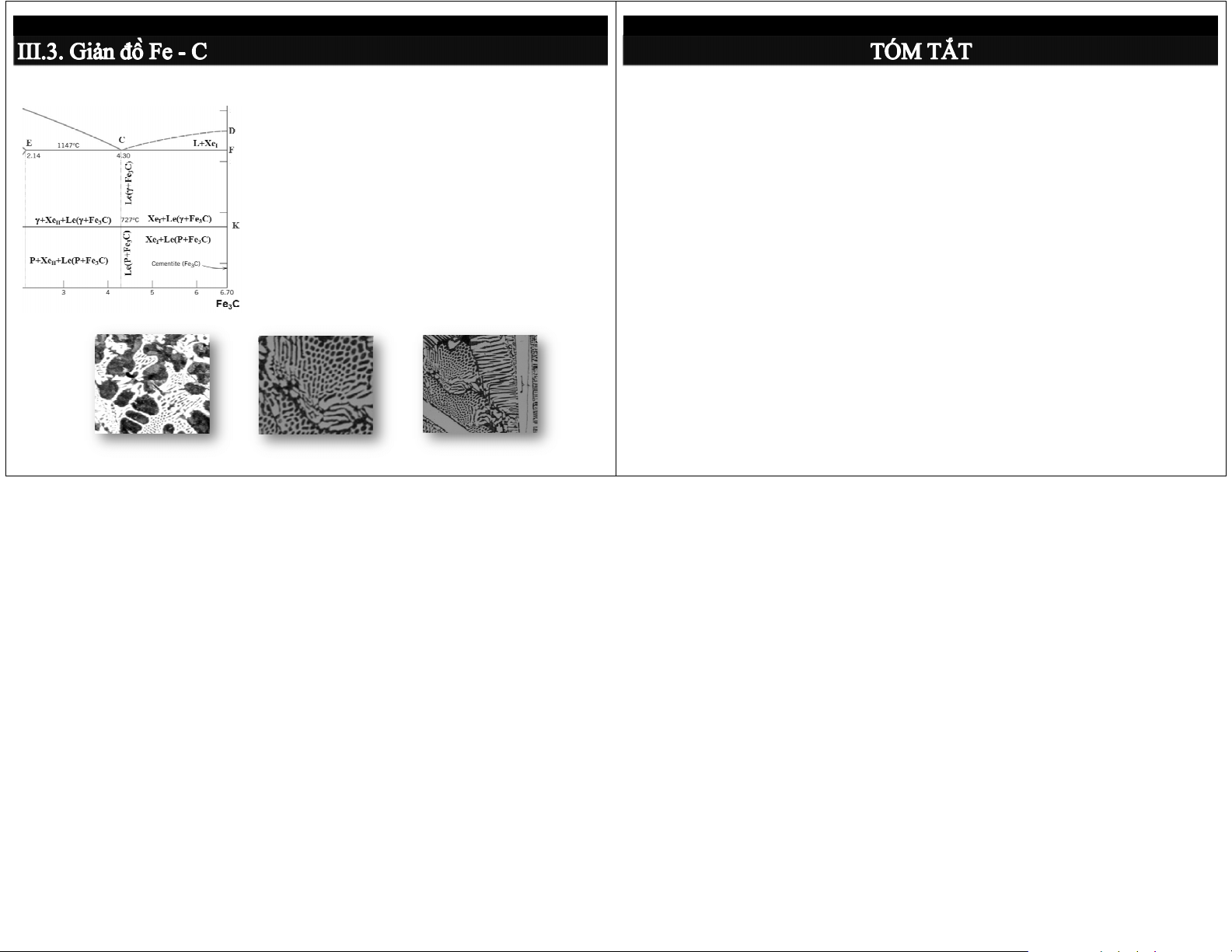
3.3.4. Phân loại gang và thép
Gang: tương ứng với GĐP là gang trắng,
Phân biệt dung dịch rắn (thay thế, xen kẽ) và các gồm 3 loại:
pha trung gian: về đk hình thành và sự thay đổi cấu trúc và t/c
d) Gang trắng trước cùng tinh (%C<4,3): tổ chức P + Xe
Ứng dụng quy tắc pha: II + Le
e) Gang trắng cùng tinh (%C=4,3):
Phân biệt giản đồ pha loại I, II, III, IV: quá trình kết tổ t chứ h c ứ 100% Le(P ( + P X + e)
tinh ở các thành phần khác nhau
f) Gang trắng sau cùng tinh (%C>4,3):
Nắm chắc giản đồ pha Fe – C (Fe – Fe tổ chức Xe 3C): I + Le
Thành phần, nhiệt độ, tổ chức tế vi các pha: Ferrit, Austenit, Xe, P, Le
Phân biệt thép và gang
Tính các nhiệt độ A , A , A (tự xây dựng công thức tổng quát) 1 3 cm
Tính % các pha trong tổ chức (ở thành phần, nhiệt độ khác nhau) d e f



