




Preview text:
4/7/2021
TRƯỜNG ĐẠI HỌC BÁCH KHOA HÀ NỘI NỘI DUNG TRÌNH BÀY VIỆN KỸ THUẬT HÓA HỌC Giới thiệu chung CÁC NGUYÊN TỐ NHÓM IV A Cacbon Silic Gecmani, Thiếc, Chì 2 1 2 GIỚI THIỆU CHUNG GIỚI THIỆU CHUNG 3 4 3 4 1 4/7/2021 GIỚI THIỆU CHUNG GIỚI THIỆU CHUNG 5 6 5 6 GIỚI THIỆU CHUNG GIỚI THIỆU CHUNG Cacbon Silic Gemani Thiếc Chì Tính phi kim giảm dần Tính kim loại tăng dần
Cacbon có tính chất đặc biệt là khả năng tạo mạch đồng
nhất …-C-C-C-… rất lớn. 7 8 7 8 2 4/7/2021 GIỚI THIỆU CHUNG CACBON TÍNH CHẤT VẬT LÝ 2 2 4 4 CF SiF GeF SnF PbS 4 6 6 8 8
Đơn chất cũng như hợp chất cacbon trong thiên nhiên là 3 3 2 3 2 2 sp sp d sp d f
hỗn hợp của hai đồng vị bền 12C (98,89%) và 13C (1,11%).
12C là cơ sở của thước đo nguyên tử khối.
Đồng vị phóng xạ 14C với chu kỳ bán
rã 5730 năm là đối tượng cần thiết cho công việc khảo cổ. 10 9 10
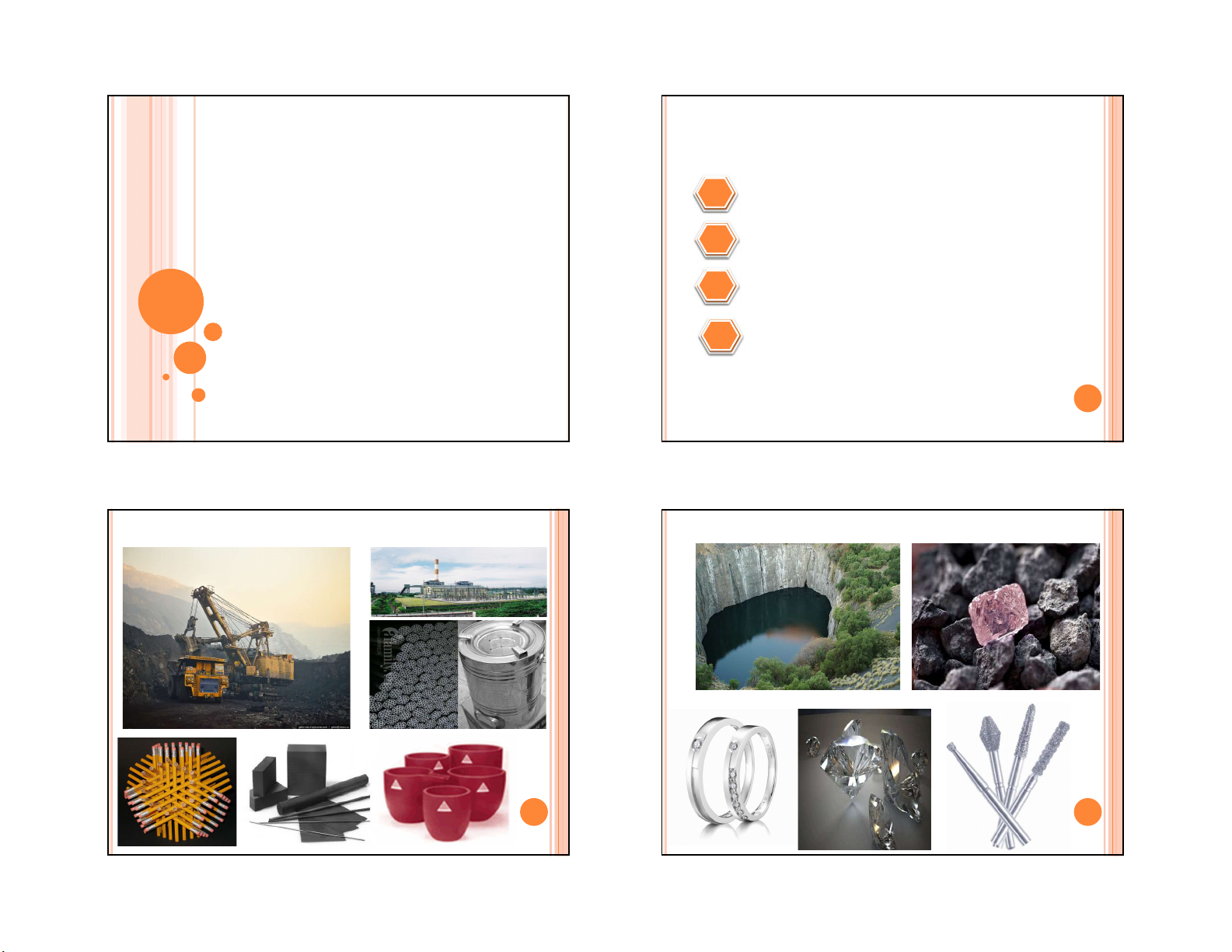
Các dạng thù hình của cacbon Kim cương và graphit d = 1,544 Å C-C d = 1,415 Å C-C CCC = 109°28’ CCC = 120° 11 12 Lai hóa sp2 Lai hóa sp3 11 12 3 4/7/2021
Cân bằng giữa kim cương và graphit Fuleren
Fuleren gồm các phân tử C 1500°C n có dạng Vắng mặt oxy
lồng với n = 44, 50, 58, 60, 70,…, 350. không khí 50000 – 60000 atm
Có thể đứa một hay một số nguyên tử kim 1200°C – 1500°C
loại vào trong lồng hình cầu Xúc tác, dung môi ∆H0 = -1,9 kJ.mol-1
Có ứng dụng đặc biệt nhất là C 298 60 có ∆S0 = 3,3 J.K-1.mol-1 dạng hình 20 mặt. 298
Những sản phẩm của C 3- với kim ∆G0 = -2,9 kJ.mol-1 60 298 13
loại kiềm là các chất siêu dẫn. 14 13 14 Graphene (2004) 15 16 4 4/7/2021 17 18 TÍNH CHẤT HÓA HỌC CACBON OXIT
Ở nhiệt độ thường: cacbon trơ về phương diện hóa học. Theo MO – LCAO: (KK) 2 2 2 2
s s*2x =y z , bậc liên kết Ở nhiệt độ cao: giữa C và O là ba.
Cgr + O2(k) CO2(k); ∆H0298 = -393,51 kJ
Cgr + O2(k) CO(k); ∆H0298 = -110,52 kJ Theo phương pháp VB: C + H2O CO + H2 CaO + 3C CaC2 + CO 19 20 19 20 5 4/7/2021 TÍNH CHẤT VẬT LÝ TÍNH CHẤT HÓA HỌC
Cacbon oxit là chất khí không màu, không mùi, khó hóa
Ở nhiệt độ thường CO ít hoạt động, các phản ứng của nó
lỏng và hóa rắn, tan ít trong nước, rất bền với nhiệt.
thưởng xảy ra ở nhiệt độ cao.
CO rất độc dễ dàng kết 1. Phản ứng với oxi: hợp với hemoglobin của
CO(k) + O2(k) CO2(k); ∆H0298 = -283 kJ
máu tạo thành phức chất
2. Phản ứng với clo tạo photgen: CO + Cl
bền hơn so với phức chất 2 COCl2
của oxi với nó, ngăn cản
3. Phản ứng với hidro tạo metanol CO + 2H nhiệm vụ chuyển oxi đi 2 CH3OH
nuôi cơ thể của hồng cầu
4. Kết hợp với nhiều kim loại tạo thành cacbonyl kim loại 21 4CO + Ni Ni(CO) 22 4 21 22 ĐIỀU CHẾ Trong lò cao: Khí hơi nước C + O2 CO2 C+H CO 2O CO+H2 2 + C 2CO CO Đốt cháy không hoàn Luyện cốc từ than đá toàn antraxit tạo khí
tạo hỗn hợp khí than đá lò ga Trong phòng thí nghiệm: 24
HCOOH + H2SO4 ⟶ CO + H2SO4.H2O 23 24 6 4/7/2021 Cacbon đioxit Tính chất hóa học
Ở điều kiện thường, phân tử CO2 rất bền, dùng để chữa cháy.
Ở nhiệt độ cao nó bị phân li môt phần: 2CO2 2CO + O2
Tính oxi hóa yếu và phản ứng khử xảy ra khó.
Trong điều kiện thích hợp, CO CO
2 oxi hóa được cacbon, hiđro,
2 là chất khí không màu, có một số kim loại mạnh:
mùi và vị chua, nặng hơn CO2 + 2Mg C + 2MgO
không khí, dễ hóa lỏng và hóa
CO2 là oxit axit, tan trong nước tồn tại các cân bằng sau: CO - 2H++CO 2-
rắn, ít tan trong nước, không 2(k) + aq CO2.aq H2CO3 H+ + HCO3 3
độc nhưng làm ngạt thở nếu
Phản ứng quan trọng nhất của CO2 liên quan đến sự đồng hóa clorophin của cây xanh: nồng độ lớn. 25 26 CO2 + H2O gluxit + O2 25 26 Điều chế CO Axit cacbonic 2 Đốt cháy các Axit cacbonic H Chuyển hóa CO tác dụng
2CO3 là axit không bền, chỉ tồn tại trong sản phẩm khí metan với hơi nước chứa cacbon
dung dịch nước, dễ phân hủy ra CO2 và H2O H - 2CO3 H+ + HCO3 Phân hủy - 2- Lên men rượu HCO3 H+ + CO3 CO2 nhiệt đá vôi
Trong phòng thí nghiệm, dd HCl tác dụng với đá vôi 27 28 27 28 7 4/7/2021 Axit cacbonic SILIC Muối cacbonat
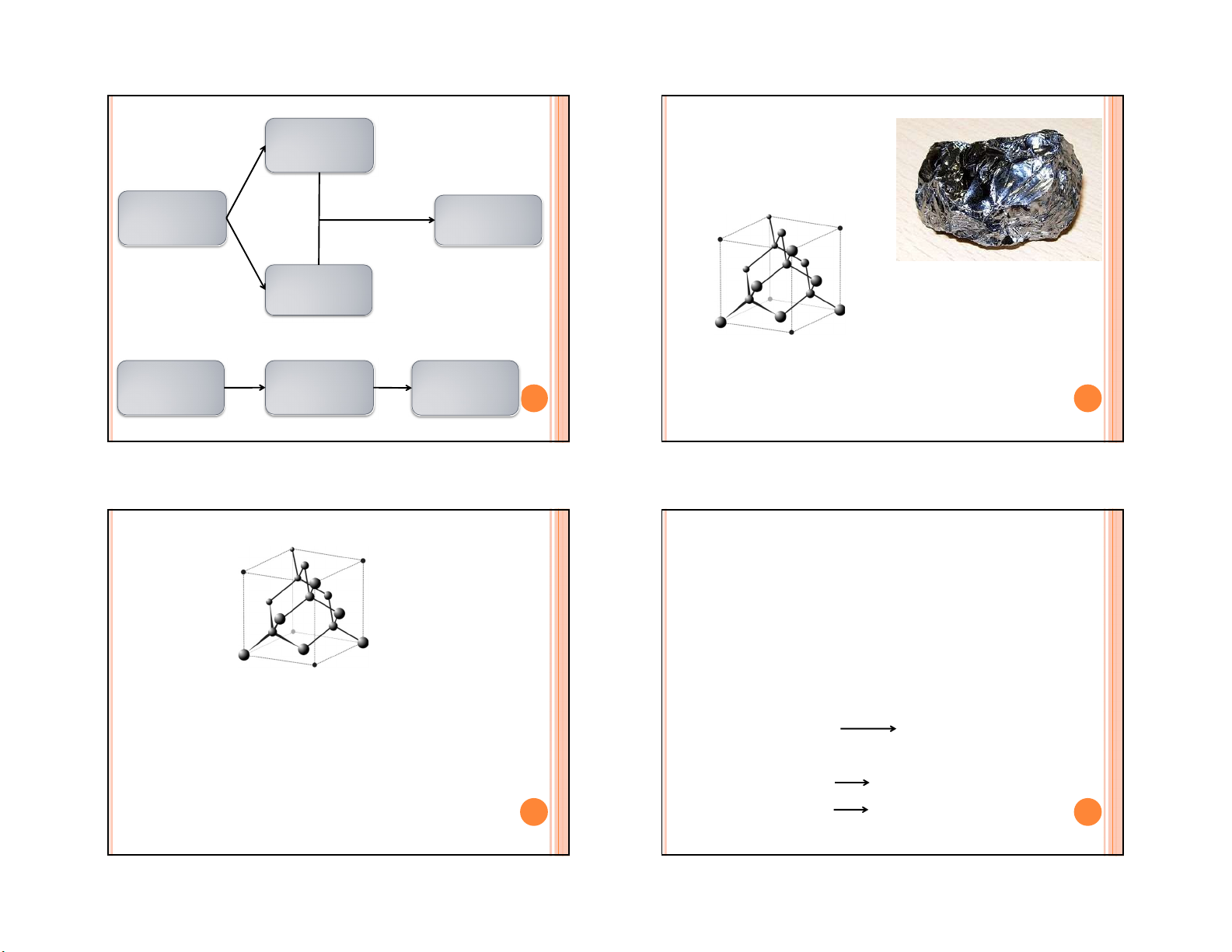
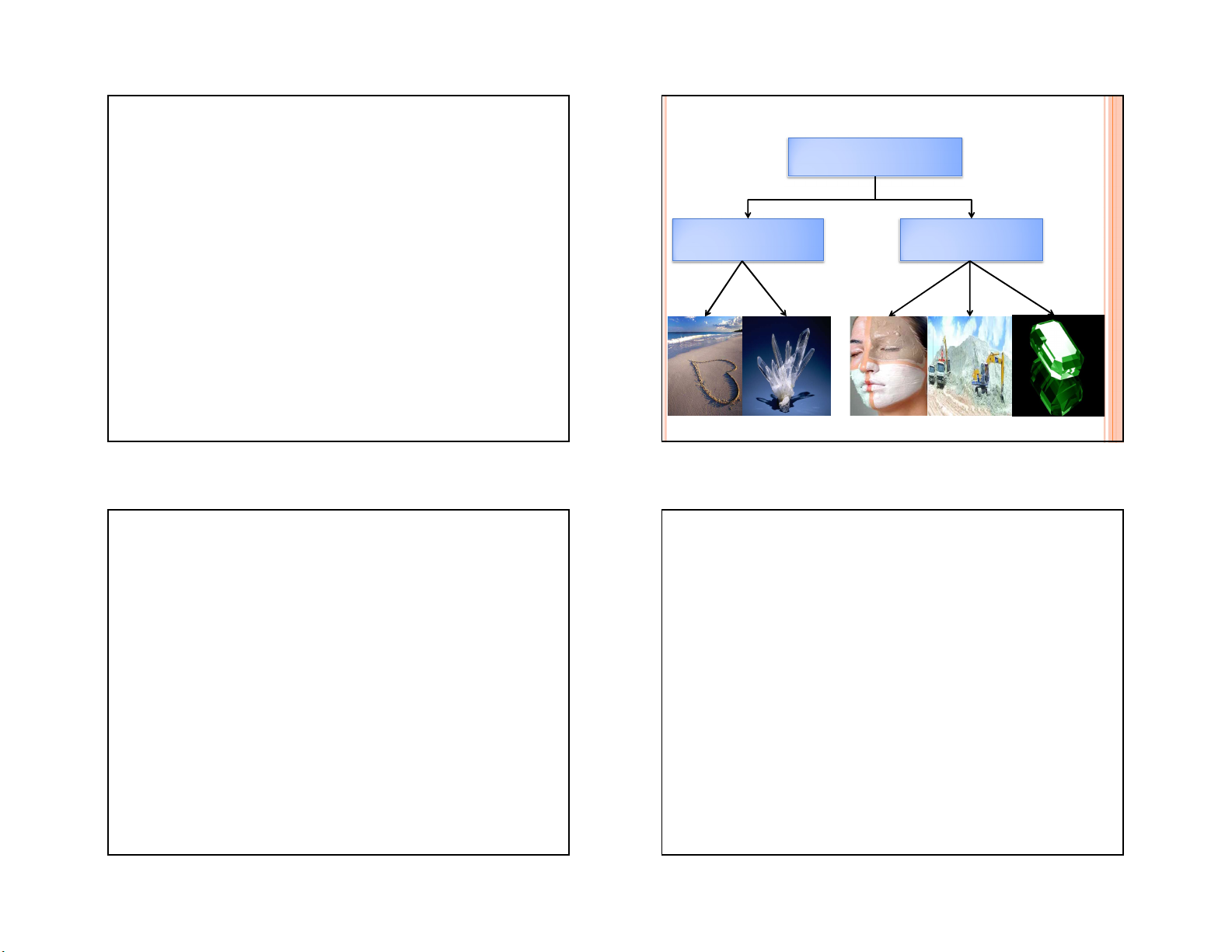
Silic đơn chất có cấu trúc Axit
tinh thể giống kim cương. Axit cacbonic CO2 Muối hiđrocacbonat
Silic tinh thể dẫn nhiệt, có tính bán dẫn, độ dẫn Muối t0 t0 Muối cacbonat
điện tăng theo nhiệt độ thể hiện đặc tính của chất Oxit + CO2 hiđrocacbonat 29 30 bán dẫn. 29 30 SILIC
Tính chất hóa học của Silic
Silic tinh thể khá trơ về phương diện hóa học:
- Tác dụng với flo ở nhiệt độ thường.
- Tác dụng với clo và oxi ở 400 – 6000C.
- Tác dụng với nitơ ở 10000C. Kim cương Silic
Silic hòa tan trong hỗn hợp HF và HNO3 3Si+4HNO d = 1,544 Å d 3+18HF 3H2[SiF6]+4NO+8H2O C-C Si-Si = 2,352 Å t t nc= 4100 ± 200K nc= 1420oC Si(bột) + H2O(h) SiO2 + H2 ở 125000atm Si + H 31 2 SinH2n+2 32 31 32 8 4/7/2021 * Tính oxi hoá: Trạng thái tồn tại
Thể hiện yếu, nó phản ứng với một vài kim loại ở nhiệt độ khá cao: Si + 2Mg Mg2Si Silic đioxit Silicat * Điều chế:
- Trong công nghiệp: Si được điều chế bằng cách
khử SiO2 trong lò điện bằng C SiO2 + 2C Si + 2CO SiO2 + 2Mg 2MgO + Si 34 33 33 34
Hợp chất với số oxi hoá +4 của Si (SiO Chì và thiếc 2) - SiO
Cấu tạo và tính chất lý học:
2 rắn, không tan trong nước, nóng chảy ở
khoảng nhiệt độ 1600oC chuyển thành chất lỏng
- Sn có 3 dạng thù hình: -Sn ⇋ -Sn ⇌ -Sn không màu.
là thiếc xám, là thiếc trắng, ở 13,2oC thiếc trắng
chuyển thành thiếc xám, nhưng tốc độ rất chậm, sự - SiO
chuyển dịch này xảy ra nhanh ở nhiệt độ khoảng
2 không tác dụng với axit trừ axit flohydric HF: SiO
30oC. Nói chung Sn thường có màu trắng bạc 2 + 4HF = SiF4 + 2H2O SiF
- Pb có màu trắng hoặc xanh. 4 + 2HF = H2[SiF6]
- Sn và Pb là những kim loại mềm và dễ nóng chảy.
- SiO2 tan trong kiềm hoặc cacbonat kim loại kiềm
nóng chảy tạo thành silicat:
SiO2 + 2NaOH (nóng chảy) = Na2SiO3 + H2O SiO 35 2 + Na2CO3 = Na2SiO3 + CO2 36 35 36 9 4/7/2021 Tính chất hoá học - Phản ứng với axit: Vì - Phản ứng với O 𝜀 = −0,136 (𝑉), 𝜀 = 2:
− 0,126 (𝑉) nên về nguyên tắc chúng đẩy được hydro
+ Ở nhiệt độ thường Sn không phản ứng với oxi, còn
ra khỏi axit không có tính oxi hoá như HCl, H2SO4
Pb bị oxi hoá ở lớp bề mặt, tạo một lớp oxit bảo vệ:
loãng. Nhưng thực tế do quá thế của hydro nên Sn và
Pb không tác dụng với các axit này. Pb + O2 = 2PbO
- Dung dịch các axit đặc và nóng dễ hoà tan hơn: + Ở nhiệt độ cao Sn + 2HCl(đặc) = SnCl2 + H2 Sn + O2 = SnO2 Pb + 4HCl(đặc) = H2[PbCl4] + H2 Pb + O2 = 2PbO Sn + H2SO4(đặc) = Sn(SO4)2 + 2SO2 + 4H2O Pb + 3H 37 2SO4(đặc) = Pb(HSO4)2 + SO2 + 2H2O 38 37 38
Hợp chất với số oxi hoá là +4 - Phản ứng với axit HNO Hợp chất với oxi: SnO 3 loãng: 2 và PbO2 3Pb + 8HNO -Tính bền: SnO
3(loãng)=3Pb(NO3)2 + 2NO + 4H2O
2 bền đối với nhiệt, còn PbO2 bị phân huỷ dần khi đun nóng:
Sn + HNO3(loãng) = Sn(NO3)2 + NO + H2O 290-320oC 390-420oC 530-550oC
PbO2 Pb2O3 Pb3O4 PbO - Phản ứng với HNO (n©u xÉm) (vµng ®á) (®á) (vµng) 3 đặc:
Pb khó phản ứng với HNO3 đặc, vì nitrat chì tạo - SnO
thành khó hoà tan trong axit HNO 2 có tính lưỡng tính: 3 đặc SnO2 + 4HCl = SnCl4 + 2H2O
Sn + 4HNO3(đặc)+ (x-2)H2O = SnO2.nH2O + 4NO2 SnCl4 + 2HCl = H2[SnCl6] SnO
- Sn và Pb hoà tan trong dung dịch kiềm nóng:
2 + 2NaOH + 2H2O = Na2[Sn(OH)6]
- PbO2 có tính oxi hoá mạnh thường dùng làm chất oxi hoá,
M + 2NaOH + 2H2O = Na2[M(OH)4] + H2
ví dụ nó oxi hoá được cả chất khử rất yếu như Mn2+ 5PbO - + 2H 39
2 + 2Mn2+ + 4H+ = 5Pb2+ + 2MnO4 2O 40 39 40 10 4/7/2021
Hợp chất với số oxi hoá +2
XO: đều là chất rắn, có màu sắc khác nhau, hầu như
Sn2+ là chất khử mạnh nhưng Pb2+ là chất khử yếu.
không tan trong nước. Oxit PbO bền nhất, có tính
SnCl2 phản ứng mạnh với Cl2 tạo thành SnCl4, còn
lưỡng tính, dễ tan trong axit nitric loãng và hoà tan
PbCl2 không có phản ứng này. Các muối của Sn2+ trong kiềm yếu hơn.
thường được dùng làm chất khử, ví dụ:
X(OH)2 đều là chất rắn, không tan trong nước, có tính lưỡng tính. Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+ Sn(OH) SnCl 2 + 2HCl = SnCl2 + 2H2O 2 + 2HgCl2 = SnCl4 + Hg2Cl2 Pb(OH) SnCl 2 + 2HCl = PbCl2 + 2H2O 2(dư) + Hg2Cl2 = SnCl4 + 2Hg X(OH)2 + 2NaOH = Na2[X(OH)4] 41 42 41 42 Lịch sử bút chì
Cây bút chì cổ nhất thế giới (thế kỉ 17) 43 44 43 44 11 4/7/2021 45 45 12



