











Preview text:
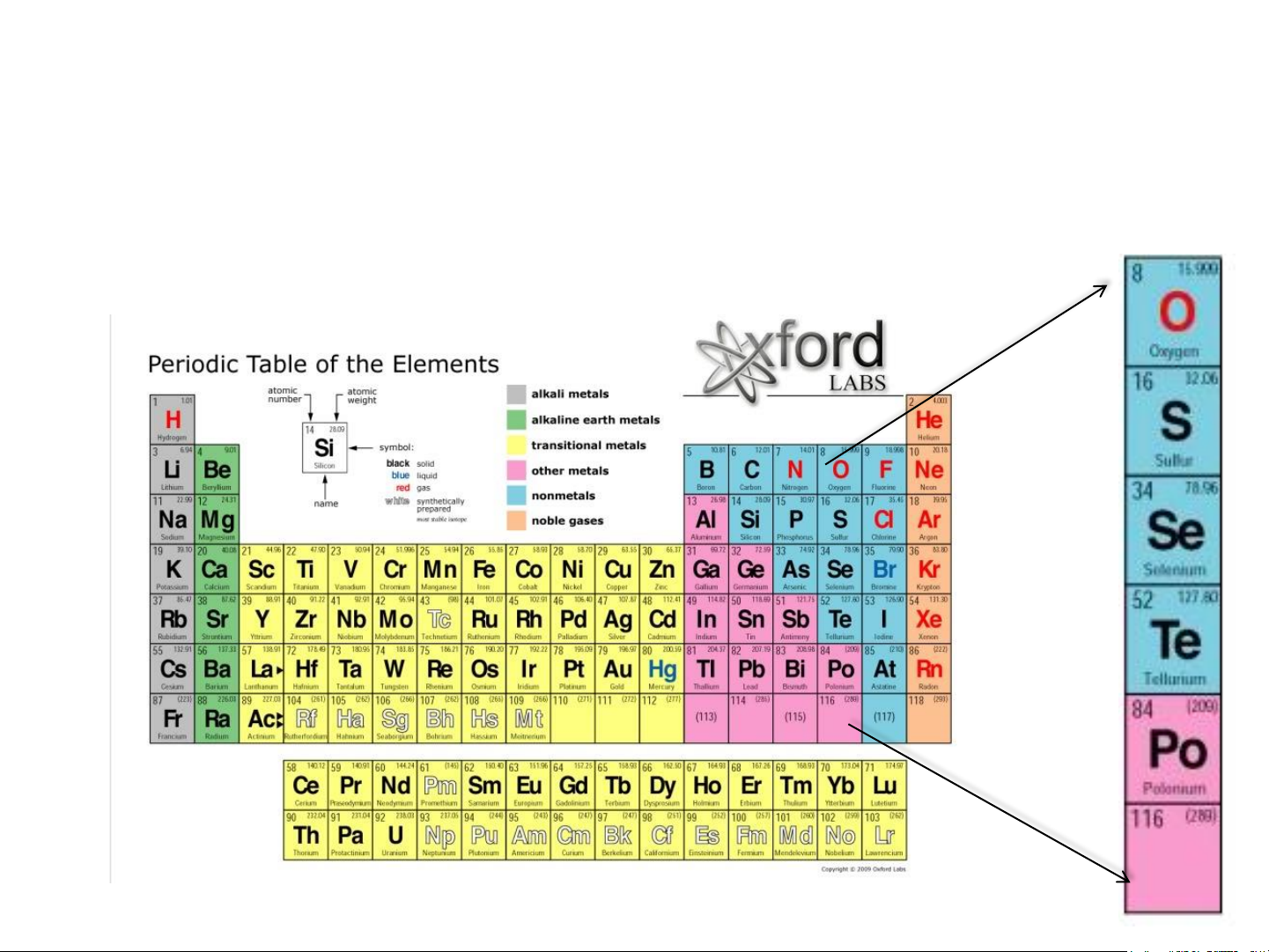
CÁC NGUYÊN TỐ NHÓM VIA
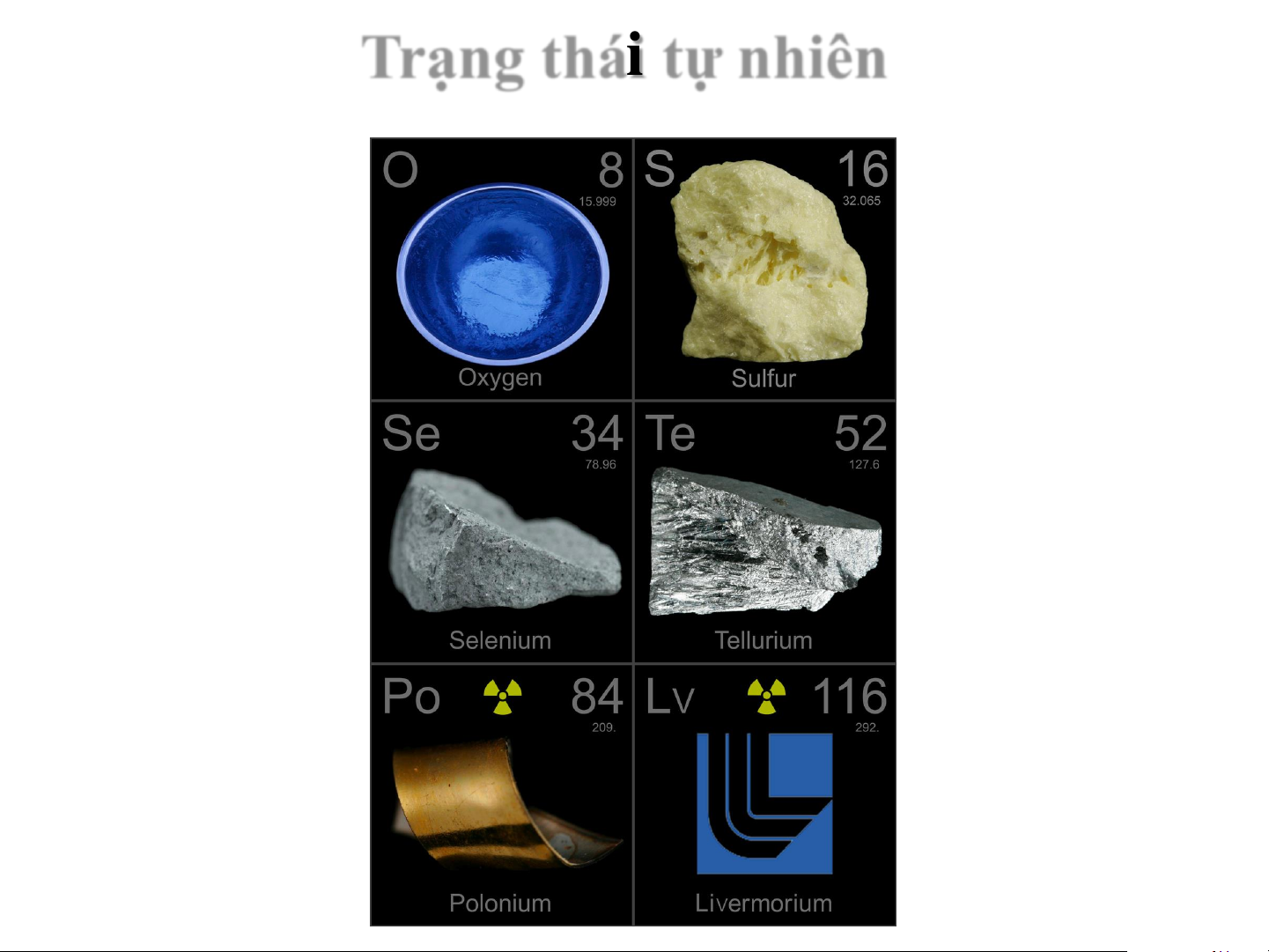
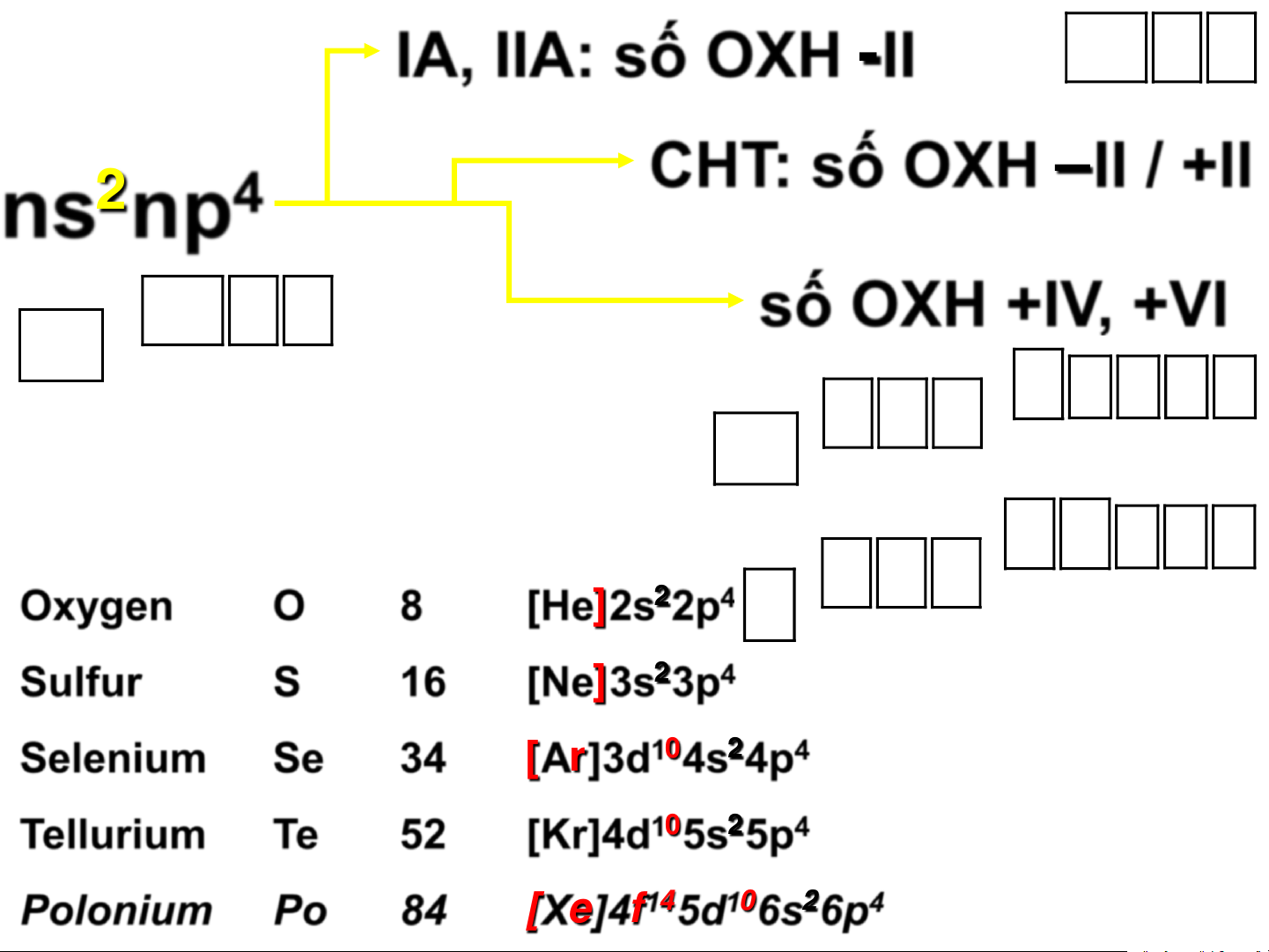
Trạng thái tự nhiên IA, IIA: số OXH -II
CHT: số OXH –II / +II ns2np4 số OXH +IV, +VI Oxygen O 8 [He]2s22p4 Sulfur S 16 [Ne]3s23p4 Selenium Se 34 [Ar]3d104s24p4 Tellurium Te 52 [Kr]4d105s25p4 3 Polonium Po 84
[Xe]4f145d106s26p4 Oxy Tính chất lý học
- Tồn tại dưới dạng phân tử gồm hai nguyên tử O . 2
- Oxi thiên nhiên tồn tại dưới dạng đơn chất và hợp
chất là hỗn hợp của 3 đồng vị: 16O 17O 18O 99,76% 0,04% 0,2% -
Là nguyên tố phổ biến trên trái đất: chiếm 21 %
trong khí quyển, chiếm 47% thành phần của vỏ trái đất…..
- Ở điều kiện thường là chất khí không màu, không mùi, không vị.
- Nhiệt độ sôi rất thấp to = -183oC, nhiệt độ S nóng chảy to = -218,9oC nc
- Khả năng hoà tan trong nước rất kém, ở
20oC 1 lít nước hoà tan khoảng 30ml O2 - Oxy là chất thuận từ.
∂ 2∂ *2∂ 2π 2 = π 2 π *1 = π *1 s s z x y x y Tính chất hoá học -
Độ bội của O là 2, E = 494 KJ.mol-1, bắt đầu 2 lk
phân huỷ thành các nguyên tử tương ứng ở 1400oC: O ⇄ 2O 2
- Oxi rất hoạt động hoá học ở nhiệt độ cao: phản
ứng trực tiếp với nhiều hợp chất và hầu hết các đơn
chất (trừ các halogen, nguyên tố khí hiếm, một số
kim loại quý) tạo thành các oxit, Điều chế oxi
- Trong phòng thí nghiệm: điều chế O bằng phân 2
huỷ các hợp chất giàu oxi, kém bền như KMnO , 4 KClO … 3 250oC 2KMnO → K MnO + MnO + O 4 2 4 2 2 to,MnO2 2KClO → 2KCl + 3O 3 2 to 2KNO → 2KNO + O 3 2 2 - Trong công nghiệp:
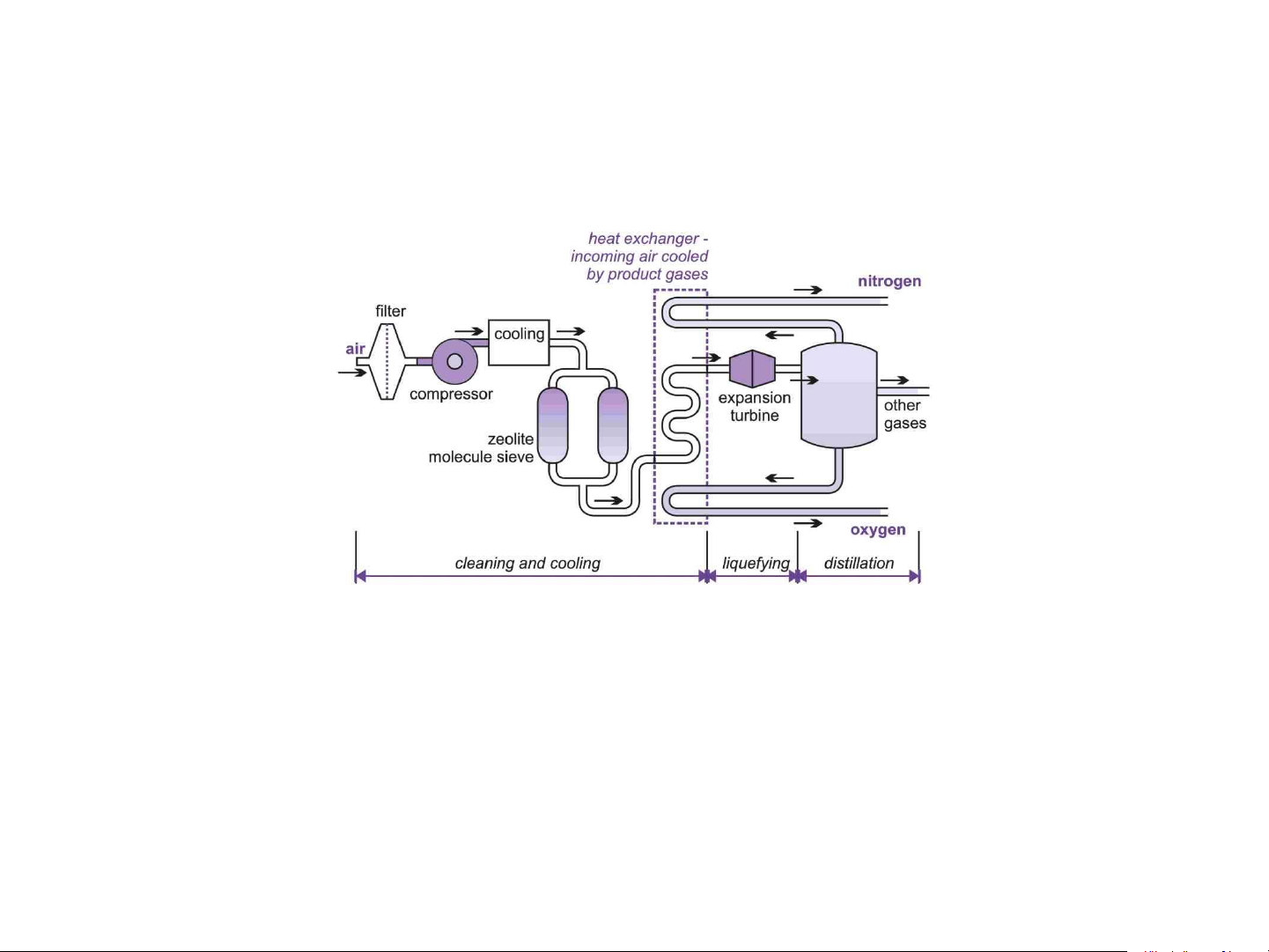
+ Chưng cất phân đoạn không khí lỏng.
+ Điện phân H O trong dung dịch kiềm cũng cho 2
phép thu được O và H tinh khiết, nhưng đây là 2 2 phương pháp đắt tiền. Ứng dụng - Oxi
tham gia vào các phản ứng phân huỷ các
hợp chất hữu cơ (xác các động thực vật thối rữa…).
-Oxi rất quan trọng đối với các quá trình trao đổi
chất của người và động thực vật
-Nhiều phản ứng oxi hoá các hợp chất bằng O đã 2
được sử dụng trong công nghiệp:
+ Phản ứng cháy của axetylen để tạo nhiệt độ cao (đèn xì)
+ Phản ứng oxi hoá SO thành SO để điều chế 2 3 axit sunfuric… Ozon Đặc điểm cấu tạo
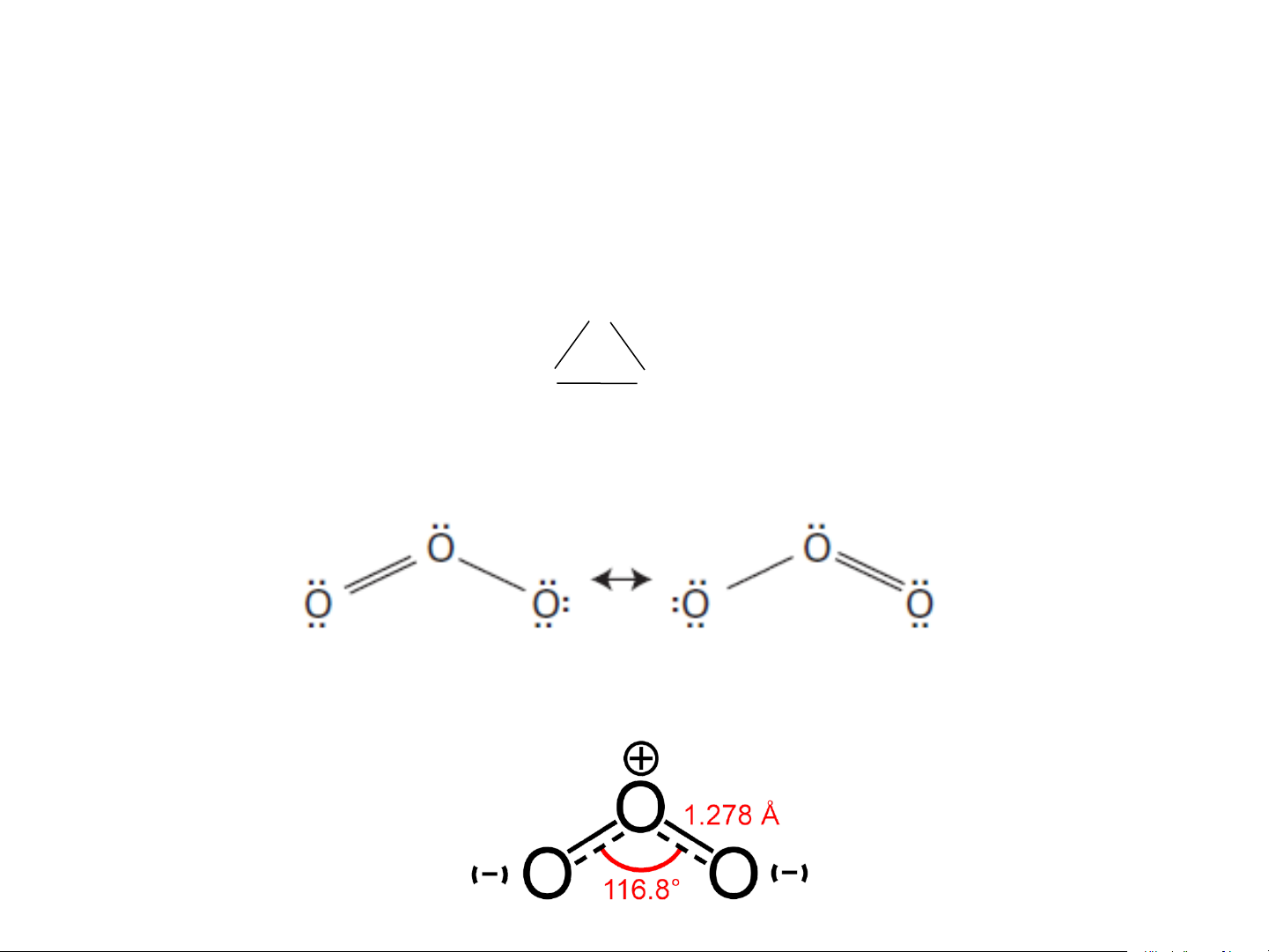
Phân tử ozon trước đây một thời gian dài được coi là có cấu tạo vòng kín: O O O
Phân tử O không có vòng kín mà là phân tử hình góc 3 Tính chất lý học
- Ở điều kiện thường O là khí có màu xanh lam 3
nhạt và có mùi đặc biệt. Phân tử có khối lượng
tương đối lớn, có cực ( = 0,66D). to =-192,7oC và nc
to = - 111,9oC. Khả năng hoà tan trong nước của O s 3
lớn hơn O 15 lần, chất nghịch từ. 2 Tính chất hoá học
- O kém bền hơn so với O và dễ bị phân huỷ: 3 2 O (K) → 3/2O (K) 3 2
- O có tính oxi hoá mạnh hơn nhiều so với O . Ví du: 3 2
O có thể tương tác với Ag và Hg. 3 2Ag + O = Ag O + O 3 2 2
- Cã thÓ oxi ho¸ sunfua thµnh sunfat: PbS + 4O = PbSO + 4O 3 4 2
- O có tính oxi hoá mạnh trong cả môi trường axit và bazơ : 3 O + 2e + 2H+ = O + H O o= 2,07V 3 2 2 O + 2e + H O = O + 2OH- o= 1,24V 3 2 2 O + 4e + 4H+ = 2H O o= 1,229V 2 2 O + 2H O + 4e = 4OH- o= 0,401V 2 2
- O là chất oxi hoá mạnh, khả năng diệt khuẩn rất tốt. Nó 3
được sử dụng để làm sạch nước uống, nước sinh hoạt, nước
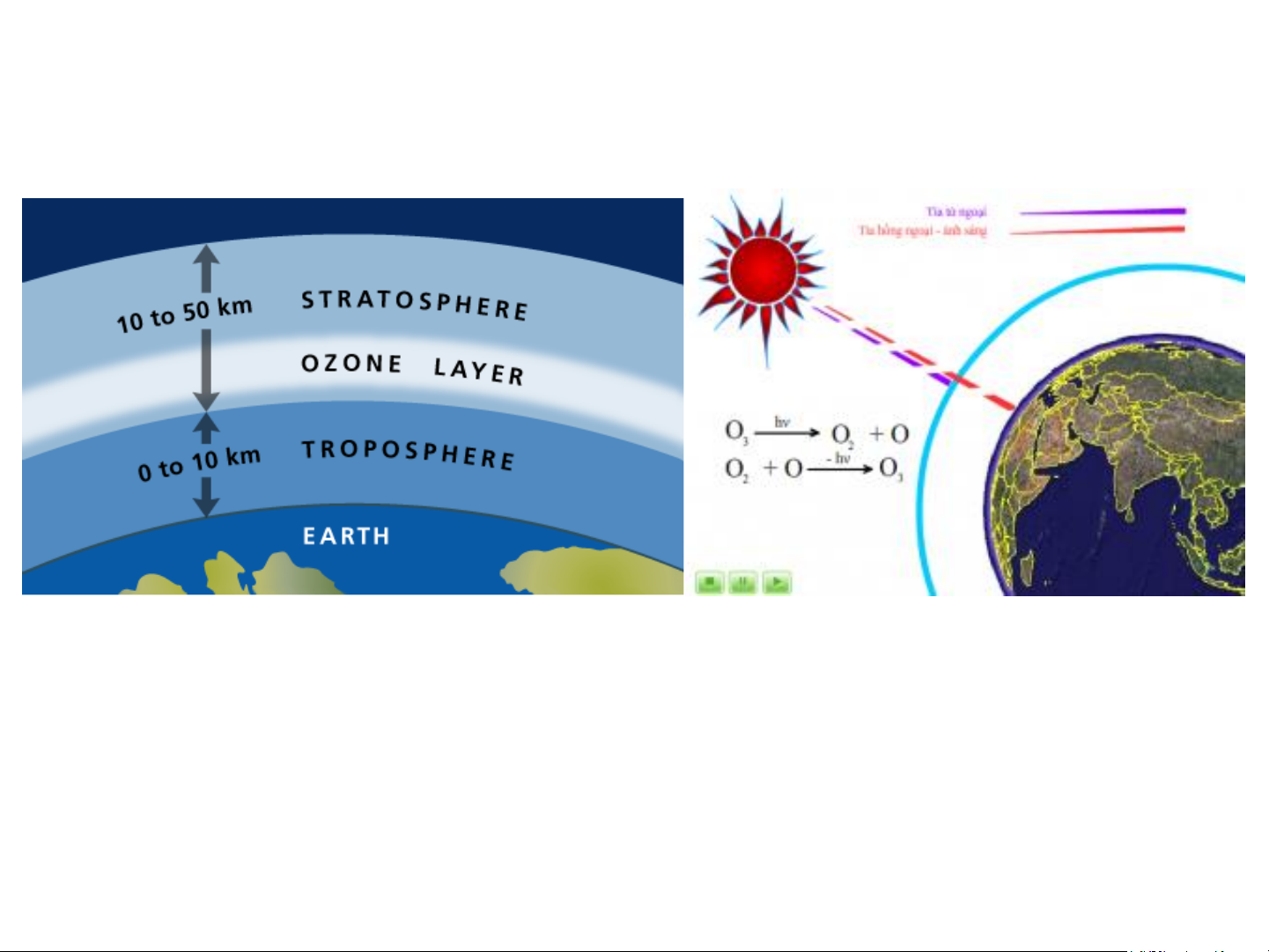
thải, làm sạch không khí. Tầng ozone
O + h (240nm < < 290nm) → O + O 2 O + O → O 2 3
O + h (280nm < <320 nm) → O + O 3 2
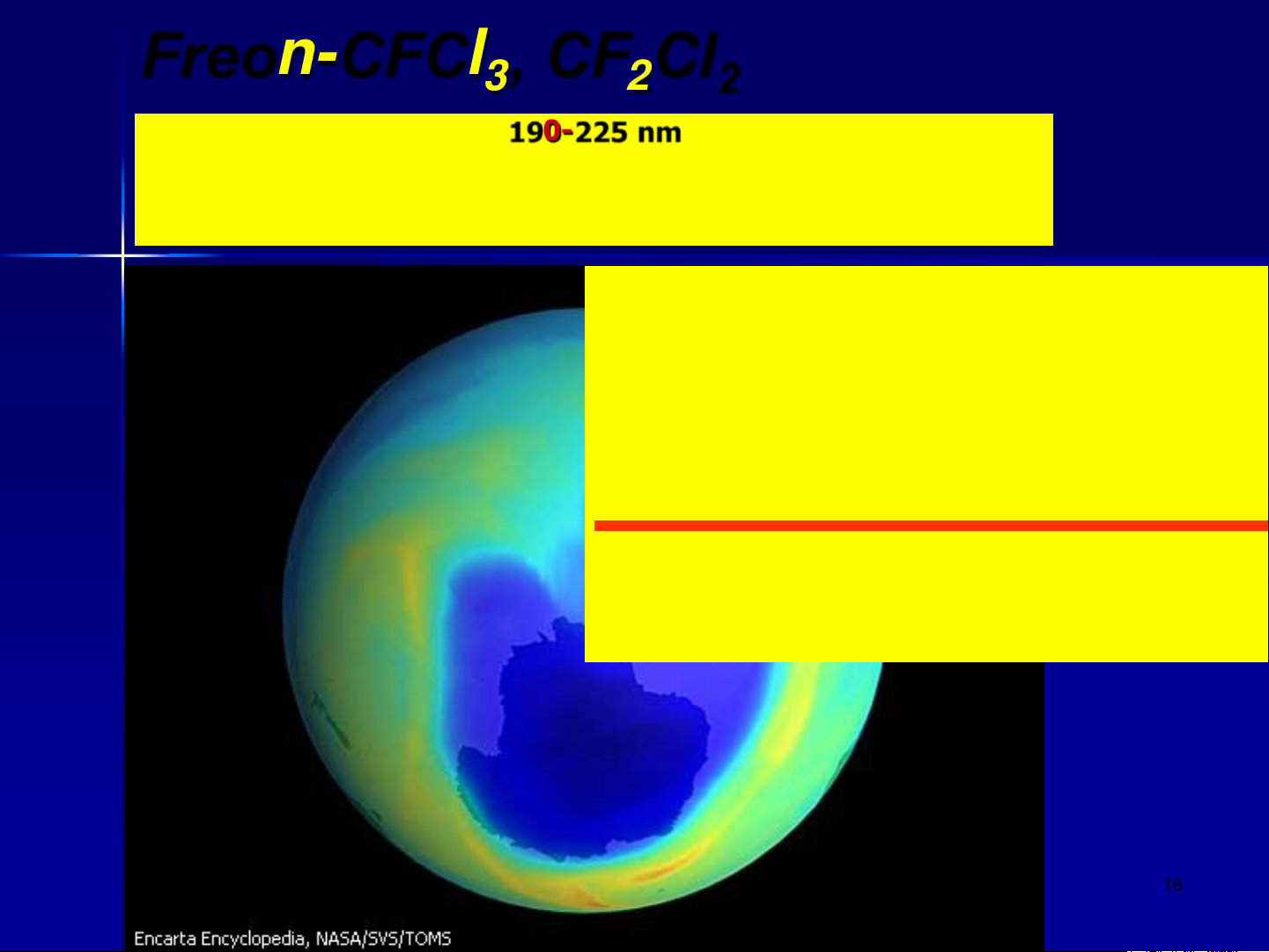
Freon-CFCl , CF Cl 3 2 2 190-225 nm
CF Cl + h = CF Cl + Cl 2 2 2
Cl + O = ClO + O 3 2
ClO + O = Cl + O2
O + O = 2O 3 2 16
http://www.ccpo.odu.edu/SEES/ozone/oz_class.htm
NO + O = NO + O 3 2 2
NO + O = NO + O 2 2
O + O = 2O 3 2
Nobel prize for Chemistry – 1995
Paul Crutzen – 1933 – Nertheland 17
Mario Molina – 1943 - US
Frank Rowland – 1927 - US OXIDE - X O n m
Oxit axit: tan trong nước tạo thành axit
Oxit lưỡng tính: vừa tan trong axit vừa tan trong bazo
Oxit bazo: tan trong nước tạo thành bazo
Oxit trơ: không tạo muối 18 Oxit axit N O SO Cl O 2 5 3 2 7 SO + H O ⎯⎯ → H SO 3 2 2 4 Sb O SiO 2 5 2
Sb O + 2NaOH + 5H O = 2Na Sb(OH ) 2 5 2 6
SiO + 2NaOH = Na SiO + H O 19 2 2 3 2
Department of Inorganic Chemistry - HUT Oxit bazo Li O Na O CaO BaO 2 2
Na O + H O ⎯⎯ →2NaOH 2 2 22 2− K 10 O
+ H O ⎯⎯⎯→2OH − 2 MgO NiO
NiO + 2HCl = NiCl + H O 2 20 2
Department of Inorganic Chemistry - HUT



