








Preview text:
3/9/2018
Trạng thái tự nhiên CÁC NGUYÊN TỐ NHÓM VIA IA, IIA: số OXH -II Oxy ns2np4
CHT: số OXH –II / +II Tính chất lý học
- Tồn tại dưới dạng phân tử gồm hai nguyên tử O số OXH +IV, +VI 2.
- Oxi thiên nhiên tồn tại dưới dạng đơn chất và hợp
chất là hỗn hợp của 3 đồng vị: 16O 17O 18O 99,76% 0,04% 0,2% Oxygen O 8 [He]2s22p4
- Là nguyên tố phổ biến trên trái đất: chiếm 21 %
trong khí quyển, chiếm 47% thành phần của vỏ Sulfur S 16 [Ne]3s23p4 trái đất….. Selenium Se 34 [Ar]3d104s24p4 Tellurium Te 52 [Kr]4d105s25p4 3 Polonium Po 84
[Xe]4f145d106s26p4 3/9/2018
- Ở điều kiện thường là chất khí không màu, Tính chất hoá học không mùi, không vị.
- Nhiệt độ sôi rất thấp to - Độ bội của O S= -183oC, nhiệt độ
2 là 2, Elk= 494 KJ.mol-1, bắt đầu nóng chảy to
phân huỷ thành các nguyên tử tương ứng ở nc= -218,9oC 1400oC: O ⇄ 2O
- Khả năng hoà tan trong nước rất kém, ở 2
20oC 1 lít nước hoà tan khoảng 30ml O2
- Oxi rất hoạt động hoá học ở nhiệt độ cao: phản - Oxy là chất thuận từ.
ứng trực tiếp với nhiều hợp chất và hầu hết các đơn
chất (trừ các halogen, nguyên tố khí hiếm, một số
kim loại quý) tạo thành các oxit,
∂ 2∂ *2∂ 2π 2 = π 2 π *1 = π *1 s s z x y x y Điều chế oxi - Trong công nghiệp:
- Trong phòng thí nghiệm: điều chế O2 bằng phân
+ Chưng cất phân đoạn không khí lỏng.
huỷ các hợp chất giàu oxi, kém bền như KMnO4, KClO3… 250oC 2KMnO K MnO + MnO + O 4 2 4 2 2 to,MnO2 2KClO 2KCl + 3O 3 2 to 2KNO 2KNO + O 3 2 2
+ Điện phân H2O trong dung dịch kiềm cũng cho
phép thu được O2 và H2 tinh khiết, nhưng đây là phương pháp đắt tiền. 3/9/2018
- Oxi tham gia vào các phản ứng phân huỷ các Ứng dụng
hợp chất hữu cơ (xác các động thực vật thối rữa…).
-Oxi rất quan trọng đối với các quá trình trao đổi
chất của người và động thực vật
-Nhiều phản ứng oxi hoá các hợp chất bằng O2 đã
được sử dụng trong công nghiệp:
+ Phản ứng cháy của axetylen để tạo nhiệt độ cao (đèn xì)
+ Phản ứng oxi hoá SO2 thành SO3 để điều chế axit sunfuric… Ozon Tính chất lý học
Đặc điểm cấu tạo
- Ở điều kiện thường O3 là khí có màu xanh lam
nhạt và có mùi đặc biệt. Phân tử có khối lượng
Phân tử ozon trước đây một thời gian dài được coi là
tương đối lớn, có cực ( = 0,66D). to có cấu tạo vòng kín: nc=-192,7oC và O
tos= - 111,9oC. Khả năng hoà tan trong nước của O3 O O
lớn hơn O2 15 lần, chất nghịch từ.
Phân tử O3 không có vòng kín mà là phân tử hình góc 3/9/2018 Tính chất hoá học - O - O
3 kém bền hơn so với O2 và dễ bị phân huỷ:
3 có tính oxi hoá mạnh trong cả môi trường axit và bazơ : O (K) 3/2O (K) 3 2 O3 + 2e + 2H+ = O2 + H2O o= 2,07V O - O 3 + 2e + H2O = O2 + 2OH- o= 1,24V
3 có tính oxi hoá mạnh hơn nhiều so với O2. Ví du: O O 2 + 4e + 4H+ = 2H2O o= 1,229V
3 có thể tương tác với Ag và Hg. O 2Ag + O = Ag O + O 2 + 2H2O + 4e = 4OH- o= 0,401V 3 2 2 - O
- Cã thÓ oxi ho¸ sunfua thμnh sunfat:
3 là chất oxi hoá mạnh, khả năng diệt khuẩn rất tốt. Nó
được sử dụng để làm sạch nước uống, nước sinh hoạt, nước PbS + 4O = PbSO + 4O 3 4 2
thải, làm sạch không khí. Tầng ozone
Freon-CFCl , CF Cl 3 2 2 190-225 nm 2 CF 2 Cl h C 2 F Cl Cl Cl 3 O ClO 2 O
ClO O Cl 2 O O O 2 3 2 O
O + h (240nm < < 290nm) O + O 2 O + O O 2 3
O + h (280nm < <320 nm) O + O 3 2 16
http://www.ccpo.odu.edu/SEES/ozone/oz_class.htm 3/9/2018 OXIDE - XnOm NO 3 O N 2 O 2 O
Oxit axit: tan trong nước tạo thành axit 2 NO O NO 2 O
Oxit lưỡng tính: vừa tan trong axit vừa tan trong bazo O O 2 3 2 O
Oxit bazo: tan trong nước tạo thành bazo
Nobel prize for Chemistry – 1995
Oxit trơ: không tạo muối
Paul Crutzen – 1933 – Nertheland 17
Mario Molina – 1943 - US 18
Frank Rowland – 1927 - US Oxit axit Oxit bazo N2 5 O S 3 O Cl2 7 O 2 Li O Na2O CaO BaO
Na O H O 2 3 SO H2O H2S 4 O 2 2 NaOH 22 2 K 10 O H O 2 2 OH 2 Sb 5 O S 2 iO
Sb O 2NaOH 5H O 2Na S ( b OH) MgO NiO 2 5 2 6 NiO 2
SiO 2NaOH Na SiO H O HCl 2 NiCl H2O 19 2 2 3 2 20
Department of Inorganic Chemistry - HUT
Department of Inorganic Chemistry - HUT 3/9/2018 Oxit lưỡng tính HYDROXIT – OmX(OH)n Hidroxit = oxit.nH Al O ZnO Cr O SnO PbO As O 2O. 2 3 2 3 4 6 Ca(OH)
ZnO 2HCl ZnCl 2 = CaO.H2O 2 H2O Zn(OH)2 = ZnO.H2O
ZnO 2NaOH H O Na Zn(OH ) 2 2 4 4H3PO4 = P4O10.6H2O
Hidroxit bazo là hidroxit tương ứng với oxit bazo.
Oxit trơ-không tạo muối
Hidroxit axit là hidroxit tương ứng với oxit axit. N
Hidroxit lưỡng tính là hidroxit tương ứng với oxit 2O CO 21 22 lưỡng tính.
Department of Inorganic Chemistry - HUT
Department of Inorganic Chemistry - HUT O
Độ mạnh của hidroxit axit mX(OH)n
tăng theo giá trị m trong HYDROXIT – OmX(OH)n phân tử m = 0 axit yếu H-O-Cl Fe(O H ) Fe(O H ) 3 2 m = 1 axit trung bình O=N-O-H M g (O H ) C a (O H ) Sr (O H ) Ba (O H ) 2 2 2 2 m ≥ 2 axit mạnh O2N-O-H
Độ mạnh bazo tăng dần
Tính chất bazo tăng khi số oxi hóa và độ âm điện của X H O I H O Br H O C l
giảm, bán kính của ion trung tâm tăng
Các axit cùng giá trị m
Độ mạnh axit tăng dần theo χ 3/9/2018 HYDROXIT – O HYDROXIT – O mX(OH)n mX(OH)n Trong chu kỳ Trong nhóm n BeO Be(O H ) ầ 2 d ng N a tă 2O M gO Al2O3 SiO2 4 P 1 O 0 SO3 C l2O7 M gO M g (O H ) N aO H M g (O H ) Al (O H ) 2 3 H 2 SiO3 H 3 PO4 H 2 SO4 H C lO4 2 bazo
Tính bazo giảm dần, tính axit tăng dần C aO C a (O H ) 2 n, tính ầ
Xét các nguyên tố ứng số oxi hóa cao nhất SrO Sr (O H ) md 2 iả g BaO Ba (O H ) axit 2 Tính Hợp chất H Tính chất lý học 2O2 Cấu tạo
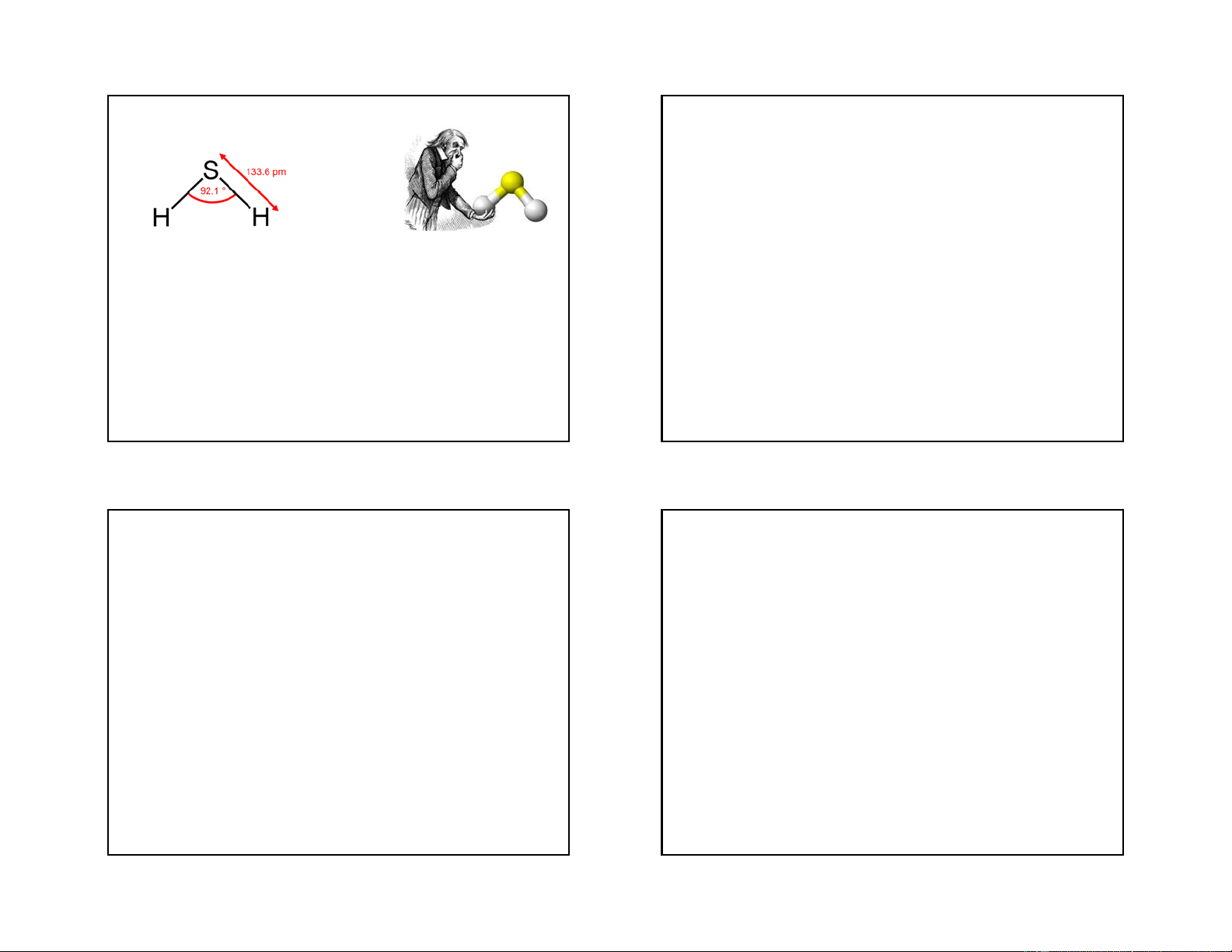
- Cấu tạo gấp khúc; d
- Ở điều kiện thường là chất lỏng màu xanh O-O=1,48A, dH-O= 0,95A,
nhạt, hơi nhớt, có thể hoà tan trong nước
Do phân tử không đối xứng nên phân cực.
bất cứ tỷ lệ nào, sôi ở ts = 152oC và hoá rắn ở tđ= -0,89oC. 0,95A 111,5o 1,48A 94,8o 3/9/2018 Tính chất hoá học
Ví dụ: + H2O2 có thể oxi hoá I- thành I2, sunfua thành sunfat…
- Đây là hợp chất kém bền dễ bị phân huỷ : H 2H 2O2 + 2KI + H2SO4 = I2 + K2SO4 + 2H2O 2O2 = 2H2O + O2 4H2O2 + PbS = PbSO4 + 4H2O
- H2O2 vừa thể hiện tính oxi hoá và vừa thể hiện tính khử. H O + 2e + 2H+ ⇄ 2H O o = 1,77V
+ Với các chất oxi hoá mạnh như KMnO 2 2 2 4, O3 hoặc Cl2 H O + 2e ⇄ 2OH- o = 0,87V thì thể hiện tính khử: 2 2 O + 2e + 2H+ ⇄ H O o = 0,68V 2 2 2
5H O + MnO - + 6H+ = 5O + 2Mn2+ + 8H O 2 2 4 2 2 - TÝnh axit yÕu cña H O 2 2 H O ⇄ H+ + HO - K = 1,5.10-12 2 2 2 1 HO - ⇄ H+ + O - K rÊt nhá 2 2 2 - §iÒu chÕ H O 2 2 Lưu huỳnh Phßng thÝ nghiªm:
Cấu tạo và tính chất lý học BaO +H SO (l)=H O +BaSO - 3s23p43do, 2 2 4 2 2 4
- Số oxi hoá: -2 (các hợp chất sunfua), -1 (hợp chất pirit FeS 2-
2), +2, +4, +6 (SF2, SO2, SF4, SO4 , SF6….) 3/9/2018
-S tồn tại dưới nhiều dạng thù hình khác nhau, do có thể tạo
mạch đồng nhất gồm nhiều nguyên tử S. Hai dạng thù hình Tính chất hoá học
thông thường gặp nhất của lưu huỳnh là S và S
-Ở nhiệt độ thường kém hoạt động hoá học, ở
nhiệt độ cao nó phản ứng với hầu hết các nguyên
+ Các dạng thù hình này đều là chất tinh thể cấu tạo từ các
tố trừ các khí hiếm, nitơ, iốt, vàng và platin phân tử S8
-Với kim loại và hydro lưu huỳnh thể hiện tính oxy
- Tất cả các dạng thù hình của S không tan trong nước, ít hoá
tan trong rượu và este, nhưng tan tốt trong benzen và t=300oC đặc biệt là CS2 + S + H ⇄ H S 2 2
- S tác dụng với các kim loại: Với các kim loại kiềm
và kiềm thổ, Ag, Hg phản ứng xảy ra ở t thường,
còn với Fe, Ni, Co, Cr phản ứng xảy ra ở nhiệt độ cao
- Với các phi kim, S thể hiện tính khử:
- Trong thiên nhiên: S tồn tại dưới cả dạng đơn chất và
+ S cháy trong không khí tạo thành khí sunfua dioxit:
hợp chất của nó như H2S, sunfua kim loại, pirit sắt, S + O sunfat, thạch cao…. 2 = SO2
+ S tác dụng với F ở nhiệt độ thường, với Cl, Br ở nhiệt độ cao
+ S cũng thể hiện tính khử khi tác dụng với các chất oxi
hoá mạnh như KClO3, K2Cr2O7, HNO3, H2SO4đ 2KClO3 + 3S = 2KCl + SO2 2H2SO4 + S = 3SO2 + 2H2O 3/9/2018 Hợp chất H2S Tính chất hoá học
- Tính axit: Đây là axit yếu hai lần axit: H S ⇄ H+ + HS- K = 10-7 2 1 HS- ⇄ H+ + S2- K = 10-14 2 - H S lμ chÊt khö m¹nh: 2
-Ở điều kiện thường là chất khí, có mùi trứng thối, rất tth độc, ít tan trong nước. 2H2S + O2 = 2S + 2H2O toC -Dung dịch bão hoà H 2H2S + 3O2 = 2SO2 + 2H2O
2S ở 25oC và 1 atm có nồng độ
khoảng 0,1M. H2S kém bền nhiệt ở 400oC nó bắt đầu phân huỷ thành S và H2 Điều chế H Do o 2S
S/H2S = 0,14V nên mọi cặp oxi hoá khử có thế
khử lớn hơn 0,14V đều có thể oxi hoá H
- Trong công nghiệp H2S thường được tách từ khí 2S thành S, ví dụ:
thiên nhiên trong quá trình tinh chế dầu mỏ - Trong phòng thí nghiệm H I + H S = S + 2HI 2S được điều chế từ 2 2 các muối sunfua: FeS + 2HCl = FeCl
+ C¸c chÊt oxi ho¸ m¹nh: Cl hoÆc Br oxy ho¸ H S thμnh H SO : 2 + H2S 2 2 2 2 4 H S + 4Cl + 4H O = H SO + 8HCl 2 2 2 2 4 3/9/2018 Hợp chất SO Tính chất hoá học 2
+ Khả năng hoà tan trong nước: SO ⇆ - ⇆ 2(K) + aq ⇆ SO2.aq ⇆ H2SO3 H+ + HSO3 2H+ + SO 2- 3 H
- Ở điều kiện thường SO
2SO3 không tách được ra khỏi dung dịch nước, 2 là khí không màu, có
nhưng các anion HSO - và SO 2- tạo được các mùi rất khó, to 3 3
S=-10oC, tonc=-75oC, tan tốt trong muối kết tinh tốt
nước. Ở 20oC 1 lít nước hoà tan khoảng 40 lít khí + Tan trong kiềm: SO2. NaOH + SO2 = NaHSO3 NaOH + NaHSO
- Là tác nhân làm lạnh và được ứng dụng để sản 3 = Na2SO3 + H2O Na
xuất axit sunfuric, là chất gây ô nhiễm môi trường. 2SO3 + 2H+ = 2Na+ + SO2 + H2O + Tính khử của SO
+ Các muối sunfit và hydrosunfit để lâu ngày trong
2 thể hiện trong môi trường axit và
trung tính, được đánh giá bằng thế khử chuẩn:
không khí cũng bị oxi hoá dần thành muối sunfat: SO 2- Chậm 4 + 2e + 4H+ ⇆ SO2.aq + 2H2O o = 0,17V SO 2- 2- 2Na 4 + 2e + H2O ⇆ SO3 + 2OH- o = -0,93V 2SO3 + O2 = 2Na2SO4
+ Tính oxi hoá: Khi tác dụng với chất khử mạnh hơn
+ Các chất oxi hoá mạnh như HNO3, KMnO4,
thì S(+4) lại thể hiện tính oxi hoá: K 2-
2Cr2O7, halogen…có thể oxi hoá SO2 hoặc SO3 2- thành SO 2- SO3 + 2S2- + 6H+ = 3S + 3H2O 4 . Ví dụ: 2HNO SO2 + 2H2S = 3S + 2H2O 3 + SO2 = H2SO4 + 2NO2
Cl2 + H2O + Na2SO3 = Na2SO4 + 2HCl Cl2 + SO2 + H2O = H2SO4 + 2HCl 3/9/2018 Mưa axit - Điều chế:
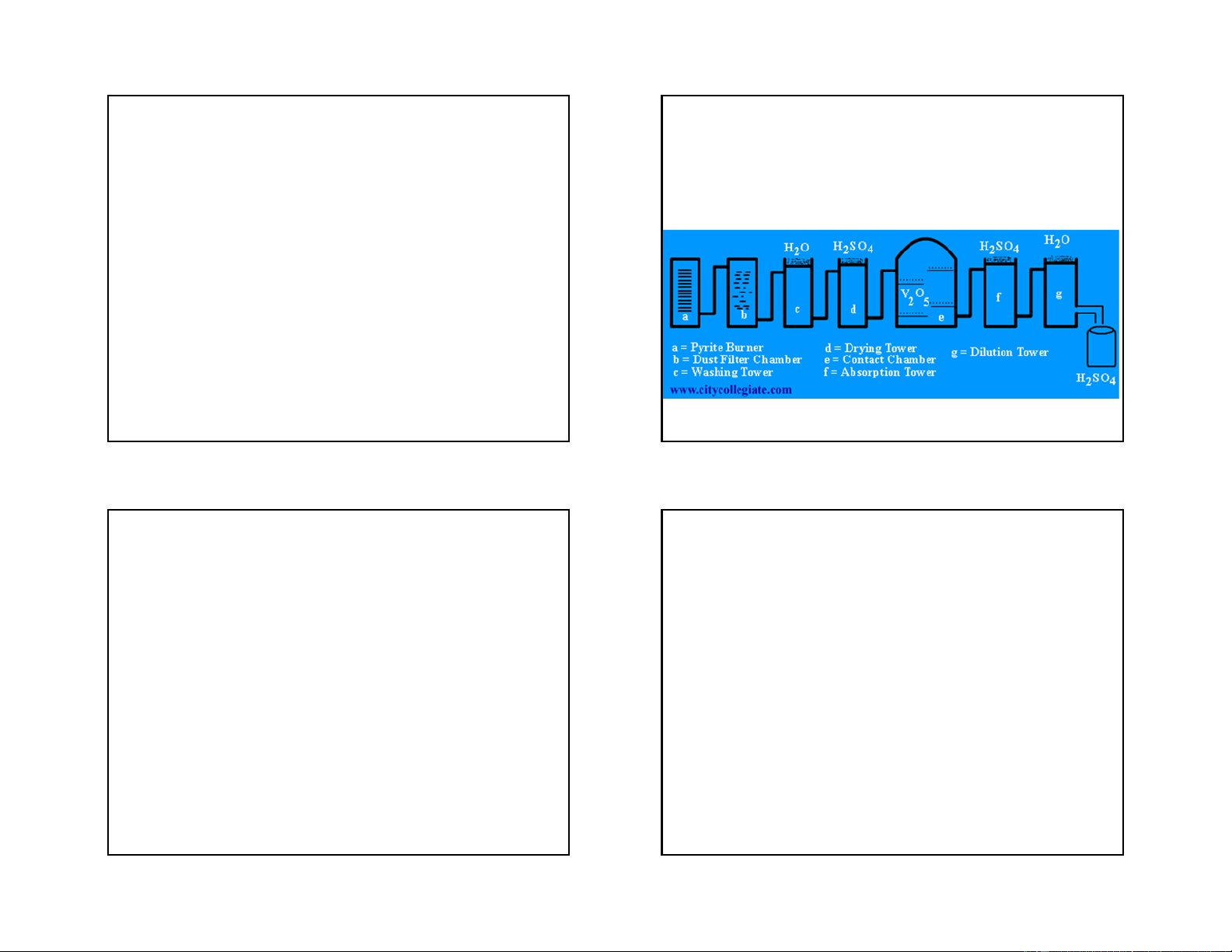
+ Trong công nghiệp: SO2 thường được điều chế từ
quặng pirit hoặc lưu huỳnh, tuy nhiên phương pháp thứ hai đắt hơn 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
+ Trong phòng thí nghiệm: SO2 được điều chế bằng
cách nhỏ axit H2SO4 vào muối sunfit hoặc hydrosunfit
NaHSO3 + H2SO4 = NaHSO4 + H2O + SO2
Hợp chất với số oxi hoá (+6) Mưa axit
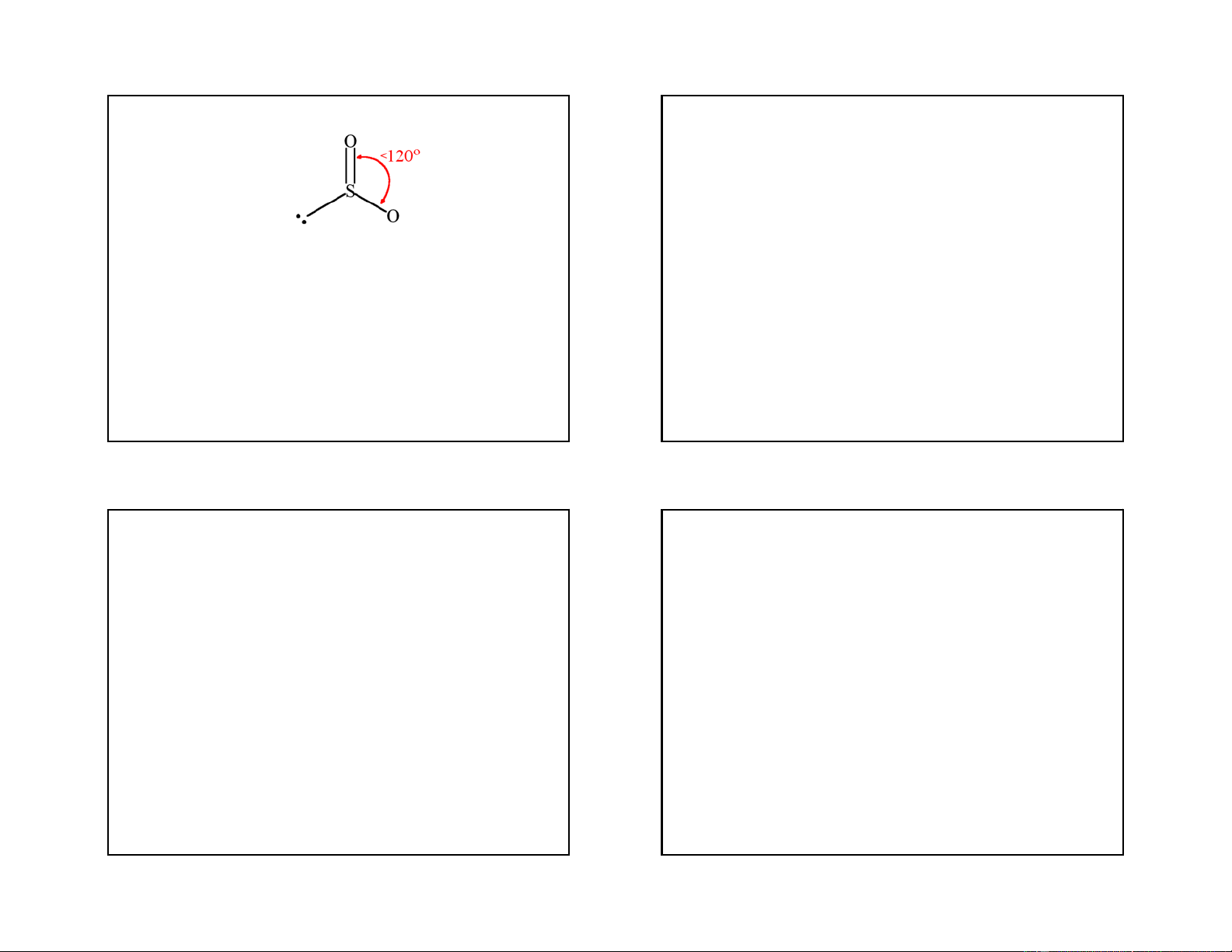
- SO3 có cấu tạo là tam giác phẳng, góc OSO là 120o, phân tử không phân cực.
- Phân tử SO3 tồn tại ở trạng thái hơi. Khi làm lạnh hơi
ngưng tụ thành chất lỏng dễ bay hơi (ts = 44,8oC) gồm
chủ yếu các phân tử trime mạch vòng (SO ⇆ 3)3: 3SO3
(SO3)3, hỗn hợp được làm lạnh đến 16,8oC, chất lỏng
biến thành khối rắn dạng SO
3 , có cấu tạo bởi 3 hình
bốn mặt SO4 nối với nhau bởi các nguyên tử O. 3/9/2018
- Hydroxit tương ứng của SO
- Trong phòng thí nghiệm: SO3 được điều chế bằng 3 là axit chưng cất axit sunfuric.
sunfuric, được tạo ra khi SO3 được hoà tan trong nước
- Trong công nghiệp SO3 được tổng hợp
bằng phản ứng oxi hoá SO2 trong không khí
có mặt xúc tác V2O5 ở nhiệt độ t= 500oC: SO (K) + O (K) ⇆ SO (K) 2 2 3
Còn phản ứng với các kim loại hoạt động thì sản - Tính chất của H2SO4:
phẩm khử H2SO4 ngoài SO2 ra còn có thể là S, H2S
+ Chất rất háo nước, khi pha loãng dung dịch H2SO4 Mg + 2H SO = MgSO + SO + 2H O 2 4 4 2 2
đặc để được H2SO4 loãng ta phải cho tương ứng 3Mg + 4H SO = 3MgSO + S + 4H O từng giọt H 2 4 4 2
2SO4 đặc vào nước mà không được làm 4Mg + 5H SO = 4MgSO + H S + 4H O ngược lại 2 4 4 2 2
Một số phi kim hoạt động hoá học như S, C, P
+ Đây là axit mạnh, H2SO4 đặc có tính oxi hoá mạnh, cũng bị axit H
có thể oxi hoá được các kim loại kém hoạt động hoá
2SO4 đặc nóng oxi hoá thành các
oxit có số oxi hoá cao, ví dụ:
học như Cu, Ag, Hg, sản phẩm phản ứng khử H2SO4 là SO S + H SO = 2SO + 2H O 2 4 2 2 2 C + H SO = CO + SO + H O 2H 2 4 2 2 2 2SO4 + Cu = CuSO4 + SO2 + 2H2O 3/9/2018
Một vài hợp chất khác của S
Một vài hợp chất khác của S
* Axit thiosunfuric H2S2O3 ít bền dễ bị phân huỷ
* Axit peoxidisunfuric H2S2O8 là chất rắn trắng dễ hút H ẩm, ion S
2- có tính oxi hoá rất mạnh: 2S2O3 H2SO3 + S 2O8 S O 2- + 2e = 2SO 2-; o = 2,01V 2 8 4 + Tính khử:
Nã cã thÓ oxi ho¸ Mn2+ thμnh MnO -, Cr3+ thμnh Cr O 2- 4 2 7 2- 2- - S 2- 2- 5S O + 2Mn2+ + 8H O = 10SO + 2MnO + 16H+ 2 8 2 4 4 2O3
bị Cl2 hoặc Br2 oxi hoá thành SO4 S 2- 2- 2O3
+ 4Cl2 + 5H2O = 2SO4 + 8Cl- + 10H+
Sù thuû ph©n H S O t¹o thμnh axit H SO còng lμ chÊt oxi ho¸ 2 2 8 2 5 m¹nh: + Khả năng tạo phức: H S O + H O = H SO + H SO 2 2 8 2 2 4 2 5 2S 2- H SO + H O = H SO + H O 2O3 + AgBr = [Ag(S2O3)2]3- + Br- 2 5 2 2 4 2 2



