



Preview text:
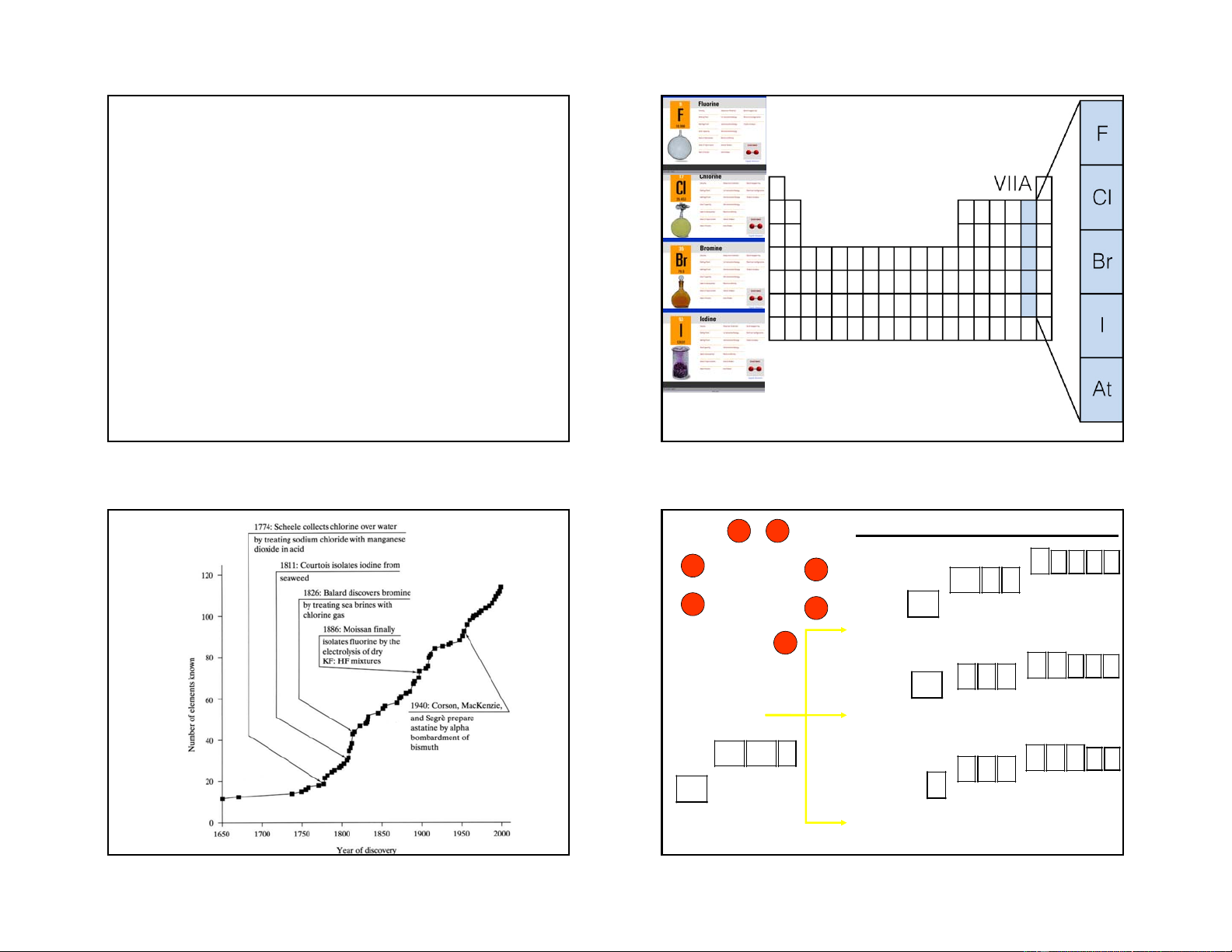
2/18/2019 GROUP VIIA The Halogens
Halogens (Greek hals, “salt”; genes, “born”)
CÁC NGUYÊN TỐ NHÓM VIIA
Department of Inorganic Chemistry - HUT The Lewis dot structure X ns2np4nd1: ClF3 ns2np5 ns2np3nd2: BrF5 ns2np2nd3: IF7
Department of Inorganic Chemistry - HUT 2/18/2019 Tính chất lý học -1 0 +1 +3 +5 +7 -Ở điều kiện thường
Flo và Clo - khí, không màu (F), vàng lục (Cl) Brôm - lỏng màu nâu đỏ HX X2 Cl2O HClO2 HClO3 HClO4 Iốt - rắn màu tím sẫm OF2 Br2O HBrO2 HBrO3 HBrO4
- Các halogen ít tan trong nước trừ Flo phân huỷ hoàn O2F2 HClO HIO2 HIO3 HIO4
toàn trong nước ở nhiệt độ thường HBrO I2O5
- I2 dễ hoàn tan trong dung dịch KI tạo thành KI3: HIO I2 + KI = KI3 Tính chất hoá học
- Flo là phi kim hoạt động nhất:
phản ứng với hầu hết các đơn chất, nhiều hợp 1. Tính oxi hoá
chất và các khí hiếm như Kr, Xe, Rn…; phản ứng xảy ra rất mãnh liệt:
Từ F, Cl, Br, I tính oxi hoá giảm dần: Cl2 + 2KBr 2KCl + Br2 Br2 + 2KI 2KBr + I2 2/18/2019
- Phản ứng giữa X với H
- Phản ứng của halogen với nước: 2: X2 + H2 2HX F
Ở nhiệt độ thường F oxi hoá nước theo phản ứng: 2+ H2 = 2HF
- nổ mạnh ở t thấp (-252oC) F2 +2H2O 4HF + O2 Cl2 + H2 = 2HCl -
chỉ nổ khi đun nóng hoặc
dưới tác dụng của ánh sáng giàu tia tử ngoại
Còn các halogen khác : X2 + H2O HX + HXO, khả năng phản ứng giảm từ Cl Br 2 đến I2 2 + H2 = 2HBr - ở t= 200oC và trên 700oC HBr bị phân ly
- Phản ứng với dung dịch kiềm: Cl I ⇆
2 + 2NaOH NaCl + NaClO + H2O 2 + H2 2HI
- t > 200oC mới bắt đầu xảy Nước Javen ra và luôn thuận nghịch. 2Cl 2 + Ca(OH)2 CaCl2 + Ca(ClO)2 + 2H2O HF HCl HBr HI Clorua vôi Ho, KJ.mol-1 -288,6 -92,3 -35,98 25,9 2. Tính khử
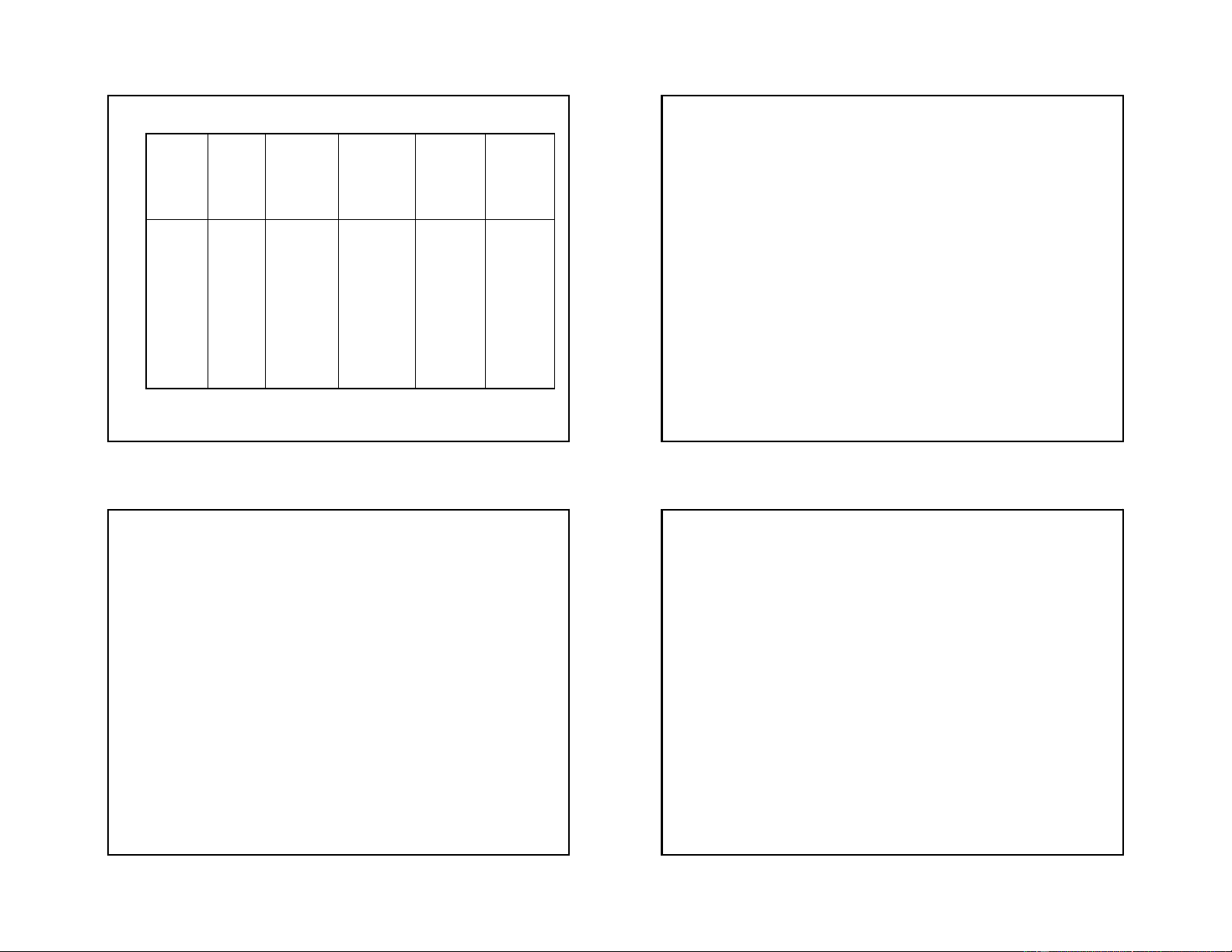
3. Các phương pháp điều chế
Không đặc trưng đối với halogen, tính khử tăng dần - Điều chế Cl2:
từ trên xuống trong nhóm (trừ F) từ Cl2 đến I2. (Br2, I2)
* Trong phòng thí nghiệm: MnO2, KMnO4, K2Cr2O7 tác Ví dụ: dụng với HCl đặc Cl MnO 2 + 2KI 2KCl + I2 2 + 4HCl MnCl2 + Cl2 + 2H2O 5Cl 2KMnO 2 + I2 + 6H2O 2HIO3 + 10HCl
4 + 16HCl 2MnCl2 + 5Cl2 + 2KCl + 8H2O Cl * Trong công nghiệp: 2 + 2KBr 2KCl + Br2 5Cl đpnc 2 + Br2 + 6H2O 2HBrO3 + 10HCl 2NaCl 2Na + Cl2 Axit HNO đpdd
3 cũng có thể oxi hoá I2 thành axit Iođic I 2NaCl + 2H
2 + HNO3(l) HIO3 + NO + H2O 2O 2NaOH + Cl2 + H2 2/18/2019 - Điều chế Br 4. Ứng dụng 2 và I2: Cl
+ Clo được ứng dụng rộng rãi nhất để tổng hợp chất 2 + 2NaBr 2NaCl + Br2 dung môi hữu cơ như CCl Cl
4, thuốc trừ sâu, diệt cỏ,
2 + 2KI 2KCl + I2, dùng lượng Cl2 nghiêm ngặt
chất dẻo, cao su, sợi tổng hợp, các chất tẩy trắng, tẩy
Vì nếu dư Cl2: 5Cl2 + I2 + 6H2O 2HIO3 + 10HCl trùng nước… Nếu thiếu Cl - 2: I2 + I- I3
+ F2 dùng để điều chế: Teflon, freon CF2Cl2 và CFCl3… - Điều chế F2: + Br
Phương pháp duy nhất để điều chế F là điện phân
2 dùng để chế hoá một số dược phẩm, thuốc
nhuộm, AgBr dùng trong nhiếp ảnh
nóng chảy muối florua. Vì sao?
+ I2 dùng trong y tế làm thuốc sát trùng, cầm máu,
chế tạo một số dược phẩm Tính chất hoá học
Hợp chất của halogen
- Tính axít khi hoà tan trong nước: HF là axit trung
bình yếu, HCl, HBr, HI là các axit mạnh
Hợp chất halogenua: HF, HCl, HBr, HI
+ Từ HF đến HI năng lượng liên kết H-X giảm dần
và đó là nguyên nhân chủ yếu làm tăng khả năng - Tính chất lý học
phân ly H+ của HX, tức là làm tăng tính axit.
+ Ở điều kiện thường đều là các chất khí không màu, có mùi sốc. HF HCl HF HI HF HCl HBr HI EH-X, KJ.mol-1 565 431 364 297 t , o S C 19,5 -84,9 -66,7 -35,8
Tính axit của HF giảm một cách đột ngột so với các HX T , o
khác là do hiện tượng liên hợp giữa các phân tử HF gây ra nc C -83 -114,2 -88 -50,8
do liên kết hydro : nHF (HF)n (n= 26)
+ Các halogenua có khả năng hoà tan trong nước rất nhiều. 2/18/2019
- Trừ HF, các HX đều có tính khử và tính khử tăng dần
- Riêng HF có tính đặc biệt khác: từ HCl, HBr, HI 6HF + SiO 2
H2[SiF6] + 2H2O, dùng HF để
+ Ví dụ: HCl bị oxi hoá bởi các chất oxy hoá mạnh khắc lên thuỷ tinh
như: KMnO4, MnO2, nhưng không bị oxi hoá bởi H2SO4
đặc, còn HBr và HI phản ứng theo các phương trình sau: - Điều chế: 2HBr + H
CaF2(r) + H2SO4(đ) CaSO4 + 2HF(k) 2SO4 SO2 + Br2 + 2H2O 8HI + H to 2SO4 H2S + 4I2 + 4H2O
+ HI còn bị oxi hoá bởi Fe3+: H2(k) + Cl2(k) 2HCl(k) 2FeCl PX 3 + 2HI 2FeCl2 + I2 + 2HCl 3 + 3HOH H3PO4 + 3HX (HBr, HI) Hợp chất chứa oxi Hợp chất chứa oxi • Các hợp chất HXO
* Các hợp chất HXO là phân tử có góc HOX = 109o, đều không bền
- Đều là các axit yếu, tính axit giảm dần: K
-Axit hipoflorơ tạo ra khi khí F a(HClO) =
2 đi qua nước ở 0oC, ở t thường đã phân huỷ thành HF và O 3,4.10-8; K 2:
a(HBrO)= 2.10-9; Ka(HlO) = 1.10-11 2HFO = 2HF + O2
- Muối của axit hipoclorơ bền hơn là hipoclorit, tạo ra
- Axit hipoclorơ HClO được tạo ra do phản ứng thuỷ phân của Cl2 trong nước: do phản ứng: Cl2 + HOH ⇆ HCl + HClO Cl
+ Dễ bị phân huỷ theo các phương trình sau:
2 + 2NaOH NaCl + NaClO+ 2H2O as 2HClO 2HCl + O2
Trong môi trường kiềm, bị phân huỷ theo phản ứng: to 3XO- ⇆ 2X- + XO - 3HClO 2HCl + HClO 3 3 (X= Cl, Br, I) 2/18/2019 * Hợp chất chứa oxi HXO3 - - - - HClO
ClO3 , BrO3 , IO3 đều có tính oxi hoá mạnh và giảm
3, HBrO3 và HIO3 đều là các axit mạnh và tính
axit giảm dần theo dãy trên.
dần trong môi trường trung tính và môi trường kiềm ClO - + 6e + 6H+ Cl- + 3H + HClO 3 2O
3 và HBrO3 kém bền và chỉ tồn tại trong dung
dịch loãng, HIO3 được tách ra dưới dạng tinh thể 6
+ Được tạo ra do sự phân huỷ của các hợp chất với o 0,059 [ClO ][H ] ε ε lg 3
số oxi hoá +1 trong môi trường kiềm: ClO /Cl 3 6 [Cl ] 3XO- ⇄ 2X- + XO - 3
Phản ứng này tăng dần từ Cl đến I: đối với ClO- xảy
ra ở t= 80oC, BrO- ở 0oC còn đối với IO- phản ứng
phân huỷ xảy ra ở t thấp hơn nữa Điều chế muối KClO3
http://sites.google.com/site/thinhbk
+ Trong công nghiệp KClO3 được điều chế bằng điện phân
dung dịch KCl không màng ngăn ở 80oC đp KCl + H
• http://www.facebook.com/thinhbkhn 2O KOH + Cl2 + H2 Cl2 + 2KOH = KClO + KCl + H2O • Email: thinhbk@gmail.com KClO ⇄ KClO3 + KCl
KClO3 được tách ra bằng cách làm lạnh Nhiệt phân muối KClO3
2KClO3(r) 2KCl + 3O2(k) ở t= 250oC có mặt xúc tác MnO2 4KClO 3
3KClO4 + KCl đun nóng không có mặt xúc tác



