








Preview text:
Contents
CHƯƠNG 1. ĐẠI CƯƠNG VỀ HÓA PHÂN TÍCH ...................................................... 2
1.1. Khái niệm hóa phân tích ....................................................................................... 2
1. 2. Vai trò và yêu cầu của hóa phân tích ................................................................... 2
1.3. Phân loại các phương pháp phân tích ................................................................... 3
1.3.1. Dựa vào khối lượng mẫu đem phân tích ................................................... 3
1.3.2. Dựa vào bản chất của phương pháp ......................................................... 3
1.4. Kết luận................................................................................................................. 4
CHƯƠNG 2. GIỚI THIỆU VỀ PHƯƠNG PHÁP PHÂN TÍCH THỂ TÍCH ................ 5
2.1. Định nghĩa ............................................................................................................ 5
2.2. Yêu cầu đối với phản ứng chuẩn độ ..................................................................... 6
2.3. Phân loại các phương pháp phân tích thể tích ...................................................... 6
2.4. Khối lượng mol và đương lượng gam .................................................................. 6
2.5. Cách biểu diễn nồng độ trong hóa phân tích ........................................................ 7
2.6. Tính toán trong phân tích thể tích......................................................................... 8 1
CHƯƠNG 1. ĐẠI CƯƠNG VỀ HÓA PHÂN TÍCH
1.1. Khái niệm hóa phân tích
Hoá học phân tích là một ngành khoa học nhằm nghiên cứu các phương pháp để xác
định thành phần hoá học và cấu trúc phân tử của các chất trong một đối tượng phân tích. Hóa
học phân tích không chỉ là khoa học về các phương pháp phân tích tích định tính và phân tích
định lượng các chất mà còn là khoa học về các phương pháp kiểm tra những quá trình hóa lý và kỹ thuật hóa học.
Phân tích định tính (PTĐT) nhằm xác định sự hiện diện của các cấu tử (nguyên tố,
nhóm nguyên tố, hay ion) trong mẫu phân tích hoặc xác định các liên kết, cấu trúc, trạng thái
vật lý của các chất và các nhóm nguyên tử trong mẫu phân tích.
Phân tích định lượng PTĐL có nhiệm vụ xác định một cách chính xác hàm lượng hoặc
tỷ lệ về lượng của các cấu tử trong mẫu. Phương pháp PTĐL dự trên phép đo các thuộc tính
hóa học, vật lý hoặc hóa lý của các chất hoặc của các phản ứng hóa học.
1. 2. Vai trò và yêu cầu của hóa phân tích
Vai trò chủ yếu của hóa phân tích là PTĐL. Tuy nhiên trong thực tế muốn xác định hàm
lượng của các cấu tử trong mẫu chưa biết thành phần là rất phức tạp, vì sự có mặt của ion hay
nguyên tố này thường cản trở việc xác định các nguyên tố khác. Đo đó, dù có yêu cầu hay
không, với một mẫu chưa biết thành phần thường phải tiến hành PTĐT trước để chọn được
phương pháp PTĐL thích hợp và cho kết quả chính xác. Các phương pháp phân tích định tính
và định lượng cho phép xác định hàm lượng các nguyên tố riêng rẽ trong các mẫu phân tích
được gọi là phương pháp phân tích nguyên tố, để xác định các nhóm chức gọi là phân tích nhóm chức.
Hóa phân tích là một ngành có vai trò quan trọng để hỗ trợ và tạo điều kiện thuận lợi
cho việc phát triển của các ngành khoa học khác như: Địa chất, khoáng vật, vật lý, sinh vật, y
dược, kỹ thuật hóa học, môi trường, nông nghiệp.. Hóa phân tích còn là cơ sở cho việc kiểm
nghiệm hóa học trong nghiên cứu và sản xuất (kiểm tra nguyên liệu, bán thành phẩm, và
thành phẩm), bên cạnh đó dự vào hóa phân tích có thể xây dựng các phương pháp kiểm tra tự
động trong các quá trình sản xuất.
Cùng với sự phát triển mạnh mẽ của các ngành khoa học, vai trò của hóa phân tích ngày
càng nâng cao, yêu cầu với ngành và người làm phân tích ngày càng khắt khe hơn. Ngành 2
phân tích phải luôn luôn phát triển theo kịp đà phát triển của xã hội. Với người phân tích phải
có kiến thức về các môn toán, lý, hóa, hóa lý và tin học để có thể nắm vững các nguyên tắc
của các phương pháp, có thể đi sâu và các phương pháp mới trên căn bản sẵn có. Ngoài ra,
trong phần thực nghiệm, người phân tích cần có những đạo đực như cẩn thận, kiên nhẫn,
chính xác, sạch sẽ, trung thực và có khả năng phán đoán kết quả phân tích.
1.3. Phân loại các phương pháp phân tích
Có nhiều các phân loại các phương pháp phân tích, tuy nhiên phổ biến nhất là các phân loại
dựa vào bản chất (đặc điểm) của phương pháp hoặc dựa vào khối lượng của mẫu đem phân tích
1.3.1. Dựa vào khối lượng mẫu đem phân tích
Phân tích thô (phân tích lượng lớn): Lượng mẫu từ 0,1- 10 g hay 1-10 ml. Dụng cụ cỡ
50-500 mL và tách chất rắn khỏi chất lỏng bằng cách lọc.
Phân tích bán vi lượng: Lượng mẫu từ 0,01- 0,1 g hay 0,01- 0,1 mL, dùng dụng cụ < 1
ml thường tách chất rắn khỏi chất lỏng bằng ly tâm.
Phân tích vi lượng: Lượng mẫu lấy từ 1 mg- 10 mg hay 1-10 µl.
Phương pháp siêu vi lượng: Lượng mẫu cỡ microgam (< 10-6g hay < 1 µl)
1.3.2. Dự vào hàm lượng của chất phân tích
Phân tích đa lượng: Bao gồm phân tích lượng lớn (hàm lượng chất khảo sát 0,1-100%)
và phân tích lượng nhỏ (hàm lượng chất khảo sát 0,001-0,1%).
Phân tích vi lượng (phương pháp phân tích vết): Khi hàm lượng chất phân tích <0,01%.
1.3.2. Dựa vào bản chất của phương pháp
Phương pháp hoá học: Dựa vào tính chất hoá học để phân tích, dùng phản ứng hóa
học để chuyển cấu tử phân tích thành hợp chất mới có tính chất đặc trưng. Dựa vào tính chất
này ta có thể xác định đượng sự hiện diện và hàm lượng của cấu tử cần phân tích.
Phương pháp hoá học là phương pháp đã pháp phân tích cổ điển, thường chỉ xác định
được các hàm lượng tương đối lớn. Nói chung là tốn thời gian, và độ nhạy không cao. Phương
pháp phân tích hoá học gồm phân tích thể tích và phân tích khối lượng.
Ví dụ: Trong môi trường NH3, với hàm lượng thích hợp Ni2+ tham gia phản ứng hóa
học với dimetyl glyoxim (DMG) cho xuất hiện kết tủa màu đỏ son. Như vậy, khi cho dung
dịch DMG tác dụng với dung dịch phân tích: 3
- Nếu dung dịch xuất hiện màu đỏ son, kết luận có Ni2+ trong mẫu phân tích.
- Tách và cân kết tủa ta xác định được hàm lượng Ni2+ trong mẫu được gọi là phân tích định lượng.
Phương pháp phân tích vật lý: Là nhóm các phương pháp để phân tích xác định tính
chất, thành phần, hàm lượng của các chất nghiên cứu mà không cần sử dụng các phẩn ứng hóa
học. Các phương pháp này có thể sử dụng các tính chất quang, điện, từ, nhiệt, hoặc các tính
chất vật lý khác. Phương pháp phân tích vật lý có ưu điểm so với phương pháp phân tích hóa
học như có thể phân tích được các chất khó bị tác bởi phương pháp hóa học, dễ áp dụng cho
các quá trình tự động hóa.
Phương pháp hóa lý: Dựa trên sự kết hợp giữa phương pháp hóa học và phương pháp
vật lý. Sau khi thực hiện phản ứng hóa học giữa chất phân tích và thuốc thử, dựa vào việc đo
tính chất vật lý của hợp chất thu được hay dung dịch tạo ra để định tính hoặc định lượng mẫu phân tích.
Phương pháp phân tích hóa lý và vật lý là phương pháp phát triển sau phương pháp hóa
học, nhưng các phương pháp này lại được phát triển với tốc độ nhanh, được sử dụng ngày
càng rộng rãi trong các phòng phân tích, các phòng thí nghiệm nghiên cứu khoa học và ngay
cả trong các phòng thí nghiệm của các nhà máy và xí nghiệp.
Nguyên tắc chung của phương pháp vật lý và hóa lý là dùng các biện pháp tích hợp
tác động lên mẫu nghiên cứu và ghi nhận sự thay đổi của các thông số hóa lý của mẫu nghiên
cứu từ đó xác định thành phần và hàm lượng của mẫu. Để quan sát và ghi nhận các thông số
hóa lý đòi hỏi phải sử dụng các dụng cụ và các thiết bị tinh vi, phức tạp, đắt tiền. Do đó,
phương pháp phân tích hóa lý thường được gọi là các phương pháp phân tích công cụ, thường
được chia thành các nhóm sau đây: (1) Phương pháp phân tích quang phổ; (2) phương
pháp phân tích điện hóa; (3) phương pháp phân tích sắc ký; (4) các phương pháp phân tích khác. 1.4. Kết luận
Nói chung phân tích là một quá trình phức tạp, nhiều khi phải tiến hành qua nhiều giai
đoạn với rất nhiều thao tác, sử dụng rất nhiều phương tiện khác nhau và trong nhiều trường
hợp phải kết hợp nhiều phương pháp khác nhau mới có thể cho kết quả chính xác được. 4
CHƯƠNG 2. GIỚI THIỆU VỀ PHƯƠNG PHÁP PHÂN TÍCH THỂ TÍCH 2.1. Định nghĩa
Phương pháp phân thể tích là một phương pháp phân tích định lượng hoá học dựa vào
việc đo thể tích của dung dịch thuốc thử đã biết nồng độ chính xác cần dùng để tác dụng
vừa đủ với chất cần phân tích cũng ở dạng dung dịch, từ đó tìm được nồng độ chất cần phân tích.
Ví dụ: Muốn xác định nồng độ chất A, ta dùng một dung dịch chất B đã biết nồng độ
chính xác để xác định.
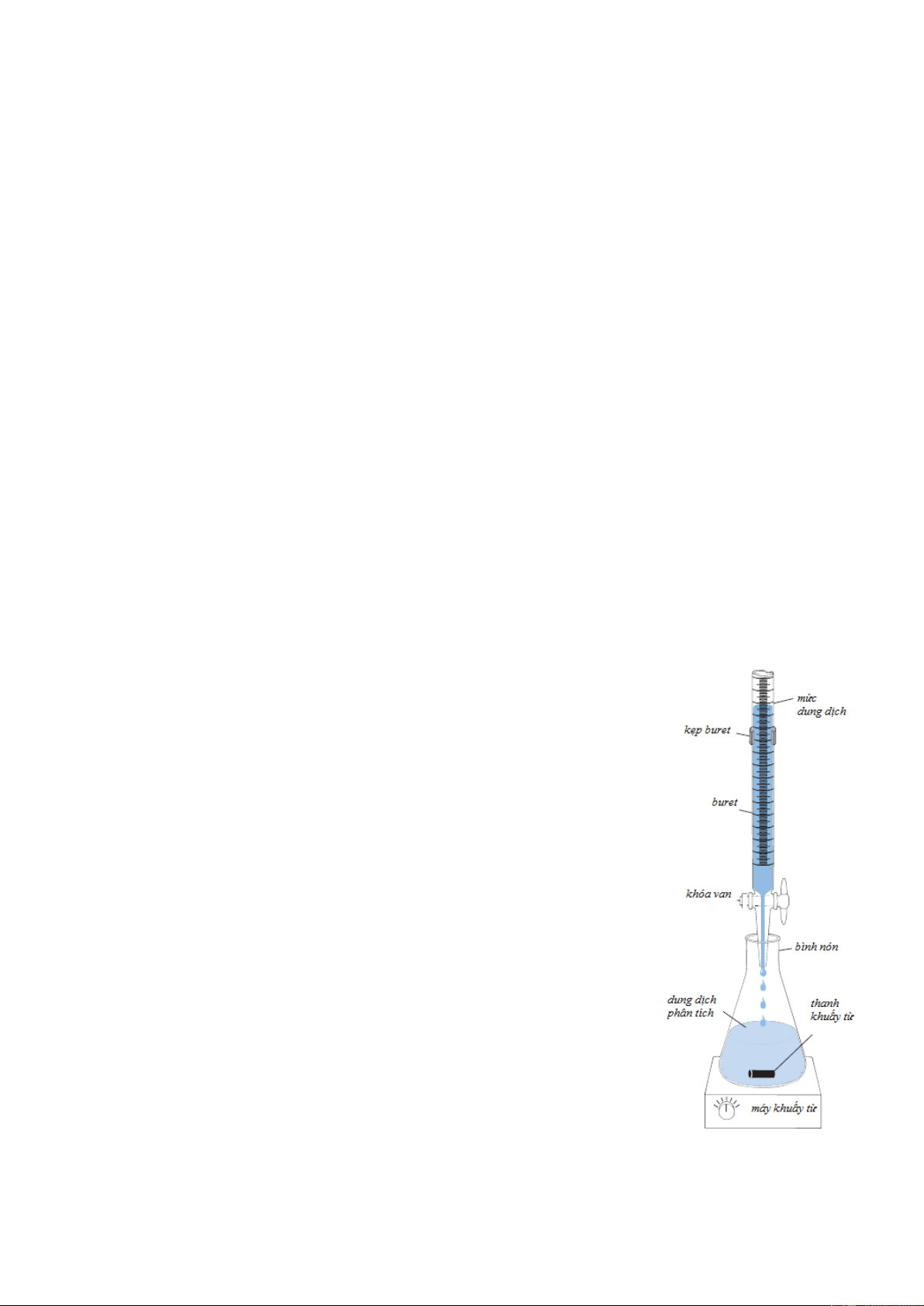
Lấy một thể tích chính xác dung dịch A cho vào bình tam giác, dung dịch B nạp vào
buret. Cho từ từ dung dịch B tác dụng với dung dịch A đến khí dung dịch B tác dụng vừa đủ
với dung dịch A thì dừng lại. Dựa vào thể tích dung dịch B thu được, có thể tìm được nồng độ
dung dịch A. Phản ứng xảy ra như sau: A+B = C +D (2.1)
Câu hỏi: Làm thế nào để biết được thời điểm dung dịch B tác
dụng vừa đủ dung dịch A?
Dung dịch B đã biết nồng độ chính xác gọi là dung dịch chuẩn.
Dung dịch A chưa biết nồng độ gọi là dung dịch phân tích.
Phương trình 2.1 gọi là phương trình (phản ứng) chuẩn độ.
Quá trình thêm từ từ chất B tác dụng với chất A gọi là quá
trình chẩn độ hay quá trình định phân.
Thời điểm chất B tác dụng vừa đủ với chất A gọi là điểm
tương đương (ĐTĐ).
Để quá trình chuẩn độ cho kết quả chính xác, chúng ta cần xác
định chính xác điểm tương. Tuy nhiên, thực tế nhiều trường hợp
người chúng ta không xác định đúng được điểm tương đương mà chỉ
có thể xác định được thời điểm trước hoặc sau điểm tương đương
môt chút (trong giới hạn sai số cho phép) gọi là điểm kết thúc chuẩn
độ. Điểm này càng gần điểm tương thì cho kết quả càng chính xác. 5
2.2. Yêu cầu đối với phản ứng chuẩn độ
Các phản ứng dùng trong phân tích thể tích phải đáp ứng chặt chẽ các yêu cầu sau đây.
- Phản ứng phải xảy ra hoàn toàn và vận tốc lớn.
- Phản ứng phải xảy ra theo đúng phương trình chuẩn độ, đúng hệ số tỷ lượng, thành
phần sản phẩm phải xác định và không đổi dù thay đổi điều kiện thực hiện thí nghiệm.
- Phải có khả năng xác định được điểm tương đương.
2.3. Phân loại các phương pháp phân tích thể tích
Phương pháp phân tích thể tích là phương pháp đơn giản nhanh chóng có thể xác định
được nhiều nguyên tố, có độ nhạy và độ chính xác cao đối với hàm lượng lớn nên được dùng
rộng rãi trong nhiều lĩnh vực khác nhau. Dựa vào các phản chuẩn độ trong phương pháp phân
tích có thể chia phương pháp phân tích thể tích làm 4 loại:
- Phương pháp trung hoà (axit-bazơ): Dựa vào phản ứng giữa axit và bazơ theo lý
thuyết axit-bazơ của Bronsted-Lowry. Ta có thể dùng một chất chuẩn axit để xác định 1
bazơ, hoặc một dung dịch chuẩn bazơ để xác định 1 axit. A1 + B2 = A2 + B1 (2.2)
- Phương pháp chuẩn độ phức chất: Dựa vào phản ứng tạo phức giữa ion kim loại với
ligand (thuốc thử). Thường dùng để xác định nồng độ của kim loại. Men+ + L ⇋ MeLn (2.3)
- Phương pháp chuẩn độ oxy hóa khử: Dựa vào phản ứng oxy hóa khử (là phản ứng
có sự trao đổi eletron). Ta có thể dùng một chất khử để xác định chất oxy hóa hoặc ngược lại. Oxh1 + kh2 = kh1 + Oxh2 (2.4)
- Phương pháp chuẩn độ kết tủa: Dựa vào phản ứng tạo hợp chất ít tan. Thường dùng
để xác định các dung dịch muối kim loại. Me+ + A– = MA↓ (2.5)
2.4. Khối lượng mol và đương lượng gam
- Khối lượng mol là khối lượng của 6,02.1023 phân tử (nguyên tử, ion) hay còn gọi là phân tử gam.
Ví dụ: 1 mol Na = 23 (g); 1 mol H2 = 2 (g); 1 mol O2 = 32 (g); 1 mol O = 16 (g)
- Đương lượng gam (mol đương lượng) là số đại lượng về mặt hoá học tương đương
với một mol H+, 1 mol Na, hay nửa mol O2-. Đ M = n
M là khối lượng mol; n là là giá trị phụ thuộc vào từng phản ứng cụ thể. 6
Đối với phản ứng axit-bazơ n là số ion H+ mà một phần tử (phân tử, nguyên tử, ion) axit
nhường đi hoặc là số ion H+ mà một phần tử bazơ nhận vào. 𝑀𝐻 H 3𝑃𝑂4 3PO4 + NaOH = NaH2PO4 + H2O Đ𝐻 = 3𝑃𝑂4 1 𝑀𝐻 H 3𝑃𝑂4 3PO4 + 2NaOH = Na2HPO4 + 2H2O Đ𝐻 = 3𝑃𝑂4 2 𝑀𝐻 H 3𝑃𝑂4 3PO4 + 3NaOH = Na3PO4 + 3H2O Đ𝐻 = 3𝑃𝑂4 3 𝑀 Ca(OH) 𝐶𝑎(𝑂𝐻)2
2 + 2HCl = CaCl2 + 2H2O Đ𝐶𝑎(𝑂𝐻) = 2 2 𝑀 Ca(OH) 𝐶𝑎(𝑂𝐻)2 2 + HCl = CaOHCl + H2O Đ𝐶𝑎(𝑂𝐻) = 2 1
Đối với phản ứng oxi hóa khử: n là số electron mà 1 phần tử chất oxy hóa nhận vào hay số
e mà một phần tử chất khử nhường đi.
5 H2C2O4 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 +10 CO2 + 8H2O M MnO - 4 + 5e + 8H+ = Mn2+ + 4 H2O ĐKmnO4= 5 M C 2- 2O4 = 2CO2 + 2e DH2C2O4 = 2
Đối với phản ứng trao đổi: n là số điện tích tham gia trao đổi trong phản ứng, n không
những phụ thuộc vào từng chất mà còn phụ thuộc vào từng phản ứng
3 ZnSO4 + 2 K4[Fe(CN)6] = Zn3K2[Fe(CN)6] + 3 K2SO4 M M ĐZnSO4 = ; ĐK4[Fe(CN)6] = 2 3
2.5. Cách biểu diễn nồng độ trong hóa phân tích
Nồng độ phần trăm khối lượng (wt.%): Là số gam chất tan có trong 100 g dung dịch.
Phần trăm khối lượng =
𝑘ℎố𝑖 𝑙ượ𝑛𝑔 𝑐ℎấ𝑡 𝑡𝑎𝑛 × 100%
𝑘ℎó𝑖 𝑙ượ𝑛𝑔 𝑐ủ𝑎 𝑐ℎấ𝑡 ℎ𝑎𝑦 ℎỗ𝑛 ℎợ𝑝
Ví dụ:(1) Dung dịch HCl 10% tức là trong 100g dung dịch HCl có 10 g HCl nguyên chất.
(2) Dung dịch CH3COOH 10 wt%: trong 100g dung dich có 10g axit acetic va 90g nước.
Phần trăm thể tích (vol%) được định nghĩa như sau: Phần trăm thể tích =
𝑡ℎể 𝑡í𝑐ℎ 𝑐ℎấ𝑡 𝑡𝑎𝑛 × 100
𝑡ổ𝑛𝑔 𝑡ℎể 𝑡í𝑐ℎ 𝑑𝑢𝑛𝑔 𝑑ị𝑐ℎ
Để tránh nhầm lẫn, đơn vị đo thường được đi kèm. Tuy nhiên, nếu không viết đơn vị, chúng
ta có thể hiểu là phần trăm về khối lượng.
Nồng độ mol/l: Số mol chất tan có trong 1 lit dung dịch
Ví dụ: (1) dung dịch NaOH 0,1 M tức là trong một lít dung dịch NaOH có 0,1 mol NaOH. 7
(2) Nước biển chứa 2,7 g muối ăn trong 100 ml. Hãy tính nồng độ của muối ăn
trong nước biển ra đơn vị mol/l.
Khối lượng mol của muối ăn = 22,99 g/mol (Na) + 35,45 g/mol (Cl) = 58,44 g/mol
Nồng độ mol/l của muối ăn trong nước biển là 2,7𝑔𝑔 𝑚𝑜𝑙 𝑁𝑎𝐶𝑙 58,44( ) C 𝑚𝑜𝑙 NaCl = = = 0,46M
𝑙𝑖𝑡 𝑛ướ𝑐 𝑏𝑖ể𝑛 100×10−3𝑙𝑖𝑡
Nồng độ đương lượng: Số mol đương lượng chất tan có trong một lit dung dịch, ký hiệu là N
Ví dụ: (1) H2SO4 0.1N: trong 1 lít dung dịch H2SO4 có 0,1 mol đương lượng 𝑀 (Đ𝐻
= = 49 g/mol đương lượng) → 0,1×49 = 4,9g 2𝑆𝑂4 2
(2) Dung dich KMnO4 0,1N, Đ=𝑀 → Đ=158 = 31,6 g/mol đương lượng 5 2
→ có 0,1×31,6 = 3,16g KMnO4
Độ chuẩn Ti: Số gam chất tan có trong một ml dung dịch
TAgNO3 = 0,001: trong 1 mL dung dịch có 0,001 g AgNO3
Độ chuẩn theo chất cần xác định TA/B: Là số gam chất B tác dụng vừa đủ với 1 ml dung dịch chuẩn chất A. Cr 2-
2O7 + Fe2+ + 14 H+ = Cr3+ + Fe3+ + 7 H2O
TK2Cr2O7/Fe2+ = 2,8.10-3 g/ml tức là cứ 1ml dung dịch K2Cr2O7 tác dụng hết 2,8.10-3 Fe2+.
Đôi khi thành phần nguyên tố hay hợp chất được diễn tả ở dạng: phần triệu - parts per
million (ppm) hay phần tỷ - parts per billion (ppb), có nghĩa là số phần triệu hay phần tỉ
gam của nguyên tố hay hợp chất phân tích trên tổng số gam dung dịch hay hỗn hợp.
𝑘ℎố𝑖 𝑙ượ𝑛𝑔 𝑐ủ𝑎 𝑐ℎấ𝑡 𝑝ℎâ𝑛 𝑡í𝑐ℎ ppm = ×106
𝑘ℎố𝑖 𝑙ượ𝑛𝑔 𝑚ẫ𝑢
𝑘ℎố𝑖 𝑙ượ𝑛𝑔 𝑐ủ𝑎 𝑐ℎấ𝑡 𝑝ℎâ𝑛 𝑡í𝑐ℎ ppb = ×109
𝑘ℎố𝑖 𝑙ượ𝑛𝑔 𝑚ẫ𝑢
Do tỉ khối của các dung dịch là gần như 1,00 g/ml, chúng ta thường coi gần đúng 1
gam nước với 1 ml nước. Do vậy 1 ppm tương ứng với 1µg/ml (= 1mg/l) và 1 ppb tương ứng với 1ng/ml (=1 µg/l).
2.6. Tính toán trong phân tích thể tích
Định luật đương lượng: Theo định luật tác dụng đương lượng nếu A và B tác dụng với
nhau hoàn toàn, số đương lượng A = số đương lượng B 8 A+ B = C+ D
Nếu A và B đều ở dạng dung dịch: VA ml dung dịch A nồng độ NA tác dụng vừa hết
VB ml dung dịch B nồng độ NB, ta có VA.NA = VB. NB
Ví dụ 1: Chuẩn độ 20,00 mL dung dịch HCl cần dùng 16,00 mL NaOH nồng độ
0,1000N. Xác định nồng độ HCl?
HCl + NaOH = NaCl + H2O N 16,00.0,1000
HCl = 𝑁𝑁𝑎𝑂𝐻.𝑉𝑁𝑎𝑂𝐻 = = 0,0800N 𝑉𝐻𝐶𝑙 20,00
Nếu một trong hai chất là chất rắn: MA gam chất A tác dụng vừa hết với VB mL chất B. Xác định NB? 𝑚𝐴 𝑁 = 𝐵𝑁𝐵 Đ𝐴 1000
Ví dụ 1: Hòa tan 0,1060g Na2CO3 trong một thể tích nước (tan hết Na2CO3), rồi đem
định phân bằng HCl thì tiêu tốn hết 16,00 mL HCl. Xác định NHCl?
Na2CO3 + 2HCl = 2 NaCl + H2O + CO2 𝑀 106 Đ 𝑁𝑎2𝐶𝑂3 𝑁𝑎 = =
= 53 (g/mol đương lượng) 2𝐶𝑂3 2 2
→ số đương lượng A (Na2CO3) = a/ĐA = 0,106/53 = 0,0020
Số đương lượng N = 𝑁𝐻𝐶𝑙×16,00 1000
→ 𝑁𝐻𝐶𝑙×16,00 0,0020×1000 = 0,0020 → NHCl = = 0,13N 1000 16,00
Ví dụ 2: Hòa tan 0,2004 g Na2B4O7.10H2O bằng nước cất trong bình nón, rồi tiến hành
chuẩn độ bằng axit HCl sử dụng chất chỉ thị metyl đỏ. Khi chất chỉ thị đổi màu, ghi được thể
tích HCl tiêu tốn là 11,20 ml. Hãy xác định nồng độ axit HCl (N, g/l)? Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3
𝑚𝑁𝑎2𝐵4𝑂7.10𝐻2𝑂 𝑁
= 𝐻𝐶𝑙 × 𝑉𝐻𝐶𝑙 (𝑚𝑙) Đ 𝑚𝑙
𝑁𝑎2𝐵4𝑂7.10𝐻2𝑂 1000 ( ) 𝑙 𝑚𝑙 1000 ( ) Thay số: N 0,2004𝑔 𝑙 HCl = 𝑔 × = 0,09383 N 190,7 ( ) 11,20 𝑚𝑙
𝑚𝑜𝑙 đươ𝑛𝑔 𝑙ượ𝑛𝑔
CHCl = NHCl × ĐHCl = 0,09383 × 36,461 = 3,421 (g/l)
Nếu cả hai chất đều ở dạng rắn: 𝑚 𝑚 𝐴 = 𝐵 Đ𝐴 Đ𝐵 9 10



