



Preview text:
Bμi tËp ho¸ v« c¬ 2
Ch−¬ng I: Phøc chÊt
1. ViÕt c«ng thøc cña phøc gi÷a ion Cr2+ víi H O vμ víi en vμ h·y dù ®o¸n sè e ®éc th©n 2
(unpaired) trong tõng phøc biÕt H O lμ phèi tö tr−êng yÕu (a weak - field ligand), en lμ phèi tö 2
tr−êng m¹nh (a strong – field ligand).
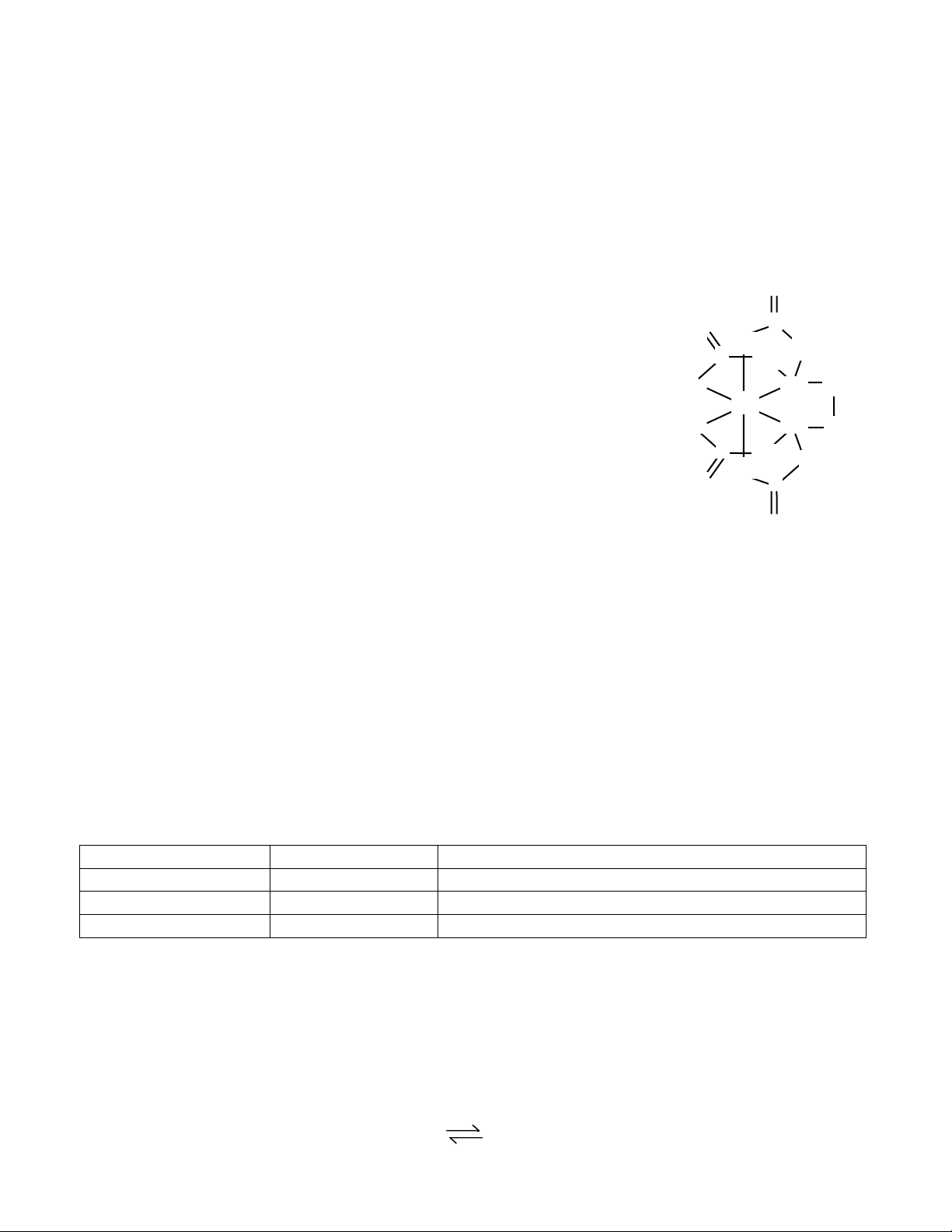
2. EDTA lμ phèi tö ®a cμng (polidentate) th−êng ®−îc dïng ®Ó xö lý sù O
®éc h¹i cña ch× do nã t¹o ®−îc phøc rÊt bÒn víi ch× (xem h×nh bªn).
[Pb(EDTA)]2- cho biÕt DLPT cña EDTA vμ SPT cña Pb2+ trong phøc O O: C nμy. CH C CH 2 2 :N CH
3. Ion [Ni(CN) ]2- lμ nghÞch tõ, cßn ion [NiCl ]2- thuËn tõ. H·y tr×nh bμy O: 2 4 4 Pb
gi¶n ®å ph©n t¸ch tr−êng tinh thÓ ®èi víi tõng phøc. BiÕt chóng cã cÊu O: :N CH
h×nh h×nh häc (geometry): tø diÖn hoÆc vu«ng ph¼ng. 2 C CH2 CH O: 2
4. Sù hÊp thô max cña phøc [Co(NH ) ]3+ t¹i λ = 470nm. H·y dù ®o¸n O C 3 6
mμu cña phøc nμy vμ tÝnh Δ (KJ.mol). o O
5. Bμi tËp 14.1 (S¸ch bμi tËp trang 96)
Momen tõ cña [FeF ]3- lμ 6μ vμ cña ion [Co(NH ) ]3+ b»ng kh«ng. h·y m« t¶ sù t¹o 6 B 3 6
thμnh hai phøc trªn tõ nh©n trung t©m vμ c¸c phèi tö theo c¸c thuyÕt liªn kÕt trong phøc chÊt.
Phøc chÊt nμo lμ spin cao , spin thÊp? Z = 26, Z = 27. Fe Co
6. Bμi tËp 14.5 (S¸ch bμi tËp trong 96) TÝnh n¨ng
l−îng lμm bÒn bëi tr−êng tinh thÓ cña hai ion phøc sau: [Co(NH ) ]2+; Δ = 10 100 cm-1 P = 22 500 cm-1 3 6 o [Co(NH ) ]3+; Δ = 22 900 cm-1 P = 21 000 cm-1 3 6 o
Tõ kÕt qña thu ®−îc h·y dù ®o¸n xem liªn kÕt trong ion phøc nμo bÒn h¬n.
7. Vμo n¨m 1895 mét sinh viªn ®iÒu chÕ ®−îc 3 hîp chÊt phèi trÝ (Coordination compound)
chøa crom, víi c¸c tÝnh chÊt sau: C«ng thøc Mμu s¾c
Sè ion Cl- trong dung dÞch / mét ®¬n vÞ c«ng thøc a. CrCl .6H O TÝm 3 3 2 b. CrCl .6H O Lôc s¸ng 2 3 2 c. CrCl .6H O Lôc sÉm 1 3 2
H·y viÕt c¸c c«ng thøc “®óng” cho c¸c hîp chÊt trªn.
8. Ion Cu2+ t¹o ®−îc víi NH 4 phøc øng víi c¸c h»ng sè bÒn β , β , β , β cã c¸c gi¸ trÞ lgβ = 3 1 2 3 4 1
4,13; lgβ = 7,61; lgβ = 10,48; lgβ = 12,59. TÝnh pK , pK , pK , pK . (K , K , K , K lμ c¸c 2 3 4 1 2 3 4 1 2 3 4
h»ng sè ph©n li (hay h»ng sè kh«ng bÒn) nÊc cña phøc [Cu(NH ) ]2+. 3 4
9. Bμi tËp 14.12 (S¸ch bμi tËp trang 97)
Cã dung dÞch [Cu(NH ) ]2+ 1M. Ion phøc nμy bÞ ph©n huû trong m«i tr−êng axit theo 3 4
ph¶n øng sau: [Cu(NH ) ]2+ + 4H+ Cu2+ + 4NH + 3 4 4 1
TÝnh pH cña dung dÞch ë ®ã 99,9% ion phøc bÞ ph©n huû. BiÕt r»ng h»ng sè bÒn tæng cña
ion phøc lμ β =1012 vμ h»ng sè ®iÖn li axit K cña NH + lμ 10-9,2. 4 a 4
Ch−¬ng II. TÝnh chÊt chung cña c¸c nguyªn tè d
1. V× sao c¸c nguyªn tè chuyÓn tiÕp ®Òu lμ kim lo¹i vμ chóng cã nhiÒu sè oxi ho¸ h¬n so víi c¸c kim lo¹i ë nhãm A.
2. TÝnh bÒn cña sè oxi ho¸ d−¬ng max t¨ng hay gi¶m theo chiÒu tõ Sc ®Õn Mn vμ theo chiÒu tõ Mn ®Õn Re? Gi¶i thÝch.
3. a. S¾p xÕp theo chiÒu Δ t¨ng cña c¸c phøc sau: [V(H O) ]2+; [Cr(H O) ]2+; [Mn(H O) ]2+ . o 2 6 2 6 2 6 Gi¶i thÝch?
b. 3 phøc [Mn(H O) ]2+ ; [MnF ]4 - vμ [Mn(CN) ]4+ cã c¸c th«ng sè ph©n t¸ch Δ øng víi 2 6 6 6 o
c¸c gi¸ trÞ 101,4; 308,9; 90,2 KJmol-1
- H·y ghi gi¸ trÞ cña Δ cho tõng phøc, c¨n cø vμo ®©u ghi ®−îc nh− vËy o
- N¨ng l−îng ghÐp cÆp P cña Mn2+ lμ 304,2 KJmol-1. H·y cho biÕt phøc nμo lμ phøc thÊp spin, cao spin.
Ch−¬ng iii. Nhãm viib
1. C©u 19.5 (S¸ch bμi tËp trang 112)
ViÕt c¸c ph−¬ng tr×nh ph¶n øng sau d−íi d¹ng ion (nÕu cã) vμ ph©n tö:
a. Cr (SO ) + NaOH(dd, thiÕu vμ d−) 2 4 3
b. Na [Cr(OH) ] + thªm tõ tõ H SO lo·ng cho tíi d− 3 6 2 4
c. Na [Cr(OH) ] + Br + NaOH(dd) 3 6 2 d. Cr (SO ) + Na CO (dd) 2 4 3 2 3 e. K CrO K +? Cr O 2 4 2 2 7 +?
g. K Cr O + HCl ®Æc (SO + H SO lo·ng) 2 2 7 2 2 4 h. (X = Cr, Mo, W): X + O → to 2 Cr3+ Cr - 0,41V 2+ 2. Cr - 0,91V TCr(OH) = 7.10-31 3 a. TÝnh εoCr(OH) /Cr 3
b. TÝnh thÕ ®iÖn cùc cña ®iÖn cùc sau: Cr/dung dÞch b·o hoμ Cr(OH) 3
3. Trong dung dÞch tån t¹i c©n b»ng sau ë 25oC 2CrO 2- 2- 4 + 2H+ Cr 2O7 + H 2O K = 1014,4
Mét dung dÞch Cromat 1M th× 90% crom n»m ë d¹ng cromat vμ 10% ë d¹ng dicromat. TÝnh pH cña dung dÞch.
4. A lμ dung dÞch K Cr O 0,1M 2 2 7 a. TÝnh pH cña dugn dÞch A
b. Thªm x mol NaOH vμo mét lit dung dÞch A (coi thÓ tÝch kh«ng thay ®æi) 0,02 <
x < 0,18. H·y lËp biÓu thøc pH = f(x) vμ tÝnh pH khi x = 0,1mol 2
c. Khi thªm 20ml dung dÞch BaCl vμo 20ml dung dÞch A, sÏ t¹o ra kÕt tña BaCrO 2 4
(Tt = 10 – 9,7). TÝnh pH trong dung dÞch thu ®−îc.
Ch−¬ng iii: nhãm viib
1. C©u 20.1 (S¸ch bμi tËp trang 115) LÊy c¸c vÝ dô minh ho¹:
a. TÝnh kim lo¹i gi¶m dÇn tõ trªn xuèng trong nhãm
b. TÝnh bÒn cña c¸c hîp chÊt chøa nguyªn tè cã sè oxi ho¸ +II gi¶m dÇn, ®ång thêi
tÝnh bÒn cña c¸c hîp chÊt chøa nguyªn tè cã sè oxi ho¸ lín nhÊt +VII t¨ng dÇn tõ mangan ®Õn reni.
2. C©u 20.2 (S¸ch bμi tËp trang 115)
Gi¶n ®å thÕ khö chuÈn cña mangan vμ tali nh− sau: MnO - 0,56V 2- 2,26V 0,95V 1,51V -1,18V 4 MnO4 MnO2 Mn3+ Mn2+ Mn Tl3+ Tl 1,25V + Tl -0,34V
a. Ion nμo kh«ng bÒn trong m«i tr−êng axit? ViÕt ph−¬ng tr×nh ph©n huû cña nã.
b. Dù ®o¸n s¶n phÈm cña ph¶n øng sau: MnO - + Tl+ + H+ 4
3. Hoμn thμnh c¸c ph¶n øng sau: a. Mn + H SO (H SO , to) 2 4 lo·ng 2 4 ®Æc
b. M (Mn, Te, Re) + HNO3 lo·ng c. MnSO + NaOH 4
d. MnO + KNO + K CO (nãng ch¶y) hay NaOH (nãng ch¶y) to cao 2 3 2 3 e. K MnO + CO (Cl ) 2 4 2 2 g. KMnO + KNO + H SO 4 2 2 4
4. Bμi tËp 20.5 (S¸ch bμi tËp trang 116)
Dung dÞch Mn2+10 – 2M ®−îc b·o hoμ b»ng H S nång ®é 0,1M. Hái cã kÕt tña MnS 2 kh«ng? biÕt r»ng Tt
= 10 – 15 vμ K vμ K cña H S lÇn l−ît lμ 10 -7 vμ 10 -14. MnS 1 2 2
5. Bμi tËp 20.8 (S¸ch bμi tËp trang 116)
Ion MnO 2- tù ph©n huû trong dung dÞch nh− sau: 4
3MnO 2- + 2H O 2MnO - + MnO ↓ + 4OH- 4 2 4 2
a. Hái ion MnO 2- bÌn nhÊt trong m«i tr−êng nμo? 4
b. TÝnh h»ng sè c©n b»ng K ë 25oC cña ph¶n øng tù ph©n huû MnO 2- trong hai m«i 4
tr−êng (pH = 0 vμ pH = 14) xem cã phï hîp víi dù ®o¸n ë c©u a kh«ng? Sè liÖu εo
ë c©u 2 (bμi tËp 20.2 s¸ch bμi tËp trang 115) 3
6. ChuÈn ®é 10cm3 dung dÞch H O trong m«i tr−êng axit (pH = 0) b»ng dung dÞch 2 2
KMnO 0,1N. T¹i ®iÓm t−¬ng ®−¬ng thÓ tÝch dung dÞch KMnO 0,1N lμ V = 11cm3. 4 4 e
a. ViÕt ph−¬ng tr×nh ph¶n øng vμ tÝnh nång ®é mol ®−¬ng l−îng cña H O vμ thÓ tÝch 2 2 O tho¸t ra (®ktc). 2
b. NÕu nhóng ®iÖn cùc Pt vμo dung dÞch H2O2 trªn ë 25oC thÕ ®iÖn cùc sÏ thay ®æi nh− V
thÕ nμo theo x = Ve (V lμ thÓ tÝch (ml) dung dÞch KMnO4 0,1N thªm vμo) khi 0 < x < 1. Coi PO2 = 1atm
ch−¬ng iv: nhãm viiib
1. C©u 21.8 (S¸ch bμi tËp trang 121)
ViÕt c¸c ph−¬ng tr×nh ph¶n øng sau d−íi dn¹g ion (nÕu cã) vμ ph©n tö (M: Fe, Co, Ni): a. M + O 2 b. M + X (X: halogen) 2 c. M + S d. M + H SO (lo·ng) 2 4 e. M + HNO (lo·ng) 3
g. MSO + NaOH (dd, trong kh«ng khÝ) 4 h. Ni(OH) + Cl + NaOH d− 2 2 i. M(OH) + H SO lo·ng 3 2 4 k. MSO + KMnO + H SO lo·ng 4 4 2 4 l. FeSO + KCN (dd, d−) 4
m. CoSO + NH (®Æc, cã mÆt NH Cl d− trong kh«ng khÝ) 4 3 4 n. NiSO + NH (dd, d−) 4 3
2. Phøc Fe(SCN)2+ cã h»ng sè ®iÖn ly K = 10-2, trong dung dÞch sÏ cã mμu ®á nh×n thÊy
®−îc khi nång ®é ≥ 10-5.
a. Thªm mét l−îng nhá muèi FeCl vμo dung dÞch KSCN 10-2M. TÝnh [Fe3+] khi nhËn 3
biÕt ®−îc mμu ®á cña phøc trªn.
b. Thªm KSCN vμo dung dÞch A chøa AgNO 0,01M vμ Fe(NO ) 10-4M th× sÏ t¹o ra kÕt 3 3 3
tña AgSCN↓ (Tt = 10-12). TÝnh [Ag+] khi trong dung dÞch cã mμu ®á cña phøc Fe(SCN)2+.
3. a. TÝnh pH ®Ó trong dung dÞch FeCl 0,1M b¾t ®Çu kÕt tña Fe(OH) . BiÕt Tt = 3 3 Fe(OH)3 4.10-38.
b. Fe3+ lμ mét axit: Fe3+ + 2H O Fe(OH)2+ + H O+ : K = 10-2,2 2 3 a
Hái ë nång ®é nμo vμ pH b»ng mÊy sÏ b¾t ®Çu kÕt tña Fe(OH) . 3 4. Hoμn thμnh d·y sau: CoSO to +dd HNO3lo·ng 4 Co(OH)2 Co(OH)3 A B 4 Ch−¬ng vi. Nhãm ib
1. Bμi tËp 22.8 (S¸ch bμi tËp trang 130)
ViÕt c¸c ph−¬ng tr×nh ph¶n øng sau d−íi d¹ng ph©n tö vμ ion (nÕu cã): a. AgCl + Na S O (dd) 2 2 3 b. CuSO + KI (dd) 4 c. CuSO + KCN (d−) 4 d. Au(OH) + NaOH (dd) 3
e. M (Cu, Ag, Au) + HCl (HNO , H SO ) 3 2 4
2. Bμi tËp 22.4 (S¸ch bμi tËp trang 129)
T¹i sao tÝnh khö cña vμng t¨ng lªn khi trong dung dÞch cã mÆt ion Cl- hay ion CN-. LÊy vÝ dô minh ho¹.
3. Bμi tËp 22.10 (S¸ch bμi tËp trang trang 130)
Trong 1lÝt dung dÞch chøa 1mol AgNO vμ 2 mol NH : 3 3
a. TÝnh nång ®é c¸c ion Ag+, [Ag(NH ) ]+ vμ ph©n tö NH khi c©n b»ng. 3 2 3
b. Thªm HNO vμo dung dÞch trªn (thÓ tÝch dung dÞch hÇu nh− kh«ng bÞ biÕn ®æi). 3
TÝnh pH cña dung dÞch khi 99% [Ag(NH ) ]+ bÞ ph©n huû. 3 2
BiÕt β [Ag(NH ) ]+ = 107,2; K (NH +) = 10-9,2. 2b 3 2 a 4
4. Cho 0,001mol AgCl (Tt = 10-10) vμo mét lÝt n−íc, ph¶i thªm vμo mÊy mol NH ®Ó 3
®−îc dung dÞch trong suèt (coi thÓ tÝch kh«ng ®æi). BiÕt β [Ag(NH ) ]+ = 107,2. 2 3 2
5. Bμi tËp 22.14 (S¸ch bμi tËp trang 134)
Cho biÕt c¸c sè liÖu sau ë 25oC: εo(Au+/Au) = 1,7V; εo(O /H O) = 1,23V; h»ng sè 2 2
®iÖn li tæng cña ion phøc (Au[CN] )– l 7,04.10-40. Chøng minh r»ng khi cã mÆt ion CN 2
- trong dung dÞch kiÒm th× εo([Au(CN) - -
/Au) nhá h¬n εo(O /OH ), nghÜa lμ oxi oxi ho¸ 2 ®−îc vμng.
6. Dung dÞch A chøa ®ång thêi CuSO 0,1M, NaCl 0,2M, Cu bét d− vμ CuCl(r) d−. BiÕt 4
TCuCl = 10-7, εoCu2+/Cu+ = 0,15V; εoCu+/Cu = 0,52V;
a. Cho biÕt cã x¶y ra ph¶n øng sau kh«ng? Cu + Cu2+ + 2Cl- 2CuCl↓
b. TÝnh h»ng sè c©n b»ng cña ph¶n øng vμ nång ®é c¸c chÊt t¹i c©n b»ng.
7. Bμi tËp 22.19 (S¸ch bμi tËp trang 136)
Cho biÕt c¸c sè liÖu sau ë 25oC: o dε εo, V 1 , VK − dT Cu+ + e Cu 0,520 0,002 [Cu(NH ) ]+ + e Cu + 2NH - 0,110 0,003 3 2 3 Cu2+ + 2e Cu 0,34 5
a. TÝnh h»ng sè c©n b»ng ë 25oC cña ph¶n øng sau: Cu + Cu2+ 2Cu+
b. Mét dung dÞch Cu2+ 10-2M chøa Cu d−, tÝnh nång ®é Cu+ khi c©n b»ng.
c. TÝnh ΔGo, ΔHo vμ ΔSo ë 25oC cña ph¶n øng: Cu+ + 2NH [Cu(NH ) ]+ 3 3 2
ch−¬ng vii: nhãm iib
1. Bμi tËp 23.5 (S¸ch bμi tËp trang 138)
ViÕt c¸c ph−¬ng tr×nh ph¶n øng sau d−íi d¹ng ion (nÕu cã) vμ ph©n tö (M – c¸c nguyªn tè nhãm IIB):
a. M(NO) + NaOH (dd, thiÕu vμ d−) 3
b. MCl + NH (dd, thiÕu vμ d−) 2 3
c. Hg(NO ) + KI (dd, thiÕu vμ d−) 3 2
d. HgCl + SnCl (dd, thiÕu vμ d−) 2 2
e. K [HgI ] + NH Cl + KOH (dd) 2 4 4
g. Hg (NO ) + Na S dd (NaOH dd; KCN dd, thiÕu, d−; Cl ) 2 3 2 2 2
2. Bμi tËp 23.6 (S¸ch bμi tËp trang 139) Hg (l) Hg (k)
ViÖc ®o ¸p suÊt h¬i cña Hg ë c¸c nhiÖt ®é kh¸c nhau ®· thiÕt lËp ®−îc ph−¬ng tr×nh: 2010 lgP = -4,80 - + 3,88lgT Hg T
P ë ®©y ®o b»ng mmHg. NhiÖt ®é s«i chuÈn cña Hg lμ 631K. TÝnh ΔHo cña c©n b»ng trªn ë Hg nhiÖt ®é s«i. 3. Sn4+ Sn2+ Sn 0,15V -0,14V Hg2+ Hg+ H -0,14V g 0,85V
a. TÝnh K c©n b»ng cña ph¶n øng Hg 2+ Hg2+ + Hg 2
b. ViÕt ph¶n øng x¶y ra khi cho bét Sn vμo dung dÞch chøa Hg2+.
4. Bμi tËp 23.13 (S¸ch bμi tËp trang 145). Hg2+ t¹o víi I - 28 -
kÕt tña mμu ®á HgI (Tt = 10-
), nÕu d− I th× HgI tan t¹o thμnh [HgI ]2- 2 2 4 (β = 10 -30). 4®l
Thªm dung dÞch KI 1M vμo 10cm3 dung dÞch Hg2+ 10-2M. TÝnh thÓ tÝch v dung dÞch KI 1
cÇn thªm vμo ®Ó b¾t ®Çu kÕt tña HgI vμ thÓ tÝch v dung dÞch KI cÇn thªm vμo ®Ó HgI b¾t ®Çu 2 2 2
tan hÕt. TÝnh nång ®é c¸c ion trong dung dÞch khi c©n b»ng trong c¶ hai tr−êng hîp. 6



