






Preview text:
TẠI SAO CÁC NGUYÊN TỐ CẦN ĐƯỢC
SẮP XẾP 1 CÁCH TUẦN HOÀN?
CHƯƠNG 1- SỰ BIẾN THIÊN
TUẦN HOÀN, TÍNH CHẤT CÁC NGUYÊN • Dễ ghi nhớ
TỐ TRONG BẢNG TUẦN HOÀN
• Dự đoán các tính chất hóa học, vật lý 1 2
Định luật tuần hoàn Mendeleep
Tính chất của các nguyên tố và hợp chất
của chúng biến thiên tuần hoàn theo
chiều tăng của khối lượng nguyên tử.
Các nguyên tố còn thiếu
có khối lượng lần lượt là: 44, 68, 72, & 100 amu 3 4
Có trường hợp ngoại lệ
Khối lượng nguyên tử của nguyên tố đứng
trước lớn hơn khối lượng nguyên tử của nguyên tố đứng sau:
Ar(Z=18): 39,948 > K (Z= 19) : 39,698
Co (Z=27): 58,933> Ni(Z=28): 58,70
Te (Z= 52): 127,60> I (Z=53): 126,9015 5 6 BẢng tuÇn hoμn
HTTH THEO THUYẾT CẤU TẠO HIỆN ĐẠI I A II A III B IV B V B VI B VII B VIII B I B II B III A IV A V A VI A VII A VIII A 1 1 2 1 H H He 1.008 1.008 4.0026 3 4 5 6 7 8 9 10
Tính chất của các nguyên tố và hợp chất 2 Li Be B C N O F Ne 6.939 9.0122
10.811 12.011 14.007 15.999 18.998 20.183
của chúng biến thiên tuần hoàn theo chiều 11 12 13 14 15 16 17 18 3 Na Mg Al Si P S Cl Ar 22.99 24.312
26.982 28.086 30.974 32.064 35.453 39.948
tăng của điện tích hạt nhân 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.102 40.08 44.956 47.89
50.942 51.996 54.938 55.847 58.932 58.71 63.54 65.37 69.72 72.59 74.922 78.96 79.909 83.8 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.468 87.62 88.906 91.224 92.906 95.94 * 98 101.07 102.91 106.42 107.9
112.41 114.82 118.71 121.75 127.61 126.9 131.29 55 56 57 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 6 Cs Ba **La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
132.91 137.33 138.91 178.49 180.95 183.85 186.21 190.2
192.22 195.08 196.97 200.29 204.38 207.2 208.98 * 209 * 210 * 222 87 88 89 104 105 106 107 108 109 110 111 112 114 116 118 7 Fr Ra ***Ac Rf Ha Sg Ns Hs Mt Uun Uuu Unb Uuq Uuh Uuo * 223 226.03 227.03 * 261 * 262 * 263 * 262 * 265 * 268 * 269 * 272 * 277 *285 *289 *293 Based on symbols used by ACS S.M.Condren 1999 58 59 60 61 62 63 64 65 66 67 68 69 70 71 * Designates that **Lanthanum Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu all isotopes are Series 140.12 140.91 144.24 * 145
150.36 151.96 157.25 158.93 162.51 164.93 167.26 168.93 173.04 174.97 radioactive 90 91 92 93 94 95 96 97 98 99 100 101 102 103 *** Actinium Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Series 232.04 231.04 238.03 237.05 * 244 * 243 * 247 * 247 * 251 * 252 * 257 * 258 * 259 * 260 7 8
I. Các loại nguyên tố: BẢng tuÇn hoμn 2016
Các nguyên tố trong bảng tuần hoàn được chia làm 4
loại: nguyên tố s; nguyên tố p; nguyên tố d; nguyên tố f
1. Nguyên tố s: Cấu hình e: ns1-2 ; Vị trí: Nằm đầu các chu kì
2. Nguyên tố p: Cấu hình e: ns2 np1-6; Vị trí: 6 nguyên tố cuối chu kì
3. Nguyên tố d: cấu hình e: (n - 1)d1-10 ns2(1); Vị trí
nằm giữa các nguyên tố s và nguyên tố p. Chúng
được gọi là các nguyên tố chuyển tiếp (transition 10 elements).
4. Nguyên tố f : Cấu hình e: ( n - 2)f1-14 (n - 1)d0(1) ns2
1. Chu kì: Là tập hợp các nguyên tố có cùng số
lớp vỏ e và đặt theo 1 hàng ngang
Các nguyên tố f được chia thành hai dãy: dãy 4f gồm
các nguyên tố từ Ce (58) đến Lu (71) được gọi là các Đặc điểm cấu tạo:
nguyên tố họ Lantan ( Lantanit hay Lantanoit).
- Các nguyên tố trong một chu kì có số lớp e
Dãy 5f từ Th (90) đến Lr(103) là các nguyên tố họ Actini
bằng nhau và bằng số thứ tự của chu kì. (Actinit hay actinoit.
- Trong phạm vi một chu kì, số e ở lớp ngoài cùng tăng từ 1 đến 8. 11 12 Quy t¾c Klechkowsky
• Chu kì 1 chỉ có 2 nguyên tố;
• Chu kì 2 và 3 có 8 nguyên tố; là chu kì l = 0 1 2 3 4
ngắn (short periods).
• Các chu kì 4, 5, 6,7 là các chu kì dài (long n = 1 1s periods). 2 2s 2p
• Chu kì 4 và 5 gồm 18 ntố. 3 3s 3p 3d
• Chu kì 6, 7 gồm 32 nguyên tố. 4 4s 4p 4d 4f 5 5s 5p 5d 5f 5g 6 6s 6p 6d 6f 6g 7 7s 7p 7d 7f 7g 8 8s 8p 8d 8f 8g 13 14
• Nhóm: Là tập hợp các nguyên tố có cấu hình e hóa
trị tương tự nhau xếp thành một cột
• Phân nhóm A gồm các nguyên tố s và nguyên tố p.
• Nhóm A gồm các nguyên tố s và nguyên tố p. IA: ns1
• Nhóm B gồm các nguyên tố d (riêng nhóm IIIB gồm
cả các nguyên tố f - hai họ latan và actini). IIA: ns2 IIIA: ns2np1 IVA: ns2np2 VA: ns2np3 VIA: ns2np4 VIIA: ns2np5 15 VIIIA: ns2np6
• Phân nhóm B gồm các nguyên tố d (riêng nhóm IIIB
gồm cả các nguyên tố f - hai họ latan và actini).
TÍNH CHẤT TUẦN HOÀN CỦA CÁC NGUYÊN TỐ
• Năng lượng các orbitan • Năng lượng ion hoá • Ái lực electron
• Bán kính nguyên tử - bán kính ion 18
1. Năng lượng các orbital
Z’ = Z - : là hằng số chắn
Ở nguyên tử và ion có 1 electron:
Việc xác định chính xác Z’ là rất khó, nhất là đối với ,
nguyên tử có nhiều e. Dùng phương pháp gần đúng.
Ở nguyên tử nhiều electron ′ ,
Trong đó: Z: điện tích hạt nhân
Z’: điện tích hạt nhân hiệu dụng n : số lượng tử chính 19 1eV = 1,6.10 20
Qui tắc Slater: VD:
+ Cấu trúc của nguyên tử được chia thành từng nhóm như O (Z=8): 1s2 2s2 2p4
sau: (1s); (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) (5s 5p) … Đối với e ngoài cùng:
+ e ở nhóm cao hơn (bên phải) coi như không chắn e ở
Z’ = 8 - (2 x 0,85 + 5 x 0,35) = 4,55 nhóm thấp hơn.
Ni (Z=28): 1s2 2s2 2p6 3s2 3p6 3d8 4s2
+ Đối với các e ở ns; np thì: Đối với e 3d:
Các e trong cùng một nhóm chắn nhau 0,35, riêng 2e
Z’ = 28 - (18 x 1 + 7 x 0,35) = 7,55 ở 1s chắn nhau 0,3. Đối với e 4s:
Các e ở nhóm (n-1) chắn 0,85
Z’ = 28 - (10 x1,00 +16 x 0,85 + 1x0,35) = 4,05
Các e ở nhóm (n-2) hoặc thấp hơn chắn 1,00
Dựa vào phương pháp Slater, có thể tính được năng
lượng của tổng các e trong nguyên tử và ion, từ đó có
+ Đối với các e ở nd hay nf thì
thể tính được năng lượng ion hoá.
Các e trong cùng nhóm chắn nhau 0,35. 21
Các e ở nhóm bên trái chắn 1,00. 22
VD: Tính Z’ đối với e ở lớp 4s, 3d của Cu( Z=29)
Phương pháp Slater cho chúng ta một bức tranh định lượng
[1s2][2s22p6][3s23p6][3d10][4s1]
về hiệu ứng chắn. Tuy nhiên đây là phương pháp gần đúng
nên không thể tránh khỏi sai số. Do vậy trong một số tài
4s: Z’ = 29 - ((10 * 1.0) + (18 * 0.85) + (0 * 0.35))
liệu, người ta xem xét hiệu ứng chắn thông qua sự suy luận
để rút ra những nhận xét mang tính so sánh. =3,7
3d: Z’ = 29 - ((18 * 1.0) + (9 * 0.35)) = 7.8 24
Sự biến thiên năng lượng của các AO hoá trị theo chiều tăng Z.
Nhận xét về hiệu ứng chắn (thông qua sự suy luận mang
a. Trong một chu kì: Khi đi từ trái sang phải (T-P): Z tăng đều 1 đơn tính định tính)…
vị nhưng e tăng được điền vào cùng lớp chắn nhau kém do vậy tăng
chậm hơn Z nên Z’ (= Z- ) tăng.
- Trong một lớp, theo chiều n, np, nd, nf: khả năng xâm
nhập giảm, do đó khả năng chắn giảm dần.
Kết quả E của AO hoá trị
- Các e trong cùng một lớp chắn nhau kém, trong một
giảm. ở dãy các nguyên tố
phân lớp chắn nhau kém hơn.
p, theo chiều tăng Z’, khả function 2s
năng xâm nhập của AO - ns
- Các e ở lớp bên trong chắn mạnh các e ở lớp bên ngoài,
lớn hơn so với AO - np nên
ngược lại các e ở lớp bên ngoài chắn rất kém đối với các Ens giảm nhanh hơn, kết 2p e ở lớp bên trong. quả: Radial distribution E = Enp - Ens tăng Distance from nucleous 25 26 b. Trong nhóm A NĂNG LƯỢNG ION HOÁ
- Từ trên xuống Z tăng do đó Z’ tăng E của e hoá trị giảm
- Do số lớp e tăng nên E tăng.
• Năng lượng ion hoá thứ nhất I1 là năng lượng tối
Tác động của yếu tố thứ hai lớn hơn tác động của yếu tố nhất
thiểu cần thiết để tách 1e ra khỏi nguyên tử ở trạng
nên từ trên xuống (T-X) trong nhóm A, E của AO hoá trị tăng
thái cơ bản và ở thể khí thành ion tích điện +1 cũng ở
(Có thể xác định theo phương pháp Slater).
trạng thái khí và cơ bản. X
- Từ T-X trong nhóm A, theo chiều tăng của khả năng xâm nhập (K,CB) - 1e X+(K,CB)
của các e ns lớn hơn so với các e np do đó
I1 > 0, I1- là năng lượng ion hoá thứ nhất E = Enp – Ens tăng … 27 28
Đối với hệ 1 e (H, He+, Li2+): Z2 Z2
I E E 0 ( 6 , 13 . ) 6 , 13 . (eV )
• Năng lượng ion hoá thứ hai ứng với quá trình e n2 n2 bứt electron thứ hai X+
Đối với hệ nhiều electron: (K,CB) - 1e X2+(K,CB) I2 > 0 Ta luôn có I2 > I1 I Z'2 Z'2 1 < I2 < I3
I E E 0 ( 6 , 13 . ) , 13 . 6 (eV ) e n2 n2
Trong đó: E là năng lượng của electron ở xa vô cùng = 0 E 30
e là năng lượng của electron bị tách Nguyªn tè First Second Third H 1312 -
Biến thiên năng lượng ion hoá trong một chu kỳ He 2731 5247
- Từ đầu đến cuối chu kỳ I1 tăng(I1 min ở kim loại Li 520 7297 11810
kiềm, I1 max ở khí hiếm) Be 900 1757 14840
- Trong một chu kì có hai sự đột biến: có hai cực tiểu B 800 2430 3569
con ở nguyên tố np1 và np4 do đó tạo ra hai cực đại con C 1086 2352 4619 ở nguyên tố ns2 và np3 N 1402 2857 4577 O 1314 3391 5301 F 1681 3375 6045 Ne 2080 3963 6276 31 32 Nguyên nhân: He Ne
Be, Mg, Zn … có phân lớp e ngoài cùng ns2 (bão hoà) • Ne has a lower IE khá bền nên có I N F than He
1 lớn, còn ở B, Al, Ga … có phân lớp e
ngoài cùng np1 bị chắn bởi phân lớp ns2 nên có I1 bé. • Both are full,
Khi chuyển từ np3 sang np4 : • Ne has more H O Be C shielding • Greater distance B
Do Enp3 (nửa bão hoà) < Enp4, mặt khác do sự đẩy Li First Ionization energy
nhau của hai e ghép đôi làm tăng E của np4. Kết quả I1 (np3) >I1(np4 ) Atomic number 33 34 He Ne Na has a lower N F IE than Li Both are s1 H O Be C Na has more shielding B Greater distance Li First Ionization energy First Ionization energy Na Atomic number Atomic number 35 36 Electron Affinity ¸i lùc electron (Electron Affinity)
The change in energy when an electron is added to a gaseous atom. Cl(g) + e Cl(g) E = -349 kJ/mol
a. Khái niệm X(k) + 1e X-(k), trao đổi với môi
A large, negative E indicates strong attraction
trường một năng lượng được gọi là ái lực e, ký hiệu là
between the atom and the added electron.
EA. Trong đa số trường hợp EA < 0 (phát ra năng lượng).
A positive E indicates the addition of an electron is unfavorable.
Ne(g) + e Ne(g) E = 40 kJ/mol 37 38
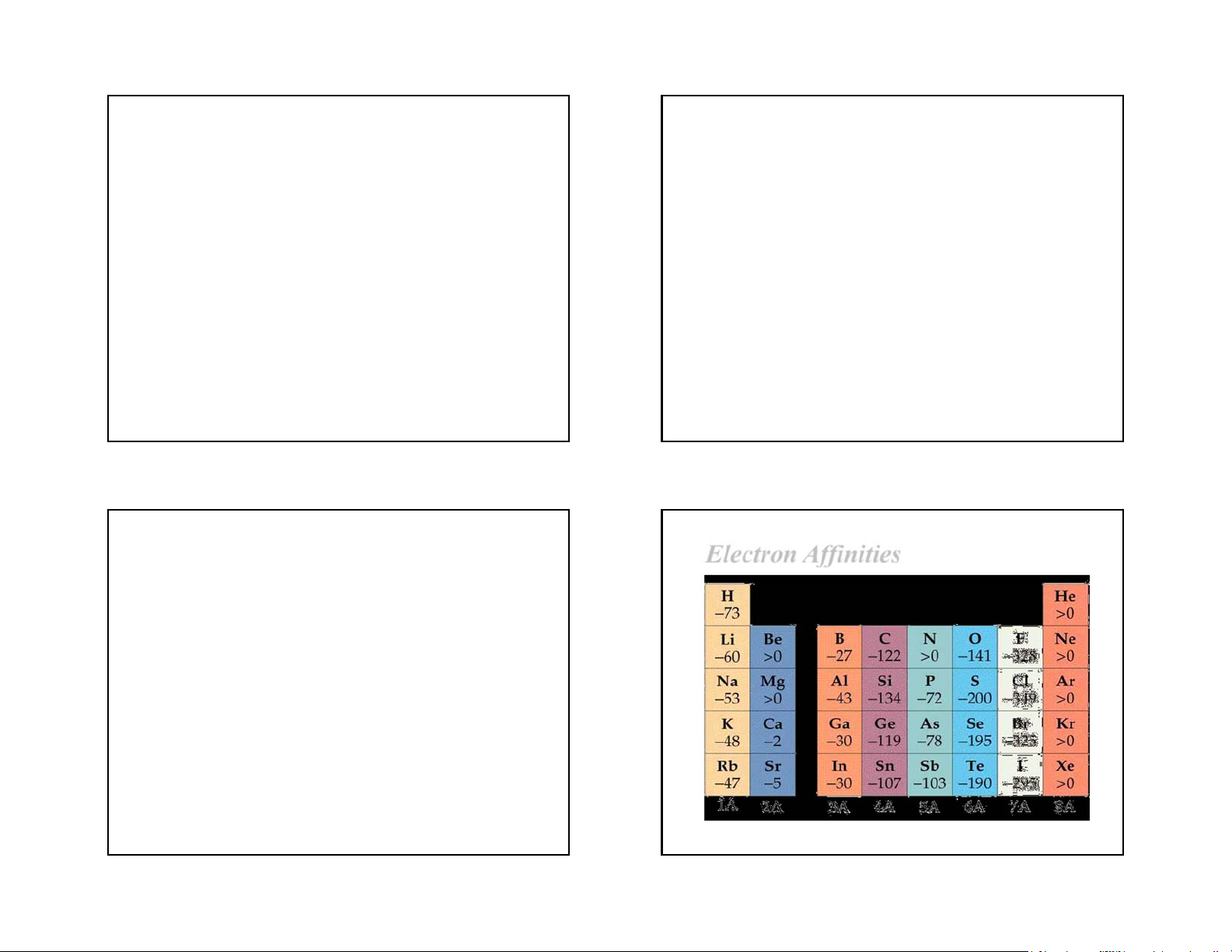
Electron Affinities
Các yếu tố ảnh hưởng lên EA:
- Số e ở lớp ngoài cùng tăng; Z’ càng lớn; kích
thước cùng nhỏ thỡ ái lực của nguyên tố càng
mạnh (EA có giá trị càng âm).
- Mật độ e lớn, khả năng nhận e khó hơn, ái lực e
yếu hơn(EA có giá trị ít âm hơn). 39 40
Ionization energy, electronegativity Electron affinity INCREASE
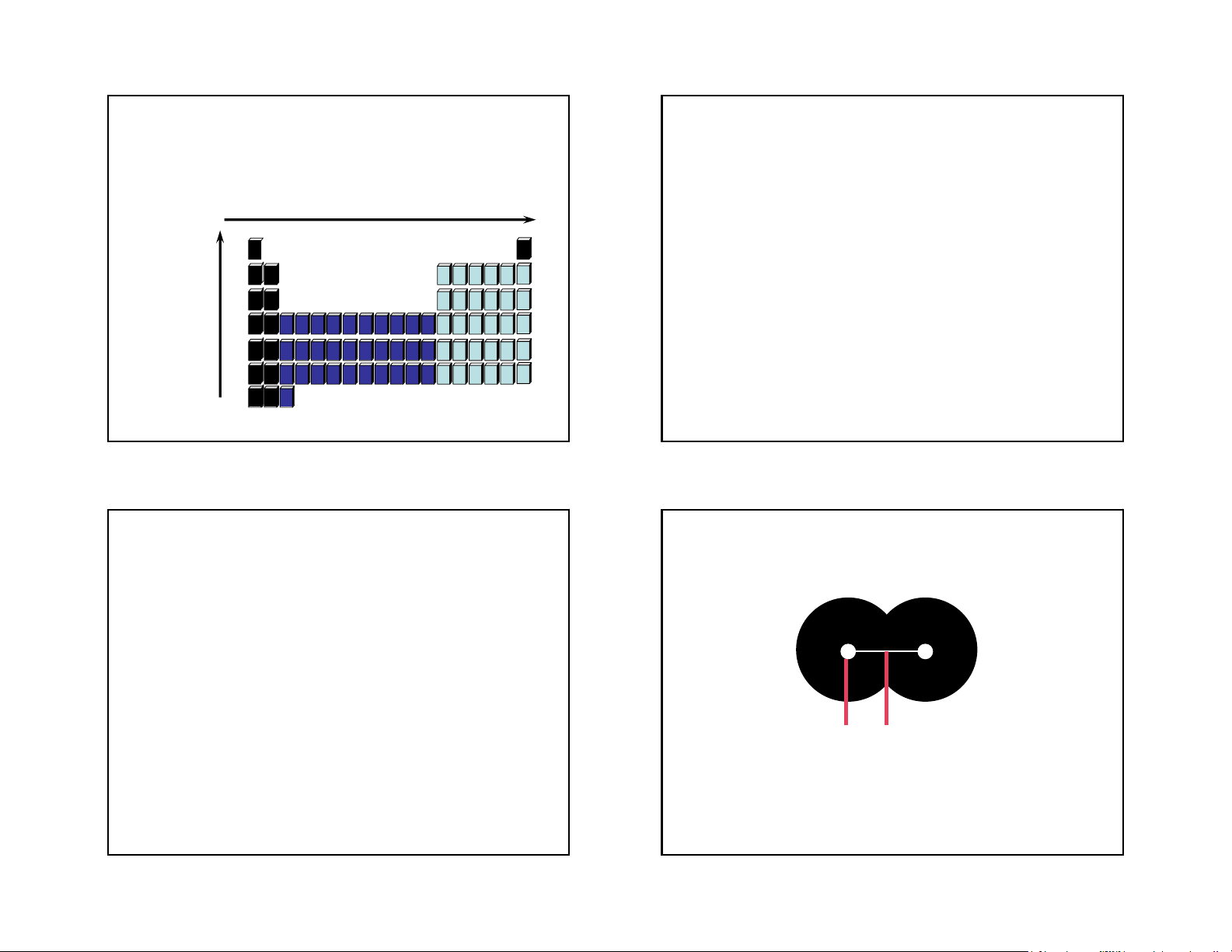
B¸n kÝnh nguyªn tö - b¸n kÝnh ion 41 42 Atomic Size B¸n kÝnh nguyªn tö } Radius
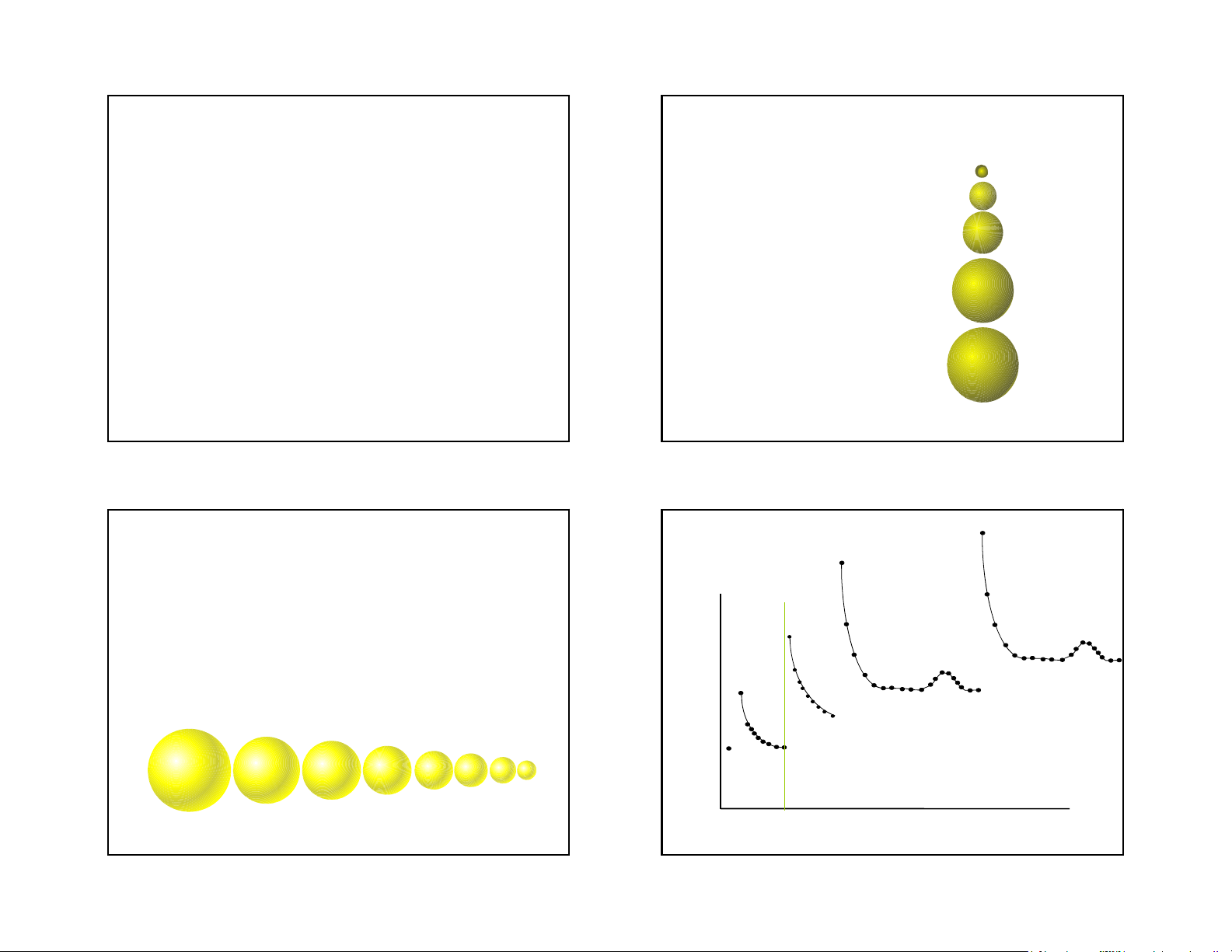
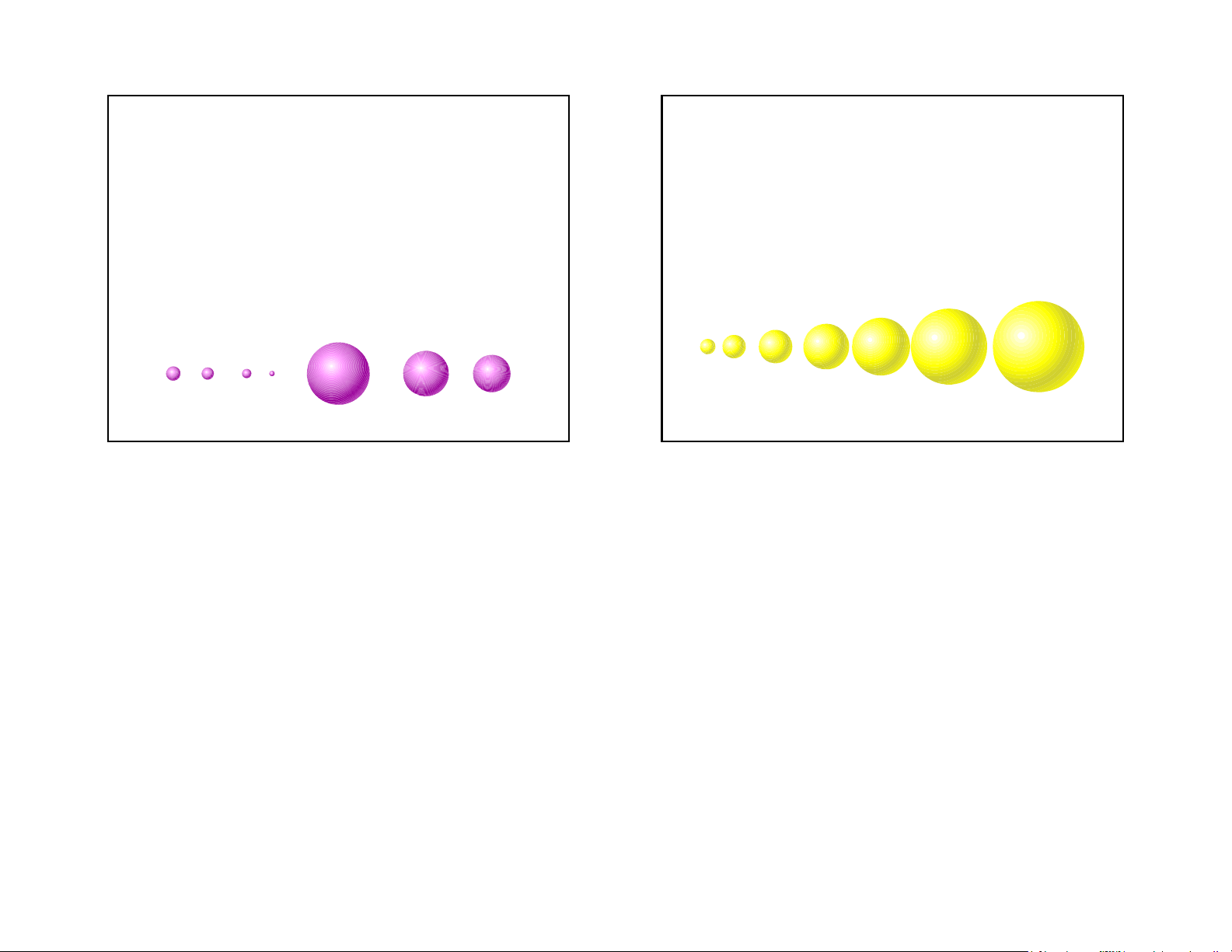
•Atomic Radius = half the distance between two nuclei of a diatomic molecule. 43 44 Trends in Atomic Size Group trends H • Influenced by two factors. • As we go down a Li • Energy Level group • Each atom has Na
• Higher energy level is further away. another energy • Charge on nucleus level, K
• More charge pulls electrons in closer. • So the atoms get bigger. Rb 45 46 Rb Periodic Trends K Overall
• As you go across a period the radius gets smaller. Na • Same energy level. • More nuclear charge. Li
• Outermost electrons are closer. Kr Ar Ne Atomic Radius (nm) H Na Mg Al Si P S Cl Ar 10 Atomic Number 47 48 Ionic radii Cation formation Anion formation
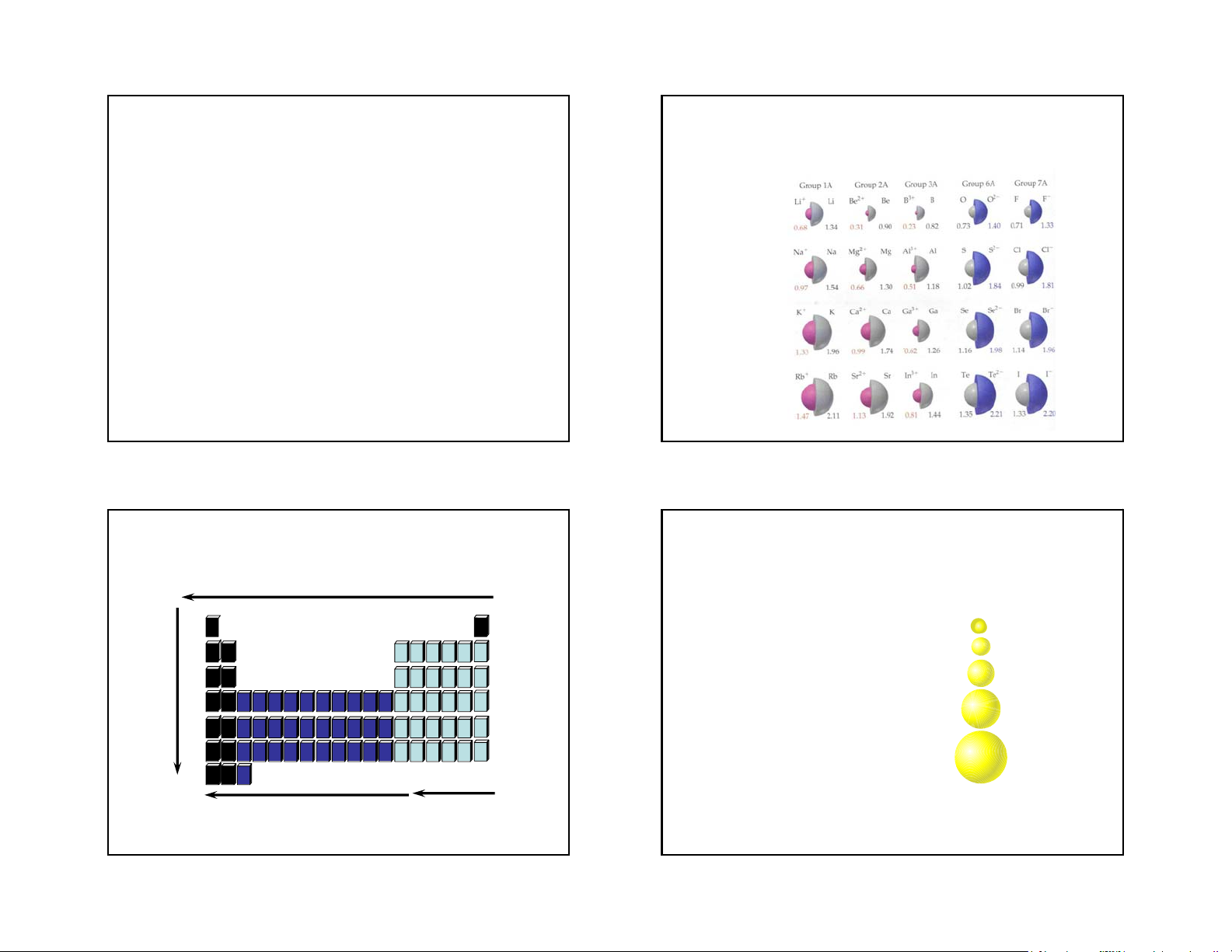
vacates outermost orbital
increases e-e repulsions and decreases e-e so they spread out more repulsions SIZE INCREASES SIZE DECREASES b¸n kÝnh ion ** 49 50 Atomic size increases, Group trends shielding constant • Adding energy level Li+1 • Ions get bigger as you Na+1 go down. K+1 Rb+1 Cs+1 Ionic size increases 51 52 Periodic Trends Size of Isoelectronic ions
• Across the period nuclear charge
• Positvie ions have more protons so they increases so they get smaller. are smaller.
• Energy level changes between anions and cations. N-3 Al+3 Na+1 Ne F-1 O-2 N-3 Li+1 B+3 O-2 F-1 Mg+2 Be+2 C+4 53 54



