











Preview text:
Tóm tắt - CH3120 - HUST Ho¸ häc v« c¬
Ch¬ng 1: Sù biÕn thiªn tuÇn hoµn tÝnh chÊt
cña c¸c nguyªn tè trong b¶ng tuÇn hoµn
I. C¸c lo¹i nguyªn tè: C¸c nguyªn tè trong b¶ng tuÇn hoµn ®îc chia lµm 4 lo¹i: nguyªn
tè s; nguyªn tè p: nguyªn tè d; nguyªn tè f (ngêi ta gäi lµ 4 khèi (block) hay d·y (series)
1. Nguyªn tè s: CÊu h×nh e: ns1-2 ; VÞ trÝ: N»m ®Çu c¸c chu k×
2. Nguyªn tè p: CÊu h×nh e: ns2 np1-6; VÞ trÝ: 6 nguyªn tè cuèi chu k×
3. Nguyªn tè d: cÊu h×nh e: (n - 1)d1-10 ns2(1); VÞ trÝ n»m gi÷a c¸c nguyªn tè s vµ nguyªn tè p.
Chóng ®îc gäi lµ c¸c nguyªn tè chuyÓn tiÕp (transition elements).
4. Nguyªn tè f : CÊu h×nh e: ( n - 2)f1-14 (n - 1)d0(1) ns2. Do ph©n líp (n - 2)f vµ (n - 1)d, thêng
lµ ë c¸c nguyªn tè ®Çu d·y, gi÷a vµ cuèi d·y ch¼ng h¹n La(57) kh«ng ph¶i lµ 4f1 6s2 mµ lµ 5d1
6s2 nªn nã lµ nguyªn tè d, kh«ng ph¶i nguyªn tè f; Gd (Gadolini) kh«ng lµ 4f8 6s2 mµ 4f7 5d1 6s2 …
C¸c nguyªn tè f ®îc chia thµnh hai d·y: d·y 4f gåm c¸c nguyªn tè tõ Ce (58) ®Õn Lu (71)
®îc gäi lµ c¸c nguyªn tè hä Lantan ( Lantanit hay Lantanoit).
D·y 5f tõ Th (90) ®Õn Lr(103) lµ c¸c nguyªn tè hä Actini (Actinit hay actinoit.
II. CÊu tróc b¶ng tuÇn hoµn.
1. Chu k× : §Æc ®iÓm cÊu t¹o:
- C¸c nguyªn tè trong mét chu k× cã sè líp e b»ng nhau vµ b»ng sè thø tù cña chu k×.
- Trong ph¹m vi mét chu k×, sè e ë líp ngoµi cïng t¨ng tõ 1 ®Õn 8.
- Chu k× 1 chØ cã 2 nguyªn tè; chu k×
2vµ 3 cã 8 nguyªn tè; 2 nguyªn tè s l = 0 1 2 3 4
vµ 6 nguyªn tè p. Chóng lµ chu k×
ng¾n (short periods). C¸c chu k× 4, 5, n = 1 1s
6 lµ c¸c chu k× dµi (long period). Chu
k× 4vµ 5 gåm 2s + 10d + 6p. Chu k× 2 2s 2p
6: 2s + La(5d1) + 14f (hä lantan) +
9d(d2- d10) + 6p; Tæng b»ng 32 3 3s 3p 3d
nguyªn tè . Chu k× 7 : 2s + Ac(6d1) +
14f (hä actini) + …(cha ®iÒn ®îc 4 4s 4p 4d 4f hÕt)
§Ó gióp trÝ nhí (memonic) trong viÖc 5 5s 5p 5d 5f 5g
x¸c ®Þnh thø tù c¸c orbital ®· ®iÒn e
cña c¸c nguyªn tè trong b¶ng; tõ ®ã 6 6s 6p 6d 6f 6g
viÕt ®îc c¸c cÊu h×nh e cña nã vµ …
cã thÓ tÝnh ®îc sè nguyªn tè trong 7 7s 7p 7d 7f 7g
mét chu k× lín, chóng ta nªn sö dông
b¶ng sau (Dùa vµo nguyªn lý v÷ng 8 8s 8p 8d 8f 8g
bÒn vµ c¸c quy t¾c Klechkowsky. XÐt vµi vÝ dô:
VÝ dô 1: Ra(88) lµ kim lo¹i kiÒm thæ ë chu k× 7. H·y dù ®o¸n kim lo¹i kiÒm thæ tiÕp theo sÏ cã
thø tù bao nhiªu? Ra : 7s2 th× kim lo¹i kiÒm thæ tiÕp theo: X ph¶i cã thªm c¸c ph©n líp e: 5f14
6d10 7p6 8s2sÏ cã thø tù = 88 + 32 = 120.
VÝ dô 2: Dù ®o¸n sè nguyªn tè cña chu k× 7: 7s2 5f14 6d10 7p6 : Sè nguyªn tè = 2 + 14 + 10 + 6 = 32 2. Nhãm
2.1. Nhãm A gåm c¸c nguyªn tè s vµ nguyªn tè p. 1 Tóm tắt - CH3120 - HUST
§Æc ®iÓm cÊu t¹o: ns1-2 (nguyªn tè s) ns2 np1-6; Sè e ngoµi cïng b»ng sè nhãm. Nhãm IA (kim
lo¹i kiÒm) më ®Çu chu k×, nhãm VIIIA (c¸c khÝ hiÕm: noble gas) cã 8 e ë líp ngoµi cïng kÕt thóc chu k×.
2.2. Nhãm B gåm c¸c nguyªn tè d (riªng nhãm IIIB gåm c¶ c¸c nguyªn tè f - hai hä latan vµ actini).
§Æc ®iÓm cÊu t¹o: Trong ph¹m vi mét nhãm B (sè e trªn (n-1)d + sè e trªn ns) b»ng nhau. C¸c
nhãm IIB ®Õn IIIB cã tæng nªu trªn b»ng sè nhãm. Nhãm VIIIB cã (n-1)d6,7,8. Nhãm IB cã (n-
1)d10 ns1, nhãm IIB cã (n-1)d10 ns2.
3. B¶ng dµi, b¶ng ng¾n. HiÖn nay nãi chung ngêi ta thêng dïng b¶ng( ®îc gäi lµ b¶ng
dµi) cã cÊu tróc nh sau: c¨n cø vµo chu k× dµi vÝ dô chu k× 4 gåm 18 nguyªn tè ®îc xÕp vµo
18 « ( sÏ t¹o ra 18 cét). Theo IUPAC, mçi cét øng víi mét nhãm ®¸nh sè tõ 1 ®Õn 18. Tuy
nhiªn c¸c ký hiÖu nhãm cña b¶ng tuÇn hoµn cßn phô thuéc vµo tÝnh truyÒn thèng (tradition) do
®ã gi÷a Mü vµ Ch©u ¢u còng cã nh÷ng nÐt kh¸c nhau (xem b¶ng díi).
ë ViÖt Nam b¶ng tuÇn hoµn cã ký hiÖu: IA IIA IIIB IVB VB VIB VIIB VIIIB IB IIB IIIA … VIIA VIIIB s1 s2 d1 d2 d3 d5(d4) d5 d6d7d8 d10s1 d10s2 p1 p5 p6
B¶ng ng¾n : XÕp nhãm A, B cïng sè thø tù vµo 1 cét vµ gäi nhãm A lµ ph©n nhãm chÝnh vµ nhãm B lµ ph©n nhãm phô .
4. HiÖn tîng néi b·o hoµ (ë nhãm IB) vµ néi nöa b·o hoµ (nhãm VIB).
III. Sù biÕn tÝnh chÊt cña c¸c nguyªn tè trong b¶ng tuÇn hoµn
1. N¨ng lîng c¸c orbital (Orbital Energy: OE)
1.1 §iÖn tÝch h¹t nh©n hiÖu dông (Effective nuclear charge : ENC) Ký hiÖu Z* hay Z’. ë 2
nguyªn tö vµ ion (1e), Ee = f(n,Z) = - 13,6 ' Z (eV) (1eV= 1,6.10-19J ) 2 n
ë nguyªn tö nhiÒu electron(Polyelectronic atom ), n¨ng lîng cña eletron kh¶o s¸t ®îc tÝnh 2 theo c«ng thøc: E Z' c = - 13,6.
( chÝnh x¸c h¬n n cïng thay b»ng n* hay n’). 2 n
Z’ = Z - : lµ h»ng sè ch¾n ( Screening hay shielding constant). ®îc coi lµ sù ch¾n cña
tÊt c¶ c¸c e kh¸c lªn e kh¶o s¸t. ViÖc x¸c ®Þnh chÝnh x¸c Z’ lµ rÊt khã, nhÊt lµ ®èi víi nguyªn
tö cã nhiÒu e. Do vËy ngêi ta cã thÓ kh¶o s¸t sù biÕn thiªn cña OE theo 2 c¸c cÊu h×nh: Dïng ph¬ng ph¸p gÇn ®óng.
1.2. Ph¬ng ph¸p Slater: Slater ®a ra mét sè quy t¾c, tõ ®ã cã thÓ x¸c ®Þnh ®èi víi e kh¶o s¸t. C¸c quy t¾c Slater:
+ CÊu tróc cña nguyªn tö ®îc chia thµnh tõng nhãm nh sau: (1s); (2s 2p) (3s 3p)
(3d) (4s 4p) (4d) (4f) (5s 5p) …
+ e ë nhãm cao h¬n (bªn ph¶i) coi nh kh«ng ch¾n e ë nhãm thÊp h¬n.
+ §èi víi c¸c e ë ns; np th×:
C¸c e trong cïng mét nhãm ch¾n nhau 0,35, riªng 2e ë 1s ch¾n nhau 0,3.
C¸c e ë nhãm,(n-1) ch¾n 0,85
C¸c e ë nhãm (n-2) hoÆc thÊp h¬n ch¾n 1,00
+ §èi víi c¸c e ë nd hay nf th×
C¸c e trong cïng nhãm ch¾n nhau 0,35.
C¸c e ë nhãm bªn tr¸i ch¾n 1,00. Mét vµi vÝ dô:
0: 1s2 2s2 2p4: §èi víi e ngoµi cïng (outermost), Z’= 8 - (2 x 0,85 + 5 x 0,35) = 4,55
Ni: 1s2 2p6 3s2 3p6 3d8 4s2. §èi víi e 3d: Z’ = 28 - (18 x 1 – 7 x 0,35) = 7,55
§èi víi e 4s: Z’ = 28 – (10 x 1,00 – 16 x 0,85 – 1 x 0,35) = 4,05
Dùa vµo ph¬ng ph¸p Slater, cã thÓ tÝnh ®îc n¨ng lîng cña tæng c¸c e trong nguyªn tö vµ
ion, tõ ®ã cã thÓ tÝnh ®îc n¨ng lîng ion ho¸. 2 Tóm tắt - CH3120 - HUST
Ph¬ng ph¸p Slater cho chóng ta mét bøc tranh vÒ ®Þnh lîng vÒ hiÖu øng ch¾n. Tuy nhiªn
®©y lµ ph¬ng ph¸p gÇn ®óng nªn kh«ng thÓ tr¸nh khái sai sè. ë nh÷ng nguyªn tè cã nh÷ng
cÊu h×nh phøc t¹p, sai sè sÏ lín h¬n. Cã lÏ h¹n chÕ lín cña ph¬ng ph¸p nµy cha tÝnh ®Õn
hiÖu øng th©m nhËp (penetration ) vµ kh¶ n¨ng ch¾n m¹nh cña líp ph©n tö e b·o hoµ. Do vËy
trong mét sè tµi liÖu, ngêi ta xem xÐt hiÖu øng ch¾n th«ng qua sù suy luËn ®Ó rót ra nh÷ng
nhËn xÐt mang tÝnh so s¸nh.
1.3. NhËn xÐt vÒ hiÖu øng ch¾n ( th«ng qua sù suy luËn mang tÝnh ®Þnh tÝnh)…
- Trong mét líp, theo chiÒu n, np, nd, nf: kh¶ n¨ng x©m nhËp gi¶m, do ®ã kh¶ n¨ng ch¾n gi¶m dÇn.
- C¸c e trong cïng mét líp ch¾n nhau kÐm, trong mét ph©n líp ch¾n nhau kÐm h¬n.
- C¸c e ë líp bªn trong ch¾n m¹nh c¸c e ë líp bªn ngoµi, ngîc l¹i c¸c e ë líp bªn ngoµi ch¾n
rÊt kÐm ®èi víi c¸c e ë líp bªn trong.
1.4. Sù biÕn thiªn n¨ng lîng cña c¸c AO ho¸ trÞ theo chiÒu t¨ng Z.
a. Trong mét chu k×: Khi ®i tõ nguyªn tè nµy sang nguyªn tè kh¸c n
Z t¨ng ®Òu 1 ®¬n vÞ nhng e t¨ng ®îc ®iÒn vµo cïng líp ch¾n ctio
nhau kÐm do vËy t¨ng chËm h¬n Z nªn Z’ t¨ng. KÕt qu¶ E cña n
AO ho¸ trÞ gi¶m. ë d·y c¸c nguyªn tè p, theo chiÒu t¨ng Z’, kh¶ fu n 2s
n¨ng x©m nhËp cña AO - ns lín h¬n so víi AO - np ( xem h×nh tio u
bªn) nªn Ens gi¶m nhanh h¬n, kÕt qu¶ E = Enp - Ens t¨ng ib tr 2p b. Trong nhãm A is d l
- Tõ trªn xuèng Z t¨ng do ®ã Z’t¨ng E cña e ho¸ trÞ gi¶m ia ad
- Do sè líp e t¨ng nªn ho¸ trÞ e t¨ng. R
T¸c ®éng cña yÕu tè thø hai lín h¬n t¸c ®éng cña yÕu tè Distance from nucleous
nhÊt nªn tõ trªn xuèng trong nhãm A, E cña AO ho¸ trÞ t¨ng (Cã
thÓ x¸c ®Þnh theo ph¬ng ph¸p Slater).
- Tõ trªn xuèng trong nhãm A, theo chiÒu t¨ng cña rA kh¶ n¨ng x©m nhËp cña c¸c e ns
lín h¬n so víi c¸c e np do ®ã E = Enp – Ens t¨ng …
- C¸c nguyªn tè d ë nhãm B sÏ xÐt ë phÇn III (häc k× sau)
2. N¨ng lîng ion ho¸ ( Iontation energy) 2.1. Kh¸i niÖm: - X(k) I1 X+ I2 X2+ I3 X3+ (k)
- §¬n vÞ ®o J (hoÆc KJ) hay eV tÝnh cho 1mol. 1eV = 96,485 KJ.mol - I1 < I2 < I3
- Cã thÓ dïng c«ng thøc sau ®Ó tÝnh In (theo ph¬ng ph¸p Slater). VÝ dô tÝnh I1
I1 = Ee,tt(X+,k) - Ee,tt(X,k) ; Ee,tt lµ n¨ng tæng cña tÊt c¶ c¸c e trong nguyªn tö hay ion kh¶o s¸t VÝ dô: Li (1s2 2s1) I1 Li+ (1s2) 2 3 , 1 2 Ee,tt (Li,k) = -13,6 2.( , 2 7) 1 . 2
I1 = Ee,tt (Li+,k) - Ee,tt (Li,k) 2 E 3 , 1 2 e,tt (Li+,k) = -13,6 2.( , 2 7) = -13,6. = 5,746 eV 2
2.2. Sù biÕn thiªn n¨ng lîng ion ho¸ trong mét chu k×.
a. Tõ ®Çu ®Õn cuèi chu k× I1 t¨ng( I1 min ë kim lo¹i kiÒm, max ë khÝ hiÕm)
b. Trong mét chu k× cã hai sù ®ét biÕn: cã hai cùc tiÓu con ë nguyªn tè np1 vµ np4 do ®ã t¹o ra
hai cùc ®¹i con ë nguyªn tè ns2 vµ np3. Nguyªn nh©n: 3
Tóm tắt - CH3120 - HUST
C¸c nguyªn tè: Be, Mg, Zn … cã ph©n líp e ngoµi cïng ns2 (b·o hoµ) kh¸ bÒn nªn cã
I1 lín, cßn ë B, Al, Ga … cã ph©n líp e ngoµi cïng np1 bÞ ch¾n bëi ph©n líp ns2 nªn cã I1 bÐ.
Khi chuyÓn tõ np3 sang np4
, do Enp3 (nöa b·o hoµ) < Enp4,
mÆt kh¸c do sù ®Èy nhau cña hai e ghÐp ®«i lµm t¨ng E cña np4. KÕt qu¶ I1 (np3) >I1(np4 ) (xem b¶ng 2)
3. ¸i lùc e (eletron Affinity)
a. Kh¸i niÖm X(k) + 1e X-(k), trao ®æi víi m«i trêng mét n¨ng lîng ®îc gäi lµ ¸i
lùc e, ký hiÖu lµ Ae. Trong ®a sè trêng hîp Ae < 0 (ph¸t ra n¨ng lîng). Mét sè gi¸ trÞ cña
Ae ë mét sè nguyªn nhãm A: B¶ng 4 B C N O F Al Si P S Cl Ae( KJ mol-1) -27 -122 -7 -141 -328 -44 -120 -72 -200 -350 Ga Ge As Se Br -29 -114 -77 -196 -325
b. C¸c yÕu tè ¶nh hëng lªn Ae:
- Sè e ë líp ngoµi cïng t¨ng; Z’ cµng lín; kÝch thíc cµng nhá th× ¸i lùc cña nguyªn tè cµng
m¹nh (Ae cã gi¸ trÞ cµng ©m).
- MËt ®é e lín, kh¶ n¨ng nhËn e khã h¬n, ¸i lùc e yÕu h¬n (Ae cã gi¸ trÞ Ýt ©m h¬n).
4. B¸n kÝnh nguyªn tö; b¸n kÝnh ion a. Kh¸i niÖm
b. Trong chu k×: Tõ ®Çu tíi cuèi rA gi¶m
c. Trong nhãmA: Tõ trªn xuèng rA, rion cïng ®iÖn tÝch t¨ng do ®ã sè líp e t¨ng.
d. HiÖn tîng Co d, Co f, 4
Tóm tắt - CH3120 - HUST
Ch¬ng 2: liªn kÕt häc vµ liªn kÕt c¸c ph©n tö
I) Mét sè kh¸i niÖm:
1. §é ©m ®iÖn cña nguyªn tè
a. Kh¸i niÖm: §é ©m ®iÖn (Ký hiÖu ) lµ ®¹i lîng ®Æc trng cho kh¶ n¨ng hót cÆp e liªn kÕt vÒ phÝa m×nh.
b. Thang ®é ©m ®iÖn: Thang ®é ©m ®iÖn th«ng dông lµ thang cña Pauling (nhµ b¸c häc Hoa
K×) ®îc x¸c ®Þnh theo n¨ng lîng liªn kÕt vµ mang tÝnh so s¸nh cã d¹ng c«ng thøc : 2 2 , 1 04.10 D D D (2.1) D A B AB AA BB
AA; DBB; DAB lµ n¨ng lîng ph¸ vì liªn
kÕt cña A-A; B-B; A-B. §Ó thu ®îc gi¸ trÞ cña . VÝ dô cã thÓ chän F (phi kim m¹nh nhÊt)
vµ F ®îc lÊy gi¸ trÞ b»ng 4. Nh vËy thang ®é ©m ®iÖn cña Pauling kh«ng cã ®¬n vÞ (xem b¶ng díi)
B¶ng 4. §é ©m ®iÖn cña mét sè nguyªn tè
Nguyªn tè Nguyªn tè Nguyªn tè Nguyªn tè Nguyªn tè Nguyªn tè Nguyªn tè H 2,1 Li 0,98 Be 1,5 B 2,0 C 2,5 N 3,07 O 3,5 F 4,0 Na 0,93 Mg 1,2 Al 1,6 Si 1,8 P 2,2 S 2,6 Cl 3,0 K 0,91 Ca 1,04 Ga 1,75 Ge 1,8 As 2,1 Se 2,5 Br 2,8 Rb 0,89 Sr 1,0 In 1,65 Sn 1,78 Sb 1,8 Te 2,1 I 2,6 Ba 0,99
c. Nh÷ng øng dông cña ©m ®iÖn
- Cã thÓ dïng ®é ©m ®iÖn ®Ó dù ¸n kiÓu liªn kÕt: céng ho¸ trÞ kh«ng ph©n cùc, ph©n cùc, ion
- Quan hÖ gi÷a ®é ©m ®iÖn víi ®é ph©n cùc liªn kÕt, ®Æc tÝnh ion cña liªn kÕt vµ gãc liªn kÕt.
2. N¨ng lîng liªn kÕt trong céng ho¸ trÞ a. Mét sè quy íc:
- N¨ng lîng t¹o thµnh liªn kÕt: VÝ dô: EA-B lµ Ho298 cña ph¶n øng A(k) + B(k) AB(k). VËy (Elk < 0).
- N¨ng lîng ph¸ vì liªn kÕt hay n¨ng lîng ph©n li AB, kÝ hiÖu DAB (DAB > 0) lµ Ho298 cña
ph¶n øng AB(k) A(k) + B(k)
- N¨ng lîng liªn kÕt trung b×nh: khi mét nguyªn tö liªn kÕt víi mét sè nguyªn tö kh¸c ta sÏ
dïng n¨ng lîng liªn kÕt trung b×nh. VÝ dô: CH4(k) C(k) + 4H(k) Ho298 = 1664 KJ.mol-1 EC-H = = 416 .
b. Quan hÖ Elk vµ ®é bÒn liªn kÕt (Bond Strength): gi¸ trÞ cña Elk cµng lín, liªn kÕt cµng bÒn.
3. §é dµi liªn kÕt kÝ hiÖu lµ l hay d, ®é dµi liªn kÕt cµng lín, ®é bÒn liªn kÕt cµng kÐm.
II) CÊu tróc ph©n tö: TÝnh chÊt lý häc (tÝnh chÊt ®iÖn, tõ, ph©n cùc), tÝnh chÊt ho¸ häc (tÝnh
bÒn, kh¶ n¨ng ph¶n øng) liªn quan mËt thiÕt ®Õn cÊu tróc ph©n tö cña hîp chÊt. Do ®ã viÖc
nghiªn cøu, kh¶o s¸t cÊu tróc ph©n tö lµ quan träng vµ cÇn thiÕt.
1. CÊu tróc Lewis (Lewis structure) hay cßn gäi lµ gi¶n ®å ®iÓm - electron – Lewis (Lewis electron – dot – diagram).
§Ó viÕt c«ng thøc Lewis cÇn lu ý:
- Gi÷a hai nguyªn tö trong ph©n tö cã c¸c g¹ch liªn kÕt, mçi g¹ch øng víi mét cÆp (pair) e t¹o liªn kÕt.
- Xung quanh c¸c nguyªn tö cã c¸c ®iÓm (dot) øng víi c¸c e cha liªn kÕt
- CÊu tróc b¸t tö Lewis (Lewis octet structure): líp e ho¸ trÞ (valince shell) cã tèi ®a 8e (®¹t
cÊu h×nh e cña khÝ hiÕm bÒn, tõ H: 2e (bÒn) : : : VÝ dô: :H – O: H – N – H :O = C = O: : – – H H 5 Tóm tắt - CH3120 - HUST
- Víi nh÷ng nguyªn tè cã AO – d, líp e lµ ho¸ trÞ cã thÓ më réng ( expanded) vît qu¸ b¸t tö
(beyond octet). VÝ dô: PF5; SF6; IF7. Nh vËy ë nguyªn tö trung t©m cã c¸c liªn kÕt (bonds)
hay cÆp e liªn kÕt (bomding pair bp); C¸c cÆp e cha liªn kÕt ( lone pair lp)
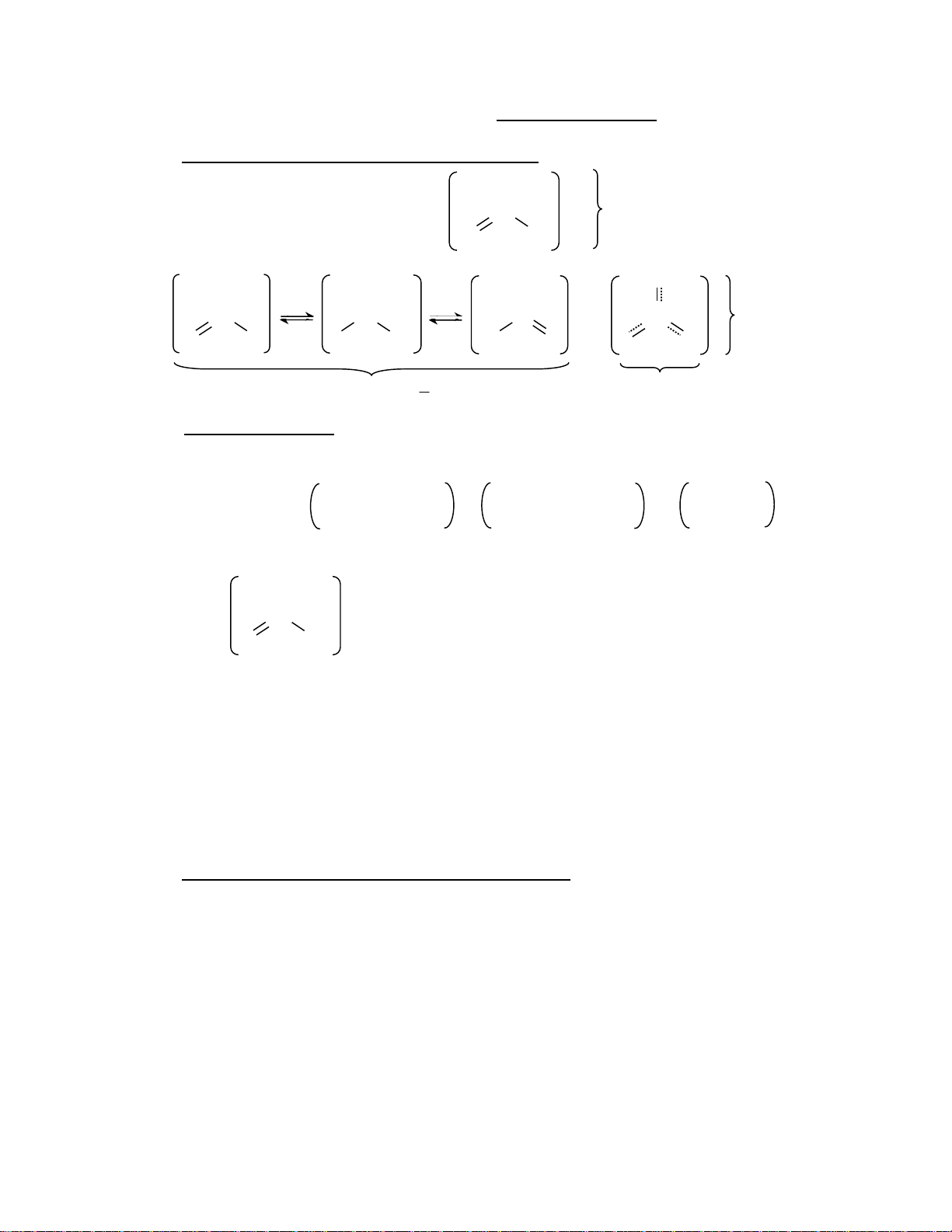
2. C«ng thøc céng hëng hay cÊu tróc céng hëng (resonance structure) :
VD CO 2 cã thÓ viÕt c«ng thøc lewis : :O: 2- 3 _ C cã mét liªn kÕt ®«i, : :O: :O: hai liªn kÕt ®¬n O 2- O 2- O 2- O 2- cã c¸c _ = _ C C C C liªn kÕt O O O O O O O O kh«ng ®Þnh chç BËc liªn kÕt 1 1 d¹ng tæng qu¸t 3
3. §iÖn tÝch h×nh thøc.(Formal charge FC). Khi viÕt c«ng thøc Lewis cã khi gÆp nh÷ng
trêng hîp cïng mét c«ng thøc ph©n tö, tån t¹i nhiÒu c«ng thøc céng hëng th× cã thÓ dùa vµo
F.C ®Ó íc ®Þnh ®îc c«ng thøc nµo hîp lý h¬n. - X¸c ®Þnh FC:
Sè e ho¸ trÞ trong Sè e cha ph©n chia Sè liªn kÕt FC = nguyªn tö tù do - = unshare - = number (2.2) = Free atom electric of bonds VÝ dô :O1- 2- _ Co
1- = 6 - 6 – 1 ; 0 = 4 – 0 – 4 : :O:o :O:1- 0 = 6 – 4 – 2 (Cacbon) Oxi
- Nh÷ng cÊu tróc cã (gi¸ trÞ) cña F.C cùc tiÓu, nguyªn tè cã ®é ©m ®iÖn lín h¬n mang F.C ©m
vµ sù ph©n chia ®iÖn tÝch nhá lµ cÊu tróc hîp lý h¬n. Nh vËy c¨n cø vµo F.C, ngêi ta sÏ
thuËn tiÖn h¬n khi chän cÊu tróc (trong c¸c cÊu tróc céng hëng) vµ x¸c ®Þnh chÝnh x¸c h¬n
bËc liªn kÕt gi÷a c¸c nguyªn tö trong ph©n tö hoÆc ion.
VÝ dô: ion SCN- cã ba cÊu tróc céng hëng(CTCH): : 1 : 1 :
:S = C = N : ; : S – C N ; :S C –: N:2-
cÊu tróc … hîp lÝ h¬n c¶ (A) (B) (C)
- CÇn nhí r»ng, F.C chØ lµ mét c«ng cô (tool) cho viÖc íc ®Þnh (assessing) cÊu tróc Lewis
(CT lewis) kh«ng ph¶i lµ ®iÖn tÝch thùc t¹i () trªn nguyªn tö.
4. Dù ®o¸n cÊu tróc kh«ng gian hay cÊu h×nh h×nh häc (CHHH) cña ph©n tö. §Ó ®o¸n nhËn
®îc CHHH cña ph©n tö chóng ta ph¶i viÕt c«ng thøc Lewis tõ ®ã sÏ viÕt c«ng thøc chung –
c«ng thøc Gillespie råi dïng m« h×nh sù ®Èy cña c¸c cÆp e ho¸ trÞ hay quan hÖ kiÓu lai ho¸ vµ CTHH cña ph©n tö.
4.1. M« h×nh VSEPR ( VSEPR model: Valence – Shell electron pair repulsion model). Nã
cung cÊp mét ph¬ng ph¸p cho sù dù ®o¸n (predicting) h×nh d¹ng (shape) cña c¸c ph©n tö,
®îc m« t¶ bëi Sidgwick vµ Powell (1940) vµ ®îc ph¸t triÓn bëi Gillespie vµ Nyholm (1957).
M« h×nh nµy dùa trªn mét nguyªn lý rÊt ®¬n gi¶n: c¸c e do tÝch ®iÑn cïng dÊu nªn ®Èy nhau.
Trong ph©n tö ë líp e ho¸ trÞ cña nguyªn tö trung t©m cã c¸c cÆp e (lp vµ bp), gi÷a chóng cã sù
®Èy nhau vµ ph©n tö ph¶i cã CHHH sao cho lùc ®Èy gi÷a chóng lµ min.
§Ó dù ®o¸n CHHH cña ph©n tö, chóng ta viÕt c«ng thøc Lewis – c«ng thøc tæng qu¸t
(Generic Formula) c«ng thøc Gillespie: AXmEn : A lµ nguyªn tö trung t©m (central atm –
C.A); X lµ nguyªn tö hoÆc nhãm nguyªn tö phèi trÝ quanh C.A; E lµ kÝ hiÖu cña lp trªn C.A. 6 Tóm tắt - CH3120 - HUST
§Æt q = m + n lµ sè vÞ trÝ kh«ng gian (Steric number – SN) ®îc chiÕm bëi nguyªn tö hay lp quanh C.A. :
VÝ dô: O = C = O: AX2 hay AX2E0 ; H – N – H : AX3E1 H
Tuú thuéc vµo gi¸ trÞ cña q, m, n, mµ ph©n tö hay ion sÏ cã CHHH kh¸c nhau. Chóng ta xÐt c¸c trêng hîp sau.
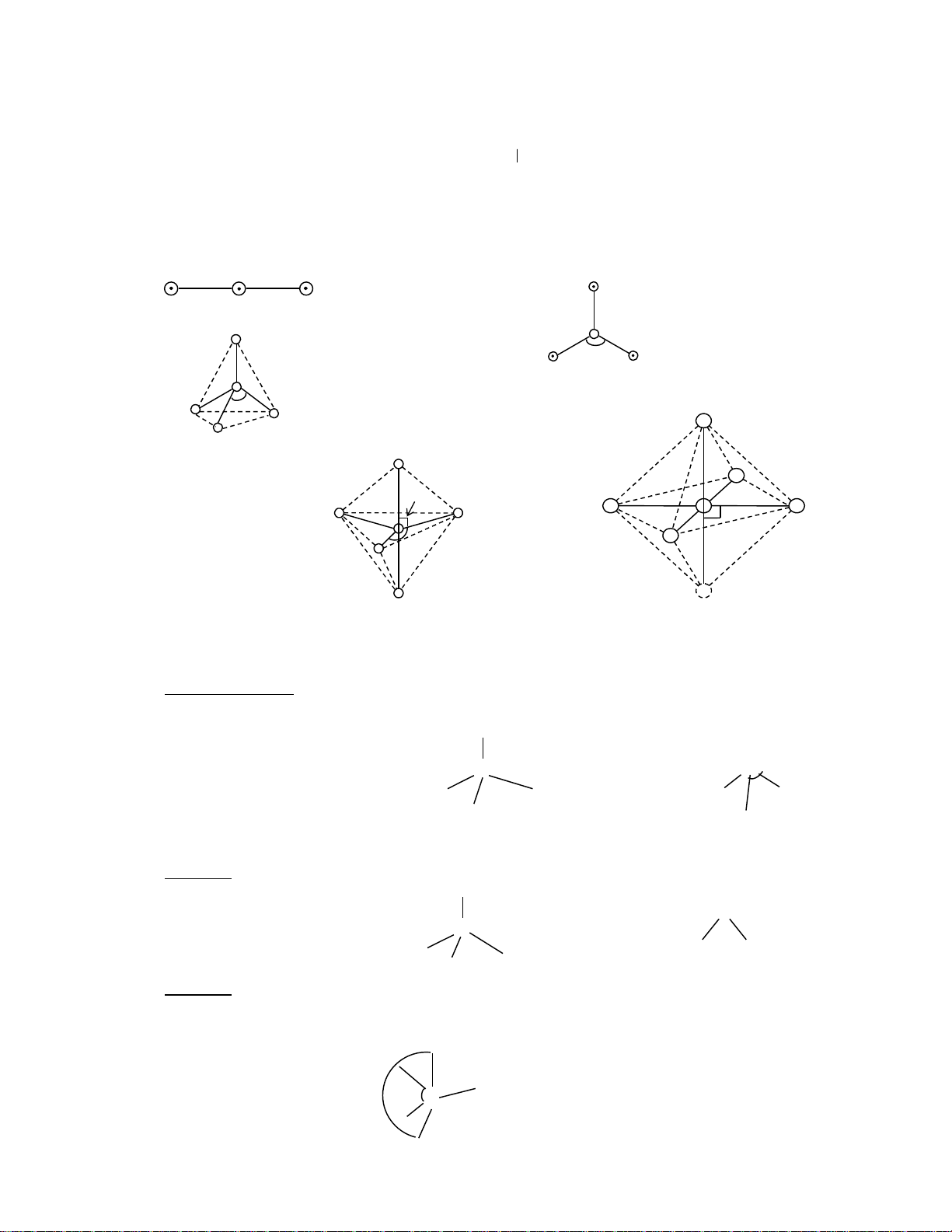
a. n = 0, kh«ng cã lp, c«ng thø lµ AXm. Chóng ta dÔ dµng nhËn thÊy r»ng víi m = 2; 3; 4; 5; 6
ph©n tö sÏ cã CHHH: th¼ng, ta gi¸c ph¼ng, tø diÖn, th¸p ®«i tam gi¸c, b¸t diÖn th¼ng (linear) (b) AX3: tam gi¸c ph¼ng (a) AX2: BeH2, Cl2 Trionnal plamar BF 2- 3, CO3 120o (c) AX4: Tø diÖn Tetrahedral CH + 2- 4; NH4 ; SO4 (d) AX5: th¸p ®«i tam gi¸c Trigonal 90o Bipyramildal PCl5 (e): AX6 90o 120o B¸t diÖn Octahedral SF6
b. Trêng hîp b 0: cã lp trªn CA th× cÇn lu ý thø tù lùc ®Èy gi÷a c¸c cÆp e; lp – lp > bp –
bp. Nh vËy kÕt hîp gi÷a lu ý nµy víi c¸c ë a còng dÔ dù ®o¸n ®îc CHHH cña ph©n tö cã n
> 0. XÐt mét trêng hîp sau:
b.1. q= 4 víi n = 1 AX3E hay AX3E1. VÝ dô: NH3 : H – N: – H N N: H – H H H 107o H C«ng thøc hay CT lewis q = 4 H H
Sù s¾p xÕp c¸c cÆp e (1lp + 3bp)
Do sù ®Èy cña mét lp mµ gãc liªn kÕt HNH ®· gi¶m xuèng 107o < 109,5 . b.2. q = 4 n = 2 H2O: AX2E2 : :
H – O: – H (c«ng thøc lewis) :O: : O Sù s¾p xÕp c¸c cÆp e 105o (CHHH) : 105o (2lp + 2bp) H H H H
b.3. q = 5 n = 1; 2; 3 th× qua ph©n tÝch lùc t¬ng t¸c gi÷a c¸c cÆp e ngêi ta ®· x¸c ®Þnh ®îc
c¸c lp ®Òu n»m. VÞ trÝ xÝch ®¹o (equafoual position) tøc lµ trªn mÆt ph¼ng n»m ngang th¼ng gãc víi trôc th¼ng ®øng. n = 1 ta cã SF4 F o 0F 8 1 < : o 3 S 7 1 F 102o < 120o = F 7 Tóm tắt - CH3120 - HUST
Víi n =2, 3 vµ q = 6 víi n =1, 2 (lu ý c¸c lp ë vÞ trÝ trôc (axial position) VÝ dô .. A AB2E 3 2 1 Bent SO B B 2, O3 Trigonal panar .. A AB Trigonal 3E 4 3 1 B B pyramidal NH3 B Tetrahedral .. A AB2E2 4 2 2 : B Bent H2O B Tetrahedral B B : A Distored AB IF4; SF4; 4E 5 4 1 tetrahedron B B XeO (or seesaw) 2F2 Trigonal bipyramidal B : B A AB3E2 5 3 2 B : T-shaped ClF3 Trigonal bipyramidal B : : A AB2E3 5 2 3 Linear XeF2, I3 B : Trigonal bipyramidal B B B A AB Square BrF5, 5E 6 5 1 B B piramidal XeOF .. 4 Octahedral .. B B AB A Square 4E2 6 4 2 B B planar XeF4, Icl4 .. Octahedral
c. Trêng cã liªn kÕt béi (multiple bond) cÇn lu ý liªn kÕt ®«i cã sù ®Èy h¬i m¹nh h¬n liªn kÕt ®¬n, vÝ dô: 8
Tóm tắt - CH3120 - HUST O .. = N C 126 > 120 O O 115 108 F F
5. Quan hÖ gi÷a §A§ vµ gãc liªn kÕt. §Ó so s¸nh c¸c chÊt cã c¸c ®iÒu kiÖn nh nhau theo
VSEPR, nhng l¹i cã gãc liªn kÕt kh¸c nhau, chóng ta ph¶i lu ý thªm ¶nh hëng cña §A§.
Chóng ta cã thÓ cã nhËn xÐt sau:
a. D·y hîp chÊt AXn - BXn - CXn - DXn: A,B,C,D lµ c¸c nguyªn tè thuéc cïng nhãm A cã X
gi¶m th× gãc liªn kÕt gi¶m.
b. D·y hîp chÊt YA’n - YB’n - YC’n - YD’n: Y lµ nguyªn tö trung t©m A’,B’,C’,D’ cïng nhãm
A cã X gi¶m th× gãc liªn kÕt t¨ng.
Nguyªn nh©n lµ khi c¸c bp ®Þnh chç gÇn nh©n cña nguyªn tö trung t©m chóng gÇn nhau h¬n,
®Èy m¹nh h¬n lµm cho gãc liªn kÕt chäc ra (cã lÏ ®Êy lµ nguyªn nh©n chÝnh). VÝ dô: H2O H2S H2Se Gãc liªn kÕt 105o 92o 91o O = SF2 O = SCl2 O = Br2
Gãc XSX thay ®æi thÕ nµo ? 92,3o 96,2o 98,2o
4.2. Quan hÖ gi÷a kiÓu lai ho¸ vµ CHHH cña ph©n tö. Ngêi ta còng cã thÓ dù ®o¸n CHHH
cña ph©n tö theo c¸ch thø hai lµ dùa vµo kiÓu lai ho¸.
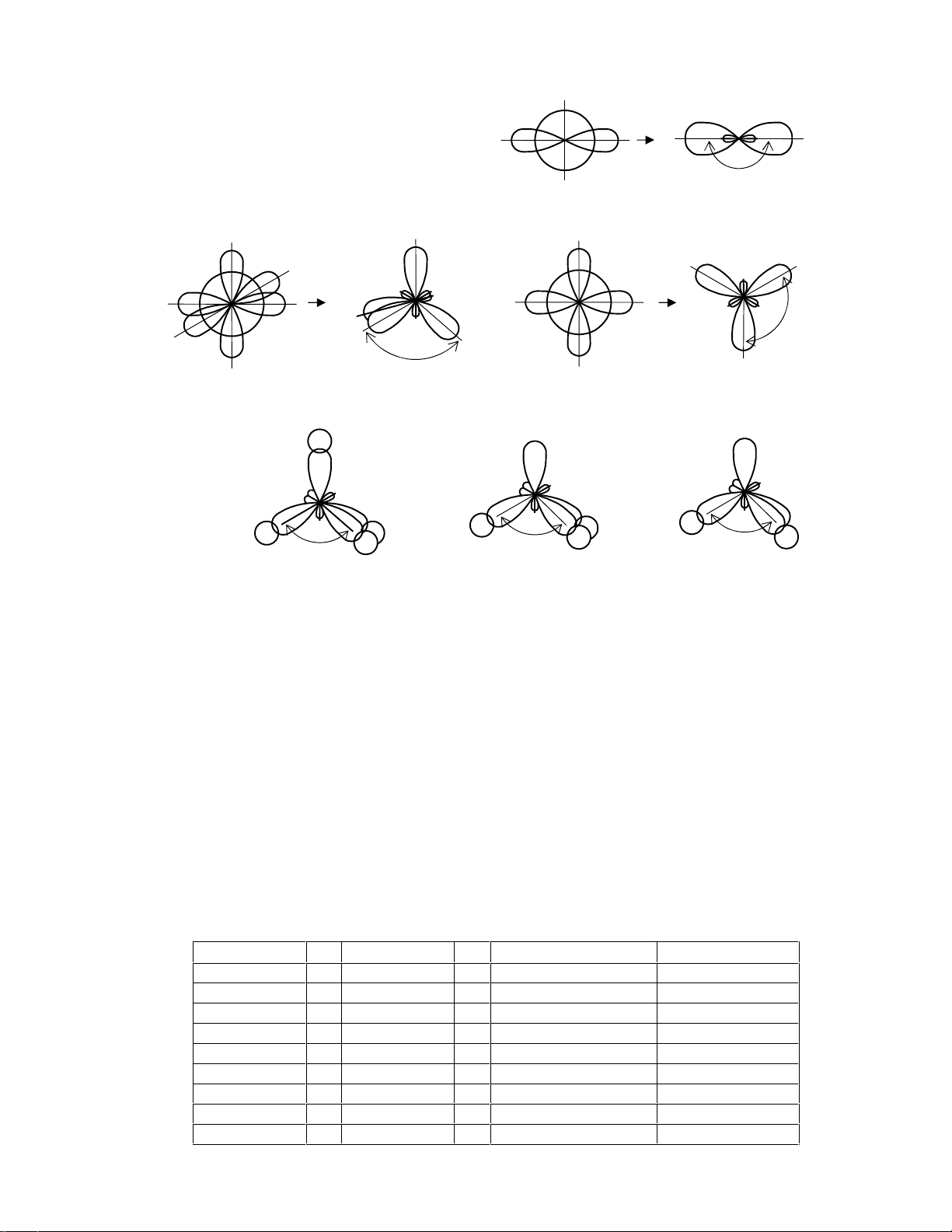
a. Lai ho¸ (Hybridization) vµ liªn kÕt. Khi t¹o liªn giwax CA víi c¸c nguyªn tö phèi tö, ë CA
cã thÓ x¶y sù tæ hîp (lai ho¸) c¸c AO hã trÞ cã E xÊp xØ nahu, song ®Þnh híng kh¸c nhau ®Ó
t¹o ra c¸c AO lai ho¸ (hybrid orbitals) ®ång nhÊt vÒ n¨ng lîng vµ cã sù ®Þnh híng trong
kh«ng gian thuËn lîi cho sù t¹o liªn kÕt (xem h×nh díi). 9
Tóm tắt - CH3120 - HUST 180o H×nh 2 (s + p) orbitals Two sp orbitals 120o 109o23’
(s + p + p + p) orbitals 4 sp3 orbitals
(s + p + p) orbitan 3 sp2 orbitals
Hybridisation of valence orbitals H CH4 H3N H2O N O C H H H H H H H H 109o28’ 107,3o 104,5o
Overlaping of orbitals in CH4, H3N and H2O molecules
CÇn lu ý c¸c ®iÒu kiÖn lai ho¸ bÒn: trong chu k×, trong nhãm kh¶ n¨ng lai ho¸?
b. Lai ho¸ vµ CHHH cña ph©n tö. §Ó dù ®o¸n CHHH cña ph©n tö, còng ph¶i thu c¸c bíc:
C«ng thøc Lewis c«ng thøc Gillespie SN: q = m + n kiÓu lai ho¸. C¨n cø vµo m dù ®o¸n CHHH cña ph©n tö. VÝ dô: C¸c ph©n tö CH +
4(NH4 ); NH3; H2O cã c«ng thøc Lewis kh¸c nhau H .. .. | H – N – H H – O – H .. H – C – H | | H H
c«ng thøc cÊu t¹o kh¸c nhau: AX4, AX3E, AX2E2 nh vËy: q = 4 + 0 = 3 + 1 = 2 + 2, kiÓu
lai ho¸ lµ sp3 tuy nhiªn CHHH th× kh¸c nhau: Tø diÖn, Th¸p tam gi¸c, g·y gãc.
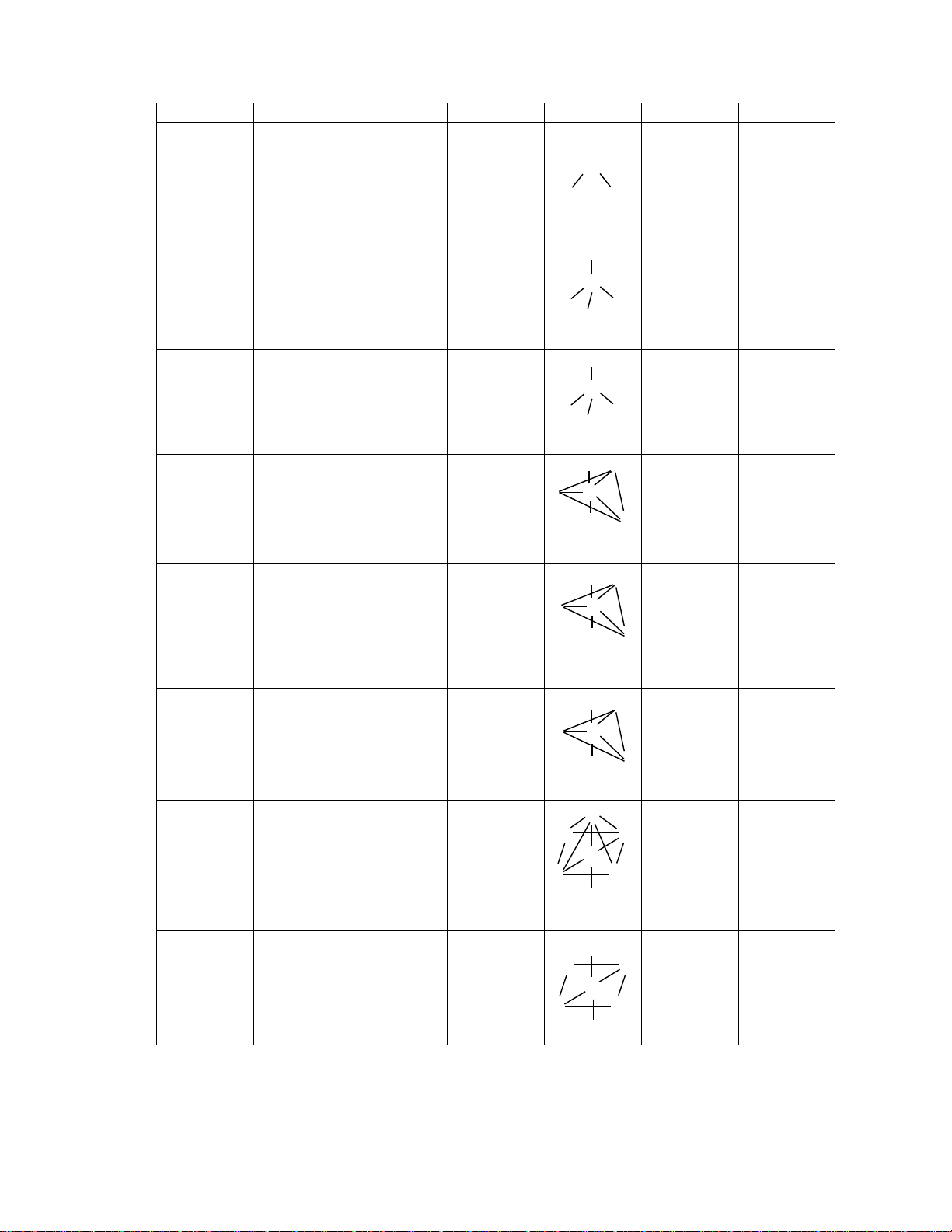
Quan hÖ gi÷a q, kiÓu lai ho¸, CHHH cña ph©n tö ®îc nªu trong b¶ng 1. C«ng thøc q KiÓu lai ho¸ m CHHH VÝ dô (AXmEn) AX2 2 Sp 2 Th¼ng BeH2, Cl2 AX3 3 sp2 3 Tam gi¸c ph¼ng BF3 AX - 2E 3 sp2 2 G·y gãc NO2 , SO2, O3 AX + 4 4 sp3 4 Tø diÖn CH4, NH4 AX3E 4 sp3 3 Th¸p tam gi¸c NH3, H3O+ AX2E2 4 sp3 2 G·y gãc H2O AX5 5 sp3d 5 Th¸p ®«i tam gi¸c PCl5 AX4E 5 sp3d 4 C¸c bËp bªnh SF4 10
Tóm tắt - CH3120 - HUST AX3E2 5 sp3d 3 Ch÷ T ClF3 AX2E3 5 sp3d 2 Th¼ng XeF2 AX 2- 6 6 sp3d2 (d2sp3) 6 B¸t diÖn SF6, SiF6 AX5E 6 sp3d2 (d2sp3) 5 Th¸p vu«ng IF5 AX4E2 6 sp3d2 (d2sp3) 4 Vu«ng ph¼ng ICl4
iv. §é ph©n cùc ph©n tö. NhiÒu tÝnh chÊt lÝ häc cña c¸c chÊt liªn quan mËt htiÕt ®Õn ®é
ph©n cùc ph©n tö. Ch¼ng h¹n khi kh¶o s¸t tÝnh tan cña chÊt tan trong dung m«i, chóng ta ®·
biÕt mét chÊt tan ph©n cùc thên tan dÔ trong dung m«i ph©n cùc vµ Ýt tan trong dung m«i kh«ng ph©n cùc.
Do vËy cÇn ph¶i nªu mét sè lu ý vÒ sù ph©n cùc ph©n tö
1. M«men lìng cùc (dipoli moment) kÝ hiÖu = l.q : q lµ ®iÖn tÝch cña tõng cùc, ®¬n vÞ
®o lµ culong (C); l lµ kho¶ng c¸ch gi÷a hai cùc. VËy ®¬n vÞ ®o cña lµ Cm. Tuy nhiªn
nÕu lÊy theo ®¬n vÞ nµy th× gi¸ trÞ cña qu¸ bÐ nªn trong thùc tÕ ngêi ta chän ®¬n vÞ
Debye (§¬ bai), kÝ hiÖu lµ D. D = 1 29 10 .
Cm. C¸c chÊt kh«ng ph©n cùc th× = 0, chÊt 3 ph©n cùc 0.
2. C¸ch x¸c ®Þnh mét chÊt cã ph©n cùc kh«ng? ph¶i theo c¸c bíc sau:
X¸c ®Þnh cÊu tróc kh«ng gian.
§iÒu kiÖn cña chÊt ph©n cùc lµ ph¶i chøa liªn kÕt ph©n cùc vµ ph¶i cã cÊu tróc bÊt ®èi xøng..
3. §Æc tÝnh ion cña liªn kÕt céng trÞ ®¬n: C¸c liªn kÕt céng ho¸ trÞ ph©n cùc ®Òu mang
®Æc tÝnh ion (nhiÒu hay Ýt nã biÓu hiÖn ®é ph©n cùc cña liªn kÕt) còng nh liªn kÕt ion
còng mang ®Æc tÝnh céng ho¸ trÞ. §Ó tÝnh ®Æc tÝnh ion cña mét liªn kÕt céng ho¸ trÞ
®¬n, ta cã thÓ lËp c«ng thøc sau: NÕu liªn kÕt A–B mang 100% ®Æc tÝnh ion víi q =
1e, l = 1Ao th× = 1Ao.1e = 10-10.1,6.10-19Cm = 4,8D. Víi liªn kÕt A – B: q < e vµ l >
1Ao th× |(+®)Æ| t= |(-)| = q = e vµ kho¶ng c¸ch gi÷a 2 ®iÖn tÝch lµ l.Ao = l.Ao..e = 4,8.l. o l(A )
< 1, lµ ®Æc tÝnh ion cña liªn kÕt céng ho¸ trÞ. = (2.3) 8 , 4 l . (D)
VÝ dô: liªn kÕt H – Cl : l = 1,27Ao (®o ®îc) = 1,07D = 0,175 cã 17,5% ®Æc tÝnh ion.
iii. mét sè lu ý vÒ ph¬ng ph¸p mo - lcao
1. CÊu h×nh e cña c¸c ph©n tö A2 (A lµ c¸c nguyªn tö chu k× 2)
2. CÊu h×nh e cña phèi tö AB (A, B lµ c¸c nguyªn tè thuéc chu k× 2)
3. BËc liªn kÕt, ®é bÒn liªn kÕt, tõ tÝnh cña ph©n tö. iv. c¸c liªn kÕt yÕu
IV.1. Liªn kÕt Hidr«
1. B¶n chÊt cña liªn kÕt Hidr«. N¨ng lîng cña liªn kÕt Hidr« kho¶ng 8 40 KJ.mol-1
2. C¸c lo¹i hîp chÊt cã liªn kÕt Hidr«
3. ¶nh hëng cña liªn kÕt Hidr« lªn tÝnh chÊt lÝ häc cña c¸c chÊt chøa liªn kÕt nµy.
IV.2. Lùc Van-der-Waals (xem ho¸ häc V« c¬)
v. Entanpi Hidrat ho¸ (Enthalpy of Hydrattion) 1. Kh¸i niÖm: X(k) X H2O (aq) H oh < 0 VÝ dô: Na(k) H2O Na+(aq) : 422,59 KJ.mol-1
2. C¸c yÕu tè ¶nh hëng lªn H oh
a. §iÖn tÝch cña ion: ®iÖn tÝch t¨ng H o h t¨ng
b. KÝch thíc cña ion, ph©n tö cµng lín gi¸ trÞ H o h gi¶m: HF (-11,5); HCl (-4,2)
vii. c¸c lu ý vÒ liªn kÕt ion
1. Sù t¹o thµnh vµ ®Æc tÝnh cña liªn kÕt ion 11 Tóm tắt - CH3120 - HUST
a. §iÒu kiÖn t¹o thµnh liªn kÕt ion, dùa vµo ®é ©m ®iÖn. CÇn lu ý viÖc ph©n lo¹i liªn kÕt ion,
céng ho¸ trÞ mang tÝnh t¬ng ®èi.
b. §Æc tÝnh cña liªn kÕt ion: kh«ng cã tÝnh b·o hoµ, kh«ng cã tÝnh ®Þnh híng.
2. N¨ng lîng m¹ng líi ion (U) (Lattice Energy)
a. Kh¸i niÖm: Li+(k) + F -(k) LiF(r) ULiF = -1008KJ.mol-1
b. X¸c ®Þnh U chóng ta cã thÓ x¸c ®Þnh U theo nhiÒu c¸ch kh¸c nhau dùa vµo c¸c sè liÖu thùc
nghiÖm vÒ c¸c ®¹i lîng: H o o
s , Hnt , I, Ae … råi lËp chu tr×nh nhiÖt ®éng häc gäi lµ chu tr×nh
Born – Haber (Born – Haber cyde) ®Ó tÝnh U. HoÆc thiÕt lËp c¸c c«ng thøc tÝnh tuy kh¸
phøc t¹p nhng l¹i cã Ých cho viÖc t×m hiÓu c¸c yÕu tè ¶nh hëng lªn n¨ng lîng m¹ng líi.
Chóng ta lµm quen víi mét sè sau: 1b. Chu tr×nh Born – Haber.
Gi¸ trÞ cña c¸c ®¹i lîng Na(r) + 1 Cl (k) H o( s ) 411 NaCl(r) 2 2 ®îc cho trong ngoÆc H o 1 nt (105,7) - ECl – Cl(-242) UNaCl ? 2 Na(k) + Cl2(k)
Na+(k) + Cl-(k) I( Na )(496),Ae(Cl)(349) H o o 1 s = Hnt -
ECl-Cl + I + Ae + UNaCl UNaCl = -757 KJ.mol-1 2 Z . A . N 2 Z . e . 1
2b. Ph¬ng tr×nh Born – LandÐ: U = 1 (2.4) 4 . d . o o n
N = 6,022.1023 cÆp ion (ion pairs) mol-1: sè Avogadro (Avogadro ‘s number)
A lµ h»ng sè Madelung (Madelung constant = MC); gi¸ trÞ cña nã phô thuéc vµo kiÓu cÊu tróc
tinh thÓ. VÝ dô kiÓu cÊu tróc NaCl lËp ph¬ng t©m khèi (body-centeredcubic - bcc) cã A =
1,74756; KiÓu CsCl: lËp ph¬ng t©m diÖn (face-centered cubic – fcc) cã A = 1,726267.
Z+, Z- lµ ®iÑn tÝch cña c¸c ion, VÝ dô: Na+: Z = 1; Cl- : Z = 1.
e lµ ®iÖn tÝch e; = 3,1416; o: h»ng sè ®iÖn m«i cña ch©n kh«ng cã gi¸ trÞ lµ 8,85.10-12 SI; do = r+ + r– (m)
n (hoÆc nB): hÖ sè ®Èy Born, cã gi¸ trÞ tuú thuéc vµo cÊu h×nh e cña c¸c ion. Víi ion cã cÊu
h×nh e t¬ng tù c¸c khÝ hiÕm: He, Ne, (Ar, Cu+), (Kr, Ag+), (Xe, Au+) th× n cã gi¸ trÞ t¬ng
øng: 5, 7, 9, 10, 12. nÕu 2 ion cã cÊu h×nh e kh¸c nhau th× lÊy gi¸ trÞ trung b×nh (average).
§Ó ®¬n gi¶n khi tÝnh ta cã thÓ chuyÓn c«ng thøc (2.2) sang c«ng thøc (2.3). Z . A . N 2 Z . e . K . 1 U = 1 (J.mol-1) K = 9.1019 vµ do (Ao) (2.5) d o n
3b. Ph¬ng tr×nh Kapustinskii (c«ng thøc cña Kapustinskii) qua sù nghiªn cøu vÒ cÊu tróc
tinh thÓ: quan hÖ gi÷a h»ng sè Madelung, sè ion trong mét “ph©n tö” ion* vµ b¸n kÝnh ion …
Kapustinskii ®· ®Ò nghÞ mét c«ng thøc cho phÐp tÝnh U, cã theer biÓu diÔn díi d¹ng: n Z . Z . K . ' 345 , 0 U = 1 KJ.mol-1 (2.6) d d o o
n: sè ion trong mét “ph©n tö” cña hîp chÊt ion. K’: h»ng sè = 1202 (khi U cã ®¬n vÞ lµ KJ.mol-1).
C¸c c«ng thøc (2.3); (2.4) thêng cã sai sè so víi thùc nghiÖm. V× khi x©y dùng c¸c c«ng thøc
nµy, c¸c t¸c gi¶ coi lµ hîp chÊt ion thuÇn tuý, cßn thùc tÕ th× trong c¸c hîp chÊt ion cã mét
phÇn ®Æc tÝnh liªn kÕt céng ho¸ trÞ.
Pauling ®· ®a ra mét gîi ý vÒ mèi quan hÖ gi÷a ®Æc tÝnh ion vµ cña 2 nguyªn tè trong liªn kÕt ( lµ ®é ©m ®iÖn) §Æc tÝnh §Æc tÝnh 1 20% 1,5 40% 2 60% 2,5 80%
C¸c yÕu tè ¶nh hëng lªn n¨ng lîng m¹ng líi ion 12
Tóm tắt - CH3120 - HUST
Gi¸ trÞ cña U cµng lín khi ®iÖn tÝch cña ion cµng lín
Sè ion trong mét ph©n tö t¨ng dÉn ®Õn gi¸ trÞ cña U cµng lín
B¸n kÝnh cña c¸c ion cµng nhá, gi¸ trÞ cña U cµng lín 13
Tóm tắt - CH3120 - HUST
Ch¬ng 3. chiÒu cña ph¶n øng ho¸ häc v« c¬
I. Ph¶n øng trao ®æi. §Ó n¾m ®îc chiÒu cña ph¶n øng trao ®æi cÇn nhí c¸c qui t¾c x¸c
®Þnh chÊt ®iÖn ly trong dung dÞch lµ ®iÖn ly m¹nh hay yÕu, ®Ó viÕt chÝnh x¸c ph¬ng tr×nh ion,
tõ ®ã míi n¾m ®îc c¸ch xÐt chiÒu ph¶n øng. 1. ChÊt ®iÖn ly m¹nh
a. Kh¸i niÖm: §iÖn ly hoµn toµn: ph¬ng tr×nh ®iÖn ly viÕt dÊu hoÆc =, trong ph¬ng tr×nh ion, viÕt díi d¹ng ion.
VÝ dô: HCl = H+ + Cl-; FeS + 2HCl = FeCl2 + H2S, FeS + 2H+ = Fe2+ + H2
b. CÇn n¾m v÷ng c¸c chÊt ®iÖn ly m¹nh
Axit m¹nh: Hidroaxit vµ Oxit axit (qui t¾c Pauling)
Baz¬ m¹nh: Hidroxyt cña kim lo¹i kiÒm vµ kiÒm thæ
C¸c muèi tan trõ CuCl2, HgCl2 … Muèi axit 2. TÝnh tan
TÝnh tan cña c¸c muèi trung tÝnh th«ng dông (2 nhãm: nhãm dÔ tan vµ nhãm khã tan)
TÝnh tan cña c¸c muèi axit cÇn nhí qui t¾c sau: HnX n =2, 3. X gèc axit X2- th× muèi chøa gèc H - - -
(n-1)X-: HS-, HCO3 , HSO4 , H2PO4 hÇu hÕt tan
3. Qui t¾c viÕt ph¬ng tr×nh ion:
N¾m v÷ng qui t¾c: trong ph¬ng tr×nh ion chØ cã mÆt chÊt kÕt tña, chÊt dÔ bay h¬i, chÊt ®iÖn ly
(n»m ë d¹ng ph©n tö) cßn chÊt ®ienÑ ly m¹nh (n»m ë d¹ng ion)
VÝ dô: Na2CO3 + H2SO4, CaCO3 + H2SO4, H3PO4 + NaOH = NaH2PO4 + H2O
H2SO4 + Ca3(PO4)2 = Ca(H2PO4)2 + CaSO4, H2S + CuSO4 = CuS + H2SO4
Zn + H2SO4 = ZnSO4 + H2S + H2O …
4. Quan hệ giữa độ hoà tan và tích số tan
5. Chiều của phản ứng trao đổi
a. Điều kiện để xảy ra phản ứng trao đổi trong dung dịch là tạo ra sản phẩm (kết tủa, điện ly
yếu, dễ bay hơi) để làm giảm nồng độ của các chất phản ứng, khi đó G của phản ứng sẽ < 0.
b. Công thức tính hằng số cân bằng của phản ứng xảy ra trong dung dịch, không có sự thay
đổi số oxi hoá:Go = -RTlnK
K là hằng số cân bằng của phản ứng phân li của chất điện ly yếu (Ka, Kb, Tt)
c. Cách lập chu trình nhiệt động để xét chiều phản ứng VÝ dô: XÐt ph¶n øng sau: CaCO3 + 2H+ Ca2+ + CO2 + H2O (1)
Go = Go1 + Go2 + Go3 Go1 (1) (3) Go3 -RTlnK = - RTlnT Ca2+ + CO 2- (2) 3 + H+ Ca2+ + H2CO3 + RTlnK1K2(H2CO3) –RTlnK3 Go2 K = 1 T . K . CaCO 3 3 K K (H CO ) 1 2 2 3
Tt(CaCO3) = 4,8.10-9; H2CO3: K1 = 4.10-7 K2 = 5.10-11 K3 = 600
Cã thÓ tÝnh ®îc K vµ suy ra chiÒu cña ph¶n øng trªn ë ®iÒu kiÖn chuÈn, 298K VÝ dô 2: MgCO 2- 3 + 2OH- Mg(OH)2 + CO3 (2) K 1 1 T K = T . MgCO3 T MgCO3 T Mg(OH)2 Mg(OH)2 Mg2+ + CO 2- 3 + 2OH-
Tõ kÕt qu¶ tÝnh khi biÕt T = 10-5 T
= 5.10-12 chóng ta dÔ dµng biÕt ®îc chiÒu cña MgCO3 Mg (OH )2
ph¶n øng ë ®iÒu kiÖn chuÈn vµ 298K.
ii. ph¶n øng oxi ho¸ khö 14 Tóm tắt - CH3120 - HUST
1. Mét sè lu ý vÒ c¸ch x¸c ®inh sè oxi ho¸
a. Trong ®¬n chÊt sè oxi ho¸ = 0
b. Trong hîp chÊt cÇn nhí c¸c lu ý:
1b. Nhí c¸c nguyªn tè chØ mang 1 sè oxi ho¸ d¬ng hoÆc ©m duy nhÊt: F (-I), kim lo¹i
kiÒm, Ag (+I), kim lo¹i nhãm IIA, Zn (+II), Al (III) …
2b. Trong mét chÊt cã nguyªn tè mang 2 sè oxi ho¸ kh¸c nhau: NH4NO3 (N: -III, +V); Fe 2-
3O4 (Fe: +II, +III); Pb3O4 (Pb: +II, +IV); S2O3 (S: +VI, -II)
2. N¾m v÷ng c¸ch c©n b»ng ph¶n øng oxi ho¸ khö trong 2 trêng hîp sau
a. Kh«ng cã sù tham gia cña m«i trêng. VÝ dô: KClO3 KCl + Cl2
b. Cã sù tham gia cña m«i trêng: H+, H2O, OH-
XÐt c¸c ph¶n øng sau ®Ó rót ra c¸c qui t¾c:
KClO3 + KI + H2SO4 KCl + I2 + K2SO4 + H2O (1)
K2Cr2O7 + SO2 + H2SO4 Cr2(SO4)3 + K2SO4 + H2O (2)
KMnO4 + KNO2 + H2O MnO2 + KNO3 + KOH (3)
KMnO4 + K2SO3 + KOH K2MnO4 + K2SO4 + H2O (4)
K2MnO4 + CO2 KMnO4 + MnO2 + K2CO3 (5)
MnO2 + KClO3 + K2CO3(nãng ch¶y) K2MnO4 + KCl + CO2 (6)
c. Trêng hîp 1 chÊt cã 2 nguyªn tè nhêng e:
VÝ dô: As2S3 + HNO3 H3AsO4 + H2SO4 + NO
3. ThÕ khö ph¶i n¾m ®îc c«ng thøc tÝnh thÕ khö cña c¸c cÆp oxi ho¸ khö 1a. Mn+/M : M lµ kim lo¹i
2b. X2(k)/X-(dd) vµ H+(dd)/H2(k) 3c. O2/H2O Víi cÆp O , 0 059 o 2/H2O: O2 + 4e + 4H+ 2H2O 4 lg P .[H ] O 4 2
o = 1,23V khi P = 1atm, [H+] = 10-14 [OH-] = 1M ta sÏ cã o(O O 2/OH-) 2 4d. CÆp M(OH)3/M(OH)2 M(OH)3 + 1e M(OH)2 + OH- o [M3 ] M3 / M2 , 0 059 lg
®îc tÝnh qua TM(OH)3 vµ TM(OH)2 vµ OH- [M 2 ] 5e. CÆp M(OH)n/M M(OH)n + ne M + n OH- o , 0 059 Mn / lg[M n M
] [Mn+] tÝnh theo TM(OH)n, [OH-] n 6g. CÆp AgCl/Ag AgCl Ag + Cl-
TÝnh o(AgCl/Ag) biÕt o(Ag+/Ag) = 0,8V TAgCl = 10-10 7h. CÆp ClO - - 3 /Cl-; ClO3 /Cl2
4. TÝnh thÕ ®iÖn cùc
1. §iÖn cùc Pt/Sn4+ C1; Sn2+ C2 (vµ c¸c ®iÖn cùc t¬ng tù)
2. §iÖn cùc Mg/dd b·o hoµ Mg(OH)2 (vµ c¸c ®iÖn cùc t¬ng tù) 5. D·y thÕ khö
1. D·y thÕ khö: VÝ dô: ClO -3 HClO Cl2 Cl- 1,425V 1,63V 1,36V
2. øng dông cña d·y thÕ khö:
X¸c ®Þnh ®îc tr¹ng th¸i nµo kÐm bÒn
Dù ®o¸n s¶n phÈm ph¶n øng
6. ChiÒu cña ph¶n øng oxi ho¸ khö
a. Nguyªn t¾c xÐt chiÒu ph¶n øng Dùa vµo G = -nFE
NÕu ph¶n øng ë ®iÒu kiÖn chuÈn th× dùa vµo Go = -nFEo
b. XÐt chiÒu ph¶n øng cho s½n Go = -nFE < 0 E = ox - kh > 0 ox > kh
c. ViÕt ph¶n øng x¶y ra th× xÐt 15
Tóm tắt - CH3120 - HUST
VÝ dô: OX1, Kh1 (OX1/Kh1) vµ OX2, Kh2 (OX2/Kh2) nÕu (OX1/Kh1) > (OX2/Kh2) th× ph¶n øng x¶y ra: OX1 + Kh2 Kh1 + OX2
iii. tr¹ng th¸i c©n b»ng ho¸ häc
1. C¸c ®Æc trng cña c©n b»ng
§iÒu kiÖn cña c©n b»ng ho¸ häc: ®iÒu kiÖn cña c©n b»ng ho¸ häc lµ G = 0 (vÒ mÆt
nhiÖt ®éng häc) vt =vn (vÒ mÆt ®éng häc).
Quan hÖ gi÷a Go vµ h»ng sè c©n b»ng: Go = -RTlnK
§Æc tÝnh cña h»ng sè c©n b»ng lµ: Nã thÓ hiÖn cho mét ph¶n øng x¸c ®Þnh, chØ thay
®æi khi nhiÖt ®é thay ®æi, tham sè nhiÖt ®éng (thÓ hiÖn h»ng sè K) nÕu cã thay ®æi còng kh«ng
lµm h»ng sè c©n b»ng thay ®æi.
2. Sù chuyÓn dÞch c©n b»ng
3 t¸c ®éng cã thÓ lµm chuyÓn dÞch c©n b»ng lµ nhiÖt ®é, ¸p suÊt vµ nång ®é.
V©n dông qui t¾c pha ®Ó t×m c¸c th«ng sè nhiÖt ®éng cã thÓ lµm c©n b»ng chuyÓn
dÞch t×m ®iÒu kiÖn thuËn lîi cho qu¸ tr×nh ph¶n øng.
iv. mét sè lu ý vµ h vµ S
1. TÝnh Ho298 cña ph¶n øng qua Hos; biªu thøc Kirhoff
2. TÝnh So cña ph¶n øng qua So298
3. Ho chuyÓn pha vµ So chuyÓn pha.
Ch¬ng 4. mét sè tÝnh chÊt chung cña c¸c chÊt v« c¬ i. Sù hoµ tan
1. Qu¸ tr×nh hoµ tan: lµ qui tr×nh ph¸ vì liªn kÕt (lk) trong chÊt tan (ct) vµ trong dung m«i
(®Æc ®iÓm) ®Ó h×nh lk - ct – dm.
Ght = Hht - TSht Khi G < 0 qu¸ tr×nh hoµ tan sÏ x¶y ra. Mét c¸ch tæng qu¸t qu¸ tr×nh hoµ tan cã thÓ h×nh dung
ct – ct + dm – dm 2ct – dm -Ect – ct Edm – dm 2Ect – dm ct + ct + dm + dm
Hht = 2Ect – dm - (Ect – ct + Edm – dm) (4.1)
Khi Hht < 0 nghÜa lµ Ect – dm cã gi¸ trÞ lín h¬n tæng (Ect – ct + Edm – dm) th× sÏ thuËn lîi cho qu¸
tr×nh hoµ tan. NÕu kh«ng th× ph¶i phô thuéc vµo Sht.
Sht = Sdd – (Sct + Sdm), qu¸ tr×nh hoµ tan lµ sù hoµ trén lÉn nªn diÔn ra theo chiÒu lµm t¨ng ®é
hçn ®én cña hÖ nªn S thêng > 0 (trõ qu¸ tr×nh hoµ tan cña chÊt khÝ)
VÒ mÆt nhiÖt ®éng rÊt khã dù ®o¸n ®îc chÝnh x¸c sù hoµ tan cña c¸c chÊt. Ngêi ta chØ cã thÓ
®a ra mét sè nhËn xÐt ®îc rót tõ kinh nghiÖm (trong mét sè trêng hîp sau).
2. C¸c trêng hîp thêng gÆp
a. ChÊt tan kh«ng ph©n cùc hay ph©n cùc Ýt tan dÔ trong dung m«i kh«ng hay ph©n cùc Ýt.
VÝ dô: mì, dÇu b«i tr¬n tan dÔ trong x¨ng, Benzen ( = 0) tan dÔ trong Toluen, ph©n cùc Ýt ( = 0,4D).
b. ChÊt tan ph©n cùc tan dÔtg dung m«i ph©n cùc
VÝ dô: HCl (1,03D) tan dÔ trong H2O (1,84D).
c. ChÊt tan cã liªn kÕt Hidr« tan rÊt dÔ trong dung m«i cã liªn kÕt Hidr« (?)
VÝ dô: NH3 vµ H2O; C2H5OH vµ H2O
3. Qu¸ tr×nh hoµ tan cña hîp chÊt ion. XÐt vÝ dô: LiCl(r) + aq Hht Li+.aq + Cl- -ULiCl Hh(Li+) + Hh(Cl-) Li+ + Cl-(k) + aq
Hht = -ULiCl + Hh(Li+) + Hh(Cl-)
Cã thÓ rót ra nhËn xÐt sau: 16
Tóm tắt - CH3120 - HUST 1 - U = f
vËy khi (r++ r-) cµng nhá (- U) cµng lín, sù hoµ tan cµng khã r r 1 1
Hh (ion d¬ng) = - f ; Hh (ion ©m) = - f . VËy khi r+ , r- cµng nhá r r
Hh(+) ; Hh(-) cµng ©m, sù hoµ tan cµng dÔ
T¸c ®éng cña r+ , r- lªn U vµ Hh ngîc chiÒu nhau. Do ®ã khã t×m thÊy quy luËt tæng qu¸t cho
dù ®o¸n tÝnh tan mét c¸ch chÝnh x¸c. Chóng ta chØ cã thÓ ®a ra mét vµi nhËn xÐt mang tÝnh so
s¸nh ®Þnh tÝnh vµ tÊt nhiªn kh«ng thÓ tæng qu¸t chung cho tÊt c¶ c¸c hîp chÊt. NÕu xÐt ¶nh
hëng cña r+ vµ r- lªn tÝnh tan, ta sÏ thÊy khi. 1
a. Sù kh¸c nhau gi÷a r+, r- cµng Ýt thuËn lîi cho tÝnh tan v× lóc ®ã – U= f biÕn ®æi r r
chËm h¬n so víi Hh(+) vµ Hh(-) xÐt bµi tËp 1. LiF (0,7; 1,81); KF (1,33; 1,36); AgF (0,97;1,36); AgCl (0,97; 1,98)
b. Trêng hîp a ¸p dông cho sù chªnh lÖch r+, r- kh«ng qu¸ lín. Khi r- >> r+ th× mét c¸ch gÇn 1 1
®óng r- + r+ r- do ®ã – U f vµ Hh(-) f mang tÝnh bï trõ. Do vËytheo chiÒu r r
t¨ng r+ Hh(r+) cã gi¸ trÞ gi¶m tÝnh tan gi¶m.
VÝ dô: theo chiÒu: MgSO4 – CaSO4 – SiSO4 – BaSO4 vµ MgCO3 – CaCO3 – SiCO3 –
BaCO3 r+ t¨ng tÝnh tan gi¶m.
II. NhiÖt ®é chuyÓn pha cña c¸c chÊt
Trong ph¹m vi ch¬ng tr×nh chóng ta ®· kh¶o s¸t nhiÖt ®é nãng ch¶y, nhiÖt ®é s«i cña c¸c
chÊt (Xem thªm Ho¸ häc V« c¬ trang 69)
1. NhiÖt ®é nãng ch¶y (Tnc hay tnc)
a. Kh¸i niÖm nhiÖt ®ã b¾t ®Çu xuÊt hiÖn tinh thÓ r¾n ®Çu tiªn, xuÊt hiÖn c©n b»ng R L
víi bËc tù do C = R – q - = 1 – 0 + 2 – 2 = 1 hÖ nhÊt biÕn. VËy Tnc phô thuéc vµo ¸p suÊt
bªn ngoµi. Cã thÓ nhËn biÕt quan hÖ T = f(P) qua biÓu thøc Clapeyron dt T V nc ; V = VL – VR (4.2) dP H nc
b. Quan hÖ Tnc, Hnc, Scn ®îc thÓ hiÖn trong c©n b»ng pha: G nc nc = Hnc - TSnc = 0 Snc = (4.3) Tnc
Hnc lín h¬n nhiÒu so víi Snc nªn Tnc chñ yÕu phô thuéc vµo Hnc. VËy nãi chung nÕu n¨ng
lîng liªn kÕt trong tinh thÓ c¸c chÊt cã gi¸ trÞ cµng lín th× Tnc cµng cao (xem b¶ng V.I Ho¸ häc V« c¬ trang 70) VÝ dô: Al : T 10670 nc = k 933 , 11 42 2. NhiÖt ®é s«i Ts (ts)
a. Kh¸i niÖm lµ nhiÖt ®é, t¹i ®ã ¸p suÊt h¬i b·o hoµ cña chÊt láng b»ng ¸p suÊt bªn ngoµi, khi ®ã cã c©n b»ng L
H víi bËc tù do C còng b»ng 1 Ts phô thuéc vµo ¸p suÊt bªn ngoµi b. Quan hÖ Ts, S bh
bh, Hbh : Gbh = Hbh - TsSbh = 0 Ts = S bh
3. Mét vµi nhËn xÐt vÒ Tnc,Ts cña c¸c chÊt v« c¬. a. Kim lo¹i:
Cã Hnt cao, tøc lµ : N¨ng lîng liªn kÕt kim lo¹i lín sÏ cã Tnc, Ts cao vµ ngîc . VÝ dô:
W cã Hnt = 878,6 KJ.mol-1 tnc = 3410oC; ts = 5900oC .
Hg cã Hnt = 61KJ.mol-1 tnc = 38,50oC; ts = 356,66oC. b. Phi kim: 17
Tóm tắt - CH3120 - HUST
Cã m¹ng líi nguyªn tö víi liªn kÕt céng ho¸ trÞ bÒn cã tnc , ts cao.
VÝ dô: Than ch× cã tnc = 3650oC
Tån t¹i ë d¹ng ph©n tö X2 , gi÷a c¸c ph©n tö chØ tån t¹i lùc Vanderwaals yÕu nªn cã tnc , ts thÊp
VÝ dô: N2 (ts = -187,9), Cl2 (ts = -34,1), Br2 (ts =58,2) c. Hîp chÊt:
Hîp chÊt céng ho¸ trÞ cã cÊu tróc m¹ng ph©n tö th× ë tr¹ng th¸i r¾n vµ láng chØ tån t¹i
liªn kÕt Vanderwaals do ®ã cã tnc , ts thÊp nh H2O, NH3 ,CO2 , H2S …(nÕu trong hîp
chÊt nµo cã liªn kÕt Hidr« th× cã tnc , ts cao h¬n )
Hîp chÊt céng ho¸ trÞ tån t¹i ë m¹ng tinh thÓ cã liªn kÕt céng ho¸ trÞ bÒn th× cã tnc cao nh SiO2 cã tnc > 1600oC. d. Hîp chÊt ion:
V× tån t¹i liªn kÕt ion cã U lín nªn thêng cã tnc , ts cao.
III. tÝnh dÉn ®iÖn cña c¸c chÊt thuyÕt vïng
1. CÊu t¹o cña tinh thÓ kim lo¹i: H¬n 80% c¸c nguyªn tè ho¸ häc lµ kim lo¹i: bao gåm c¸c
nguyªn tè s, nguyªn tè d, nguyªn tè f vµ mét sè nguyªn tè p. NÕu kÎ mét ®êng chÐo tõ B qua
Si, As, Te, At th× c¸c nguyªn tè p n»m phÝa trªn ®êng chÐo (kho¶ng 10 nguyªn tè) lµ phi kim,
c¸c nguyªn tè ë ®êng chÕo lµ b¸n dÉn (nöa phi kim nöa kim lo¹i: B Si As Te At
TÝnh phi kim gi¶m, tÝnh kim lo¹i t¨ng
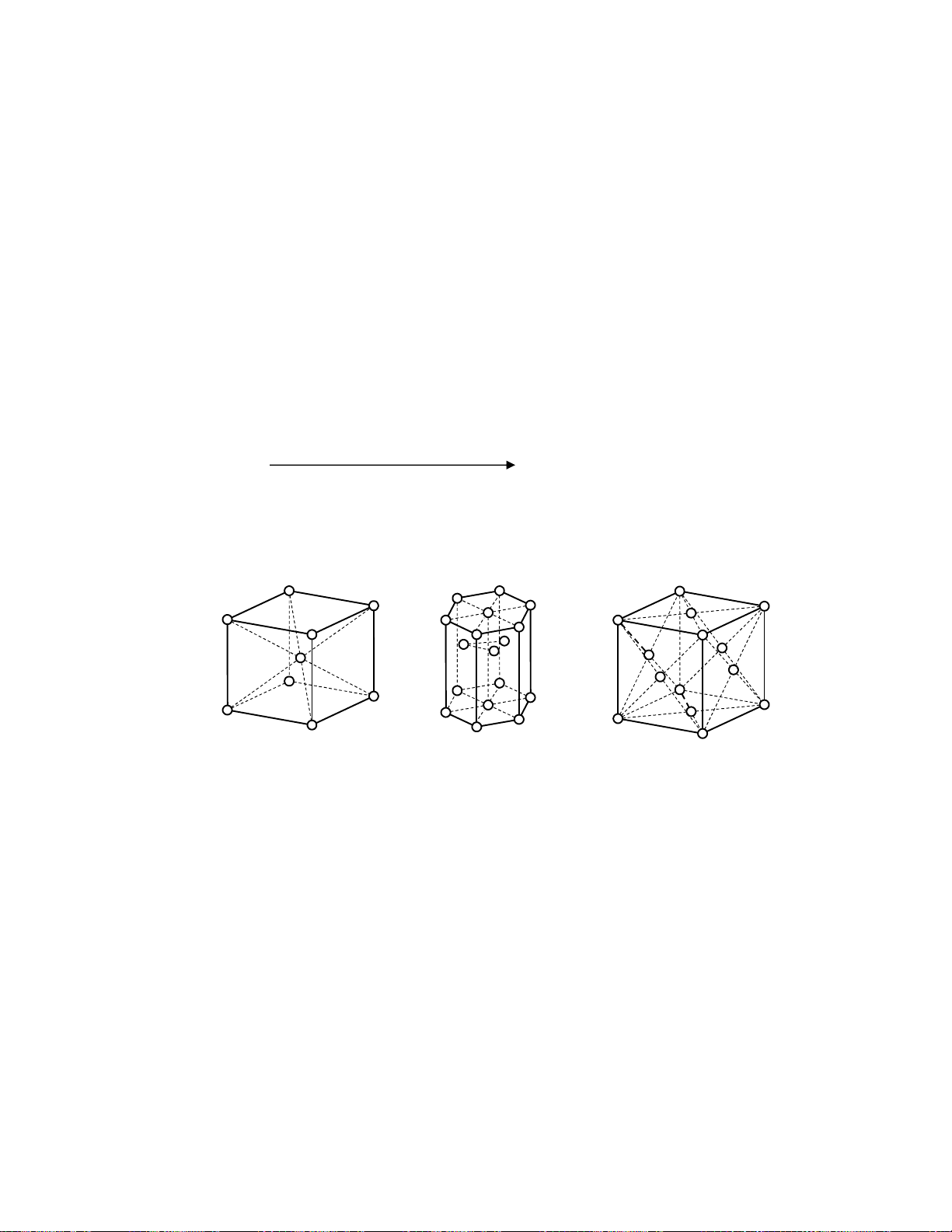
Kim lo¹i ë tr¹ng th¸i r¾n cã cÊu tróc tinh thÓ. Ba kiÓu m¹ng líi tinh thÓ cña hÇu hÕt kim lo¹i
a. LËp ph¬ng t©m khèi: kim lo¹i kiÒm, Fe, Ba …
b. M¹ng lËp ph¬ng t©m diÖn: Ca, Cu, Ag, Al …
c. M¹ng lôc ph¬ng: Be, Mg, Zn … LËp ph¬ng t©m khèi Lôc ph¬ng LËp ph¬ng t©m diÖn
2. Gi¶i thÝch tÝnh dÉn ®iÖn cña kim lo¹i: Cho ®Õn nay ngêi ta thêng gi¶i thÝch tÝnh dÉn ®iÖn cña kim lo¹i theo 2 c¸ch:
a. C¸ch thø nhÊt: Thao lý thuyÕt ®¬n gi¶n vÒ liªn kÕt kim lo¹i th× m¹ng líi kim lo¹i bao gåm
c¸c ion d¬ng kim lo¹i chiÕm chç ë c¸c nót m¹ng, xung quanh cã c¸c e ho¸ trÞ chuyÓn ®éng
t¬ng ®èi tù do. NghÜa lµ trong kim lo¹i c¸c e ho¸ trÞ tham gia liªn kÕt lµ kh«ng ®Þnh chç trong
toµn khèi kim lo¹i, chÝnh c¸c electron nµy g¾n c¸c ion kim lo¹i víi nhau t¹o ra ®é bÒn cña kim
lo¹i, g©y ra tÝnh dÉn ®iÖn, dÉn nhiÖt cña kim lo¹i.
Kim lo¹i chØ tån t¹i díi d¹ng nguyªn tö riªng biÖt khi ë tr¹ng th¸i h¬i (trõ mét sè rÊt Ýt ë
d¹ng ph©n tö 2 nguyªn tö. ThÝ dô: Li2).
b. C¸ch thø 2: ThuyÕt ®¬n gi¶n vÒ liªn kÕt kim lo¹i chhØ gi¶i thÝch ®Þnh tÝnh tÝnh dÉn ®iÖn kim
lo¹i ®Ó gi¶i thÝch ®îc b¶n chÊt cña liªn kÕt kim lo¹i, thêng dïng thuyÕt vïng (Band Theory BT).
ThuyÕt vïng dùa trªn c¬ së cña ph¬ng ph¸p MO-LCAO. C¸c MO ®îc t¹o thµnh b»ng sù tæ
hîp c¸c AO theo nguyªn t¾c 2AO khi tæ hîp cho 2MO (MO*: MO ph¶n liªn kÕt =
antibonding) cã n¨ng lîng cao hon MOlk (bonding) cã n¨ng lîng thÊp h¬n (xem l¹i Ho¸ §¹i
c¬ng). Nh vËy khi cã sù tæ hîp cña N AO sÏ t¹o ra N MO vµ sè AO tham gia tæ hîp cµng
lín sÏ t¹o mét sè MO cµng lín. ë chÊt r¾n, c¸c nguyªn tö n»m rÊt gÇn nhau, sè nguyªn tö
trong ®¬n vÞ thÓ tÝch rÊt lín (VÝ dô: ë Li lµ 4,56.1022 nguyªn tö/cm3) do ®ã sè AO tham gia tæ 18 Tóm tắt - CH3120 - HUST
hîp cùc lín t¹o ra mét sè cùc lín c¸c MO. C¸c MO ®îc s¾p xÕp gÇn nhau t¹o thµnh n¨ng lîng.
Sù ®iÒn e vµo c¸c AO trong vïng n¨ng lîng theo chiÒu n¨ng lîng t¨ng dÇn vµ mçi MO ®îc
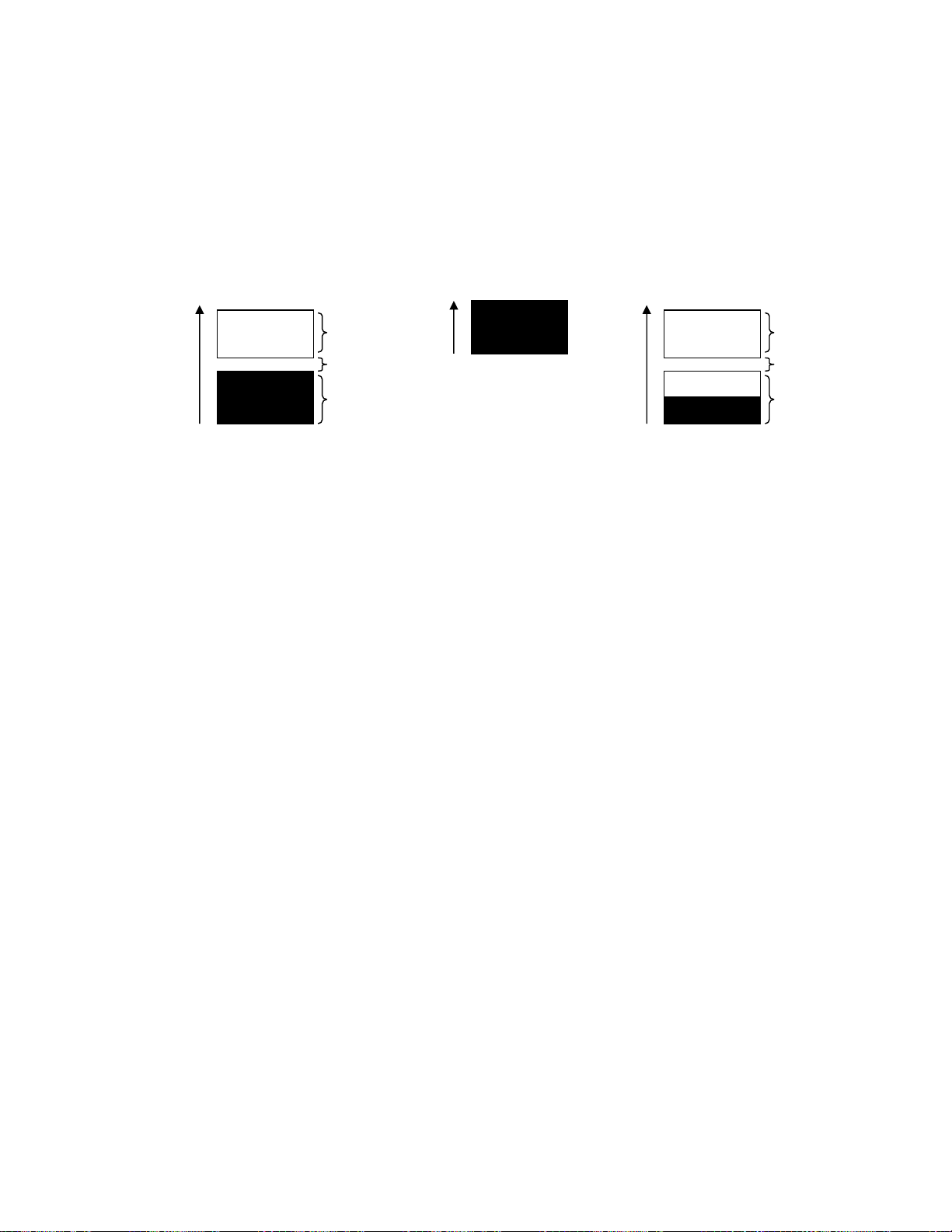
chiÕm bëi 2e cã spin ngîc nhau. KÕt qu¶ lµ: cã vïng ®· ®îc ®iÒn hÕt vïng b·o hoµ (VÝ dô
vïng ns2 lµ vïng b·o hoµ), cã vïng cha bÞ chiÕm hÕt, cßn mét phÇn trèng (VÝ dô vïng ns1 míi ®iÒn mét nöa). E E E CB CB Vïng cÊm Vïng ®iÒn ®Çy ns2 BG VB VB Vïng cha ®iÒn ®Çy ns1
Gi÷a c¸c vïng cã mét kho¶ng trèng gäi lµ vïng cÊm.
c. ChÊt dÉn ®iÖn (kim lo¹i), chÊt b¸n dÉn, chÊt c¸ch ®iÖn. Tªn c¸c vïng:
- Vïng ho¸ trÞ (Valence band - VB) lµ vïng ®· chiÕm hoµn toµn hay cha hoµn toµn øng víi
møc n¨ng lîng cao nhÊt (so víi c¸c vïng ®· bÞ chiÕm)
- Vïng dÉn (Contruction band - CB) lµ vïng trèng n»m ngay trªn vïng ho¸ trÞ.
Ph©n biÖt c¸c chÊt lµ kim lo¹i (chÊt dÉn ®iÖn), chÊt b¸n dÉn, chÊt c¸ch ®iÖn.
- Kim lo¹i – chÊt dÉn ®iÖn: VB cha ®iÒn hÕt hoÆc vïng ho¸ trÞ ®· bÞ chiÕm hÕt song VB vµ
CB xen phñ nhau, tiÕp xóc hay n»m gÇn nhau, chØ c¸ch nhau mét vïng cÊm rÊt hÑp cã E < 0,1eV.
Khi ®Æt kim lo¹i trong ®iÖn trêng e sÏ chuyÓn lªn vïng dÉn vµ tham gia vµo qu¸ tr×nh dÉn ®iÖn.
- ChÊt b¸n dÉn (Semiconductor): VB ®· ®îc ®iÒn ®Çy e song vïng cÊm cã E = 0,1 – 3eV.
Khi ®Æt trong ®iÖn trêng, kÌm theo mét t¸c dông kÝch (®un nãng hay chiÕu s¸ng) e míi
chuyÓn lªn CB ®îc tham gia vµo quÊ tr×nh dÉn ®iÖn.
- ChÊt c¸ch ®iÖn (Insulator) VB ®· ®îc ®iÒn ®Çy, vïng cÊm cã E > 3eV, e kh«ng chuyÓn lªn
CB ®îc ®Ó tham gia vµo qu¸ tr×nh dÉn ®iÖn. iv. tÝnh chÊt tõ 19



