






Preview text:
4/22/2012
Chromate and Dichromate Ions
CHƯƠNG 10. PHỨC CHẤT +4
Một số ñịnh nghĩa +3 1. Phức chất
2. Số phối trí của nhân trung tâm +2
3. Dung lượng phối trí của phối tử
Hằng số ñiện ly và hằng số bền của ion phức +5
Thuyết liên kết hóa trị
Thuyết trường tinh thể
1. Sự tách các orbital hóa trị d của nhân trung tâm bởi trường các phối tử In acid In base
trong ion phức 8 mặt ñều AL x+ 6
2. Sự phân phối các e hóa trị d trong ion phức 8 mặt ñều
3. Năng lượng làm bền bởi trường tinh thể Ws
4. Thuyết trường tinh thể áp dụng cho ion phức bốn mặt ñều AL x+ 4
5. Các yếu tố ảnh hưởng ñến thông số tách ∆
6. Sự tạo thành các ion phức có cấu trúc khác
7. Ưu nhược ñiểm của thuyết trường tinh thể Cr(OH) lưỡng tính
Thuyết orbital phân tử 3 KHÁI NIỆM Ion phức Coordination Chemistry
– Là tập hợp các cation và anion
Có ion trung tâm là kim loại Hợp chất phối Có các phối tử trí (phức chất) là hợp chất hóa học mà phân tử của nó chứa ion phức
Trong ion phức-complex tồn tại nguyên tử
trung tâm (nhân trung tâm), thường là các ion
kim loại chuyển tiếp và bao quanh nó là các
nguyên tử, phân tử hay ion liên kết gọi là phối tử-ligands
Ion phức ñược gọi là cầu nội-coordination
sphere, là vùng chứa nguyên tử hoặc ion
trung tâm và các phối tử.
Số phối trí-coordination number là số liên
kết σ của nhân trung tâm với các phối tử
Phức mang ñiện tích ñược gọi là ion phức- complex ion [CoCl(NO . 2)(NH3)4]+
Chất mà có chứa một hoặc nhiều ion phức
ñược gọi là hợp chất phối trí-coordination compound. 1 4/22/2012 Số phối trí biến ñổi phụ thuộc vào bản chất của phối tử, nồng ñộ, nhiệt ñộ, cầu ngoại. Cu2+, Ni2+, Zn2+ có số phối trí biến ñổi. Co3+, Cr3+, Rh3+, Ir3+, Pt4+, Ir4+ có số phối trí 6 không ñổi
Dung lượng phối trí của phối tử
Hanoi university of technology
Nhiều nguyên tử và ion, nhất là các kim loại chuyển cÊu t¹o cña phøc chÊt
tiếp, có nhiều orbital trống do ñó có thể nhận các cặp ñiện tử.
Dung lượng phối trí của phối tử là số liên kết σ của 1 Thµnh phÇn cña phøc chÊt
phối tử liên kết với nhân trung tâm.
ChÊt t¹o phøc (nguyªn tö trung t©m): cã thÓ lµ ion hay
Phối tử có dung lượng phối trí bằng 1 gọi là phối tử nguyªn tö
ñơn càng-monodentate ligands, như NH3, OH-, Cl-,
Phèi tö (Ligand): ion ng−îc dÊu víi nguyªn tö trung t©m NO - 2 , CN-
hoÆc ph©n tö trung hoµ ®iÖn
Phối tử có dung lượng phối trí lớn hơn 1 gọi là phối
§iÖn tÝch cÇu néi: lµ ion hay phÇn tö trung hoµ ®iÖn ®−îc
tử ña càng-polydentate ligand, như H
t¹o thµnh bëi nguyªn tö trung t©m vµ ligand 2N-CH2-CH2- NH 2- 2, C2O4 .
CÇu ngo¹i: nh÷ng ion n»m ngoµi vµ ng−îc dÊu víi cÇu
Phối tử ña càng liên kết với nhân trung tâm tạo néi
thành vòng 5 hoặc vòng 6 gọi là phức chất vòng càng-chelate.
Hanoi university of technology §iÖn tÝch cña ion phøc (®iÖn tÝch cÇu n«i) n+/- Ligand X+/- n Ion bï Ion kim lo¹i (nguyªn tö trung t©m) CÇu ngo¹i CÇu néi Ho¸ häc chÊt phøc 2 4/22/2012
Hanoi university of technology
Mét sè vÝ dô vÒ gäi tªn phøc chÊt [Cu(NH3)4]SO4 tetraaminecopper(II) sulfat [Ti(H2O)6][CoCl6] hexaaquatitanium(III) hexachlorocobaltat(III) [Co(NH3)6]Cl3 Hexaamin coban(III) clorua [Cr(NH3)6]Cl3 Hexaamin crom(III) clorua K4[Fe(CN)6] Kali hexaxianoferat(II) H[AuCl4] Axit tetracloroauric
C©n b»ng ho¸ häc trong phøc chÊt
Hanoi university of technology
1/ H»ng sè bÒn vµ kh«ng bÒn
Trong dung dÞch, phøc chÊt th−êng xuyªn ph©n ly
thµnh cÇu néi vµ cÇu ngo¹i t−¬ng tù nh− hîp chÊt v«
c¬ ®¬n gi¶n ph©n ly thµnh cation vµ anion [Ni(NH ) ]Cl = [Ni(NH ) ]2+ + 2Cl− 3 6 2 3 6 Na[Al(OH) ] = Na+ + [Al(OH) ]- 4 4
Ion phøc (cÇu néi) l¹i ph©n ly thµnh ion trung t©m vµ
phèi tö víi c¸c kh¶ n¨ng ph©n ly kh¸c nhau ®Æc tr−ng b»ng h»ng sè c©n b»ng: K [Ni(NH ) ]2+ = Ni2+ + 6 NH 3 6 3 + [Al(OH) ] − = Al3+ + 4OH-
AgCl(s) 2NH (aq) Ag(NH ) (aq) Cl − + → + (aq) 4 3 [ 3 2 ]
Hanoi university of technology
Hanoi university of technology C ×
§a sè ion phøc lµ chÊt kÐm ®iÖn ly, qu¸ tr×nh ph©n 2 + C 6 Ni NH3 −9 [Ni(NH ) ]2+ K = = 9,8.10
ly chuyÓn dÞch m¹nh vÒ phÝa bªn tr¸i (phÝa tao 3 6 C[Ni(NH ) ]2+ 3 6 phøc). C × 3+ C 4 − −33
§Ó chØ kh¶ n¨ng t¹o phøc cña nguyªn tö trung [Al(OH) ]- K = Al OH = 1.10 4 C
t©m ng−êi ta dïng h»ng sè bÒn tøc h»ng sè chØ [Al(OH) ]− 4
kh¶ n¨ng ng−îc l¹i cña kh¶ n¨ng ph©n ly. Ký
Kkb cµng lín th× kh¶ n¨ng ph©n ly cña ion phøc hiÖu: Kb
cµng m¹nh tøc ion phøc cµng kÐm bÒn Do ®ã cã quan hÖ:
Kkb ®−îc gäi lµ h»ng sè kh«ng bÒn 1 K = b K kb 3 4/22/2012
Hanoi university of technology
Hanoi university of technology
H»ng sè bÒn cña mét sè ion phøc: Ion phøc Kb Ion phøc Kb Ion phøc Kb Ion phøc K Xyanua Trilon B (E§TA) Bromua b Ion phøc Kb Ion phøc Kb Amoniac Hydroxi Clorua
[Ag(CN)2]- 7,08.1019 [Al(E§TA)]
1,4.1016 [AgBr2]- 2,19.107 [Ag(NH3)2]+ 1,0.108 [Al(OH)4]- 1,00.1033 [AgCl2]- 1 ,1.105 [Au(CN)2]- 2,0.1038 [Co(E§TA)]2− 2,0.106 [AuBr2]- 2,88.1012 [Cd(NH3)4]2+ 3,63.106 [Cd(OH)2]2- 2,63.108 [AuCl2]- 2,63.109
[Cd(CN)4]2- 1,29.1017 [Cu(E§TA)]2− 6,3.1018 [CdBr4]2- 5,01.103 [Co(NH3)6]2+ 2,45.104 [Cr(OH)4]- 7,94.1029 [AuCl4]2- 2,0.1021
[Co(CN)6]4- 1,23.1019 [Fe(E§TA)]2− 2,1.1014 [HgBr4]2- 1,0.1021 [Co(NH3)6]3+ 1,99.103
[Cu(OH)4]2- 3,63.1014 [CuCl2]- 2,24.105
[Cu(CN)2]- 1,00.1024 [Fe(E§TA)] − 1,3.1025 Iot ®ua
[Cu(NH3)4]2+ 51,07.1012 [Fe(OH)4]2- 3,63.108 [HgCl4]2- 1,66.1015 [Fe(CN) [Ni(NH 6]4- 7,94.1036
[Hg(E§TA)]2− 6,3.1021 [AgI2]- 5,5.1011 3)4]2+ 1,02.108 [Zn(OH)4]2- 5,02.1017 [Zn(NH [Fe(CN) 3)4]2+ 5,01.108 6]3- 7,94.1043 [Ni(E§TA)]2−
4,2.1018 [HgI4]2- 6,67.1029 [Ni(CN)4]2- 1,0.1031 [Zn(E§TA)]2−
3,2.1016 [PbI4]2- 8,32.103 Ho¸ häc chÊt phøc GV: TS. TrÇn ®¹i L©m
Hanoi university of technology
Hanoi university of technology
2/ H»ng sè bÒn tæng vµ h»ng sè bÒn theo tõng nÊc H»ng sè bÒn tæng: Ni2+ + NH C 3 [Ni(NH3)]2+ 2 + K [ Ni( NH3 )] 2 = = 4 6 , 81 . 0 b1 C C + × 2 C Ni NH + 3 [ Ni ( NH ) ]2 [Ni(NH )]2+ + NH [Ni(NH ) ]2+ 3 6 K = 3 3 3 2 C bt 2 + 6 + × K [ N i ( N H 3 ) 2 ] 2 = = 1,3 2 1 . 0 C C b 2 2 NH C Ni 3 + × 2 C [ N i ( N H N H 3 ) ] 3 [Ni(NH ) ]2+ + NH [Ni(NH ) ]2+ 3 2 3 3 3 C + K [ N i ( N H 2 ) ] K 3 3 1 = = 4 ,07 1 . 0
bt=Kb1.Kb2.Kb3.Kb4.Kb5.Kb6=1,02.108 b 3 C + × C [ N i ( N H 2 N H 3 ) 2 ] 3 [Ni(NH ) ]2+ + NH [Ni(NH ) ]2+
C¸c yÕu tè nhiÖt ®éng häc cña hÖ dung 3 3 3 3 4 C 2 + K [ Ni ( NH 3 ) 4 ] 1 = = 1 1 , 8 1 . 0 b 4 C + × 2 C [ N i ( N H N H
dÞch khi t¹o phøc vµ quan hÖ gi÷a chóng 3 ) 3 ] 3 [Ni(NH ) ]2+ + NH [Ni(NH ) ]2+ C 2 + 3 4 3 3 5 [ N i ( N H ) ] K 3 5 = = 4 ,2 6 b 5 víi h»ng sè c©n b»ng K: C + × 2 C [ N i ( N H N H 3 ) 4 ] 3 C 2 + [Ni(NH ) ]2+ + NH [Ni(NH ) ]2+ K [ N i ( N H 3 ) 3 = ] = 0 ,8 1 3 5 3 3 6 b 6 C + × 2 C [ N i ( N H N H 3 ) 2 ] 3 Ho¸ häc chÊt phøc GV: TS. TrÇn ®¹i L©m
Hanoi university of technology
Hanoi university of technology
Quan hÖ gi÷a h»ng sè bÒn cña phøc chÊt víi biÕn thiªn
n¨ng l−îng Gibbs cña qu¸ tr×nh t¹o phøc trong dung dÞch:
∆S0 cña hÖ còng t¨ng lªn m¹nh khi thay thÕ phèi tö ∆G0=-2,303.R.T.lgK
mét cµng b»ng phèi tö nhiÒu cµng. Tøc khi t¹o phøc
∆H0 cña ph¶n øng t¹o phøc ®−îc quyÕt ®Þnh bëi n¨ng chÊt vßng cµng.
l−îng lkÕt gi÷a nguyªn tö trung t©m vµ phèi tö. NÕu lkÕt ®ã VD1: [Cu(NH
gÇn víi lkÕt ion thuÇn tuý th× n¨ng l−îng lkÕt t¨ng lªn theo 3)4]2+ + 2en = [Cu(en)2]2+ + 4NH3
sù t¨ng ®iÖn tÝch vµ sù gi¶m b¸n kÝnh ion VD2:
∆S0 cña hÖ th−êng t¨ng lªn m¹nh khi t¹o phøc. Do sù hçn [Cu(en)2]2+ rÊt bÒn h¬n [Cu(NH3)4]2+
lo¹n cña hÖ t¨ng lªn bëi sù ph¸ vá solvat cña ion trung t©m (K =1,35.1020) (K
vµ phèi tö nªn nhiÒu ph©n tö dung m«i ®−îc gi¶i phãng khi b b=1,07.1012) t¹o phøc. [Ni(en)3]2+ rÊt bÒn h¬n [Ni(NH3)6]2+ [M(H (K =1,29.1019) (K
2O)6]n+ + 6L- = [ML6]n-6 + 6H2O b b=1,02.108) Ho¸ häc chÊt phøc GV: TS. TrÇn ®¹i L©m Ho¸ häc chÊt phøc 4 4/22/2012
Hanoi university of technology
Hanoi university of technology
3/ HiÖu øng vßng cµng
4/ §é bÒn cña phøc chÊt vµ ®é tan cña kÕt tña
Kh¸i niÖm hiÖu øng vßng cµng: ®ã lµ sù t¨ng ®é
Sù t¹o phøc cã ¶nh h−ëng lín ®Õn ®é tan cña c¸c
bÒn cña phøc chÊt vßng cµng so víi phøc chÊt muèi Ýt tan. VÝ dô:
mét cµng (Kb vßng cµng > Kb mét cµng) AgCl(r)
Ag+(dd) + Cl-(dd) , TAgCl= 1,8.10−10
HiÖu øng nµy g©y nªn kh«ng ph¶i do yÕu tè Ag+
entanpi mµ do yÕu tè entropy cña ph¶n øng t¹o (dd) + 2NH3(dd) [Ag(NH3)2]+, Kb = 1.108 phøc AgCl(r) + 2NH3(dd)
[Ag(NH3)2]+(dd) + Cl-(dd) XÐt vÝ dô: C × C × C × C [Ni(NH + C [Ag(NH )] Cl− + − + 3 Ag Cl [Ag(NH3 2 ) ] 3)6]2+ + 3en = [Ni(en)3]2+ + 6NH3 K = = = T × K 2 C C × 2 AgCl b C + ∆H0 = -25 kJ/mol vµ ∆ S0 NH3 NH Ag 3 298= 110 J/mol.®é.
K = 1,8.10−10 1.108 = 1,8.10−2 Ho¸ häc chÊt phøc
Hanoi university of technology
Hanoi university of technology vÝ dô:
Trong khi ®ã ®é tan cña AgCl trong n−íc lµ:
Hoµ tan AgCl trong dung dÞch NH3 1M vµ gäi ®é tan cña kÕt
tña ®ã d−íi d¹ng ion phøc lµ x (mol/lit), th×: s = 10 . 8 , 1 −10 = 3 , 1 10 . 5 − (mol / l) AgCl(r) + 2NH3(dd) [Ag(NH3)2]+(dd) +Cl-(dd)
VËy AgCl trong dung dÞch NH Nång ®é ban ®Çu, mol/l 1 0 0
3 1M cã kh¶ n¨ng tan gÊp 0 1 , Nång ®é c©n b»ng, mol/l 1-2x x x 4 n = = 0,769 .10
lÇn so víi ®é tan cña AgCl trong n−íc −5 , 1 3.10 C + × C − 2 Cl x K [Ag(NH ) ] 3 2 = = = −2 1 8 , 1 . 0 C 2 1 ( − 2 NH 2x) 3 x = 0 , 1 3 C = + 0,10M x = 0,10 1 − 2 x [Ag(NH ) ] 3 2 Ho¸ häc chÊt phøc Ho¸ häc chÊt phøc
? Có kết tủa không trong dung dịch chứa các chất sau:
[Ag+] tuy rất nhỏ nhưng không thể bằng 0, sử
dụng hằng số bền tổng cộng - β2b của phức ñể
0.1 mol AgNO hòa tan trong 1 lít nước chứa NH 1M. 3 3 tính [Ag+]:
Nếu 0.01 mol NaCl ñược thêm vào dung dịch thì có kết +
Ag + (aq) + 2NH (aq) ⇀ ↽ Ag ( NH ) (aq) 3 [ 3 2 ] tủa AgCl không ? Initial concs. 0 M 0.80 M 0.10 M Changes +x M +2x M -x M
Giả sử β2b rất lớn: Eqlbrm conc. x M 0.80 + 2x M 0.10 - x M +
Ag + (aq) + 2NH (aq) ⇀ ↽ Ag ( NH ) (aq) [Ag(NH ) ]+ 0.10-x 0.10 3 [ 3 2 ] 3 2 β = = = 1.6.107 2b [Ag+][NH ]2 3 x(0.80 + 2x)2 x(0.80)2 Initial conc. 0.10 M 1.00 M 0 M 0.10 Change -0.10 M -0.20 M +0.10 M x = [Ag+] = = 9.8.10-9 M (1.6 .107)(0.80)2 Eqlbrm conc. (0) M 0.80 M 0.10 M 5 4/22/2012
Xét trường phối tử trong
THUYẾT TRƯỜNG TINH THỂ
phức bát diện AL x+ Crystal Field Theory 6 1.
Phức chất tồn tại và bền do tương tác tĩnh
ñiện giữa nhân trung tâm và các phối tử A 2.
Coi phối tử là ñiện tích ñiểm không có cấu trúc 3.
Coi nhân trung tâm có các orbital d hóa trị bị
biến ñổi năng lượng do tác dụng của ñiện
trường tạo bởi các phối tử 4.
Phức chất có ñối xứng xác ñịnh
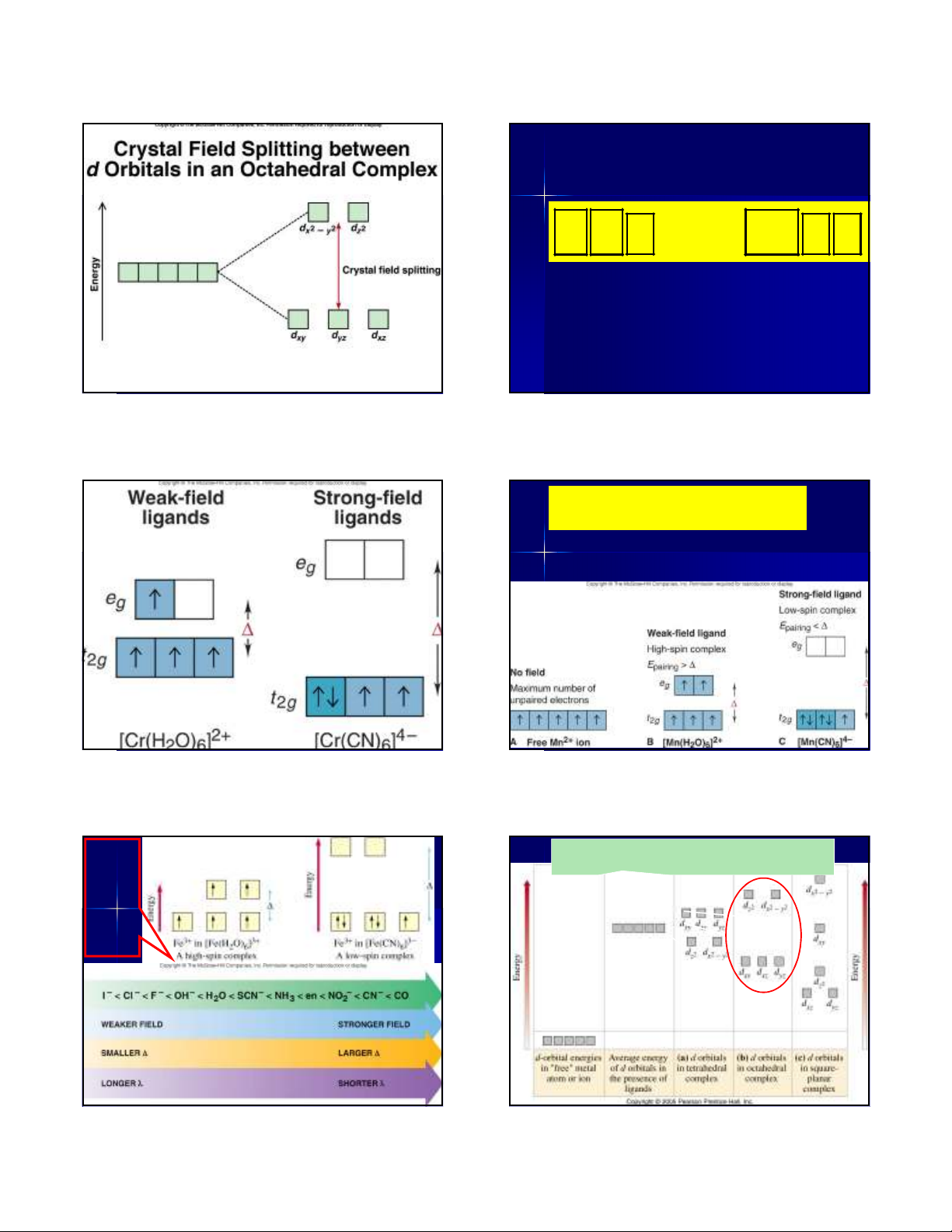
Sự tách các orbital hóa trị d của nhân
trung tâm bởi trường các phối tử e Các orbital g - E2 màu vàng có năng lượng cao hơn các ∆- orbital màu thông số tách ñ do tác dụng của trường phối tử t2g – E1 ∆=E2 – E1 3E1 + 2E2 = 0 E2 = 0.6∆ ∆ ∆ E1 = - 0.4∆ 6 4/22/2012 Fig. 22.17 P > < ∆ ↑ ↑ → ↑↓ ∆
P là năng lượng cặp ñôi của electron
Là năng lượng cần thiết ñể chuyển 2 e ñộc thân
với spin cùng dấu từ 2 orbital cùng năng lượng
vào 1 orbital mà ở ñó chúng có spin ngược dấu nhau
W = (0.4n − 0.6n )∆ s 1 2 ∆ < P
Ws - năng lượng làm bền bởi trường tinh thể
n1 - số e trên các orbital t2g
n2 - số e trên các orbital eg ∆ > P “Spin cao”:
Orbital d ñược phân tách theo các cách khác nhau, phụ thuộc vào cấu e có thể
trúc hình học của phức chất: bát diện (O ), tứ diện (T ) hay vuông h d chiếm cả
phẳng. Ở chương trình này, ta chỉ tập trung xét phức bát diện các orbital eg và t2g.
∆ Dãy phổ hóa học ∆ 7 4/22/2012
Hanoi university of technology
Hanoi university of technology Sè electron d
C¸u h×nh electron cña phøc chÊt Spin toµn phÇn Quang phæ hÊp thô d1 (t )1 1/2
§©y lµ kÕt qu¶ næi bËt cña thuyÕt tr−êng tinh thÓ: nã ®· gi¶i 2g
thÝch mµu cña phøc chÊt cña c¸c kim lo¹i chuyÓn tiÕp bëi ®a d2 (t )2 1 2g
sè phøc chÊt cña kim lo¹i chuyÓn tiÕp lµ cã mµu. d3 (t )3 3/2 2g (t )4, (t )3 (e )1 d4 2g 2g g 1 (t )5 , (t )3(e )2 d5 2g 2g g 1/2 d6 (t )6, (t )4 (e )2 0 2g 2g g
(t )6 (e )1, (t )5 (e )2 d7 2g g 2g g 1/2 d8 (t )6 (e )2 1 2g g d9 (t )6 (e )3 1/2 2g g [Fe( e H ( O) ] [Co C ( o H O) ]2+ 2 [Ni( i H ( O) O ] [Cu( u H ( O) O ]2 [Zn(H ( O) O ]2 2 ) O ] H ( ) O ]2+ 2 6 2 6 2 6 2 6 3 2 6 3+ 3 2 2+ 2 + + Ho¸ häc chÊt phøc GV: TS. TrÇn ®¹i L©m d10 (t )6 (e )4 2g g
Hanoi university of technology
Nguyên nhân gây ra màu của phức chất
Nguyªn nh©n cã mµu cña c¸c phøc chÊt lµ do chóng hÊp
thô chän läc n¨ng l−îng ë vïng tr«ng thÊy cña quang phæ.
Chóng cßn cã kh¶ n¨ng hÊp thô n¨ng l−îng ë c¶ trong
vïng tö ngo¹i vµ hång ngo¹i.
§Æc tr−ng cho c−êng ®é hÊp thô n¨ng l−îng ng−êi ta sö
dông hÖ sè hÊp thô mol:ε. Theo ®Þnh luËt Lambert –Beer:
ε = (1 / C.l) lg(Io / I)
D= lg(Io/I): mËt ®é quang cña dung dÞch
1. Nguyªn nh©n cña sù hÊp thô trong vïng tr«ng thÊy
Electron trong ph©n tö hoÆc trong ion chuyÓn dêi tõ møc n¨ng
l−îng nµy sang møc n¨ng l−îng kh¸c gäi lµ b−íc chuyÓn møc electron.
Sự hấp thụ ánh sáng và Quan
nguyên nhân tạo màu sắc hệ … còn lại ánh giữa Ánh sáng sáng xanh ñi vàng bị hấp chất qua làm dung thụ… dịch ñược nhìn hấp thấy màu xanh thụ và
… còn lại ánh sáng Ánh sáng xanh vàng ñi qua làm màu bị hấp thụ… dugn dịch có màu vàng quan blue: 400-490 nm yellow-green: 490-580 nm sát red: 580-700 nm 8 4/22/2012
Qui tắc về màu bổ sung xác ñịnh
Hanoi university of technology
màu hấp thụ và màu quan sát
Phæ hÊp thô cña ion phøc [Ti(H O) ]+3 2 6 Phøc chÊt cã mµu tÝm Vïng cho Vïng cho ¸nh s¸ng ®i ¸nh s¸ng ®i qua qua Vïng hÊp thô d ε
Hanoi university of technology
Hanoi university of technology −34 8
Ion Ti3+ cã cÊu h×nh electron d1. Theo thuyÕt tr−êng tinh thÓ, (6,626 ×10 J.s)(3,00 ×10 m / s) ∆ = × 6,623 ×1023
electron d duy nhÊt ®ã trong ion phøc [Ti(H O −10 2O)6]3+ chiÕm mét 4926 ×10 m
trong 3 obitan d cã n¨ng l−îng thÊp . D−íi t¸c dông cña ¸nh ion/ mol J/ion
s¸ng, ion phøc hÊp thô mét l−îng tö n¨ng l−îng E =hν vµ
biÕn n¨ng l−îng ®ã thµnh n¨ng l−îng kÝch thÝch electron ∆ = 242,8 kJ/mol 0 chuyÓn dêi tõ ®Õn d , 1 1 ε ®Õn dγ : − 1 υ = = = 20300cm − 8 λ 4926 × 10 d1d 0 hυ 0 1 ε γ d d ε γ
N¨ng l−îng ®ã chÝnh lµ th«ng sè t¸ch n¨ng l−îng ∆O =242,8
§èi víi nh÷ng ion kim lo¹i chuyÓn tiÕp cã 2electron d trë lªn,
kJ/mol cña ion phøc b¸t diÖn [Ti(H2O)6]3+ vµ cã thÓ tÝnh ®−îc tõ
tøc lµ cã cÊu h×nh dn(n>1), sù chuyÓn dêi kh«ng chØ lµ mét mµ
b−íc sãng cña bøc x¹ bÞ hÊp thô cùc ®¹i theo ph−¬ng tr×nh:
lµ cña mét sè electron nªn sinh ra mét sè d¶i hÊp thô
h lµ h»ng sè Pl¨ng tÝnh b»ng J.s,
Sù chuyÓn tõ møc n¨ng l−îng tõ thÊp ®Õn cao cña c¸c electron
C lµ tèc ®é ¸nh s¸ng tÝnh b»ng m/s,
d trong c¸c ion kim lo¹i cña phøc chÊt tu©n theo nh÷ng nguyªn ∆ = c h N O N lµ sè Avoga®ro λ
®ã lµ quy t¾c läc lùa spin vµ quy t¾c läc lùa cña Laport ∆O tÝnh b»ng J
Hanoi university of technology
Ảnh hưởng của phối tử lên
màu của hợp chất phối trí
¦u nh−îc ®iÓm cña thuyÕt tr−êng tinh thÓ ¦u ®iÓm:
§· cho phÐp gi¶i thÝch vµ tiªn ®o¸n nhiÒu ®Æc ®iÓm vµ tÝnh chÊt cña
phøc chÊt: sè phèi trÝ, ho¸ lËp thÓ, tÝnh chÊt tõ, tÝnh chÊt nhiÖt ®éng, mµu
s¾c cña phøc chÊt, phæ hÊp thô.. Nh−îc ®iÓm:
Do thuyÕt coi liªn kÕt kim lo¹i –phèi tö lµ liªn kÕt ion vµ chØ chó ý ®Õn
orbitan cña nguyªn tö trung t©m, bá qua orbitan nguyªn tö cña phèi tö nªn cã mét sè h¹n chÕ:
+ Kh«ng gi¶i thÝch ®−îc nh÷ng ph©n tö trung hoµ nh− H2O, NH3 l¹i cã
lùc tr−êng m¹nh h¬n nh÷ng anion nh−: OH-, Cl-, F-..
+Kh«ng ®Ò cËp ®Õn liªn kÕt π mÆc dï liªn kÕt nµy gÆp nhiÒu trong
phøc chÊt víi phèi tö lµ CO, alken, alkin... 9




