



Preview text:
5/17/2018 CHƯƠNG 16. NHÓM IIB CHƯƠNG 16. NHÓM IIB NỘI DUNG TÍNH CHẤT LÝ HỌC 1. ĐƠN CHẤT
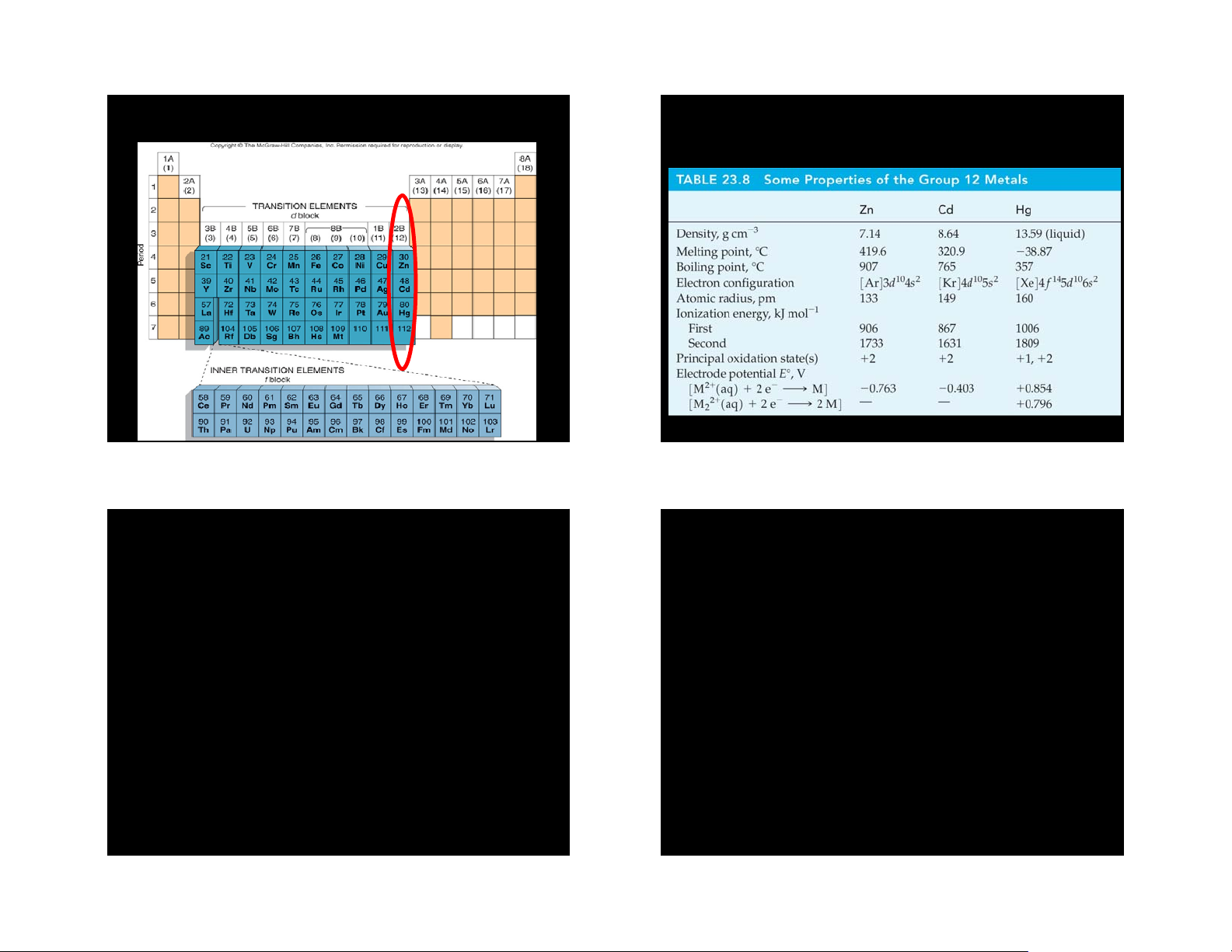
1. Là kim loại, có Mp và Bp thấp nhất trong số 1. Tính chất lý học các kim loại d 2. Tính chất hóa học
2. Hg là kim loại duy nhất tồn tại trạng thái lỏng 3. Ứng dụng ở nhiệt độ thường
4. Trạng thái tự nhiên, điều chế
3. Các e (n-1)d10 bền không tham gia liên kết
kim loại, tính trơ cặp e ns tăng dần từ trên 2. HỢP CHẤT
xuống trong nhóm năng lượng liên kết kim
1. Hợp chất chứa nguyên tố có số OXH II
loại là yếu và giảm dần từ trên xuống trong
2. Hợp chất chứa nguyên tố có số OXH I nhóm
4. Dễ tạo hợp kim với nhau và với nhiều kim loại
khác. Hợp kim của Hg gọi là hỗn hống 5/17/2018 TÍNH CHẤT HÓA HỌC
1. Hoạt động hóa học hơn các kim loại nhóm IB
cùng chu kỳ chủ yếu do liên kết kim loại yếu hơn
2. Từ trên xuống trong nhóm tính hoạt động hóa
học giảm dần do tính trơ cặp e ns tăng dần • Phản ứng với S:
- Zn, Cd phản ứng mạnh nhưng cần nhiệt độ
- Hg phản ứng ngay ở nhiệt độ thường -> dùng
để thu hồi Hg khi bị vỡ nhiệt kế TÍNH CHẤT HÓA HỌC Phản ứng với HNO3 * Phản ứng với halogen:
- Hg phản ứng dễ hơn so với Zn và Cd
• Phản ứng với các axit loãng (H2SO4) Khi dư Hg: - Zn và Cd có phản ứng
Hg Hg(NO ) Hg (NO ) 3 2 2 3 2 - Hg không phản ứng * Phản ứng với các H đặc, 2SO4 HNO3
Zn 2NaOH 2H O
Na Zn(OH ) H 2 2 4 2 5/17/2018
2ZnS 3O 2ZnO 2SO 2 2 ZnO C Zn CO
Hợp chất chứa nguyên tố có số OXH II
Zn CdSO ZnSO Cd 4 4 HgS O Hg SO 2 2
ZnO màu trắng, lưỡng tính, bền nhiệt
ZnO có nhiều ứng dụng…
CdO màu nâu, tính bazo yếu, bền nhiệt
HgO màu vàng, tính bazo yếu, không bền nhiệt
Đều không tan trong nước, dễ tan trong axit, riêng ZnO tan trong kiềm
ZnO 2NaOH H O Na Zn(OH ) 2 2 4
ZnO có nhiều ứng dụng làm sơn trắng, thuốc trong y học 5/17/2018
ZnO có nhiều ứng dụng…
Hydroxit là kết tủa trắng xốp M 2OH M (OH ) 2 Hydroxit Hg(OH)2 không bền: 2 Hg 2OH
H O HgO 2
Hg(II) có tính OXH rõ rệt hơn nhiều so với hợp chất Cd(II), Zn(II):
Hg(NO ) 2KI
HgI (do) 2KNO 3 2 2 3
2HgCl SnCl
Hg Cl (trang) SnCl 2 2 2 2 4
Hg Cl SnCl
2Hg (den) SnCl 2 2 2 4
Các phản ứng này không xảy ra với Cd(II), Zn(II) HgI 2 KI K HgI 2 2 4
Các muối sunfua ít tan, độ tan giảm dần: ZnS trắng, CdS vàng, HgS đen:
Thuốc thử Nessler để phát hiện vết NH + 3 hoặc NH4 2 2 M S MS 2 2HgI NH 3OH Hg NI (nau) 7I 3H O 4 3 2 2 ZnS, ZnO phát huỳnh quang 5/17/2018 2 Hg (NO ) Hg 2NO 2 3 2 2 3
Hợp chất chứa nguyên tố có số OXH I
Hg (NO ) 2NaCl
Hg Cl (trang) 2NaNO 2 3 2 2 2 3
Hg (NO ) 2NaOH
Hg O (den) H O 2NaNO 2 3 2 2 2 3 Hg O
HgO (vang) Hg (den) 2 2 2 Hg S
HgS(den) Hg 2 2
Hg 2CN
Hg(CN) Hg 2 2
Hg(CN ) 2CN (du)
Hg(CN) 2 2 4 2 2 Hg
Hg Hg 2 2 Hg 3 K 610 2 Hg OXH - KH 2
Hg Cl SnCl
2Hg SnCl 2 2 2 4
Hg Cl Cl 2HgCl 2 2 2 2



