

Preview text:
1- Độ âm điện của nguyên tố
Department of General & Inorganic Chemistry - HUST
Khái niệm: Độ âm điện của nguyên tố CHƯƠNG 2
là khả năng của nó hút cặp electron
CẤU TẠO PHÂN TỬ VÀ
liên kết trong phân tử về phía mình. LIÊN KẾT HOÁ HỌC
§é ©m ®iÖn cña mét sè nguyªn tè
Thang độ âm điện: Thang độ âm điện thông dụng là
thang của Pauling được xác định theo năng lượng
liên kết và mang tính so sánh có dạng công thức : Nguyªn Nguyªn Nguyªn Nguyªn tè tè tè tè H 2,1 10 . 04 , 1 02
(D D D ) Li 0,98 Be 1,5 B 2,0 C 2,5 A B AB AA BB Na 0,93 Mg 1,2 Al 1,6 Si 1,8 D K 0,91 Ca 1,04 Ga 1,75 Ge 1,8
AA, DBB; DAB là năng lượng phá vỡ liên kết của A-A; B-B; A-B. Rb 0,89 Sr 1,0 In 1,65 Sn 1,78 Ba 0,99
2. Năng lượng liên kết trong cộng hoá trị Nguyªn tè Nguyªn tè Nguyªn tè N 3,07 O 3,5 F 4,0
a. Một số quy ước: P 2,2 S 2,6 Cl 3,0
Năng lượng liên kết kí hiệu Elk là năng lượng tạo thành As 2,1 Se 2,5 Br 2,8 liên kết. Sb 1,8 Te 2,1 I 2,6
Ví dụ: EA-B là Ho298 của phản ứng: A(k) + B(k) AB(k)
c. Những ứng dụng của âm điện Ho
- Có thể dùng độ âm điện để dự đoán kiểu liên kết: 298 của phản ứng AB(k) A(k) + B(k) , gọi là
năng lượng phá vỡ liên kết hay năng lượng phân li AB,
cộng hoá trị không phân cực, phân cực, ion kí hiệu DAB (DAB > 0).
- Quan hệ giữa độ âm điện với độ phân cực liên kết,
đặc tính ion của liên kết và góc liên kết. cÊu tróc ph©n tö
CÊu tróc Lewis (Lewis structure)
•Cấu trúc bát tử Lewis: lớp e hoá trị có tối đa 8e Cấu trúc Lewis
(đạt cấu hình e của khí hiếm bền, trừ H: 2e (bền)
Cấu trúc cộng hưởng Điện tích hình thức
Dự đoán cấu trúc không gian (cấu hình hình học) VÝ dô:
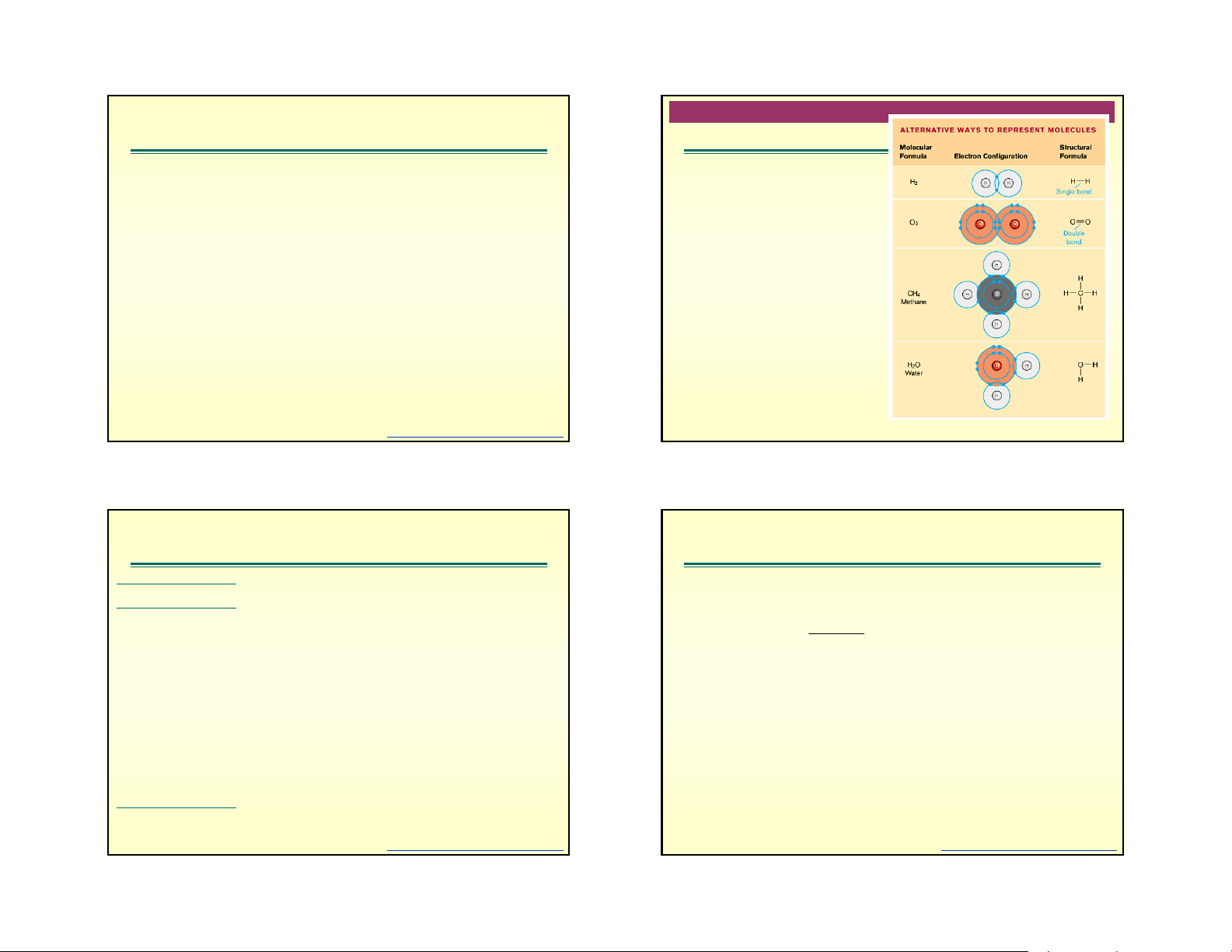
Give the Lewis structure for each of the following. H – O: HF, CH H N H 4, N2, CF4, NH3, NO+ O C O = = I H H
- Như vậy ở nguyên tử trung tâm có các liên kết
(bonds) hay cặp e liên kết (bonding pair bp); các
cặp e chưa liên kết (lone pair lp)
- Với những nguyên tố có AO – d, lớp e là hoá trị
có thể mở rộng (expanded) vượt quá bát tử (beyond
octet). Ví dụ: PF5; SF6; IF7.
Cấu trúc cộng hưởng
Cấu trúc cộng hưởng (resonance structure) NO 3 N 2O O O O N N O O N O = O N O O N O = N N O = = C2H6O H H H H N N O H C C O H H C O C H H H H H Ethyl alcohol Methyl ether
CÊu tróc céng hưëng (resonance structure)
§iÖn tÝch h×nh thøc (Formal charge - FC). : 2- 2- O :O: C C • X¸c ®Þnh FC: : :O: :O: O O FC =
e ho¸ trÞ trong nguyªn tö tù do
- e chưa ph©n chia - sè liªn kÕt 2- O 2- 2- O O C C C O O O O O O
(§iÖn tÝch h×nh thøc- FC)
(§iÖn tÝch h×nh thøc- FC) : -1 2- :O:
C¸c cÊu tróc cã FC cùc tiÓu, nguyªn tè cã ®é ©m ®iÖn lín FC 4 0 4 0 cacbon
h¬n mang FC ©m vμ sù ph©n chia ®iÖn tÝch nhá lμ cÊu tróc C0 hîp lý h¬n. : -1 :O:0 :O:
FC 6 6 1 1 oxi N ThÝch hîp 2O nhÊt
FC 6 4 2 0 -2 +1 +1 -1 +1 0 0 +1 -1 oxi N N O N N O = = N N O
(§iÖn tÝch h×nh thøc- FC)
(§iÖn tÝch h×nh thøc- FC) • BeF +1 -1 0 2: BF3: F B F = 0 F +1 -2 +1 0 0 0 0 0 0 F Be F = = F Be F F B F F B F 0 F F ThÝch hîp nhÊt ThÝch hîp F B F = nhÊt F M« h×nh VSEPR (§iÖn tÝch h×nh thøc- FC)
(Valence – Shell electron pair repulsion) FC chØ lμ mét c«ng
Nguyªn lý: c¸c e do tÝch ®iÖn cïng dÊu nªn ®Èy nhau. cô (tool) cho viÖc
Trong ph©n tö ë líp e ho¸ trÞ cña nguyªn tö trung t©m
ưíc ®Þnh (assessing)
cã c¸c cÆp e (lp vμ bp), gi÷a chóng cã sù ®Èy nhau vμ cÊu tróc Lewis (CT
ph©n tö ph¶i cã CHHH sao cho lùc ®Èy gi÷a chóng lμ lewis) kh«ng ph¶i lμ min. ®iÖn tÝch thùc t¹i trªn nguyªn tö. M« h×nh VSEPR M« h×nh VSEPR
(Valence – Shell electron pair repulsion)
(Valence – Shell electron pair repulsion)
•Để dự đoán CHHH của phân tử, chúng ta viết công VÝ dô:
thức Lewis – công thức tổng quát công thức Gillespie: AXmEn : O = C = O: AX hay AX E 2 2 0
•A -nguyên tử trung tâm (CA);
•X -nguyên tử hoặc nhóm nguyên tử phối trí quanh AX E H N H 3 1
CA; E -kí hiệu của lp trên CA. H
•Đặt q = m + n là số vị trí không gian được chiếm bởi
Tuú thuéc vμo gi¸ trÞ cña q, m, n, mμ ph©n tö hay
nguyên tố hay lp quanh CA.
ion sÏ cã CHHH kh¸c nhau. XÐt c¸c trưêng hîp sau.
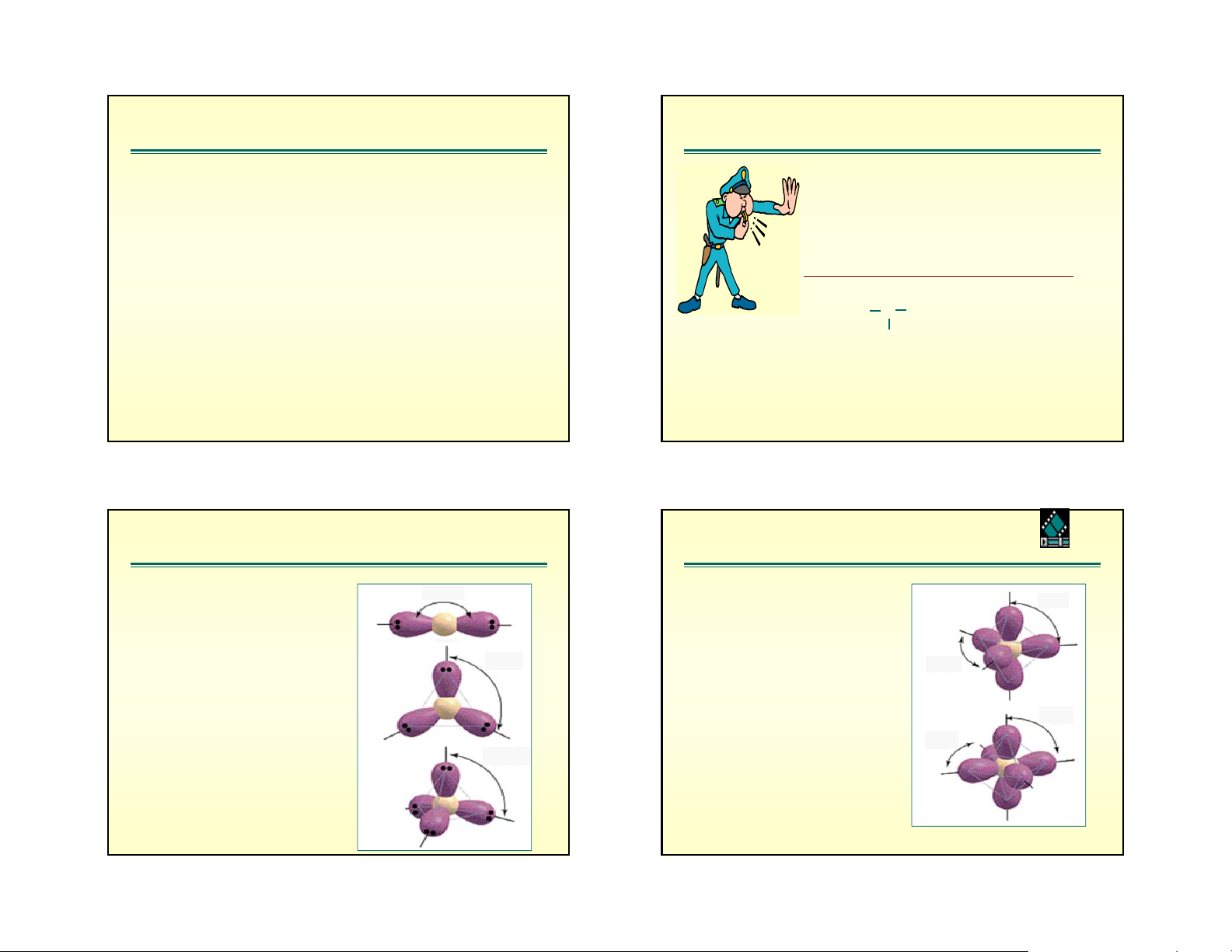
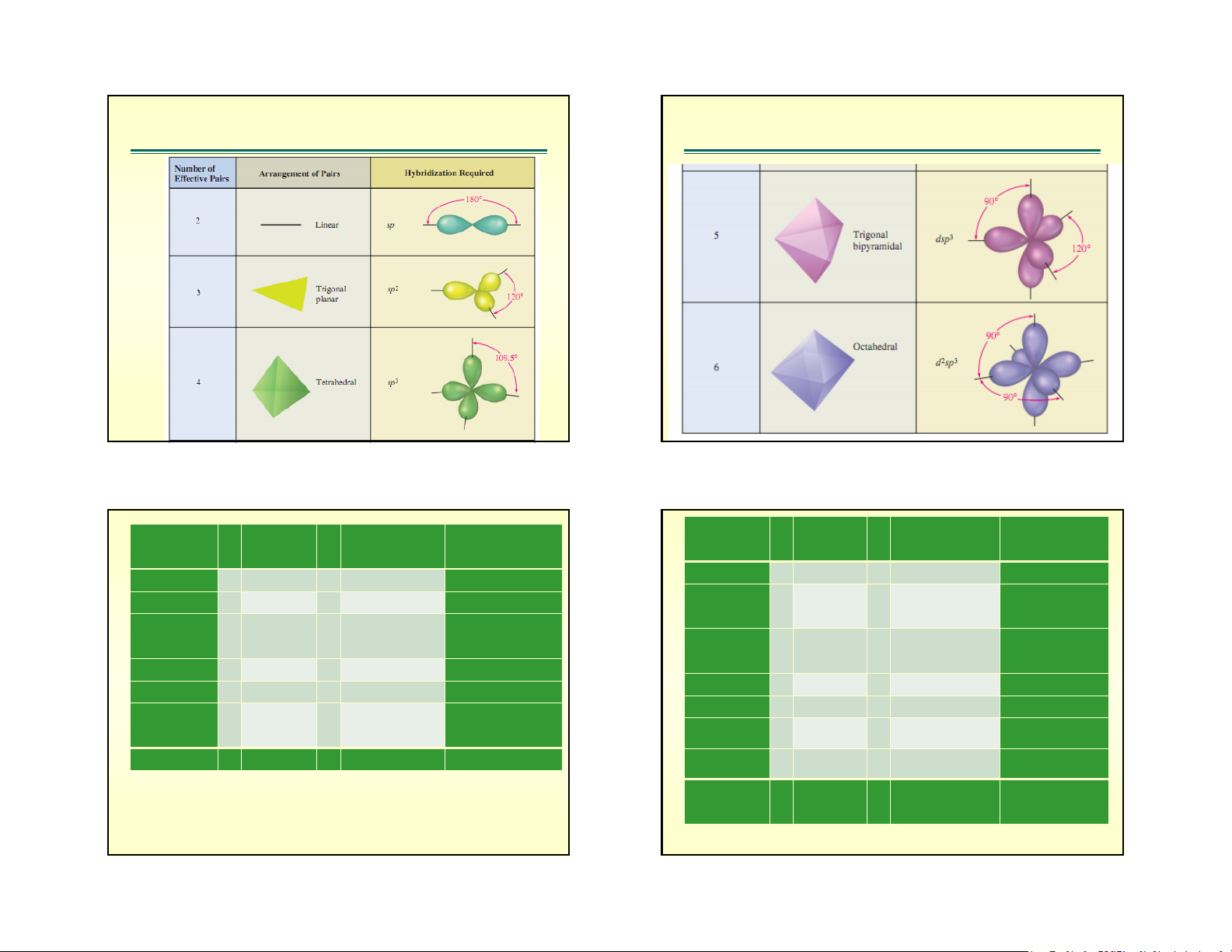
a/n=0. Kh«ng cã lp. C«ng thøc lμ AXm QuickTime Movie m CÊu h×nh 180 m CÊu h×nh 90 2 Thẳng 5 Tháp tam giác 120 120 3 Tam giác phẳng 90 90 109.5 6 Bát diện 4 Tứ diện
b/n≠0. Cã lp trªn CA. C«ng thøc: AX E m n 1. q=4, n=1 AX3E1
• Lưu ý thø tù lùc ®Èy gi÷a c¸c cÆp e: H N H
lp – lp > bp – bp H
KÕt hîp gi÷a lưu ý nμy víi c¸c cÊu h×nh ë a còng dÔ C«ng thøc Lewis
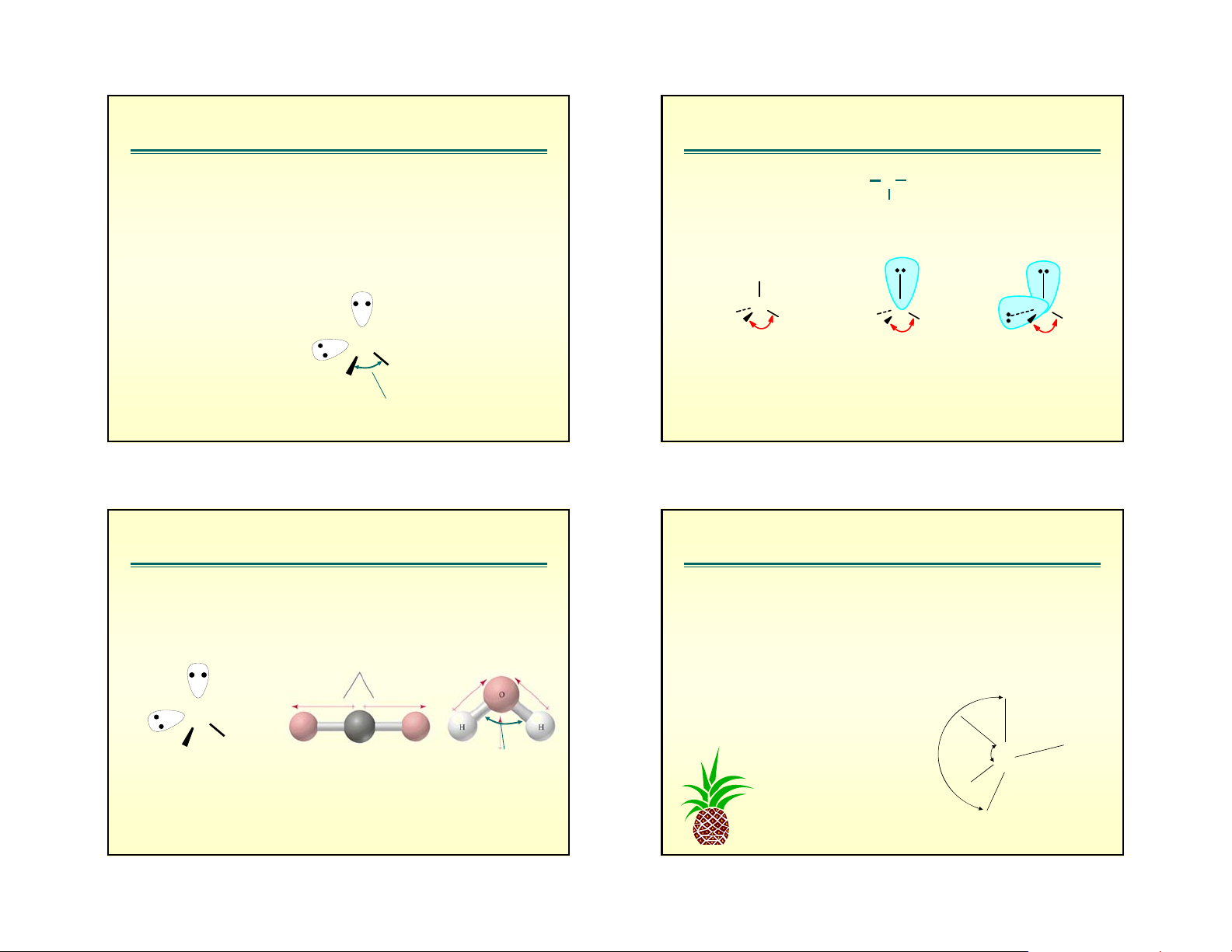
dù ®o¸n ®ưîc CHHH cña ph©n tö cã n > 0. • VÝ dô: H O : H 2 C N O H H H H H O H H H 109.5O 104.5O 107O H H
Sù s¾p xÕp c¸c cÆp electron (1lp+3bp) 104.5
Do sù ®Èy cña 1lp mμ gãc liªn kÕt HNH gi¶m xuèng 107o < 109,5o 2. q=4, n=2 AX 3. q=5, n=1,2,3 2E2
Qua ph©n tÝch lùc tư¬ng t¸c gi÷a c¸c cÆp e H O: AX E 2 2 2 H O H - -
ngưêi ta ®· x¸c ®Þnh ®îc c¸c lp ®Òu n»m vÞ trÝ
xÝch ®¹o tøc lμ trªn mÆt ph¼ng n»m ngang C«ng thøc Lewis
th¼ng gãc víi trôc th¼ng ®øng. o F O F < 180 H n = 1 ta cã SF4 o : 105 H S
Sù s¾p xÕp c¸c cÆp e =173 F (2lp + 2bp) F
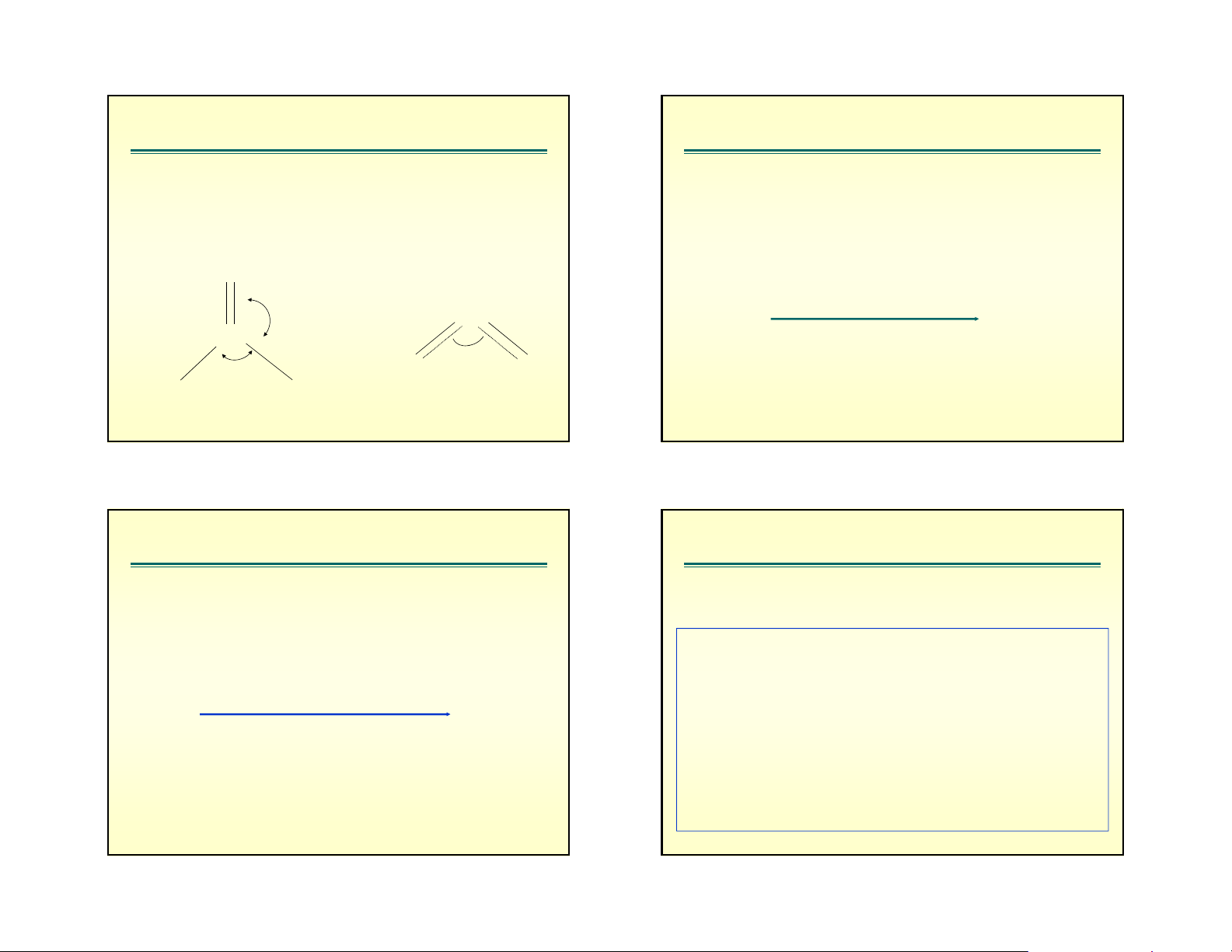
c. Trưêng cã liªn kÕt béi (multiple bond)
Quan hÖ gi÷a ®é ©m ®iÖn vμ gãc liªn kÕt
CÇn lưu ý liªn kÕt ®«i cã sù ®Èy h¬i m¹nh
Dãy hợp chất AXn-BXn-CXn-DXn với A,B,C,D h¬n liªn kÕt ®¬n.
thuộc phân nhóm chính có độ âm điện giảm thì góc liên kết giảm. VÝ dô: O : H O H S H Se 126o> 120o N 2 2 2 C Gãc liªn kÕt 1150 O O 105o 92o 91o 1080 F F
Quan hÖ gi÷a kiÓu lai ho¸ vμ cÊu h×nh
h×nh häc cña ph©n tö (Sinh viªn tù xem)
• Dãy hợp chất YA’n - YB’n - YC’n - YD’n: Y là
Ngưêi ta còng cã thÓ dù ®o¸n CHHH cña ph©n tö
nguyên tử trung tâm A’,B’,C’,D’ cùng phân
theo c¸ch thø hai lμ dùa vμo kiÓu lai ho¸.
nhóm chính có độ âm điện giảm thì góc liên kết tăng
Lai ho¸ (Hybridization) vμ liªn kÕt: Khi t¹o
liªn gi÷a CA víi c¸c nguyªn tö phèi tö, ë CA O = SF O = SCl O = SBr
cã thÓ x¶y sù tæ hîp (lai ho¸) c¸c AO hãa trÞ 2 2 2
cã E xÊp xØ nhau, song ®Þnh hưíng kh¸c
Gãc X-S-X thay ®æi thÕ nμo ? 92,3o 96,2o 98,2o
nhau ®Ó t¹o ra c¸c AO lai ho¸ (hybrid
orbitals) ®ång nhÊt vÒ n¨ng lưîng vμ cã sù
®Þnh hưíng trong kh«ng gian thuËn lîi cho sù t¹o liªn kÕt.
Quan hÖ gi÷a kiÓu lai ho¸ vμ cÊu h×nh
Quan hÖ gi÷a kiÓu lai ho¸ vμ cÊu h×nh
h×nh häc cña ph©n tö (Sinh viªn tù xem)
h×nh häc cña ph©n tö (Sinh viªn tù xem) C«ng q KiÓu lai m CHHH VÝ dô C«ng q KiÓu lai m CHHH VÝ dô thøc ho¸ thøc ho¸ (AX E ) (AX E ) m n m n AX 2 Sp 2 Th¼ng BeH , Cl AX 5 sp3d 5 Th¸p ®«i PCl 5 5 2 2 2 AX 3 sp2 3 Tam gi¸c BF tam gi¸c 3 3 ph¼ng AX E 5 sp3d 4 C¸c bËp SF 4 4 AX E 3 sp2 2 G·y gãc NO -,SO , O bªnh 2 2 2 3 AX 4 sp3 4 Tø diÖn CH , NH + AX E 5 sp3d 3 Ch÷ T ClF 3 2 3 4 4 4 AX E 4 sp3 3 Th¸p tam NH , H O+ AX E 5 sp3d 2 Th¼ng XeF 2 3 2 3 3 3 2- gi¸c AX 6 sp3d2 6 B¸t diÖn SF , SiF 6 6 6 AX E 4 sp3 2 Gãy gãc H O 2 2 2 AX E 6 sp3d2 5 Th¸p vu«ng IF 5 5 AX E 6 sp3d2 4 Vu«ng ICl 4 2 4 ph¼ng §é ph©n cùc cña ph©n tö
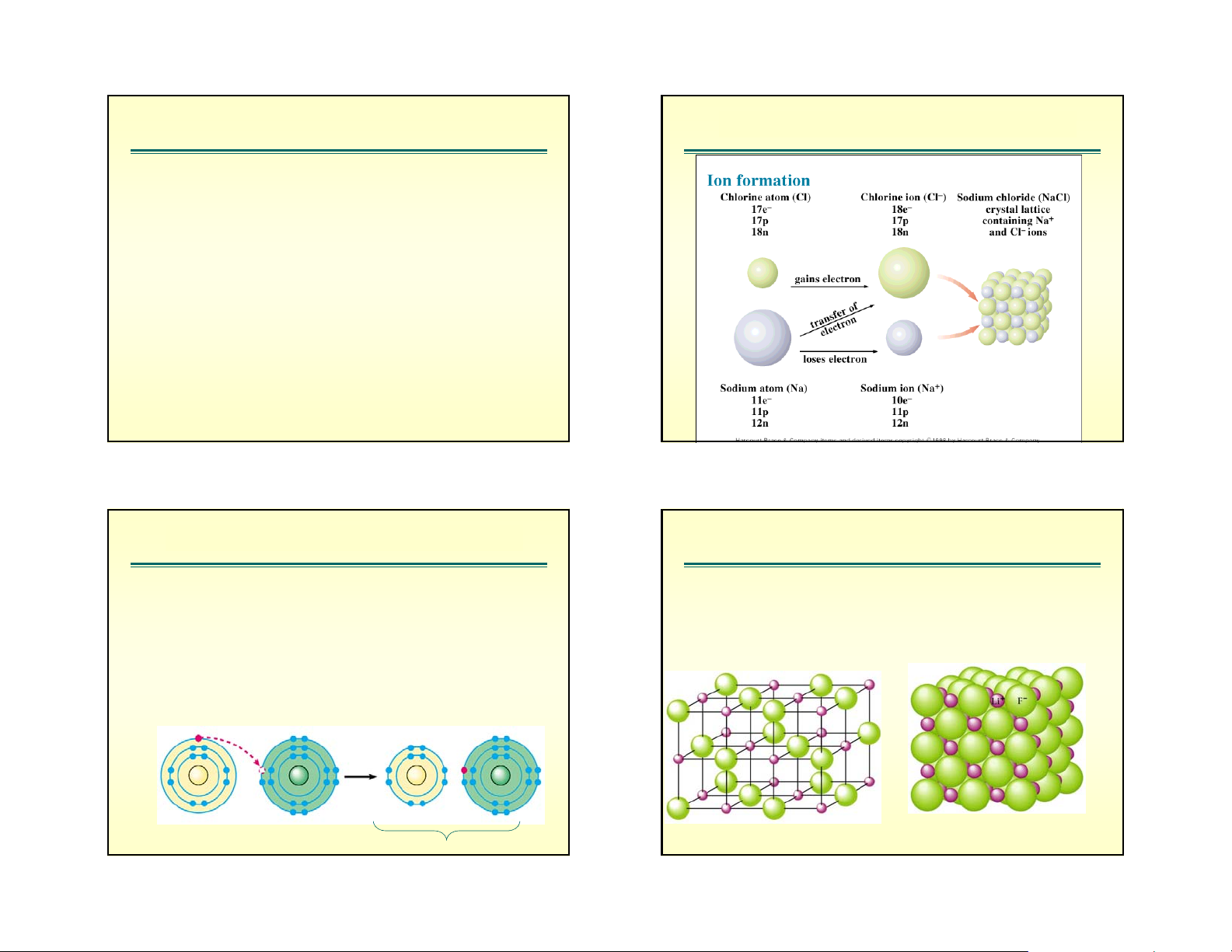
• Một phân tử phân cực nếu những trung tâm mang §é ph©n cùc cña ph©n tö
điện tích âm và điện tích dương bị tách biệt ! ? §é ph©n cùc cña ph©n tö §é ph©n cùc cña ph©n tö
M«men lưìng cùc kÝ hiÖu : = l.q
q lμ ®iÖn tÝch cña tõng cùc, culong (C);
l lμ kho¶ng c¸ch gi÷a hai cùc.
C¸c chÊt kh«ng ph©n cùc th× = 0, chÊt ph©n cùc 0. 1 D 29 1 10 . Cm 3
2. C¸ch x¸c ®Þnh ph©n tö cã ph©n cùc hay kh«ng?
3.§Æc tÝnh ion cña liªn kÕt céng ho¸ trÞ ®¬n Theo c¸c bưíc sau:
C¸c liªn kÕt céng ho¸ trÞ ph©n cùc ®Òu mang
• X¸c ®Þnh cÊu tróc kh«ng gian.
®Æc tÝnh ion (nhiÒu hay Ýt nã biÓu hiÖn ®é
• §iÒu kiÖn cña chÊt ph©n cùc lμ ph¶i
ph©n cùc cña liªn kÕt) còng như liªn kÕt ion
chøa liªn kÕt ph©n cùc vμ ph¶i cã
còng mang ®Æc tÝnh céng ho¸ trÞ. cÊu tróc bÊt ®èi xøng.
§Ó tÝnh ®Æc tÝnh ion cña mét liªn kÕt céng ho¸
VÝ dô: liªn kÕt H – F. Thùc nghiÖm ®o ®ưîc trÞ
= 1,83D. q = = 1e; l = 0,92Ao. Tính độ liên kết ion? TN 100 % LT
= 1,6.10-19.0,92.10-10 = 1,472.10-29 Cm =4,42D LT 83 , 1 D §é ion cña HF lμ: , 0 41 % 41 , 4 42D
H2O = 104,50; lO-H = 0,957Ao O Thùc nghiÖm: = 1,85D 1 0 2 5 , 104 = 2. .cos52,25 1 H H 85 , 1 D 51 , 1 1 . 2 cos , 52 25 TÝnh to¸n:
= 1,6.10-19.0,957.10-10 = 1,5312.10-29Cm=4,6D 1
§é ion cña liªn kÕt O-H lμ: 51 , 1 D 0 328 , 32 8 , % 4,6D
Molecular Dipole Moments
Molecular Dipole Moments
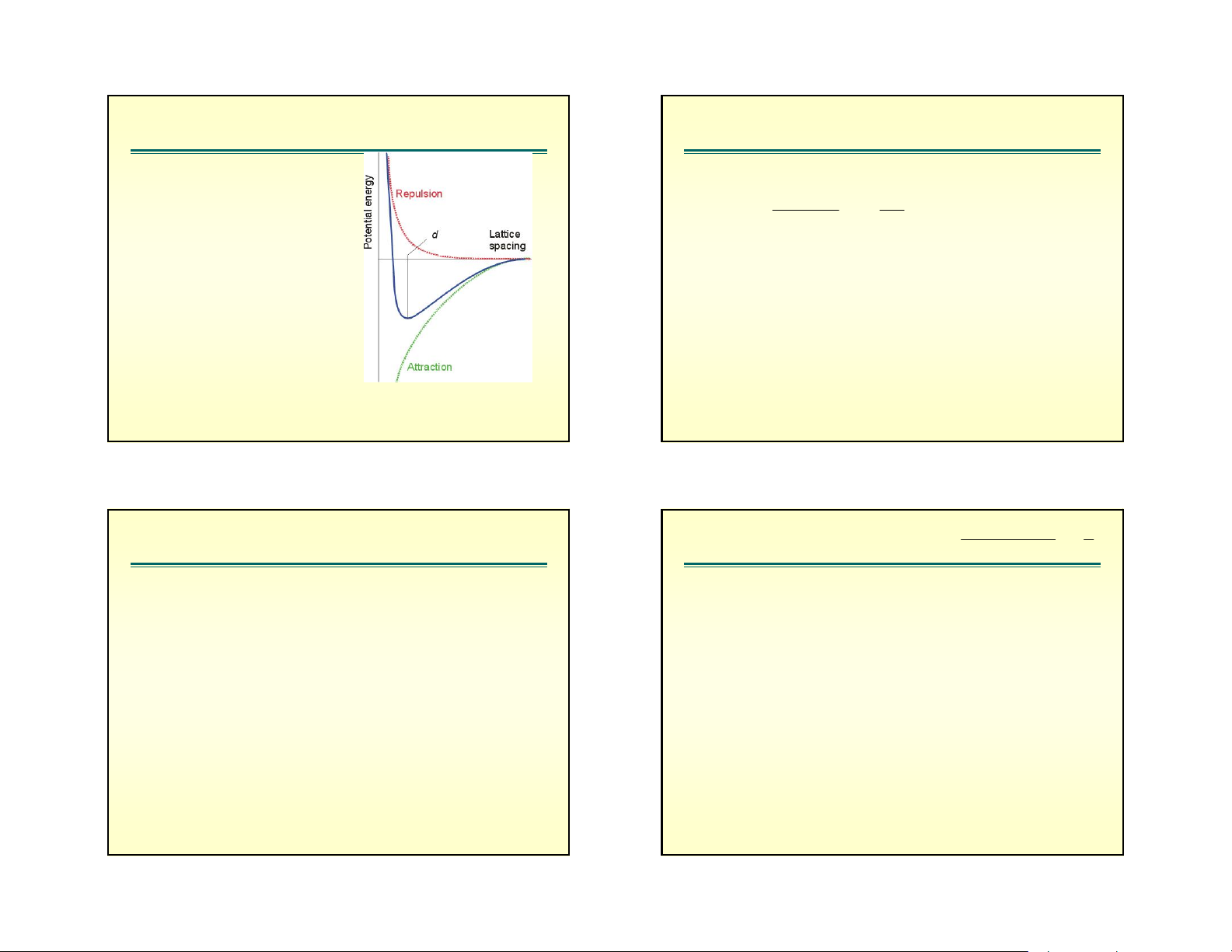
Are the following polar or nonpolar?
Are the following polar or nonpolar? Cl F 109 Cl 120 C BF F B F B Cl 3: Trigonal CCl Cl C Cl 4: Tetrahedral Cl Cl F Planar F F Nonpolar Cl Nonpolar O Cl Cl CH O 120 2O: Trigonal C CH H C H C 3Cl: Tetrahedral H H C H Planar H H H H H Polar Polar liªn kÕt ion
Sù t¹o thμnh liªn kÕt trong NaCl
1. Sự tạo thành và đặc tính của liên kết ion
a. Điều kiện tạo thành liên kết ion, dựa vào
độ âm điện. Cần lưu ý việc phân loại liên kết
ion, cộng hoá trị mang tính tương đối.
b. Đặc tính của liên kết ion: không có tính bão
hoà, không có tính định hướng.
Sù t¹o thμnh liªn kÕt trong NaCl
N¨ng lîng m¹ng líi ion
1. One atom loses electron(s) to become a cation.
2. N¨ng lîng m¹ng líi ion (U) (Lattice Energy) a. Kh¸i niÖm:
2. Another atom gains the electron(s) and Li+(k) + F -(k) LiF(r) U = -1008KJ.mol-1 becomes an anion. LiF
3. The opposite charges draw the two ions together like a magnet. Na Cl Na Cl Na Cl Na+ Cl– Sodium atom Chlorine atom Sodium ion Chloride ion Figure 2.7A
Năng lượng mạng lưới ion U
N¨ng lîng m¹ng líi ion ion Trong nhiều hợp chất:
Uion là năng lượng cần thiết để phá vỡ 1 mol hợp chất ion ở thể rắn thành các
-Các nguyên tử có xu hướng mất hoặc thu vài
ion tự do ở trạng thái khí và cơ bản.
e để có cấu hình e bền của nguyên tử khí trơ
ngay trước hoặc sau trong bảng tuần hoàn. 2 Z Z e 1
-Phân tử được tạo thành bởi sự chuyển e hóa U 1 aN J mol ion /
trị từ nguyên tử này sang nguyên tử kia. 4 R n
-Nguyên tử mất e biến thành ion dương – o B r0 cation.
-Nguyên tử nhận e biến thành ion âm – anion. Z r
+, Z- - số điện tích của cation va anion mang
-Các ion mang điện tích trái dấu sẽ hút nhau
e – điện tích của electron, e = -1.602 . 10-19 [C] và đi lại gần nhau.
R – khoảng cách ngắn nhất giữa cation và anion trong hợp chất [m]
-Khi đến gần nhau, xuất hiện lực đẩy bởi N – số Avogadro
tương tác của vỏ e của các ion.
α – hằng số Madelung có giá trị phụ thuộc kiểu cấu trúc tinh thể.
-Lực đẩy càng tăng khi các ion càng lại gần α
nhau và đến lúc cân bằng với lực hút thì các NaCl = 1.7475, αCsCl = 1.763
ion dừng lại ở khoảng cách nhất định.
nB – hệ số đẩy Born có giá trị phụ thuộc vào cấu hình e của ion
-Tương tác giữa các ion trong phân tử là
nB - He, Ne, Ar, Kr, Xe = 5, 7, 9, 10, 12 tương tác tĩnh điện nB – LiF
= 0.5(nB – Li = He + nB – F = Ne) = 0.5(5 + 7) = 6 2 b. X¸c ®Þnh U: N.A Z . Z . e . 1 Ph¬ng tr×nh Born - LandÐ U 1 4. d . o o n
N = 6,022.1023 cÆp ion (ion pairs) mol-1; :
Cã thÓ x¸c ®Þnh U theo nhiÒu c¸ch kh¸c nhau:
A lμ h»ng sè Madelung (Madelung constant = MC); gi¸ trÞ cña
ThiÕt lËp c¸c c«ng thøc tÝnh tuy kh¸ phøc
nã phô thuéc vμo kiÓu cÊu tróc tinh thÓ.
Z+, Z- lμ ®iÖn tÝch cña c¸c ion,
t¹p nhng l¹i cã Ých cho viÖc t×m hiÓu c¸c yÕu
e lμ ®iÖn tÝch e; = 3,1416; : h»ng sè ®iÖn m«i cña ch©n o
tè ¶nh hëng lªn n¨ng lîng m¹ng líi.
kh«ng cã gi¸ trÞ lμ 8,85.10-12 SI;
HoÆc dùa vμo c¸c sè liÖu thùc nghiÖm vÒ d = r - r o + – (m)
n (hoÆc nB): hÖ sè ®Èy Born, cã gi¸ trÞ tuú thuéc vμo cÊu h×nh
c¸c ®¹i lîng: H o, H o, I, EA … råi lËp chu s nt
e cña c¸c ion. Víi ion cã cÊu h×nh e t¬ng tù c¸c khÝ hiÕm: He,
tr×nh nhiÖt ®éng häc gäi lμ chu tr×nh Born –
Ne, (Ar, Cu+), (Kr, Ag+), (Xe, Au+) th× n cã gi¸ trÞ t¬ng øng: 5,
Haber (Born – Haber cyde) ®Ó tÝnh U.
7, 9, 10, 12. nÕu 2 ion cã cÊu h×nh e kh¸c nhau th× lÊy gi¸ trÞ trung b×nh (average value). Born - LandÐ Ph¬ng tr×nh Kapustinskii
A lμ h»ng sè Madelung (Madelung constant = MC);
Qua sù nghiªn cøu vÒ cÊu tróc tinh thÓ: quan
gi¸ trÞ cña nã phô thuéc vμo kiÓu cÊu tróc tinh thÓ.
hÖ gi÷a h»ng sè Madelung, sè ion trong mét
VÝ dô kiÓu cÊu tróc NaCl lËp ph¬ng t©m khèi (body-
“ph©n tö” ion* vμ b¸n kÝnh ion … Kapustinskii
centeredcubic - bcc) cã A = 1,74756; KiÓu CsCl: lËp
®· ®Ò nghÞ mét c«ng thøc cho phÐp tÝnh U, cã
ph¬ng t©m diÖn (face-centered cubic – fcc) cã A = thÓ biÓu diÔn díi d¹ng: 1,726267.
§Ó ®¬n gi¶n khi tÝnh ta cã thÓ chuyÓn c«ng thøc trªn .
n Z .Z .K' 345 , 0 U 1 ,(KJ. 1 mol ) sang c«ng thøc: d d N. . A Z .Z . 2 e .K o o 1 U 1 ,(J. 1 mol ) d n
n: sè ion trong mét “ph©n tö” cña hîp chÊt ion. o
K’=h»ng sè =1202 (khi U cã ®¬n vÞ lμ KJ.mol-1). K 10 . 9 19;d ( 0 A ) 0
Năng lượng mạng lưới ion U
R – khoảng cách giữa các ion trong tinh thể ion
Born- Haber * Born - LandÐ * Kapustinskii
bằng tổng số bán kính của cation và anion Qui tắc Kapustinskii
được xác định trong tinh thể có cấu trúc kiểu NaCl C¸c c«ng thøc thêng cã
α – hằng số Madelung đối với các chất khác Z Z n
nhau gần như tỷ lệ với số ion trong phân tử. sai sè so víi thùc U kJ / mol n ion
B–hệsốđẩyBornlàgầnnhưnhauđớivới r r nghiÖm. V× khi x©y dùng tất cả các hợp chất
Σn – số ion trong một phân tử c¸c c«ng thøc nμy, c¸c
C – hằng số có giá trị phụ thuộc vào đơn vị
dùng. C = 1.08.10-7 nếu r [m] và U t¸c gi¶ coi lμ hîp chÊt ion [kJ/mol] Tinh thể
Uion – Thực nghiệm [kJ/mol] Uion – Lý thuyết [kJ/mol] ion thuÇn tuý, cßn thùc NaCl 769 783 NaBr 736 745 tÕ th× trong c¸c hîp chÊt NaI 690 673 KCl 702 688 ion cã mét phÇn ®Æc tÝnh KBr 674 658 KI 637 619 liªn kÕt céng ho¸ trÞ. AgF 954 861
Tồn tại 1 phần liên kết cộng hóa trị AgCl 904 729 AgBr 895 R < r 696 ++r- AgI 883 652
Uion-TN > Uion-LT Chu tr×nh Born- Haber
Quan hÖ gi÷a ®Æc tÝnh ion vμ ®é ©m ®iÖn Na+(g) + e- + Cl(g)
Pauling ®· ®a ra mét gîi ý vÒ mèi quan hÖ H E(Cl) Na+(g) + Cl-(g)
gi÷a ®Æc tÝnh ion vμ cña 2 nguyªn tè trong I1(Na)
liªn kÕt ( lμ ®é ©m ®iÖn) Na(g) + Cl(g) H f(Cl,g) Na(g) + ½Cl Lattice 2(g) §Æc tÝnh ion §Æc tÝnh ion energy H f (Na,g) Na(s) + ½Cl2(g) 1 20% 1,5 40% H f(NaCl,s) NaCl(s) 2 60% 2,5 80%
H o = H o - 0,5.E + I + EA + U U = -757 KJ.mol-1 s nt Cl-Cl NaCl NaCl
Năng lượng liên kết cộng hóa trị Echt
C¸c yÕu tè ¶nh hëng lªn n¨ng lîng m¹ng líi ion
1916 Gilbert Newton Lewis (1875-1946) nhà hóa
học người Mỹ xuất phát từ chỗ các nguyên tử có xu
hướng đạt đến cấu hình e bền của khí trơ nhưng cho
rằng liên kết được tạo thành bởi sự cho-nhận của e
Gi¸ trÞ cña U cμng lín khi ®iÖn tÝch cña ion
hóa trị của các nguyên tử tham gia liên kết để tạo cμng lín
thành các cặp e chung giữa hai nguyên tử.
Liên kết cộng hóa trị hay liên kết nguyên tử
Sè ion trong mét ph©n tö t¨ng dÉn ®Õn gi¸
Liên kết không cực: cặp e liên kết chung có mức
Lewis was one of the giants of physical chemistry during the first half of
the 20th century. After his Ph.D. with T. W. Richards at Harvard (1899)
and brief periods on the faculty there and at MIT he went in 1912 to the trÞ cña U cμng lín
độ như nhau với từng nguyên tử, Cl2.
University of California, Berkeley where he transformed the chemistry
department from one which paid little attention to research to one of the
Liên kết có cực: cặp e liên kết chung bị dịch về
pre-eminent departments in the country. He is most known for his
research in thermodynamics (his 1923 book with Randal became the
B¸n kÝnh cña c¸c ion cμng nhá, gi¸ trÞ cña
một trong hai nguyên tử, HCl.
"bible" in the field), his proposal of the shared electron pair bond
(summarized in his 1923 book "Valence and the Structure of Atoms and
Molecules"), his description of acids and bases as electron-pair
acceptors and donors, and for his researches on fluorescence, U cμng lín
Tính chất quan trọng của liên kết cộng hóa trị là phosphorescence and theories of color in organic molecules. Lewis was
always personally active in the laboratory, and it was while working there
độ bền liên kết với thước đo là năng lượng liên kết. that he suddenly died.
Liên kết càng bền thì năng lượng liên kết càng lớn.
Department of Inorganic Chemistry - HUT
Năng lượng liên kết cộng hóa trị Echt Covalent Bonds Sharing electrons
Năng lượng liên kết cộng hóa trị trong một phân tử
là năng lượng cần thiết để làm đứt liên kết đó creates covalent
Năng lượng của liên kết tăng khi độ bội của liên kết tăng bonds, very strong bonds that produce a molecule.
A2: EA-A là nhiệt của phản ứng phân hủy phân tử thành 2 nguyên tử ở trạng thái khí. Notice, in this figure,
ABn: EA-B có giá trị tuyệt đối bằng 1/n năng lượng tạo thành phân tử đó từ các nguyên tử that molecules can ở trạng thái khí. A be depicted in
nBm: áp dụng phương pháp lai hóa và cộng hưởng để tính. several different ways. Table 2.8
Department of Inorganic Chemistry - HUT
Năng lượng liên kết cộng hóa trị Echt
Năng lượng liên kết cộng hóa trị Echt
A2: EA-A là nhiệt của phản ứng phân hủy phân tử thành 2 nguyên tử ở trạng thái khí. ABn:
EA-B có giá trị tuyệt đối bằng 1/n năng lượng H
tạo thành phân tử đó từ các nguyên tử ở trạng thái khí.
2(k,cb) H(k, cb) + H(k, cb) EH-H = ∆HPU = 435 kJ/mol
C(k, cb) + 4H(k, cb) CH4(k, cb) ∆HPU = -1659 kJ/mol Phân tử EA-A [kJ/mol]
Phân tử tương tự nhau có năng lượng liên kết khá gần Li 1659 2 107 Na2 71 E 414 kJ / mol K2 50 nhau. CH Rb2 46 4 Cs2 43 F E 2 159
C-H trên chỉ là năng lượng trung bình của mội liên kết C-H trong CH4. Cl
Phân tử kim loại kiềm: E
Thực tế E cần làm đứt lần lượt từng liên kết C-H trong CH 2 242
cht khá bé, giảm khi Z tăng. 4 là 426, 367, 517 và 334 Br2 192 kJ/mol. I2 150
Khi làm đứt từng liên kết trong AB N Phân tử halogen: E
n sẽ làm biến đổi cấu hình e và hạt nhân của hệ 2 942
cht lớn hơn, giảm dần khi Z tăng. O
làm biến đổi năng lượng tương tác của các nguyên tử trong phân tử. 2 494 H2 435
CH4 có góc liên kết HCH là 109o28’, khi tách 1 H thành CH3 thì góc HCH là 120o HF 560
Echt của các nguyên tố đứng cạnh nhau trong chu kỳ
cấu tạo tứ diện của phân tử CH HCl 426
4 biến thành cấu tạo tam giác của nhóm CH3. HBr 364 HI 293 chênh lệnh nhau nhiều (N NO 627
2, O2, F2) do độ bội liên kết CO 1070 khác nhau (p = 3, 2, 1)
Department of Inorganic Chemistry - HUT
Department of Inorganic Chemistry - HUT
Năng lượng liên kết cộng hóa trị Echt
Năng lượng liên kết cộng hóa trị Echt
H2O có năng lượng cần làm đứt liên kết O-H thứ nhất và thứ hai tương ứng là 493
và 426 kJ/mol, còn năng lượng liên kết O-H trung bình là 460 kJ/mol.
Khi tách H ra khỏi H2O, trạng thái lai hóa của O không biến đổi là do ở trạng thái 1
cơ bản, O có 2 e hóa trị độc thân và 2 e này đuộc dùng để tạo 2 liên kết O-H trong
p e e *
H2O khi tách H thì trạng thái hóa trị của O biến đổi tương đối ít và quá trình tách 2 MO MO
này không đòi hỏi một năng lượng kích thích lớn.
p tính theo phương pháp cặp electron liên kết Phân tử HgCl
p = số cặp electron dùng chung để tạo liên kết giữa chúng
2 có năng lượng làm đứt liên kết Hg-Cl lần lượt là 338 và 104 kJ/mol
và năng lượng trung bình là 221 kJ/mol. Sự chênh lẹch lớn về năng lượng của các
liên kết Hg-Cl là do khi đứt liên kết đầu thì trạng thái hóa trị của nguyên tử Hg biến Tổng quát: p tính theo
phương pháp cặp e liên kết
đổi ít, trong khi đứt liên kết Hg-Cl thứ hai đã biến Hg từ trạng thái sp sang trạng sự lai hóa
thái s2 giải phóng một năng lượng đáng kể bù cho năng lượng cần để làm đứt liên sự cộng hưởng kết. 2
Phân tử CO2 có năng lượng làm đứt lần lượt các liên kết là 530 và 1070 kJ/mol, sp
trung bình là 802 kJ/mol. Lý do là khi tách 1 nguyên tử O ra khỏi CO2 đã chuyển
liên kết C-O còn lại trong phân tử từ 1 liên kết đôi thành 1 liên kết ba trong CO. NO
Năng lượng liên kết phụ thuộc vào bậc (độ bội) của liên kết và độ xen phủ 3
của các orbital hóa trị. Bậc liên kết càng lớn, độ xen phủ các orbital hóa trị
càng lớn thì liên kết càng bền năng lượng liên kết càng lớn. ¼ ONO 120o
Department of Inorganic Chemistry - HUT
Department of Inorganic Chemistry - HUT
Năng lượng liên kết cộng hóa trị Echt
Năng lượng liên kết cộng hóa trị Echt | O | O
Độ xen phủ của các orbital hóa trị lớn khi:
- Miền xen phủ rộng và mật độ e ở miền xen phủ lớn. P P
- Z’ đối với orbital hóa tị lớn. N N
- Số lượng tử chính n nhỏ.
- Hiệu năng lượng các orbital hóa trị trong nguyên tử và giữa các nguyên tử
tham gia liên kết là nhỏ. | O | | O | O O
- Số nút hàm xuyên tâm của của orbital hóa trị là ít (số nút = n – l -1).
- Ở miền xen phủ có nhiều orbital hóa trị tham gia. O O O
Yếu tố quyết định năng lượng liên kết là bậc liên kết. Khi bậc liên kết bằng nhau P | | nhưng E
cht khác nhau là do độ xen phủ các orbital hóa trị là khác nhau.
Trong 1 chu kỳ, từ trái qua phải: N N N
- Z’ đối với các orbital hóa trị tăng dần E cht tăng dần.
- Hiệu năng lượng các orbital hóa trị, Enp-Ens, giảm dần Echt giảm dần Tổng E O O O O O O
cht sẽ là giá trị cạnh tranh giữa 2 xu hướng này.
Trong 1 phân nhóm A, từ trên xuống:
- Năng lượng các orbital hóa trị cùng dạng tăng dần. 11 2 1
- Số lượng tử chính n của các orbital hóa trị tăng làm số nút hàm xuyên tâm p 1 tăng. N O 3 3 Echt giảm dần.
Department of Inorganic Chemistry - HUT
Department of Inorganic Chemistry - HUT Phân tử E
Năng lượng liên kết kim loại - ∆Ha A-A Độ dài LK [kJ/mol] [Å]
F không có orbital hóa trị d Li2 105 2.67
Từ Cl có orbital hóa trị d Thuyết khí electron: Na2 72 3.08 tham gia liên kết
- Mạng lưới kim loại gồm các ion dương kim loại. K2 49 3.92
- Các e hóa trị chuyển động tự do trong toàn mạng lưới như phần tử khí. Rb2 45 -- CS
Giúp giải thích định tính được tính chất vật lý chung của kim loại 2 43 -- F
Hạn chế thì e không đóng vai trò nhiệt dung nguyên tử nên mâu thuẫn. 2 151 1.42 Cl2 239 1.99 Br2 190 2.28 I2 149 2.67 At2 -- --
Thuyết vùng (MO-LCAO: Molecular Orbitals-Linear Combination of the Atomic Orbitals
- Kim loại là hệ nhiều nhân.
- Trạng thái e trong hệ giống như trạng thái của e trong phân tử. Phân tử Li2 Be2 B2 C2 N2 O2 F2 Ne2
- Các e không là hóa trị ở trong trường hạt nhân riêng của nguyên tử. p 1 0 1 2 3 2 1 0
- Các e hóa trị ở trong trường chung của tất cả hạt nhân nguyên tử kim loại. EA-A [kJ/mol] 105 0 289 628 941 494 151 0
- Trạng thái của e hóa trị được mô tả bằng orbital phân tử - MO. lA-A [Å] 2.67 -- 1.59 1.31 1.10 1.21 1.42 --
- MO trong kim loại thuộc về nhiều nguyên tử MO không định chỗ
Department of Inorganic Chemistry - HUT
Năng lượng liên kết kim loại - ∆Ha
Năng lượng solvat hóa ion
Năng lượng solvat hóa ion là năng lượng tỏa ra khi 1 mol ion ở thể khí tan vào
dung môi thành dung dịch vô cùng loãng. Khi dung môi là nước, gọi là năng lượng hydrat hóa. 298 405.84 / ( ) ( ) G kJ mol Na k H O l Na trong dung dich 2 Phương trình Born: 2 2 Z e N 1 G H T S k 1 s s s 2r
ε – hằng số điện môi của dung môi
k – hằng số phụ thuộc đơn vị sử dụng
∆Hs – nhiệt solvat hóa ion
∆Ss – sự biến thiên entropi solvat hóa ion
∆Gs – sự biến thiên thế đẳng áp solvat hóa cation hay anion (năng lượng solvat hóa ion).
Z+, Z- - điện tích dương, âm của cation và anion
r+, r- - bán kính của cation và anion
Department of Inorganic Chemistry - HUT
Department of Inorganic Chemistry - HUT
Năng lượng liên kết yếu
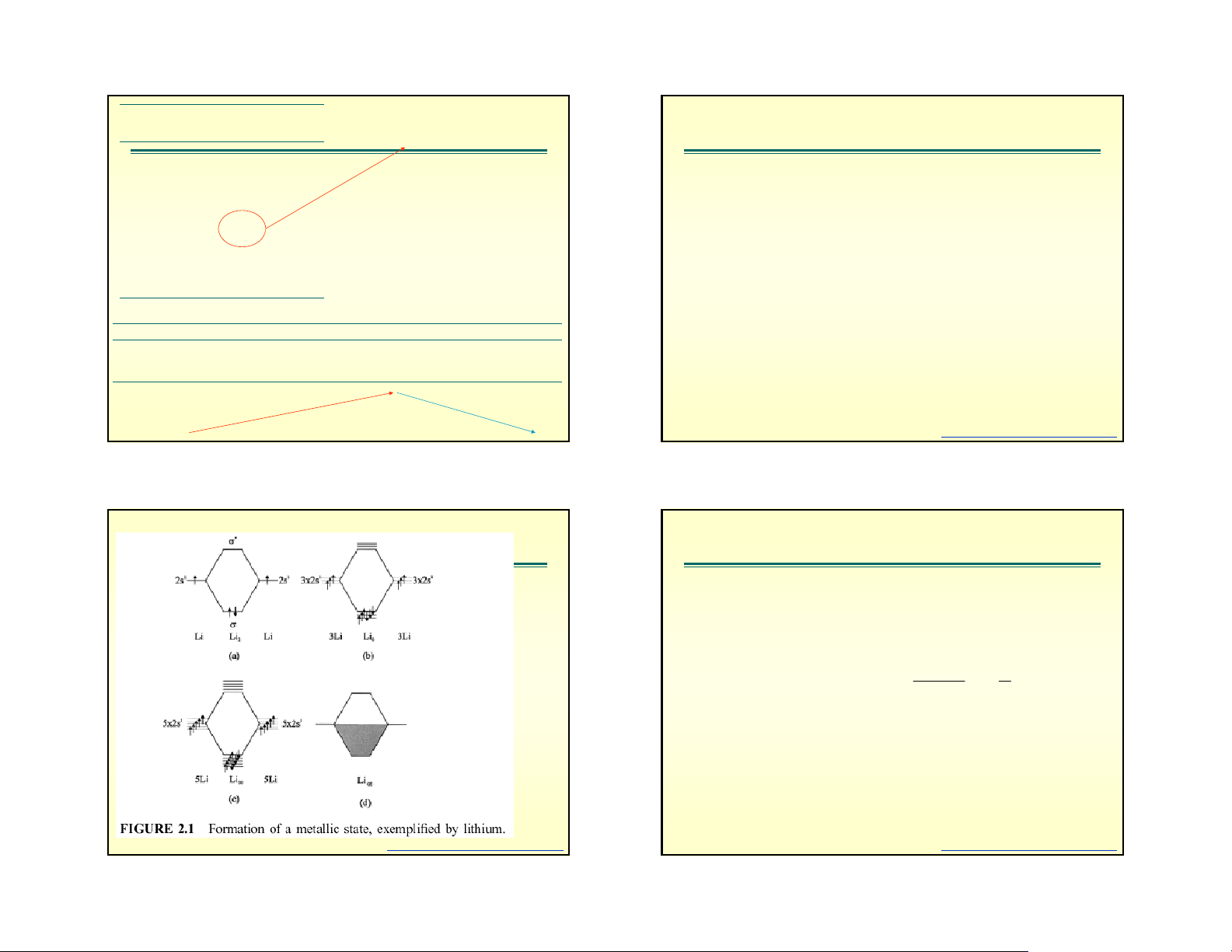
Năng lượng liên kết hydro E Hydrogen bonding hyd
H khi đã liên kết với nguyên tử
của nguyên tố có độ âm điện lớn • Polarity means small
(F, O, N) còn có khả năng liên kết negative charge at O
phụ với nguyên tử khác trong
phân tử. Liên kết phụ này gọi là end
liên kết hydro, biểu diễn bằng • Small positive charge at dấu chấm.
Năng lượng liên kết hydro phụ H end
thuộc chủ yếu vào độ âm điện • Attraction between +
của nguyên tử liên kết với nó. Độ
âm điện càng lớn năng lượng and – ends of water liên kết hydro càng lớn. molecules to each other
Năng lượng liên kết hydro nhỏ
hơn rất nhiều so với năng lượng or other ions
liên kết ion và liên kết cộng hóa
trị, giá trị của nó trong khoang 4 – • Molecules ‘order’
40 kJ/mol, lớn nhất là 113 kJ/mol themselves with these trong F-………HF relatively weak H-bonds Fig. 5.3
Department of Inorganic Chemistry - HUT
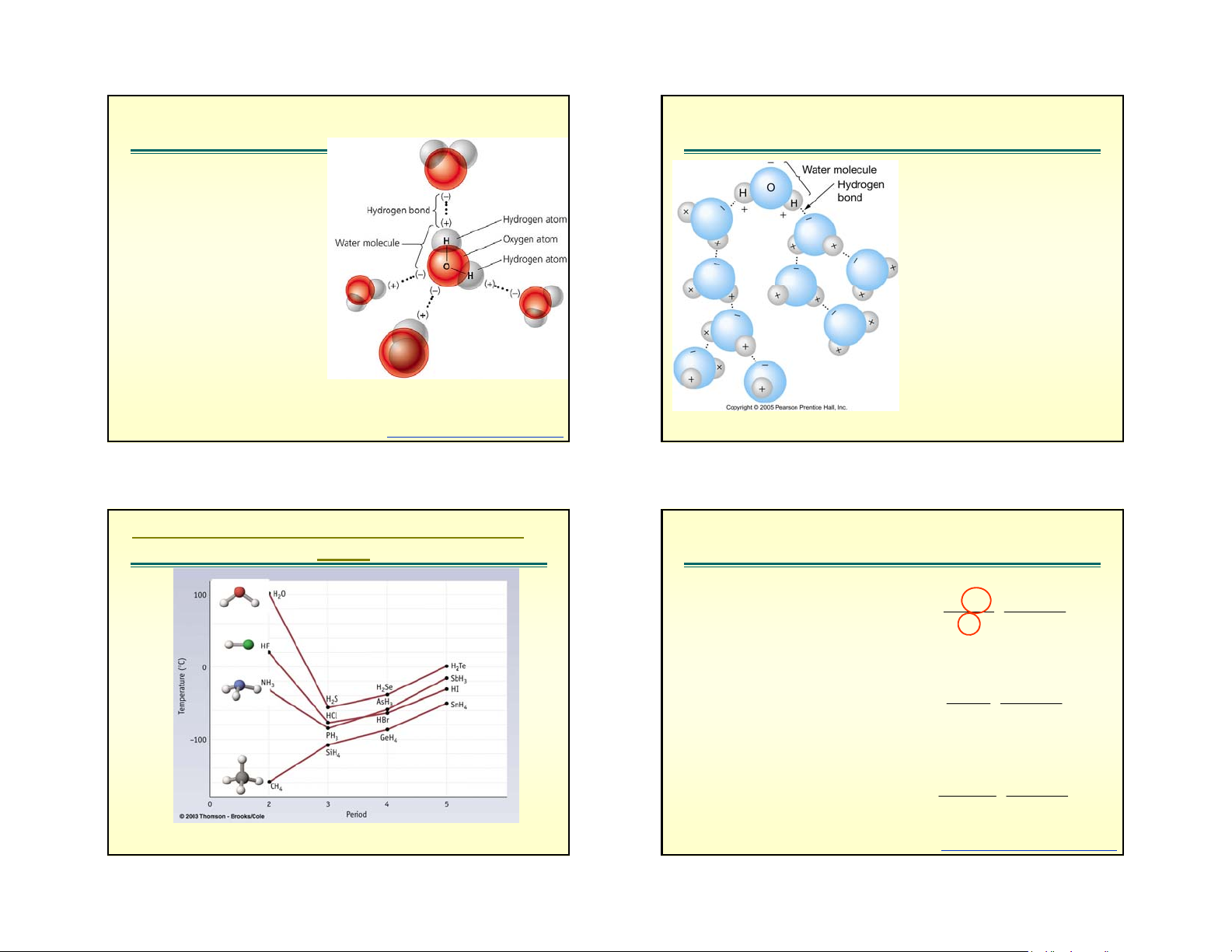
Effect of Hydrogen-Bonding on Boiling
Năng lượng liên kết yếu Point
Năng lượng tương tác Van der Waals Uvdv
Uvdv là tương tác giữa các phân tử, chủ yếu là tương tác hút khi các vỏ e chưa xâm nhập vào nhau 4 2 1 U dh 6
3kTR 4o 2 Z 2 2 1 U U vdv cu 6 R 4o 2 ]
μ – momen lưỡng cực của phân tử [Cm]
k – hằng số Boltzmann, 1.3805.10-23 [J/K] 2 T – nhiệt độ [K] 3h 1 o
R – khoảng cách giữa 2 phân tử [m] U kt 6
εo – hằng số điện môi của chân không, 8.85.10-12 [SI] 4R
α – độ phân cực (biến dạng) của phân tử 4o 2
h – hằng số Plank, 6.626.10-34 [Js]
νo – tần số dao động ứng với năng lượng ở T = O K
Department of Inorganic Chemistry - HUT



