











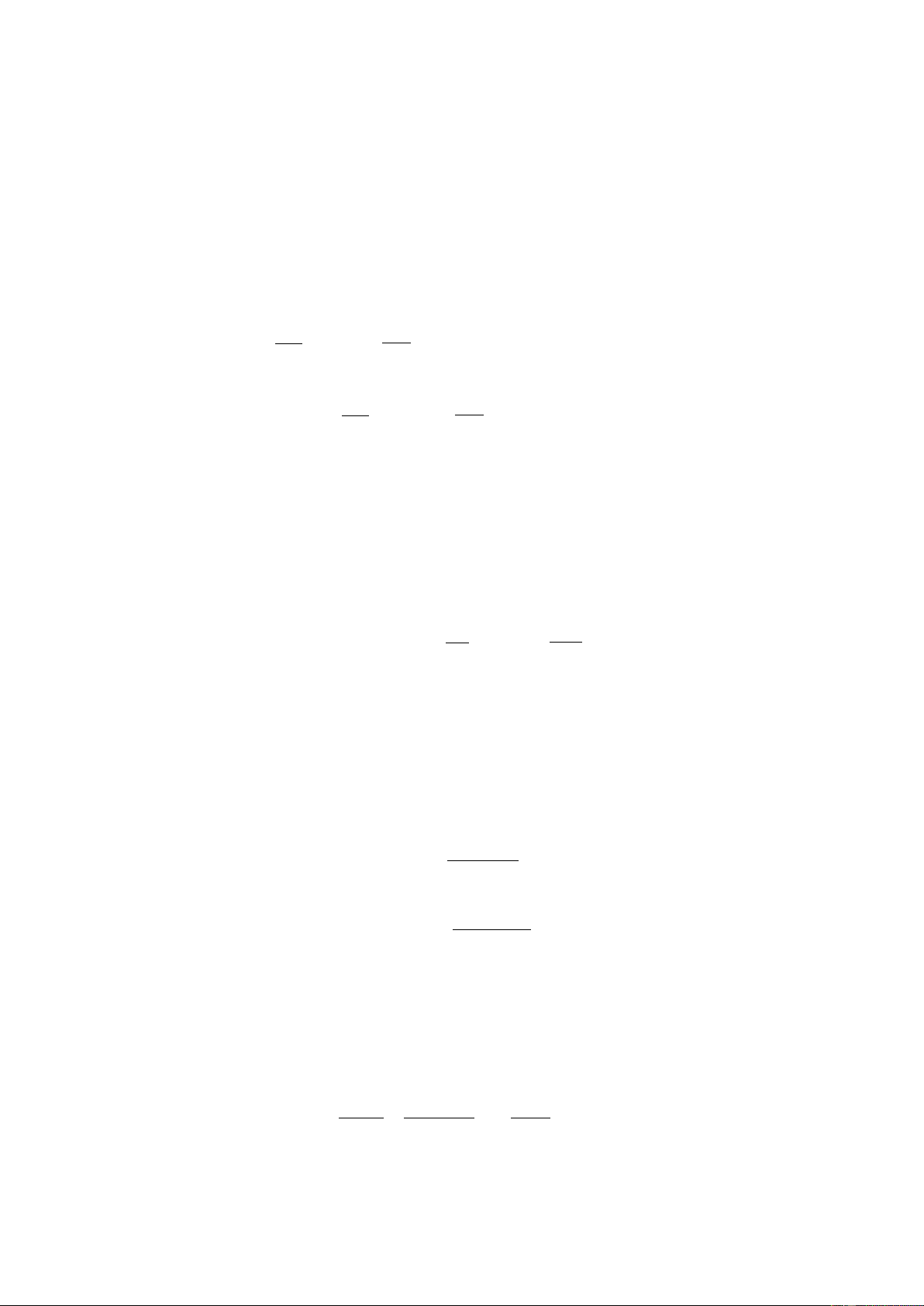




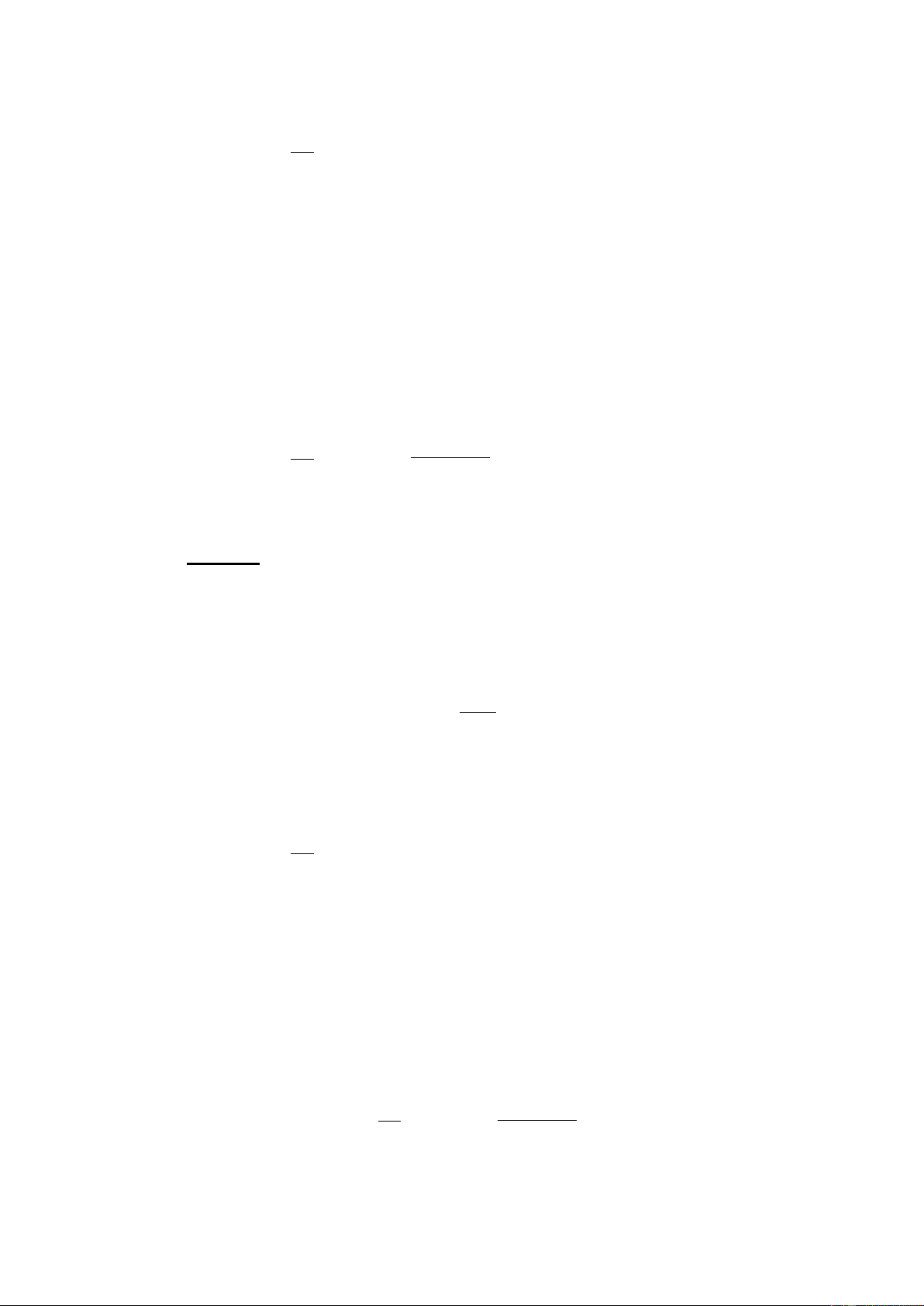
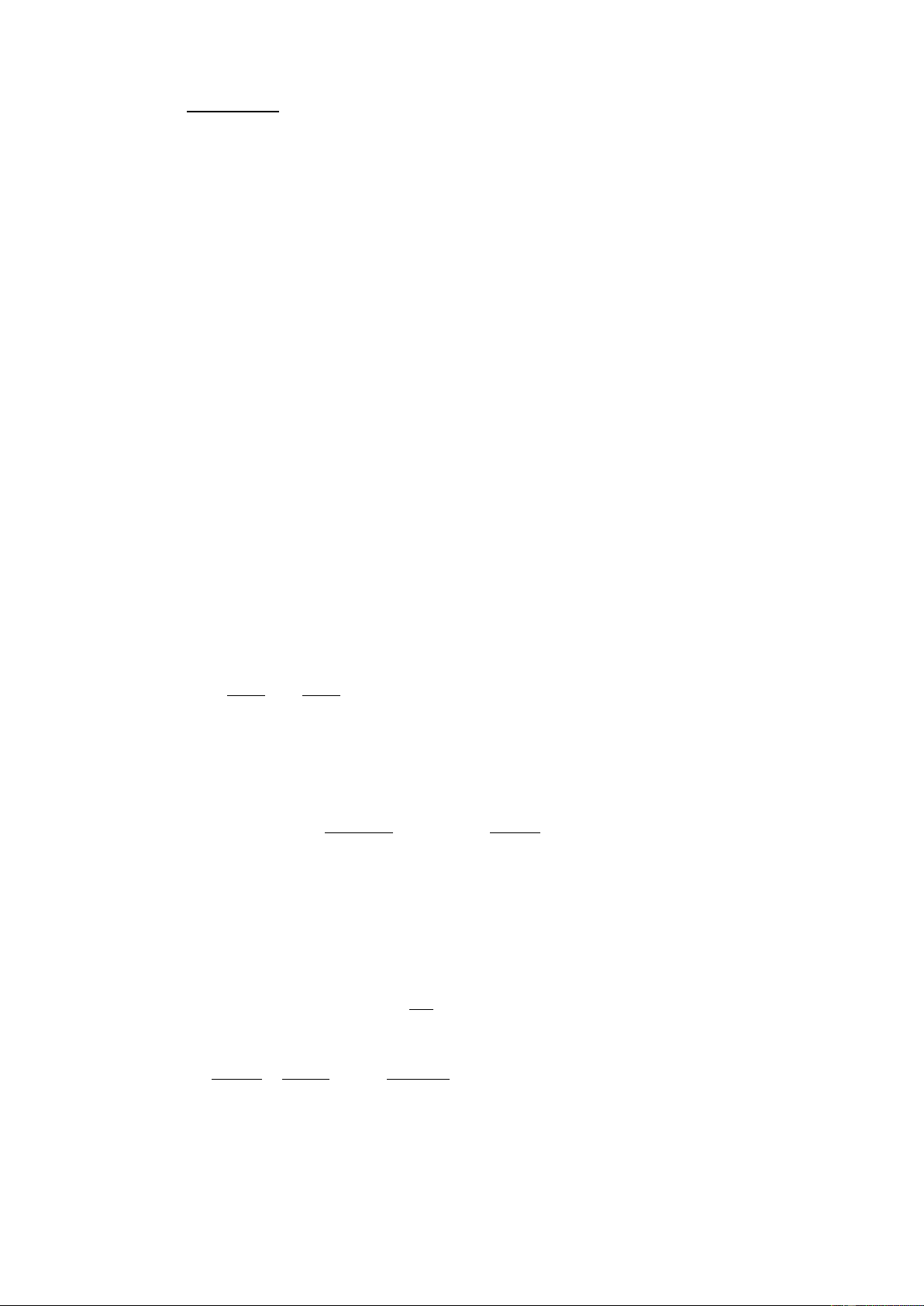

Preview text:
CHƯƠNG 3. CHUẨN ĐỘ AXIT BAZƠ
3.1. Phản ứng axit bazơ
II.1.1. Định nghĩa axit-bazơ cặp axit bazơ liên hợp + Theo Bronsted: -
Axit là những chất có khả năng cho proton. Axit sau khi cho proton
tạo ra một bazơ gọi là bazơ liên hợp. -
Bazơ là những chất có khả năng nhận proton
+ Phương trình: A1 B1 + H+ (axit) (bazơ)
B1 là bazơ liên hợp của axit A1 và gọi A1/B1 cặp axit bazơ liên hợp
+ Nước là dung môi vừa có khả năng cho và nhân proton, nên các axit
bazơ có thể thể hiện tính chất của chúng trong nước. B + H2O A + OH- A/B NH + +
3 + H2O NH4 + OH- NH4 /NH3 CH3COOH + H2O CH3COO- + H3O+ CH3COOH/CH3COO-
HCl + H2O Cl- + H3O+ HCl/Cl-
Chất lưỡng tính vừa có khả năng nhường H+ vừa có khả năng nhận H+ như H - 2- 2O, HCO3 , HSO4 .
Đa axit là axit có thể cho nhiều H+ ví dụ : H2SO4
Đa bazơ là bazơ có khả năng nhận nhiều H+ ví dụ: PO 3- 4
1.Phản ứng axit bazơ A1 + B2 B1 + A2 A1 H+ + B1 A1/B1 B2 + H+ A2 A2/B2 Ví dụ: CH + 3COOH + NH3 CH3COO- + NH4
CH3COOH CH3COO- + H+ CH3COOH/ CH3COO- NH + + 3 + H+ NH4 NH4 / NH3 1
Thực chất phản ứng axit bazơ là sự trao đổi H+ giữa hai cặp axit bazơ liên hợp.
2.Hằng số axit- bazơ, tích số ion của nước • Hằng số axit:
Giả sử có axit A hoà tan vào nước A + H2 O B + H3O+ + + [B].[H O+ ] [B].[ H O ] [B].[ H ] K 3 3 cb = Kcb. [H2O] = = [H ] O .[ A] [A] [A] 2
Trong dung dịch ta có nồng độ H O xấp xỉ nhau bằng 1000/18 =55,5 (M). 2
Rất lớn so với nồng độ ion trong dung dịch nên coi [H2O] = const. + Đặt K [B].[ H ] cb. [H2O] =Ka = [A]
Ka gọi là hằng số axit biểu thị cường độ mạnh yếu của axit. Ngoài ra còn
dùng đại lượng pKa= -logKa Đối với một axit K
càng nhỏ axit phân li càng mạnh a càng lớn pKa Đối với một axit K
càng lớn axit phân li càng yếu a càng bé pKa
ví dụ: CH3COOH : Ka= 1,74.10-5, pKa=4,67
HCN Ka= 6,2.10-10, pKa = 9,21 • Hằng số bazơ.
Giả sử có bazơ B hoà tan vào nước. B + H2O A + OH- A . OH − − AOH K = = . cb Kcb.[OH-] = Kb B.H O B 2
Kb là hằng số bazơ biểu thị cường độ mạnh yếu của của bazơ, ngoài ra còn
dùng đại lượng pKb = - log Kb
Kb càng lớn pKb càng bé bazơ càng mạnh
Kb càng bé pKb càng lớn bazơ càng yếu
Ví dụ: NH3 : Kb = 1,8.10-5 pKb=4,75
CH3 COO-: Kb= 10-9,25 pKb=9,25 2
Các bazơ mạnh như KOH, NaOH, Ca(OH)2, Ba(OH)2 vv… có Kb=+
• Tích số ion của nước. H2O + H2O = H3O+ + OH- + − H O 3 . OH + − K =
K . H O 2 = H O . OH = K cb 2 cb 2 3 H O 2 H O 2
ở 25OC, P=1atm, KH2O= [H3O+].[OH-] =10-14
• Quan hệ giữa Ka,Kb khi A và B là hai cặp axit bazơ liên hợp + B . H3 O Ka = A − AOH Kb = . B + K K = . = K a b H O 3 OH− w =10-14
Vậy Ka lớn axit mạnh thì Kb nhỏ bazơ liên hợp lại yếu
Ví dụ: CH3COOH/CH3COO-
CH3COOH + H2O CH3COO-+ H3O+ Ka=10-4,75 , Kb=10-9,25
Đối với axít mạnh : HCl + H2O H3O+ + Cl- −14 10 Ka = + Kb= + = 0
II.1.2.Chuẩn độ theo phương pháp trung hòa.
Phương pháp này dựa vào phản ứng trung hòa A1 + B2 B1+ A2
ví dụ: HCl + NaOH NaCl + H2O
trong quá trình định phân [H+] thay đổi tức pH thay đổi. Điểm tương
đương của quá trình định phân ứng với một giá trị xác định. Bằng cách nào đó
xác định pH và kết thúc quá trình định phân đúng vào thời điểm đó. Muốn vậy
người ta phải có máy đo pH hay chất có thể đổi màu theo pH để theo dõi sự biến
thiên của pH trong quá trình định phân và xác định pH tại thời điểm tương đương.
II.2. Cân bằng axít - bazơ trong dung dịch nước. 3
II.2.1. pH của dung dịch chứa cặp axit- bazơ liên hợp
Giả sử trong dung dịch có axit HA nồng độ ban đầu C , hằng số axit K A a và
có bazơ liên hợp A- nồng độ ban đầu CB
Cân bằng trong dung dịch nước là:
HA + H2O H3O+ + A- ( HA H+ + A -) NaA Na+ + A- CB CB CB
H2O + H2O H3O+ + OH- (H2O H+ + OH-) −A + . H + Ka .HA K H = a= (1) HA −A
Vì dung dịch trung hòa về điện nên ta có:
Na++H+= _A+ _ OH C + B [H+] =[ A-] + [OH-] (2)
Theo định luật bảo toàn khối lượng: [HA] + [A-] = CA + CB (3)
từ (2) [A-]= CB +[H+] - [OH-] (4)
từ (3) [HA]= CA + CB -[A-] = CA + CB -CB -[H+] + [OH-] = CA -[H+] + [OH-] (5)
Thay (4), (5) vào (1) ta có: - CA [H+ ] + [ OH- ] [H+] =Ka. (2-1) CB + [H+ [ - ] OH- ]
II.2.2. pH của dung dịch axit mạnh
Giả sử dung dịch axit mạnh HA nồng độ ban đầu CA. Ka=+
Ta có cân bằng: HA + H2O A- + H3O+ ( HA H+ + A-) (1)
H2O + H2O H3O+ + OH- ( H2O H+ + OH- ) (2)
Theo phương trình bảo toàn điện tích ta có [H+] =[A-] + [OH-] 4
−A.H3 + Vì axit mạnh Ka= O HA = +
[HA]= 0 nên cân bằng (1) chuyển hoàn toàn sang phải
[A-] = CA [H+]= CA+ [OH-]
+ nếu như nồng độ axít không quá bé (dung dịch không quá loãng ) sao cho
CA>> 10-6 (M) ta có thể bỏ qua [OH-] bên CA
[H+] = CA pH= -log[H+] =-logCA
Ví dụ: Tính pH của dung dịch HCl có nồng độ 10-3 M, 10-5M, 10-8M + Nếu CA 10-8 - 10-6 M −14 10 ta có [H+] = CA + + H
[H+]2 - CA.[H+] - 10-14 = 0
giải phương trình [H+] pH =-log[H+]
+ Nếu CA << 10-8 thì bỏ qua CA [H+] =[OH-] =10-7 pH =7
II.2.3. pH của dung dịch bazơ mạnh
Giả sử dung dịch có bazơ mạnh B có nồng độ ban đầu CB, Kb =+ Ta có cân bằng: B + H2O BH+ + OH- (1) H2O + H2O H3O+ + OH- (2)
Phương trình bảo toàn proton: [H3O+] + [BH+]= [OH-]
Kb=+ nên [B]= 0 và [BH+]=CB [OH-]= CB + [H+]
+ Nếu CB >> 10-6 ta có thể bỏ qua [H+] bên cạnh CB [OH-] = CB
pOH=-lgCB pH = 14 -pOH =14+ lgCB + Nếu CB 10-8 -10-6 5 −14 10 [OH-] = CB + − OH
[OH-]2 - CB.[OH-] -10-14 =0
giải phương trình [OH-] pOH pH
+ Nếu CB << 10-8 thì bỏ qua CB [OH-] =[H+] =10-7 pH = pOH = 7
II.2.4. pH của dung dịch đơn axit yếu.
Giả sử axit yếu HA có nồng độ ban đầu CA Ta có các cân bằng sau:
HA + H2O A- + H3O+ (HA H+ + A-) Ka (1)
H2O + H2O H3O+ + OH- ( H2O H+ + OH- ) Kw (2) Cách 1: [H + ].[ A− ] Ta có Ka = (3) [ ] HA KH2O = [H+].[OH-]. (4)
The định luật bảo toàn khối lượng. CA = [HA] + [A-] (5)
Dung dịch trung hòa về điện . [H+] = [OH-] + [A-] (6)
từ 3,4,5,6 ta rút được phương trình sau.
[H+]3 + Ka[H+]2 –(Ka.CA+ KH2O)[H+] – Ka.KH2O = 0 (7)
giải phương trình (7) ta được [H+] tuy nhiên để giải phương trình bậc 3
rất khó khăn nên ta giải gần đúng.
Nếu dung dịch không quá loãng và axit không quá yếu sao cho. 14 K . a Ca K (10− ) H2O khoảng 100 lần C
.H + K A H2O
[H+]2 + KA.[H+] - Ka.CA = 0 [H+] pH
cách 2: Dựa vào công thức (2-1) 6
Nếu dung dịch không quá loãng và axit không quá yếu sao cho: [H+] >> [OH-]
thay vào công thức (2-1) ta có C − A + H [H+]=
vì dung dịch axit CB = 0 C + B + H CA + − H [H+]= + H
[H+]2 + KA.[H+] - Ka.CA = 0 [H+] pH
+ Nếu CA >> [H+] ( 100 lần) [H+]2 =Ka.CA [H+] = Ka.C A
pH = 1 ( pKa − lgC ) (2-4) 2 A
chú ý: khi cần tính pH của dung dịch axit yếu ta thay ngay vào công thức
(2-4) tính được pH sau đó so sánh vơí điều kiện CA >>H+] nếu thoả mãn ta chấp
nhận nếu không thoả mãn thì ta phải giải phương trình trên.
Ví dụ: Tính pH của dung dịch axit
a. CH3COOH 0,1 M , Ka =10-4,75
b. NH4Cl 0,1 M , KNH3 =10_4,75
c. CHCl2COOH 0,1 M , KCHCl2COOH= 8.10-2 =10 -1,1 giải
a. CH3COOH + H2O CH3COO- + H3O+ PH = 1 1
( pKa − lg C ) = ( 75 , 4 − lg ) 1 , 0 = 875 , 2 2 A 2 b. NH + 4Cl NH4 + Cl- NH + 4 H+ + NH3 14 − 14 − 10 10 −9,25 K + = = = 10 NH −4,75 4 K 10 NH 3 pH = 1 1
( pKa − lg C ) = , 9 ( 25 − lg ) 1 , 0 = 1 , 5 25 2 A 2 7
c. CHCl2COOH CHCl2COO- + H+ pH= 1 1
( pKa − lg C ) = 1 , 1 ( − lg ) 1 , 0 = 05 , 1 2 A 2
[H+] = -10-1,05 không thoả mãn điều kiện CA [H+]. nên ta phải
giải phương trình: [H+]2 + Ka.[H+] - Ka.CA = 0
[H+]2 + 10-1,1.[H+] - 10-1,1.10-1 = 0 [H+] =0,05797 pH = 1,236
II.2.5. pH của dung dịch bazơ yếu.
Giải sử dung dịch có bazơ yếu B, nồng độ ban đầu là CB và hằng số bazơ là Kb ta có cân bằng B + H2O BH+ + OH- (1) Kb
H2O + H2O H3O+ + OH- (2) Kw
Nếu dung dịch không quá loãng, bazơ không quá yếu sao cho K C K b B H O 2 C
. OH − K B H O 2 [OH-] >> [H+]
từ công thức (2-1) ta có OH- [H+] = Ka . CB − − OH 10 14 − 10 14 − OH- = OH − . Kb CB − − OH
[OH-]2 + Kb.[OH-] - Kb.CB = 0 (3)
nếu CB>> [OH-] ( 100 lần ) thì [OH-]2 = K b.CB 1 1 pOH =
( pK − lg C ) pH = 14 − pOH = 14 − ( pK − lg C ) 2 b b 2 b A 1 = 7 + ( pKa + lg C ) (2 - 5) 2 B
Chú ý: khi cần tính pH của dung dịch bazơ yếu thay vào công thức
(2-5) ta tìm được pOH (pH) sau đó so sánh với điều kiện nếu thoả mãn thì kết
quả đạt được chấp nhận. Nếu không ta phải giải phương trình (3) tìm pOH (pH) 8
Ví dụ: tính pH của dung dịch NH3 0,1M biết KNH3 =10-4,75
Dung dịch CH COONa 0,1 M biết K 3 CH3COOH =10-4,75 Giải a. NH + 3 + H2O NH4 + OH- pH= 14- 1 1
( pK − lg C ) = 14 − ( 75 , 4 + ) 1 = , 11 25 2 b B 2
pOH = 2,875 nên thoả mãn điều kiện b. CH3COONa CH3COO- + Na+
CH3COO- + H2O CH3COOH + OH- PH =7 + 1 1
( pKa + lg C ) = 7 + ( 75 , 4 − ) 1 = 8 , 8 75 2 B 2
pOH= 14-8,875 = 5,125 thoả mãn điều kiện
II.2.6. pH của dung dịch đa axít yếu HnA (n 2)
Giải sử trong dung dịch có đa axit H A nồng độ ban đầu là C , hằng số n A axit là Ka , …Ka 1, Ka2 n: Ta có các cân bằng: HnA H+ + Hn-1A (1) Ka1 Hn-1A H+ + Hn-2A (2) Ka2 ……………………… ………………………
H1A(n-1)- H+ + An- (n) Kan H2O + H2O H3O+ + OH- Kw H .A− + . n−1 H Ka1 = H A n H .A2− . + n−2 H Ka2 = Hn 1 − A ………………… ………………… n− A + . H Kan = (n− ) 1 − HA 9
Thường ta gặp các đa axit có Ka1>> Ka2>> Ka3 …….>>Kan nên cân bằng
(1) là chủ yếu và ta có thể bỏ qua các cân bằng (2), (3) …(n) do vậy ta sẽ tính
pH như của dung dịch axit yếu, và thay Ka =Ka1 1
pH = (pKa − lgC ) 2 1 A
Ví dụ: Tính pH của dung dịch H3PO4 0,1M biết Ka1 = 10-2,25, Ka2 = 10- 7,20 , Ka3=10-12,40 pH = 1 (pKa 1 1 -lgCA) = ( , 2 2 − lg ) 1 , 0 = 6 ,
1 không thoả mãn điều kiện CA 2 2 [H+]
nên ta phải giải phương trình: [H+]2 + Ka.[H+] - Ka.CA=0 [H+] = 0,0211 pH =1,65.
II.2.7. pH của dung dịch đa bazơ
Giải sử dung dịch có đa bazơ Bn- nồng độ ban đầu CB, axit H B có hằng số …. Ka n axit: Ka1, Ka2, Ka3 n Ta có các cân bằng:
Bn- + H2O BH(n-1)- + OH- (1) Kb1 =Kw/Kan BH(n-1)- + H (n-2)- 2O BH2 + OH- (2) Kb2 =Kw/Kan-1
………………………………..
………………………………. H2O + H2O H3O+ + OH- Kw Thường đa bazơ có K
>>….. >> K nên cân bằng (1) là b1>> Kb2 >>Kb3 bn
chủ yếu nên có thể bỏ qua các cân bằng khác, Tính pH của dung dịch như dung dịch đơn bazơ yếu.
pOH = 1 ( pK − lgC ) 2 1 b B pH = 1 7 + ( pKa + lg C ) 2 n B
Ví dụ: Tính pH của các dung dịch
a.dịch Na2CO3 0,1M biết Ka1=10-6,2, Ka2 =10-10,2 10
b. dung dịch Na3PO3 0,1 M biết Ka1=10-2,2, Ka2=10-7,2, Ka3=10-12,4 giải. a. Na 2 2CO3 2Na+ + CO3 CO 2- - 3
+ H2O HCO3 + OH- Kb1 , Ka2 HCO -
3 + H2O H 2CO3 +OH- Kb2 , Ka1 H2O + H2O H3O+ + OH-
pOH = 1 ( pK − lgC ) 2 1 b B 14 − 14 10 10− K − , 3 = = b1 = 8 10 10 − ,2 Ka 10 2 pOH = 1 8 , 3 ( − lg ) 1 , 0 = ,
2 4 thoả mãn điều kiện 2 pH =14-2,4= 11,6 b. Na 3- 3PO4 3 Na+ + PO4 PO 3- 2- 4
+ H2O HPO4 + OH- Kb1 , Ka3 HPO 2- - 4
+ H2O H 2PO4 + OH- Kb2 , Ka2 H -
2PO4 + H2O H 3PO4 + OH- Kb3 , Ka1 H2O + H2O H3O+ + OH- 14 − 14 10 10− K − , 1 = = b1 = 6 10 12 − ,6 K 10 a3 pOH = 1 6 , 1 ( − lg ) 1 , 0 = 3 ,
1 không thoả mãn điều kiện nên ta phải giải 2 phương trình: [OH-]2 + Kb.[OH-] - Kb.CB = 0
[OH-]2 + 10-1,6[OH-] – 10-1,6.0,1 = 0 [OH-] = 3,9.10-2 pOH = 1,4 pH= 12,6
8. pH của dung dịch axit yếu và bazơ liên hợp.
Giả sử dung dịch có hỗn hợp axit yếu HA nồng độ ban đầu C , hằng số A
Ka và bazơ liên hợp A- nồng độ ban đầu CB 11 Ta có các cân bằng sau: HA A- + H+ Ka H2O H+ + OH- Kw C − A + H + − OH H+ = Ka. C + B + H − − OH CA − Nêú 7 . ka
10 dung dịch có môi trường axit [H+] >> [OH-] CB C − A + H Nên H+ = Ka. C + B + H
[H+]2 + (Ka+CB)[H+] -Ka.CA =0
nếu CA, CB >> [H+], [OH-] (8-1) C [H+] = Ka. A CB C pH= pKa - lg A CB
Nếu Ka. CA < 10-7 môi trường bazơ [OH-] >> [H+] CB C + A − OH H+ = Ka. C − B − OH − − C + A − OH 14 14 10 10 = OH− K C − B − OH b [OH-]2 + (Kb+CA)[OH-]-Kb.CB=0
Nếu CA, CB >> [OH-], [H+] (8-2) C [H+] = Ka. A CB C pH= pKa - lg A CB
Ví dụ: Tính pH của dung dịch chứa hỗn hợp CH COOH M 1 , 0 a. 3 CH COONa , 0 M 01 3 biết K CH3COOH =10-4,75 12 NH M 1 , 0 b. 3 NH Cl M 01 , 0 4 biết KNH3 =10-4,75 Giải a. CH3COOH CH3COO- + H+ Ka C 1 , 0 Ta có Ka. A =10-4,75. = 10-3,75 > 10-7 C , 0 01 B C 1 , 0
Nên pH = pKa-lg A =4,75-lg =3,75 C , 0 01 B
Thoả mãn điều kiện (8-1) b. NH + 4Cl NH4 + Cl- NH + 4 + H2O NH3 + H3O+ C , 0 01 pH=pKa-lg A =9,25-lg =10,25 C 1 , 0 B Thoả mãn điều kiện
II.2.9. pH của dung dịch có chất lưỡng tính
Giả sử trong dung dịch có chất lưỡng tính là HA- và nồng độ ban đầu là C ta có cân bằng: + H 2− . A HA- H+ + A2- (1) K2= − HA
H+.HA− HA- + H+ H2A (2) K1= H A 2 H2O + H2O H3O+ + OH- (2) [H+] = [H+]1 -[H+]2 + [H+]3 = [A2-] - [H2A] +[OH-] − + HA HA .H K = K H O 2 2. - + + H + K H 1 13 K (K . ) K (K C . + K ) 1 2 − HA + K [H+]= H O 2 = 1 2 H O 2 K + K + C 1 − HA 1 K .C + Nếu K 2 H2O C K1 [H+] = K .K 1 2 1 pH= (pK1+pK2) 2
Ví dụ: tính pH của các dung dịch:
a. Dung dịch NaHCO3 0,1M biết K1=10-6,4 K2=10-10,2
b. dung dịch Na2HPO4 0,1M biết K1=10-2,2 K2 =10-7,2 K3=10-12,4 Giải a. NaHCO - 3 =Na+ + HCO3 HCO - 3 + H+ H2CO3 HCO - 2- 3 + H2O CO3 + H3O+ H2O + H2O H3O+ +OH- 1 1
PH= (pK1 + pK 2) = ( , 6 4 + , 10 ) 2 =8,3 2 2 b. Na 2- 2HPO4 = 2Na+ + HPO4 HPO 2- 3- 4 H+ + PO4 HPO 2- 4 + H+ H3PO4 H2O + H2O H3O+ +OH- 1 1
PH= (pK + pK ) = (7,2 + , 12 4) =9,8 2 2 3 2
II.2.10. Tính nồng độ cân bằng của dạng axit bazơ trong dung dịch khi biết pH.
a. Giải sử dung dịch axit HA có nồng độ ban đầu Co 14
HA +H2O H3O+ +A- (HA H+ +A-) Co= HA + A- H+A- . Ka= HA HA [A-] = Ka . + H HA Co = [HA] + Ka. + H + H + Ka = [HA].( ) + H H+ C [HA] = O H + + Ka KaC [A-]= O H + + Ka + HA H nếu ta đặt o = = + C H + Ka O A− Ka 1 = = H + C + Ka O ta sẽ có [HA] = o.Co [A-] = 1 Co (10-1)
b. giả sử dung dịch axit H A nồng độ ban đầu là C 2 o H2A H+ + HA- HA- H+ + A2- Co = [H2A] +[ HA-] +[A2-] + H − . HA H A K − HA 2 = 1= H A K1 2 + H 15 H+ 2 . A − HA− − H A 2 2 K = A = K = K K 2 HA− 2
H+ 1 2 H+2 C = + + O H A H A H A K K K 2 2 2 1
H+ 1 2 H+2 C = + + O 1 1 H A 1 K K K 2 1 H+ 1 2 + H 2 ( 2 + + H
+ K . H + K K 1 1 2 ) C = O H A 2 H+2 ( 2+ + H
+ K . H + K K 1 1 2 ) H A = C . 2 O H+2 H A H+2 2 = = O C + + + + O
(H 2 K . H K K 1 1 2) + HA− K H 1 = C . O ( + +
H 2 + K . H + K K 1 1 2) − + HA K H 1 = = 1 C + + + + O
(H 2 K . H K K 1 1 2) − K K 2 A = C . O ( + + H 1 2
2 + K . H + K K 1 1 2) 2A− K K = = 2 C + + + + O (H 1 2 2 K . H K K 1 1 2)
c.Tổng quát với axit H A nồng độ ban đầu là C n o ta có: H+n H nA=Co o với = o 1 − −2
H + n + K + + + + + 1H
n K K12H n ... K K ...K 1 2 n 1 − K + 1H n H n-1A-1 =Co 1 với = 1 1 − −2
H + n + K + + + + + 1H
n K K12H n ... K K ...K 1 2 n −2 K K + 1 2 H n H n-2A-2 = Co 2 với = 2 1 − −2
H + n + K + + + + + 1H
n K K12H n ... K K ...K 1 2 n
…………………………………………………………….
…………………………………………………….. 16 K K ...K A-n = C 1 2 n = o n với n 1 − −2
H + n + K + + + + + 1H
n K K12H n ... K K ...K 1 2 n (10-2)
Ví dụ: Tính nồng đồ của HPO 2- 4 trong dung dịch đệm Biết Co= 0,1M, pH =7
K1=10-2.2 , K2=10-7,2 , K3=10-12,4 C - 2- 3-
o= [H3PO4] + [H2PO4 ] + [HPO4 ] + [PO4 ] =0,1 Giải
Theo công thức (10-2) với n=3 ta có: H+3 = = 9,821.10-6 o
H+3 + K H+2 + K K H+ + K K K 1 1 2 1 2 3 K H + 1 2 = = 0,617 1
H+3 + K H+2 + K K H+ + K K K 1 1 2 1 2 3 K K H + 1 2 = = 0.378 2
H+3 + K H+2 + K K H+ + K K K 1 1 2 1 2 3 K K K = = 1,551.10-5 3 H+ 1 2 3
3 + K H+2 + K K H+ + K K K 1 1 2 1 2 3 [HPO 2-
4 ] = Co . 2 =0,1.0,378 =0,0378 (M)
II.3. Dung dịch đệm II.3.1. Khái niệm.
Ví dụ: Thêm 1 ml dung dịch HCl 0,1 M vào 1 lit nước xem pH thay đổi thế nào.
Thêm 1 ml dung dịch HCl 0,1 M vào1lit dung dịch hỗn hợp CH3COOH 0,1M và CH COONa 0,1M với K 3
a=10-4,75 xem pH thay đổi thế nào. Giải - nước có pH=7 1. 1 , 0
khi thêm HCl vào ta có: [H+]= −4 = 10 M 1000
pH = 4 vậy ta thấy pH thay đổi 3 đơn vị 17 -
khi chưa thêm HCl vào ta có C pH =pK A a-lg = 4,75- lg1 =4,75 CB
sau khi thêm HCl vào ta có: H+ + CH3COO- CH3COOH ban đầu: 10-4 10-1 10-1 phản ứng: 10-4 10-4 10-4
cân bằng: 0 10-1-10-4 10-1+10-4 − − C 1 4 10 + 10 pH =pK A a-lg = 4,75 -lg − − 4,75 C 1 4 10 −10 B
Vậy ta thấy pH hầu như không thay đổi
Ví dụ 2: thêm 1ml dung dịch NaOH 0,1M vào 1 lit nước
thêm 1ml dung dịch NaOH 0,1M vào 1 lit dung dịch CH3COOH 0,1M và CH3COONa 0,1M -
Khi chưa thêm NaOH vào nước pH=7 1. 1 , 0 Khi thêm NaOH ta có [OH-] = −4
= 10 M pOH=4 pH=10 1000
Vậy pH thay đổi là 3 đơn vị - Khi chưa thêm NaOH ta có C pH =pK A a-lg = 4,75- lg1 =4,75 CB sau khi thêm NaOH ta có:
CH3COOH + OH- CH3COO- + H2O ban đầu: 10-1 10-4 10-1 phản ứng: 10-4 10-4 10-4
cân bằng: 10-1-10-4 0 10-1+10-4 − − C 1 4 10 −10 pH =pK A a-lg = 4,75 -lg − − 4,75 C 1 4 10 + 10 B
vậy pH hầu như không thay đổi. 18
Nhận xét: dung dịch có tính chất giữ pH hầu như không thay đổi khi ta
thêm vào 1 lượng nhỏ axit mạnh hoặc bazơ mạnh vào gọi là dung dịch đệm. Định nghĩa:
dung dịch đệm là dung dịch có khả năng duy trì pH ổn định khi ta cho
thêm một lượng nhỏ axit mạnh hoặc bazơ mạnh
dung dịch đệm chứa axit yếu và bazơ liên hợp
NH4Cl/NH3, CH3COOH/CH3COONa, NaH2PO4/Na2HPO4, NaHCO3/Na2CO3
Ngoài ra tác dụng của dung dịch đệm còn thấy ở dung dịch axit mạnh có
nồng độ lớn, bazơ mạnh có nồng độ lớn, dung dịch muối axit, chất lưỡng tính
pH của dung dịch đệm phụ thuộc vào bản chất của dung dịch (pK ) và tỷ a số nồng độ CA/CB
Nếu dung dịch đệm đem pha loãng vẫn đảm bảo pH không thay đổi
II.3.2. Đệm dung: ( dung lượng đệm) (đệm năng)
Đệm dung của một dung dịch đệm là số mol axit mạnh hoặc bazơ mạnh
thêm vào 1 lit dung dịch để pH của dung dịch thay đổi 1 đơn vị db da = = − dpH dpH
db, da lần lượt là số mol axit mạnh và bazơ mạnh cần thêm vào dung dịch
đểm để pH của nó tăng lên hay giảm đi một lượng bằng dpH db db = − . 3 , 2 = − [ 3 , 2 + H ]. (1) d ln[ + H ] d[ + H ]
gọi CA, CB là nồng độ của các dạng axit và bazơ liên hợp trong dung dịch
đệm và tổng nồng độ của chúng là C = CA+ CB = const.
dC = −dC A B mặt khác ta có [H+ C ] = K A a. (2) CB d[H + ] d H + C + C = = −K . A B (3) a 2 d d C b CB B thay 2,3 vào 1 ta có: 19 2 C C = 2,3.K A B a. . C
K .(C + C ) B a A B C C ( − C ) d A A C C . C C . d C A B A B = 3 , 2 = 3 , 2 = 3 , 2 C + C C dC dC A B A A d max = 0 C = C 5 , 0 C = C 5 , 0 dC a B A
Ví dụ: Tính nồng độ (C ) của dung dịch đệm CH A, CB 3COOH/CH3COONa
có pH bằng 5 để khi thêm 0,25 mol HCl vào 1 lit dung dịch đó thì pH thay đổi 0,5 đơn vị
II.3.3. ứng dụng của dung dịch đệm
Trong hoá phân tích có nhiều qúa trình thực hiện ở pH ổn định như:
- Qúa trình tạo kết tủa
- Qúa trình tạo phức chất - Qúa trình chiết tách
Ta phải dùng dung dịch đệm để giữ cho pH ổn định
I.4. Chuẩn độ axit bazơ -
Phương pháp axit bazơ dựa trên phản ứng trao đổi proton giữa dung
dịch chuẩn của dung dịch định phân để xác định nồng độ axit bazơ -
Các dung dịch chuẩn trong phương pháp này thường là các axit mạnh hoặc bazơ mạnh -
Trong qúa trình chuẩn độ nồng độ các ion H+, OH- thay đổi tức pH
của dung dịch thay đổi. Vì vậy để xác định điểm tương đương người ta thường
dùng những chất mà màu sắc của chùng thay đổi theo pH của dung dịch. Những
chất này gọi là chất chỉ thị axit bazơ hoặc chất chỉ thị pH. -
Đường biểu diễn sự phụ thuộc pH của dung dịch vào thể tích dung
dịch chuẩn thêm vào gọi là đường định phân.
II.4 1. Chất chỉ thị để xác định điểm tương đương .
1. Cân bằng chuyển màu. -
Các chất chỉ thị axit bazơ phần lớn là những axit hoặc bazơ hữu cơ
yếu có thể đổi màu theo pH ở những giá trị xác định. Màu của dạng axit và của
dạng bazơ khác nhau trong dung dịch. 20



