












Preview text:
Bài giảng Hóa học – Cấu tạo chất. MỤC LỤC
Phần 2: LIÊN KẾT HÓA HỌC VÀ CẤU TẠO PHÂN TỬ ................................................................... 3
Chương 3. LIÊN KẾT HÓA HỌC. PHÂN LOẠI LIÊN KẾT HÓA HỌC ............................................ 3
3.1. Các đặc trưng cơ bản của liên kết hóa học ................................................................................... 3
3.1.1. Năng lượng liên kết cộng hóa trị (E) và năng lượng mạng lưới tinh thể (U) ........................ 3
3.1.2. Cặp electron không liên kết, cặp electron liên kết ................................................................ 4
3.1.3. Độ dài liên kết (d) .................................................................................................................. 4
3.1.4. Góc hóa trị ............................................................................................................................. 5
3.1.5. Độ bội liên kết ....................................................................................................................... 5
3.2. Phân loại liên kết .......................................................................................................................... 5
3.2.1. Liên kết cộng hóa trị .............................................................................................................. 5
3.2.2. Liên kết ion ............................................................................................................................ 7
3.2.3. Liên kết kim loại ................................................................................................................... 7
3.2.4. Các kiểu liên kết yếu ............................................................................................................. 8
BÀI TẬP CHƯƠNG 3 ............................................................................................................................ 8
Chương 4. MÔ HÌNH LEWIS ................................................................................................................ 8
4.1. Sơ đồ cộng hóa trị ........................................................................................................................ 9
4.1.1. Sơ đồ thuần túy cộng hóa trị ................................................................................................. 9
4.1.2. Sơ đồ cộng hóa trị cho - nhận ................................................................................................ 9
4.2. Quy tắc bát tử ............................................................................................................................. 10
4.3. Electron không định chỗ ............................................................................................................ 11
4.4. Điện tích hình thức (F) ............................................................................................................... 12
4.5. Khả năng phản ứng của các hợp chất ......................................................................................... 13
4.6. Hạn chế của mô hình Lewis về liên kết cộng hóa trị ................................................................. 14
BÀI TẬP CHƯƠNG 4 .......................................................................................................................... 14
Chương 5. THUYẾT LIÊN KẾT HÓA TRỊ ......................................................................................... 15
5.1. Phương pháp Heiter – London và phân tử H2 ............................................................................ 15
5.2. Những tiên đề cơ bản của thuyết liên kết hóa trị ........................................................................ 16
5.3. Hóa trị của nguyên tố trong liên kết cộng hóa trị theo thuyết V.B. Quy tắc hóa trị spin ........... 19
5.4. Thuyết lai hóa ............................................................................................................................. 20
5.4.1. Các kiểu lai hóa orbital ........................................................................................................ 21 1
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
5.4.2. Cách xác định kiểu lai hóa và dự đoán cấu trúc hình học phân tử (ion). Mô hình VSEPR 23
5.4.3. Điều kiện để lai hóa bền ...................................................................................................... 28
5.5. Hạn chế của thuyết V.B ............................................................................................................. 28
TÓM TẮT CHƯƠNG 5 ........................................................................................................................ 28
BÀI TẬP CHƯƠNG 5 .......................................................................................................................... 32
A. BÀI TẬP TRẮC NGHIỆM .............................................................................................................. 32
B. BÀI TẬP TỰ LUẬN ........................................................................................................................ 36 2
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Phần 2: LIÊN KẾT HÓA HỌC VÀ CẤU TẠO PHÂN TỬ
Chương 3. LIÊN KẾT HÓA HỌC. PHÂN LOẠI LIÊN KẾT HÓA HỌC
Hầu hết các nguyên tử (trừ khí hiếm) không thể tồn tại tự do mà chúng phải liên
kết với nhau để đạt cấu trúc nguyên tử bền vững như khí hiếm.
3.1. Các đặc trưng cơ bản của liên kết hóa học
3.1.1. Năng lượng liên kết cộng hóa trị (E) và năng lượng mạng lưới tinh thể (U)
Năng lượng liên kết cộng hóa trị (gọi tắt là năng lượng liên kết, kí hiệu là E)
là năng lượng được giải phóng khi hình thành một liên kết cộng hóa trị từ hai
nguyên tử tự do ở trạng thái khí, cơ bản.
Ví dụ. Khi tạo thành 1 phân tử khí H2 từ hai nguyên tử H ở trạng thái khí, quá
trình đã giải phóng năng lượng là 7,24.10-19 J.
H (k) + H (k) → H2 (k) EH-H = - 7,24.10-19 J.
hay EH-H = 7,24.10-19.6,02.1023 = -435,85 kJ.mol-1.
Như vậy, năng lượng của liên kết EH-H cũng chính là năng lượng liên kết của phân
tử H2 và bằng -7,248.10-19 J hoặc – 435,85 kJ.mol-1.
* Quy ước về dấu của năng lượng:
Quá trình giải phóng năng lượng thì giá trị năng lượng mang dấu âm (-).
Quá trình thu năng lượng thì giá trị năng lượng mang dấu dương (+).
Đối với phân tử từ ba nguyên tử trở lên, năng lượng liên kết của phân tử được tính
bằng tổng năng lượng của các liên kết thành phần.
Ví dụ, năng lượng liên kết của phân từ CH3CN được tính:
𝐸!"!!# = 3EC-H + EC-C + EC≡N
Trường hợp phân tử có nhiều liên kết giống nhau, người ta thường tính năng lượng
liên kết trung bình của các liên kết đó.
Ví dụ, năng lượng liên kết của phân tử CH4 là 1649,00 kJ.mol-1, năng lượng trung
bình của liên kết C-H trong phân tử CH4 được tính: $ E "#$ C-H =
= &'(%) = - 412 kJ.mol-1. % %
Ngược lại với năng lượng liên kết là năng lượng phá vỡ liên kết. Năng lượng
phá vỡ liên kết cộng hóa trị (gọi tắt là năng lượng phá vỡ liên kết, kí hiệu là D)
là năng lượng cần thiết để phá vỡ một liên kết cộng hóa trị trong phân tử ở trạng
thái khí, cơ bản thành hai nguyên tử tự do ở trạng thái khí, cơ bản. 3
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Ví dụ, để phá vỡ liên kết H-H trong 1 phân tử H2 cần cung cấp năng lượng 7,24.10- 19 J.
H2 (k) → H (k) + H (k) DH-H = 7,24.10-19 J hay 435,85 kJ.mol-1.
(Chú ý: D là năng lượng cung cấp cho quá trình nên mang dấu dương).
Năng lượng phá vỡ liên kết tron phân tử nhiều nguyên tử cũng được tính bằng tổng
năng lượng phá vỡ của các liên kết thành phần.
Như vậy, năng lượng liên kết và năng lượng phá vỡ liên kết của một liên kết có
giá trị tuyệt đối bằng nhau nhưng ngược dấu. EX-X = - DX-X
Giá trị tuyệt đối của năng lượng liên kết càng lớn thì liên kết càng bền.
Năng lượng mạng lưới ion (gọi tắt là năng lượng mạng lưới, kí hiệu U) là
năng lượng giải phóng khi tạo được một tinh thể từ các ion ở trạng thái khí, cơ bản.
Li+(k,cb) + F-(k,cb) → LiF(r) U LìF = -1008 kJ/mol.
* Cũng có thể định nghĩa năng lượng mang lưới là năng lượng tối thiểu cung cấp để
phá vỡ liên kết trong tinh thể thành các ion ở trạng thái khí, cơ bản. Theo quan điểm
này, năng lượng mạng lưới có giá trị dương.
3.1.2. Cặp electron không liên kết, cặp electron liên kết
Cặp electron không liên kết là cặp electron riêng của 1 nguyên tử và không tạo nên liên
kết. Cặp electron liên kết là cặp electron chung, tạo được liên kết giữa hai nguyên tử.
Cặp electron liên kết được tạo thành từ sự góp chung 1 electron hóa trị tự do của 2
nguyên tử tham gia liên kết (2 electron phải có ms trái dấu) hoặc được tạo thành do 1
nguyên tử có cặp electron hóa trị chưa tham gia liên kết và 1 nguyên tử có orbital trống.
Ví dụ, trong phân tử NH3, có 1 cặp electron hoá trị không liên kết ở nguyên tử N, 3 cặp
electron hoá trị liên kết giữa N và H. H cặp electron liên kết
Cặp electron không liên kết :N H H
3.1.3. Độ dài liên kết (d)
Độ dài liên kết là khoảng cách giữa tâm của 2 nguyên tử liên kết trực tiếp với
nhau. Độ dài liên kết thường được tính ra A0.
Ví dụ, trong phân tử H2, dH-H = 0,74A0; trong phân tử H2O, liên kết O-H có dO-H
= 0,957 Ao; trong phân tử CO2, liên kết C=O có độ dài dC=O = 1,162 Ao. 4
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất. 3.1.4. Góc hóa trị
Góc hóa trị là góc tạo bởi 1 nguyên tử liên kết trực tiếp với 2 nguyên tử khác
trong phân tử.
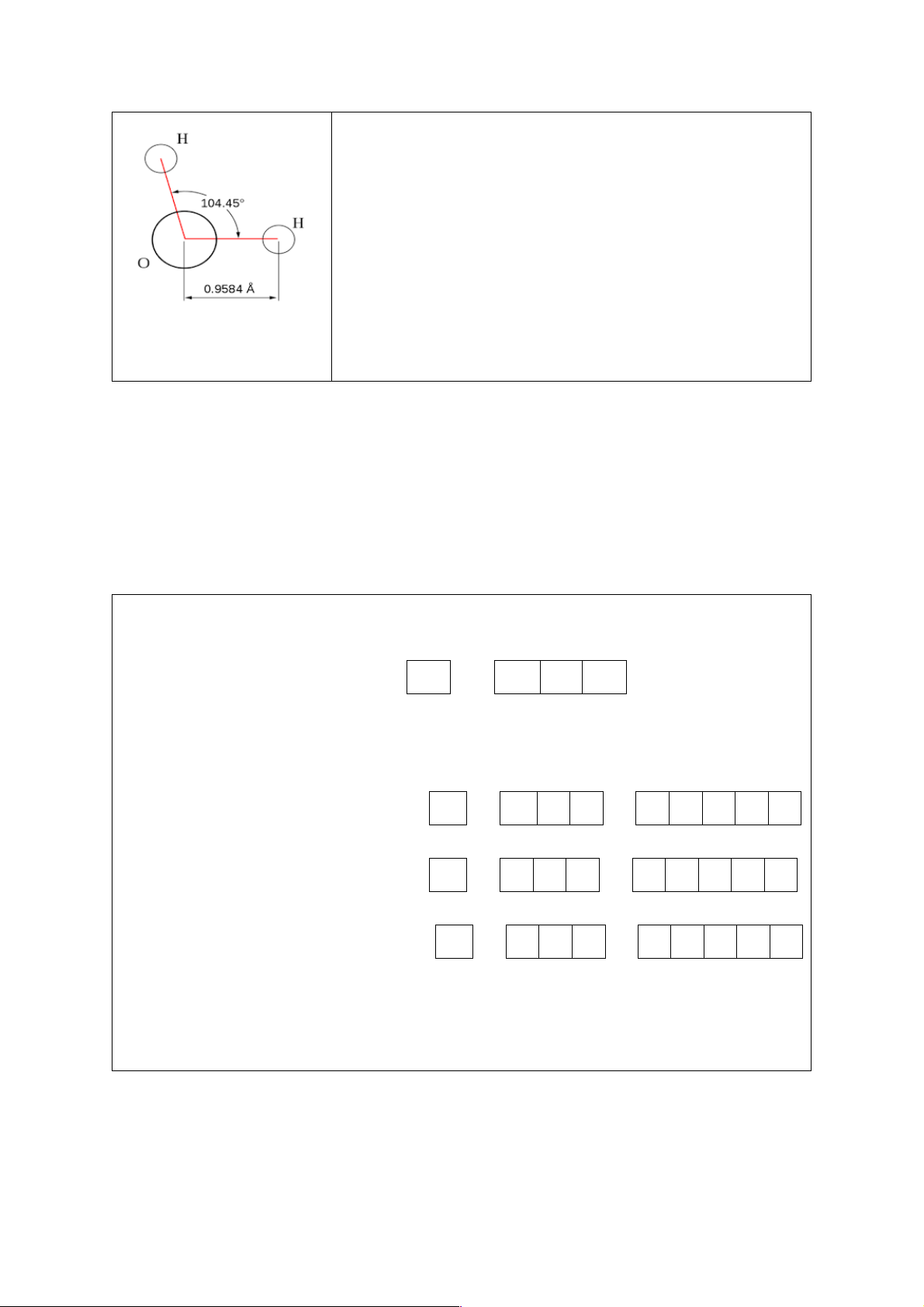
Ví dụ, trong phân tử H2O, 𝐻𝑂𝐻 $ = 104,50. H H O Góc liên kết 𝑂𝐶𝑂
$ = 180o trong phân tử CO2.
3.1.5. Độ bội liên kết
Độ bội liên lết là số liên kết được hình thành giữa 2 nguyên tử trong phân tử.
Ví dụ, N≡N trong phân tử N2 có độ bội liên kết là 3; C=O trong phân tử CO2 có
độ bội là 2; H-H trong phân tử H2 có độ bội là 1.
Liên kết có độ bội là 1 gọi là liên kết đơn. Liên kết có độ bội từ 2 trở lên gọi là liên kết bội.
Tuy nhiên, ngoài các độ bội liên kết là những số nguyên ta còn có thể gặp các số
không nguyên. Ví dụ độ bội của liên kết giữa C và O trong ion CO 2- 3 là 1'; độ bội *
của liên kết trong ion H +
2 là '… Ta sẽ đề cập đến vấn đề này ở các phần sau. +
3.2. Phân loại liên kết
Dựa vào bản chất của các liên kết, người ta phân chia thành một số loại liên kết sau đây:
3.2.1. Liên kết cộng hóa trị
Căn cứ vào hiệu độ âm điện (Dχ) giữa hai nguyên tố liên kết với nhau, người ta
phân chia thành liên kết cộng hóa trị và liên kết ion. Cụ thể như sau:
Hiệu độ âm điện (Dχ) Kiểu liên kết Dχ < 1,7 Liên kết cộng hóa trị Dχ ≥ 1,7 Liên kết ion
Hai nguyên tử tham gia liên kết có độ âm điện không khác nhau nhiều (Dχ < 1,7),
liên kết với nhau bằng những cặp electron chung, được gọi là liên kết cộng hóa trị.
Cặp electron chung giữa hai nguyên tử có thể được hình thành bằng 1 trong hai cách sau: 5
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
1) Sự góp chung các electron tự do với ms trái dấu của hai nguyên tử tham gia liên
kết (liên kết cộng hóa trị thuần túy).
2) Cặp electron chung chỉ do 1 nguyên tử có cặp electron hóa trị chưa tham gia liên
kết bỏ ra, còn nguyên tử kia có orbital nguyên tử trống (liên kết cộng hóa trị cho - nhận).
Liên kết giữa hai nguyên tố khác nhau (hợp chất) gọi là liên kết cộng hóa trị có
cực. Liên kết giữa hai nguyên tử giống nhau (đơn chất) gọi là liên kết cộng hóa trị không cực.
Để giải thích sự tạo thành liên kết cộng hóa trị, cho đến nay, trên thế giới đã có một số thuyết: • Mô hình Lewis.
• Thuyết liên kết hóa trị (Valence Bond – V.B).
• Thuyết orbital phân tử (Molecular Orbital - MO).
• Thuyết trường tinh thể.
• Thuyết trường phối tử.
Về phân loại liên kết cộng hóa trị, dựa vào kiểu xen phủ giữa các orbital hóa trị
tham gia liên kết, người ta phân thành các kiểu sau đây:
Hình 4.1. Các kiểu liên kết cộng hóa trị. 6
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Hình 4.2. Liên kết σ tạo thành do sự xen phủ của orbital lai hóa sp3 của C và orbital s của H.
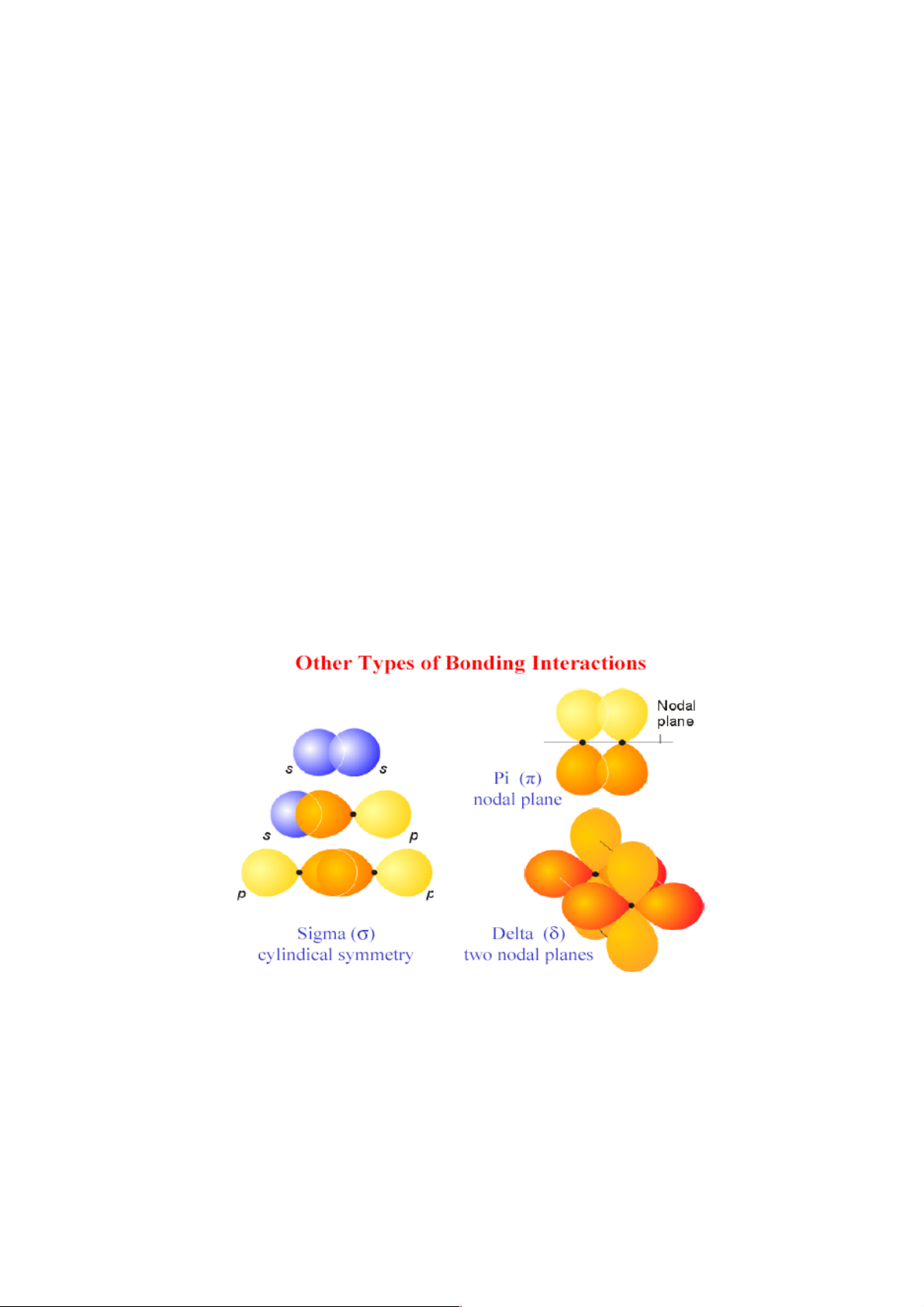
• Liên kết σ (xích ma): Là liên kết mà phần orbital xen phủ giữa hai nguyên tử
nằm trên trục nối hai hạt nhân. Liên kết σ có thể hình thành giữa các orbital
thuần túy với nhau như orbital s với orbital s (s-s); giữa orbital s với orbital p
(s-p); giữa orbital p với orbital p (p-p)… (hình 4.1). Đồng thời, liên kết σ có
thể hình thành giữa orbital lai hóa với orbital thuần túy, chẳng hạn như liên kết
giữa orbital sp3 của C và orbital s của H trong phân tử CH4 (hình 4.2).
• Liên kết π (pi): Là liên kết mà phần orbital xen phủ nằm đối xứng nhau về hai
bên của trục nối hai hạt nhân (hình 4.1).
• Liên kết δ (đen ta): Là liên kết mà phần orbital xen phủ tạo thành hai đôi nằm
đối xứng nhau qua trục nối hai hạt nhân (hình 4.1).
Liên kết σ bền. Liên kết π và liên kết δ kém bền, dễ bị phá vỡ trong các phản ứng hóa học. 3.2.2. Liên kết ion
Liên kết ion được tạo thành giữa hai nguyên tử có độ âm điện khác nhau nhiều,
thường là giữa các kim loại điển hình và phi kim điển hình. Hiệu độ âm điện giữa hai
nguyên tử Dχ ≥ 1,7. Để tạo thành liên kết, nguyên tử kim loại đã nhường electron hóa
trị để trở thành ion dương, nguyên tử phi kim nhận electron từ nguyên tử kim loại để
trở thành ion âm, ion âm và dương tương tác hút với nhau tạo thành liên kết ion.
Liên kết ion được hình thành do tương tác tĩnh điện giữa các ion mang điện trái dấu.
3.2.3. Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại
trong mạng tinh thể do sự tham gia của các electron tự do. 7
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
3.2.4. Các kiểu liên kết yếu
Ngoài các kiểu liên kết bền, có giá trị tuyệt đối của năng lượng lớn như đã kể ở
trên, còn có một số kiểu liên kết có giá trị tuyệt đối năng lượng nhỏ chỉ cỡ hàng chục
jun như liên kết hidro hoặc cỡ vài jun như liên kết (lực) Van de Walls.
Chúng ta sẽ lần lượt nghiên cứu, giải thích sự hình thành các kiểu liên kết hóa học
trong các chương tiếp theo. BÀI TẬP CHƯƠNG 3
1. Cho các hợp chất NaF, NaCl, NaBr và NaI. Hợp chất nào có tính cộng hóa trị
nhiều nhất và hợp chất nào có tính ion nhiều nhất?
2. Cho biết các năng lượng liên kết sau đây: EC-C = -83 kcal/mol; EC=C = -143
kcal/mol; EC-H = -100 kcal/mol. Hãy tính năng lượng liên kết của toàn phân tử
benzen ứng với công thức cổ điển của Kelule. So sánh với giá trị thực nghiệm
EA = - 1315 kcal/mol. Đáp số: E = 1278 kcal/mol.
3. Hãy cho biết các loại liên kết có trong các phân tử sau: Cl2, O2, N2, CO2, (H2O)x, (HF) +
2, NH3, NH4 , KF. Biết độ âm điện của H C O N F K 2,1 2,5 3,5 3,0 4,0 0,8
Chương 4. MÔ HÌNH LEWIS
Hình 4.1. Lewis, nhà vật lí người Mĩ (1875 - 1946).
Năm 1916, Lewis – nhà vật lí người Mĩ đã đưa ra những giải thích đầu tiên về liên
kết hóa học trong các hợp chất có liên kết cộng hóa trị. Lí thuyết của Lewis ra đời
trước khi cơ học lượng tử đưa ra những lí thuyết về vấn đề này. Ông đã hình dung ra
rằng các liên kết cộng hóa trị là sự dùng chung một hay nhiều cặp electron hóa trị giữa 8
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
hai nguyên tử tham gia liên kết. Vào thời điểm đó, ông không thể giải thích vì sao lại
tồn tại những đôi electron như vậy mà không phải là 3 electron hay con số khác. Sau
này, nguyên lí Pauli ra đời mới giải thích được sự tồn tại của những cặp elctron như
vậy. Tuy nhiên, bằng trực giác, Lewis đã nhận thấy vai trò của đôi electron là hút các
hạt nhân về phía mình và do đó làm các hạt nhân lại gần nhau và tạo thành liên kết.
4.1. Sơ đồ cộng hóa trị
4.1.1. Sơ đồ thuần túy cộng hóa trị
Mỗi liên kết cộng hóa trị được tạo thành do sự ghép chung 1 electron tự do của 2
nguyên tử tham gia liên kết.
Ví dụ, sự tạo thành liên kết trong phân tử H2 như sau:
H• + • H → H••H hoặc H – H
Sự tạo thành phân tử HCl như sau:
H• + •Cl → H••Cl hoặc H – Cl
Chú ý: Mỗi cặp electron hóa trị được kí hiệu bằng một gạch (-), không phân biệt là
cặp electron chung hay riêng. Trên sơ đồ Lewis của phân tử hoặc ion, tất cả các cặp
electron hóa trị đều được thể hiện.
H – H và H – Cl lần lượt là sơ đồ Lewis của phân tử H2 và HCl.
Ví dụ tự giải: Vẽ sơ đồ Lewis cho các phân tử sau: Cl2, HF, H2O.
4.1.2. Sơ đồ cộng hóa trị cho - nhận
Để tạo được liên kết cộng hóa trị cho - nhận, một nguyên tử tham gia liên kết phải
có cặp electron hóa trị chưa tham gia liên kết (nguyên tử cho), nguyên tử còn lại phải
có orbital hóa trị trống (nguyên tử nhận). Cặp electron chung chỉ do nguyên tử cho cung
cấp. Khi liên kết giữa hai nguyên tử được hình thành, người ta không thể tìm lại được
nguồn gốc của các electron trong cặp electron chung. Do đó, liên kết cộng hóa trị cho –
nhận có thể được kí hiệu bằng một mũi tên từ chất cho sang chất nhận (→) hoặc một
gạch (-) như liên kết cộng hóa trị thuần túy.
Ví dụ, sự hình thành liên kết trong ion NH + 4 như sau: H H
NH3 + H+ → H - N → H+ hoặc H – N – H+ (1) H H
Sự hình thành liên kết trong phân tử SO2 như sau: 𝑆̅ = 𝑂| (2) 𝑂| 9
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
(1) và (2) lần lượt là sơ đồ Lewis của ion NH + 4 và phân tử SO2.
Chú ý: Orbital trống trong nguyên tử nhận có thể là tự có (như H+) hoặc có thể tạo
ra nhờ sự sắp xếp lại electron trong nguyên tử ở trạng thái kích thích.
Ví dụ tự giải: Vẽ sơ đồ Lewis của ion H - 3O+, BF4 .
Mỗi nguyên tử có thể tạo ra một số lượng liên kết cộng hóa trị nhất định phụ thuộc
vào cấu trúc electron của nó. Số liên kết cộng hóa trị của mỗi nguyên tử phụ thuộc số
electron tự do, số cặp electron chưa tham gia liên kết và số orbital trống của nguyên tử đó.
Để xác định số liên kết của mỗi nguyên tử trong phân tử và vẽ sơ đồ Lewis của
phân tử, ta dựa vào quy tắc bát tử.
4.2. Quy tắc bát tử
Các nguyên tố nhóm VIIIA có cấu trúc electron bền vững, trừ He (có 2 electron),
nguyên tử các nguyên tố khác đều có 8 electron lớp ngoài cùng. Nguyên tử của tất cả
các nguyên tố thuộc các nhóm khác đều có số electron lớp ngoài cùng nhỏ hơn 8, do đó
chúng không bền. Các nguyên tử này phải nhường, nhận hoặc góp chung electron hóa
trị với nguyên tử khác để đạt được cấu trúc có 8 electron lớp ngoài cùng giống như khí
hiếm trong các hợp chất. Quy tắc mà các nguyên tử có xu hướng đạt tới trạng thái có 8
electron ngoài cùng giống khí hiếm trong các hợp chất gọi là quy tắc bát tử.
Trong phân tử (ion), các nguyên tử phải trao đổi hoặc góp chung những
electron để đạt cấu trúc electron của khí hiếm.
Ví dụ: Phân tử Cl2, nguyên tử Cl có 7 electron lớp ngoài cùng, sau khi 2 nguyên tử
Cl liên kết với nhau thì mỗi nguyên tử đều có 8 electron lớp ngoài cùng. Tương tự các
nguyên tử S và O trong phân tử SO2, C và O trong phân tử CO2…đều có 8 electron lớp ngoài cùng (hình 4.2).
Hình 4.2. Công thức electron của các phân tử Cl2, SO2, CO2, LiH, BeH2, BH3 SF6 và ClF5.
Tuy nhiên, quy tắc này không tổng quát, có một số trường hợp ngoại lệ.
H có cấu trúc 1s1 nên có khuynh hướng đạt cấu trúc 1s2 của He nên không có “bát tử.
Một số phân tử như LiH, BeH2, BH3.... Các nguyên tử Li, Be, B không có đủ 8
electron lớp ngoài cùng (hình 4.2).
Một số trường hợp lớp ngoài cùng có hơn 8 electron. Ví dụ SF6, ClF5, … (hình 4.2). 10
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
4.3. Electron không định chỗ
Trong thực tế, có những phân tử có thể được biểu diễn bằng hai hay nhiều công
thức Lewis khác nhau, trong đó có những công thức không tồn tại trong thực tế.
Ví dụ, liên kết trong phân tử N2O có thể được biểu bằng như sau: N≡N-O Û N=N=O Û N= ⃛ N− ⃛O A B C
Các cấu trúc A, B và C là tương đương, có 1 cặp electron không định chỗ giải
tỏa đều cho cả liên kết N=N và N-O. A, B là các cấu trúc giới hạn, hay các công thức
cộng hưởng (các công thức mezome) giữa chúng có quan hệ cộng hưởng. Dạng giới
hạn không tồn tại trong thực tế. C là công thức lai hóa cộng hưởng.
Công thức cộng hưởng là tập hợp các công thức Lewis mô tả một chất hóa học,
chỉ khác nhau ở sự phân bố các electron xung quanh các hạt nhân, các công thức này
còn gọi là những công thức giới hạn hay công thức mesome.
Lai hóa cộng hưởng là công thức thực của một ion hay phân tử là công thức trung
gian giữa mọi công thức cộng hưởng.
Bài tập ví dụ: Viết các công thức cộng hưởng và công thức lai hóa cộng hưởng của CO 2-
3 và xác định bậc cho các liên kết. Giải: CO 2-
3 có thể viết công thức Lewis như sau: :Ö: 2- C :O: :Ö:
Trong thực tế, ba nguyên tử O trong CO 2-
3 là như nhau, do vậy, cặp electron π sẽ
giải tỏa đều trên cả ba liên kết C-O. Công thức cộng hưởng (A, B, C) và công thức lai
hóa cộng hưởng (D) của CO 2- 3 như sau:
:Ö: 2- :Ö: 2- :Ö: 2- :Ö: 2- C C C C ↔ :O: :Ö: ↔ :O: :Ö: ↔ :O: :Ö: ↔ :O: :Ö: (A) (B) (C) (D)
“……” là kí hiệu liên kết π không định chỗ. Bậc liên kết giữa C và O là 1'. *
Bài tập ví dụ tự giải: Viết các công thức cộng hưởng và công thức lai hóa cộng hưởng của CO 2- -
3 , NO2 và xác định bậc cho các liên kết. 11
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
4.4. Điện tích hình thức (F)
Khi viết công thức Lewis, có thể gặp trường hợp cùng một công thức phân tử tồn tại
nhiều công thức Lewis thì có thể dựa vào điện tích hình thức để ước định được công
thức nào hợp lý hơn và công thức nào hợp lí nhất.
Cách xác định điện tích hình thức:
F = Số electron hóa trị trong nguyên tử tự do – Số electron chưa liên kết – Số liên kết :Ö: (-1) 2-
O (có liên kết đơn) 6 – 6 – 1 = -1 C(0)
O (có liên kết đôi) 6 – 4 – 2 = 0 (0):O: :Ö:(-1) C 4 – 0 – 4 = 0
Tìm công thức hợp lí nhất theo nguyên tắc sau:
• Những cấu trúc có tổng giá trị tuyệt đối điện tích hình thức nhỏ và sự phân chia điện tích nhỏ.
• Nguyên tố có độ âm điện lớn hơn mang điện tích hình thức âm hơn và ngược lại.
Như vậy, căn cứ vào F người ta sẽ thuận tiện hơn khi chọn cấu trúc (trong các cấu
trúc cộng hưởng) và xác định chính xác hơn bậc liên kết giữa các nguyên tử trong phân tử hoặc ion.
Bài tập ví dụ: Viết các công thức Lewis của ion SCN- và cho biết công thức nào hợp lí nhất.
Giải: Ion SCN- có thể có ba công thức Lewis như sau: Công thức cộng Điện tích hình Tổng giá trị tuyệt Nhận xét hưởng thức trên mỗi đối điện tích nguyên tử
:𝑆̈(0)=C(0)=𝑁̈:(-1) FS = 6-4-2 = 0 0+0+1 = 1 Công thức có sự phân
chia điện tích nhỏ 0; -1. (A) FC = 4-0-4 = 0
N có độ âm điện cao nhất FN = 5-4-2 = -1 có điện tích âm nhất.
:𝑆̈:(-1)-C(0)≡N:(0) FS = 6-6-1 = -1 1+0+0 = 1 Công thức có sự phân
chia điện tích nhỏ 0; -1. (B) FC = 4-0-4 = 0
S không có độ âm điện FN = 5-2-3 = 0 cao nhất nhưng có điện tích âm nhất. 12
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
:S(+1)≡C(0)-:𝑁̈:(-2) FS = 6-2-3 = +1 1+0+2 = 3 Công thức có sự phân
chia điện tích lớn 0; +1; (C) FC = 4-0-4 = 0
+2. N có độ âm điện cao FN = 5-6-1 = -2 nhất có điện tích âm nhất.
Như vậy, trong các công thức trên, công thức A là hợp lý nhất vì có tổng giá trị tuyệt
đối điện tích nhỏ nhất (1), sự phân chia điện tích nhỏ nhất (0; -1) và N có độ âm điện
lớn nhất mang điện tích âm nhất trong công thức.
Bài tập ví dụ tự giải:
Viết các công thức Lewis của ion OCN- và cho biết công thức nào hợp lí nhất.
Cần nhớ rằng F chỉ là một công cụ cho việc ước định cấu trúc Lewis, không phải
điện tích thực trên nguyên tử.
4.5. Khả năng phản ứng của các hợp chất
Công thức Lewis của các phân tử hay ion và các điện tích hình thức của các nguyên
tử cũng cho phép xác định khả năng phản ứng của chúng. Nói chung, các phân tử hay
ion có cấu trúc Lewis không theo quy tắc bát tử như số electron lớp ngoài cùng của
nguyên tử nhỏ hơn 8 thường có khả năng phản ứng cao. Cụ thể như các trường hợp sau:
Phân tử NO có công thức Lewis là |Ṅ=O|, nguyên tử N trong phân tử có 7 electron
lớp ngoài cùng (chưa đạt được 8) nên phân tử này có khả năng phản ứng cao. Cụ thể
các phân tử NO tự phản ứng để tạo phân tử N2O2 (hiện tượng dime). |𝑂/=𝑁
0. + .𝑁0=𝑂/| → |𝑂/=𝑁0-𝑁0=𝑂/|
Các gốc như H3C• hay Cl• đều không có đủ 8 electron lớp ngoài cùng trong các
nguyên tử, do đó không bền theo Lewis. Các gốc này rất dễ tham gia phản ứng, chẳng
hạn các phản ứng dây chuyền trong hóa hữu cơ.
Các axit và bazơ Lewis. Ở cập học phổ thông ta đã biết đến khái niệm axit, bazơ
theo Arrhenius, theo Bronsted và Lowry. Ta còn có khái niệm axit và bazơ Lewis. Theo
Lewis, axit là những phần tử có một nguyên tử thiếu ít nhất một cặp electron để thỏa
mãn quy tắc bát tử. Như vậy axit là những phần tử có khả năng nhận cặp electron, bazơ
là những phần tử có khả năng cho đôi electron. Ví dụ, trong phân tử BF3, ở trạng thái
kích thích B có 3 electron tự do sẽ liên kết với 3 nguyên tử F và 1 orbital trống. Như
vậy, B thiếu 1 cặp electron để thỏa mãn quy tắc bát tử, do đó BF3 là một axit Lewis.
Phân tử NH3, nguyên tử N có 3 electron tự do liên kết với 3 nguyên tử H và 1 cặp
electron chưa liên kết. Khi phản ứng với BF3, NH3 đã bỏ ra đôi electron của N để thành
cặp electron chung với B (hình 4.3). Như vậy, NH3 là bazơ Lewis. H |𝐹/| 13
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất. | | H - N: B - 𝐹/| | | H |𝐹|
Hình 4.3. Công thức của axit Lewis BF .
3, bazơ NH3 và sự tạo thành phân tử NH3.BF3
4.6. Hạn chế của mô hình Lewis về liên kết cộng hóa trị
• Với các chất có liên kết bội, có khi phải dùng nhiều cấu trúc giới hạn không có
thực để mô tả một cách nặng nề các phân tử.
• Không giải thích và tiên đoán được cấu trúc hình học của phân tử, sự khác nhau về lk ϭ và lk π.
• Qui tắc bắt tử được đưa ra trong thời kì mà mô hình Bohr là duy nhất để mô tả
các mức năng lượng của nguyên tử. Do đó Lewis đã không biết được sự khác
nhau về năng lượng giữa các electron ở các phân lớp khác nhau trong cùng một
lớp. Theo đó, đã dễ dàng giải thích được sự giống hệt nhau của 4 liên kết C-H
trong CH4. Thực tế thì 4 electron hóa trị của C có năng lượng khác nhau. Để tạo
được 4 liên kết C-H giống nhau, C phải ở trạng thái kích thích và lai hóa.
• Không giải thích được trong ion H +
2 liên kết chỉ đảm bảo bởi 1 electron (theo
thuyết này liên kết được tạo thành bằng những cặp electron chung).
• Không giải thích được từ tính của phân tử (ion), vì các tính chất thuận từ đòi hỏi
có ít nhất 1 electron tự do trong khi các phân tử (ion) được tạo thành theo Lewis
chỉ có các cặp electron.
• Không giải thích được độ bền liên kết của các phân tử (ion). BÀI TẬP CHƯƠNG 4
1. Viết các công thức Lewis có thể có của các phân tử và ion sau: PO 3- 2- - 4 , SO4 , NO2 , NO + 2 , CH3O-, HClO, H3PO3.
2. Viết công thức cộng hưởng của NO2 để chứng minh nó cũng có hiện tượng dime hóa
2NO2 Û N2O4. Biết trong N2O4 tồn tại liên kết N – N.
3. Biểu diễn các công thức cộng hưởng và lai hóa cộng hưởng cho mỗi chất sau: O3; SO - 2; NO2 .
4. Viết các công thức Lewis và tính điện tích hình thức ở mỗi nguyên tử trong các dẫn
xuất oxi sau đây của S. Từ đó suy ra công thức Lewis hợp lí nhất: SO 2- 3; SO3 ; H2SO4; N2O.
5. Các phân tử dưới đây đều là những phân tử trung hòa. Hỏi phân tử nào trong các
phân tử đó không chứa điện tích hình thức dương và âm.
A. (CH3)3N-B(CH3)3; B. (CH3)2N-O-CH3;
C. CH2 = N = N; D. (CH3)3N-O; E. F3B-O(CH3)2 Đáp án: B 14
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Chương 5. THUYẾT LIÊN KẾT HÓA TRỊ
(THUYẾT V.B – THEORIE OF VALENCE BOND)
Thuyết liên kết hóa trị viết tắt là thuyết V.B hay còn gọi là thuyết (phương pháp)
cặp electron liên kết. Đây là lí thuyết giải thích các liên kết cộng hóa trị được tạo nên
bằng những cặp electron chung. Lí thuyết này ra đời khi đã có lí thuyết cơ học lượng tử
và sử dụng cơ học lượng tử để nghiên cứu nên rất chính xác. Nó đã giải quyết được
nhiều vấn đề mà mô hình Lewis chưa giải thích được.
5.1. Phương pháp Heiter – London và phân tử H2
Khi áp dụng cơ học lượng tử để giải quyết vấn đề bản chất liên kết hóa học, năm
1927 hai nhà bác học W.Heiter và F.London đã giải bài toán tính năng lượng liên kết
và độ dài liên kết trong phân tử H2. Kết quả thu được còn sai số nhiều so với thực tế.
Đến năm 1960 C.R.Roothaan đã cải tiến hàm sóng và có kể đến tương quan electron,
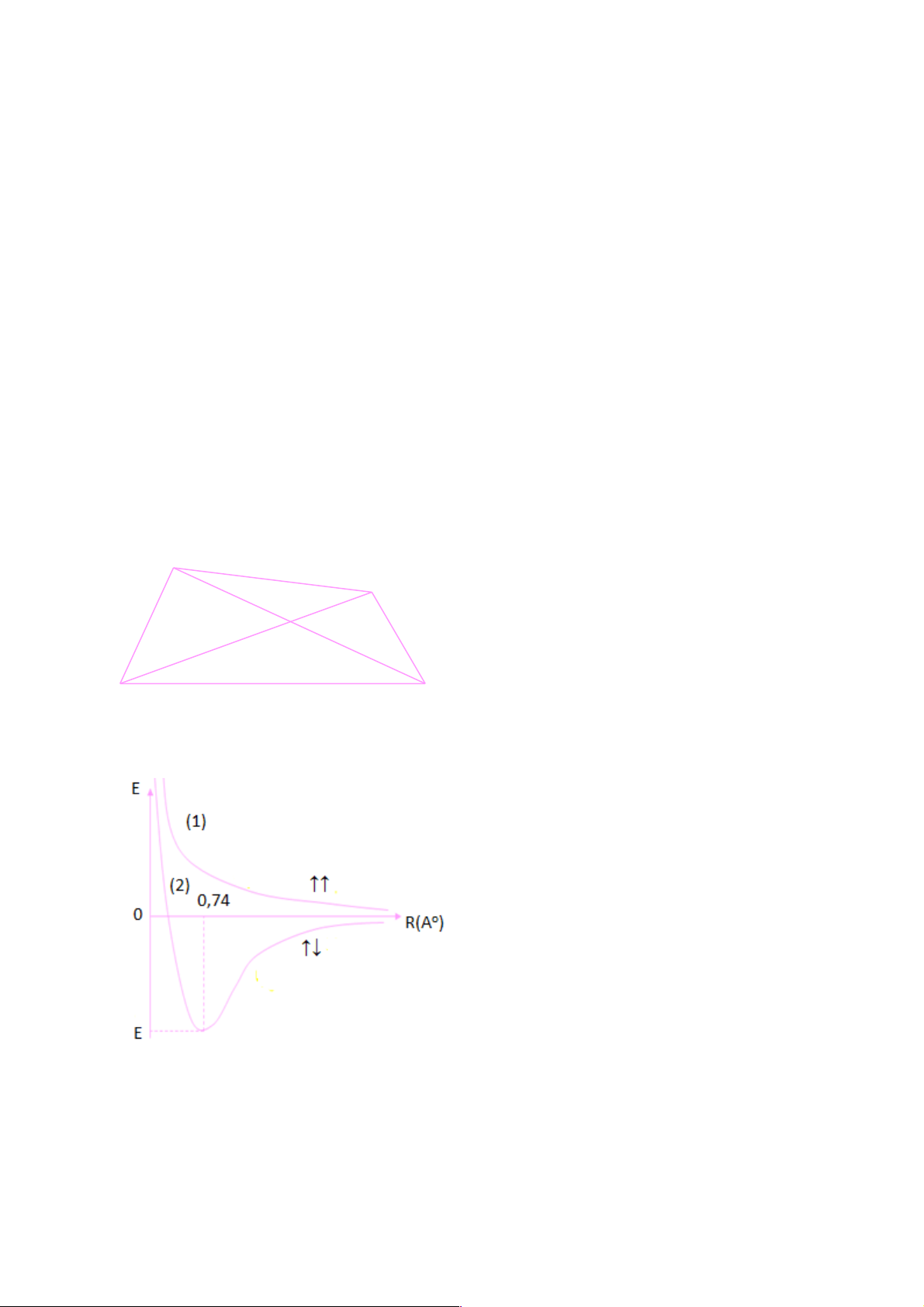
kết quả thu được đã sát với thực nghiệm. e1 e2
Coi hai hạt nhân a và b đứng yên, hai
electron e1 và e2 chuyển động quanh
hai hạt nhân. Đây là bài toán hai hạt.
Bằng phương pháp giải gần đúng, thu
được các kết quả như sau: a b
Hình 5.1. Tương tác trong phân tử H2.
Trên hình 5.2, đường (1) cho thấy, khi hai
nguyên tử H có ms cùng dấu tương tác với
nhau, năng lượng tương tác giữa hai
nguyên tử rất lớn nên không bền, do đó
không tạo được liên kết. Đường (2) cho
thấy, khi hai nguyên tử H có ms trái dấu
tương tác với nhau, năng lượng tương tác
giảm dần và đạt cực tiểu tại năng lượng E,
đây chính là năng lượng liên kết của phân
tử H2. Đồng thời, tại điểm cực tiểu, giá trị
khoảng cách giữa hai hạt nhân là 0,74 Ao,
đây chính là độ dài liên kết trong phân tử H2. 15
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Hình 5.2. Sự phụ thuộc của năng lượng tương tác giữa hai nguyên tử H vào khoảng
cách R giữa hai hạt nhân.
Từ các kết quả trên, kết luận được đưa ra cho bài toán phân tử H2 như sau:
• Liên kết giữa 2 nguyên tử H được hình thành khi 2 electron của 2 nguyên tử H
tham gia liên kết có giá trị ms trái dấu, tức là: ms =-1/2 và ms=+ ½. Khi đó năng
lượng của phân tử H2 thấp hơn tổng năng lượng của 2 ng tử H cô lập.
• Có sự xen phủ của 2 mây electron hóa trị vì khoảng cách giữa hai hạt nhân H
nhỏ hơn 2 lần bán kính (bán kính nguyên tử H là 0,529 Ao).
2rH = 2.0,529A0 < R = 0,740A0.
Trên cơ sở bài toán phân tử H2, nghiên cứu mở rộng cho các phân tử khác người ta
đã xây dựng được những tiên đề cơ bản của thuyết V.B.
5.2. Những tiên đề cơ bản của thuyết liên kết hóa trị
1. Liên kết cộng hóa trị được hình thành bằng 1 cặp electron chung giữa 2 nguyên tử
tham gia liên kết. Cặp electron chung này có thể do:
• Sự ghép đôi của 2 electron tự do có ms trái dấu của 2 nguyên tử tham gia liên kết
(cộng hóa trị thuần túy).
• Một nguyên tử cung cấp cặp electron hóa trị còn nguyên tử kia có orbital nguyên
tử trống (cộng hóa trị cho-nhận).
2. Khi tạo liên kết, xảy ra sự xen phủ giữa các orbital nguyên tử hóa trị của hai nguyên
tử tham gia liên kết. Mức độ xen phủ càng lớn liên kết càng bền.
3. Liên kết cộng hóa trị là liên kết có hướng. Hướng liên kết là hướng có sự xen phủ lớn
nhất. Liên kết sẽ được phân bố theo phương nào mà mức độ xen phủ các orbital
liên kết là lớn nhất. Dưới đây là một số cách xen phủ giữa các orbital nguyên tử. 16
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
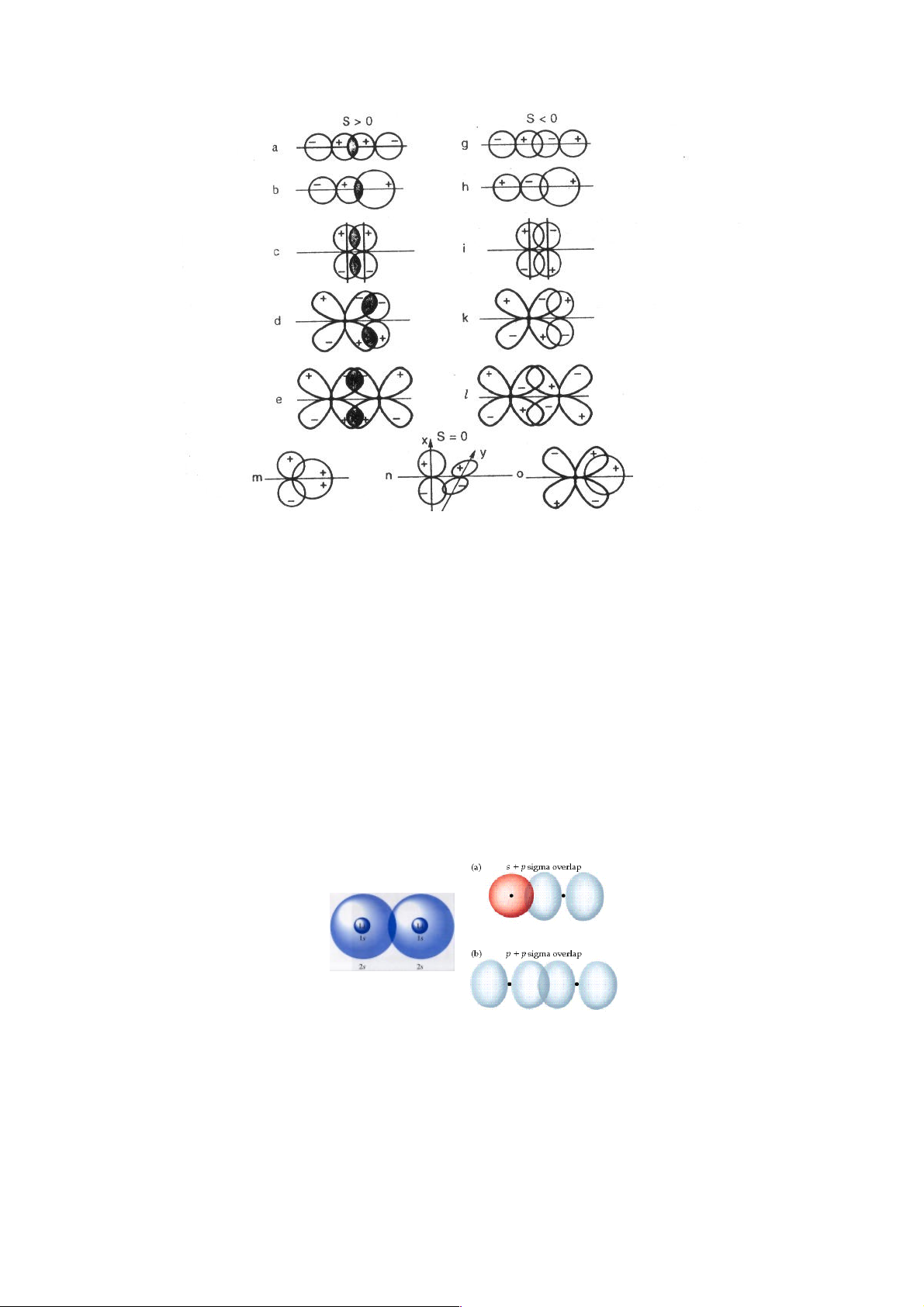
Hình 5.3. Các cách xen phủ khác nhau giữa các orbital.
Xen phủ dương (a-e); xen phủ âm (g-l); xen phủ không (m-o)
Xen phủ dương – tạo được liên kết. Là xen phủ giữa các phần cùng dấu của các
orbital. Hình 5.3, a-e là các ví dụ cho xen phủ dương. Các xen phủ này tạo nên các liên kết σ và liên kết π.
Liên kết s: Là liên kết mà phần orbital xen phủ giữa hai nguyên tử nằm trên trục
nối hai hạt nhân (hình 5.3 a-c; hình 5.4). Liên kết σ có thể hình thành giữa các orbital
thuần túy với nhau như orbital s với orbital s (s-s); giữa orbital s với orbital p (s-p);
giữa orbital p với orbital p (p-p);… . Đồng thời, liên kết σ có thể hình thành giữa orbital
lai hóa với orbital thuần túy, chẳng hạn như liên kết giữa orbital sp3 của C và orbital s của H trong phân tử CH4.
Hình 5.4. Sự tạo thành liên kết σ.
Liên kết p: Là liên kết mà phần orbital xen phủ nằm đối xứng nhau về hai bên của
trục nối hai hạt nhân (hình 5.3 d, e; hình 5.5). 17
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Hình 5.5. Sự tạo thành liên kết π.
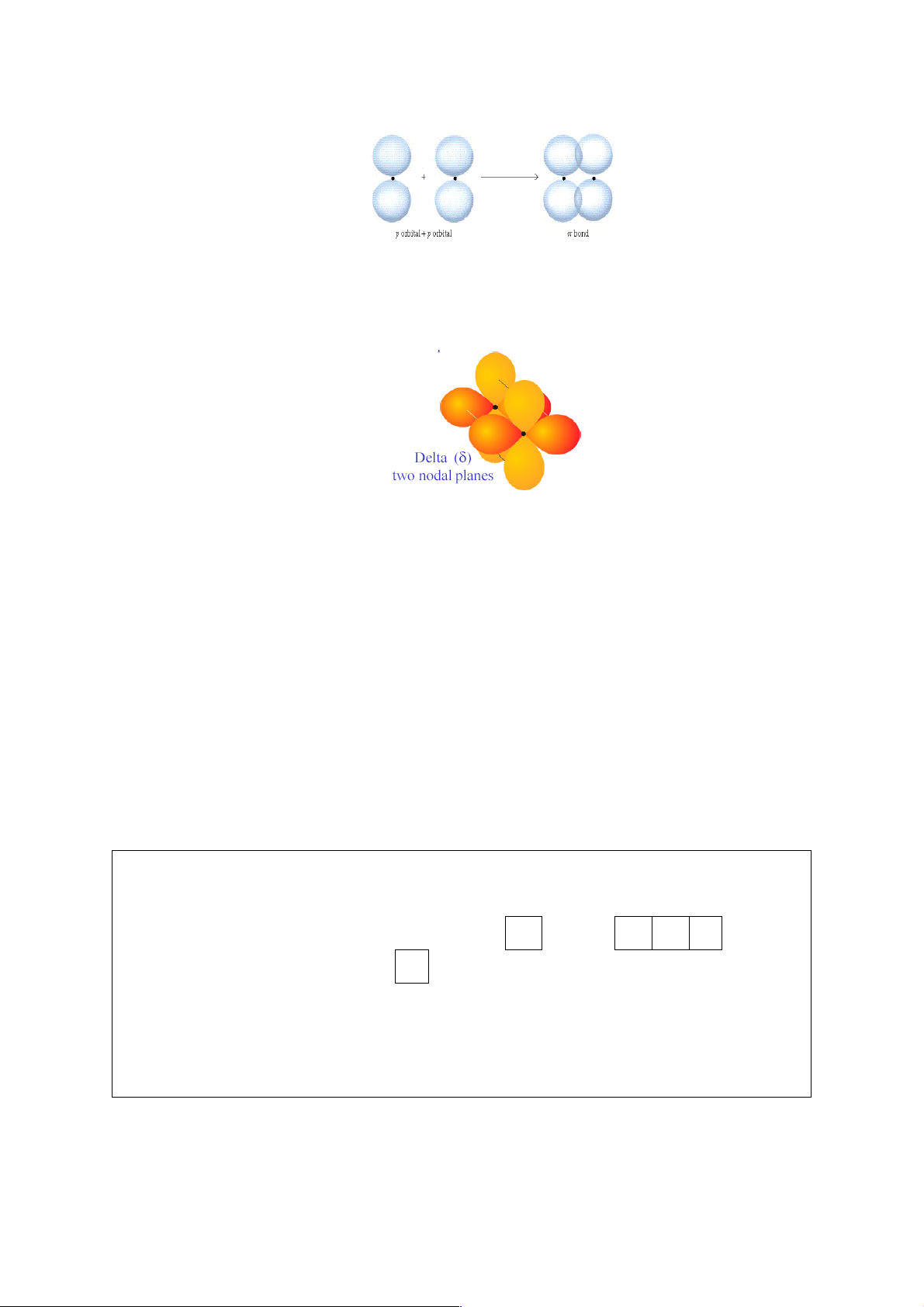
Liên kết δ: Là liên kết mà phần orbital xen phủ tạo thành hai đôi nằm đối xứng
nhau qua trục nối hai hạt nhân (hình 5.6).
Hình 5.6. Sự tạo thành liên kết 𝛿.
Xen phủ âm – không tạo liên kết. Là xen phủ giữa các phần khác dấu của các orbital.(hình 5.3, g - l).
Xen phủ bằng không – không tạo liên kết (hình 5.3, m-o)
4. Liên kết cộng hóa trị có tính bão hòa, nghĩa là số liên kết của mỗi nguyên tố là có
hạn. Ví dụ, 1 nguyên tử C chỉ liên kết được với tối đa 4 nguyên tử H tạo thành CH4
(không tạo được CH5) vì chỉ có 4 electron thuộc 4 orbital hóa trị; 1 nguyên tử N có 3
electron tự do và 1 cặp electron hóa trị nên chỉ có thể tạo được tối đa 4 liên kết cộng
hóa trị trong đó 3 liên kết cộng hóa trị thuần túy và 1 liên kết cho-nhận.
Như vậy, thuyết VB có thể giúp ta giải thích và tiên đoán được cấu trúc hình học
của một số phân tử hay ion.
Ví dụ: Giải thích các liên kết và cho biết cấu trúc hình học của phân tử H2O. Giải: O (Z = 8): 1s22s22p4 ↑↓ ↑↓ ↑ ↑ H (Z =1): 1s1 ↑ 2s 2p 1s
Nguyên tử O có 2 electron tự do sẽ góp chung với 2 electron tự do của 2 nguyên tử
H tao thành 2 cặp electron chung tạo ra 2 liên kết cộng hóa trị. Công thức cấu tạo là
H-𝑂̈-H. Sự xen phủ các orbital tạo thành liên kết như sau: 18
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Ba orbital p nằm trên ba trục tọa độ x, y, z. Giả sử cặp
electron đã ghép đôi nằm trên trục y, 2 electron tự do nằm
trên trục x và z. Hai orbital của 2 nguyên tử H xen phủ với
các orbital của O trên trục x và z. Trục x và z vuông góc
với nhau nên đáng lẽ góc 𝐻𝑂𝐻
$ tạo thành có góc 90o. Tuy
nhiên, liên kết cộng hóa trị O-H phân cực mạnh về phía O
nên H mang một phần điện tích dương, vì vậy hai nguyên
tử H cùng mang điện tích dương nên đẩy nhau, làm cho góc 𝐻𝑂𝐻
$ tăng lên (thực nghiệm xác nhận được là 104,5o).
Hình 5.7. Cấu trúc góc Như vậy, phân tử H2O có hình dáng (cấu trúc hình học) là của phân tử H2O.
hình chữ V hay còn gọi là dạng góc hoặc hình gấp khúc.
Ví dụ tự giải: Giải thích các liên kết và cho biết cấu trúc hình học của phân tử H3N.
5.3. Hóa trị của nguyên tố trong liên kết cộng hóa trị theo thuyết V.B. Quy tắc hóa trị spin
Hóa trị hay số liên kết của một nguyên tố bằng số electron tự do trong nguyên
tử nguyên tố đó ở trạng thái cơ bản hoặc kích thích.
Hóa trị = số electron độc thân.
Ví dụ: Xác định các hóa trị có thể có của N và S.
Giải: N (Z = 7), 1s22s22p3 có 3 electron tự do ở trạng thái cơ bản: ↑↓ ↑ ↑ ↑
Như vậy N có hóa trị 3. 2s 2p S (Z = 16), 1s22s22p63s23p4. Ở trạng thái cơ bản S ↑↓ ↑↓ ↑ ↑ 3s 3p 3d
Ở trạng thái kích thích thứ nhất S* ↑↓ ↑ ↑ ↑ ↑ 3s 3p 3d
Ở trạng thái kích thích thứ hai S** ↑ ↑ ↑ ↑ ↑ ↑ 3s 3p 3d
S ở trạng thái cơ bản có 2 electron tự do nên có hóa trị 2; trạng thái kích thích thứ
nhất có 4 electron tự do nên có hóa trị 4; trạng thái kích thích thứ 2 có 6 electron tự
do nên có hóa trị 6. Vậy S có ba trạng thái hóa trị là 2; 4 và 6.
Ví dụ tự giải: Xác định các hóa trị có thể có của O và P.
Như vậy, với những nguyên tố có nhiều trạng thái hóa trị, hóa trị của nguyên tố được
xác định theo từng hợp chất. 19
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Cần phân biệt hóa trị theo V.B và cộng hóa trị của nguyên tố. Chẳng hạn, với N, ở
trên ta vừa xác định được hóa trị duy nhất theo V.B là 3. Tuy nhiên, ngoài cộng hóa trị 3 như trong NH +
3, N còn có thể có cộng hóa trị là 4 trong NH4 .
Chú ý: Khi xác định hóa trị theo số electron tự do ở trạng thái kích thích, sự kích
thích electron chỉ xảy ra được giữa các phân lớp trong cùng một lớp. Điều này được
giải thích như sau: Các electron trong các phân lớp của cùng một lớp có năng lượng
không quá xa nhau, vì vậy chỉ cần cung cấp năng lượng nhỏ để kích thích electron
chuyển từ phân lớp nọ sang phân lớp kia. Lượng năng lượng này sẽ được bù lại sau khi
nguyên tử ở trạng thái kích thích này tạo liên kết (sau khi tạo liên kết sẽ giải phóng năng
lượng). Việc kích thích electron chuyển từ lớp nọ sang lớp kia cần năng lượng rất lớn,
lượng năng lượng này không thể được bù lại sau khi nguyên tử bị kích thích tạo liên kết
nên không thực hiện được.
Đối với những nguyên tố nhóm B, các mức năng lượng của ns np và nd khá gần
nhau nên sự kích thích để chuyển electron giữa các phân lớp này là tương đối dễ. Vì
vậy, trạng thái hóa trị của các nguyên tố này là rất phong phú. 5.4. Thuyết lai hóa
Ở mục 5.2 ta đã giải thích liên kết và xác định được cấu trúc hình học của một số
phân tử. Cụ thể, phân tử H2O có cấu trúc gấp khúc, phân tử NH3 có cấu trúc hình tháp
tam giác. Tương tự như vậy, ta hãy thử giải thích các liên kết và xác định cấu trúc hình học của phân tử CH4. C (Z = 6): 1s22s22p2 ↑↓ ↑ ↑ H (Z =1): 1s1 ↑ 2s 2p 1s
Ở trạng thái cơ bản, C có 2 electron tự do nên không thể liên kết được với 4
nguyên tử H. Do đó, C sẽ phải ở trạng thái kích thích để có 4 electron tự do: C (Z = 6): 1s22s12p3 ↑ ↑ ↑ ↑ 2s 2p 4H ↑ ↑ ↑ ↑ 1s 1s 1s 1s
Nguyên tử C có 4 electron tự do sẽ góp chung với 4 electron tự do của 4 nguyên
tử H tao thành 4 cặp electron chung tạo ra 4 liên kết cộng hóa trị. Trong 4 liên kết C –
H, có 1 liên kết 2s-1s và 3 liên kết 2p-1s. Như vậy, trong 4 liên kết C – H có 1 liên kết
sẽ khác với 3 liên kết còn lại. Tuy nhiên, thực nghiệm xác nhận rằng, 4 liên kết C – H
trong phân tử CH4 giống hệt nhau và cấu trúc hình học phân tử này là hình tứ diện đều.
Để giải quyết mâu thuẫn này, thuyết lai hóa ra đời. Theo đó, các orbital 2s và 2p của C 20
TS. Nguyễn Thị Thúy Nga




