








Preview text:
Quá trình &)Thiết bị
Công nghệ Hoá học III
QUÁ)TRÌNH)&)THIẾT)BỊ)CHUYỂN)KHỐI
Chương 3: Quá trình Chưng Cất
Giảng viên:)Nguyễn Minh)Tân
Bộ môn QT7TB)CN)Hóa học &)Thực phẩm
Trường Đại học Bách khoa Hà Nội
nguyen.minhtan@gmail.com
Chương 3: Các Quá trình Chưng Cất
1. Các khái niệm chung
Chưng/Distillation là phương pháp tách hỗn hợp chất lỏng thành các
cấu tử riêng biệt, dựa trên độ bay hơi khác nhau của các cấu tử trong hỗn hợp.
Chương 3: Các Quá trình Chưng Cất
1. Các khái niệm chung
• Được ứng dụng rộng rãi để tách các hỗn hợp: • Dầu mỏ
• Không khí hoá lỏng (-190oC) để tách O2 và N2.
• Quá trình tổng hợp hữu cơ
• Tách các chế phẩm sinh học
• Chưng hỗn hợp hai cấu tử
• Sản phẩm đỉnh gồm cấu tử dễ bay hơi và một phần cấu tử khó bay hơi (P)
• Sản phẩm đáy gồm cấu tử khó bay hơi và một phần cấu tử dễ bay hơi (W)
Chương 3: Các Quá trình Chưng Cất
1. Các khái niệm chung
• Chưng luyện/ rectification là phương pháp chưng
nhiều lần, để thu sản phẩm
có độ tinh khiết cao hơn.
Chương 3: Các Quá trình Chưng Cất
1. Các khái niệm chung
• Phân loại chưng và chưng luyện theo:
– Áp suất làm việc: • chân không, • áp suất thường • áp suất cao.
– Số lượng cấu tử trong hệ:
– Phương thức làm việc: • hệ 2 cấu tử, • liên tục, • hệ 3 cấu tử, • gián đoạn. • hệ nhiều cấu tử.
– Các phương pháp chưng đặc biệt:
• Chưng bằng hơi nước trực tiếp • Chưng trích ly. • Chưng đẳng phí
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử: 2.1. Khái niệm:
• Hỗn hợp lỏng hai cấu tử A và B được biểu diễn qua các đại lượng:
– Khối lượng, m (kg, kg/h).
– Thể tích, V (m3, m3/h).
– Mol, n (kmol, kmol/h). – Với quan hệ: m = V . ρ và m/M = n
• ρ - khối lượng riêng, kg/m3. • M - phân tử lượng.
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử: 2.1. Khái niệm:
• Hỗn hợp khí (hơi) 2 cấu tử:
– Nhiệt độ, t (oC, K)
– Áp suất, P (at, mmHg) – Với khí lý tưởng: PV / T = const ở đktc (o): Vo = n. 22,4 (m3)
– Ở điều kiện nhiệt độ và áp suất bất kỳ:
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử: 2.1. Khái niệm:
• Áp suất riêng phần của cấu tử trong hỗn hợp lỏng: pA = aA . Pbh . XA và pB = aB . Pbh . XB
• Độ bay hơi tương đối: α
– α thể hiện khả năng bay hơi của các cấu tử trong hỗn hợp.
– α càng lớn, khả năng tách A ra khỏi B càng dễ.
– α = 1, không thể tách AB bằng phương pháp chưng thông thường.
• Quy ước: cấu tử A (đứng trước) luôn có độ bay hơi lớn hơn và
nồng độ của nó được dùng để tính toán.
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
a. Phân loại hỗn hợp hai cấu tử:
• Hỗn hợp lý tưởng:
– lực liên kết giữa các phân tử cùng loại và khác loại là giống
nhau và chúng hoà tan hoàn toàn vào nhau theo bất kỳ tỷ lệ nào.
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
a. Phân loại hỗn hợp hai cấu tử: • Hỗn hợp thực:
– Tan lẫn hoàn toàn nhưng có sai lệch với định luật Raoult: p = a . Pbh . X
• α > 1 – sai lệch dương
• α < 1 – sai lệch âm.
– Tan lẫn hoàn toàn nhưng có tồn tại điểm đẳng phí.
• Áp suất hơi đạt cực đại, hệ ethanol - nước.
• Áp suất hơi đạt cực tiểu, hệ acid nitric - nước.
– Tan lẫn một phần vào nhau, hệ nước – n buthanol.
– Hoàn toàn không tan lẫn, hệ benzen – toluen.
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
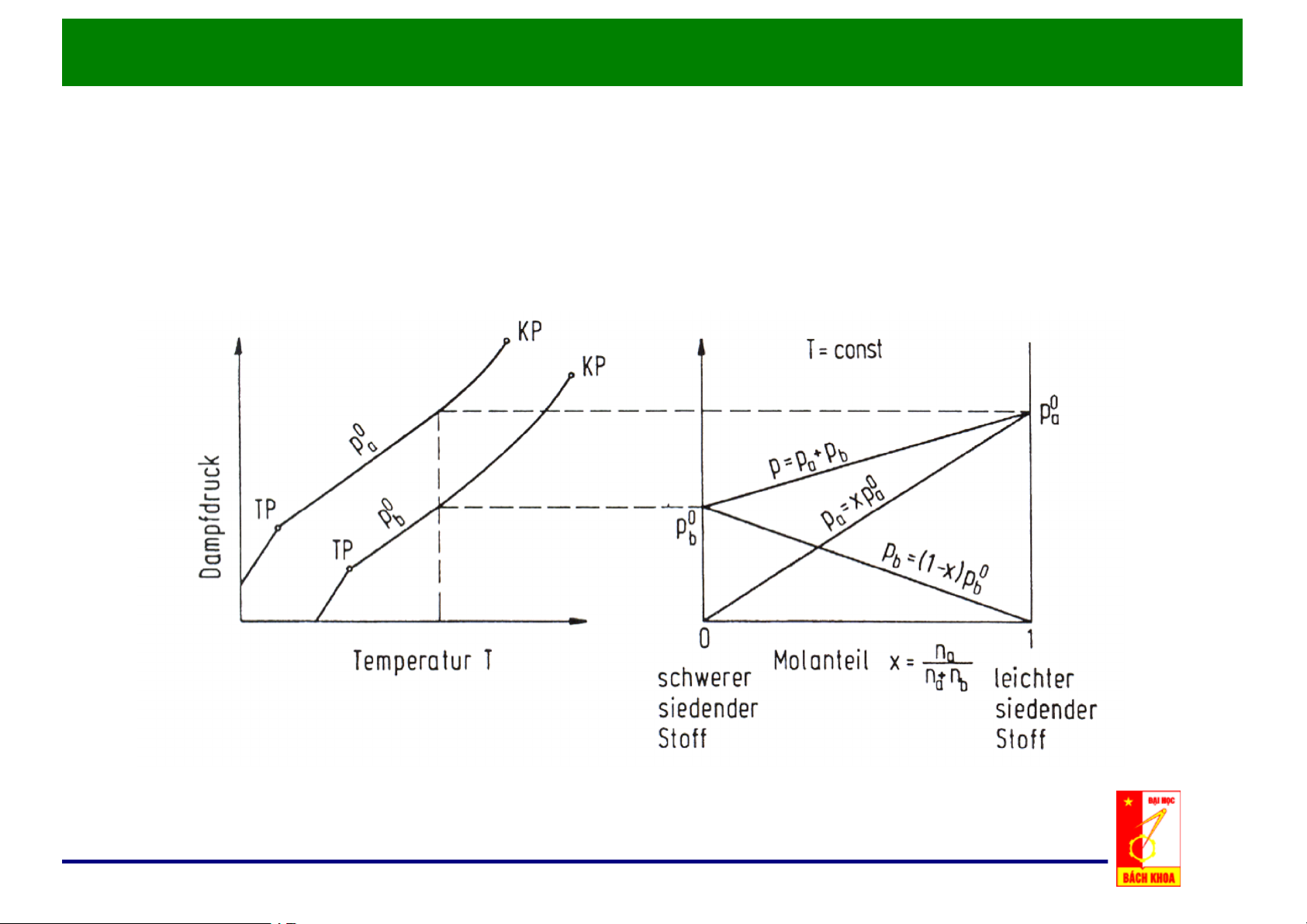
b. Đồ thị x – P, t = const:
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
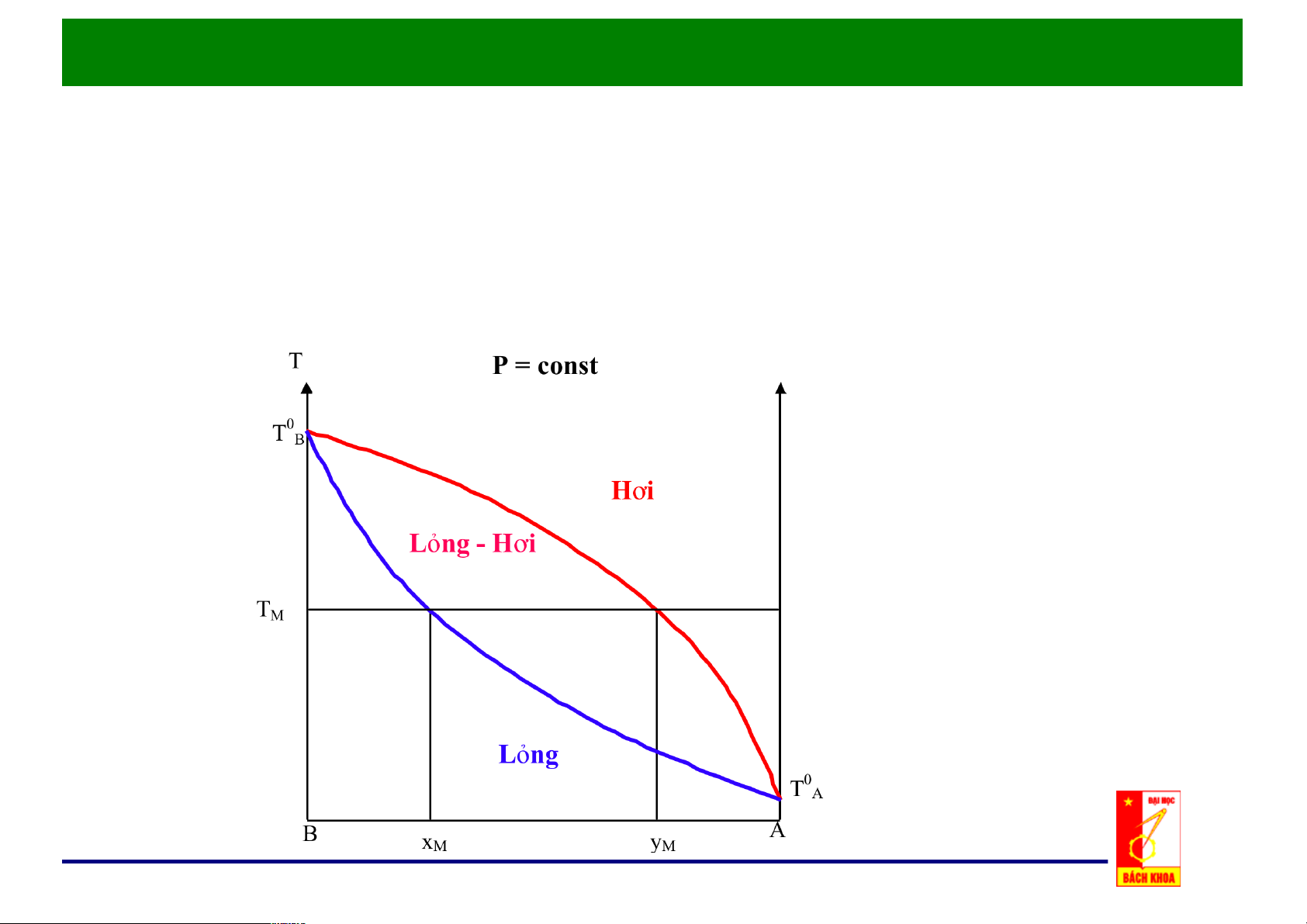
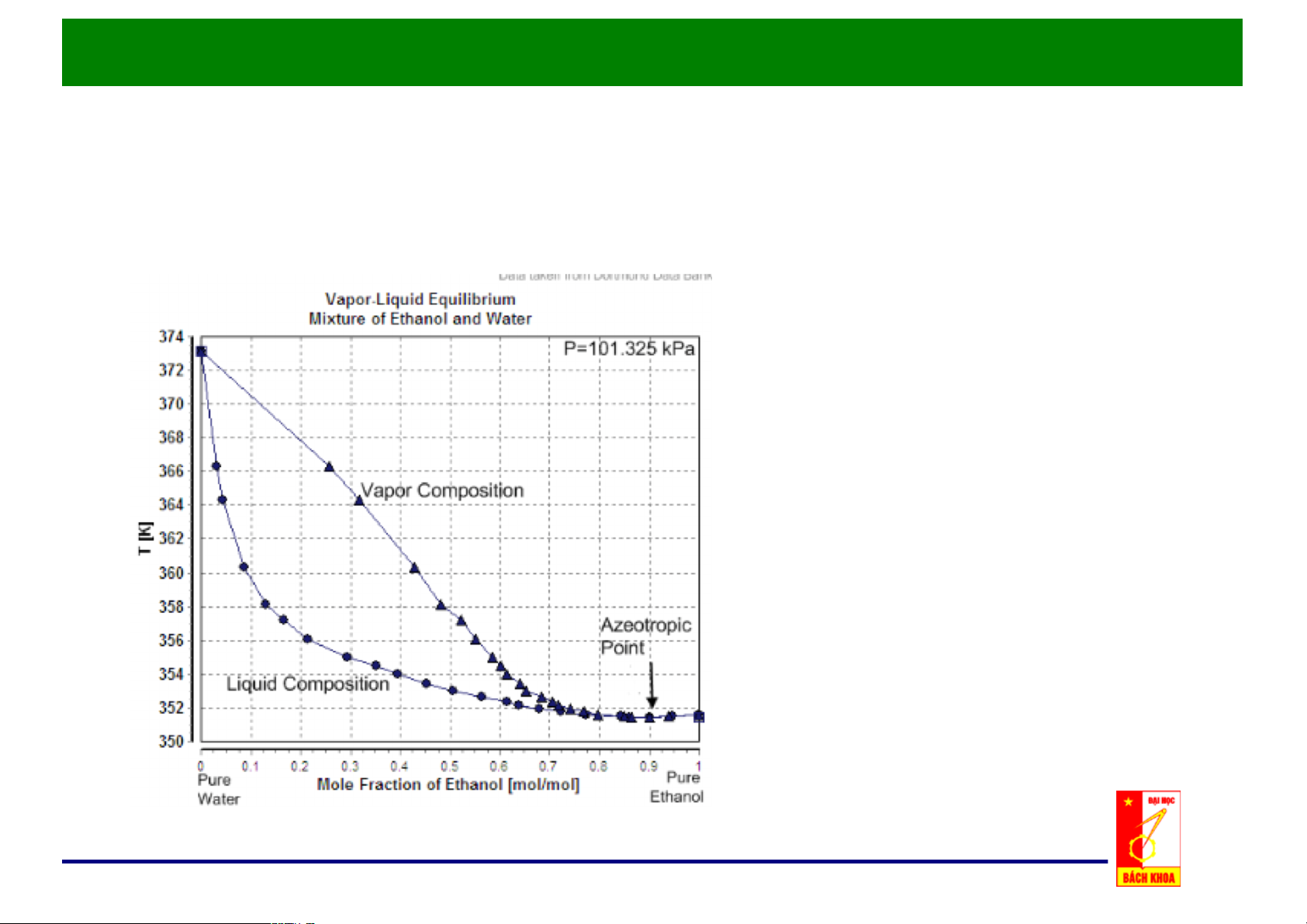
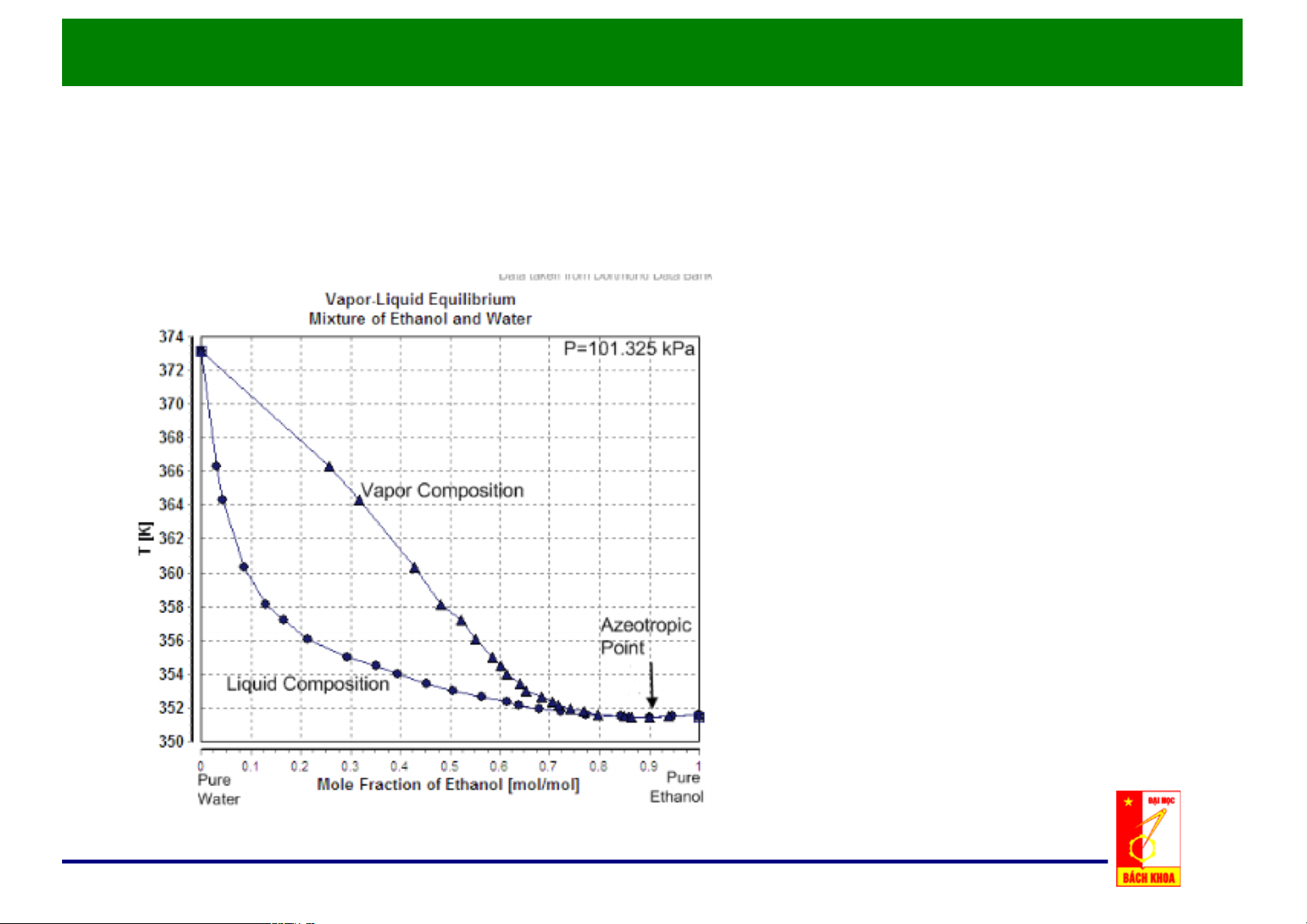
c. Đồ thị x, y - t: p = const
Nhiệt độ sôi Ts là hàm của x.3
Giản đồ đẳng áp T-x-y
Nhiệt độ ngưng tụ Tk là hàm của y
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
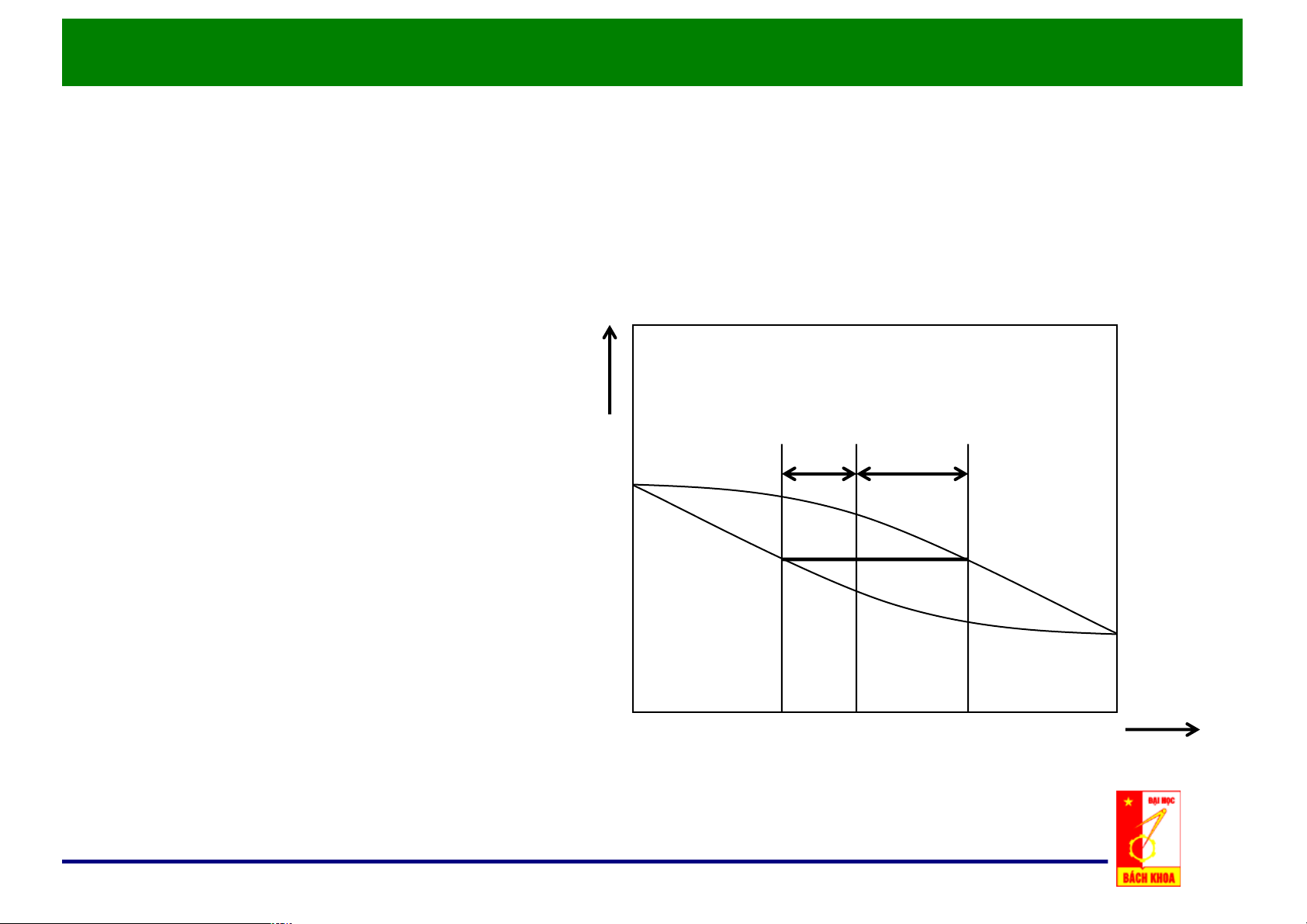
d. Quy tắc đòn bẩy t, oC • Có Z mol hỗn hợp hai cấu tử. = D = F • Trong vùng hai pha: G – F mol lỏng F E – D mol hơi. • Z = F + D xF xZ yD x, y Quy$tắc$đòn$bẩy
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
d. Quy tắc đòn bẩy
• Phương trình cân bằng vật liệu cho cấu tử dễ bay hơi:
Z . xZ = D . yD + F . xF
• Quy tắc đòn bẩy: F y ! x D Z = D x ! x Z F F EG y ! x D FE x ! x F EG y ! x D Z = = Z F = = D Z = = D FE x ! x Z FG y ! x Z FG y ! x Z F D F D F
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
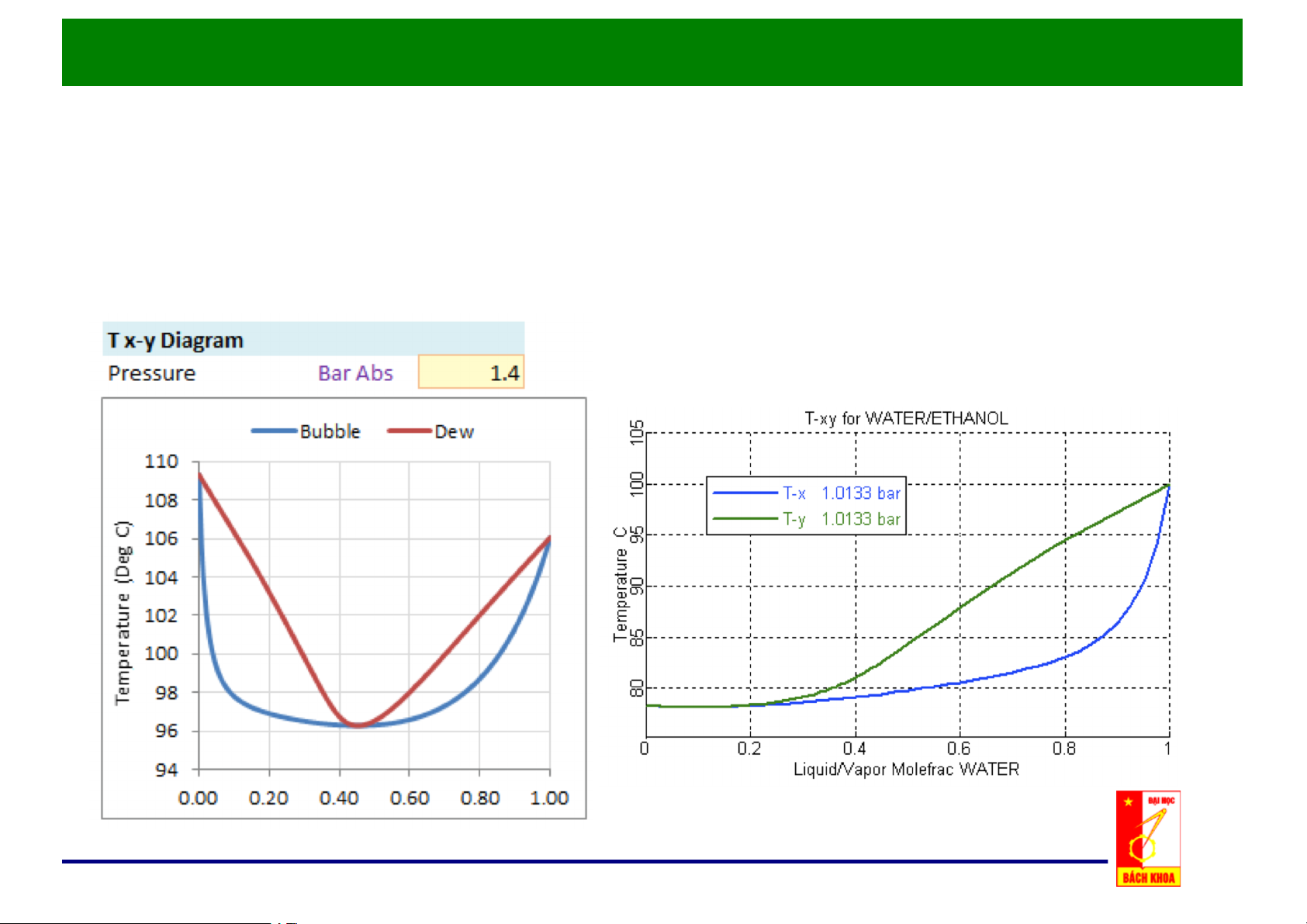
e. Đồ thị x, y – t cho hỗn hợp thực:
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
e. Đồ thị x, y – t cho hỗn hợp thực:
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
e. Đồ thị x, y – t cho hỗn hợp thực:
• Điểm đẳng phí tương
ứng với nhiệt độ cực tiểu. • Bên trái điểm đẳng phí có thể tách bằng phương pháp chưng thông thường.
Quan hệ x,)y)– t)của hệ có điểm đẳng phí ở áp suất cực đại
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
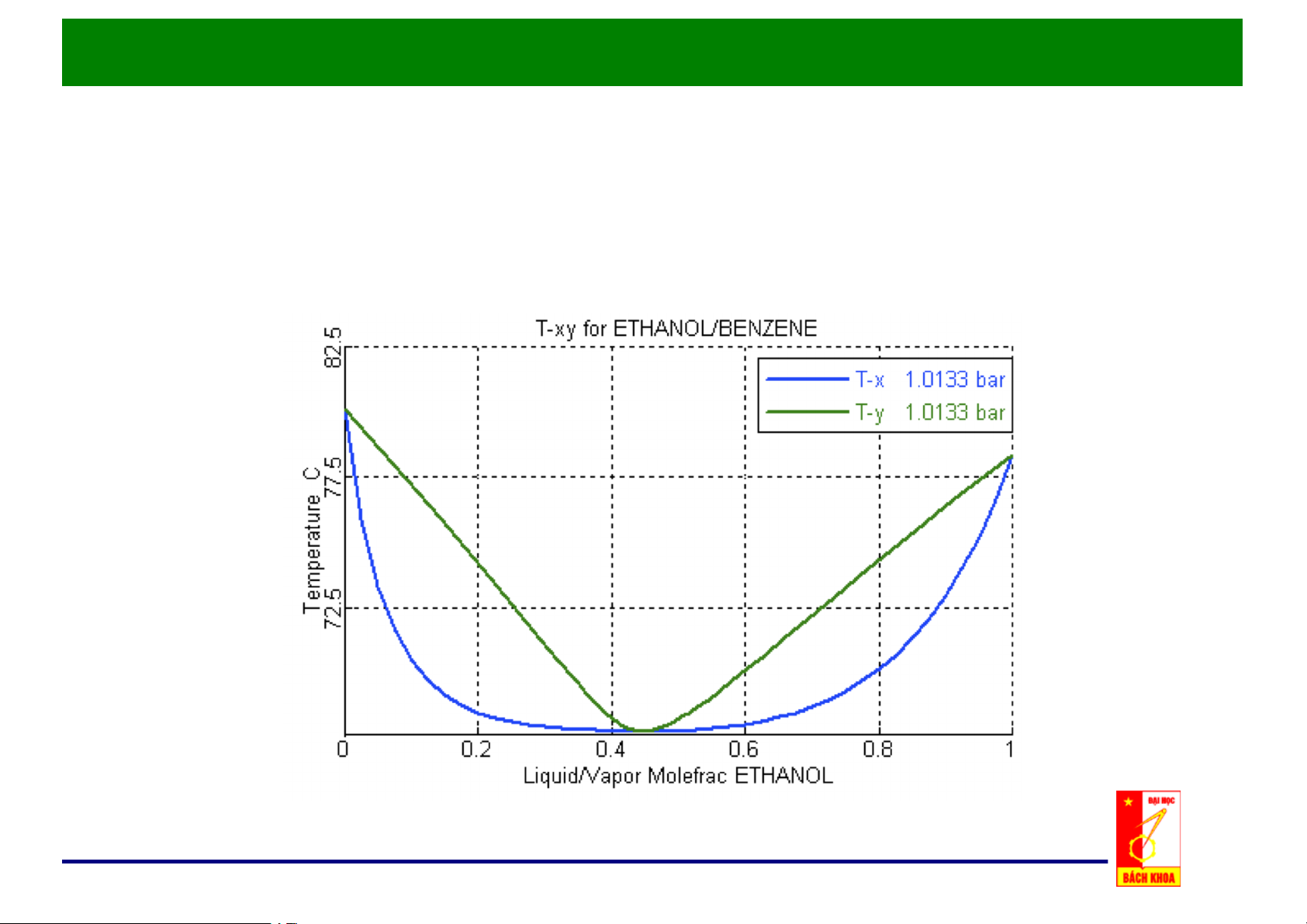
e. Đồ thị x, y – t cho hỗn hợp thực: • Tại điểm đẳng phí, không tách
được bằng chưng luyện.
• Bên phải điểm đẳng phí cũng
không thực hiện được quá
trình chưng vì nồng độ cân
bằng của pha hơi nhỏ hơn pha lỏng.
• Trường hợp điểm đẳng phí
cực tiểu, các quan hệ trên sẽ hoàn toàn ngược lại.
Quan hệ x,)y)– t)của hệ có điểm đẳng phí ở áp suất cực đại
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
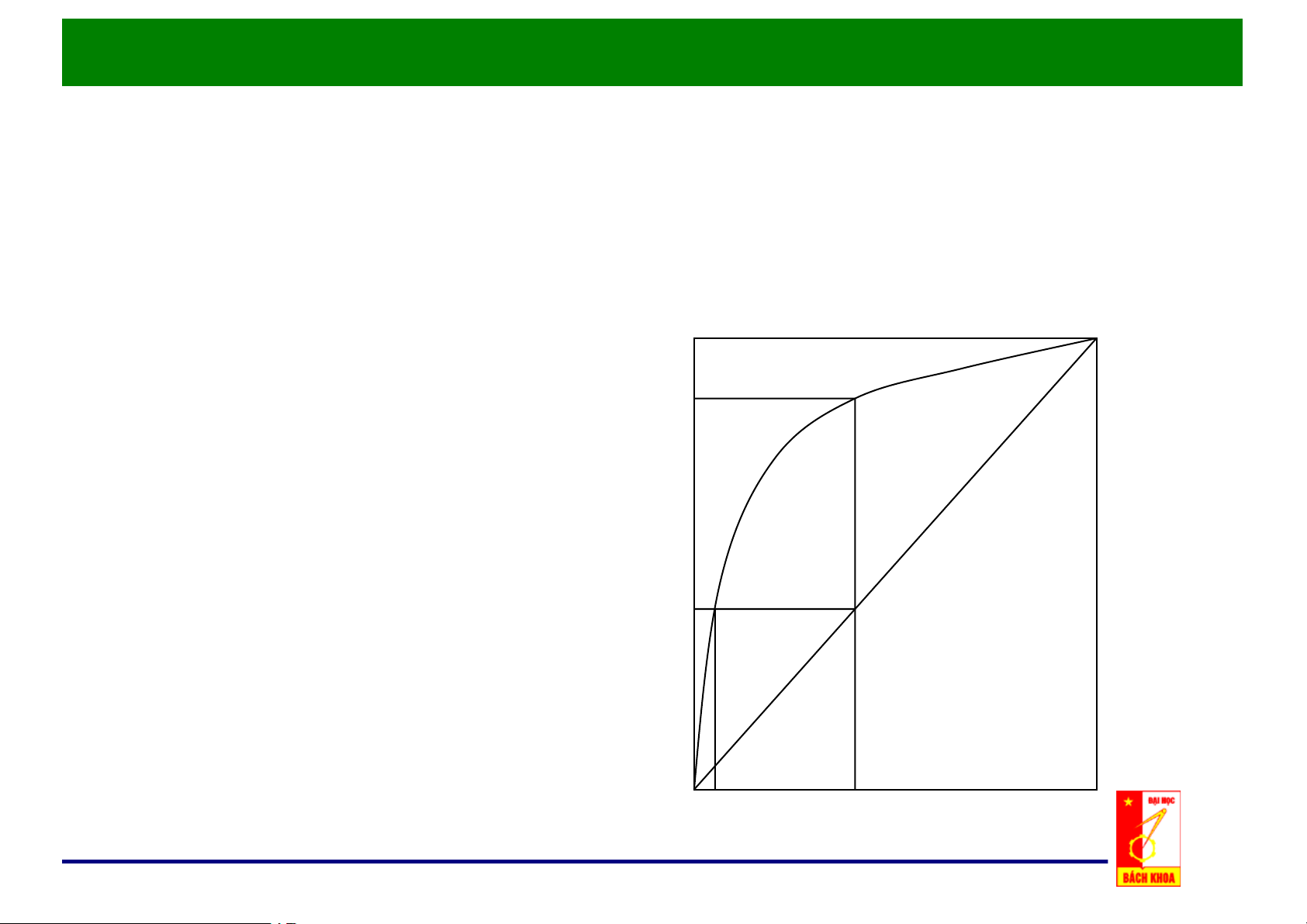
f. Đồ thị y – x: p = const
• Được sử dụng phổ biến trong y chưng luyện. y*
• Động lực của quá trình: Δy = y* - y Δx = x* - x y
• Số liệu đường cân bằng
thường cho sẵn trong các sổ tay. x* x x
Chương 3: Các Quá trình Chưng Cất
2. Hỗn hợp hai cấu tử:
2.2. Cân bằng hơi - lỏng của hỗn hợp hai cấu tử:
g. Cách biểu diễn đường cân bằng
• Từ đường sôi trên đồ thị y, x – t.
• Từ đồ thị Pbh – t.
• Tính nồng độ của pha hơi theo phương trình đường ngưng tụ
(kết hợp phương trình Dalton và Raoult): P y = x bhi i i P
• Với hỗn hợp thực, việc xác định đường cân bằng pha lỏng –
hơi thường dựa vào thực nghiệm.




