



Preview text:
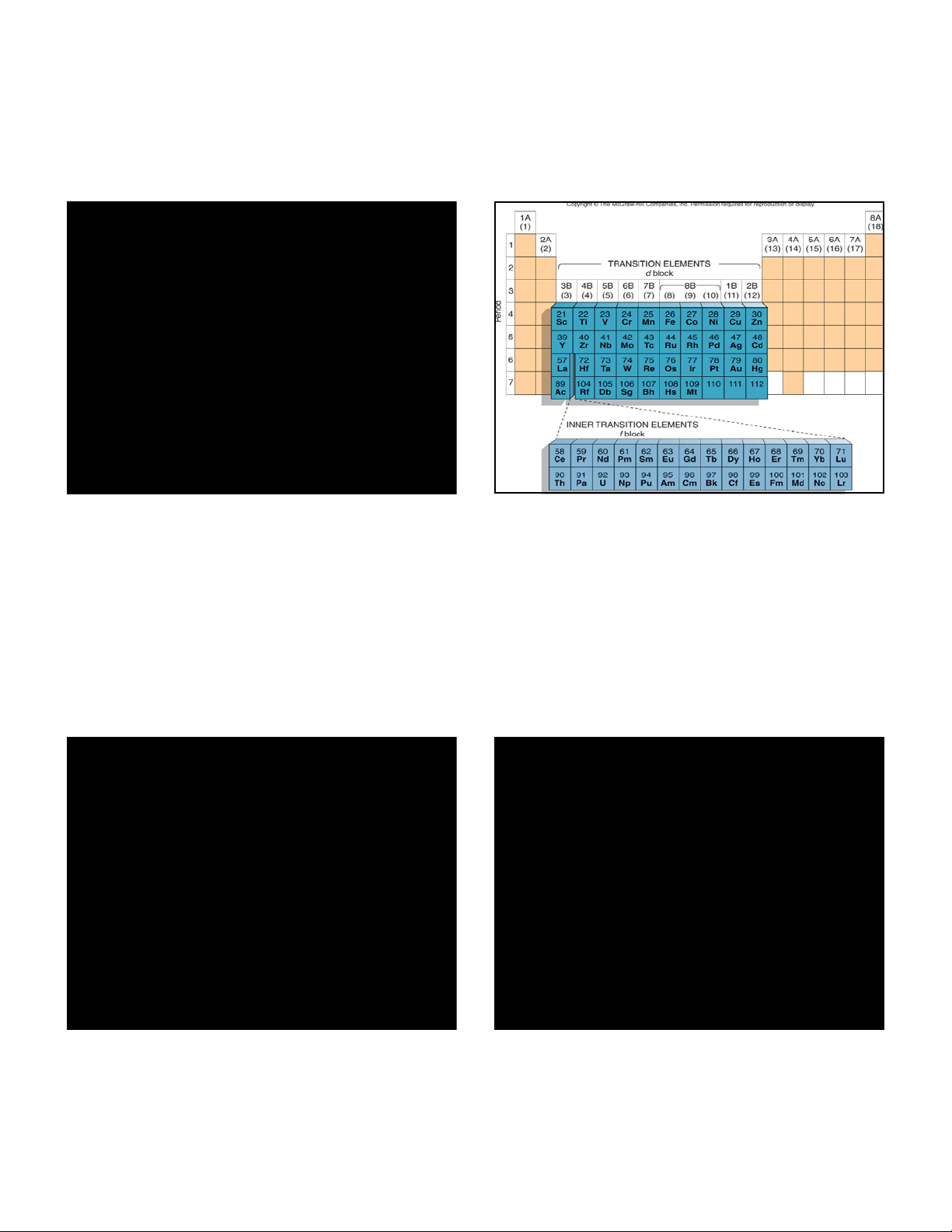
5/3/2018 CHƯƠNG 14. NHÓM VIIIB NHÓM SẮT Fe Co Ni [Ar]3d64s2 [Ar]3d74s2 [Ar]3d84s2 II, III, VI II, III, V II, IV 1.241 1.253 1.246 rA Ru Rh Pd [Kr]4d75s1 [Kr]4d85s1 [Kr]4d105s0 Os Ir Pt
[Xe]4f145d66s2 [Xe]4f145d76s2 [Xe]4f145d96s1 NỘI DUNG TÍNH CHẤT LÝ HỌC 1. ĐƠN CHẤT
1. Là kim loại; Fe, Co màu trắng xám, Ni màu 1. Tính chất lý học trắng bạc 2. Tính chất hóa học
2. Tính chất cơ học phụ thuộc nhiều vào tạp 3. Ứng dụng chất
4. Trạng thái tự nhiên, điều chế
3. Có tính chất từ giống nhau, khác với các kim
loại khác. Fe-α dưới 768 oC có tính sắt từ 2. HỢP CHẤT
4. Cấu trúc tinh thể, tồn tại ở nhiều dạng khác 1. Oxit nhau. 2. Hydroxit < 912 oC:
Fe-α là lập phương tâm khối 3. Muối 912-1394 oC:
Fe-γ là lập phương tâm mặt 4. Phức chất > 1394 oC-Mp:
Fe-δ là lập phương tâm khối 1 5/3/2018 TÍNH CHẤT HÓA HỌC
M không phản ứng với H2O ở nhiệt độ thường mà chỉ
phản ứng ở nhiệt độ cao
1. Fe hoạt động hóa học mạnh nhất, giảm dần theo chiều Fe – Co – Ni ~500o C
2. Với oxy không khí: Fe bị oxi hóa trong không khí ẩm
3Fe 4H O Fe O 4H 2 3 4 2
bởi ăn mòn điện hóa tạo gỉ sắt Fe2O3.xH2O,
Fe3O4.xH2O; Co, Ni bền trong không khí nên để mạ
Fe dễ tan trong H2SO4, HCl loãng; Co, Ni hòa tan chậm
3. Với halogen: FeX3, FeI2, CoX2, CoF2-CoF3, NiX2 hơn o
4. Với S: tạo MS khi bột kim loại tác dụng với S nóng 0.44V 2 Fe / Fe 5. Với C: Fe o 2 0.28V 2 3C, Fe2C, Co3C, Co2C Co / Co M 2H M H2
6. Với Si, P, B: tác dụng ở nhiệt độ cao o 0.25V 2 Ni / Ni
7. Với N: không phản ứng trực tiếp; có thể TH gián tiếp Đều dễ tan trong HNO
8. Với H: không phản ứng; hòa tan H khi R và NC; Ni
3 loãng tạo Fe(NO3)3, Co(NO3)2,
làm xúc tác khi hydro hóa các hợp chất hữu cơ Ni(NO3)2
9. Với nước và axit: thế khử tiêu chuẩn âm
Đều bị thụ động khi nhúng vào HNO3 đặc nguội; Fe thụ
động khi nhúng vào H2SO4 đặc nguội
The iron pillar that won’t rust! 2 5/3/2018 Fe3O4 manhetit Fe2O3 hematit Fe2O3.H2O goetit TRẠNG THÁI TỰ NHIÊN 2Fe2O3.3H2O limonit (Co, Fe)AsS cobantin NiAsS gecdofit ỨNG DỤNG 3 5/3/2018 ĐIỀU CHẾ Henry Bessemer (1813-1898)
The problem of mass-producing steel was solved
in 1855 by Henry Bessemer, with the
introduction of the Bessemer converter at his
steelworks in Sheffield, England. 4 5/3/2018 HỢP CHẤT
FeO, Fe O , Fe O , FeO OXIT 2 3 3 4 3
CoO, Co O , Co O , CoO 2 3 3 4 2
NiO, Ni O , Ni O , NiO 2 3 3 4 2 fuse
Fe O Na CO
2NaFeO CO 2 3 2 3 2 2 2Fe(OH )
Fe O 3H O 3 2 3 2
Fe2O3 sau khi nung ở nhiệt độ cao không tan trong axit như Al2O3, Cr2O3
Fe3O4 = FeO.Fe2O3 màu đen, không tan trong axit. Là
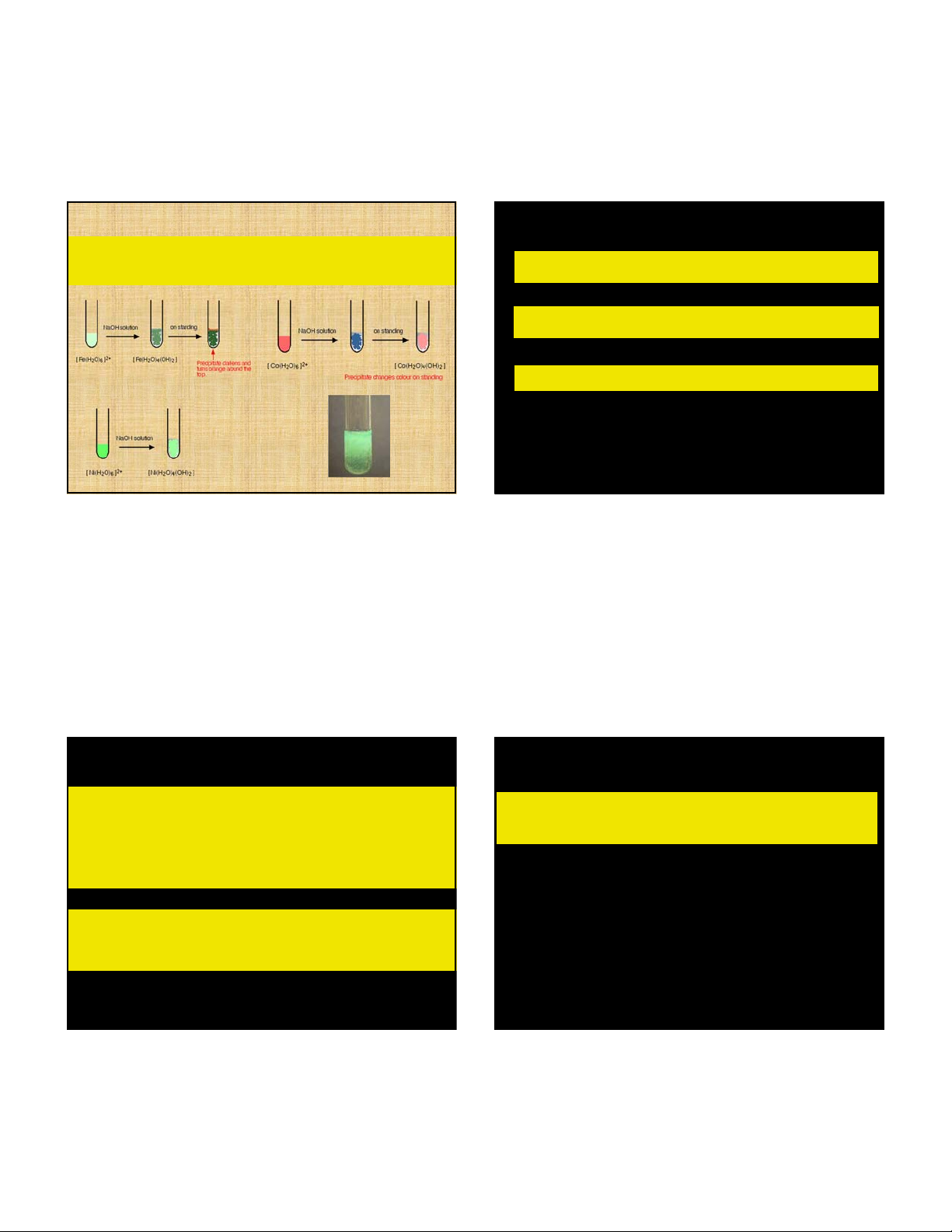
các oxit quan trọng nhất của Fe, có ở trong quặng để chế tạo sắt-thép 5 5/3/2018 HYDROXIT HYDROXIT 2 M 2OH M (OH ) 2 4Fe(OH ) O 2H O 4Fe(OH ) 2 2 2 3 trắng nâu
4Co(OH ) O 2H O 4Co(OH ) 2 2 2 3 hồng nâu
2Ni(OH ) Br 2NaOH
2Ni(OH ) 2 NaBr 2 2 3 xanh đen
=> So sánh tính khử của Fe(OH)2, Co(OH)2 và Ni(OH)2
Ni2+(aq) + 2OH-(aq) <==> Ni(OH) (s) 2 HYDROXIT
Fe(III) chỉ thể hiện tính OXH với chất KH mạnh
Fe(OH ) 3HCl
FeCl 3H O 3 3 2 3 2 2Fe 2I 2Fe I
2Co(OH ) 6HCl
2CoCl Cl 6H O 2 3 2 2 2
2Ni(OH ) 6HCl
2NiCl Cl 6H O
Tính chất OXH tăng dần theo dãy Fe(III) – Co(III) – Ni(III) 3 2 2 2
4Co(OH ) 8HNO
4Co(NO ) O 10H O 3 3 3 2 2 2
4Ni(OH ) 8HNO
4Ni(NO ) O 10H O 3 3 3 2 2 2
Co(III), Ni(III) có tính OXH mạnh trong môi trường axit. 6 5/3/2018 MUỐI 49o C 58o C 90o C 140o .6 .4 .2 . C CoCl H O CoCl H O CoCl H O CoCl H O CoCl 2 2 2 2 2 2 2 2 2
FeCl .6H O, Fe(NO ) .6H O, FeSO .7H O, FeSO .(NH ) SO Mohr 2 2 3 2 2 4 2 4 4 2 4 Xanh nhạt
Tất cả các muối đều dễ tan trong nước và mang màu
giống muối ngậm nước tương ứng
FeCl .6H O, Fe(NO ) .9H O, Fe (SO ) .18H O, NH Fe(SO ) .12H O Phen 3 2 3 3 2 2 4 3 2 4 4 2 2 Vàng nâu 2 3 2 5Fe
MnO 8H
5Fe Mn 4H O 4 2
Muối Co(II) khi đun nóng sẽ chuyển màu do mất nước kết tinh
CoX ( X halogen).6H O, Co(NO ) .6H O,CoSO .7H O 2 2 3 2 2 4 2 Hồng
4FeSO O 2H O
4Fe(OH )SO 4 2 2 4
Muối Mohr bền nhất trong các muối Fe(II), còn các muối
khác dễ bị OXH một phần trong không khí
NiCl .6H O, Ni(NO ) .6H O, NiSO .7H O, NiSO .(NH )SO .6H O 2 2 3 2 2 4 2 4 4 4 2
Fe2+ có tính KH trong môi trường axit, Co2+ và Ni2+ Xanh đậm không thể hiện tính KH
Potassium ferrocyanide will react with Fe3+ solution to
produce a dark blue precipitate called Prussian blue:
K+ + Fe3+ + [Fe(CN) ]4- <==> KFe[Fe(CN) ] 6 6 PHỨC CHẤT
Potassium ferricyanide will react with Fe2+ solution to
produce a dark blue precipitate called Prussian blue:
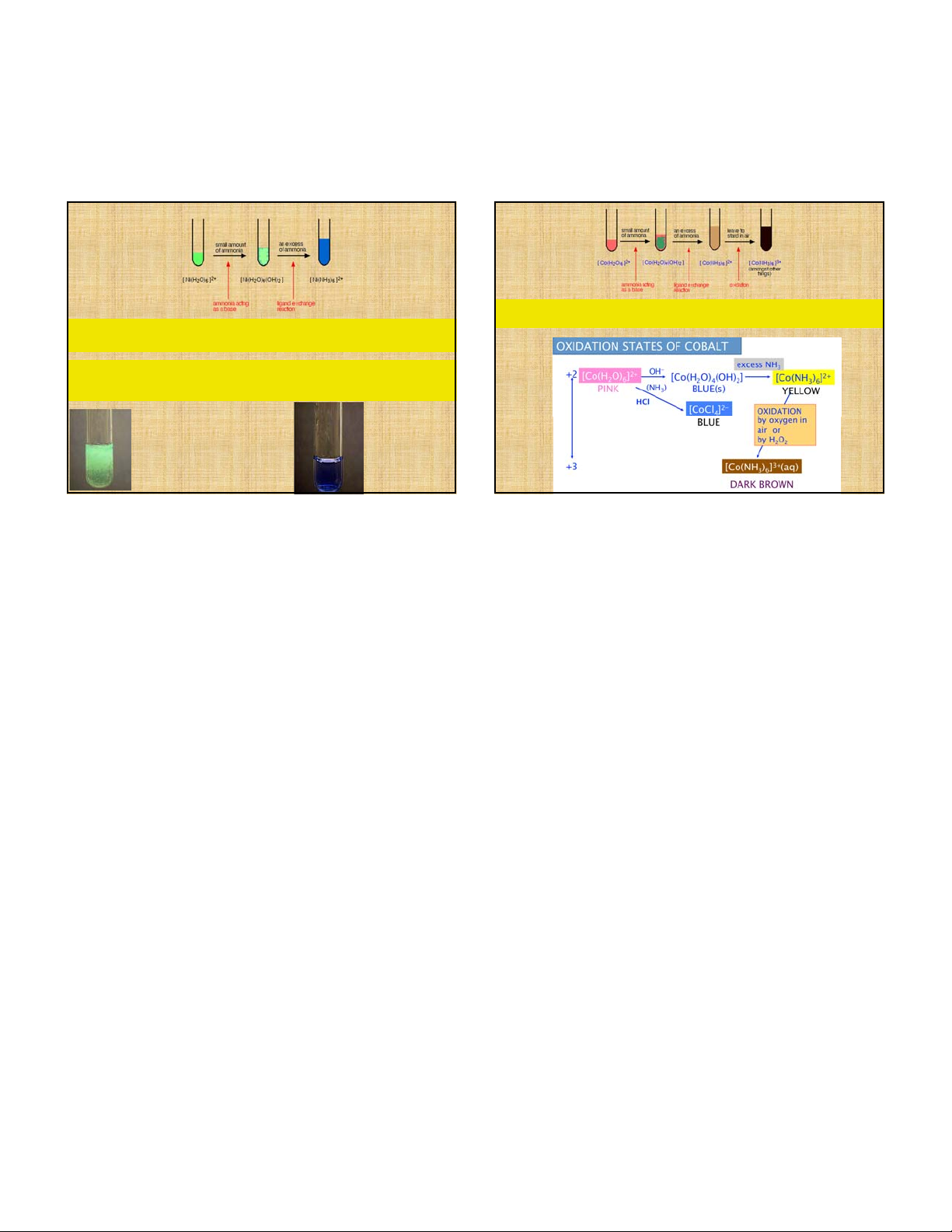
K+ + Fe2+ + [Fe(CN) ]3- <==> KFe[Fe(CN) ] 6 6 7 5/3/2018 2 3 4 Co(NH ) 4NH O
4 Co(NH ) 4NH 2H O 3 6 4 2 3 6 3 2 2 Ni 2NH 2H O Ni(OH ) 2NH 3 2 2 4 2
Ni(OH ) 6NH Ni(NH ) 2OH 2 3 3 6 8



