






Preview text:
05/26/20
Cơ sở Hóa học phân tích
Cơ sở Hóa học phân tích
Mã học phần: CH3330 và CH3331 Tài liệu tham khảo Khối lượng: 3 (3-1-0-6) Tiếng Anh: Lý thuyết: 45 tiết
1. Douglas A. Skoog, Donald M. West, F. James Hol er, Bài tập: 15 tiết
Stanley R. Crouch (2004), Fundamentals of Analytical
Chemistry, 8th edition, Thomson, USA.
2. Daniel C. Harris (2006), Quantitative analytical
chemistry, 7th edition. W. H. Freeman, New York
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 1
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 4 1 4
Cơ sở Hóa học phân tích
Chương 4: Phương pháp chuẩn độ kết tủa PHÂN TÍCH ĐỊNH LƯỢNG
Phương pháp chuẩn độ kết tủa là một phương pháp
CÁC PHƯƠNG PHÁP PHÂN TÍCH HÓA HỌC
PTTT dựa vào phản ứng tạo hợp chất ít tan (kết tủa)
Phần I: Nhóm các phương pháp phân tích
để xác định nồng độ ion chất cần phân tích hoặc nồng thể tích (PTTT) độ thuốc thử.
Chương 1: Đại cương về các PP PTTT
Yêu cầu của phản ứng kết tủa dùng trong phương
Chương 2: Phương pháp chuẩn độ axit – bazơ
pháp chuẩn độ kết tủa:
Chương 3: PP chuẩn độ phức chất
- Kết tủa tạo thành thực tế không tan (độ tan rất nhỏ -
Chương 4: Phương pháp chuẩn độ kết tủa T 10-10)
Chương 5: Phương pháp chuẩn độ oxy hóa –
- Phản ứng xảy ra nhanh & hợp thức khử
- Sự hấp phụ & cộng kết của kết tủa không làm sai
Phần II: Phương pháp phân tích khối lượng kết quả phân tích.
Chương 6: Phương pháp phân tích khối lượng
- Phản ứng phải có khả năng xác định ĐTĐ
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 2
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 5 2 5
Cơ sở Hóa học phân tích
Chương 4: Phương pháp chuẩn độ kết tủa V.1. Cân bằng dị thể Tài liệu tham khảo
5.1.1. Tích số tan và độ tan Tiếng Việt: a. Quy luật tích số tan 1. Bài giảng mAn+ + nBm- ⇌ A
2. Trần Bính (1997), Bài giảng chuẩn hóa học phân mBn (mA + nB ⇌ A ) tích. NXB ĐHBKHN mBn
3. Hoàng Minh Châu, Từ Văn Mặc, Từ Vọng Nghi
Biểu thức tích số tan của kết tủa AmBn là:
(2002), Cơ sở hóa học phân tích. NXB KHKT m n T a a
4. Trần Tứ Hiếu (2002), Hóa học phân tích, NXB A B A B m n ĐHQGHN
AmBn là chất khó tan (tức là nồng độ của các ion A
5. Nguyễn Tinh Dung (2007), Hóa học phân tích – Phần
và B trong dung dịch bão hòa rất nhỏ): III, NXB GD m n T [A] [B]
T chỉ phụ thuộc vào nhiệt độ A B m n
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 3
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 6 3 6 1 05/26/20
Chương 4: Phương pháp chuẩn độ kết tủa N G V.1. Cân bằng dị thể U Y Ễ
5.1.1. Tích số tan và độ tan N X
b. Quan hệ giữa độ tan và tích số tan U Â N
Ví dụ 1: Tính độ tan của CaSO T 4 ở 200C biết T của R Ư CaSO Ờ
4 tại nhiệt độ này là 9,110-6. N G
Ví dụ 2: Tính tích số tan của BaSO4 ở 20oC, nếu –A
biết rằng 100 ml dung dịch bão hòa tại nhiệt độ này N A C chứa 0,245 mg BaSO H 4. E M – S C E – H U S T
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 1 7
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 10 7 10
Chương 4: Phương pháp chuẩn độ kết tủa
Chương 4: Phương pháp chuẩn độ kết tủa V.1. Cân bằng dị thể V.1. Cân bằng dị thể
5.1.1. Tích số tan và độ tan
5.1.2. Sự kết tủa hoàn toàn và sự hòa tan kết tủa a. Quy luật tích số tan
• Khi kết tủa 1 ion nào đó, kết tủa hết ion đó
[A]m[B]n < T(AmBn) Chưa hình thành Dung dịch chưa
(mong muốn) nghĩa là ion đó chuyển hoàn toàn kết tủa bão hòa
vào kết tủa, không còn lại trong dung dịch.
[A]m[B]n = T(AmBn) Chưa hình thành Dung dịch bão hòa kết tủa
• Về mặt lý thuyết thì không thể kết tủa hoàn toàn [A]m[B]n > T(A
1 ion nào đó. Trong thực tế 1 ion nào đó coi là mBn) Tạo thành kết tủa Dung dịch quá bão hòa
kết tủa hoàn toàn khi nồng độ cân bằng của nó
trong dung dịch (sau khi kết tủa) là khá nhỏ
không ảnh hưởng đến quá trình phân tích tiếp
theo. Thông thường là 10-6 mol/l (tương đương
với sai số của cân phân tích 10-4 g)
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 8
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 11 8 11
Chương 4: Phương pháp chuẩn độ kết tủa
Chương 4: Phương pháp chuẩn độ kết tủa V.1. Cân bằng dị thể V.1. Cân bằng dị thể
5.1.3. Những yếu tố ảnh hưởng đến độ tan
5.1.1. Tích số tan và độ tan
a. Ảnh hưởng của ion lạ: hiệu ứng muối
b. Quan hệ giữa độ tan và tích số tan m n m n m n T a a f f [A] [B] A B A B A B m n
Độ tan (s) của một chất là nồng độ của chất đó TA B
trong dung dịch bão hòa (ở một nhiệt độ nhất định) s(A B ) mn m n [ mol/l] m n m n m n f f m n
Độ tan (s) và tích số tan (T) là những đại lượng đặc A B 2
trưng cho dung dịch bão hòa, có thể tính được s từ 1 z lg i f T và ngược lại. i 2 1 T 1 2 s(A B ) mn A B m n [ mol/l] z C i i m n m n m n 2 i
Trong dung dịch có ion lạ lực ion hệ số
hoạt độ f độ tan s
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 9
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 12 9 12 2 05/26/20
c. Ảnh hưởng của pH và chất tạo phức đến độ
Chương 4: Phương pháp chuẩn độ kết tủa
tan của kết tủa, tích số tan điều kiện V.1. Cân bằng dị thể
– M có phản ứng tạo phức phụ với ion lạ L:
5.1.3. Những yếu tố ảnh hưởng đến độ tan M + L ⇌ ML [ML] 1
b. Ảnh hưởng của ion chung [M].[L] [ML ]
• Nếu thêm ion của kết tủa vào dung dịch bão hòa ML + L ⇌ ML 2 2 2 [ML].[L]
của kết tủa đó, tích số ion sẽ lớn hơn tích số tan, … [ML ] k
nên cân bằng sẽ chuyển dịch về phía tạo thêm MLk-1 + L ⇌ MLk k [ML ][L] k 1
kết tủa và làm giảm độ tan của nó.
• Ví dụ: Tính độ tan của BaSO
– Có quá trình proton hóa của A : 4 trong dung dịch Na H+ + A ⇌ HA K -1
2SO4 0,01M và so sánh với độ tan của nó am trong nước. H+ + HA ⇌ H -1 2A Ka(m-1) … H+ + H -1 (m-1)A ⇌ HmA Ka1
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 13
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 16 13 16
c. Ảnh hưởng của pH và chất tạo phức đến độ
Chương 4: Phương pháp chuẩn độ kết tủa
tan của kết tủa, tích số tan điều kiện V.1. Cân bằng dị thể
• Gọi [M]’ và [A]’ là tổng nồng độ các dạng ion và phân tử của
5.1.3. Những yếu tố ảnh hưởng đến độ tan M và A tan trong dung dịch;
c. Ảnh hưởng của pH và chất tạo phức đến độ
• Khi đó, tích số điều kiện được định nghĩa là:
tan của kết tủa, tích số tan điều kiện. ' T [M ']m[ ' A ]n M A m n
Với [M]’ = [M] + [ML] + [ML2] + … + [MLk] (1)
[M '] [M ] [ML] [ML ] ... [ML ] 2 k [M '] [M ] 1 ( [L]
[L]2 . .. [L]k ) 1,1 1,2 1,k αM(L)
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 14
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 17 14 17
c. Ảnh hưởng của pH và chất tạo phức đến độ
c. Ảnh hưởng của pH và chất tạo phức đến độ
tan của kết tủa, tích số tan điều kiện
tan của kết tủa, tích số tan điều kiện
• Phản ứng tạo kết tủa:
• Gọi [M]’ và [A]’ là tổng nồng độ các dạng ion và phân tử của M và A tan trong dung dịch; mM + nA ⇌ M T [M ]m[ ]n A mAn MAn
• Khi đó, tích số điều kiện được định nghĩa là:
• Giả sử ion tạo kết tủa M và A trong dung dịch có tham ' T [M ']m[ ' A ]n M A m n
gia phản ứng phụ. Trong đó: và [A]’ = [A] + [HA] + … + [H
• M tham gia tạo phức với ion lạ L (hoặc tạo phức mA] (2) [H ] [H ]2 [H ]m [ ' A ] [ ] A 1 ( ... ) hidroxo với ion OH-) K K K K K ...K am am a(m ) 1 am a(m ) 1 a1
• A (là anion của axit yếu) bị proton hóa để tạo α ' m n A(H) T T
thành các dạng axit liên hợp M A M ( L) Y ( H ) m n ' T mn M A s m n
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 15 M A m n m n m n
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 18 15 18 3 05/26/20
Chương 4: Phương pháp chuẩn độ kết tủa
d. Ảnh hưởng của sự tạo phức với ion của kết tủa V.1. Cân bằng dị thể Với n = 1, ta có:
5.1.3. Những yếu tố ảnh hưởng đến độ tan
– Phản ứng tạo kết tủa :
c. Ảnh hưởng của pH và chất tạo phức đến độ M + A ⇌ MA T [M ][A ]
tan của kết tủa, tích số tan điều kiện. M n A – Phản ứng tạo phức: Ví dụ 1: BT 6/53 M + A ⇌ MA* Tính độ tan của CaF 1
2 trong dung dịch HCl 10-3 M. MA + A ⇌ MA 2 2
Biết KHF = 6 10-4; T(CaF2) = 410-11. …
Ví dụ 2: Tính độ tan của CuS trong nước. Biết T MA CuS (p-1) + A ⇌ MAp p
= 6,310-36 ; H2S có pKa1 = 7,0 và pKa2 = 15; hằng 1 (p 1 - )
số bền tổng cộng của các phức giữa Cu2+ và OH- s T ( [A] . .. [A] ) ( 1) MA [ ] 1,1 1,2 1,p A
lần lượt là 107, 1013,68, 1017, 1018,5.
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 19
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 22 19 22
d. Ảnh hưởng của sự tạo phức với ion của kết tủa
Chương 4: Phương pháp chuẩn độ kết tủa Với n = 1, ta có: V.1. Cân bằng dị thể
– Giả thiết trong dung dịch chỉ tồn tại chủ yếu các
5.1.3. Những yếu tố ảnh hưởng đến độ tan
phức MA* và MA2, vì nồng độ của A do kết tủa
c. Ảnh hưởng của pH và chất tạo phức đến độ
phân ly ra thường không lớn, ta có:
tan của kết tủa, tích số tan điều kiện. 1
Ví dụ 3: Tính độ tan của BaSO s T ( [A] ) ( 2) 4 trong dung dịch MA 1,1 1,2
muối dinatri của EDTA nồng độ 10-2M có pH = 10. [ ] A Biết T(BaSO – T ừ ( 2 ) c ó thể tìm được [A]
4) = 1,110-10 ; hằng số bền của phức
min để độ tan của kết
BaY2- là 107,87. Bỏ qua sự tạo phức hidroxo giữa
tủa MA là nhỏ nhất, tức là ds/d[A] = 0. Ta có:
Ba2+ và OH- . H4Y có pKa1 = 2; pKa2 = 2,67; pKa3 = 1 6,27; pK [ ] A ( 3) min a4 = 10,95. ĐS: 2,2710-3M 1,2 s T (2 ) min MA 1,2 1,1
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 20
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 23 20 23
d. Ảnh hưởng của sự tạo phức với ion của kết tủa
d. Ảnh hưởng của sự tạo phức với ion của kết tủa Với n = 1, ta có:
– Phản ứng tạo kết tủa :
– Giả thiết trong dung dịch chỉ tồn tại chủ yếu các M + nA ⇌ MAn T [M ][ ]n A MA phức MA* và MA – Phản ứng tạo phức: n
2, vì nồng độ của A do kết tủa N G
phân ly ra thường không lớn; U Y M + A ⇌ MA Ễ 1 N MA + A ⇌ MA
– Mặt khác, ta lại có: X 2 2 U Â … s [M ] [ * MA ] [MA ] N 2 T R MA Ư (p-1) + A ⇌ MAp p [ ] A [ * MA ] [ 2 MA ] ( p h ư ơ n
g trình bảo toàn nồng độ của A) ỜN [M '] s [M ] [M ] A [MA ] ... [MA ] 2 G – 2 p [ ]
A [M ] [MA ] [M ] [M ][ ]2 A A 2 , 1 2 N T A C [M '] s MA H n 1 ( [A]
[A]2 . .. [A]p ) T E MA M [ ]n 1,1 1,2 1,p A [A] T [ ] A [ ] , 1 2 MA A – S C 1 E – s [M '] T ( [A]( -1n)
[A](2-n) . .. [A](p-n)) T H MA MA U n [ ]n 1,1 1,2 1,p A hay [ ] A ( p h ư ơ
ng trình dùng để tính nồng độ cân S 1 T T
bằng của A trong dung dịch)
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 21 , 1 2 MA 24 21 24 4 05/26/20
d. Ảnh hưởng của sự tạo phức với ion của kết tủa
Chương 4: Phương pháp chuẩn độ kết tủa
• Ví dụ 1: Tính độ tan của AgCl trong nước. Biết T V.1. Cân bằng dị thể AgCl =
1,7810-10, hằng số bền tổng cộng của các phức bạc
5.1.4. Hiện tượng cộng kết và kết tủa sau (xem clorua là: 103,04 105,04.
chương Phương pháp phân tích khối lượng)
5.1.5. Kết tủa keo (xem chương Phương pháp phân
• Ví dụ 2: Tính nồng độ cân bằng Cl- để kết tủa AgCl tan ít tích khối lượng)
nhất, biết Ag+ tạo phức với Cl- với các hằng số sau: AgCl β1 = 103,04 AgCl - 2 β1,2 = 105,04
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 28
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 25 25 28
5.1.6. Cân bằng giữa 2 anion và 1 cation tạo kết tủa (hoặc 2
Chương 4: Phương pháp chuẩn độ kết tủa
cation và 1 anion tạo kết tủa) V.1. Cân bằng dị thể
Trường hợp 1: Thêm cation M+ vào dung dịch hỗn hợp của A- và X-
5.1.3. Những yếu tố ảnh hưởng đến độ tan A MA
d. Ảnh hưởng của nhiệt độ T M MA
• Tích số tan chỉ là hằng số ở nhiệt độ xác định. X MX TMX
Do đó nhiệt độ thay đổi thì độ tan thay đổi.
• Sự thay đổi của độ tan theo nhiệt độ có liên quan
[M+][A-] > TMA thì có kết tủa MA (1)
đến hiệu ứng nhiệt khi hòa tan:
[M+][X-] > TMX thì có kết tủa MX (2)
Quá trình hoà tan là thu nhiệt thì độ tan sẽ tăng theo •
Nếu (1) thoả mãn trước thì kết tủa MA xuất trước.
nhiệt độ và ngược lại. •
Khi có cả 2 kết tủa MA và MX thì: + - [M ][A ]=T MA + - [M ][X ]=TMX
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 26
Nguyễn X. Trường – ANACHEM-SCE-HUST-1/29 26 29
5.1.6. Cân bằng giữa 2 anion và 1 cation tạo kết tủa
Chương 4: Phương pháp chuẩn độ kết tủa
(hoặc 2 cation và 1 anion tạo kết tủa) V.1. Cân bằng dị thể
• Giả sử (1) đạt được trước thì khi bắt đầu xuất hiện kết tủa
5.1.3. Những yếu tố ảnh hưởng đến độ tan MX ta có:
e. Ảnh hưởng của kích thước hạt kết tủa. + -
• Với cùng một lượng kết tủa, nó sẽ tan nhiều hơn [M ][A ]=T T MA - MA [A ]=[X] . 0
nếu tồn tại ở dạng hạt nhỏ. + - [M ][X ] =T T 0 MX MX
• Vì vậy, khi tiến hành kết tủa có gắng tạo điều Với [X-]
kiện để thu được kết tủa lớn hạt.
0 là nồng độ ban đầu của anion X-
Nếu [A-] 10-6M thì quá trình kết tủa MA và MX là phân đoạn. Ví dụ: BT 3 – SGK/53
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 27
Nguyễn X. Trường – ANACHEM-SCE-HUST-1/30 27 30 5 05/26/20
5.1.6. Cân bằng giữa 2 anion và 1 cation tạo kết tủa (hoặc 2
cation và 1 anion tạo kết tủa) V.2. Chuẩn độ kết tủa V.2.1. Phân loại phương
Trường hợp 2: Thêm anion X- vào dung dịch chứa kết tủa MA
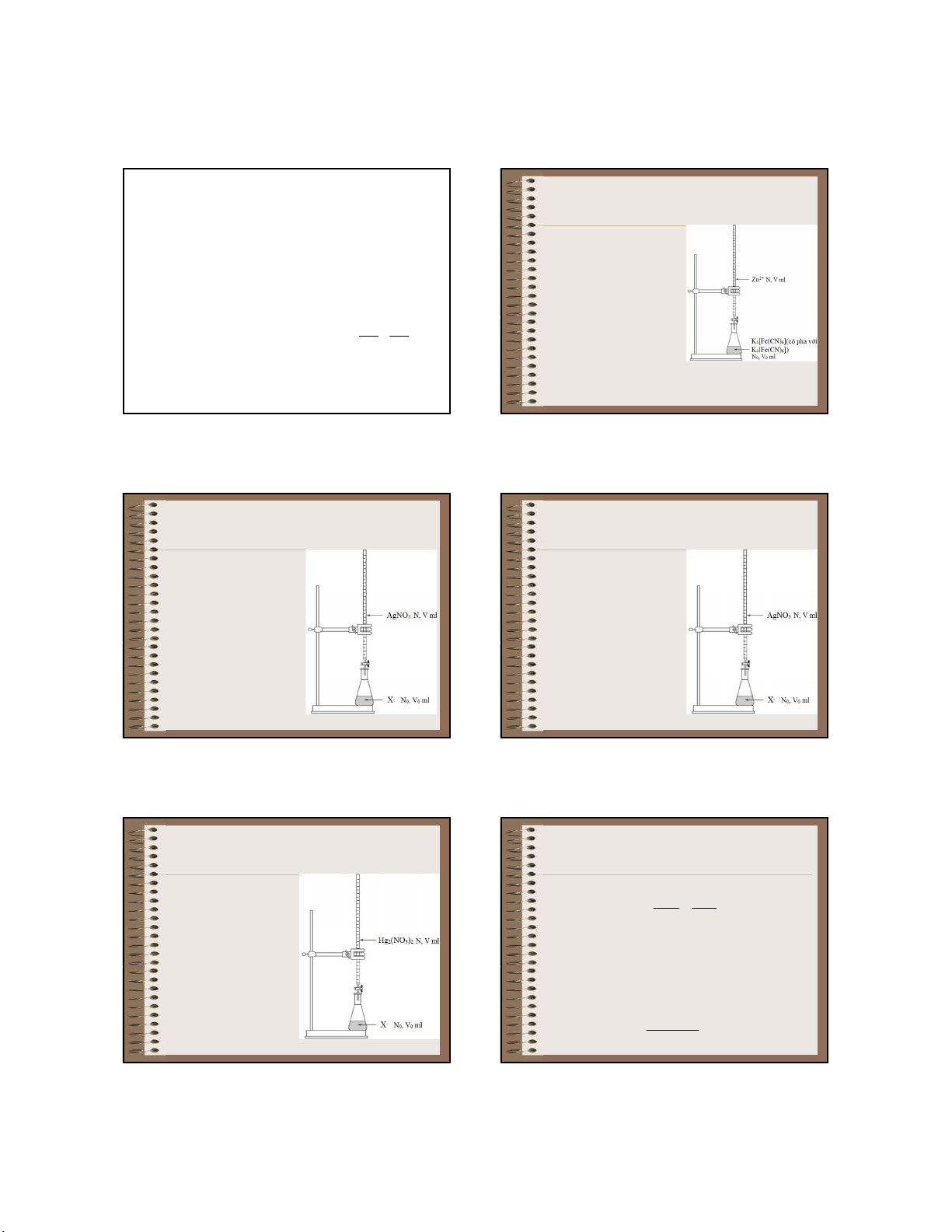
pháp chuẩn độ kết tủa MA M A TMA
c. Phương pháp chuẩn độ + kẽm X Dùng dung dịch chuẩn là K4[Fe(CN)6] (có pha lẫn MX T
K3[Fe(CN)6]) để xác định MX nồng độ ion Zn2+ - [X ] T Phản ứng chuẩn độ:
Khi có kết tủa MX thì [M+].[X-] = T MX MX - [A ] T 3Zn2+ + 2K Fe(CN) = • Nếu T MA 4 6
MX < TMA thì dễ dàng có kết tủa MX K Fe(CN) • Nếu T 2Zn3 6 2 trắng xanh lơ
MX > TMA thì nồng độ X- phải lớn mới có kết tủa MX + 6K+
Ví dụ: Hòa tan ↓BaSO4 bằng cách chuyển thành ↓BaCO3 dễ tan
hơn khi thêm dư thuốc thử (NH4)2CO3
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 34
Nguyễn X. Trường – ANACHEM-SCE-HUST-1/31 31 34 V.2. Chuẩn độ kết tủa V.2. Chuẩn độ kết tủa V.2.2. Phương pháp bạc V.2.1. Phân loại phương
Giả sử chuẩn độ V0 ml dung
pháp chuẩn độ kết tủa
dịch chứa ion X- (Cl-, Br-, I- hay a. Phương pháp bạc
SCN-) có nồng độ C0 (mol/l)
bằng dung dịch AgNO3 có nồng Dùng để xác định các
độ C (mol/l). Tích số tan của halogenua (Cl-, Br-, I-) và kết tủa là TAgX SCN- bằng dung dịch
V.2.2.1. Xây dựng đường định chuẩn AgNO
phân: pX (hoặc pAg) theo thể 3 tích (V) AgNO Phản ứng chuẩn độ: 3 thêm vào (hoặc mức độ định phân F). Ag+ + X- ⇌ AgX F = CV/C0V0 pX + pAg = pTAgX
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 32
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 35 32 35 V.2. Chuẩn độ kết tủa
5.2.2.1. Xây dựng đường định phân N G V.2.1. Phân loại phương - Phản ứng chuẩn độ U Y Ễ
pháp chuẩn độ kết tủa N Ag+ + X- ⇌ AgX X U b. Phương pháp thủy N V C V Â V 0 0 0 0 N T ngân I tđ N C R Ư Ờ Dùng để xác định các N - Chưa định phân G – halogenua (Cl-, I-) bằng A + V = 0 N A dung dịch chuẩn C + pX = -lgC H Hg 0 E M 2(NO3)2
- Bắt đầu định phân đến trước ĐTĐ – Phản ứng chuẩn độ: S C + 0 < V < V E – Hg 2+ tđ H 2 + 2X- ⇌ Hg2X2 C V CV U pX lg[ X ] 0 0 lg S ex T V V 0 36
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 33 33 36 6 05/26/20
5.2.2.1. Xây dựng đường định phân
5.2.2.2. Các phương pháp xác định điểm cuối trong phương pháp bạc - Tại ĐTĐ + V = Vtđ a. Phương pháp Mohr 1 +pX pAg pTAgX b. Phương pháp Volhard 2 - Sau ĐTĐ c. Phương pháp Fajans + V > Vtđ T + [X AgX ] [Ag]ex CV C V pX pT 0 0 lg AgX V V 0
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 37
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 40 37 40
Ví dụ: xây dựng đường định phân 50,0 ml dung dịch a. Phương pháp Mohr
NaCl 0,1 M bằng dung dịch AgNO3 0,1 M. TAgCl =
- Dùng chất chỉ thị tạo kết tủa có màu để xác định N 1,0 10-10 G ĐTĐ U Y Ễ VAgNO3 pCl pAg F
- Định phân Cl-, Br- với CCT với K N (ml) 2CrO4 X U Â 0 1,0 - 0
+ Phản ứng chuẩn độ: Ag+ + Cl- ⇌ AgCl trắng N T 5 1,1 8,9 0,1 R + Phản ứng chỉ thị: Ư Ờ 25 1,5 8,5 0,5 N 2- G 45 2,3 7,7 0,9
2Ag+ + CrO4 ⇌ Ag2CrO4 đỏ gạch T =10-11,95 –A 49,5 3,3 6,7 0,99 N A C 49,95 4,3 5,7 0,999 H E 50 5,0 5,0 1 M – 50,05 5,7 4,3 1,001 S C E 50,5 6,7 3,3 1,01 – H 75 7,8 2,2 1,5 U S T 100 8,7 1,3 2 41
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 38 38 41
Nhận xét về đường định phân: a. Phương pháp Mohr
- pXđp (hay pAgđp) phụ thuộc vào nồng độ và tích số tan: + C, C N
0 càng nhỏ thì bước nhảy càng ngắn và ngược lại G U + T Y
AgX càng bé thì bước nhảy càng dài và ngược lại. TAgX < Ễ
10-10 thì mới xác định được ĐTĐ. N X U Â N T R Ư Ờ N G –ANACHEM –SCE –HUS
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 39 T
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 42 39 39 42 7 05/26/20 a. Phương pháp Mohr
Ví dụ: Chuẩn độ Cl- với CCT fluorescein - Điều kiện: N N G - Trước ĐTĐ: Cl- còn G
+ Tính toán lượng CCT cần dùng để kết tủa đỏ gạch U U Y Y Ễ Ễ
xuất hiện tại ĐTĐ hoặc lân cận ĐTĐ với ss = 0,1% N
+ dung dịch có màu của CCT ở dạng tự do N X X U U
+ Môi trường chuẩn độ: 6,5 < pH < 8,5 Â
+ tạo thành hệ keo âm AgCl/NaCl  N N T T
+ Trong dung dịch không chứa Pb2+ và Ba2+ R {[(mAgCl)nCl-, (n-x)Na+]xNa+} R Ư Ư Ờ Ờ
+ Không dùng để định phân ion I- và SCN- N - Sau ĐTĐ: Ag+ dư N G G – – A
+ tạo thành hệ keo dương AgCl/NaNO A N 3 N A A C
{[(mAgCl)nAg+, (n-x)NO -]xNO -} C H 3 3 H E E M
+ kết tủa hấp phụ anion của CCT làm thay đổi màu sắc M – – S của CCT S C C E E – – H H U U S S T T 43 46 43 46 b. Phương pháp Volhard
- Dùng chất chỉ thị tạo phức có màu đặc trưng để xác định ĐTĐ
- Xác định I-, Br-, SCN- với CCT Fe3+ + Phản ứng chỉ thị:
Fe3+ + SCN- ⇌ FeSCN2+đỏ máu
SCN- chuẩn độ trực tiếp; I-, Br- chuẩn độ ngược - Điều kiện:
+ Môi trường axit (thường dùng HNO3 > 0,3 M)
+ Khi xác định I- cần cho Ag+ dư trước rồi mới cho
CCT Fe3+ để tránh phản ứng: 2Fe3+ + 2I- ⇌ 2Fe2+ + I2
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 44 44 c. Phương pháp Fajans
- Xác định Cl-, I-, Br- hay SCN- dùng chất chỉ thị hấp phụ.
- CCT hấp phụ là những axit hoặc bazơ hữu cơ
yếu, trong dung dịch có thể phân ly thành ion.
Màu dạng ion của CCT hấp phụ khi ở trạng thái
tự do khác với màu khi nó bị hấp phụ lên bề mặt
kết tủa. Ví dụ: fluorescein, eosin - Điều kiện:
+ Môi trường 6,5 < pH < 8,5
NGUYỄN XUÂN TRƯỜNG – ANACHEM – SCE – HUST 45 45 8



