

Preview text:
Quá trình &*Thiết bị
Công nghệ Hoá học III
QUÁ*TRÌNH*&*THIẾT*BỊ*CHUYỂN*KHỐI
Chương 4: Quá trình trích ly
Giảng viên:)Nguyễn Minh)Tân
Bộ môn QT7TB)CN)Hóa học &)Thực phẩm
Trường Đại học Bách khoa Hà Nội tan.nguyenminh@hust.edu.vn
Chương 2: Quá trình trích ly
1. Các khái niệm chung
Trích ly là quá trình tách một hoặc
một số chất tan trong chất lỏng hay
trong chất rắn bằng một chất lỏng khác gọi là dung môi
(1) Nếu quá trình tách chất hoà tan
trong chất lỏng bằng một chất lỏng
khác thì gọi là trích ly lỏng -lỏng (solven extraction)
(2) Nếu quá trình tách chất hoà tan trong chất rắn bằng một chất lỏng
khác thì gọi là trích ly rắn-lỏng (solid liquid extraction or leaching)
(3) Nếu quá trình tách chất hoà tan trong chất rắn bằng một chất ở tình
trạng siêu tới hạn thì gọi là trích ly siêu tới hạn (supercritical extraction) 1
Chương 2: Quá trình trích ly
1. Các khái niệm chung Trích ly lỏng-lỏng (liquid liquid extraction) Ví dụ
Chương 2: Quá trình trích ly
1. Các khái niệm chung Ví dụ
Sản$phẩm$đang$giao$dịch$trên$thị$trường$thế$giới
Bột Chlorogenic tự nhiên chiết từ café$tươi
Natural'Chlorogenic Acide Green'Coffee'Extract
https://www.alibaba.com/product-detail/Natural-Chlorogenic-Acid-Green-Coffee-
Extract_60335372011.html?spm=a2700.7735675.30.36.CShxao&s=p 2
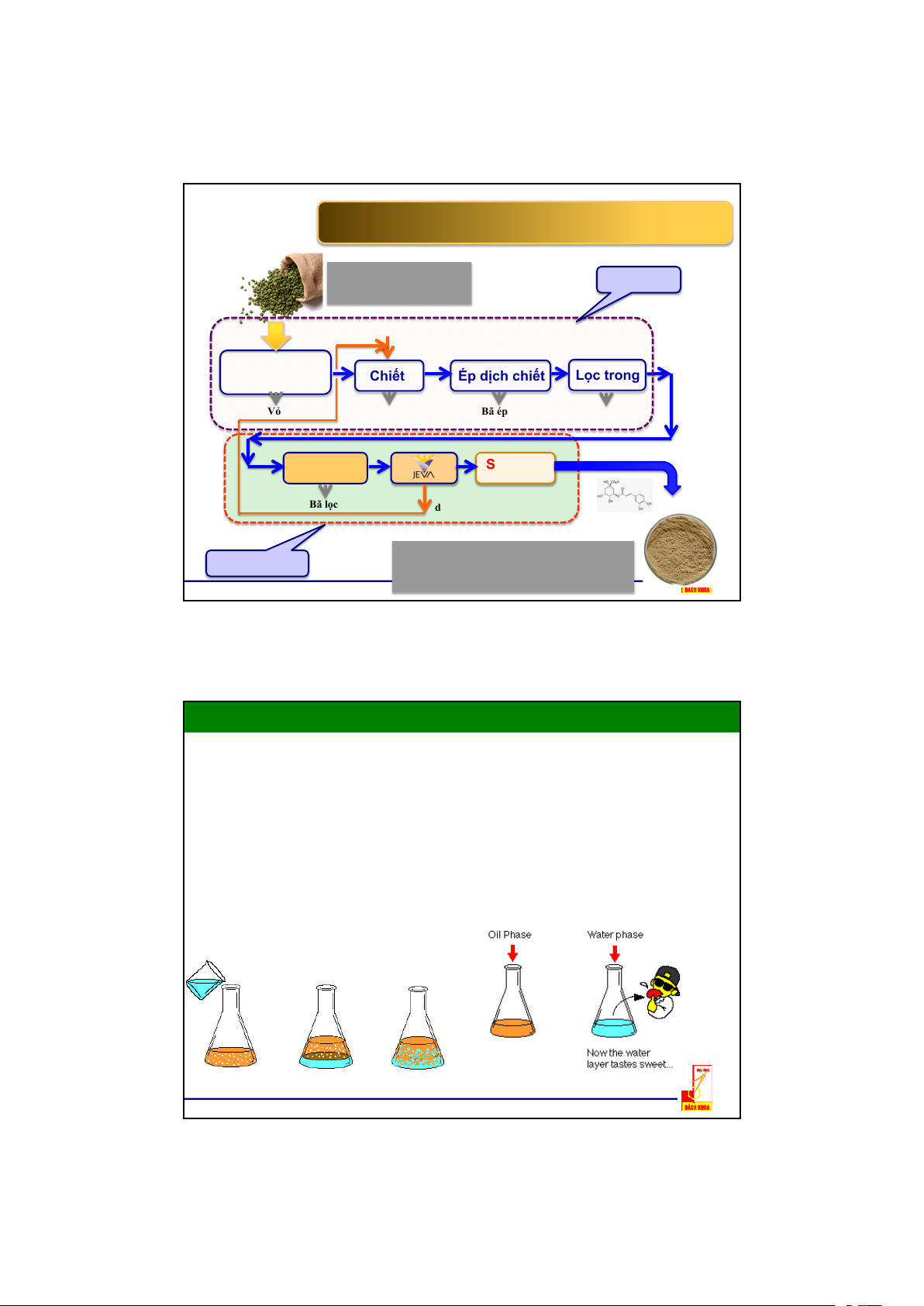
DÂY CHUYỀN CÔNG NGHỆ SẢN XUẤT BỘT CHLOROGENIC
TỪ CHẠT CAFE TƯƠI ỨNG DỤNG CÔNG NGHỆ JEVA Nguyên liệu Tiền 4 Dung môi Tách vỏ, Chiết Ép dịch chiết Lọc trong Vỏ Hạt Bã ép Bã lọc Lọc Nano Sấy phun Dịch ngưng Bã lọc dung môi Sản phẩm Chế 55,360%
Chương 2: Quá trình trích ly
1. Các khái niệm chung
Quá trình trích ly được sử dụng rất rộng rãi trong nhiều ngành công
nghiệp, đặc biệt là công nghiệp hoá học và thực phẩm với Mục đích: - Tách các cấu tử quý.
- Thu được dung dịch có nồng độ đậm đặc (đối với trích ly lỏng - lỏng)
- Cũng như chưng luyện nó là một trong những phương pháp
chủ yếu để phân tách một hỗn hợp đồng nhất thành các cấu tử thành phần. 3
Chương 2: Quá trình trích ly
1. Các khái niệm chung
Khi nào dùng Trích ly ? Khi cần:
•"Tách các chất từ dung dịch loãng với dung môi là nước
•"Tách các hợp chất phân cực hoặc axit/bazơ từ các hỗ hợp hữu cơ
•"Các sản phẩm không bền nhiệt
•"Tinh chế các vật liệu không bay hơi
•"Xử lý hỗn hợp đẳng phí và hỗn hợp có các cấu tử có nhiệt độ sôi gần nhau
•"Tránh sử dụng phương pháp chưng cất do"có chi phí cao
Chương 2: Quá trình trích ly
1. Các khái niệm chung
Khi nào dùng Trích ly ? Khi cần:
•"Tách các chất từ dung dịch loãng với dung môi là nước
•"Tách các hợp chất phân cực hoặc
axit/bazơ từ các hỗ hợp hữu cơ
•"Các sản phẩm không bền nhiệt
•"Tinh chế các vật liệu không bay hơi
•"Xử lý hỗn hợp đẳng phí và hỗn hợp
có các cấu tử có nhiệt độ sôi gần nhau
•"Tránh sử dụng phương pháp chưng cất do"có chi phí cao www.modularprocess.com 4
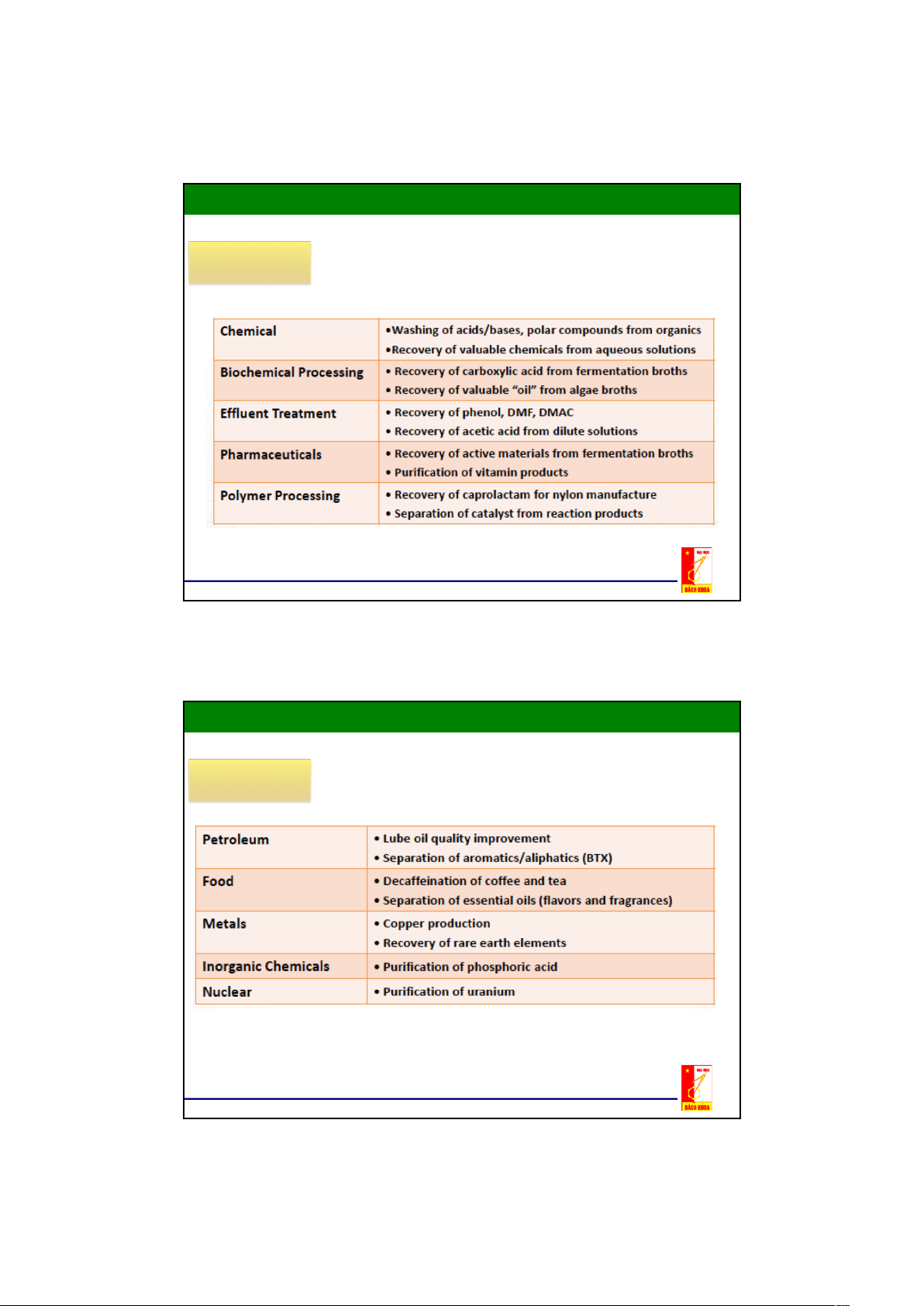
Chương 2: Quá trình trích ly
1. Các khái niệm chung Ứng dụng www.modularprocess.com
Chương 2: Quá trình trích ly
1. Các khái niệm chung Ứng dụng www.modularprocess.com 5
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.1. Sơ đồ nguyên tắc Trích ly Lỏng – Lỏng
Quá trình trích ly Lỏng –Lỏng gồm ba giai đoạn :
- Giai đoạn trộn lẫn dung dịch đầu (gồm dung môi đầu L và
cấu tử cần tách M) với dung môi thứ G. Cấu tử phân bố (cấu tử cần
tách ) M sẽ di chuyển từ dung dịch vào dung môi thứ cho đến khi đạt
được cân bằng giữa hai pha .
- Giai đoạn tách hai pha ra. Hai pha này phân thành lớp nên
tách ra rất dễ dàng ,một pha gồm dung môi thứ G và cấu tử phân bố
M, gọi là dung dịch trích (E). Một pha gồm dung môi đầu L và một
ít cấu tử phân bố còn lại, gọi là raphinát (R). Thường thì các cấu tử
trong dung dịch đầu và trong dung môi thứ có hoà tan 1 phần vào
nhau nên mỗi pha tối thiểu gồm ba cấu tử
- Giai đoạn hoàn nguyên dung môi : tách cấu tử ra khỏi dung môi
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.1. Sơ đồ nguyên tắc Trích ly Lỏng – Lỏng 6
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.1. Sơ đồ nguyên tắc Trích ly Lỏng – Lỏng www.modularprocess.com
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.1. Sơ đồ nguyên tắc Trích ly Lỏng – Lỏng
So sánh việc tách một hỗn hợp lỏng đồng nhất bằng phương pháp
trích ly và bằng phương pháp chưng luyện
1 - Trích ly được tiến hành ở nhiệt độ thường nên thích hợp
với những chất dễ bị phân huỷ ở nhiệt độ cao .
2 - Có thể tách được những dung dịch đẳng phí và những
dung dịch có độ bay hơi tương đối rất gần nhau
3 - Với những dung dịch quá loãng thì dùng trích ly sẽ tiết kiệm hơn
4 – Quá trình trích ly phức tạp hơn 7
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.1. Sơ đồ nguyên tắc Trích ly Lỏng – Lỏng
Chương 2: Quá trình trích ly
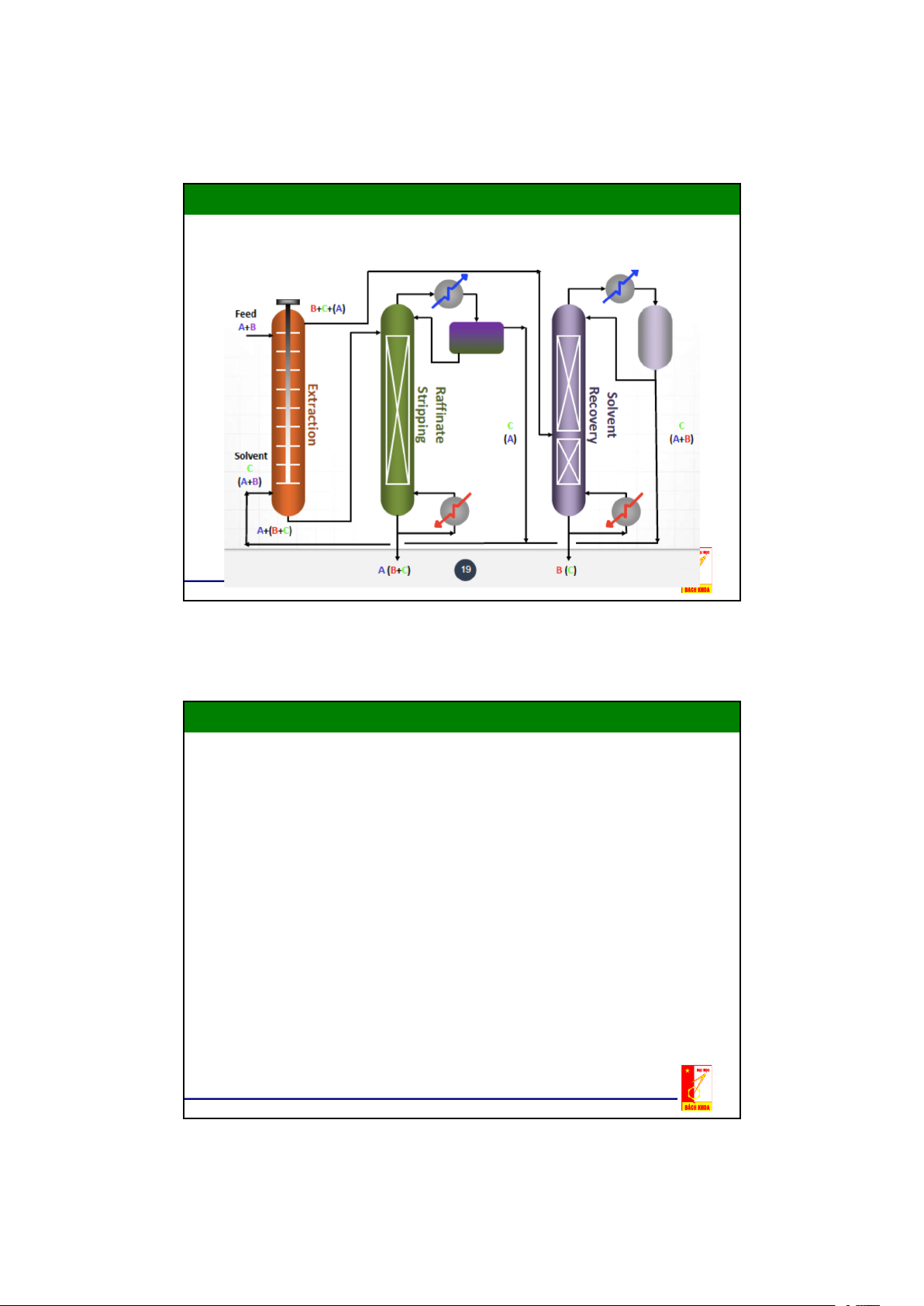
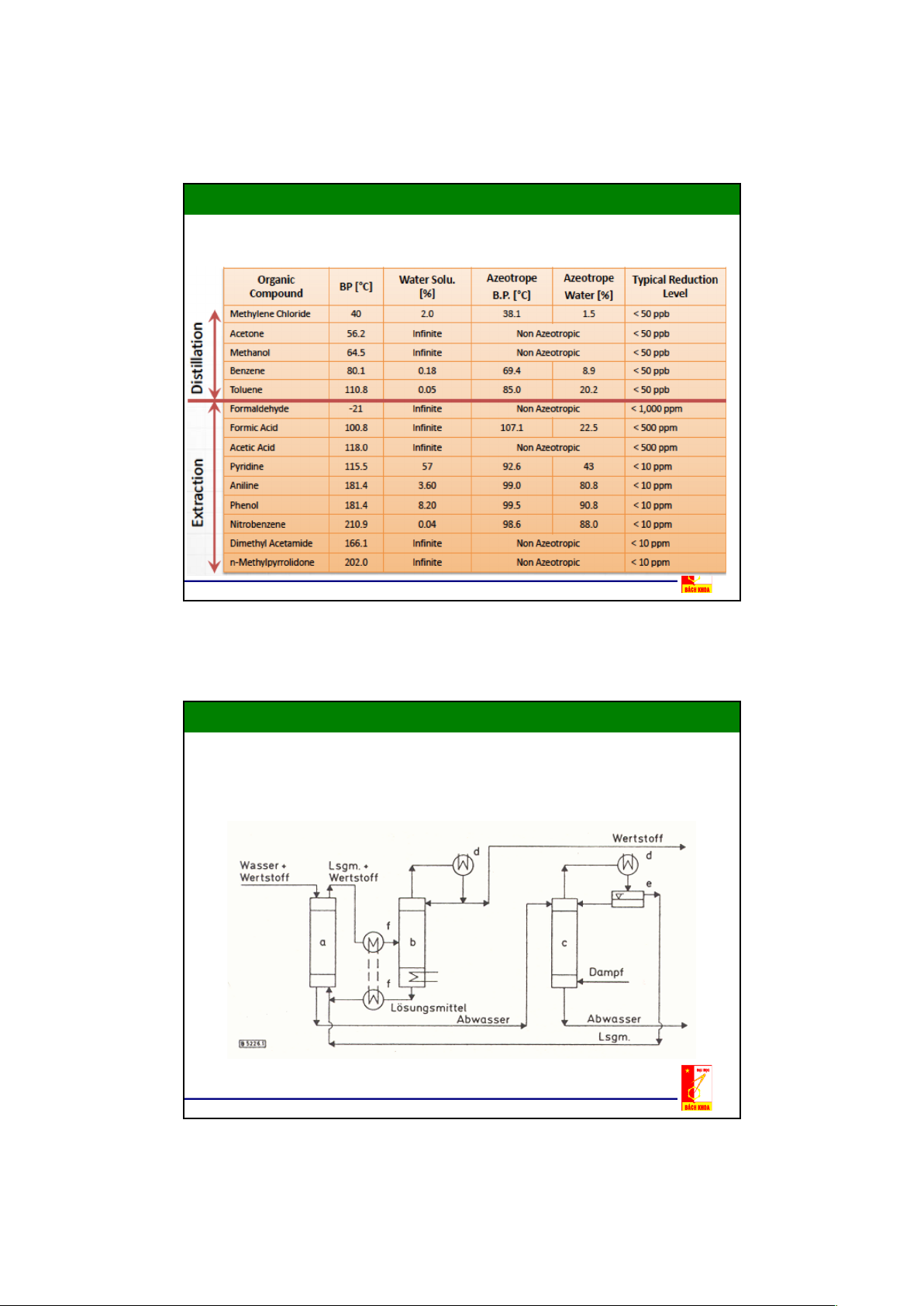
2. Trích ly Lỏng – Lỏng
Để bay hơi 1.kg.nước (55,5.mol),.mất 2257.kJ,.cho 1.kg.butyl axetat (Kp.
126 C,.8,6.mol).chỉ 309,4.kJ,.khoảng 14%.giá trị cho Nước,.và cho 1.kg.
toluen (Kp.110. C,.10,9.mol).356.kJ,.chiếm khoảng 16%.giá trị của nước
a"Thiết bị trích ly,.b"Dung.môi/Tháp tách cấu tử quý,.c"Tháp rửa,.
d"Thiết bị ngưng tụ,.e Thiết bị phân ly,.f"Thiết bị trao đổi nhiệt 8
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
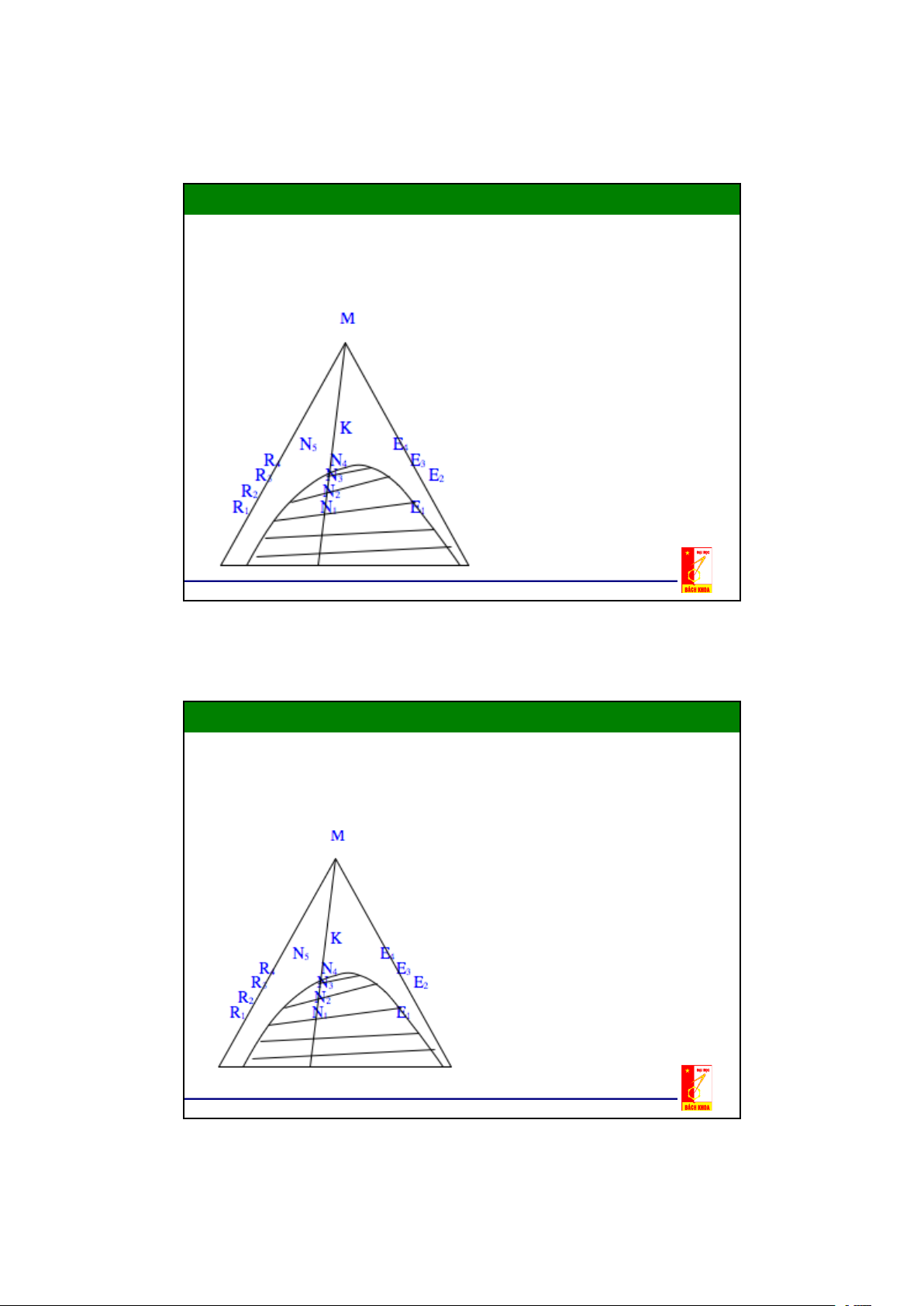
2.2. Cân bằng pha trong hệ lỏng – lỏng Định luật phân bố
- Trạng thái cân bằng trong hệ lỏng - lỏng được xác định bằng thế hoá
của chất hoà tan trong cả hai pha
- y*, x là nồng độ cân bằng của cấu tử phân bố trong dung dịch trích và trong raphinát y* m = m: hệ số phân bố x
- Đối với dung dịch thực thì m phụ thuộc vào nồng độ:
y* = f(x) là một đường cong , m được xác định bằng thực nghiệm
- Trường hợp đơn giản nhất là m = const. Khi đó m chỉ phụ thuộc vào
nhiệt độ và ít phụ thuộc vào nồng độ.
- Nhiều trường hợp tuy rằng nồng độ của cấu tử phân bố rất bé nhưng
sự phụ thuộc cân bằng lại rất phức tạp do có sự tác dụng hoá học của
cấu tử phân bố với dung môi ,hay do hiện tượng hydrat hoá ,solvat
hoá ... Do đó sự phụ thuộc cân bằng y* = f(x) là đường cong.
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
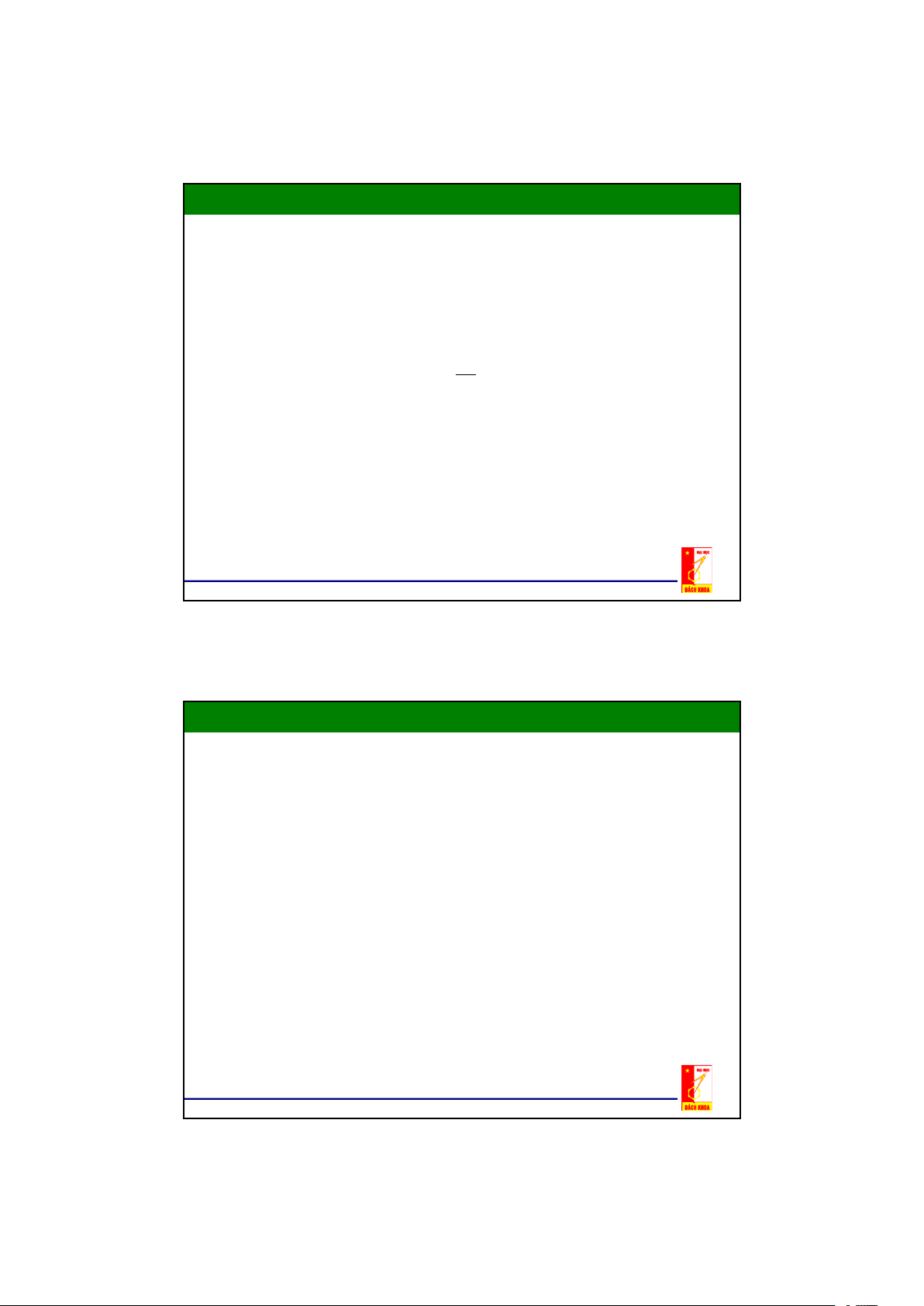
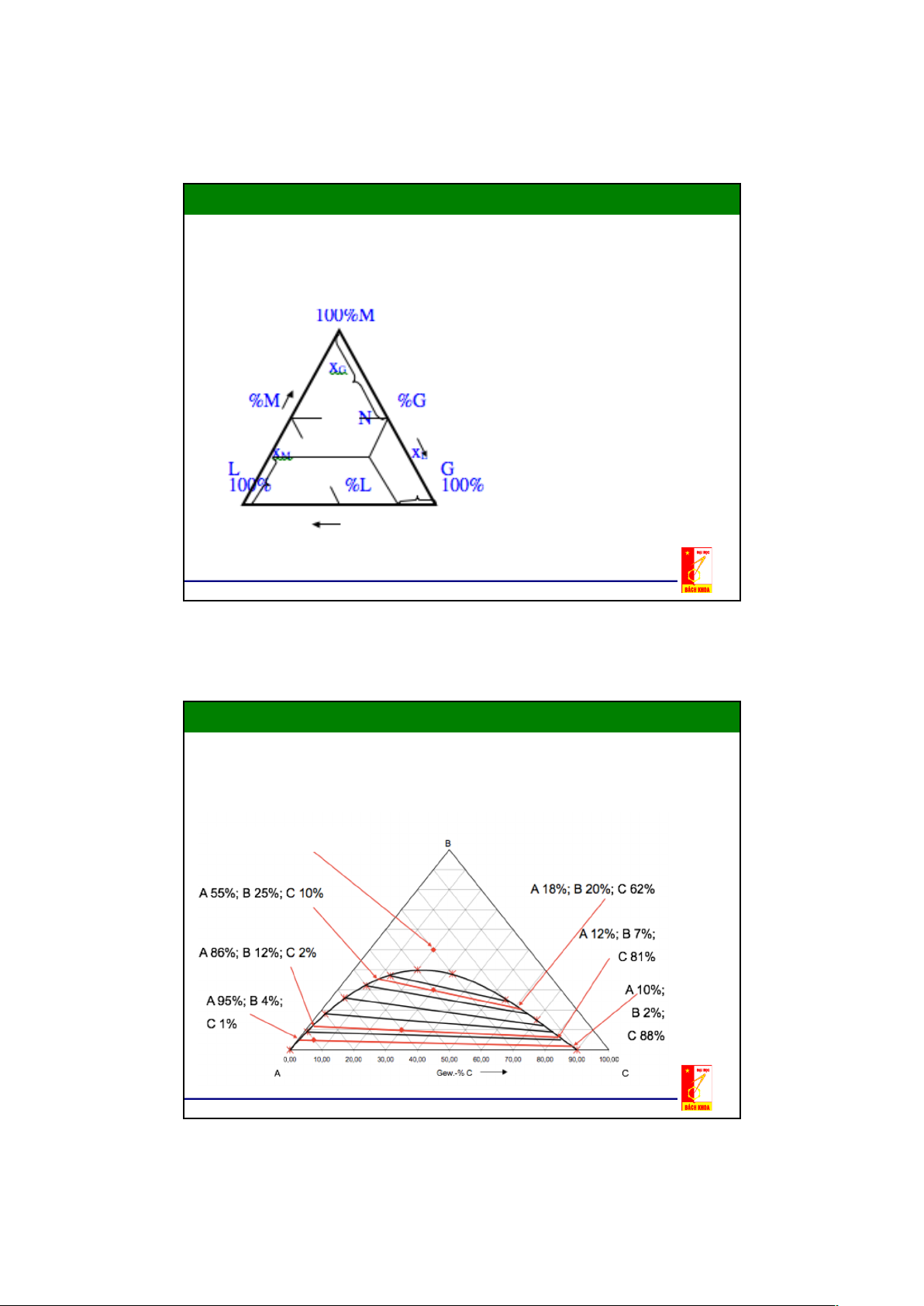
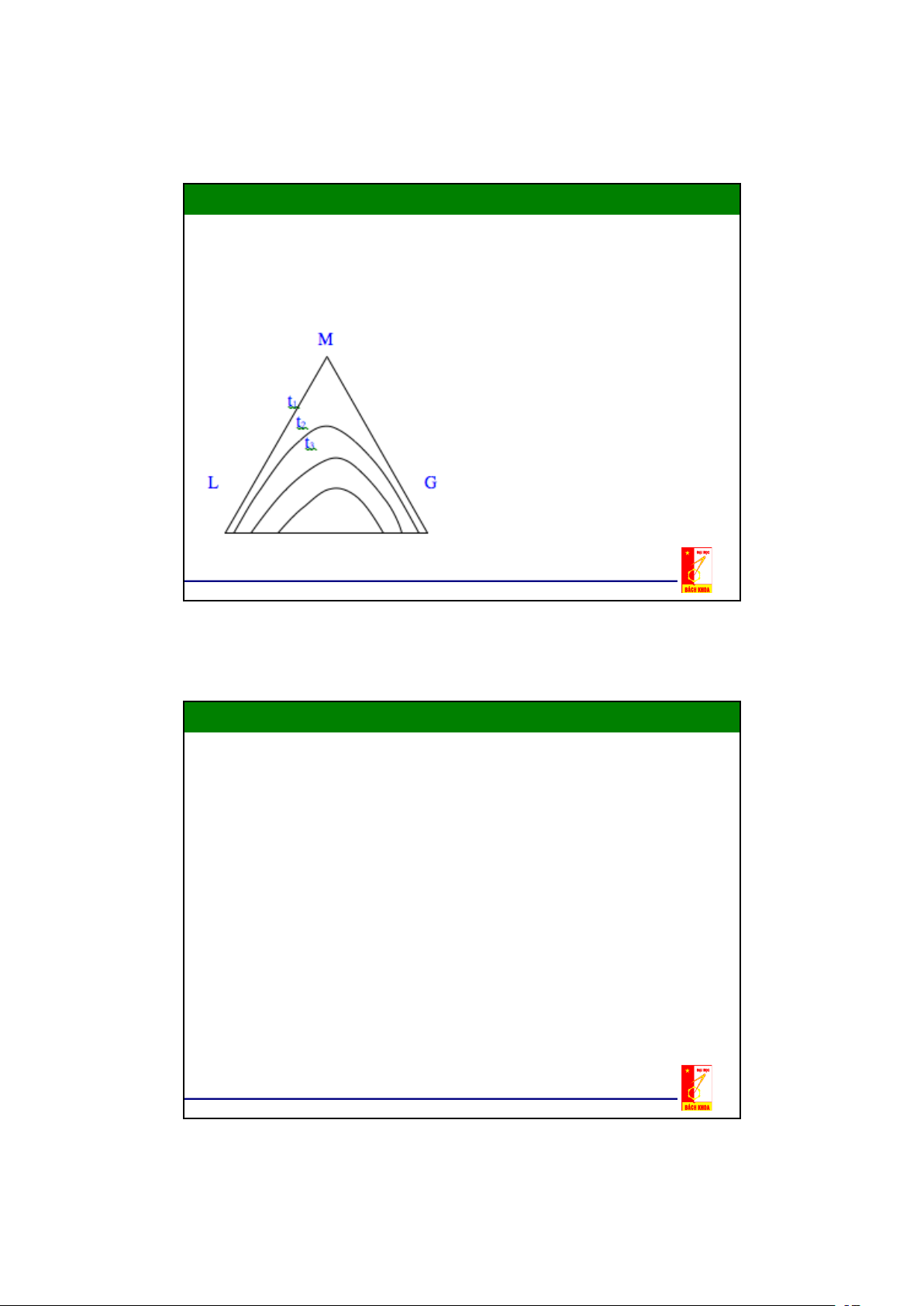
2.2. Cân bằng pha trong hệ lỏng – lỏng Đồ thị tam giác
- Nếu dung môi đầu L và dung môi thứ G hoà tan một phần vào nhau
thì khi trích ly mỗi pha sẽ là một dung dịch gồm ba cấu tử ,nên thành
phần của nó không thể biểu diễn trên đồ thị đề các y-x được
- Thuận tiện nhất là biểu diễn trên hệ toạ độ tam giác đều.
- Trên các đỉnh của tam giác biểu diễn cấu tử phân bố (cấu tử cần
tách) M, dung môi đầu L, dung môi thử G tinh khiết 100%.
- Mỗi điểm nằm trên các cạnh của tam giác đều biểu diễn thành phần
của dung dịch hai cấu tử.
- Mỗi điểm nằm trong tam giác đều biểu diễn thành phần của dung dịch 3 cấu tử. 9
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng Đồ thị tam giác Ví dụ điểm N xG = 50% xL = 20% xM =30%
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng Đồ thị tam giác Vùng 1 pha 10
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
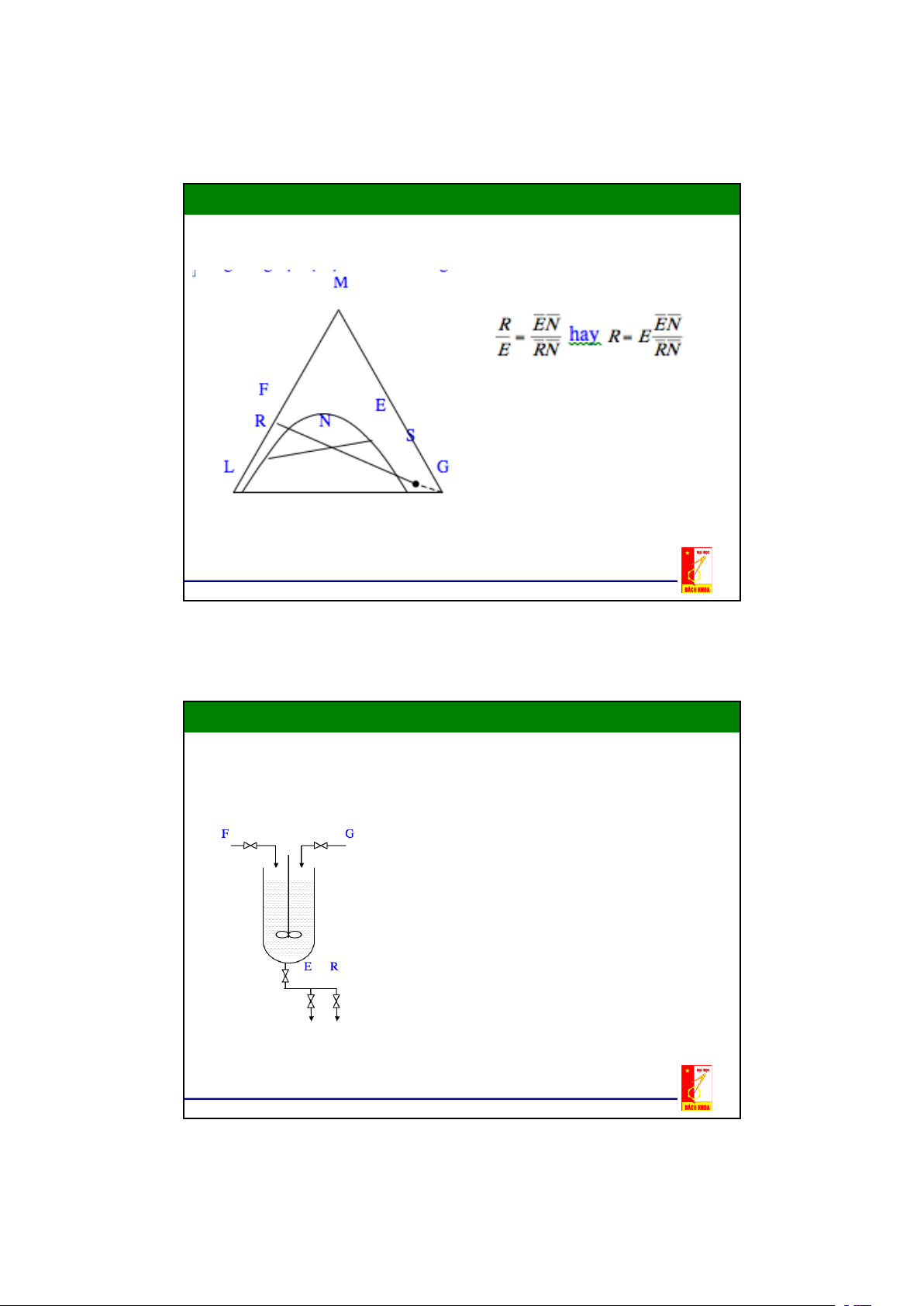
2.2. Cân bằng pha trong hệ lỏng – lỏng Đồ thị tam giác Quy tắc tỷ lệ:
Điểm hỗn hợp N trong đồ thị tam giác - khi
phân thành hai pha : pha trích E và pha
raphinát R . Theo quy tắc đòn bẩy thì:
- Các điểm N,R,E cùng nằm trên 1 đường
thẳng trong đồ thị tam giác.
- Điểm N chia R và E theo tỷ lệ:
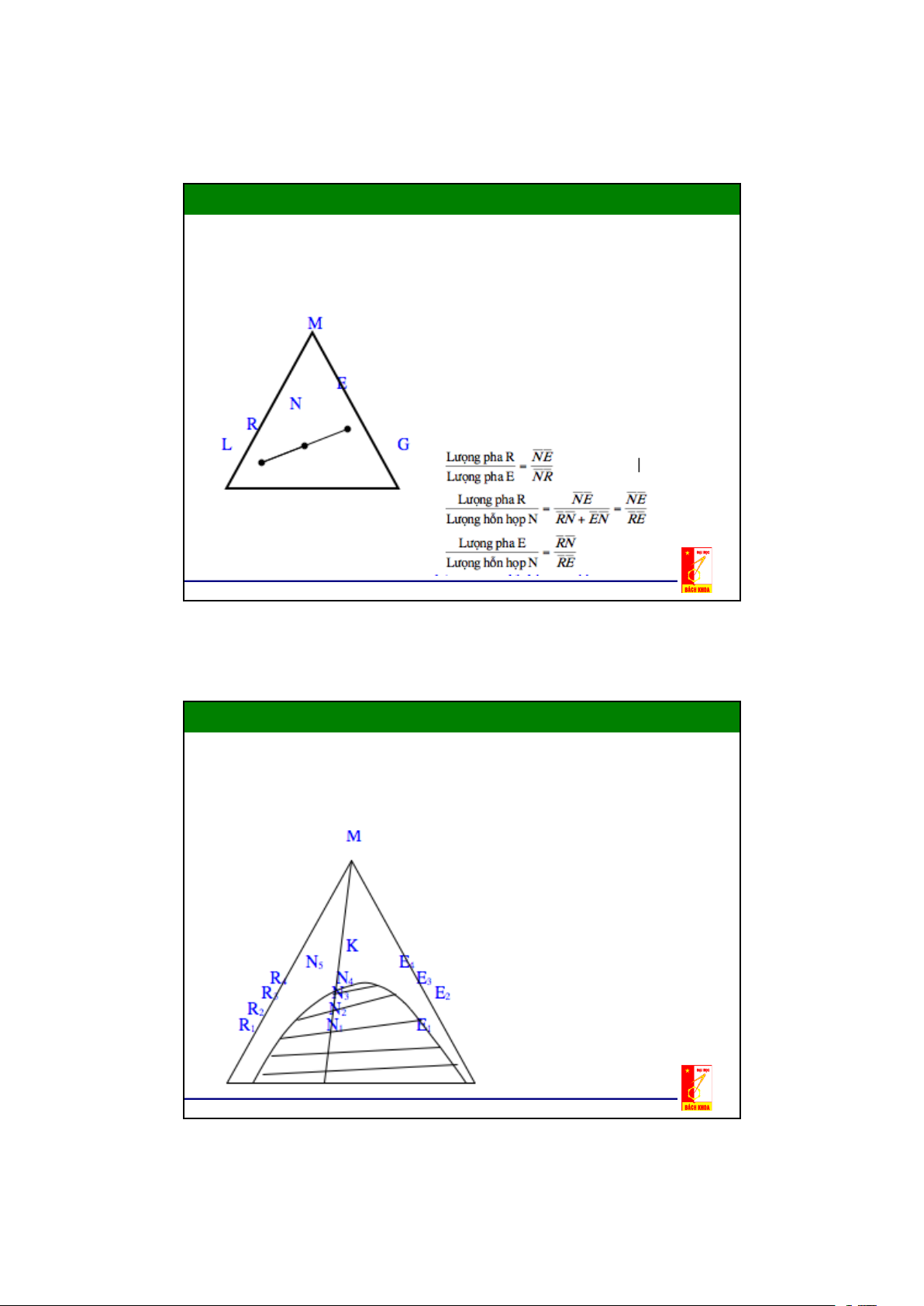
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
Đường cân bằng trong đồ thị tam giác- Đồ thị tam giác có thể dùng
để biểu diễn trạnh thái cân
bằng của hệ ba cấu tử như cấu
tử phân bố M ,dung môi đầu L,
dung môi thứ G. - Để thu được
đường cong cân bằng, xét quá
trình thêm cấu tử phân bố M
vào hỗn hợp không đồng nhất của hai dung môi L và G:
Giả sử M hoà tan hạn chế
trong cả L và G ,còn bản thân L
và G cũng hoà tan hạn chế vào nhau 11
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
Đường cân bằng trong đồ thị tam giác
M và L, cũng như M và G tạo thành một
dung dịch đồng nhất 2 cấu tử (thành
phần được đặc trưng bằng các điểm trên các cạnh LM và GM)
Dung môi L và G chỉ tạo thành
những dung dịch đồng nhất chỉ
trên đoạn nhỏ LR và EG.
Một hỗn hợp bất kỳ trên đoạn
RE đều phân thành hai lớp:
dung dịch bão hoà 2 cấu tử
R(dung dịch bão hoà G ở trong
L) và E (dung dịch bão hoà L trong G )
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
Đường cân bằng trong đồ thị tam giác
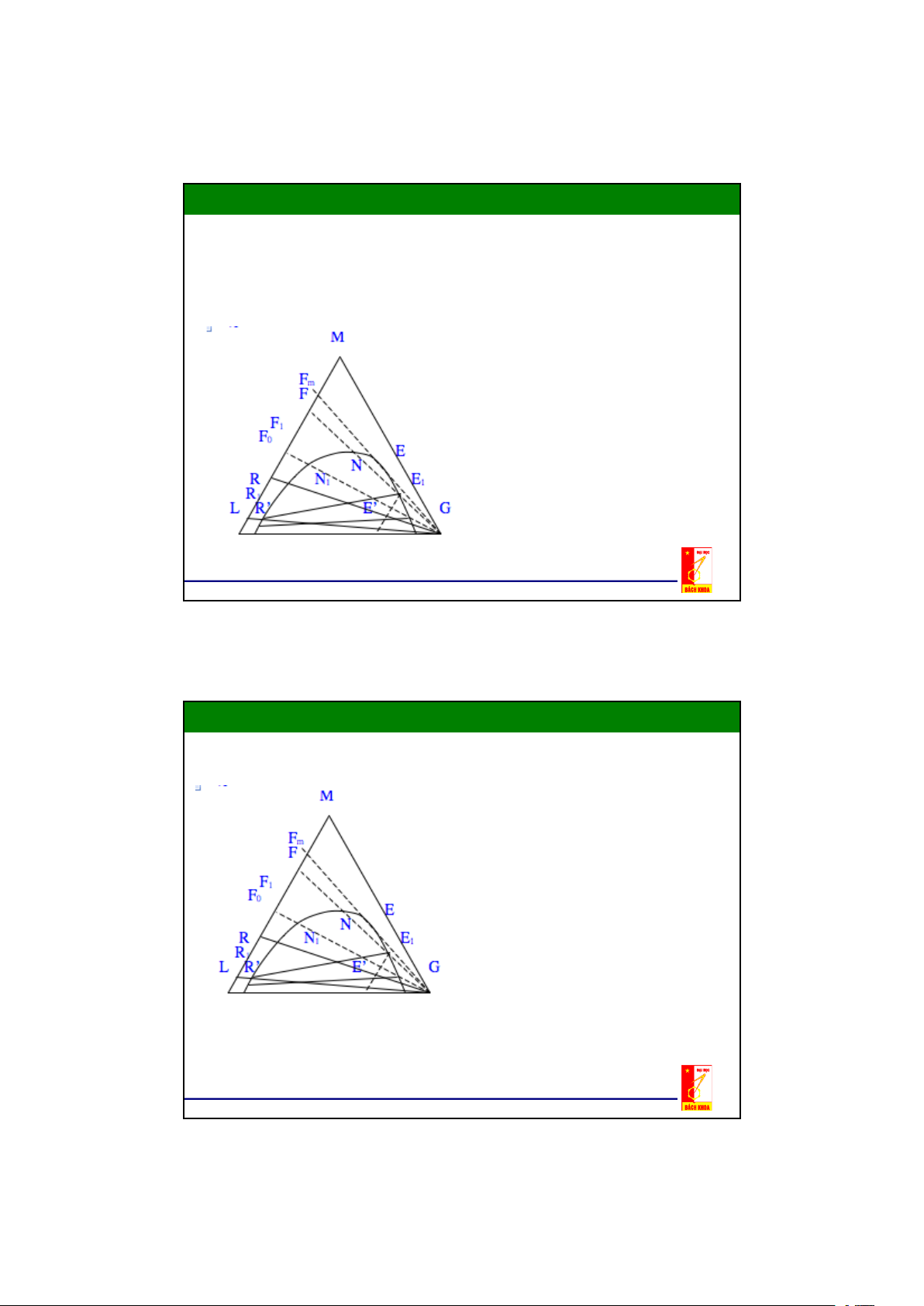
Lượng các dung dịch bão hoà
phụ thuộc vị trí của điểm N được
xác định theo quy tắc đòn bẩy.
Khi thêm cấu tử phân bố M vào
hỗn hợp có thành phần tại N thu
được hỗn hợp 3 cấu tử N1 nằm trên đoạn thẳng MN.
Hỗn hợp N1 là hỗn hợp không
đồng nhất nên phân thành hai pha
(2 lớp) có nồng độ cân bằng là
R1 (pha của dung môi L) và E1
(pha của dung môi G) với tỷ lượng E1N1 : R1N1. 12
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
Đường cân bằng trong đồ thị tam giác
Khi thêm tiếp cấu tử phân bố M
vào hỗn hợp N1, thu được hỗn
hợp 3 cấu tử có thành phần biểu
diễn ở N2,N3,...và cũng như trên
ta thu được các pha bão hoà R2E2; R3E3;…
Nếu cứ tiếp tục thêm cấu tử phân
bố vào hỗn hợp không đồng nhất
N4 đến hỗn hợp N5 thì pha R5 biến mất
Nếu tiếp tục thêm cấu tử M vào
hỗn hợp không đồng nhất N5 thì
sẽ thu được 1 hỗn hợp đồng nhất 3 cấu tử
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
Đường cân bằng trong đồ thị tam giác Nối tất cả các điểm
RR1R2......K......E2E1E được đường
cong cân bằng . Nhánh RR1R2....K là
đặc trưng cho các thành phần cân bằng
của dung môi đầu L (Raphinát), nhánh
K....E2E1E là đặc trưng cho thành
phần cân bằng của dung môi thứ G (dung dịch trích)
K là điểm tới hạn - tại đó cả hai pha
đồng thời biến mất hay xuất hiện .
Các điểm nằm trong đường cong
cân bằng là hệ dị thể, ngoài đường
cong cân bằng là hệ đồng thể 13
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
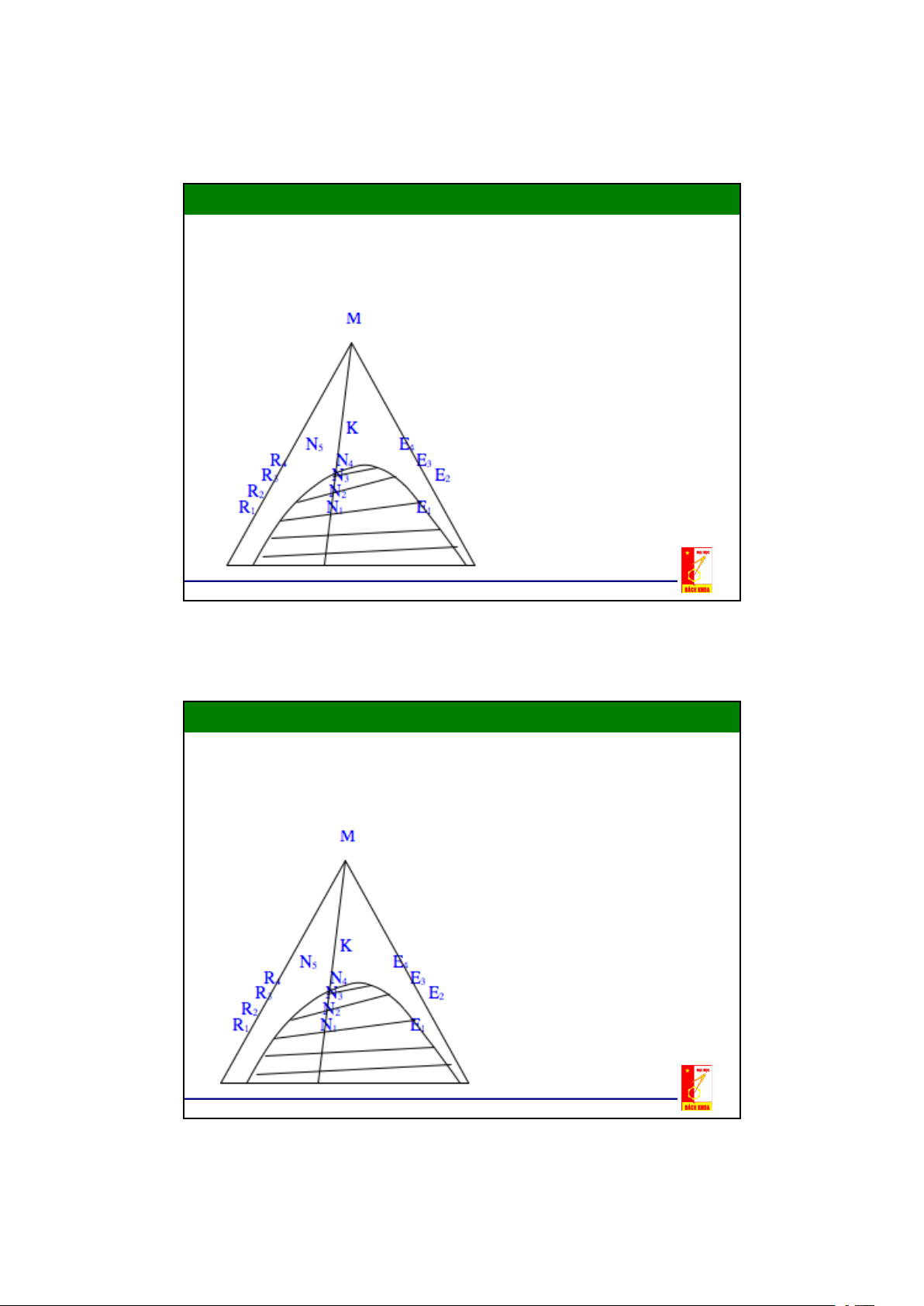
Đường cân bằng trong đồ thị tam giác
- Quá trình trích ly chỉ có thể thực
hiện được đối với các hỗn hợp nằm
trong đường cong cân bằng
- Các đường R1E1; R2E2;.... là các đường liên hợp
- Nhờ đồ thị, dễ dàng xác định được hệ
số phân bố m của định luật phân bố đối
với từng cặp dung dịch:
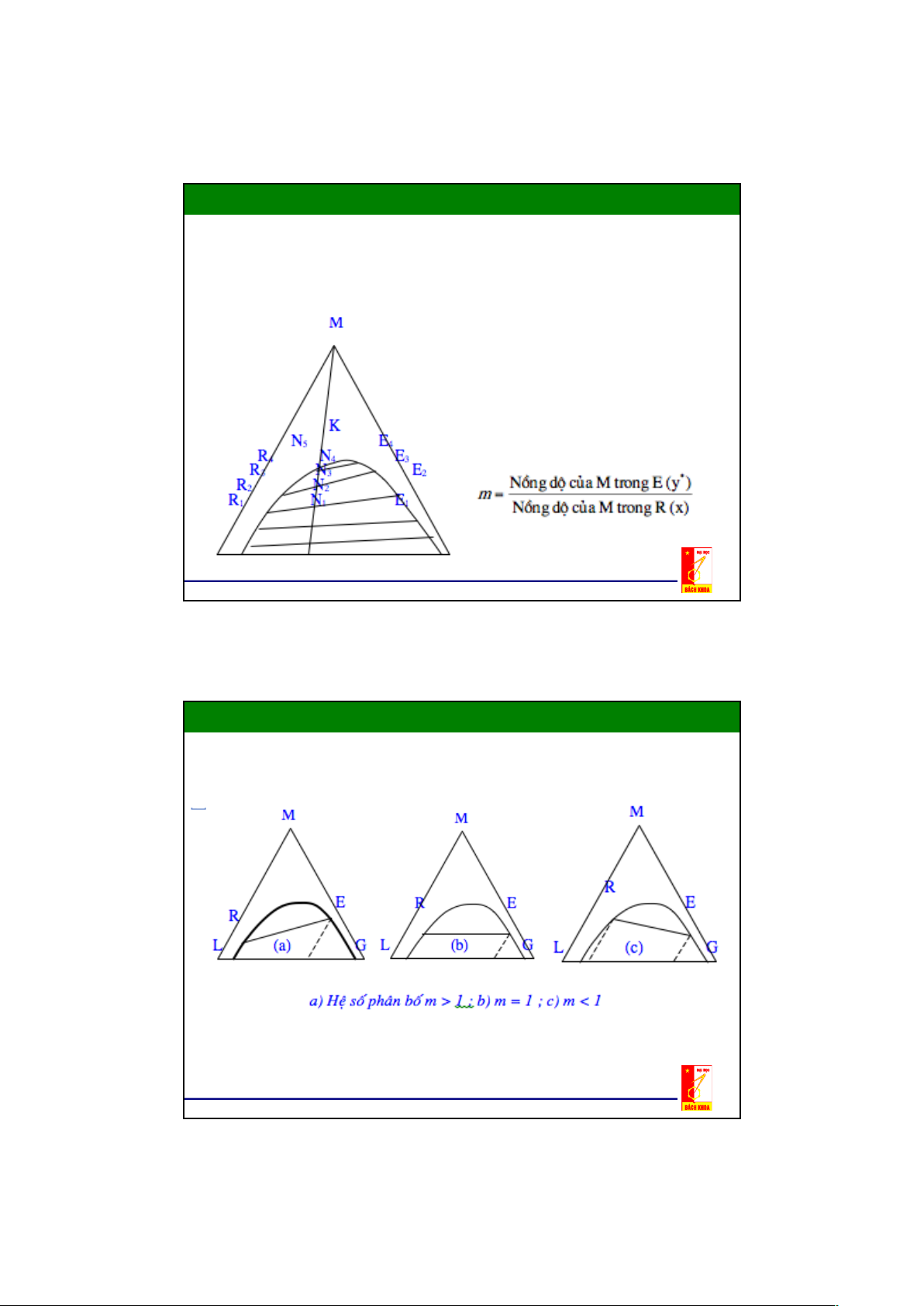
m có thể lớn hơn hoặc bằng 1 hay m <1
phụ thuộc vào bản chất của các dung
môi L,G và cấu tử phân bố M.
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
Đường cân bằng trong đồ thị tam giác
- Quá trình trích ly càng có hiệu quả khi m càng lớn hơn 1
- Nếu m nhỏ hơn hay bằng 1 thì không thể tiến hành quá trình trích ly được 14
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
Ảnh hưởng của nhiệt độ lên quá trình trích ly
Nhiệt độ có ảnh hưởng đến kích thước của vùng dị thể. Khi nhiệt độ
càng tăng thì kích thước của vùng dị thể càng bé
- Tuỳ theo từng loại dung dịch mà khi
tăng nhiệt độ đến một giới hạn nào đó
thì kích thước của vùng dị thể biến mất.
- Ngoài ra khi giảm nhiệt độ thì độ
nhớt của dung dịch tăng, làm giảm tốc độ khuếch tán
- Bởi vậy, tuỳ theo từng trường hợp cụ
thể để chọn nhiệt độ thích hợp
Trích ly lỏng-lỏng thường được tiến hành ở nhiệt độ của môi trường.
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.2. Cân bằng pha trong hệ lỏng – lỏng
Ảnh hưởng của độ dốc đường liên hợp lên quá trình trích ly
- Hệ số phân bố k càng lớn, quá trình trích ly càng tốt
- Đường liên hợp càng dốc thì khả năng phân tách của dung môi tương ứng càng tốt 15
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.3. Nguyên tắc trích ly
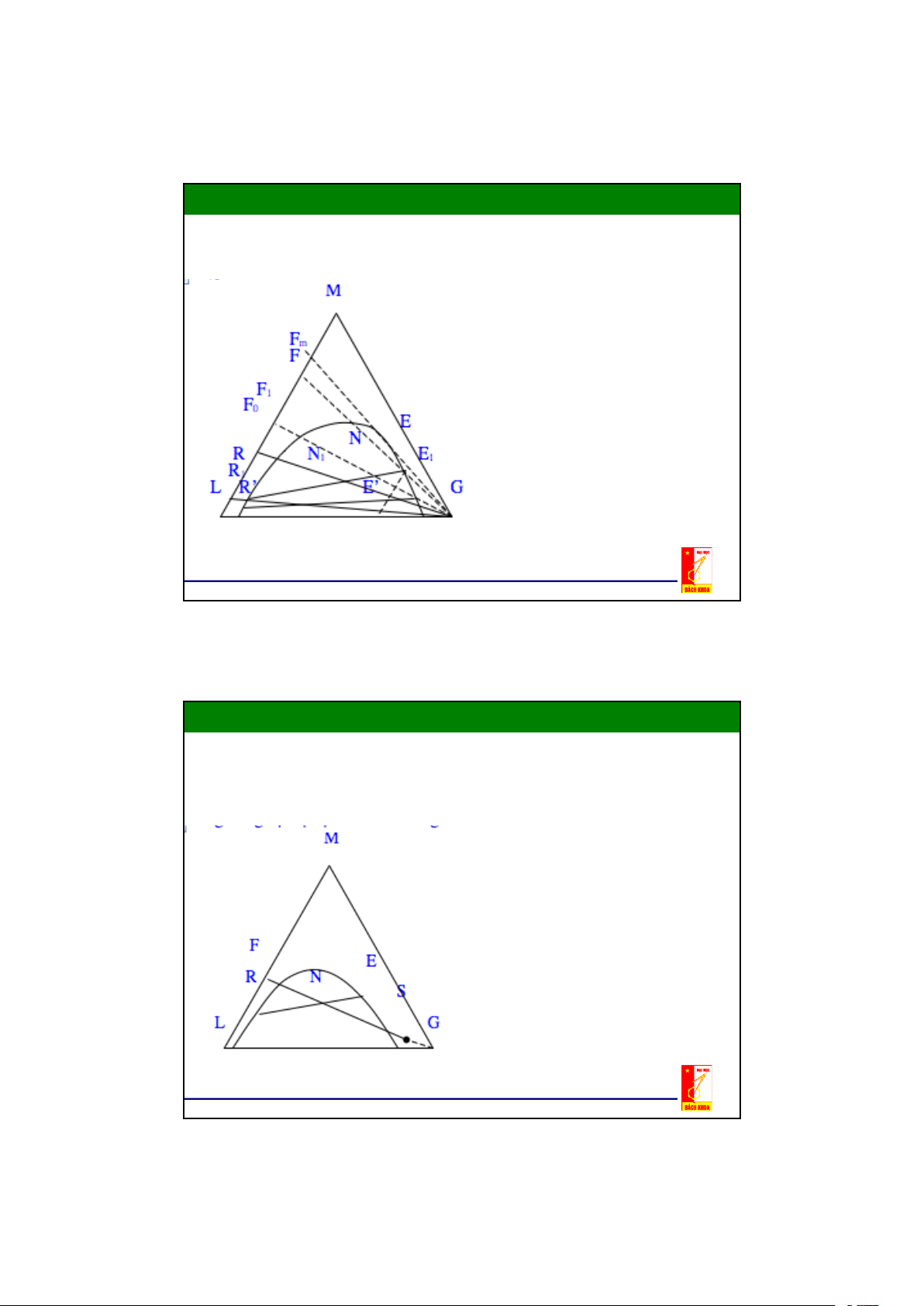
Hỗn hợp 2 cấu tử L và M hoàn toàn tan lẫn vào nhau, ta có thể tách
chúng ra khỏi nhau bằng phương pháp trích ly nếu chọn được dung môi thứ G thích hợp .
- Dung môi đầu L hoà tan hạn chế trong dung môi thứ.
- Cấu tử cần tách (cấu tử phân bố)
M hoà tan hoàn toàn trong dung
môi đầu và trong dung môi thứ
- Hỗn hợp đầu gồm hai cấu tử L và
M có thành phần biểu diễn ở F0
- Nếu thêm dung môi thứ G vào
F0,ta được 1 hỗn hợp 3 cấu tử
(thành phần của hỗn hợp N này
được biểu diễn ở điểm nào đấy
nằm trên đường thẳng F0G phụ
thuộc vào tỷ lượng G/F0.
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.3. Nguyên tắc trích ly
- Hỗn hợp N là hỗn hợp dị thể , không
hoà tan vào nhau, phân thành 2 lớp
- Pha E gồm hầu hết là G, một phần L
và M. Pha R gồm hầu hết là L , một phần G và M.
- Nồng độ của cấu tử cần tách trong
pha E là EE' lớn hơn trong pha raphinát là RR’.
- Tìm cách tách Raphinát R ra khỏi
dung dịch trích E (thường bằng
phương pháp gạn), rồi thêm dung môi
thứ G vào R, được 1 hệ 3 cấu tử mới có thành phần ở N1. 16
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.3. Nguyên tắc trích ly
- Cũng như trên hỗn hợp N1 là hỗn
hợp không đồng nhất sẽ phân
thành 2 pha (2 lớp): pha Raphinát R1 và dung dịch trích E1
- Thành phần của dung môi đầu L
trong R1 lớn hơn trong R và nếu
tiếp tục làm như thế và tìm cách
tách dung môi thứ ra khỏi raphinát
thì cuối cùng thu được raphinát
gồm hầu hết là dung môi đầu.
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.4. Cân bằng vật liệu của quá trình trích ly
- Cân bằng vật liệu của quá trình
trích ly cũng chính là phương trình
cân bằng vật liệu chung của quá
trình chuyển khối ở dạng vi phân hay tích phân
- Trường hợp dung môi đầu L ,
dung môi thứ G hoà tan một phần
vào nhau thì giá trị của chúng
không phải là hằng số theo chiều
cao của thiết bị, tỷ số G/L là đại
lượng biến đổi , tức là đường nồng
độ làm việc của quá trình trích ly
lỏng - lỏng trong hệ toạ độ đề các là đường cong . 17
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.4. Cân bằng vật liệu của quá trình trích ly
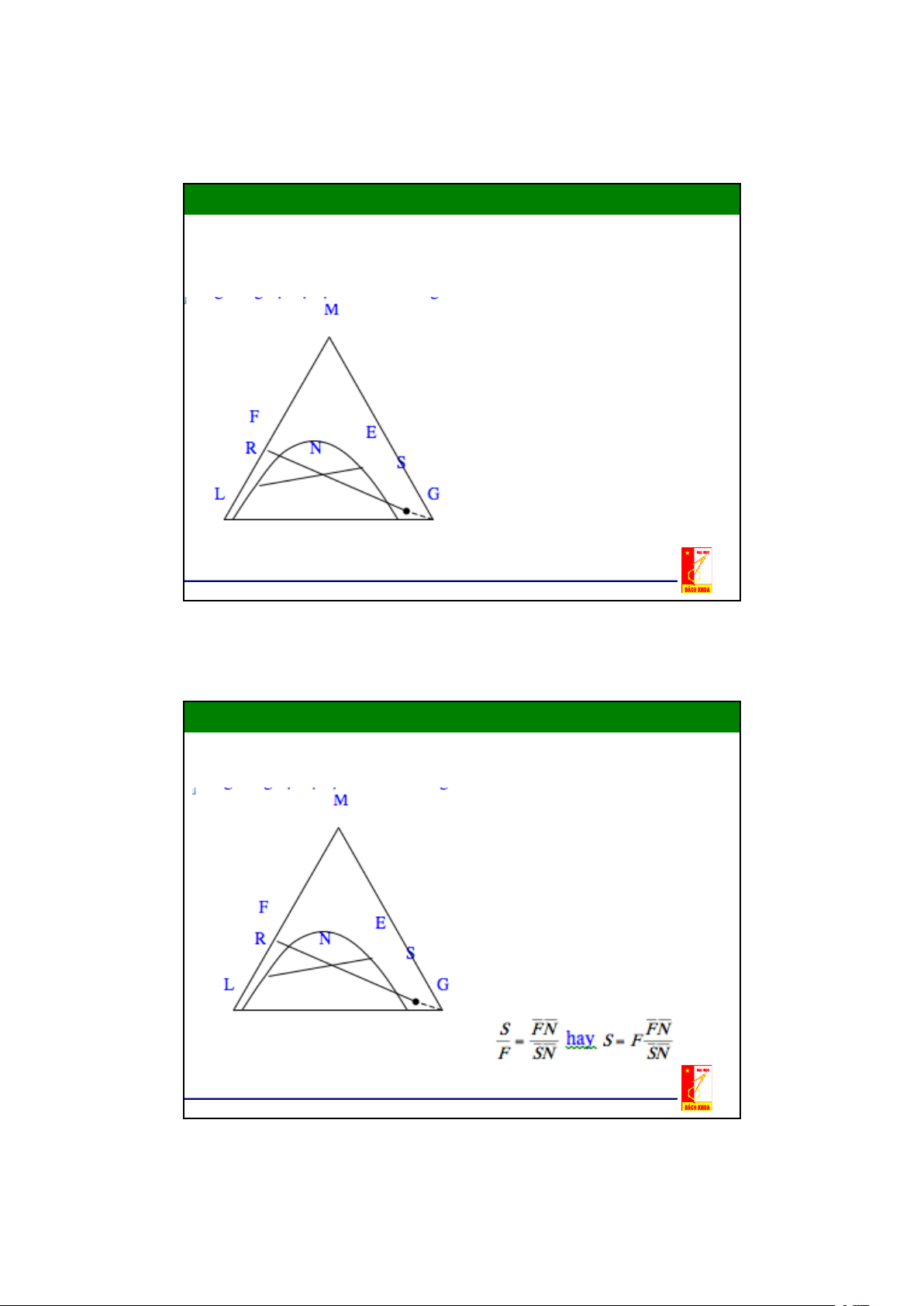
Phương trình cân bằng vật liệu có dạng : F + S = R + E = N
F: khối lượng của hỗn hợp đầu (gồm
dung môi đầu L và cấu tử phân bố M) (kg/h)
S: khối lượng của hỗn hợp dung môi
thứ (gồm chủ yếu là dung môi thứ G
có hoà tan một ít cấu tử phân bố M
và dung môi đầu L) (kg/h).
E,R: khối lượng của pha trích và pha
raphinát (phân lớp không hoà tan vào nhau) (kg/h).
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.4. Cân bằng vật liệu của quá trình trích ly
- Phương trình cân bằng vật liệu có
thể xem như quá trình trộn lẫn hỗn
hợp đầu F với dung môi thứ có
thành phần ở S được 1 hỗn hợp ở N
- Hỗn hợp có thành phần ở N
không hoà tan vào nhau và phân
thành 2 lớp: raphinát R và dung
dịch trích E ở trạng thái cân bằng
Theo quy tắc đòn bẩy ta có : hay 18
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.4. Cân bằng vật liệu của quá trình trích ly
Tương tự đối với raphinát R và dung dịch trích E
FN , SN , EN , RN là các đoạn
thẳng đo được trên hình vẽ có cùng thứ nguyên chiều dài
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.5. Các phương pháp trích ly
Trích ly một bậc gián đoạn
- Dung dịch đầu F có nồng độ cấu tử cần tách
xF vào thùng với 1 lượng cần thiết
- Dung môi thứ G có nồng độ cấu tử cần tách yG
- Khuấy đến trạng thái cân bằng thì ngừng khuấy
- Để yên cho chất lỏng phân lớp ngay trong thiết bị
- Rót hết lớp pha nặng rồi lớp pha nhẹ 19
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.5. Các phương pháp trích ly
Trích ly một bậc liên tục
- Hỗn hợp đầu F , dung môi thứ
G được rót liên tục vào thùng khuấy 1
- Dung dịch được khuấy liên tục
và tháo liên tục vào thiết bị
phân ly 2 phân ly liên tục thành
pha nặng và pha nhẹ và được tháo ra liên tục
- Rót hết lớp pha nặng rồi lớp pha nhẹ
Chương 2: Quá trình trích ly
2. Trích ly Lỏng – Lỏng
2.5. Các phương pháp trích ly
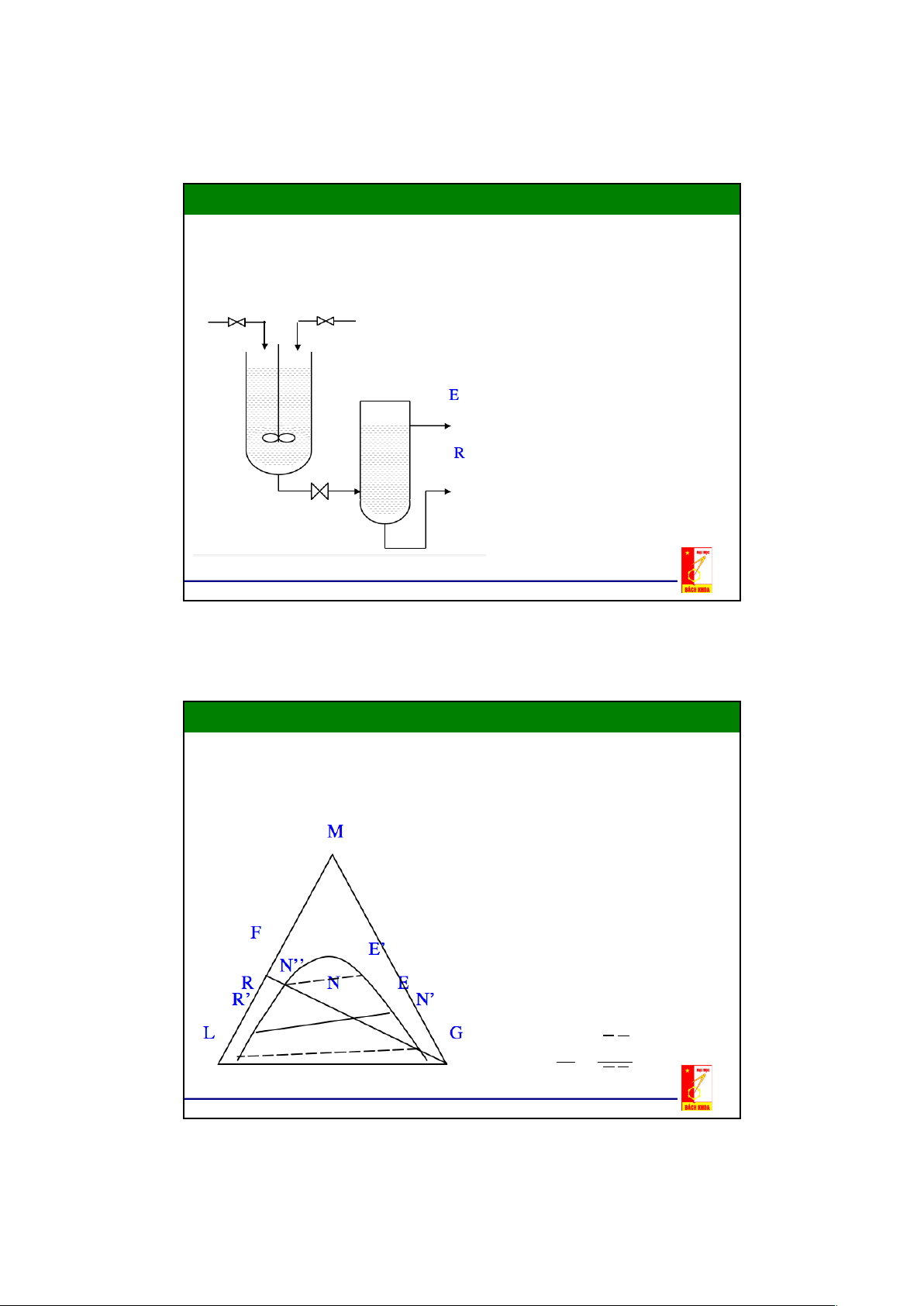
Biểu diễn trích ly một bậc trên đồ thị tam giác
- Hỗn hợp đầu F, nồng độ xF
- Quá trình trộn hỗn hợp đầu và
dung môi thứ G xẩy ra trên
đường thẳng FG, toạ độ của
điểm hỗn hợp N được xác định
bằng tỷ lượng giữa lượng hỗn
hợp đầu F và lượng dung môi
thứ G theo quy tắc đòn bẩy: F GN = G FN 20




