




Preview text:
Chương 14:
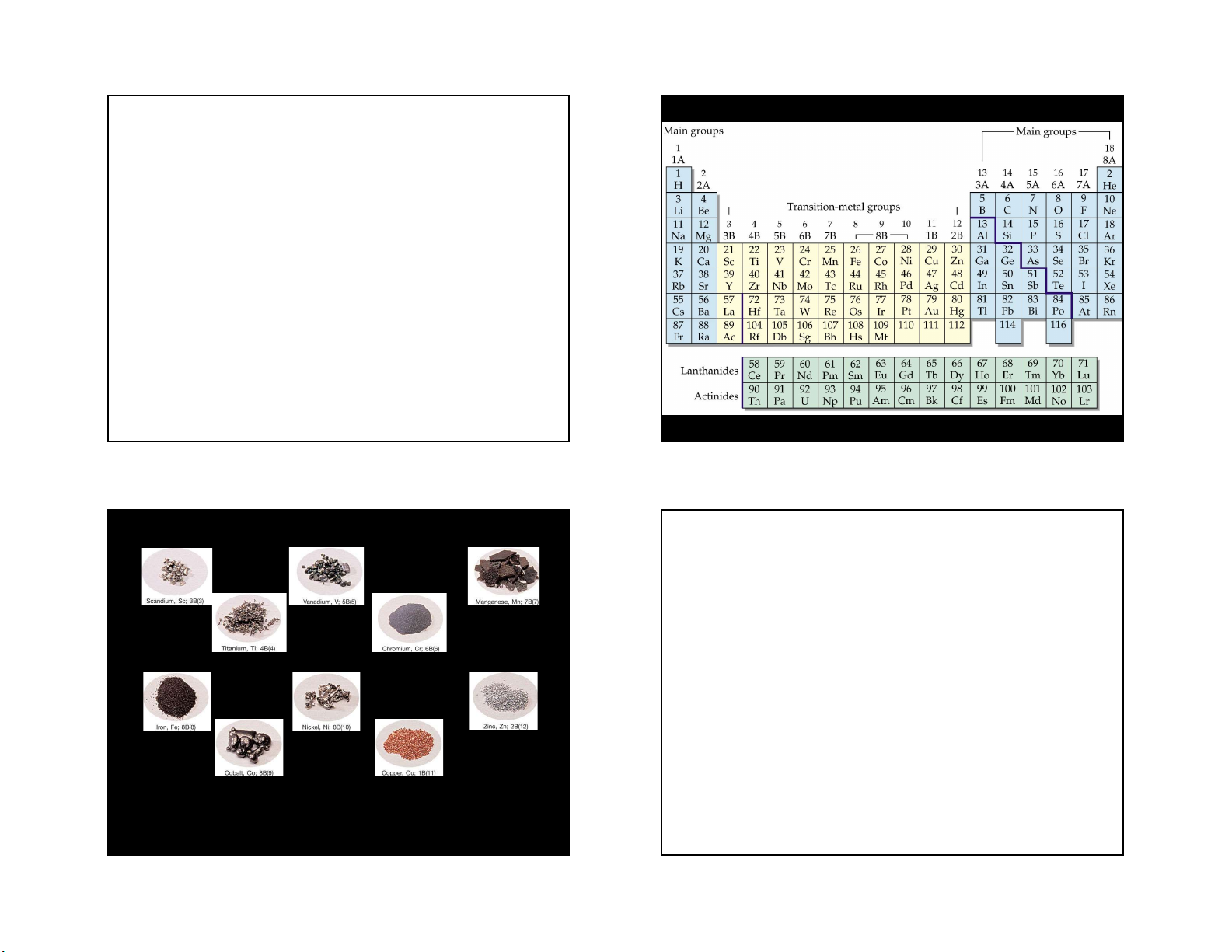
TÍNH CHẤT CHUNG CỦA CÁC KIM LOẠI CHUYỂN TIẾP 1 1 2
1. Đặc điểm cấu hình electron nguyên tử của các nguyên tố chuyển tiếp
+ Có 1 hoặc 2e ở lớp ngoài cùng trừ trường hợp của
Pd (Z=46), có cấu hình electron hoá trị là 4d105so
+ Năng lượng của các electron ở hai phân lớp ngoài
cùng là (n-1)dxns1-2 gần nhau nên các e ở hai phân
lớp này đều là electron hoá trị 4 3 4
+ Từ trái sang phải trong một chu kỳ, năng lượng
2. Tính chất chung của các nguyên tố chuyển tiếp
của các electron ở ns và (n-1)d đều giảm, nhưng
- Đều là các kim loại. Vì sao?
hiệu Ens - E(n-1)d tăng dần (vì sao?),
do đó các electron trên (n-1)d càng khó tham gia
- Các nguyên tố chuyển tiếp d thể hiện nhiều số oxi liên kết hoá học hoá khác nhau. Vì sao ?
- Số oxi hoá lớn nhất của các nguyên tố chuyển tiếp
+ Từ trên xuống trong một phân nhóm phụ, nói
bằng tổng số e ở phân lớp ns và phân lớp (n-1)d và
chung năng lượng của các electron ns ít biến đổi,
bằng số thứ tự nhóm chứa nó trừ các nguyên tố ở nhưng hiệu năng lượng E nhóm IB, IIB và VIIIB ns - E(n-1)d giảm,
nên các electron (n-1)d dễ tham gia liên kết hoá
học cùng với các electron ns 5 6 5 6
- Từ trái sang phải trong một chu kỳ độ bền của số
- Các nguyên tố d có nhiều obitan hoá trị trống, đặc
oxi hoá lớn nhất của các nguyên tố nói chung giảm
biệt là các ion kim loại chuyển tiếp dễ tạo phức chất
dần, vì hiệu năng lượng Ens - E(n-1)d tăng dần, làm
cho các electron (n-1)d trở nên khó tham gia liên kết
- Các ion kim loại chuyển tiếp 4d và 5d thường tạo
hoá học cùng với các electron ns
phức spin thấp và bền hơn so với các ion của kim
- Từ trên xuống dưới nói chung độ bền của số oxi
loại chuyển tiếp 3d, vì các cặp e trên 4d và 5d đẩy
hoá lớn nhất tăng dần, do năng lượng của các
nhau kém hơn trên 3d, do đó năng lượng ghép đôi electron (n-1)d tăng dần.
P của các e trên 4d và 5d thấp hơn so với trên 3d
- Độ bền của các số oxi hoá rất liên quan đến tính
- Nhiệt độ nóng chảy của các kim loại chuyển tiếp
chất oxi hoá khử của các hợp chất. Ví dụ ở nhóm
nói chung lớn hơn so với các kim loại không chuyển
VIIB Mn có số oxi hoá lớn nhất là +VII ít bền nhất, do
tiếp, vì các kim loại chuyển tiếp có nhiều obitan
đó hợp chất Mn +VII có tính oxi hoá mạnh, dễ dàng
tham gia liên kết kim loại.
bị khử thành Mn2+ trong môi trường axit 7 8 7 8 Chương XVI 1.2. Tính chất hoá học:
Các nguyên tố nhóm VIB và VIIB * Đơn chất:
- Các kim loại này kém hoạt động hoá học và độ
hoạt động hoá học giảm từ trên xuống
1. Tính chất chung của các nguyên tố nhóm VIB
1.1. Cấu hình và số oxi hoá: - Phản ứng với oxi:
Nhóm VIB gồm các nguyên tố Cr, Mo và W.
+ Ở nhiệt độ thường chúng bền trong không khí - Cr: 3d54s1
+ Khi đun nóng Cr bị oxi hoá chậm tạo thành - Mo: 4d55s1
Cr2O3. Mo và W chỉ phản ứng với oxi ở nhiệt độ - W: 5d46s2
500- 600oC tạo thành MoO3 và WO3 2Cr + 3O2 = 2Cr2O3(r) 9 10 9 10 - Phản ứng với halogen:
- Phản ứng với các phi kim khác như N và C: Cr,
Mo và W tạo thành các hợp chất nitrua và cacbua
+ F phản ứng với cả 3 kim loại trên ngay - Phản ứng với H ở nhiệt độ thường:
2O: ở nhiệt độ cao (600-800oC),
Cr phản ứng với H2O tạo thành oxit Cr (+III): 2Cr + 3F2 = 2CrF4 (hoÆc CrF5) 2Cr + 3H2O = Cr2O3 + 3H2 Mo + 3F2 = MoF6 -Phản ứng với axit: W + 3F Cr + 2HCl = CrCl 2 = WF6 2 + H2
+ Víi Cl th× ph¶i ®un nãng. Br chØ ph¶n øng víi Cr
Cr thụ động với HNO3 đặc
vµ Mo, cßn I chØ ph¶n øng víi Cr 11 12 11 12 * Hợp chất của Cr: - Oxit bền
nhất Cr2O3 và hydroxit tương ứng là
Cr(OH)3 không tan trong nước và có tính chất lưỡng tính:
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] In acid In base 13 13 14
- Oxit Cr2O3 trơ về phương diện hoá học nhất là sau
khi đã nung nóng ở t cao, nó trơ đối với axit và kiềm.
- Cr3+ có tính chất khử, đặc biệt trong môi trường
Tính lưỡng tính của nó thể hiện khi nấu nóng chảy với kiềm, ví dụ: kiềm: 2[Cr(OH) 2- 6]3- + 3H2O2 2CrO4 + 2OH- + 8H2O
Cr2O3 + 2NaOH 2NaCrO2 + H2O
- Muối clorua, sunfat và phèn crôm có công thức
- Ion Cr3+ có bán kính nhỏ và điện tích lớn và còn tương ứng CrCl3.6H2O, Cr2(SO4)3.18H2O,
3e hoá trị 3d3 nên là một trong những chất tạo
KCr(SO4)2.12H2O, đều dễ tan trong nước và ion Cr3+
phức mạnh nhất, có thể tạo phức với hầu hết các
cũng bị thuỷ phân. Nếu trong dung dịch muối Cr3+
phối tử. Độ bền của các phức chất Cr(III) biến đổi
chứa anion gốc axit rất yếu thì sự thuỷ phân xảy ra
trong khoảng giới hạn rộng rãi tuỳ vào bản chất hoàn toàn. Ví dụ:
của phối tử và cấu hình của phức chất. Một số
2Cr3+ + 3S2- + 6H2O 2Cr(OH)3 + 3H2S
phức chất bền như:[Cr(NH3)6]3+, [CrCl6]3-, [Cr(CN)6]3- 2Cr3+ + 3CO 2- 3 + 3H2O 2Cr(OH)3 + 3CO2 15 16 15 16 Hợp chất của Cr (VI): CrO H O H CrO 3 2 2 4 Anhidrit cromic Axit cromic Hợp chất Cr(III) có tính chất khác Al(III) 2H2CrO4 ⇌ H2Cr2O7 + H2O về màu sắc Tên chromium xuất phát từ chromus-Hylạp, có nghĩa là màu sắc 2 2 2H CrO Cr O H O 17 4 2 7 2 17 18 Ứng dụng
- Các hợp chất Cr (VI) là chất oxi hoá mạnh, - Cr 𝜀
= 1,33 (𝑉) do đó nó có thể oxi hoá
2O3 dùng chế tạo sơn màu, nhuộm màu cho thủy
tinh và gốm sứ; thành phần vật liệu đánh bóng được nhiều chất như:
- Các muối cromat và đicromat đều dễ tan. + K Cr 2-
2Cr2O7, Na2Cr2O7.2H2O màu đỏ da cam, dùng 2O7
+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O
trong công nghiệp thuộc da, diêm, dệt, làm chất oxi hóa
Trong môi trường trung tính và kiềm CrO 2- 4
thường bị khử thành Cr(OH)
+ K2Cr2O7+H2SO4 đặc có tính oxi hóa mạnh làm 3
chất tẩy rửa dụng cụ thủy tinh, gốm sứ
+ Hợp chất Cr(VI) đều rất độc 19 20 19 20
2. Các nguyên tố nhóm VIIB: 2.2 Tính chất hoá học
2.1. Cấu hình và số oxi hoá: * Đơn chất:
Nhóm VIIB gồm các nguyên tố Mn, Tc
Mn là kim loại hoạt động (Tecnexi) và Re (Reni)
- Phản ứng với oxi: Mn bột phản ứng với O2
- Cấu hình electron hoá trị: ns2(n-1)d5, có 7e
khi bị đun nóng: Mn + O2 = MnO2, nhưng nếu
hoá trị, có thể số oxi hoá từ + I đến + VII. Đối
ở dạng khối thì nó chỉ phản ứng với O2 ở lớp
với Mn các số oxi hoá + II, +IV và +VII là bền,
trên bề mặt tạo thành Mn2O3 ngăn không cho
số oxi hoá +III và +VI ít bền, còn các số oxi hoá
lớp bên trong phản ứng tiếp theo +I và +V rất không bền
- Phản ứng với halogen: dễ dàng phản ứng
với halogen tạo thành MnX2 21 22 21 22
- Thế khử chuẩn của cặp Mn2+/Mn là -1,18V, nên Mn ở
dạng bột đẩy được hydro ra khỏi nước nóng: Mn + 2HOH = Mn(OH)2 + H2
Kết tủa tạo thành phủ trên bề mặt sẽ làm chậm phản ứng lại MnO pyrolusite Mn O hausmannite
- Mn dễ tan trong các axit loãng như H 2 3 4 2SO4 và HCl : Mn + 2HCl = MnCl2 + H2
-Phản ứng với axit H2SO4 đặc và HNO3 như sau: Mn + H2SO4 = MnSO4 + SO2 + H2O
3Mn + 8HNO3(loãng) = 3Mn(NO3)2 + 2NO + 4H2O 23 (Mn, Fe) O bixbyite MnCO rhodochrosite 2 3 3 23 24 ĐIỀU CHẾ
1. Điện phân dd MnCl2 hoặc MnSO4 trong (NH4)2SO4
2. Khử oxit bằng Si trong lò điện 3. Nhiệt Al 4. Khử bằng C 900 3 o C
MnO Mn O O 2 3 4 2 5. Khử bằng H ỨNG DỤNG 3Mn O Al 9Mn 4Al O 3 4 2 3 MnO Fe O 5C Mn 2Fe 5CO 2 2 3 600 2NH TcO 7 o C
H 2Tc 2NH 8H O 4 4 2 3 2 1000 2NH ReO 4 o C
H 2 Re N 8H O 4 4 2 2 2 25 26
1. Feromangan dùng để chế tạo thép đặc biệt
2. Thép 15 %Mn có độ rắn và bền cao chế
tạo ray tàu hỏa, máy nghiền bi, máy đập búa
3. Thép Mg-Mn chống ăn mòn tốt
4. Hợp kim Cu-Mn-Ni có hệ số nhiệt điện trở thấp
5. Hợp kim Re-W-Mo dùng sản xuất đèn điện,
dụng cụ điện chân không
6. Hợp kim W-Re làm cặp nhiệt điện trong khoảng 0-2500 oC
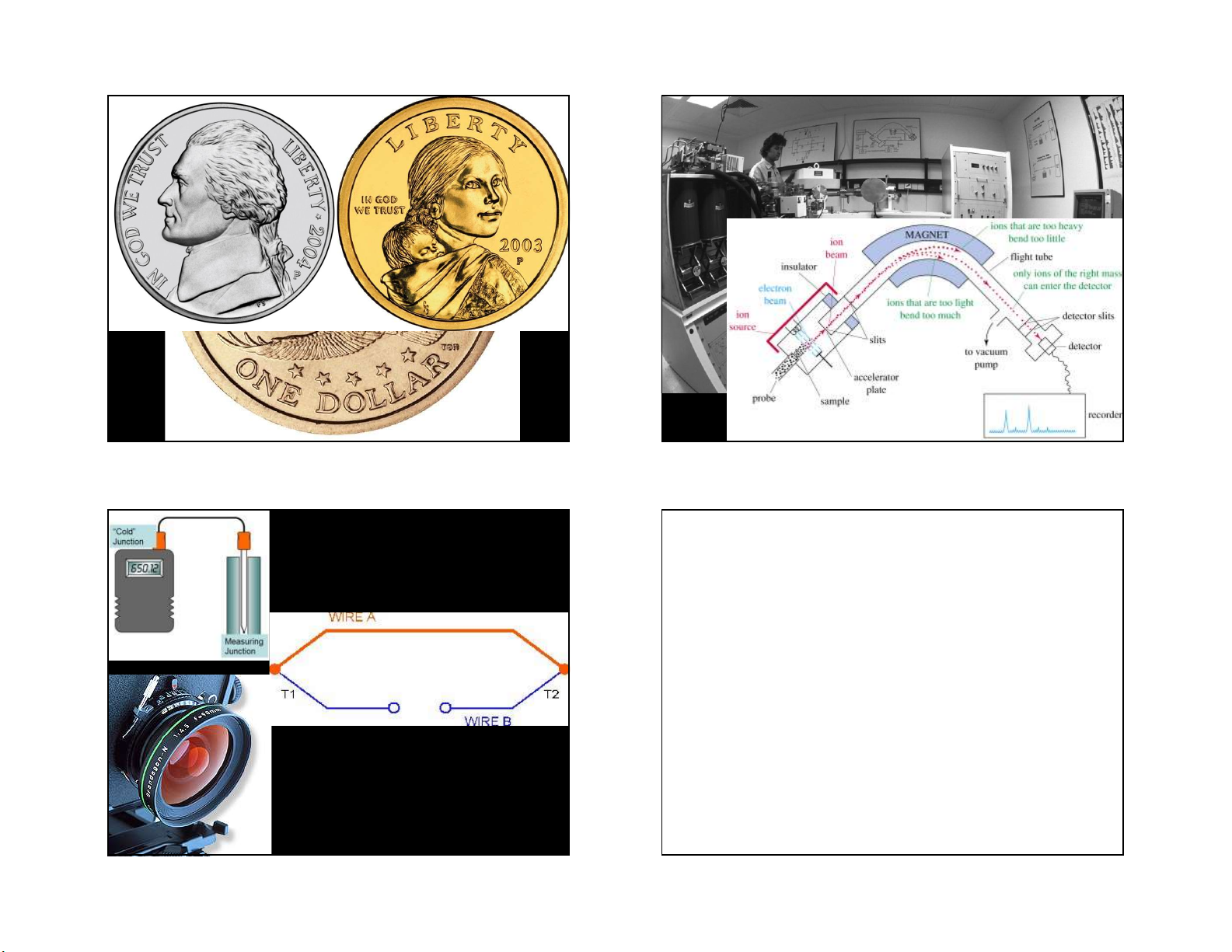
7. Re và hợp chất dùng làm chất xúc tác khi oxi hóa NH3, CH4, hidro hóa C2H4 27 28 56% Cu + 35% Ag + 9% Mn
88.5% Cu + 6% Zn + 3.5% Mn + 2% Ni
the only United States coins to use Mn were the
"Wartime" nickel from 1942–1945, and the Sacagawea Dollar (2000–present). 29 30 • Hợp chất:
Mn có thể tạo với oxi các hợp chất MnO, Mn2O3,
MnO2, Mn3O4, MnO3 và Mn2O7. Các oxit bền là MnO2, Mn2O3 và Mn3O4.
Tính axit của các oxit tăng dần theo chiều tăng số
oxi hoá, còn tính bazơ giảm dần. MnO, Mn2O3 là các
oxit bazơ, MnO2 có tính lưỡng tính còn MnO3 và Mn2O7 là các oxit axit 32 31 32
- Mn2O7: Ở điều kiện thường là chất lỏng, ở 55oC phân - MnO2:
huỷ chậm, ở 90oC bị phân huỷ nổ theo phản ứng: Ở 530oC MnO Mn2O7 = 2MnO2 + O2
2 bị phân huỷ tạo thành Mn2O3, sau đó thành Mn3O4
Là chất oxi hoá mạnh, tác dụng với nhiều chất hữu cơ o o 3MnO 530 C 9 00 C M n O M n O 2 2 3 3 4 như rượu và este
2Mn2O7 + 2(C2H5)2O + 9O2 = 4MnO2 + 8CO2 + 10H2O
Tan trong nước tạo thành dung dịch axit HMnO MnO 4:
2 + 4HCl(đặc) = MnCl2 + Cl2 + 2H2O Mn2O7 + H2O = 2HMnO4 Điều chế:
2KMnO4(r) + H2SO4(đ)= Mn2O7 + H2O + K2SO4 33 34 33 34
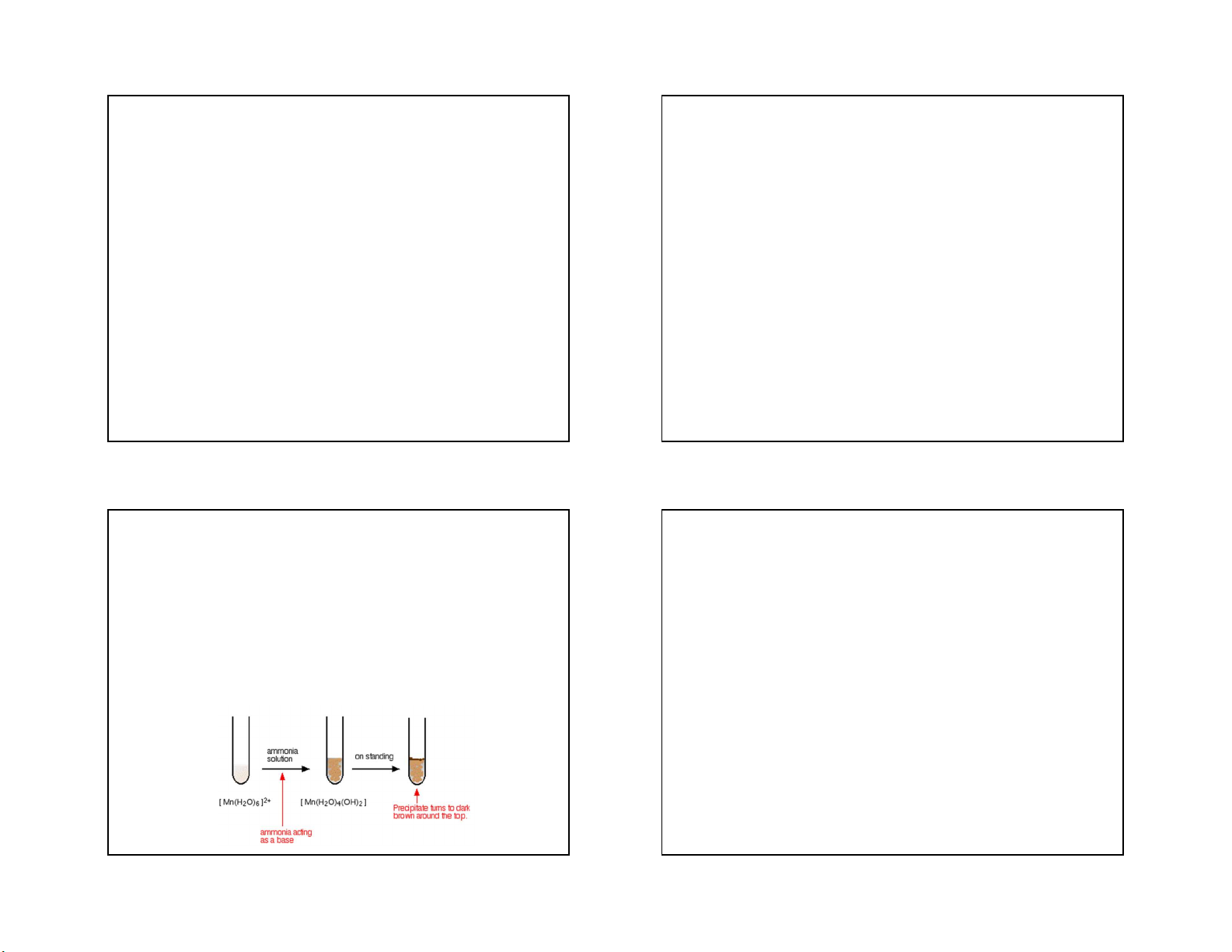
- Mn(OH)2: là chất kết tủa màu trắng, tạo ra do
phản ứng trao đổi giữa dung dịch muối và kiềm: Mn2+ + 2OH- = Mn(OH)
- Muối Mn (II): ion Mn2+ có tính khử yếu, chỉ bị oxi hoá
2 ở nhiệt độ thường hydroxit 2-
tạo thành chuyển dần thành màu nâu do bị oxi hoá
khi tác dụng với các chất oxi hoá mạnh như S2O8 - thành MnO(OH): hoặc BiO3 : 4Mn(OH) 5KBiO - + 5K+ + 7H 2 + O2 = 4MnO(OH) + 2H2O,
3(r) + 2Mn2+ + 14H+ = 5Bi3+ + MnO4 2O
tiếp theo MnO(OH) được oxi hoá đến MnO
Muối Mn (II) thường có màu hồng nhạt, khi tan trong 2
nước tạo thành ion [Mn(H2O)6]2+ bát diện. Muối Mn2+ thường dùng MnSO4.4H2O, MnCl2.4H2O,
Mn(NO3)2.6H2O là những tinh thể màu hồng nhạt và dễ tan trong nước. 35 36 35 36
- Hợp chất Mn (VI): muối manganat MnO 2- 4 được tạo
- Các muối Mn (IV) không bền, nhưng một vài ion
thành khi nấu nóng chảy MnO2 với kiềm và có mặt chất
phức của nó bền như [MnF6]2-, [MnCl6]2- tương đối oxi hoá. Ví dụ: bền.
MnO2(r) + KNO3(r) + 2KOH K2MnO4 + KNO2 + H2O
- MnO2 phản ứng với axit đặc không thu được muối
Mn (IV) mà chỉ thu được muối Mn(II):
+ Muối manganat kim loại kiềm hoà tan trong nước tạo
MnO2(r) + 4HCl MnCl2 + Cl2 + 2H2O ra màu xanh do ion MnO 2- 2- 4 . Ion MnO4 chỉ bền trong
dung dịch kiềm mạnh, dễ bị phân huỷ trong môi trường
axit và trung tính theo phản ứng: 3MnO 2- - 4 + 2H2O ⇋ 2MnO4 + MnO2 + 4OH- + Tính khử của ion MnO 2- 4 : 37 38 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl 37 38
Ion MnO - có tính chất oxi hoá mạnh, sản phẩm của - Hợp chất Mn (VII): 4
phản ứng khử phụ thuộc vào pH của môi trường:
Axit pemanganic HMnO4 là axit mạnh, có màu tím
đỏ, tương đối bền trong dung dịch loãng, nhưng bị
phân huỷ khi nồng độ trên 20%:
+ Trong môi trường axit mạnh: vừa đủ MnO - 4 : sản
phẩm của phản ứng khử MnO - 4 là Mn2+ 2HMnO4 = 2MnO2 + O3 + H2O 2MnO - - -
4 + 5NO2 + 6H+ = 2Mn2+ + 5NO3 + 3H2O
Muối tương ứng là pemanganat bền hơn, muối dư MnO -
4 thì xảy ra phản ứng tự oxy hoá khử
thường dùng là KMnO4, khi đun nóng được phân của MnO -
4 và Mn2+ tạo thành MnO2 ít tan có màu huỷ: nâu. 2MnO - + 3Mn2+ + 2H 2KMnO 4 2O = 5MnO2 + 4H+ 4(r) C o 250 K2MnO4 + MnO2 + O2 39 40 39 40 Ion MnO -
4 có tính chất oxi hoá mạnh, sản phẩm của
phản ứng khử phụ thuộc vào pH của môi trường:
Điều chế KMnO4: Nấu nóng chảy MnO2 với kiềm
KOH có mặt chất oxi hoá, sau đó oxi hoá K2MnO4
+ Trong môi trường trung tính, axit yếu, kiềm yếu, sản
thu được bằng chất oxi hoá mạnh như Cl2: phẩm của sự khử MnO - 4 là MnO2: 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 2KOH + 3Na2SO4
Trong công nghiệp: điện phân dung dịch
+ Trong môi trường kiềm mạnh, sản phẩm của sự 2K khử MnO - 2- 2MnO4 + 2H2O 2KMnO4 + 2KOH + H2 4 là MnO4 :
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O 41 42 41 42



