














Preview text:
CHƯƠNG 5 KHÍ LÝ TƯỞNG
5.1 Một số khái niệm ❖Khí lý tưởng
▪ Lực tương tác giữa các phân tử tạo thành chất khí không đáng kể.
▪ Kích thước các phân tử không đáng kể và có thể bỏ qua
▪ Chỉ tương tác khi va chạm, không tương tác tĩnh điện
▪ Các phân tử xem như chất điểm, bỏ qua kích thước phân tử
5.1 Một số khái niệm
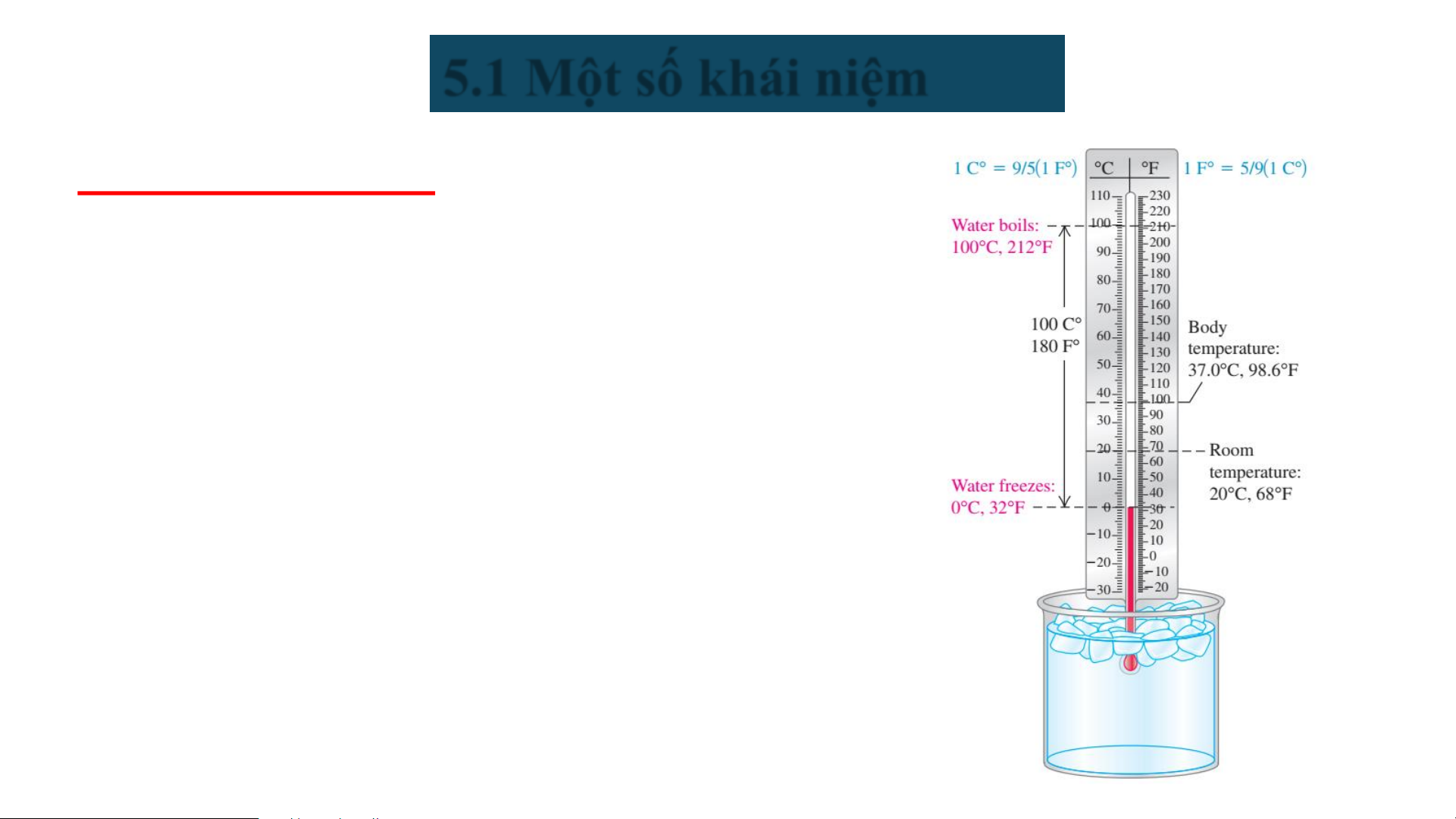
❖Thông số trạng thái ➢ Nhiệt độ (t,T)
• Thang nhiệt độ bách phân (Celsius): t (C)
• Thang nhiệt độ tuyệt đối (Kelvin): T (°K)
• Liên hệ giữa thang nhiệt độ Kelvin và thang
nhiệt độ Celsius: T (°K) = t (°C) + 273
5.1 Một số khái niệm
❖Thông số trạng thái ➢ Áp suất (p)
Lực nén trên đơn vị diện tích vuông góc với lực nén 𝑭 𝒑 = 𝑺
✓ Một số đơn vị đo áp suất 1 N/m2 = 1 Pa
1 atm = 760 mmHg = 760 torr= 1,01.105 N/m2 1 torr = 1 mmHg
1 at = 736 mmHg = 9,81.104 N/m2 1 bar = 105 N/m2
5.1 Một số khái niệm
❖Thông số trạng thái ➢ Thể tích (V)
▪ Là miền không gian các phân tử khí chuyển động
▪ Đối với khí lý tưởng thể tích của bình chứa là thể tích khí
▪ Trong hệ SI, đơn vị thể tích V là m3
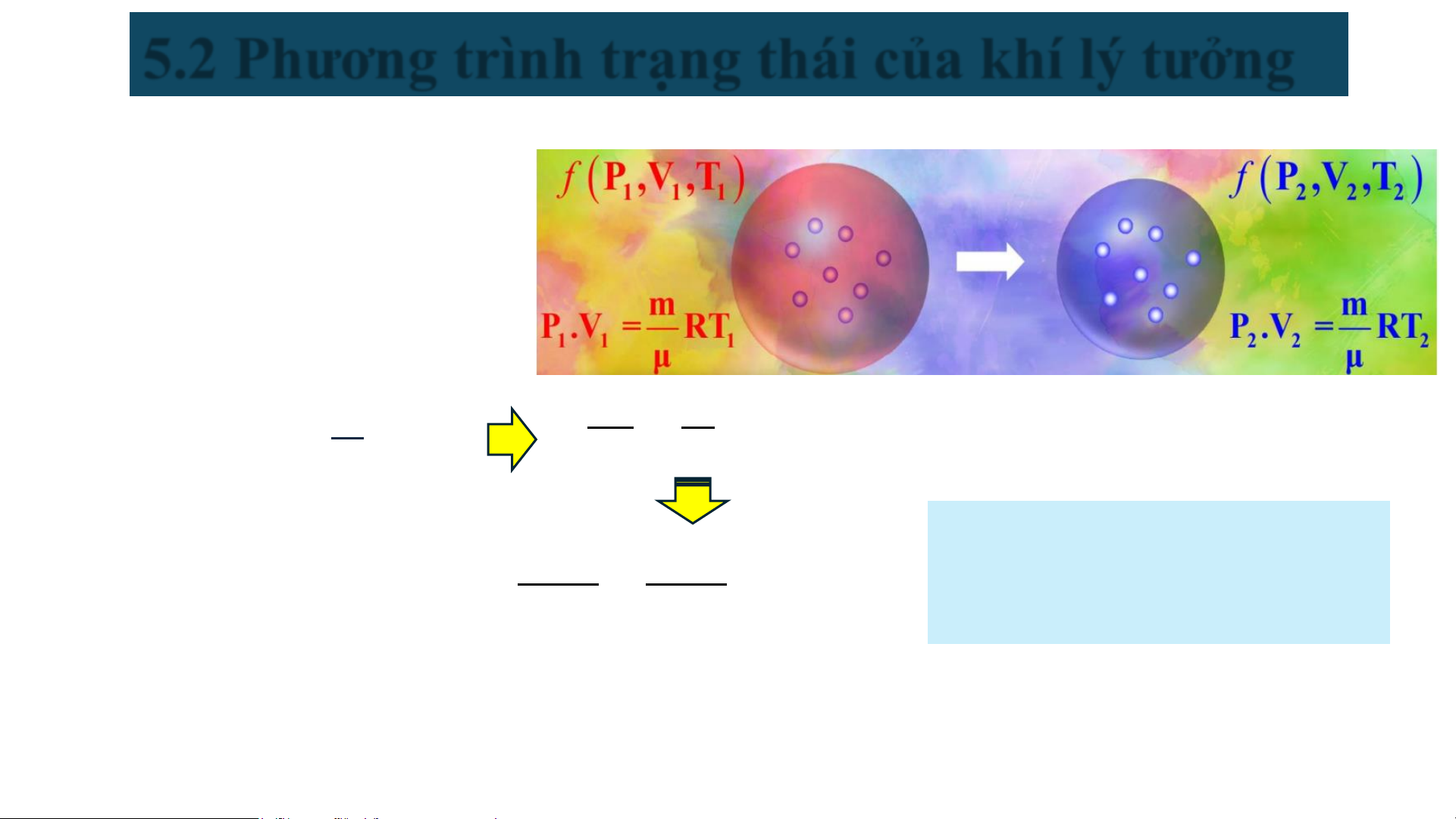
5.2 Phương trình trạng thái của khí lý tưởng
5.2.1 Phương trình trạng thái khí lý tưởng 𝐦 𝐩𝐕 = 𝐑𝐓 𝛍 Trong đó: ▪ p: áp suất (N/m2 ) ▪ V: thể tích (m3 ) ▪ T: nhiệt độ (K)
▪ m: khối lượng khí (kg)
▪ là khối lượng của 1 kmol khí (kg/kmol)
▪ R = 8.31.103 (J/kmol.K) hằng số khí lý tưởng
5.2 Phương trình trạng thái của khí lý tưởng
5.2.1 Phương trình trạng thái khí lý tưởng 𝐦 𝒑𝑽 𝒎 𝐩𝐕 = 𝐑𝐓 = 𝑹 = 𝒄𝒐𝒏𝒔𝒕 𝛍 𝑻 𝝁
Là quá trình biến đổi của khối 𝒑𝟏𝑽𝟏 𝒑
= 𝟐𝑽𝟐 = 𝒄𝒐𝒏𝒔𝒕
khí có P hoặc V hoặc T không 𝑻𝟏 𝑻𝟐 thay đổi theo thời gian
❖ Điều kiện tiêu chuẩn của khí T = 273 K ( 0 C) P = 1 atm (105 Pa) V = 22.4 lít
5.2 Phương trình trạng thái của khí lý tưởng
5.2.2 Một số trường hợp riêng
a) Quá trình đẳng nhiệt (T = const): pv = const
(định luật Boyle-Mariotte)
b) Quá trình đẳng áp (p = const): V = const (định luật Gay-Lussac) T
c) Quá trình đẳng tích (V = const): p = const (định luật Charles) T
5.2 Phương trình trạng thái của khí lý tưởng ❖Ví dụ
Có 40 g khí Oxy chiếm thể tích 3 lít ở nhiệt độ T = 292,5 K.
a) Tính áp suất của khối khí
b) Cho khối khí nở đẳng áp đến thể tích 4 lít. Hỏi nhiệt độ của khối khí sau khi dãn nở là bao nhiêu?
Phương trình trạng thái khí lý tưởng: pV = mRT μ
p= mRT = 408,31292,5 = 107(N/m2) μV 32310−3
Quá trình đẳng áp: p1 = p2= p = const
Trạng thái 2: pV2 = mRT T = 3850 K μ 2 2 = μ p V2 mR = 32107410−3 408,31
5.3 Thuyết động học của phân tử các chất khí
1. Số lượng phân tử: Một bình chứa có thể tích V chứa một số lượng
rất lớn (N) các phân tử giống hệt nhau, mỗi phân tử có khối lượng m.
2. Kích thước phân tử: Kích thước của chúng rất nhỏ so với khoảng
cách trung bình giữa các phân tử và so với kích thước của bình chứa.
3. Chuyển động: Các phân tử luôn chuyển động ngẫu nhiên và liên
tục tuân theo các định luật của Newton. Mỗi phân tử thỉnh thoảng
va chạm với thành bình. Các va chạm này là va chạm hoàn toàn đàn hồi.
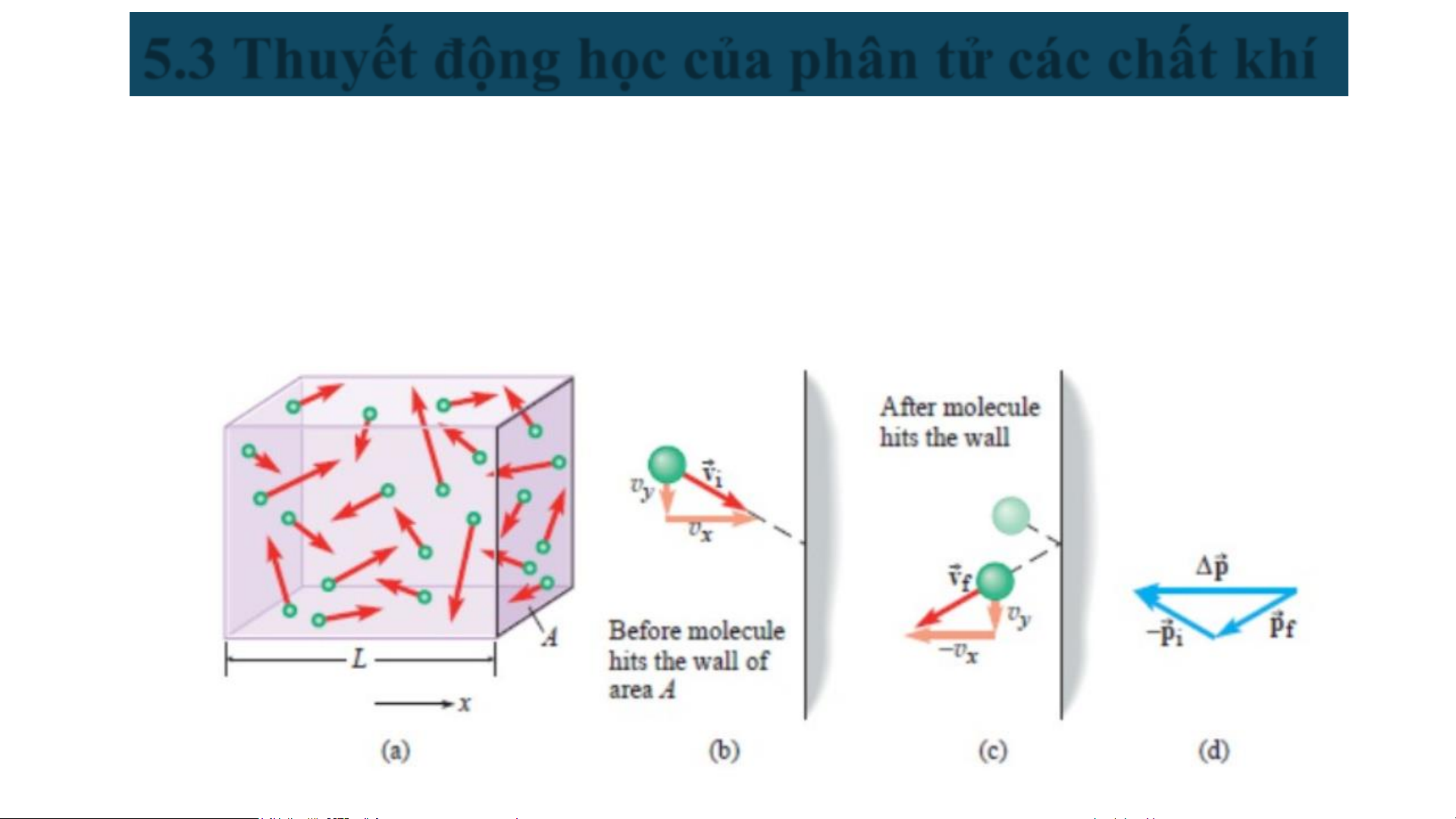
4. Áp suất: Trong quá trình va chạm với thành bình, các phân tử tạo
ra lực lên thành bình. Tổng hợp của những lực này chính là áp suất
mà khí tác dụng. Khi một phân tử va chạm với thành, thành phần
vận tốc song song với tường không đổi, trong khi thành phần vận
tốc vuông góc với tường bị đổi hướng nhưng không đổi độ lớn.
5.3 Thuyết động học của phân tử các chất khí
5.3.1 Phương trình cơ bản của thuyết động học phân tử về chất khí
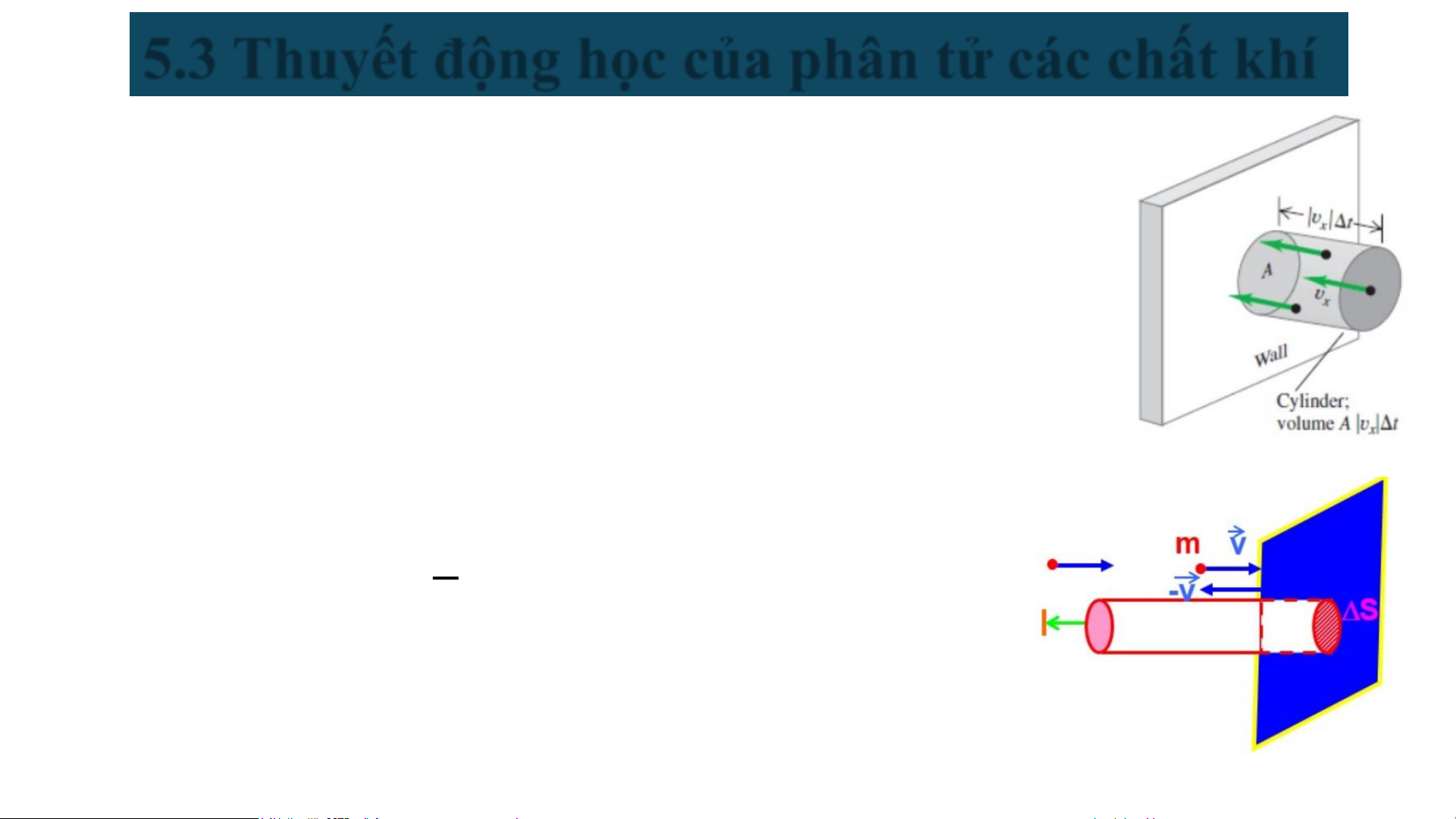
Xét một chất khí gồm N phân tử trong một bình hình lập phương cạnh a.
Lấy một diện tích nhỏ ΔS của thành bình và tính số phân tử va đập vào bề mặt ΔS đó trong thời gian Δt.
5.3 Thuyết động học của phân tử các chất khí
5.3.1 Phương trình cơ bản của thuyết động học phân tử về chất khí
▪ Giả sử mọi phân tử chuyển động với cùng vận tốc v.
▪ Trong khoảng thời gian Δt, các phân tử khí đập vào bề mặt ΔS
chứa trong thể tích hình trụ đáy ΔS, chiều cao v.Δt (hình vẽ).
▪ Gọi n là mật độ phân tử khí theo thể tích (số phân tử/m³).
▪ Số phân tử khí này bằng: 𝟏 ∆𝐧 = 𝒏∆𝑺𝒗∆𝒕 𝟔
5.3 Thuyết động học của phân tử các chất khí
5.3.1 Phương trình cơ bản của thuyết động học phân tử về chất khí
▪ Sau va chạm động lượng của mỗi phân tử biến thiên một lượng:
∆𝒑 = −𝒎𝒗 − 𝒎𝒗 = −𝟐𝒎𝒗
▪ Theo định lý động lượng (p = Ft): Δp bằng xung lượng của ngoại lực 𝑓 𝑏
do thành bình tác dụng lên phân tử trong thời gian Δt: −𝟐𝒎𝒗
∆𝐩 = 𝒇𝒃. ∆𝒕 → 𝒇𝒃 = ∆𝒕
▪ Định luật Newton 3, mỗi phân tử tác động lên thành bình một lực f: 𝟐𝒎𝒗 𝒇 = −𝒇𝒃 = ∆𝒕
Do đó lực nén vuông góc của các phân tử lên bề mặt ΔS:
5.3 Thuyết động học của phân tử các chất khí
5.3.1 Phương trình cơ bản của thuyết động học phân tử về chất khí
Do đó lực nén vuông góc của các phân tử lên bề mặt ΔS:
Theo định nghĩa áp suất:
5.3 Thuyết động học của phân tử các chất khí
5.3.1 Phương trình cơ bản của thuyết động học phân tử về chất khí
Thực ra các phân tử không chuyển động với nhau cùng một vận tốc mà có thể khác nhau.
Do đó, trong công thức trên ta thay giá trị trung bình:
là trung bình của bình phương vận tốc.
Trong đó: v1, v2, …,vi,…,vi,…,vN là vận tốc của các phân tử trong khối khí.
Phương trình cơ bản của thuyết động học phân tử về chất khí
Trong đó động năng tịnh tiến trung bình của một phân tử:
5.3 Thuyết động học của phân tử các chất khí 5.3.2 Các hệ quả Từ công thức 𝐦 𝑵 𝐩𝐕 = 𝐑𝐓 = 𝑹𝑻 𝛍 𝑵𝑨
(N: số phân tử của khối khí, NA = 6,023.1026: số phân tử trong 1 kmol khí) 𝑅 𝑘𝐵 = = 1,37 × 10−23 (J/K) Hằng số Boltzmann 𝑁𝐴 N pV = NkBT → p = k V BT = nkBT 𝑁 Với 𝑛 =
𝑙à 𝑚ậ𝑡 độ 𝑝ℎâ𝑛 𝑡ử 𝑉 𝟐 𝟐
Từ pt cơ bản TĐHPT: 𝐩 = 𝐧𝐄 𝒌 𝟑 𝐝 𝐄𝐝 = 𝟑 𝑩𝐓
Như vậy động năng tịnh tiến trung bình của một phân tử chỉ phụ
thuộc vào nhiệt độ (tỉ lệ với nhiệt độ tuyệt đối).
5.3 Thuyết động học của phân tử các chất khí
5.3.3. Luật phân bố đều năng lượng theo các bậc tự do 1) Bậc tự do (i)
Bậc tự do của các phân tử khí là số tọa độ độc lập cần thiết để xác định vị trí của phân tử đó ở trong không gian.
▪ Trường hợp phân tử chỉ có 1 nguyên tử: i=3
▪ Trường hợp phân tử gồm 2 nguyên tử (khí oxy, nitơ, hydro, …): i = 3+2 =5
▪ Phân tử gồm 3 nguyên tử: i = 6
▪ Nguyên tử gồm nhiều phân tử hơn 3 nguyên tử: i = 6
5.3 Thuyết động học của phân tử các chất khí
5.3.3. Luật phân bố đều năng lượng theo các bậc tự do
2) Luật phân bố đều năng lượng theo các bậc tự do
Động năng trung bình của phân tử được phân bố đều cho các bậc tự do của phân tử.
▪ Động năng trung bình của một phân tử một nguyên tử: 3 𝑖 𝑘 kT 2 𝐵𝑇 = 2
▪ Phân tử này chuyển động với bậc tự do i = 3
▪ Theo luật phân bố đều năng lượng cho các bậc tự do, ứng với mỗi bậc tự do của
phân tử có một năng lượng là 0.5 kBT
▪ Đối với phân tử có nhiều nguyên tử hơn, ngoài chuyển động tịnh tiến còn có
chuyển động quay nên có năng lượng lớn hơn 1.5 kBT
▪ Mỗi bậc tự do của phân tử có một động năng 1 𝑘 2 𝐵𝑇
Động năng của cả phân tử : 1 i 𝑘 2 𝐵𝑇
5.3 Thuyết động học của phân tử các chất khí
5.3.4. Nội năng của khí lý tưởng
• Nội năng là phần năng lượng ứng với chuyển động bên trong của vật, năng
lượng bao gồm động năng do sự chuyển động của các phân tử trong khối khí
(chuyển động tịnh tiến, chuyển động quay, dao động của các phần tử tạo nên
hệ) và thế năng tương tác giữa các phân tử khí.
• Đối với khí lý tưởng, các phân tử không tương tác nhau, thế năng tương tác
giữa các phân tử xem như không có.
• Nội năng 𝑈 của khí lý tưởng chỉ là tổng động năng của các phân tử.
• Độ biến thiên nội năng của hệ phụ thuộc vào trạng thái ban đầu, trạng thái
sau cùng của hệ, không phụ thuộc quá trình biến đổi. Nội năng U là một hàm của trạng thái.
5.3 Thuyết động học của phân tử các chất khí
5.3.4. Nội năng của khí lý tưởng
Xét một khối khí có N phân tử, mỗi phân tử có i bậc tự do, toàn bộ khối khí có
Ni bậc tự do, mỗi bậc tự do ứng với một năng lượng là 1/2kBT, nên nội năng của khối khí là: Trong đó: 𝑹 𝒎 𝑵 𝒌𝑩 = ; = 𝑵𝑨 𝝁 𝑵𝑨
➢ Nội năng của khí lý tưởng chỉ phụ thuộc vào nhiệt độ của khối khí.
➢ Nếu nhiệt độ của khối khí thay đổi một lượng ΔT=T2 − T1, độ biến thiên nội năng: 𝒎 𝒊 ∆𝐔 = 𝑹∆𝑻 𝝁 𝟐



