









Preview text:
CHƯƠNG 6 (tt) NGUYÊN LÝ II NHIỆT ĐỘNG HỌC
NHỮNG HẠN CHẾ CỦA NGUYÊN LÝ THỨ NHẤT CỦA NHIỆT ĐỘNG HỌC
❖ Thí nghiệm với nước sôi và nước đá
Nếu bạn cho 0.1 kg nước sôi và 0.1 kg nước đá vào một chiếc cốc cách nhiệt, sau một
thời gian bạn sẽ có 0.2 kg nước ở khoảng 10°C.
Điều này hoàn toàn hợp lý vì năng lượng nhiệt từ nước sôi truyền sang đá, đá tan
chảy và hỗn hợp đạt cân bằng nhiệt.
Nhưng, nếu sau một thời gian bạn thấy hệ quay ngược lại thành 0.1 kg nước đá và 0.1
kg nước sôi thì điều đó sẽ rất bất ngờ.
Về mặt định luật I nhiệt động lực học (bảo toàn năng lượng) thì không sai, vì năng
lượng vẫn được bảo toàn.
Nhưng thực tế, hiện tượng đó không bao giờ xảy ra trong tự nhiên.
NHỮNG HẠN CHẾ CỦA NGUYÊN LÝ THỨ NHẤT CỦA NHIỆT ĐỘNG HỌC
▪ Nguyên lý I chỉ nói rằng năng lượng không thể tự sinh ra hay mất đi, mà chỉ chuyển hóa
từ dạng này sang dạng khác. Nhưng không cho biết quá trình đó xảy ra theo chiều nào.
Ví dụ: Nguyên lý thứ nhất không cấm việc nhiệt tự chảy từ lạnh sang nóng (vì vẫn bảo toàn
năng lượng). Nhưng trong thực tế, điều đó không bao giờ xảy ra tự nhiên → ta cần nguyên lý thứ hai để giải thích.
▪ Không giải thích được các quá trình tự diễn biến.
Nguyên lý thứ nhất không phân biệt được quá trình thuận nghịch (có thể đảo ngược) và bất
thuận nghịch (chỉ đi một chiều).
Ví dụ: Khi hòa mực vào nước, nguyên lý thứ nhất không nói tại sao mực hòa tan nhưng không tự tách ra.
Ví dụ: không giải thích tại sao nhiệt luôn truyền từ nóng → lạnh, chứ không ngược lại.
NHỮNG HẠN CHẾ CỦA NGUYÊN LÝ THỨ NHẤT CỦA NHIỆT ĐỘNG HỌC
▪ Theo nguyên lý I công và nhiệt lượng là tương đương nhau, công có thể chuyển hóa hoàn
toàn thành nhiệt, nhưng ngược lại thì không.
Ví dụ, ma sát làm nóng động cơ xe, chuyển hóa toàn bộ công cơ học thành nhiệt. Nhưng
việc chuyển hóa toàn bộ nhiệt lượng thành công cơ học trong một chu trình là điều không thể.
▪ Không cho biết hiệu suất của quá trình chuyển đổi năng lượng.
Ví dụ: Khi đốt than để chạy nhà máy điện, nguyên lý thứ nhất chỉ nói năng lượng hóa học
biến thành nhiệt, rồi thành cơ năng và điện. Nhưng không cho biết tại sao chỉ thu được <
40% thành điện, phần còn lại mất đi dưới dạng nhiệt thải.
Tóm lại, nguyên lý I không đưa ra tiêu chí nào về tính khả thi của một quá trình. Nó
chỉ trả lời câu hỏi "bao nhiêu?" (về năng lượng) chứ không trả lời câu hỏi "có thể không?"
hay "theo hướng nào?". Để giải quyết những hạn chế này, chúng ta cần đến nguyên lý II
nhiệt động lực học, với khái niệm entropy để xác định hướng tự phát của các quá trình.
HƯỚNG CỦA CÁC QUÁ TRÌNH NHIỆT ĐỘNG LỰC HỌC
❖ Các quá trình tự nhiên có một hướng ưu tiên, không thể tự đảo ngược.
Ví dụ, nhiệt luôn tự chảy từ một vật nóng sang một vật lạnh, không bao giờ ngược lại.
Tương tự, không khí trong một chiếc hộp sẽ lan tỏa đều khắp, chứ không bao giờ tự
động dồn về một phía, để lại chân không ở phía còn lại.
❖ Các hiện tượng này tuân theo một quy tắc cơ bản: mọi quá trình tự nhiên đều diễn
ra theo một hướng xác định, không bao giờ tự đảo ngược. Mặc dù sự đảo ngược
không vi phạm nguyên lý I của nhiệt động lực học (vì năng lượng vẫn được bảo
toàn), nhưng nó không xảy ra trong thực tế.
HƯỚNG CỦA CÁC QUÁ TRÌNH NHIỆT ĐỘNG LỰC HỌC
❖ Quá trình thuận nghịch và không thuận nghịch
➢ Quá trình thuận nghịch (Reversible Process): Đây là một quá trình lý tưởng hóa diễn
ra rất chậm, qua một chuỗi các trạng thái cân bằng. Nó có thể được đảo ngược bằng
cách thay đổi các điều kiện bên ngoài một cách vô cùng nhỏ. Trong quá trình này, hệ
thống luôn ở trạng thái cân bằng cơ học và nhiệt. Quá trình đưa hệ nhiệt động từ trạng
thái 1 sang trạng thái 2 và ngược lại, từ trạng thái 2 về trạng thái 1, đi qua đúng mọi
trạng thái trung gian giống như chiều thuận từ 1 đến 2.
➢ Quá trình không thuận nghịch (Irreversible Process): Đây là những quá trình thực tế
diễn ra trong tự nhiên. Chúng không thể tự đảo ngược trở lại trạng thái ban đầu mà
không cần có sự can thiệp từ bên ngoài. Ví dụ về quá trình này là sự giãn nở tự do của khí hoặc ma sát.
HƯỚNG CỦA CÁC QUÁ TRÌNH NHIỆT ĐỘNG LỰC HỌC
❖ Mối quan hệ với trật tự và hỗn loạn (Entropy)
Kết nối hướng của các quá trình tự nhiên với khái niệm entropy, thước đo của sự hỗn loạn
hoặc mất trật tự của một hệ thống.
•Các quá trình tự phát luôn có xu hướng chuyển từ trạng thái có trật tự cao sang trạng thái
có trật tự thấp hơn (hỗn loạn hơn).
•Ví dụ, khi một chất khí giãn nở, các phân tử của nó phân tán khắp không gian, tạo ra một
trạng thái hỗn loạn hơn so với khi chúng bị nén trong một thể tích nhỏ.
Điều này là một phần quan trọng của nguyên lý II của nhiệt động lực học, khẳng định
rằng entropy của một hệ kín luôn tăng trong một quá trình tự phát. ĐỘNG CƠ NHIỆT
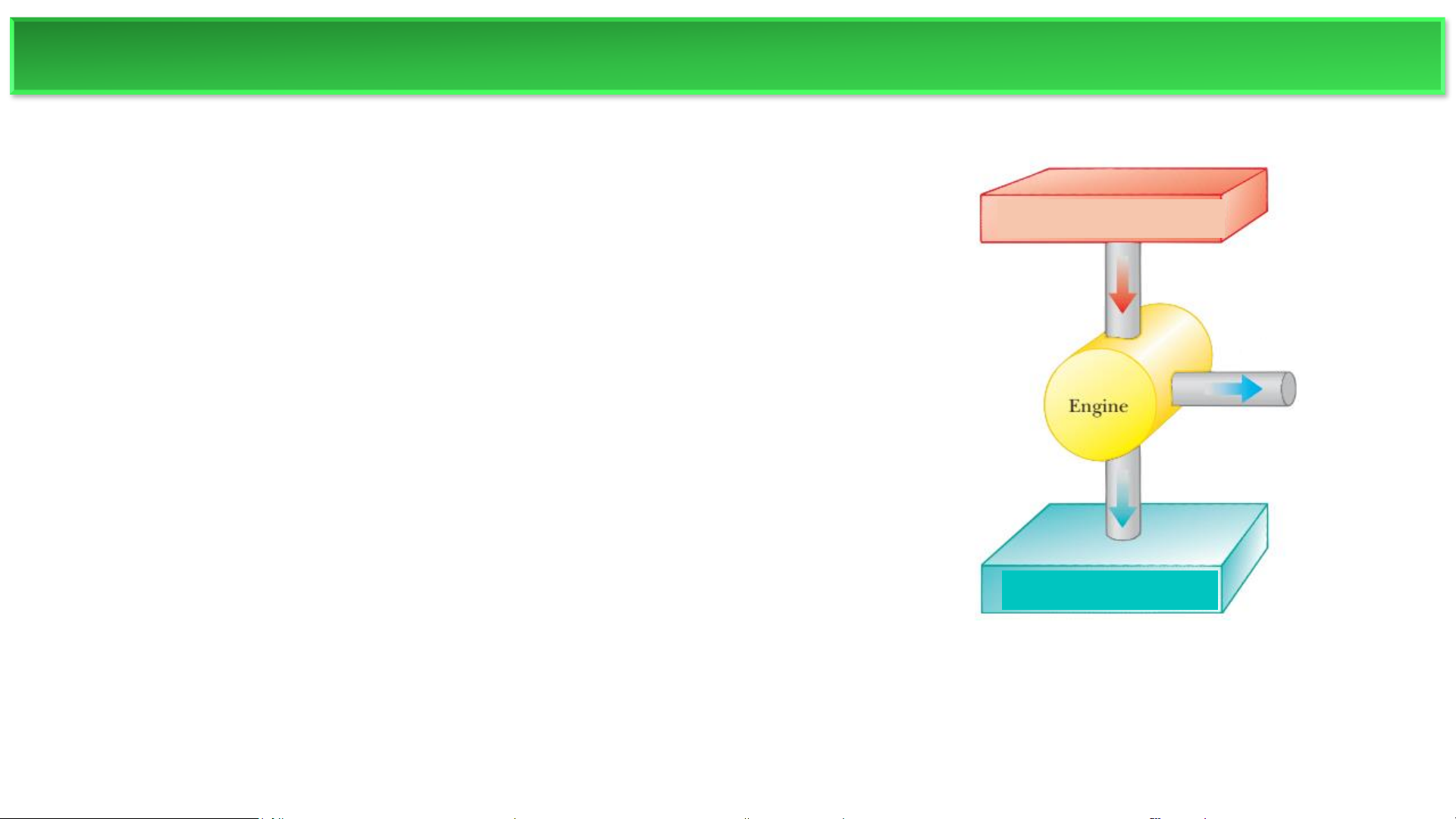
▪ Động cơ nhiệt là một thiết bị chuyển hóa năng lượng nhiệt thành công cơ học. Nó
hoạt động thông qua một chu trình (cyclic process), nghĩa là chất làm việc (working
substance, ví dụ như hơi nước hoặc hỗn hợp xăng-không khí) quay trở lại trạng thái
ban đầu sau khi hoàn thành một chuỗi các quá trình.
▪ Trong một chu trình, sự thay đổi nội năng của chất làm việc (ΔU) bằng 0. Do đó,
theo nguyên lý I của nhiệt động lực học, nhiệt (Q) truyền vào hệ thống bằng với
công (A) do động cơ thực hiện.
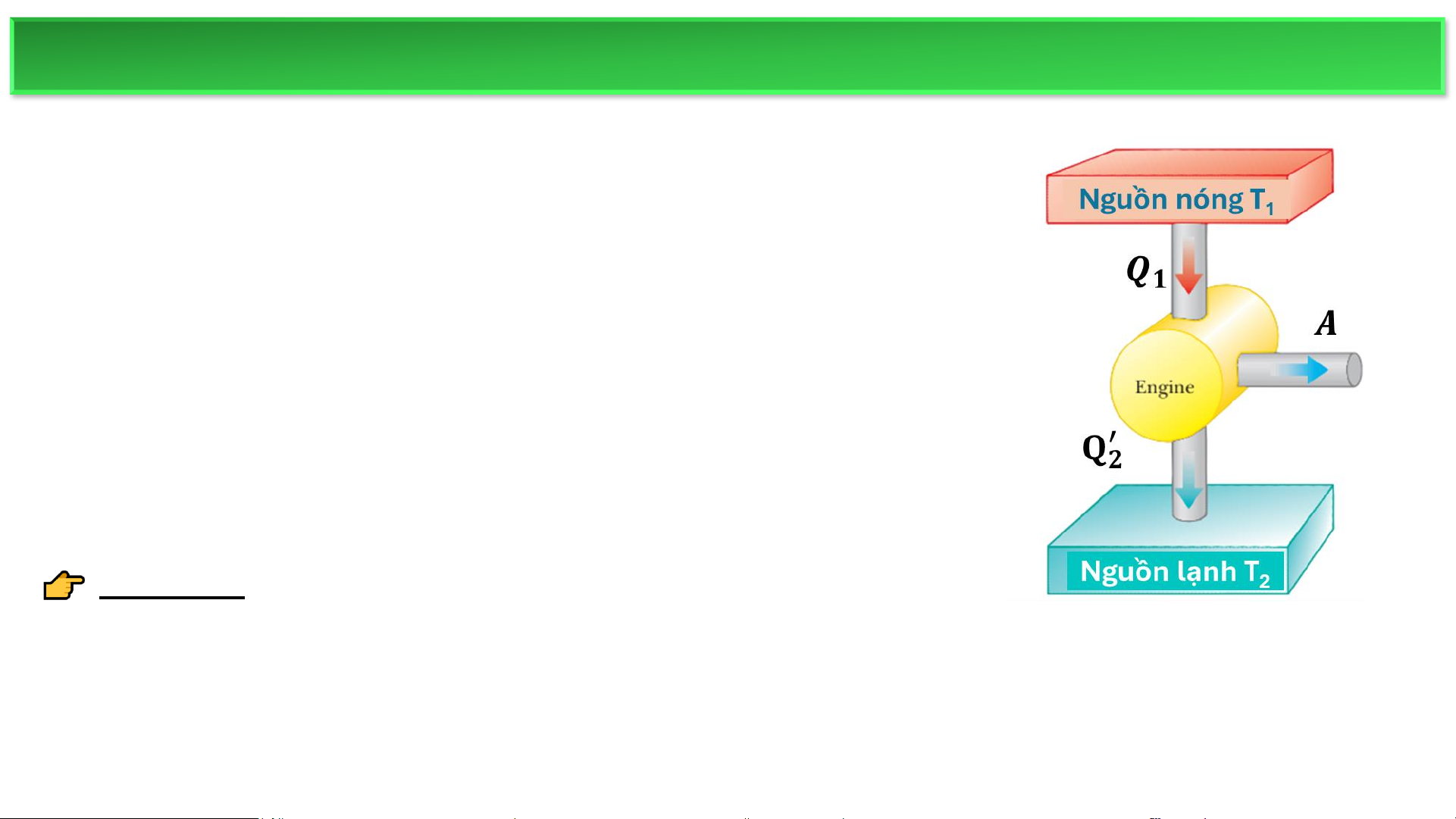
❖ Hoạt động của động cơ nhiệt
Nguồn nóng (Hot reservoir): Nguồn nóng (hot reservoir): Cung cấp nhiệt lượng
lớn ở nhiệt độ không đổi (ví dụ: ngọn lửa, khí nóng trong nồi hơi). Ở nhiệt độ cao
(T1). Động cơ nhận nhiệt lượng Q1 từ bể chứa này.
Nguồn lạnh (Cold reservoir): Hấp thụ phần nhiệt thải ra, cũng ở nhiệt độ không đổi
nhưng thấp hơn (ví dụ: nước lạnh hoặc không khí làm mát trong tuabin hơi). Ở nhiệt độ thấp (T ′
2). Động cơ xả nhiệt lượng 𝑄2 ra bể chứa này. ĐỘNG CƠ NHIỆT
❖ Hoạt động của động cơ nhiệt
Chu trình hoạt động chung của động cơ nhiệt
Một động cơ nhiệt luôn thực hiện chu trình khép kín với Nguồn nóng T1
chất làm việc (working substance). Chu trình gồm 3 giai 𝑸 đoạn chính: 𝟏
1.Nhận nhiệt từ nguồn nóng (hot reservoir) ở nhiệt độ 𝑨 cao.
→ Nhiệt lượng này làm chất làm việc tăng năng lượng. 𝐐′ 2.Sinh công (work done by the engine). 𝟐
→ Chất làm việc thực hiện công cơ học ra bên ngoài (ví
dụ: đẩy piston, quay tua-bin). Nguồn lạnh T2
3.Thải nhiệt ra nguồn lạnh (cold reservoir) ở nhiệt độ thấp hơn.
→ Đây là phần nhiệt không thể chuyển thành công nên bị thải bỏ. ĐỘNG CƠ NHIỆT
Ví dụ: Động cơ hơi nước
•Chất làm việc: nước. •Chu trình:
• Nước được đun trong nồi hơi → bốc hơi thành hơi nước nóng.
• Hơi nước giãn nở và đẩy piston → sinh công cơ học.
• Sau đó, hơi nước được ngưng tụ nhờ nước làm mát → trở lại thành nước lỏng.
• Nước này lại quay về nồi hơi → bắt đầu chu trình mới.
Ý nghĩa: Chu trình này cho thấy không có động cơ nào có
thể biến toàn bộ nhiệt nhận được thành công cơ học. Một
phần nhiệt luôn phải thải ra môi trường (nguồn lạnh). Đây chính
là nền tảng dẫn đến nguyên lý thứ hai của nhiệt động học. ĐỘNG CƠ NHIỆT
❖ Hoạt động của động cơ nhiệt
▪ Công có ích do động cơ thực hiện là A. Công do chất làm việc thực hiện.
▪ Q là dương (nhiệt nhận vào), và 𝑸, là âm (nhiệt thải ra). Tuy nhiên, để tiện cho
việc tính toán, thường dùng giá trị tuyệt đối của chúng: Khi đó: 𝑸 ′ 𝟏 = 𝑨′ + 𝑸𝟐
tức là nhiệt vào bằng công sinh ra cộng với nhiệt thải.
➢ Điều này có nghĩa là
Công có ích mà động cơ tạo ra là phần chênh lệch giữa nhiệt lượng
nhận vào và nhiệt lượng thải ra. Động cơ nhiệt nhận nhiệt từ nguồn
nóng, biến đổi một phần thành công, còn lại thải ra nguồn lạnh. ĐỘNG CƠ NHIỆT
❖Hiệu suất động cơ nhiệt
Hiệu suất nhiệt () của động cơ nhiệt là thước đo mức độ hiệu quả của động cơ trong
việc chuyển đổi nhiệt năng thành công cơ học. Nó được định nghĩa là tỷ số giữa công
hữu ích (A’) và nhiệt lượng nhận vào (Q1) 𝑨′ 𝑸 ′ 𝑸′ = =
𝟏 − 𝑸𝟐 = 𝟏 − 𝟐 𝑸𝟏 𝑸𝟏 𝑸𝟏
❖Phát biểu nguyên lý thứ hai nhiệt động lực học:
▪ Phát biểu của Thompson: Một động cơ nhiệt không thể sinh công nếu nó chỉ trao đổi với một
nguồn nhiệt duy nhất. → Không chế tạo được động cơ vĩnh cửu loại 2.
▪ Không thể chế tạo một máy làm việc theo chu trình mà chỉ nhận nhiệt từ một nguồn rồi biến toàn bộ nhiệt đó thành công.
→ Nói cách khác, không thể = 𝟏 (tức 𝑸′𝟐 = 𝟎) đối với một động cơ nhiệt. Luôn luôn có
một lượng nhiệt thải ra ( 𝑸′ ) không thể tránh khỏi. Vì vậy, hiệu suất nhiệt () luôn nhỏ hơn 𝟐 1. ĐỘNG CƠ NHIỆT ❖Ví dụ
Trong một chu trình, một động cơ trích xuất 2×103 J năng lượng từ một nguồn nóng và
truyền 1.50×103 J đến một nguồn lạnh. (a) Tìm hiệu suất nhiệt của động cơ. (b) Động
cơ này thực hiện bao nhiêu công trong một chu trình? (c) Động cơ tạo ra công suất bao
nhiêu nếu nó trải qua bốn chu trình trong 2.50 s?
(a) Tìm hiệu suất nhiệt của động cơ. 𝑸′ 𝟏. 𝟓 × 𝟏𝟎𝟑 = 𝟏 − 𝟐 = 𝟏 − = 𝟎. 𝟐𝟓 = 𝟐𝟓% 𝑸𝟏 𝟐 × 𝟏𝟎𝟑
(b) Động cơ này thực hiện bao nhiêu công trong một chu trình? 𝑨′ = 𝑸 ′
𝟏 − 𝑸𝟐 = 𝟐 × 𝟏𝟎𝟑 − 𝟏. 𝟓 × 𝟏𝟎𝟑 = 𝟓 × 𝟏𝟎𝟐 𝑱
(c) Tìm công suất đầu ra của động cơ. 𝑨′ 𝟓 × 𝟏𝟎𝟐 × 𝟒 𝑃 = = = 𝟖 × 𝟏𝟎𝟐 𝑾 𝑡 2.5 ĐỘNG CƠ NHIỆT ❖Ví dụ
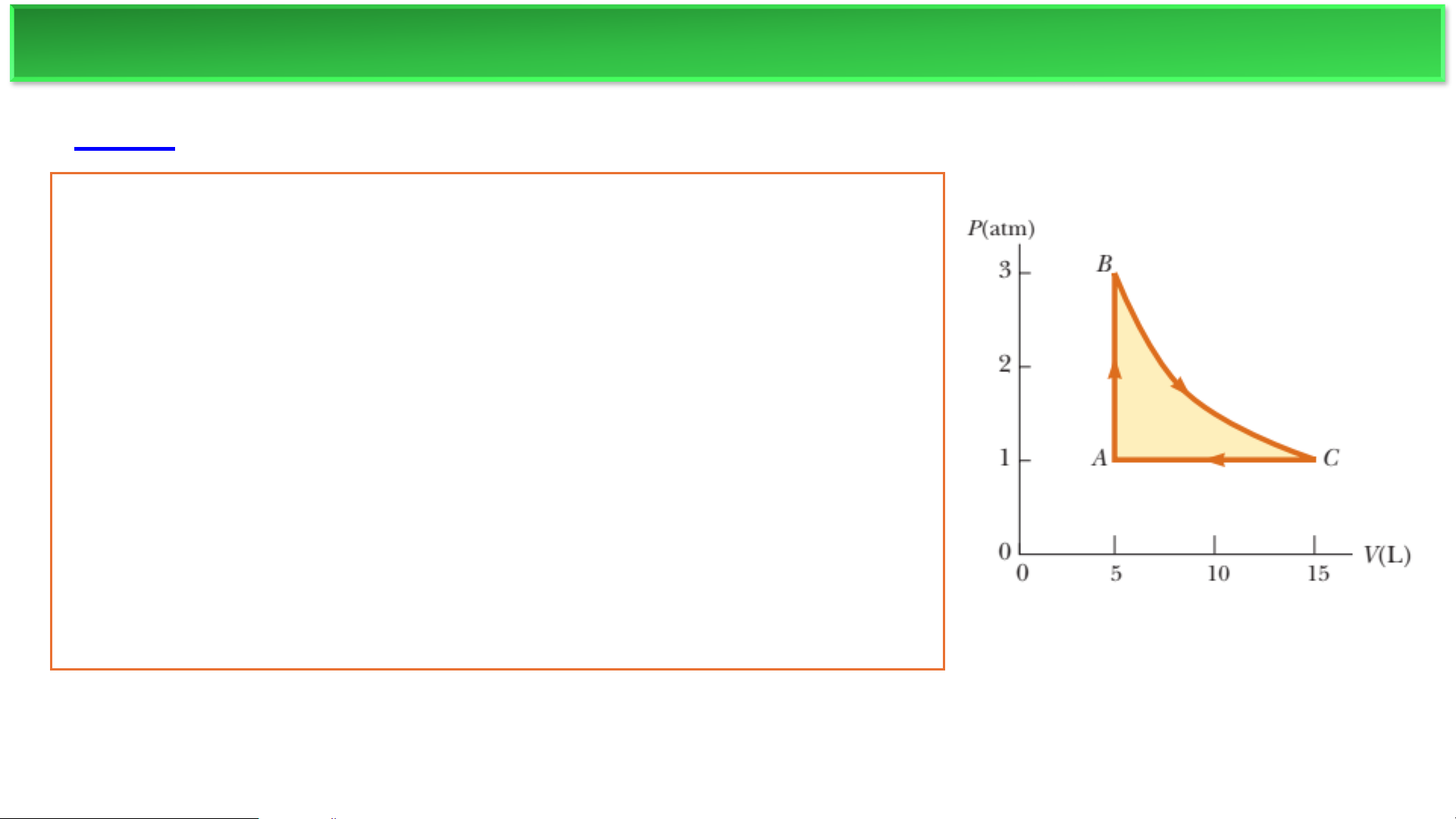
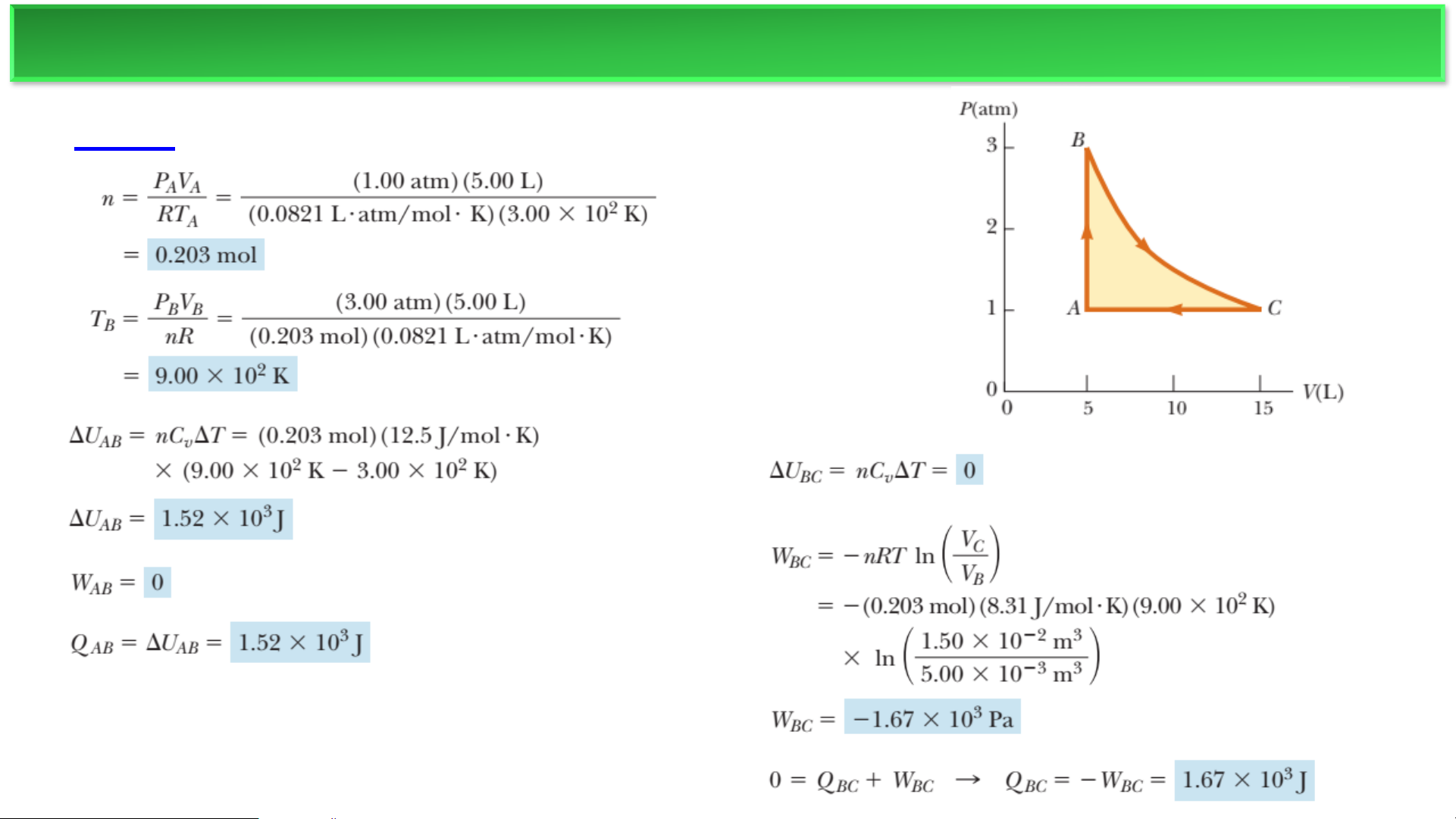
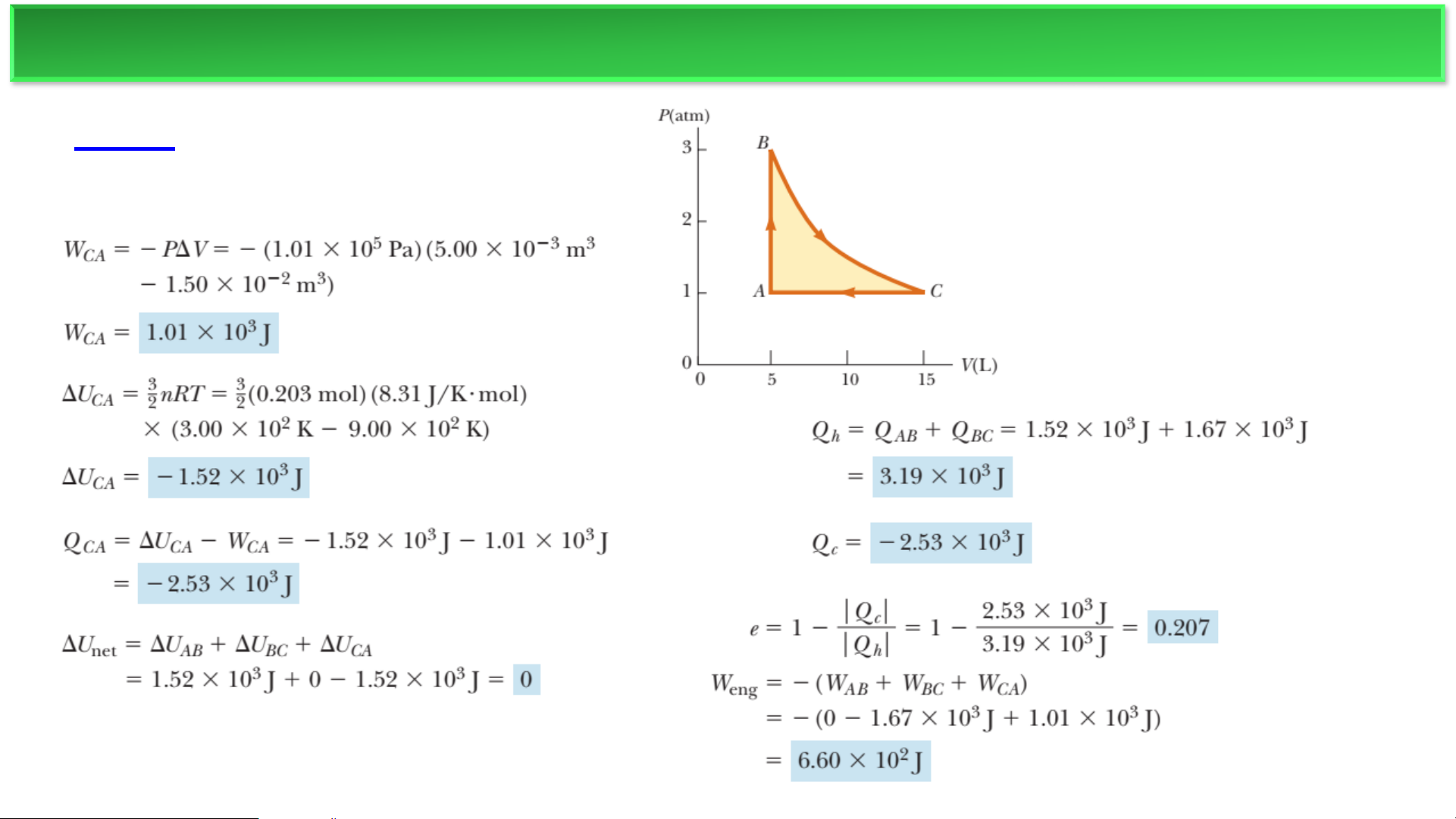
Một động cơ nhiệt chứa một chất khí đơn nguyên tử lý
tưởng được nén trong một xi lanh bằng một piston di
chuyển được. Chất khí bắt đầu tại điểm A, nơi T=3×103 K.
(Hình 12.11a.) B→C là một quá trình giãn nở đẳng nhiệt.
(a) Tìm số mol n của chất khí và nhiệt độ tại B. (b) Tìm
ΔU, Q, và a cho quá trình đẳng tích A→B. (c) Lặp lại cho
quá trình đẳng nhiệt B→C. (d) Lặp lại cho quá trình đẳng
áp C→A. (e) Tìm sự thay đổi ròng về nội năng cho toàn bộ
chu trình. (f) Tìm năng lượng nhiệt được truyền vào hệ,
năng lượng nhiệt bị thải ra, hiệu suất nhiệt, và công mà
động cơ thực hiện lên môi trường. ĐỘNG CƠ NHIỆT ❖Ví dụ a) b) c) ĐỘNG CƠ NHIỆT ❖Ví dụ d,e) f) MÁY LÀM LẠNH ❖Tủ lạnh Nguồn nóng T1
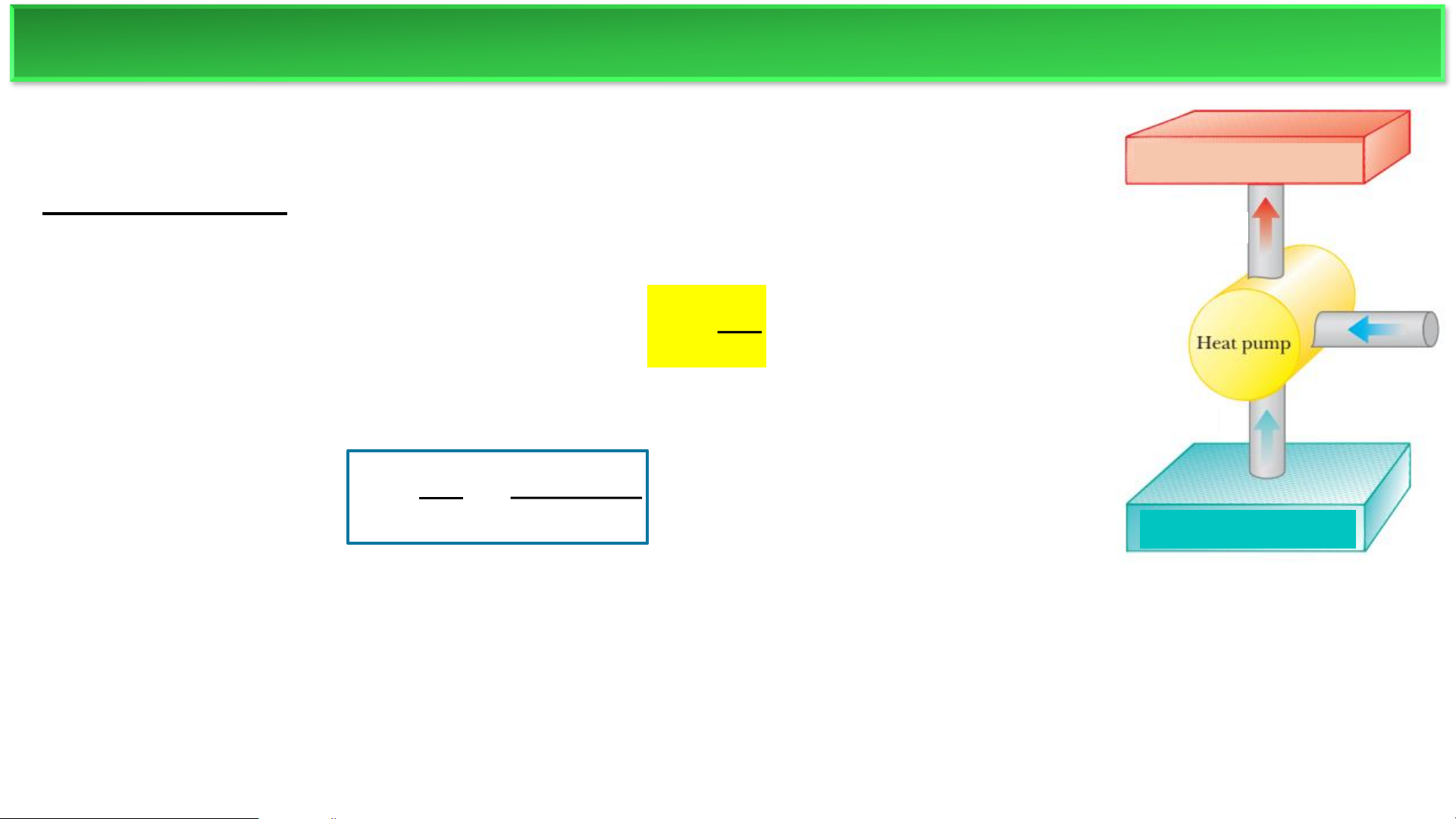
▪ Động cơ nhiệt: Lấy năng lượng từ một nguồn nóng và biến một ′
phần thành công cơ học, sau đó thải phần năng lượng còn lại ra 𝐐𝟏 nguồn lạnh. 𝑨
▪ Bơm nhiệt (hoạt động ngược lại): Năng lượng được cung cấp (dưới
dạng công) để di chuyển nhiệt từ một nguồn lạnh đến một nguồn nóng. 𝑸𝟐
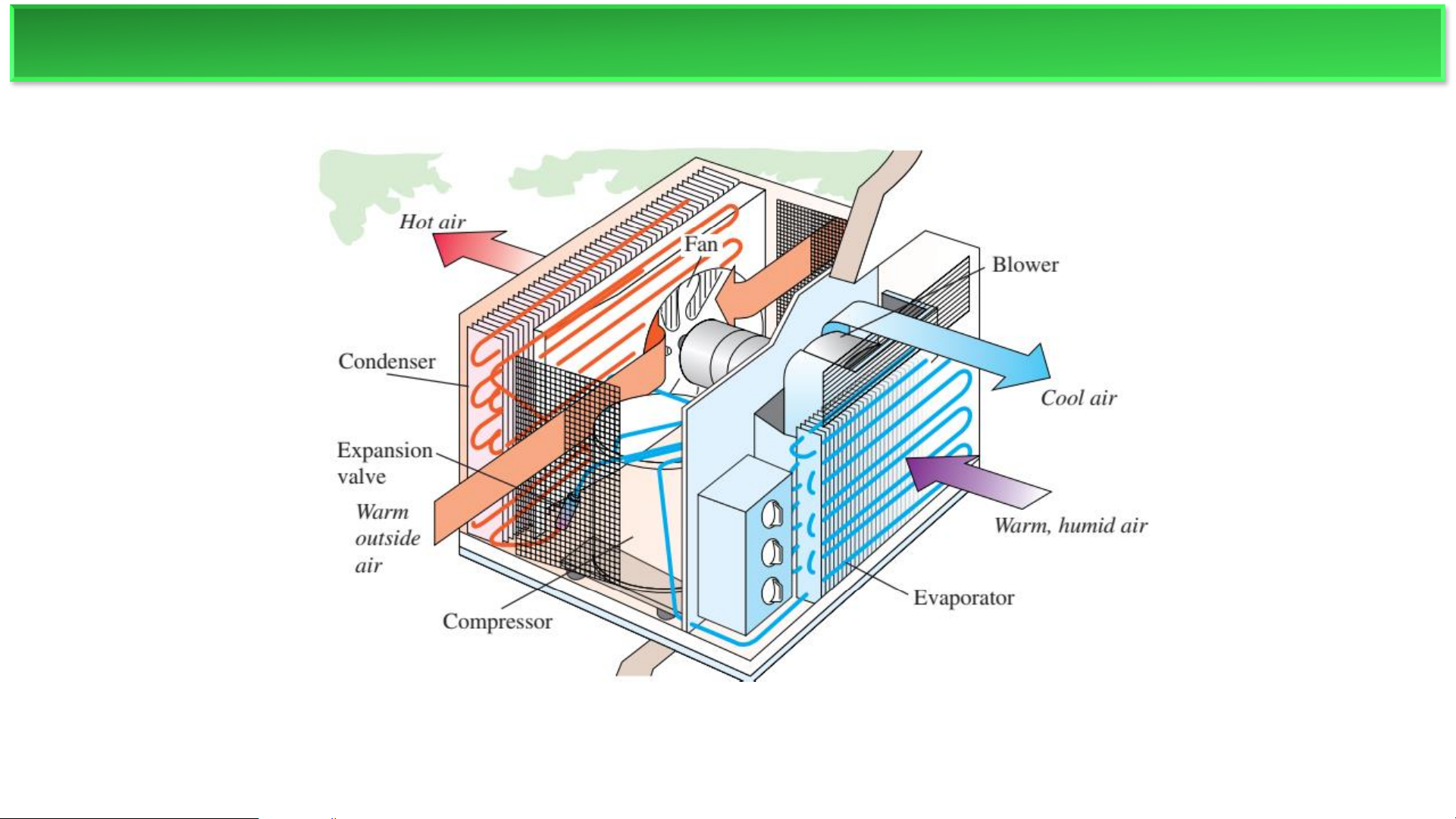
Ví dụ phổ biến nhất của bơm nhiệt là tủ lạnh.
Quá trình: Năng lượng nhiệt ( 𝑸𝟐 ) được hút ra từ bên trong tủ lạnh Nguồn lạnh T
(nguồn lạnh). Năng lượng này, cùng với công (A’) được thực hiện bởi 2
máy nén, được chuyển đến môi trường bên ngoài (nguồn nóng) dưới
dạng năng lượng nhiệt (𝑸′ ). 𝟏
▪ Công việc: Công (A) là năng lượng điện mà bạn phải trả để máy nén hoạt động.
▪ Lợi ích: Lợi ích mong muốn là loại bỏ nhiệt từ bên trong tủ lạnh (𝑸𝟐). MÁY LÀM LẠNH ❖Tủ lạnh Nguồn nóng T1
Hệ số làm lạnh là tỷ số giữa năng lượng nhiệt được hút ra từ nguồn ′
lạnh và công (A) được cung cấp cho thiết bị. 𝐐𝟏 𝑨 𝑸 𝜺 = 𝟐 𝑨 Theo NL 1 𝑄′ ′
1 = 𝐴 + 𝑄2 → 𝐴 = 𝑄1 − 𝑄2 𝑸𝟐 𝑸 𝑸 𝜺 = 𝟐 = 𝟐 𝑨 𝑸′𝟏 − 𝑸𝟐 Nguồn lạnh T2
▪ càng cao, thiết bị càng hiệu quả. Điều này có nghĩa là nó có thể loại
bỏ nhiều nhiệt hơn từ nguồn lạnh (Q2) với một lượng công nhỏ (A).
▪ Thiết bị hiệu quả nhất là thiết bị loại bỏ được lượng nhiệt lớn nhất từ
nguồn lạnh với lượng công nhỏ nhất. MÁY LÀM LẠNH MÁY LÀM LẠNH ❖Ví dụ
Các ngoại lực trong máy làm lạnh lý tưởng thực hiện một công bằng bao nhiêu
để lấy đi nhiệt lượng 105J từ buồng làm lạnh, nếu nhiệt độ trong nguồn là 263K
và nhiệt độ của nước làm lạnh là 285K Th = 285 K Tc = 263 K
Hệ số máy làm lạnh lý tưởng: Q Q = 2 = 2 A Q, −Q 2 = 263 1 = 11,95 285−263 T ε 2 lý tưởng =
Công thực hiện của máy lạnh: T1 − T2 Q = 2 => A = Q = 8368 (J) A 2/ = 105 11,95



