






Preview text:
Bài giảng Hóa học – Cấu tạo chất.
Chương 6. THUYẾT ORBITAL PHÂN TỬ
Thuyết liên kết hóa trị còn một số hạn chế như chưa giải thích được từ tính của một
số phân tử (ion) và sự tồn tại của những liên kết chỉ đảm bảo bởi 1 electron (đã trình
bày ở cuối chương 5). Thuyết orbital phân tử ra đời đã giải quyết được những hạn chế
đó. Tuy nhiên, thuyết orbital phân tử khá phức tạp, người ta thường phải dùng các
phương pháp gần đúng. Phương pháp gần đúng thường dùng là phương pháp Orbital
phân tử - Tổ hợp tuyến tính các orbital nguyên tử. (Molecular Orbital – Linear
Combination of Atomic Orbitals: MO-LCAO)
6.1. Cơ sở lý thuyết của phương pháp MO
Trong thuyết V.B, các orbital nguyên tử (AO) vẫn còn nguyên vẹ trong các phân tử,
nghĩa là vẫn còn giữ được đặc tính riêng của các nguyên tử trong phân tử. Vì vậy, ta
dùng cấu hình electron của từng nguyên tử để giải thích liên kết. Còn trong thuyết MO,
các electron của các nguyên tử trong phân tử là chung của toàn bộ phân tử, nguyên tử
không còn giữa dặc tính riêng trong phân tử.
Các hạt nhân nguyên tử trong phân tử được coi như đứng yên. Mỗi electron trong
phân tử được coi như chuyển động trong một điện trường do các hạt nhân nguyên tử và
các electron còn lại gây ra. Trạng thái của mỗi electron được mô tả bằng một hàm sóng
gọi là orbital phân tử (MO). Trạng thái của toàn bộ phân tử được xác định bởi hàm sóng
toàn phần của phân tử.
Các MO được tạo thành do sự tổ hợp tuyến tính của các AO. Chỉ các AO hóa trị mới
có thể tham gia tổ hợp để tạo MO, n AO tham gia tổ hợp thì thu được n MO.
Bài toán phân tử quy về việc xác định các MO và các mức năng lượng tương ứng
của chúng, xây dựng giản đồ mức năng lượng của các MO, sau đó sắp xếp electron vào
các MO theo những nguyên lí và quy tắc thích hợp để thu được cấu trúc electron của phân tử.
Giải phương trình sóng Schrodinger sẽ thu được hàm sóng trong phân tử (MO) và
năng lượng tương ứng. Sau đây ta sẽ lần lượt khảo sát các phân tử (ion) từ đơn giản đến phức tạp.
6.2. Điều kiện để tổ hợp bền các AO thành MO
Để tổ hợp bền các AO tham gia tổ hợp phải đảm bảo các điều kiện sau:
• Các AO phải gần nhau về mặt năng lượng.
• Các AO phải xen phủ nhau đáng kể.
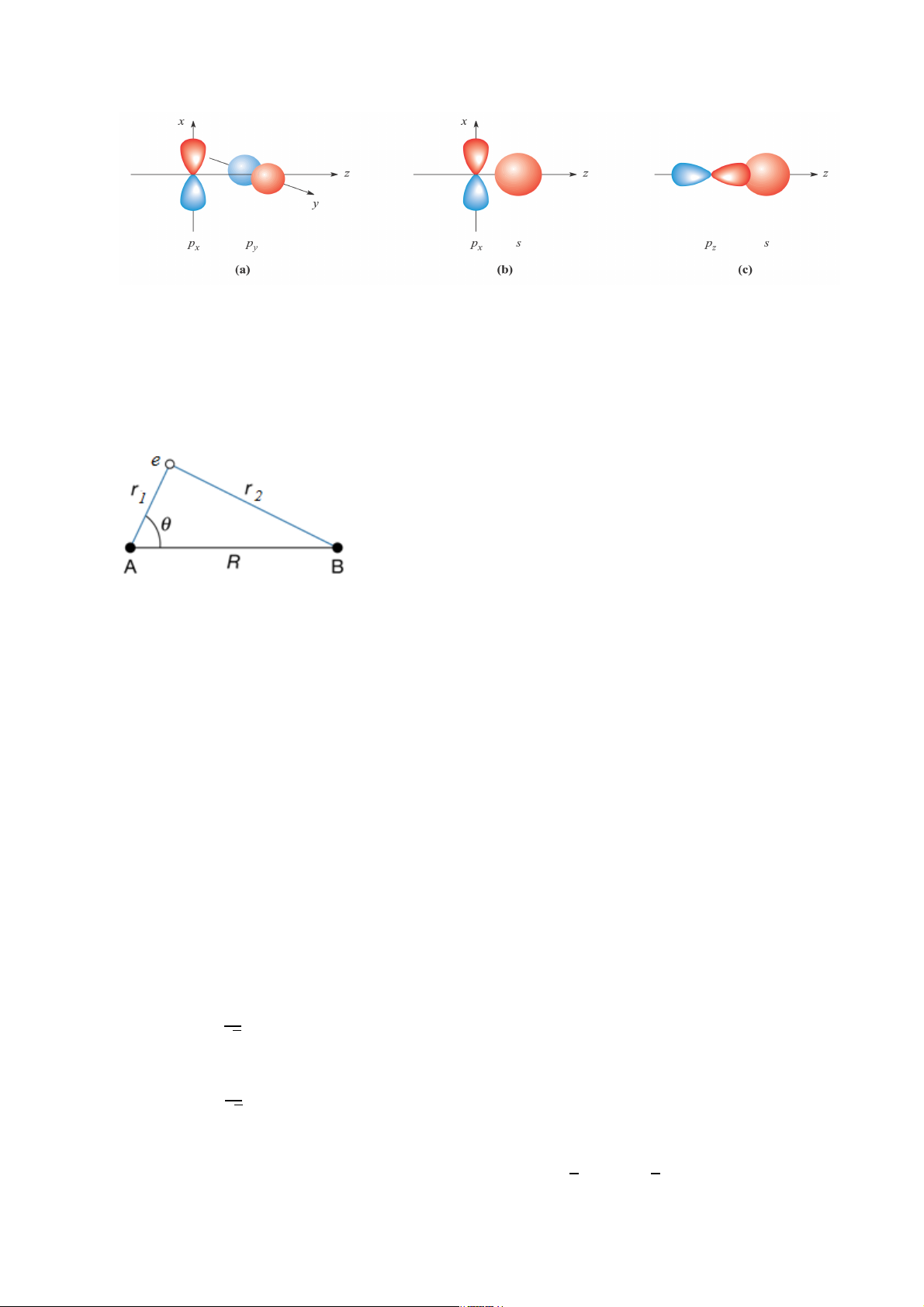
• Các AO phải đối xứng giống nhau đối với đường liên kết trong phân tử . Hình
6.1. a và 6.1b không tạo liên kết, 6.1c tạo liên kết. 1
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Hình 6.1. Các kiểu đối xứng giữa các AO tham gia tổ hợp
6.3. Phân tử (ion) hai nguyên tử có hạt nhân giống nhau A n± 2
6.3.1. Phân tử (ion) hai nguyên tử có hạt nhân giống nhau chu kì 1
Xét sự tạo thành ion H + 2 . Ion H +
2 là hệ có 2 tâm. Hai hạt nhân nguyên tử hidro A
và B coi như đứng yên. Một electron chuyển động
trong hệ. Đây là bài toán 1 electron. Phương trình sóng
Schrodinger như sau: Hψ = Eψ
Giải phương trình sóng ta được hàm sóng ψ (MO) và Hình 6.2. Ion H + năng lượng E. 2 .
Trong phân tử, hai hạt nhân A và B cách nhau một khoảng R xác định. Khi electron
chuyển động gần hạt nhân A, nó chịu tác dụng chủ yếu của hạt nhân A và trạng thái
electron được mô tả bởi hàm sóng φ1 của nguyên tử A nhưng chịu một nhiễu loạn nào
đó gây ra bởi hạt nhân B, nên phải có một số hạng bổ sung vào biểu thức của MO.
Tương tự như vậy, khi electron chuyển động gần hạt nhân B, trạng thái của nó được mô
tả bởi hàm sóng φ2 có bổ sung một số hạng biểu thị sự nhiễu loạn gây ra bởi hạt nhân
A. Từ đó có thể coi MO ψ như tổ hợp tuyến tính của các AO φ1 và φ2. Ψ = a1φ1 + a2φ2 Các hệ số a 2 2
1 và a2 là trọng lượng thống kê của φ1 và φ2, a1 và a2 là xác suất để
electron trong phân tử được mô tả bởi φ1 hay φ2. Vì hai hạt nhân A và B giống nhau nên: a 2 2 1 = a2 nên có a1 = ± a2.
Sau khi giải phương trình sóng schrodinger của ion H +
2 bằng phương pháp biến phân ta được kết quả là:
ψlk = ψ+ = ! (φ1 + φ2) ứng với MO liên kết (kí hiệu MO) có năng lượng thấp E+. √#
Thấp hơn năng lượng của các AO ban đầu.
ψplk = ψ- = ! (φ1 - φ2) ứng với MO phản liên kết (kí hiệu MO*) có năng lượng cao √#
E-. Cao hơn năng lượng của các AO ban đầu.
Nếu có n AO tổ hợp ta sẽ thu được n MO trong đó có $ MO và $ MO*. # # 2
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
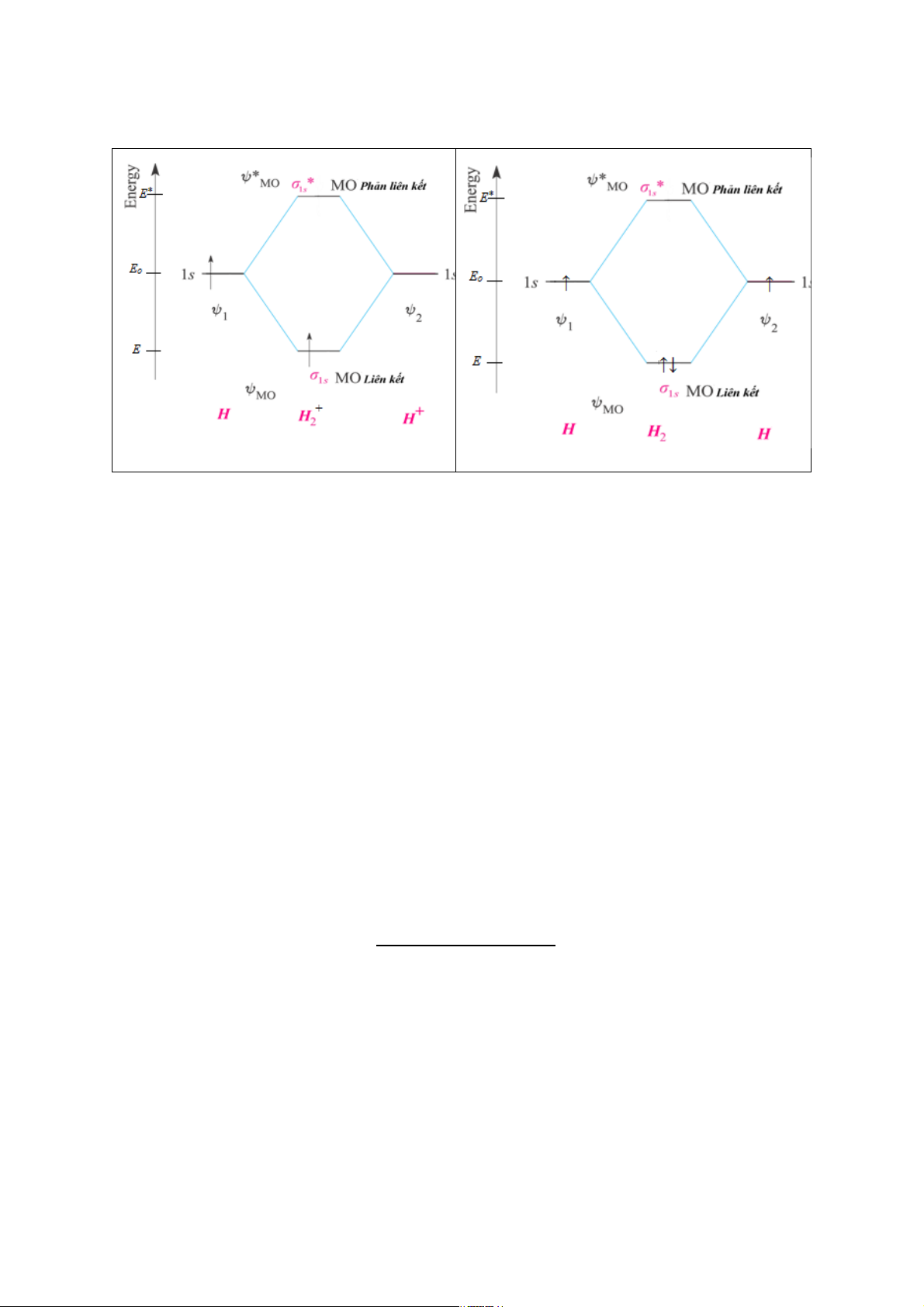
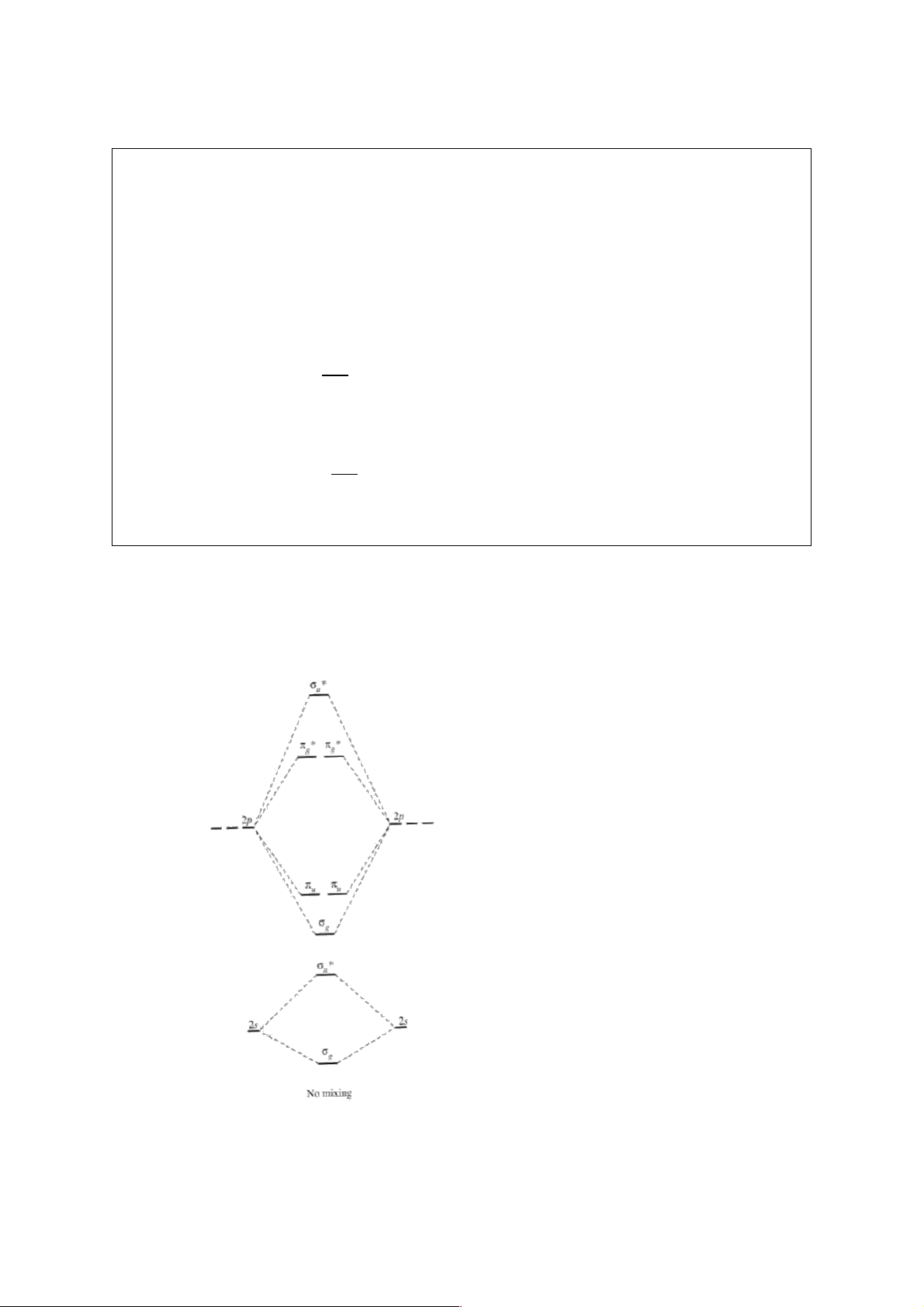
Giản đồ năng lượng các MO của H + 2 : (a) (b)
Hình 6…Giản đồ năng lượng các MO của ion H + 2 .
Sự tổ hợp của 2 AO 1s của nguyên tử H và ion H+ thu được 2 MO là MO liên kết σ *
1s và MO phản liên kết σ1s (hình 6..a). MO σ1s có năng lượng E thấp hơn so với năng
lượng của các AO ban đầu E *
0. MO σ1s có năng lượng E* cao hơn năng lượng E0 của các AO ban đầu. Ion H +
2 có 1 electron sẽ phân bố vào MO có năng lượng thấp nhất. Sự phân bố
electron trong phân tử cũng tuân theo nguyên lí Pauli, nguyên lí vững bền và qui tắc
Hund giống như trong nguyên tử. Ta viết được cấu hình electron phân tử (ion) của H + 2 như sau: σ 1 1s .
Tượng tự ta cũng vẽ được giản đồ năng lượng của phân tử H2 (hình 6..b). Cấu hình electron của phân tử H 2 2 là σ1s .
6.3.2. Đặc trưng cơ bản của liên kết hóa học và từ tính của phân tử (ion)
6.3.2.1. Bậc liên kết, độ dài liên kết và độ bền liên kết
Thuyết MO cho cách tính bậc liên kết như sau:
Bậc liên kết (P) = 𝐒ố 𝐞 𝐭𝐫ê𝐧 𝐌𝐎– 𝐒ố 𝐞 𝐭𝐫ê𝐧 𝐌𝐎∗ [6.1] 𝟐
Theo công thức (6.1), bậc liên kết tính được có thể là số nguyên, số không nguyên
và thậm chí bằng 0. Bậc liên kết càng lớn thì liên kết càng bền, năng lượng cần để phá
vỡ liên kết càng lớn và độ dài liên kết càng giảm.
Bậc liên kết bằng 0 thì không tồn tại liên kết.
6.3.2.2. Từ tính của phân tử (ion)
Phân tử (ion) có electron tự do thì có từ tính (hay còn gọi là thuận từ), không có
electron tự do thì không có từ tính (hay còn gọi là nghịch từ). 3
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Ví dụ: Tính bậc liên kết của ion H +
2 và phân tử He2. Từ đó cho biết phân tử (ion)
nào bền hay không bền. Xác định từ tính của phân tử (ion) bền. Giải: Ion H + 1
2 đã được xác định có cấu hình electron σ1s . Bậc liên kết là: P(H + +
2 ) = ! = 0,5 > 0 nên ion H bền. # 2
Từ giản đồ năng lượng hình 6..a cho thấy H +
2 có 1 electron tự do nên nó có từ tính.
Bằng cách tương tự ion H +
2 ta vẽ được giản đồ năng lượng các MO cho phân tử He *
2. 4 electron của phân tử He2 sẽ được phân bố vào 2 MO σ1s và σ1s , mỗi MO 2
electron, cấu hình electron như sau: σ 2 *2 1s σ1s .
Bậc liên kết P (He2) = #2# = 0 nên phân tử He #
2 không bền, nghĩa là không tồn tại phân tử này.
Ví dụ tự giải: Tính bậc liên kết và xác định từ tính của H + 2 và He2 .
6.3.3. Phân tử (ion) hai nguyên tử có hạt nhân giống nhau A n± 2 chu kì 2
Mỗi nguyên tử chu kì 2 khi tham gia liên kết sẽ sử dụng 4 AO hóa trị (1 AO 2s và
3 AO 2p) để tham gia tổ hợp. Như vậy, phân tử hai nguyên tử giống nhau sẽ có 8 AO
tham gia tổ hợp, ta sẽ thu được 8 MO, trong đó 4 MO liên kết và 4 MO phản liên kết.
Cụ thể: 1 AO 2s của nguyên tử này tổ hợp với 1 AO 2s của nguyên tử kia được 2 MO là σ *
2s và σ2s . 3 AO 2p (px, py, pz) của nguyên tử này tổ hợp với 3 AO 2p của nguyên tử kia được 6 MO là σ * * *
pz, σpz , πpx, πpx , πpy, πpy .
Như đã đề cập ở trên, MO được tạo thành do sự tổ hợp của các AO 2s và 2p. Tuy
nhiên, đi từ đầu đến cuối chu kì, hiệu năng lượng np – ns tăng nên thứ tự năng lượng
các MO trong các phân tử đầu và cuối chu kì có chút khác nhau. Ta cần phân biệt giản
đồ năng lượng của các phân tử đầu chu kì và cuối chu kì.
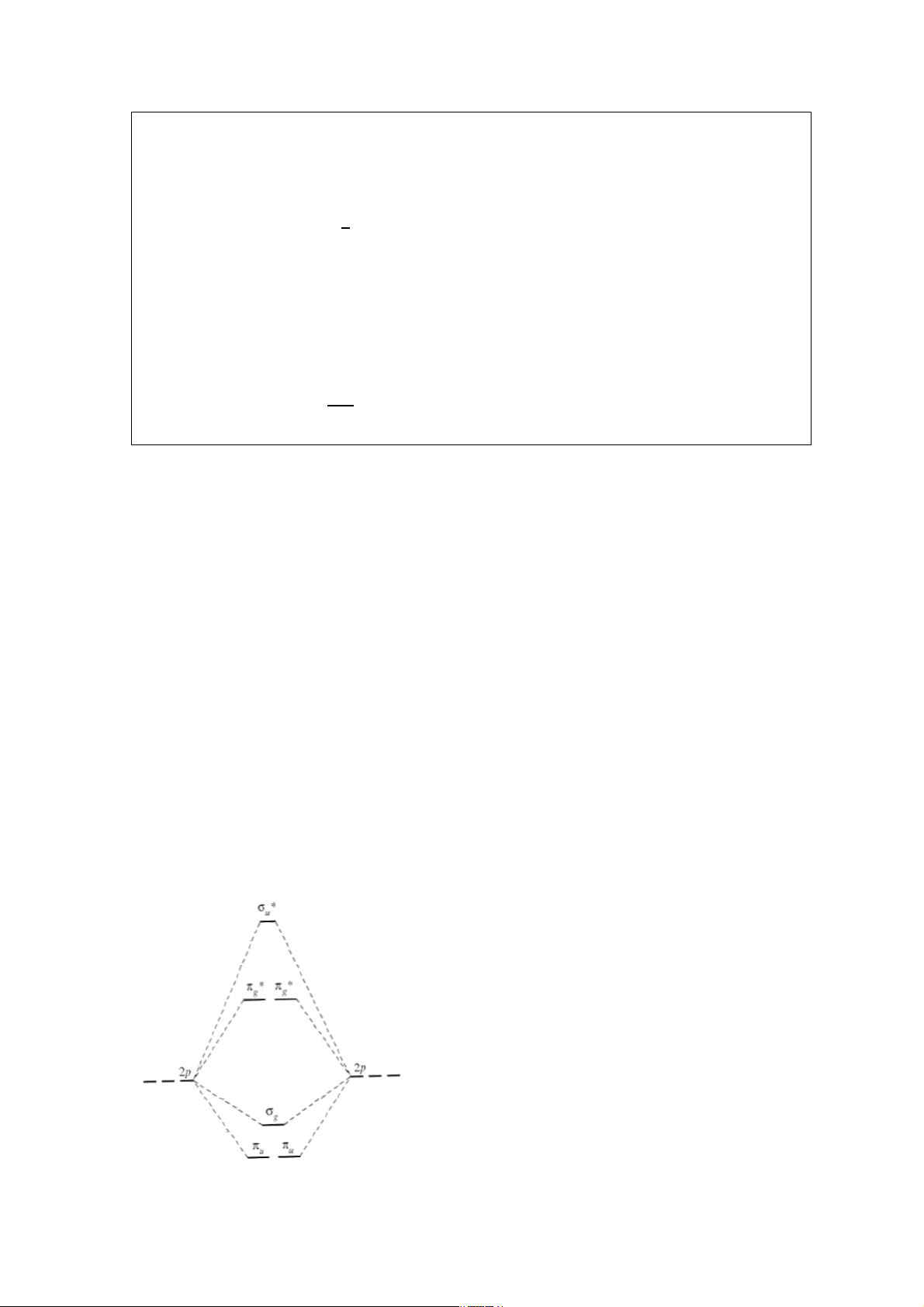
6.3.3.1. Giản đồ năng lượng phân tử (ion) A n±
2 đầu chu kì 2
Các nguyên tố đầu chu kì 2 bao gồm các nguyên tố có Z ≤ 7: Li, Be, B, C và N.
Để đơn giản, ta kí hiệu MO trên giản đồ là
“-“ thay cho ô lượng tử.
Hai nguyên tử A là như nhau nên năng lượng
của các AO 2s và AO 2p của hai nguyên tử
là bằng nhau trên giản đồ.
Trên giản đồ ta thấy năng lượng MO σpz lớn
hơn năng lượng MO πpx và πpy. Điều này là
do nguyên tử các nguyên tố đầu chu kì có
năng lượng ns và np rất gần nhau nên xảy ra
sự đẩy nhau mạnh giữa MO σ2s và MO σpz, 4
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
làm cho σpz nhảy lên mức năng lượng cao hơn.
Như vậy, thứ tự năng lượng các MO trong phân tử ion A n± 2 đầu chu kì 2 như sau: (KK) б * * * *
2s б2s π2px=π2py б2pz π2px = π2py б2pz .
(KK): Kí hiệu lớp 1 ở bên trong không tham gia liên kết.
Hình 6.. Giản đồ năng lượng các MO của phân tử (ion) A n± 2 đầu chu kì 2.
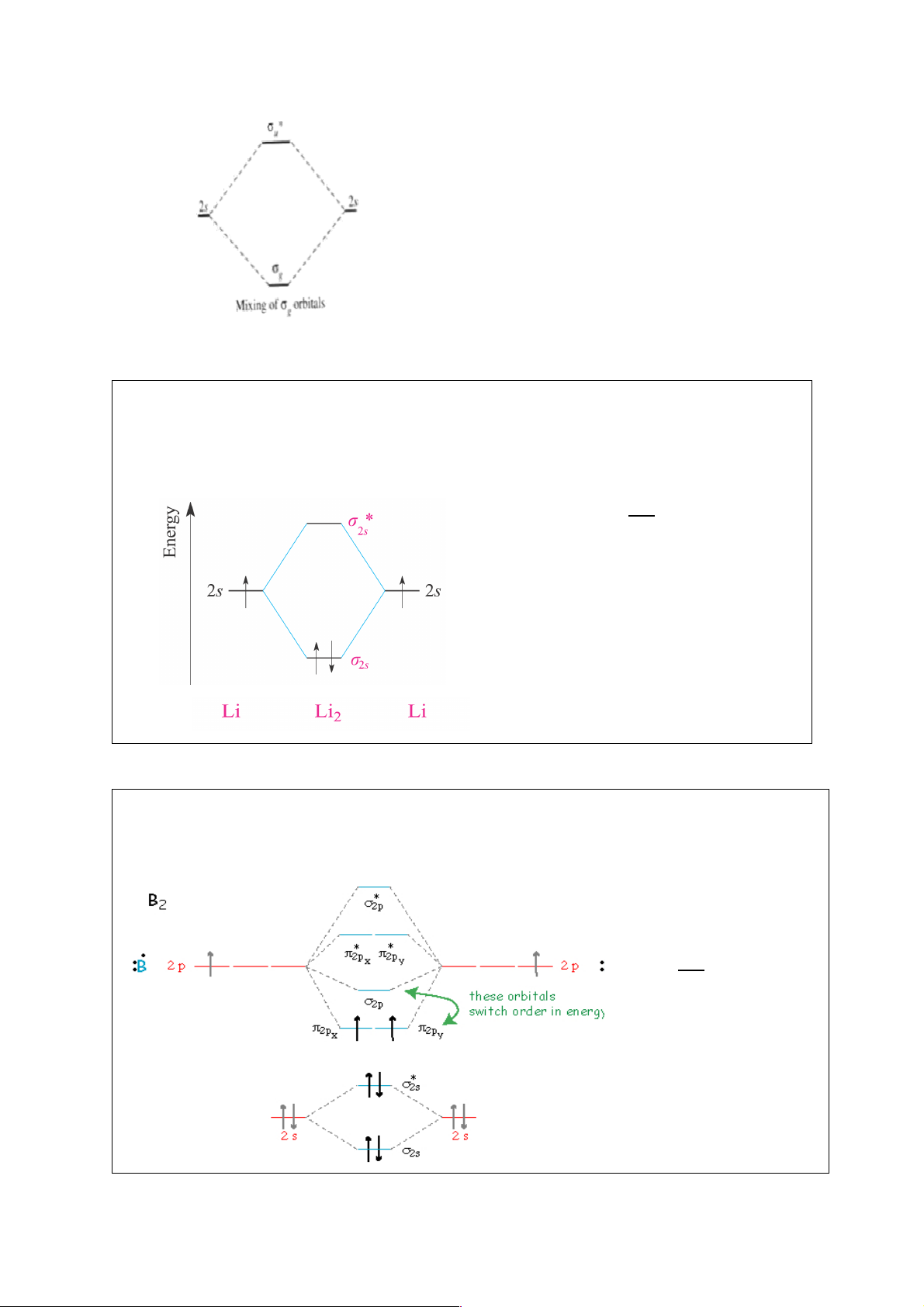
Ví dụ 1: Vẽ giản đồ năng lượng, tính bậc liên kết và xác định từ tính của phân tử Li2.
Giản đồ năng lượng các MO Cấu hình e: (KK) б 2 2s . Bậc liên kết: #23 = 1. #
Phân tử không có từ tính vì không có electron tự do.
Ví dụ 2: Vẽ giản đồ năng lượng, tính bậc liên kết và xác định từ tính của phân tử phân tử B2.
Giản đồ năng lượng các MO: Cấu hình e B2: (KK)б 2 *2 1 1 2s б2s π2px =π2py . Bậc liên kết: P = 42# = 1. #
Phân tử có từ tính vì có 2 electron tự do. 5
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Ví dụ 3. So so sánh độ dài liên kết và độ bền liên kết của B + 2 và B2 .
Giải: Để so sánh độ dài và độ bền liên kết của các phân tử và ion ta phải tính bậc liên
kết; Để tính được bậc liên kết ta phải viết được cấu hình electron phân tử.
Chú ý, với những bài tập không yêu cầu vẽ giản đồ năng lượng mà chỉ cần viết cấu
hình electron thì ta chỉ cần điền các electron vào các MO theo thứ tự năng lượng từ
thấp đến cao, tuân theo nguyên lí Pauli và qui tắc Hund. Cấu hình electron của B 2 *2 1 1
2: (KK)б2s б2s π2px =π2py .
Bậc liên kết của B2: P = 42# = 1. # Cấu hình electron của B + 2 *2 1 2 *2 1
2 : (KK)б2s б2s π2px hoặc (KK)б2s б2s π2py vì năng lượng π2px=π2py. Bậc liên kết của B + 2 : P = 52# = 0,5. # Như vậy, P (B + +
2) = 1 > P (B2 ) = 0,5 nên độ dài liên kết của B2 nhỏ hơn B2 ; B2 bền hơn B + 2 .
6.3.3.1. Giản đồ năng lượng phân tử (ion) A n±
2 cuối chu kì 2
Các nguyên tố cuối chu kì 2 bao gồm các nguyên tố có Z > 7: O, F. Ne không tham gia các phản ứng.
Hai nguyên tử A là như nhau nên
năng lượng của các AO 2s và AO 2p
của hai nguyên tử là bằng nhau trên giản đồ.
Ở các nguyên tố cuối chu kì, năng
lượng của các AO 2s và 2p không
quá gần nhau nên không còn sự đẩy
nhau giữa các MO σ2s và σpz. Do đó,
thứ tự năng lượng từ thấp đến cao của các MO là: (KK) б * 2s б2s б2pz π * * *
2px=π2py π2px =π2py б2pz .
Ta thấy, giản đồ của các nguyên tố
đầu chu kì và cuối chu kì chỉ khác
nhau ở chỗ thứ tự năng lượng của
MO. Đối với các nguyên tố đầu chu
kì, năng lượng MO б2pz cao hơn
π2px=π2py, còn đối với các nguyên tố
cuối chu kì, thứ tự năng lượng
Hình 6. Giản đồ năng lượng các MO của phân tử ngược lại. (ion) A n± 2 cuối chu kì 2. 6
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Ví dụ: Vẽ giản đồ năng lượng, tính bậc liên kết và xác định từ tính của O + 2 và O2 . Từ
đó so sánh độ bền, độ dài liên kết giữa hai phần tử này.
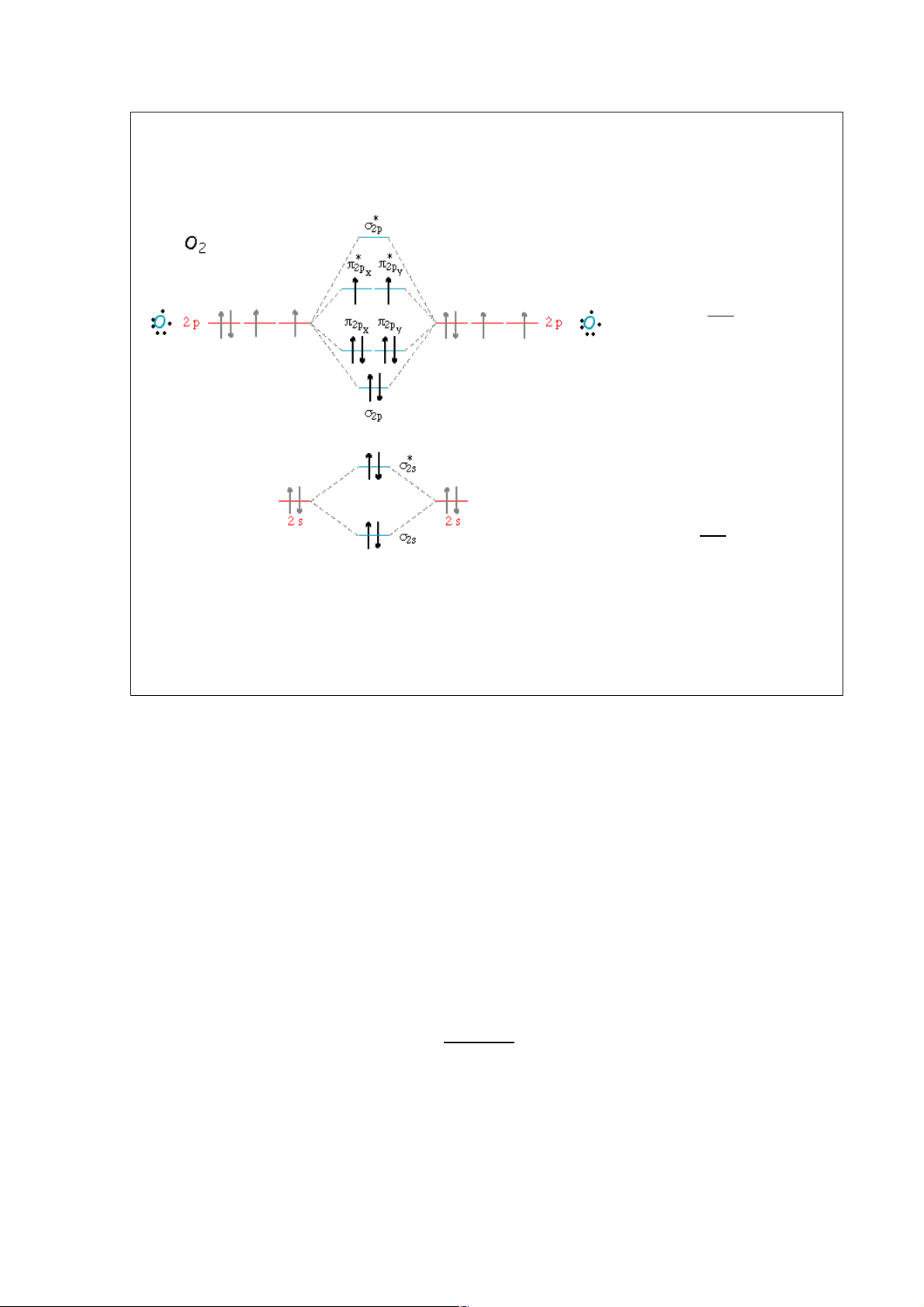
Hình 6.. là giản đồ năng lượng các MO của O2: Cấu hình electron O2: (KK) б 2 *2 2 2s б2s б2pz π 2 2 *1 *1 2px =π2py π2px =π2py . Bậc liên kết O2: P = 624 = 2. # O2 có từ tính vì có 2 electron tự do. Cấu hình electron O + 2 : (KK) б 2 *2 2 2s б2s 2б2pz π 2 2 *1 2px =π2py π2px . Bậc liên kết O + 2 : P = 625 = 2,5. # +
Hình 6. Giản đồ năng lượng các MO của O O2 có từ tính vì có 1 2. electron tự do. Giản đồ cho O +
2 tự như O2, chỉ thiếu 1 electron trên MO πx hoặc πy.
Ta thấy, bậc liên kết của O + +
2 (2,5) lớn hơn O2 (2,0), nên O2 bền hơn O2 và độ dài liên kết của O + 2 lớn hơn O2 .
6.4. Phân tử (ion) hai nguyên tử có hạt nhân khác nhau ABn±
Các MO của phân tử hai nguyên tử khác nhau cũng được tạo thành do sự tổ hợp
tuyến tính của các AO hóa trị như đối với phân tử hai nguyên tử có hạt nhân giống nhau.
Tuy nhiên, cần chú ý năng lượng các AO hóa trị ban đầu của các nguyên tử tham gia
liên kết. Cụ thể, các nguyên tử khác nhau sẽ có năng lượng khác nhau. Nguyên tử nào
có độ âm điện lớn sẽ có năng lượng thấp và ngược lại, nguyên tử có độ âm điện nhỏ sẽ có năng lượng cao.
Đối với phân tử (ion) 2 nguyên tử của các nguyên tố chu kì 2, trật tự sắp xếp năng
lượng của các MO tạo thành và giản đồ năng lượng các MO được xác định như sau:
Tính số đơn vị điện tích hạt nhân trung bình 𝑍̅ của hai nguyên tử trong phân tử: 𝑍 𝑍̅ = 7 + 𝑍8 2
• Nếu 𝑍̅ ≤ 7 thì thứ tự năng lượng và giản đồ năng lượng các MO được sắp xếp
như các nguyên tố đầu chu kì.
• Nếu 𝑍̅ > 7 thì thứ tự năng lượng và giản đồ năng lượng các MO được sắp xếp
như các nguyên tố cuối chu kì. 7
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Ví dụ 1: Vẽ giản đồ năng lượng, viết cấu hình electron, tính bậc liên kết và xác định
từ tính của phân tử CO.
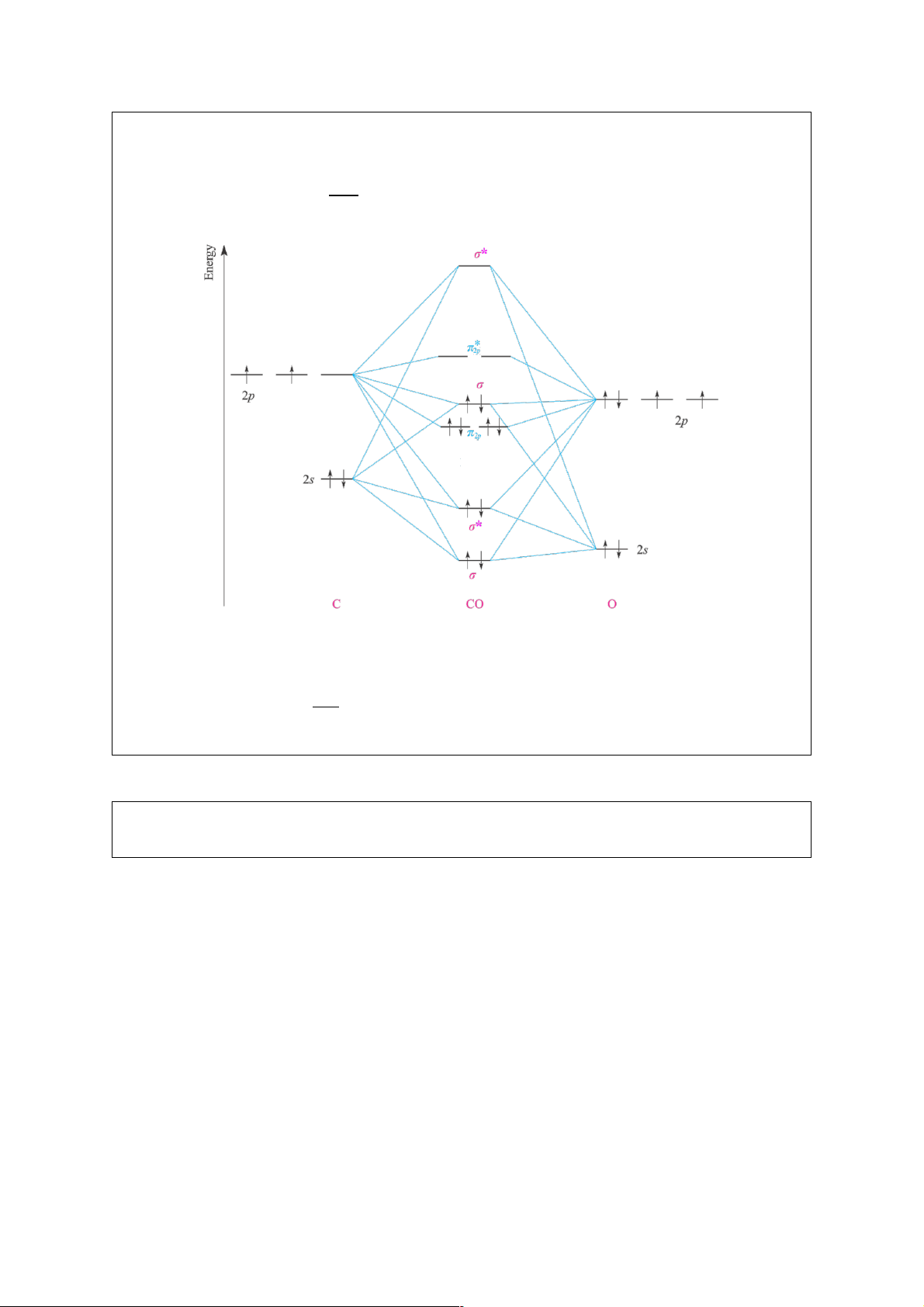
Giải: Phân tử CO có 𝑍̅ = 9: 6 = 7 nên giản đồ tương tự phân tử A n± các nguyên tố # 2
đầu chu kì. Hình 6.. là giản đồ năng lượng các MO của CO:
Hình 6. Giản đồ năng lượng các MO của CO.
Cấu hình electron của CO: (KK) б 2 *2 2 2 2 2s б2s πx =πy бz .
Độ bội liên kết: P = 62# = 3. #
CO không có từ tính vì không có electron tự do.
Ví dụ 2: Vẽ giản đồ năng lượng, viết cấu hình electron, tính bậc liên kết và xác định
từ tính của phân tử NO. 8
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Hình 6.. là giản đồ năng lượng các MO của NO: Giải: Phân tử NO có 𝑍̅ = ;: 6 = #
7,5 nên giản đồ tương tự phân tử A n±
2 các nguyên tố cuối chu kì.
Cấu hình electron của NO: (KK) б 2 *2 2 2 2 *1 2s б2s бz πx =πy πx .
Độ bội liên kết: P = 625 = 2,5. #
NO có từ tính vì có 1 electron tự do.
Chú ý: Vì năng lượng πx và πy
như nhau nên cũng có thể viết
cấu hình electron của NO như sau: (KK) б 2 *2 2 2 2 *1 2s б2s бz πx =πy πy .
Hình 6. Giản đồ năng lượng các MO của NO
Ví dụ 3: Vẽ giản đồ năng lượng, viết cấu hình electron, tính bậc liên kết và xác định
từ tính của phân tử LiF.
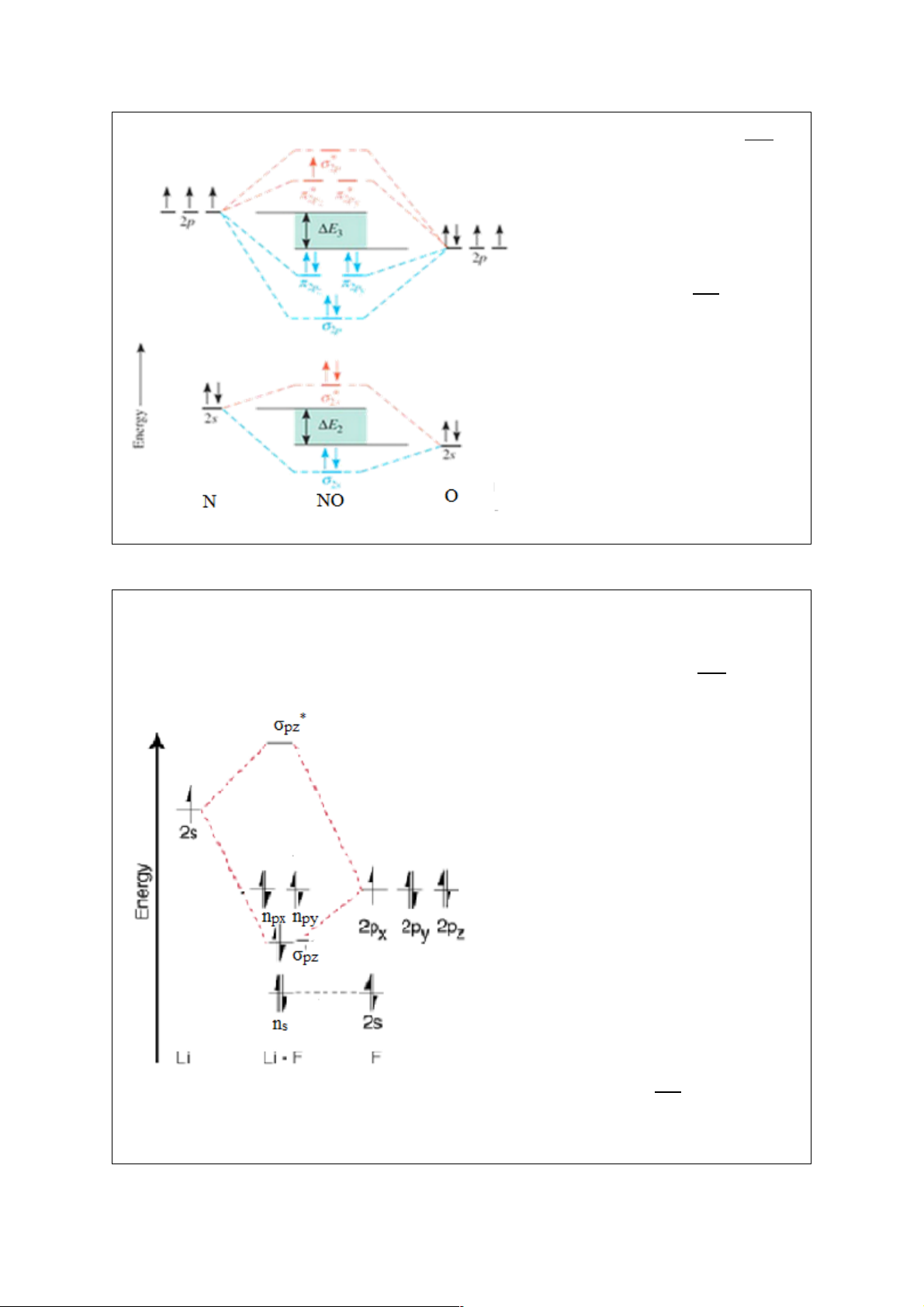
Hình 6.. là giản đồ năng lượng các MO của Giải: Phân tử LiF có 𝑍̅ = 5: < = 6 nên LiF: #
giản đồ tương tự phân tử A n± 2 các nguyên tố đầu chu kì.
Trong 4 AO hóa trị của F chỉ có 1 AO
2pz chứa electron tự do tham gia tổ
hợp với AO 2s của Li. Ba AO hóa trị
còn lại của F (2px, 2py và 2s) không tổ
hợp được với AO 2s của Li vì 2 AO
2px và 2py không có cùng tính chất đối
xứng với AO 2s của Li và AO 2s của
F có năng lượng thấp hơn nhiều so với
AO 2s của Li. Các AO không tham
gia tổ hợp tạo MO này được kí hiệu
lần lượt là npx, npy, ns.
Cấu hình electron của LiF: (KK) n 2 2 2 2 2s бpz npx =npy .
Hình 6. Giản đồ năng lượng các MO của Độ bội liên kết: P = #23 = 1. # LiF.
LiF không có từ tính vì không có electron tự do. 9
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Ví dụ 4: Vẽ giản đồ năng lượng, viết cấu hình electron, tính bậc liên kết và xác định
từ tính của phân tử HF.
Hình 6.. là giản đồ năng lượng các Giải: MO của HF được tạo ra do sự tổ hợp của MO của HF:
AO 1s của H và 1 AO 2p của F. Trong 4 AO
hóa trị của F chỉ có 1 AO 2pz chứa electron tự
do tham gia tổ hợp với AO 1s của H. Ba AO
hóa trị còn lại của F (2px, 2py và 2s) không tổ
hợp được với AO 1s của H vì 2 AO 2px và 2py
không có cùng tính chất đối xứng với AO 1s
của H và AO 2s của F có năng lượng thấp hơn
nhiều so với AO 1s của H. Các AO không
tham gia tổ hợp tạo MO này được kí hiệu lần lượt là npx, npy, ns.
Cấu hình electron của HF: n 2 б 2 n 2=n 2. H HF F 2s pz px py
Hình 6. Giản đồ năng lượng các Độ bội liên kết: P = #23 = 1. # MO của HF.
HF không có từ tính vì không có electron tự do.
Ví dụ 5. So sánh năng lượng ion hóa thứ nhất của N, NO và N2.
Giải. Từ giản đồ năng lượng của các phân tử N2 (hình 6.) và NO (hình 6.) ta nhận
thấy: Electron cuối cùng trong phân tử N2 đang ở MO liên kết бz, có năng lượng (E)
thấp hơn so với các AO của nguyên tử N (Eo). Electron cuối cùng trong phân tử NO
ở trên MO phản liên kết π *
x , có năng lượng (E*) cao hơn so với các AO của nguyên
tử N (Eo). E < Eo < E*. Do đó, ta có thứ tự tăng dần năng lượng ion hóa như sau:
I1(NO) < I1(N) < I1(N2).
6.5. Phân tử có từ ba nguyên tử trở lên
Dưới đây là một số ví dụ áp dụng thuyết MO – LCAO để vẽ giản đồ năng
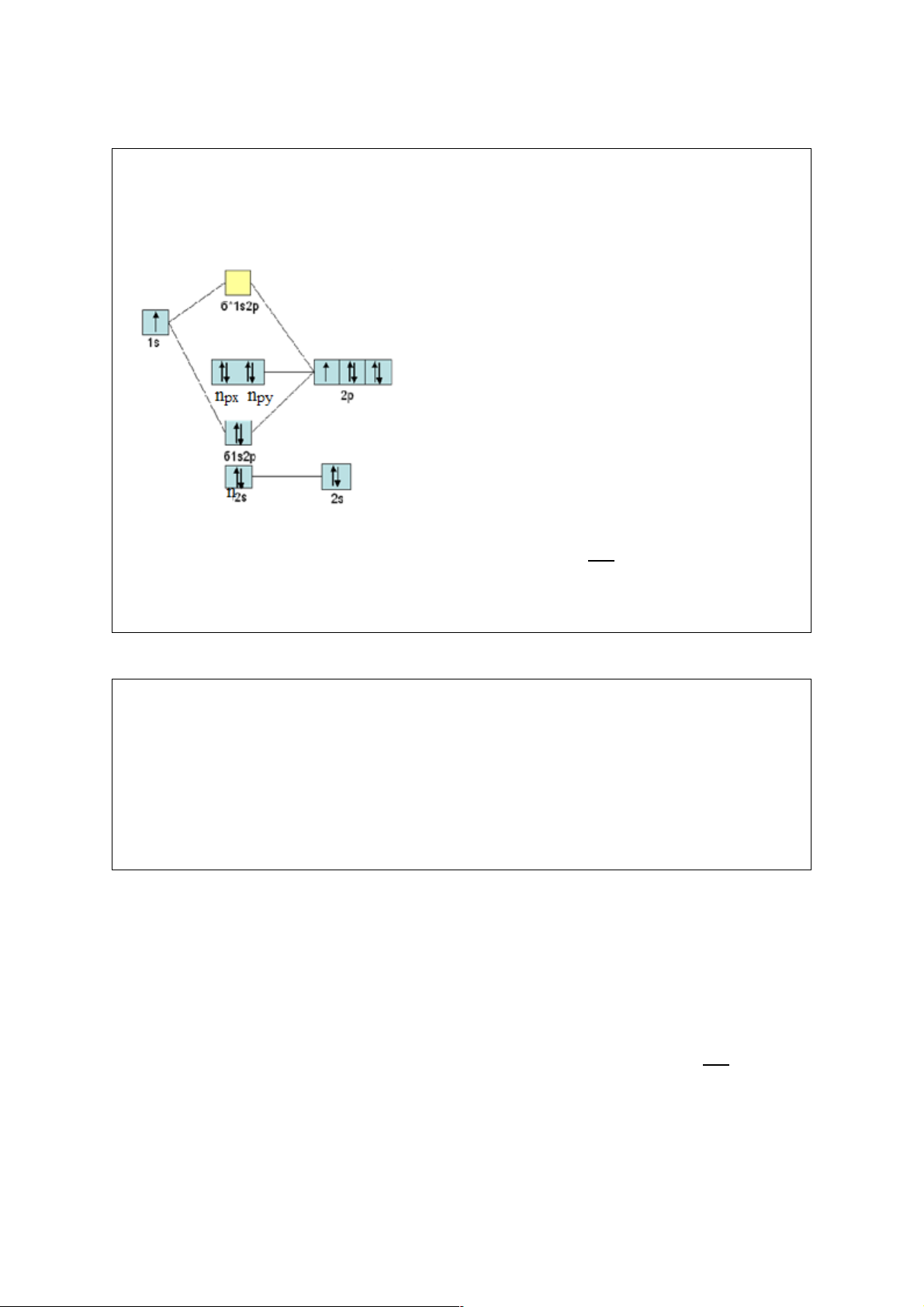
lượng, viết cấu hình electron phân tử và xác định từ tính cho một số phân tử có từ ba nguyên tử trở lên. Phân tử BeH 2 2 2. Cấu hình e: σs σz
Hình 6..là giản đồ năng lượng các MO của phân
Bậc liên kết P = 423 = 2, tử BeH # 2.
trong đó bậc của liên kết giữa Be và H là 1.
Phân tử không có từ tính vì không có electron tự do. 10
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
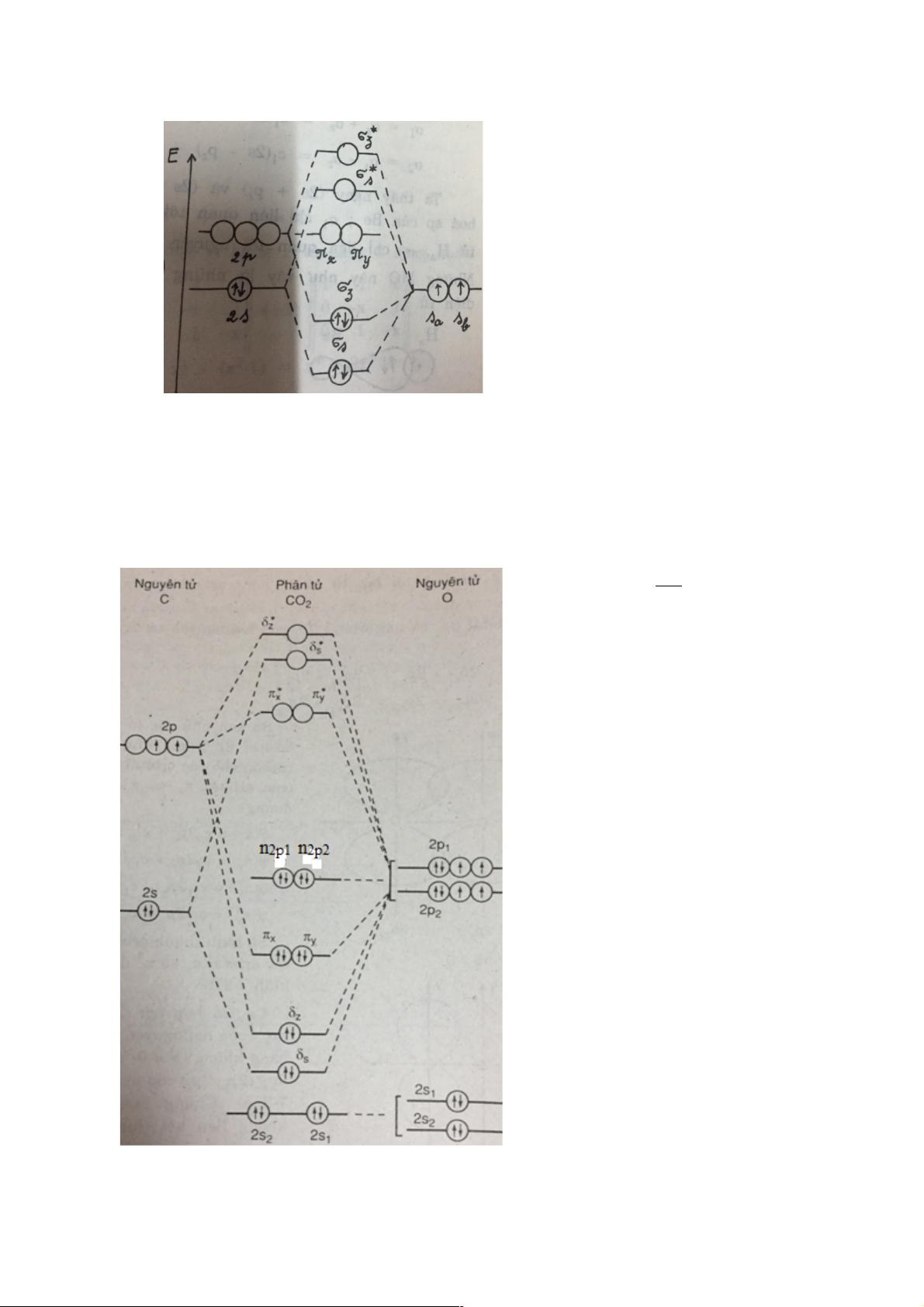
Hình 6.. Giản đồ năng lượng các MO của BeH2. Phân tử CO2 Cấu hình electron:
Giản đồ năng lượng các MO của phân tử CO 2 2 2 2 2 2 2 2
n2s1 n2s2 σ2s σ2pz π2px =π2py n2p1
được trình bày trên hình 6.. = n 2 2p2 .
Bậc liên kết P = 623 = 4, trong đó #
bậc liên kết giữa C và O là 2.
Phân tử không có từ tính do không có electron tự do.
Hình 6.. Giản đồ năng lượng các MO của CO2. 11
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất. Phân tử H2O Cấu hình electron:
Giản đồ năng lượng các MO của phân tử n 2 2 2 2 2s σs σz n2p .
H2O được trình bày trên hình 6..
Bậc liên kết P = 423 = 2, trong đó bậc … #
liên kết giữa Hvà O là 1.
Hình 6.. Giản đồ năng lượng các MO của H
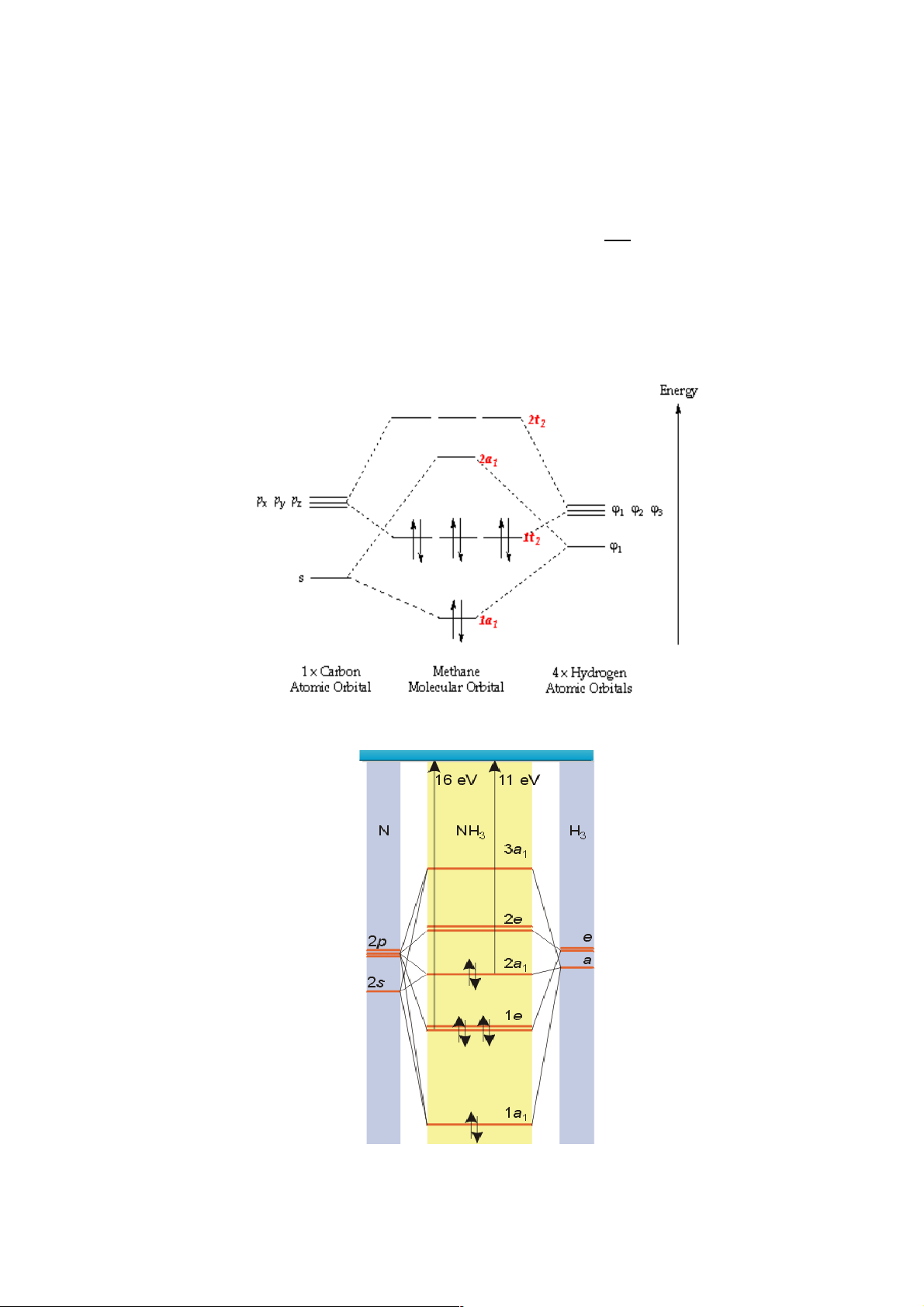
Phân tử không có từ tính do không có 2O. electron tự do. Phân tử CH4 Phân tử NH3 12
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Như vậy, thuyết orbital phân tử đã giải quyết được hết các hạn chế của thuyết liên
kết hóa trị. Nó đã giải thích thỏa đáng về liên kết của hầu hết các phân tử. BÀI TẬP CHƯƠNG 6
A. BÀI TẬP TRẮC NGHIỆM
0033: Theo thuyết MO-LCAO, số MO thu được khi tổ hợp 8 AO (các AO đều thỏa mãn
điều kiện tổ hợp) là: A. 4. B. 8. C. 10. D. 16.
0034: Chọn phát biểu đúng. Theo thuyết MO:
A. MO liên kết có năng lượng cao hơn các AO ban đầu.
B. MO liên kết có năng lượng cao hơn các MO phản liên kết.
C. MO liên kết có năng lượng thấp hơn các AO ban đầu.
D. MO liên kết có năng lượng bằng các AO ban đầu.
0035: Chọn câu đúng: Sự thêm electron vào orbiatal phân tử phản liên kết (MO*) làm cho:
A. Giảm độ dài và tăng năng lượng liên kết.
B. Tăng độ dài và giảm năng lượng liên kết.
C. Tăng độ dài và tăng năng lượng liên kết.
D. Giảm độ dài và giảm năng lượng liên kết.
0036: So sánh bậc liên kết trong các phân tử và ion N2, CO, CN- ta có:
A. Trong CO lớn nhất.
B. Trong CN- lớn nhất.
C. Trong N2 lớn nhất. D. Bằng nhau.
0037: So sánh độ dài liên kết và nhận xét về từ tính của phân tử O + 2 và ion O2 . A. d(O + +
2) < d(O2 ), O2 và O2 đều có từ tính. B. d(O + +
2) > d(O2 ), O2 và O2 đều có từ tính. C. d(O + +
2) < d(O2 ), O2 không có từ tính và O2 có từ tính. D. d(O + +
2) < d(O2 ), O2 và O2 đều không có từ tính.
0038: Orbital nguyên tử đã được điền đầy electron có năng lượng cao nhất trong phân tử NO là: A. π*x. B. σz.
C. σ*z. D. πy. 13
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
0039: Chiều tăng dần năng lượng ion hóa thứ nhất của các nguyên tử và phân tử N, O, NO, N2 là:
A. I1(NO) < I1(O) < I1(N) < I1(N2) B. I1(NO) < I1(N) < I1(O) < I1(N2)
C. I1(N) < I1(O) < I1(NO) < I1(N2) D. I1(O) < I1(N) < I1(NO) < I1(N2)
0040: Thứ tự tăng dần năng lượng ion hóa thứ nhất của các phân tử và ion NO, NO+, N và O là:
A. I1(NO+) > I1(NO) > I1(N) > I1(O). B. I1(NO+) > I1(N) > I1(O) > I1(NO).
C. I1(NO+) > I1(O) > I1(N) > I1(NO). D. I1(NO) > I1(O) > I1(N) > I1(NO+).
0041: So sánh năng lượng ion hóa I1 của các nguyên tử và phân tử theo thuyết MO ta có:
A. I1(C2) > I1(C) và I1(O2) > I1(O). B. I1(C2) < I1(C) và I1(O2) < I1(O).
C. I1(C2) < I1(C) và I1(O2) > I1(O). D. I1(C2) > I1(C) và I1(O2) < I1(O).
0042: Theo thuyết MO, trong các phân tử H - 2-
2, H2 , H2 , phân tử nào có liên kết bền nhất,
phân tử nào thuận từ, phân tử nào không tồn tại (cho kết quả theo thứ tự trên). A. H 2- - - 2- 2- - - 2-
2, H2 , H2 . B. H2, H2 , H2 . C. H2 , H2 , H2. D. H2 , H2, H2 .
0043: Chọn đáp án đúng: Cấu hình e của ion CN- là: A. (KK)σ 2 2 2 2 2 2 2 2 2 2
2s σ*2s πx = πy σ2pz . B. (KK)σ2s σ*2s σ2pz πx = πy . C. (KK)σ 2 2 2 2 1 1 2 2 2 2 1 1
2s σ*2s πx = πy σ2pz π*x . D. (KK) σ2s σ*2s πx = πy σ2pz π*y .
0044: Theo phương pháp MO, bậc liên kết và tính chất từ của ion O 2- 2 là:
A. 1; thuận từ. B. 1; nghịch từ. C. 2; thuận từ. D. 2; nghịch từ
0045: Cho các cấu tử sau: N2, B2, BF, CN, NO-. Chọn đáp án mà tất cả các cấu tử đều
có tính thuận từ theo thuyết MO.
A. B2, CN, NO-. B. N2, BF. C. N2, NO-. D. BF, CN, NO-.
0046: Sắp xếp dãy phân tử và ion sau theo thứ tự tăng dần của độ dài liên kết: O + 2 , O2, O - 2- 2 , O2 , có thứ tự sau: A. O + - 2- + - 2- 2 < O2< O2 < O2 .
B. O2 > O2 > O2> O2 . C. O + - 2- + - 2- 2 > O2> O2 > O2 .
D. O2 < O2 < O2 < O2.
0047: Theo thuyết MO, liên kết trong cấu tử nào kém bền nhất? A. O - 2- + 2. B. O2 . C. O2 . D. O2 .
0048: Theo thuyết MO, chọn phát biểu đúng về phân tử NO:
A. NO kém bền hơn O2 vì nó có bậc liên kết nhỏ hơn O2. 14
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
B. NO là chất nghịch từ.
C. Bậc liên kết bằng 3.
D. NO là chất thuận từ.
0049: Theo thuyết MO, cấu tử nào dưới đây không có cấu hình electron kiểu: (KK) σ 2 s σ *2 2 2 2 s πx = πy σz ? A. N2. B. CO. C. CN-. D. NO.
0050: Trong các phân tử sau: Be2, N2, C2 và He2, chọn đáp án mà tất cả các phân tử đều
không tồn tại theo thuyết MO.
A. He2. B. Be2, He2. C. Be2, C2 và He2. D. C2, He2.
0051: Trong các phân tử sau: Ne +
2, F2, O2 và He2, chọn đáp án mà tất cả các phân tử
đều không tồn tại theo cả hai thuyết V.B và MO. A. F +
2, He2. B. Ne2, F2. C. O2 , He2. D. Ne2, He2.
0052: Biết độ âm điện của C là 2,5 và của O là 3,5. Hãy chọn phát biếu đúng: Trong
giản đồ năng lượng các MO của phân tử CO thì:
A. Năng lượng của C cao hơn O.
B. Năng lượng của C thấp hơn O.
C. Năng lượng của C và O bằng nhau vì chúng cùng thuộc chu kỳ 2.
D. Không so sánh được năng lượng của C và O vì còn phụ thuộc nhiều yếu tố.
0053: Dựa vào thuyết MO, chọn sự so sánh đúng về hai phân tử O2 và B2:
A. Cả O2 và B2 đều thuận từ.
B. Bậc liên kết của O2 và B2 bằng nhau và đều bằng 2.
C. Cả O2 và B2 đều có năng lượng ion hóa thứ nhất của dạng phân tử thấp hơn so với
dạng nguyên tử tương ứng.
D. Có sự tồn tại của phân tử O2, còn B2 không tồn tại.
B. BÀI TẬP TỰ LUẬN
1. Cho các phân tử và ion sau: H + -
2 ; H2; H2 ; He2. Vẽ giản đồ MO cho H2 rồi suy ra:
- Cấu hình e các phân tử và ion trên
- Bậc liên kết trong các phân tử và ion trên
- So sánh độ bền liên kết giữa chúng
- Giải thích tại sao không tồn tại He2.
2. Cho các phân tử và ion B + - 2, B2 , F2, F2
a. Hãy vẽ giản đồ năng lượng các MO và cấu hình e của các phân tử và ion đó. 15
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất. b. Tính bậc liên kết.
c. Nhận xét về độ bền liên kết và độ dài liên kết của B + - 2 với B2 , F2 với F2 . d. Nhận xét từ tính.
e. So sánh các kết quả trên với phương pháp cặp e liên kết (VB).
3. Đã biết năng lượng liên kết của các phân tử sau (kJ/mol). H + + + 2 H2 O2 O2 F2 F2
-345 -259 -498 -664 -259 -310
a. So sánh và giải thích các dữ kiện đó bằng thuyết MO.
b. So sánh với kết quả của thuyết V.B.
4. Vẽ giản đồ năng lượng các MO của các phân tử N2; CO và BF. Từ đó viết cấu
hình e và tính bậc liên kết trong các phân tử đó.
5. Giải thích vì sao năng lượng ion hoá của các phân tử H2, N2, C2, CO cao hơn
năng lượng ion hoá của các nguyên tử tương ứng và năng lượng ion hoá của các
phân tử F2, O2, NO lại thấp hơn năng lượng ion hoá của các nguyên tử tương ứng. H C N O F
I1 ( kJ/mol ) 1308 1083 1396 1312 1675 H2 C2 N2 O2 F2 CO NO
I1 1488 1154 1507 1173 1526 1354 913
(Gợi ý: Dựa vào đặc điểm cấu hình e của các phân tử).
6. Cho các phân tử HX (X: F, Cl, Br, I).
a. Vẽ giản đồ năng lượng các MO, viết cấu hình e phân tử và tính bậc liên kết
trong các phân tử HX trên.
b. Hãy giải thích sự thay đổi độ bền của các liên kết HX khi X thay đổi từ F đến I.
7. Dựa vào thuyết MO, hãy viết cấu hình e, xác định bậc liên kết và từ tính của các
phân tử NO, NO+. Cho biết phân tử nào có năng lượng phân li lớn hơn?
8. Vẽ giản đồ năng lượng, tính số liên kết và xác định từ tính của phân tử CO2 theo MO. 16
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
Chương 7. THUYẾT TRƯỜNG TINH THỂ VÀ LIÊN KẾT TRONG PHỨC CHẤT
7.1. Một số định nghĩa và khái niệm 7.1.1. Phức chất
Phức chất là những phần tử được tạo thành bởi ion kim loại - được gọi là ion trung
tâm, liên kết với một số ion âm hay phân tử trung hòa - được gọi là phối tử, trong
đó số phối tử bao quanh ion trung tâm không tuân theo tỉ lệ hợp thức được xác
định bởi quan hệ hóa trị thông thường.
Trong ion phức tồn tại một nguyên tử hay ion trung tâm gọi là nhân trung tâm (thường
là kim loại chuyển tiếp).
Bao quanh nhân trung tâm là các nguyên tử, phân tử hay ion liên kết với nó gọi là các phối tử.
Ví dụ: Trong phức chất K3[Co(NO2)6], nguyên tử trung tâm là Co, 6 nhóm NO2 gọi là
các phối tử, ion [Co(NO2)6]3- gọi là cầu nội (phần nằm trong ngoặc vuông), cầu ngoại là 3 nguyên tử K.
Ion phức có thể là cation như [Cu(NH3)4]2+ hay anion như [Co(NO2)6]3-.
Một số phức đặc biệt: Phức chất không có cầu ngoại như [Co(NH3)3Cl3]; Ion phức có
thể chứa nhiều nhân như [Co 4+ 2(NH3)8(OH)2]
- chứa hai nhân Co; Phức chất chứa nhiều
ion phức như [Pt(NH3)4][PtCl4].
7.1.2. Số phối trí của nhân trung tâm
Số phối trí của nhân trung tâm là số liên kết δ của nhân trung tâm với các phối tử trong ion phức.
Ví dụ: Số phối trí của Co3+ trong ion phức [Co(NO2)6]3- là 6; số phối trí của Cu2+ trong [Cu(NH3)4]2+ là 4.
Đối với một số ion trung tâm, số phối trí không phải là hằng số. Chẳng hạn, Cu2+ có các
số phối trí là 2; 4; 6. Ni2+ và Zn2+ có các số phối trí là 4; 6. Số phối trí của nhân trung tâm phụ thuộc vào:
• Bản chất phối tử: [Ni(NH3)6]2+, [Ni(CN)4]2-.
• Bản chất ion tạo phức. • Nồng độ. • Nhiệt độ. • cầu ngoại.
Một số ion trung tâm có số phối trí không đổi như: Co3+, Cr3+, Fe2+, Fe3+, Pt4+ có có số
phối trí 6. Pt2+, Au3+ có số phối trí là 4. 17
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
7.1.3. Dung lượng phối trí của phối tử
Dung lượng phối trí của phối tử (DLPT) là số liên kết σ của một phối tử liên kết với nhân trung tâm.
Ví dụ: OH-, Cl-, I-, F-, NH3, CN- có DLPT bằng 1 thể hiện trong các phức chất
[Fe(OH)6]3-, [CoF6]3-….; H2N-CH2-CH2-NH2 (Etylendiamin-en) có DLPT bằng 2 thể
hiện trong phức chất [Co(en)3]3+.
Phối tử có DLPT bằng 1 gọi là phối tử đơn càng. Phối tử có DLPT lớn hơn 1 là phối tử đa càng.
7.2. Thuyết liên kết hóa trị giải thích liên kết trong phức chất
Nguyên tắc của phương pháp:
Liên kết được tạo thành trong phức chất là liên kết cho-nhận giữa các cặp electron hóa
trị chưa tham gia liên kết của phối tử và orbital trống của nhân trung tâm (orbital trống phải là orbital lai hóa).
Ví dụ 1: Giải thích liên kết trong ion phức [Fe(CN)6]4- bằng thuyết V.B. Biết rằng
phức chất không có từ tính.
Giải: Cấu hình electron của Fe2+ (Z = 26): (Ar) 3d64s04p0.
Ion CN- có 1 cặp electron hóa trị chưa tham gia liên kết.
Để Fe2+ liên kết với 6 ion CN- mà phân tử không có từ tính thì 6 electron trong phân
lớp 3d của Fe2+ sẽ ở trạng thái ghép đôi, tạo nên 2 orbital trống, 2 orbital này lai hóa
với 1 orbital 4s và 3 orbital 4d để tạo nên 6 orbital trống lai hóa d2sp3. Liên kết cho-
nhận giữa Fe2+ với 6 ion CN- được trình bày trong sơ đồ dưới đây: Fe2+ ↑↓ ↑↓ ↑↓ 3d 4s 4p CN- CN- CN- CN- CN- CN-
Lai hóa d2sp3 như trên gọi là lai hóa trong. Phức chất có nguyên tử trung tâm lai hóa
trong gọi là phức orbital trong. Phức chất mà nguyên tử trung tâm có các electron d
ghép cặp như trên gọi là phức spin ghép cặp hay phức spin thấp.
Ví dụ 2: Giải thích liên kết trong ion phức [FeF6]4- bằng thuyết V.B. Biết rằng phức chất có từ tính.
Giải: Cấu hình electron của Fe2+ (Z = 26): (Ar) 3d64s04p0.
Cấu hình electron của F- (Z = 9): (He) 2s22p6, có 4 cặp electron hóa trị.
Để ion phức có từ tính thì 6 electron trong phân lớp 3d của Fe2+ sẽ có 2 electron ở
trạng thái ghép đôi, còn 4 electron tự do. 1 Orbital 4s, 3 orbital 4p và 2 orbital 4d lai 18
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
hóa với nhau tạo thành 6 orbital lai hóa sp3d2. Sáu orbital trống này sẽ tạo liên kết
cho-nhận với 6 ion F- như trong sơ đồ dưới đây: Fe2+ ↑↓ ↑ ↑ ↑ ↑ 3d 4s 4p 4d F- F- F- F- F- F-
Lai hóa sp3d2 như trên gọi là lai hóa ngoài. Phức chất có nguyên tử trung tâm lai hóa
ngoài gọi là phức orbital ngoài. Phức chất mà nguyên tử trung tâm có các electron d
chưa ghép cặp như trên gọi là phức spin tự do hay phức spin cao.
Các phức chất spin cao thuận từ.
Cũng như với các phân tử (ion) đơn giản, dựa vào thuyết lai hóa orbital và mô hình
VSEPR có thể dự đoán được cấu trúc hình học của các phân tử (ion) phức chất. Bảng
7..đưa ra một số kiểu lại hóa orbital và cấu trúc hình học của phức chất.
Bảng 7.. Một số kiểu lai hóa và cấu trúc hình học của phức chất. Số phối trí Kiểu lai hóa của Cấu trúc hình Ví dụ
nguyên tử trung tâm học phân tử (ion) 2 sp Thẳng [Cu(NH3)2]+, [CuCl2]- [Ag(NH3)2]+, [Ag(CN)2]- 4 sp3 Tứ diện đều [Zn(NH3)4]2+, [ZnCl4]2- , Tháp tam giác [BF4]-, [Be(OH)4]2-, [Hg(CN)4]2- 4 dsp2 Vuông phẳng [PtCl4]2-, [Ni(CN)4]2-, [Cu(NH3)4]2+ 5 sp3d Tháp đôi tam [Ni(CN)5]3-, (SbCl5)2- giác 5 sp3d Tháp vuông [Ni(CN)5]3- 6 d2sp3 Bát diện [Co(NH3)6]3+, [Fe(CN)6]3- 6 sp3d2 Bát diện [CoF6]3-, [PtCl6]2-, [Al(H2O)2(OH)4]-, [SnCl6]2-
Áp dụng thuyết V.B để giải thích liên kết trong phức chất có ưu điểm là đơn giản, dễ
hiểu, cho phép giải thích định tính liên kết của phức chất.
Tuy nhiên, thuyết này còn có một số hạn chế. Chẳng hạn, ở trên ta giải thích được trong
phức chất [Fe(CN)6]4- nguyên tử trung tâm có lai hóa trong và [FeF6]4- nguyên tử trung
tâm có lai hóa ngoài là nhờ vào việc cho biết trước từ tính của ion phức. Nếu chưa biết
được từ tính thì ta không thể xác định được vì sao phức này nguyên tử trung tâm có lai
hóa trong, phức kia lại có lai hóa ngoài. Ngoài ra, thuyết V.B áp dụng cho phức chất
chưa giải thích được một số tính chất như cộng hưởng từ, tính chất quang học hay màu 19
TS. Nguyễn Thị Thúy Nga
Bài giảng Hóa học – Cấu tạo chất.
của các phức chất. Các hạn chế này sẽ được khắc phục trong thuyết trường tinh thể,
thuyết orbital phân tử và thuyết trường phối tử.
7.3. Thuyết trường tinh thể giải thích liên kết trong phức chất
7.3.1. Các luận điểm cơ bản của thuyết trường tinh thể
Thuyết trường tinh thể do hai nhà vật lí Bethe và V.Vleck đề ra năm 1933 để giải thích
tính chất của các chất dạng tinh thể. Năm 1950, thuyết trường tinh thể được áp dụng
vào nghiên cứu phức chất của các kim loại nhóm B.
Các luận điểm của thuyết trường tinh thể như sau:
• Phức chất được tạo thành và bền là nhờ vào lực hút tính điện giữa nhân trung tâm và các phối tử.
• Khi xét ion trung tâm có chú ý đến cấu trúc electron chi tiết của nó; các phối tử
được coi là “không có cấu trúc”, là những điện tích điểm (hoặc lưỡng cực điểm)
tạo nên trường tĩnh điện bên ngoài đối với ion trung tâm (trường phối tử). Dưới
tác dụng của trường các phối tử này, ion trung tâm bị tách mức năng lượng. Các
phối tử nằm xung quanh ion trung tâm trên các đỉnh của hình đa diện, tạo nên
những phức chất có cấu trúc đối xứng nhất định.
• Phức chất được mô tả bằng các định luật của cơ học lượng tử.
7.3.2. Sự tách mức năng lượng các orbital d hóa trị của ion trung tâm trong trường phối tử
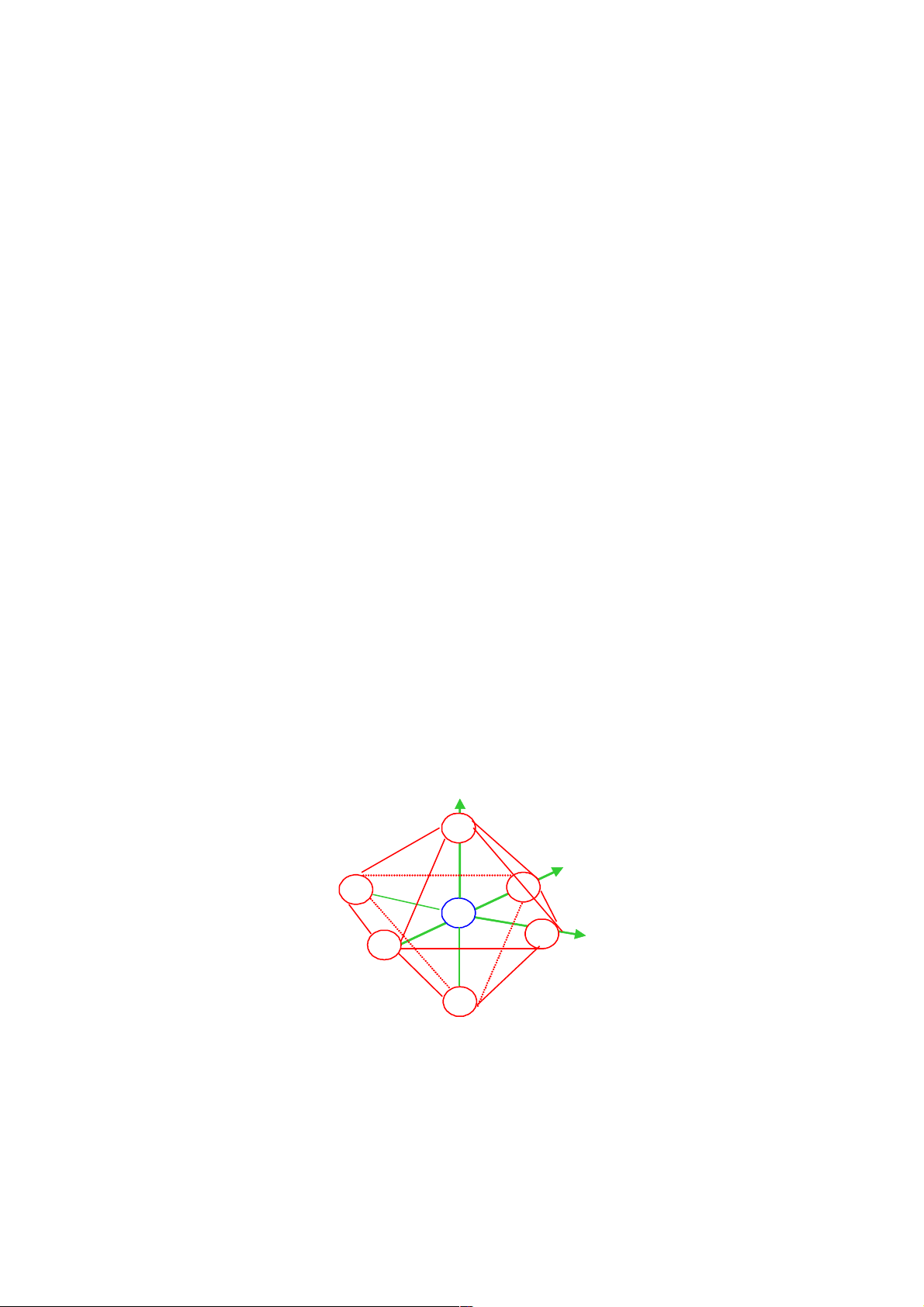
Xét phức bát diện (hình 7..). A là nguyên tử trung tâm, L1, L2, L3, L4, L5, L6 là các phối tử. L5 z L3 y L2 A x L4 L1 L6
Hình 7.. Mô hình phức bát diện.
Ion trung tâm Mn+ có 5 orbital hóa trị d, ở trạng thái tự do năng lượng các orbital này
bằng nhau (sự suy biến bậc 5). Khi các phối tử tiến lại gần để tạo liên kết thì xuất hiện
tương tác tĩnh điện giữa các phối tử là điện tích điểm với năm orbital d của nhân trung 20
TS. Nguyễn Thị Thúy Nga




