




Preview text:
Chương 7 ĐỘNG HÓA HỌC 1
•Nhiệt động hóa học
Khảo sát trạng thái đầu và trạng thái cuối của hệ.
Điều kiện để pư diễn ra: G = H - T.S <0
Mức độ diễn ra của quá trình : K ; G0 = -RTlnK T T •Động hóa học
Nghiên cứu giai đoạn trung gian : cơ chế phản ứng
Phản ứng diễn ra nhanh hay chậm: tốc độ phản ứng
Các yếu tố ảnh hưởng tới tốc độ phản ứng 2
I. MỘT SỐ KHÁI NIỆM
1. Phân loại phản ứng
Phản ứng đơn giản – pư diễn ra có 1 giai đoạn H (k) + I (k) = 2HI(k) 2 2
Phản ứng phức tạp –pư diễn ra qua nhiều giai đoạn
Mỗi giai đoạn – gọi là một tác dụng cơ bản
∑ giai đoạn ( tác dụng cơ bản ): cơ chế của pư. Ví dụ 2N O = 4NO + O 2 5 2 2 Có hai giai đoạn: N O = N O + O 2 5 2 3 2 N O + N O = 4NO 2 5 2 3 2 3
2. Định nghĩa vận tốc phản ứng
Vận tốc phản ứng được xác định bằng biến thiên nồng độ
của một trong các chất tham gia hoặc sản phẩm trong một đơn vị thời gian.
Vận tốc TRUNG BÌNH: C v t C
Vận tốc TỨC THỜI: dC v lim t 0 t dt
Thứ nguyên của vận tốc phản ứng: mol.l-1.s-1 4
Phản ứng đồng thể ở nhiệt độ không đổi: a A + B b = C c + D d C a C C A A B C b a b B TỐC ĐỘ TRUNG BÌNH 1 1 1 C C 1 C C C A B D v = - = - = + = + a t c t b t d t 5
Phản ứng đồng thể ở nhiệt độ không đổi (có thể tích không đổi) a A + B b = C c + D d dC a dC dC A A B dC b a b B
TỐC ĐỘ TỨC THỜI 1 dC 1 dC 1 dC 1 dC A B C D V = - = - = + = + a dt b dt c dt d dt 6
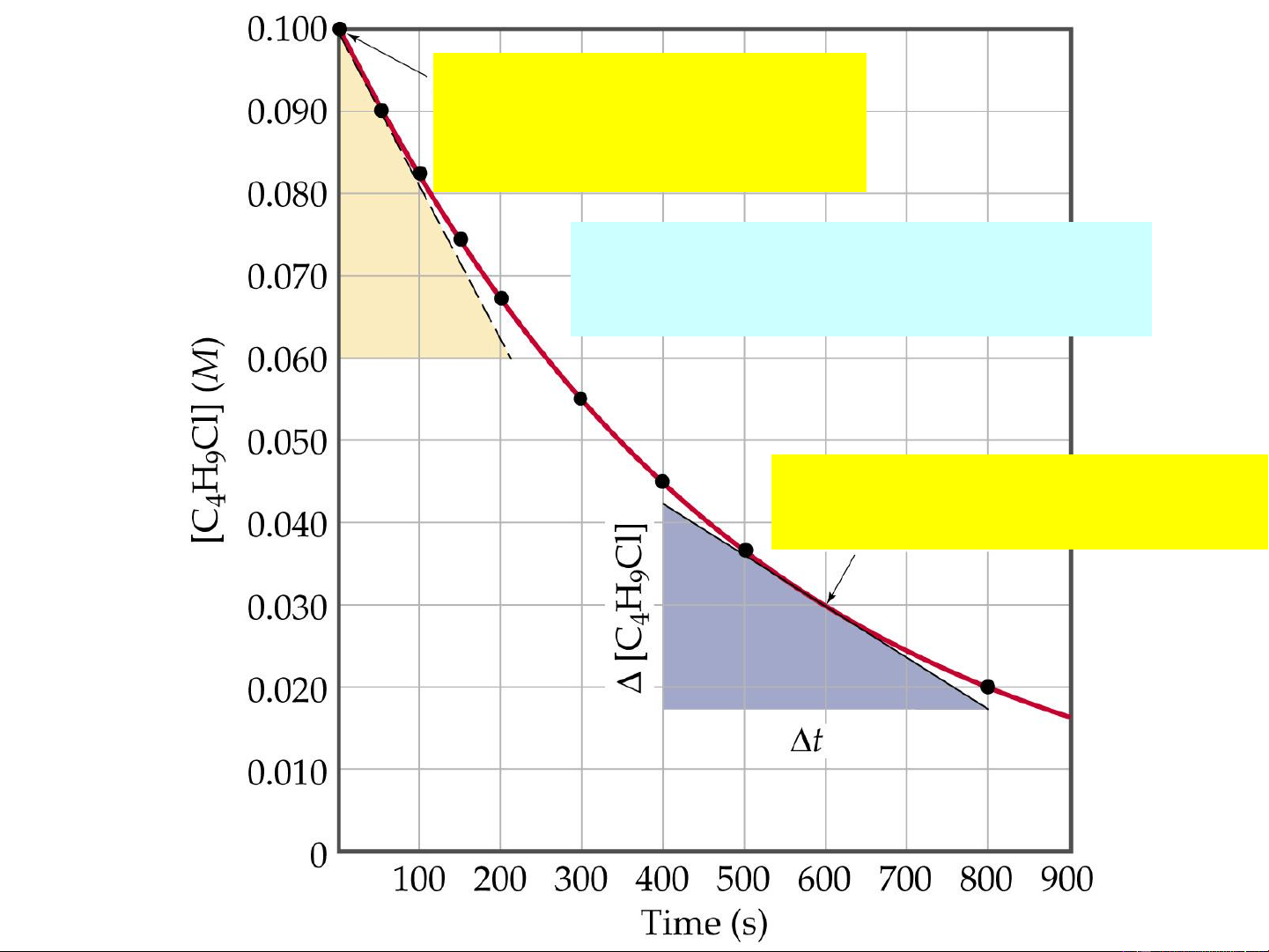
Tốc độ tức thời tại t=0 (tốc độ ban đầu )
C H Cl(aq) + H O(l) 4 9 2
C H OH(aq) + HCl(aq) 4 9
Tốc độ tức thời tại t= 600s 7
II. ĐỊNH LUẬT TÁC DỤNG KHỐI LƢỢNG
Phát biểu: Vận tốc phản ứng tỷ lệ thuận với nồng độ các
chất tham gia với các số mũ khác nhau.
Ở nhiệt độ không đổi, pư đồng thể, đơn giản: aA + bB = cC + dD
PHƢƠNG TRÌNH ĐỘNG HỌC: v = k.Cm .Cm A B
C C – nồng độ các chất, mol.l-1 A; B
m – bậc phản ứng đối với chất A;
n - bậc phản ứng đối với chất A;
m+n – BẬC CHUNG CỦA PHẢN ỨNG (BẬC CỦA PHẢN ỨNG)
v- vận tốc của phản ứng; mol.l-1.s-1 8 BẬC PHẢN ỨNG
Phân tử số - là số tiểu phân ( ng tử, phân tử, ion ) của chất
pư tương tác gây nên biến đổi hoá học trong 1 tác dụng cơ bản.(PTS = 1,2,3) Tam phân tử Đơn phân tử Hai phân tử Đối với pư đơn giản
PTS=1 → pư đơn phân tử I (k) = 2I(k) 2
PTS=2 → pư lưỡng phân tử H (k) + I (k) = 2HI (k) 2 2
PTS=3 → pư tam phân tử 2NO (k) + O (k) = 2NO (k) 2 2 EOS 9
Một phản ứng bao gồm nhiều giai đoạn nối tiếp nhau,
tốc độ p/ư được quyết định bởi tốc độ của giai đọan chậm nhất
Chậm → quyết định tốc độ nhanh EOS 10
ĐỊNH LUẬT ĐỘNG HỌC aA + bB = cC + dD
Tốc độ tức thời : V = kC n C m A B
Phản ứng đơn giản n = a ; m = b Phản ứng phức tạp n a hoặc n = a m b hoặc m = b m+n – bậc phản ứng
k – hằng số tốc độ pư , phụ thuộc vào : bch pư, T, xúc tác 11
Ví dụ - xét phản ứng phức tạp
2NO(g) + Br (g) 2NOBr(g) 2
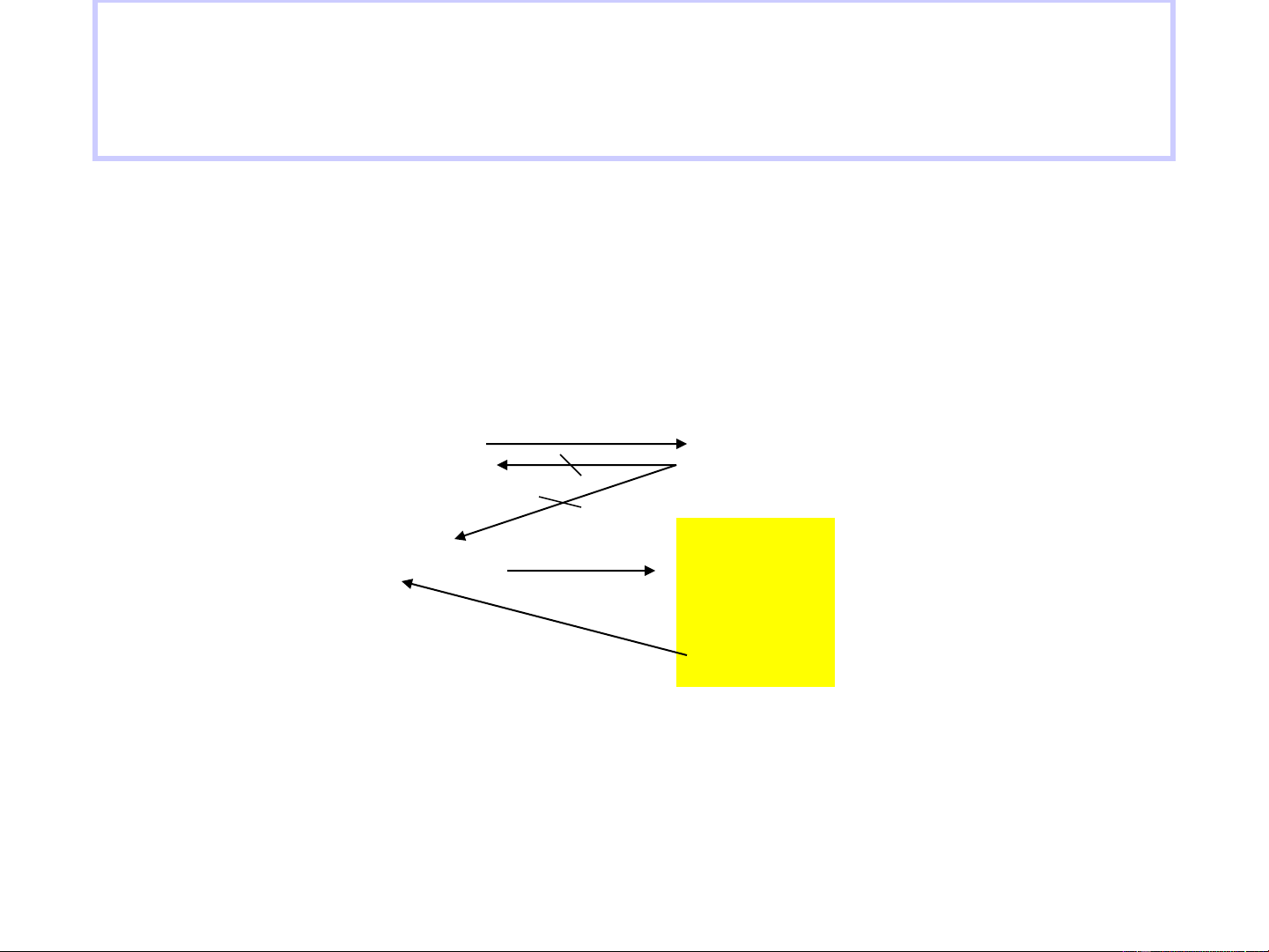
• Tốc độ phản ứng được xác định bằng thực nghiệm : v = k[NO]2[Br ] 2 • Cơ chế phản ứng k Step 1:
NO(g) + Br 1
2(g) NOBr2(g) (fast) k-1 k Step 2: NOBr 2
2(g) + NO(g) 2NOBr(g) (slow) 12
•Vì giai đoạn 2 chậm nên tốc độ phản ứng v = v2 V = v = k [NOBr ][NO] 2 2 2
•NOBr là chất trung gian không bền nên nồng độ NOBr sẽ 2
biểu diễn qua nồng độ NO và Br của cân bằng ở gđoạn 1 2
k [NO][Br ] k [NOBr ] (V ) = (v ) 1 2 1 2 1 cb -1 cb k [NOBr ] 1 [NO][Br ] 2 2 k 1 k k Rate 1 k [NO][Br [ ] NO] 1 k [NO]2[Br ] 2 2 2 2 k 1 k 1
v = k[NO]2 [Br ] 2 13
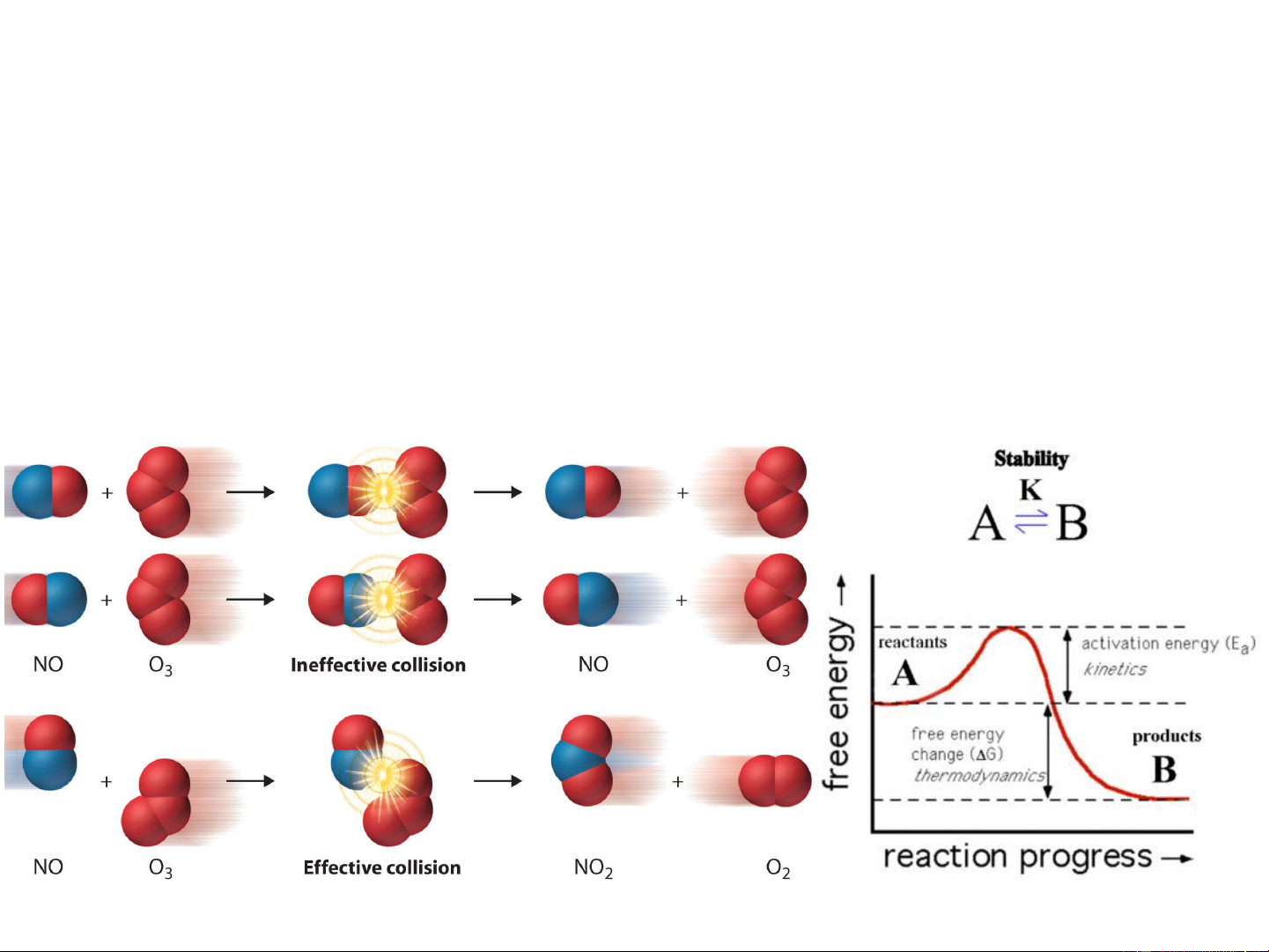
III- THUYẾT VA CHẠM HOẠT ĐỘNG 14
Phản ứng đồng thể, đơn giản, lưỡng phân tử của hệ khí lý tưởng .
• Thuyết va chạm hoạt động
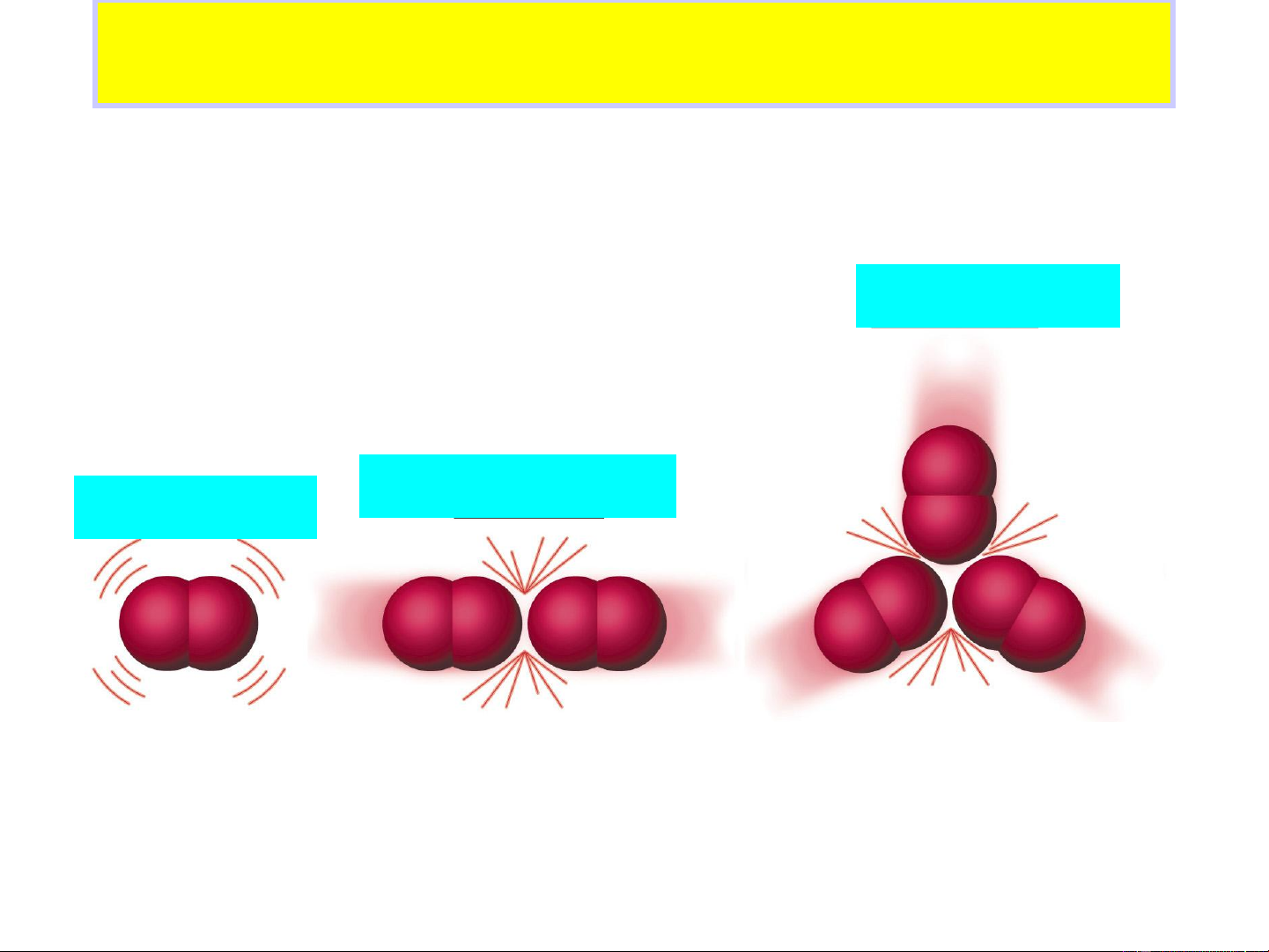
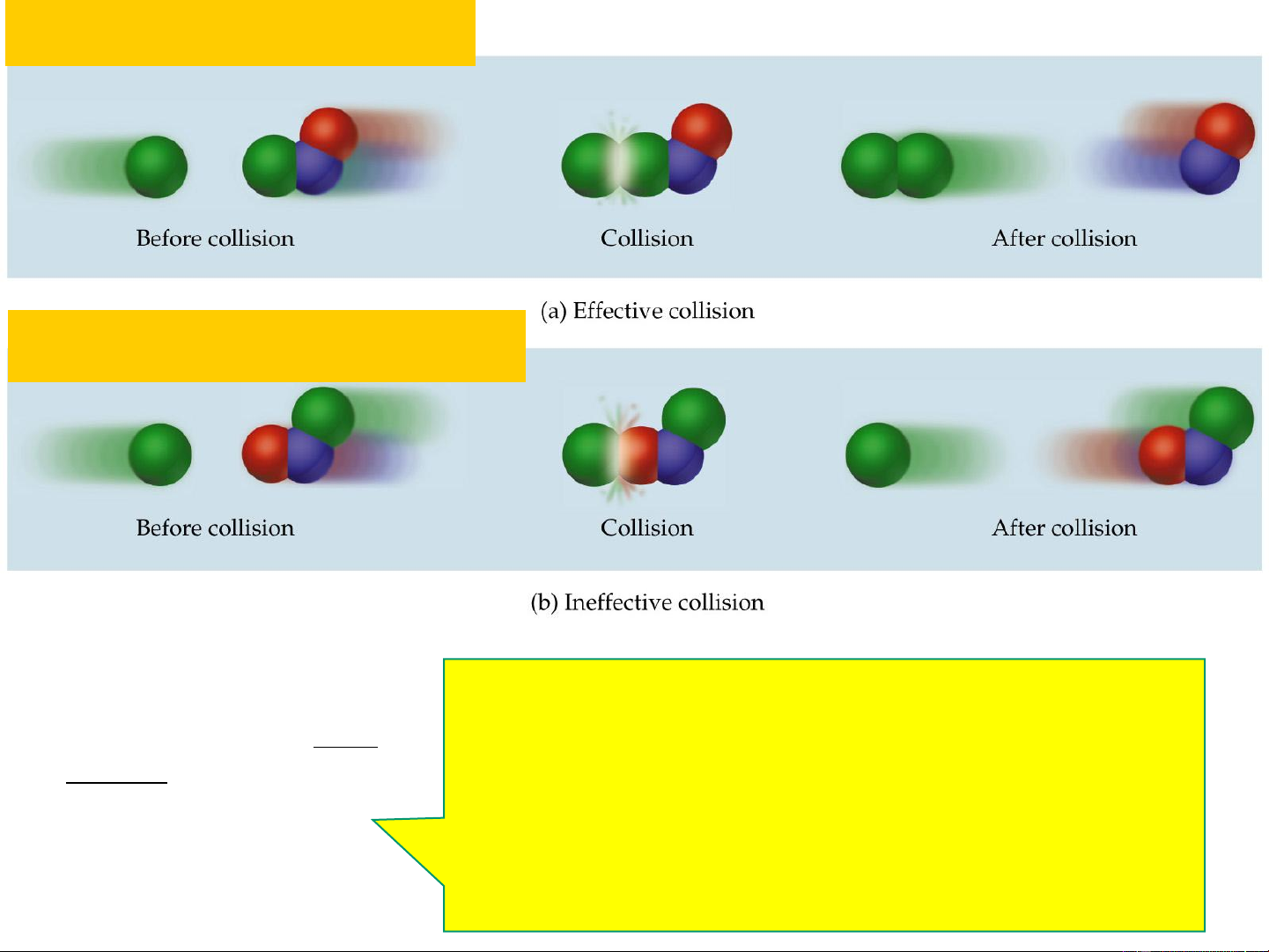
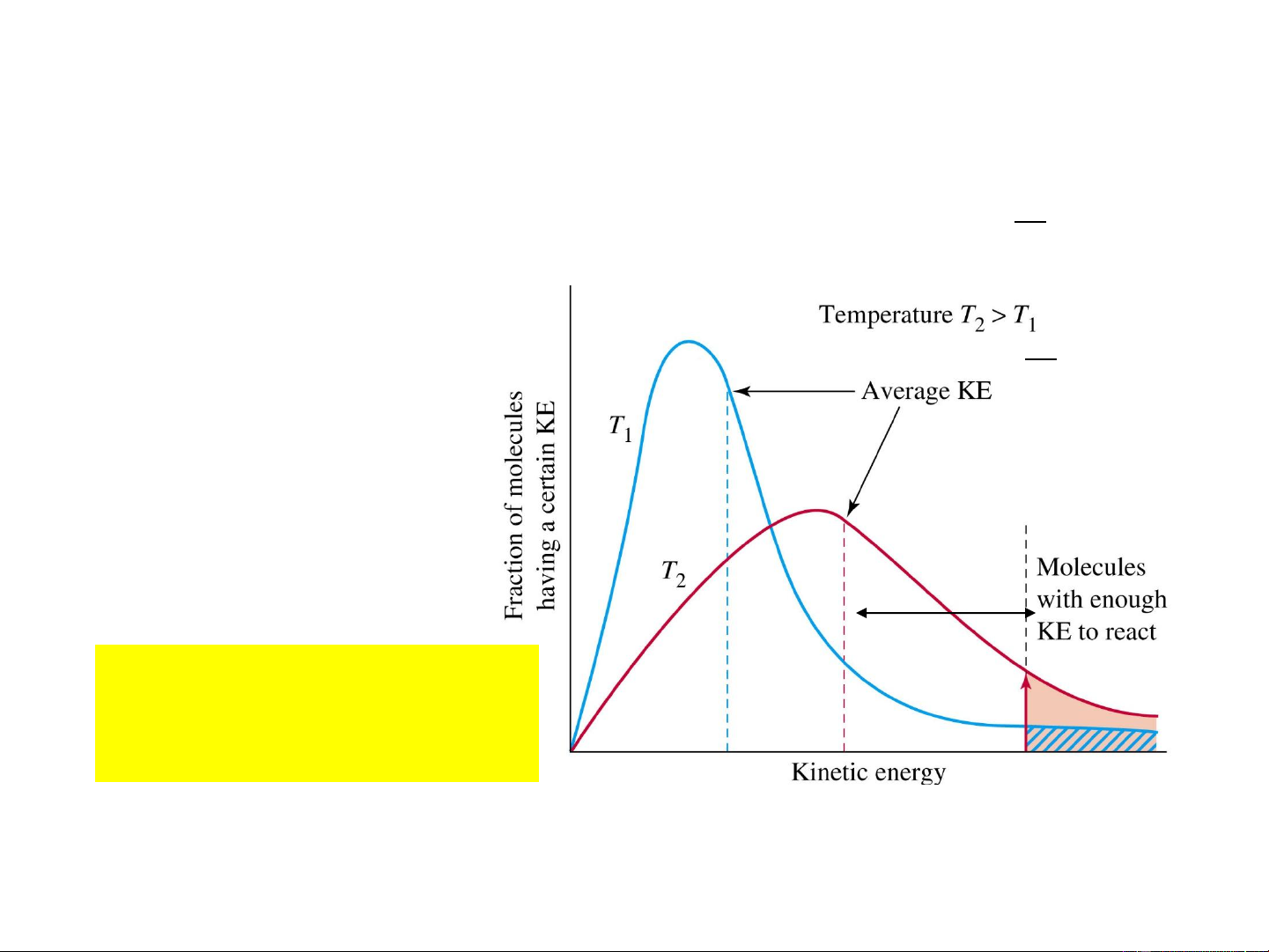
• Thuyết phức chất hoạt động 15 Va chạm có hiệu quả Va chạm không hiệu quả N – số phân tử; 0 * E * N
N* - số phân tử hoạt động; RT e
E – năng lượng hoạt hóa, (J.mol-1); N a 0 R = 8,314 J.mol-1.K-1; 16 T – nhiệt độ, K
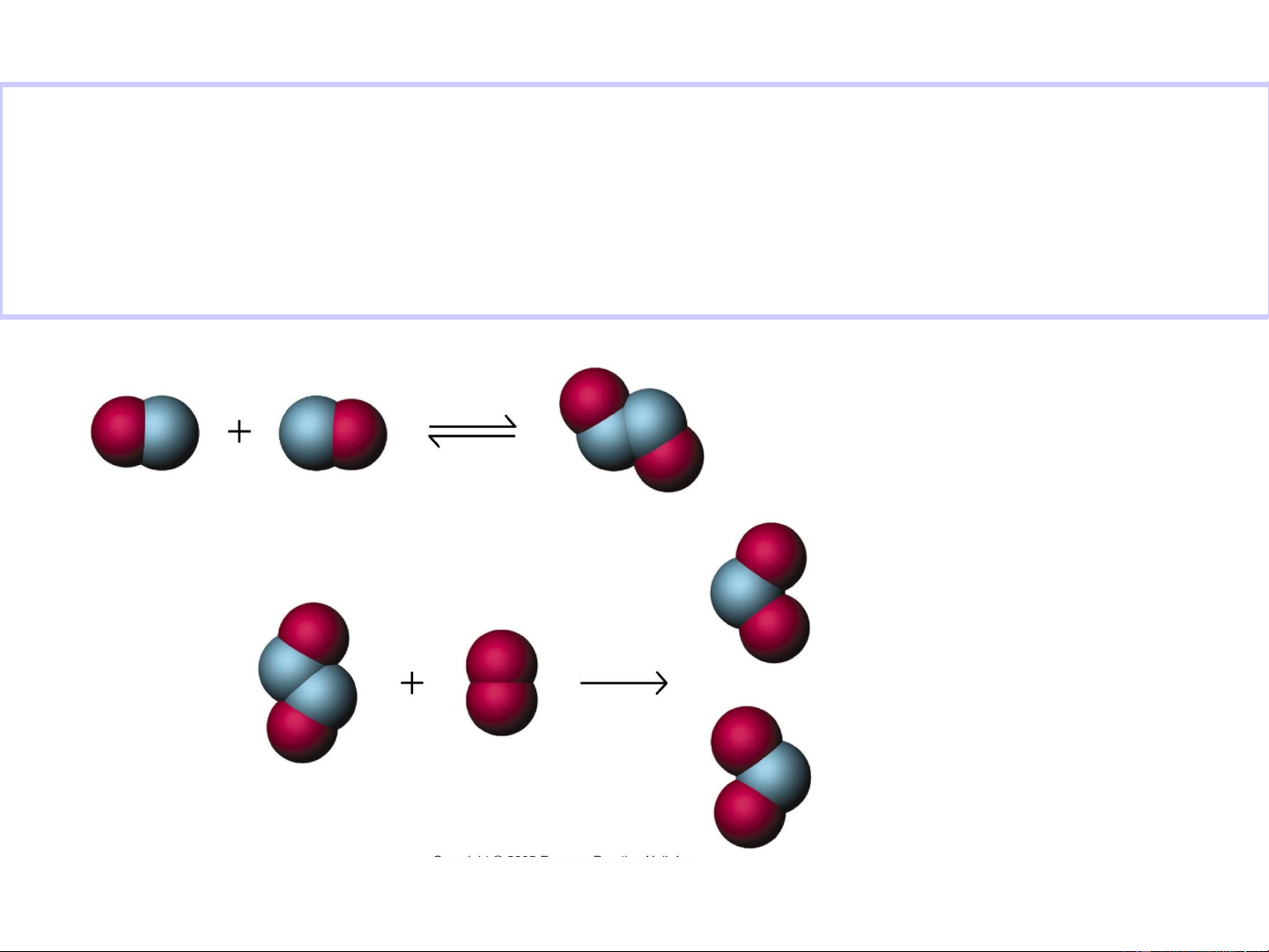
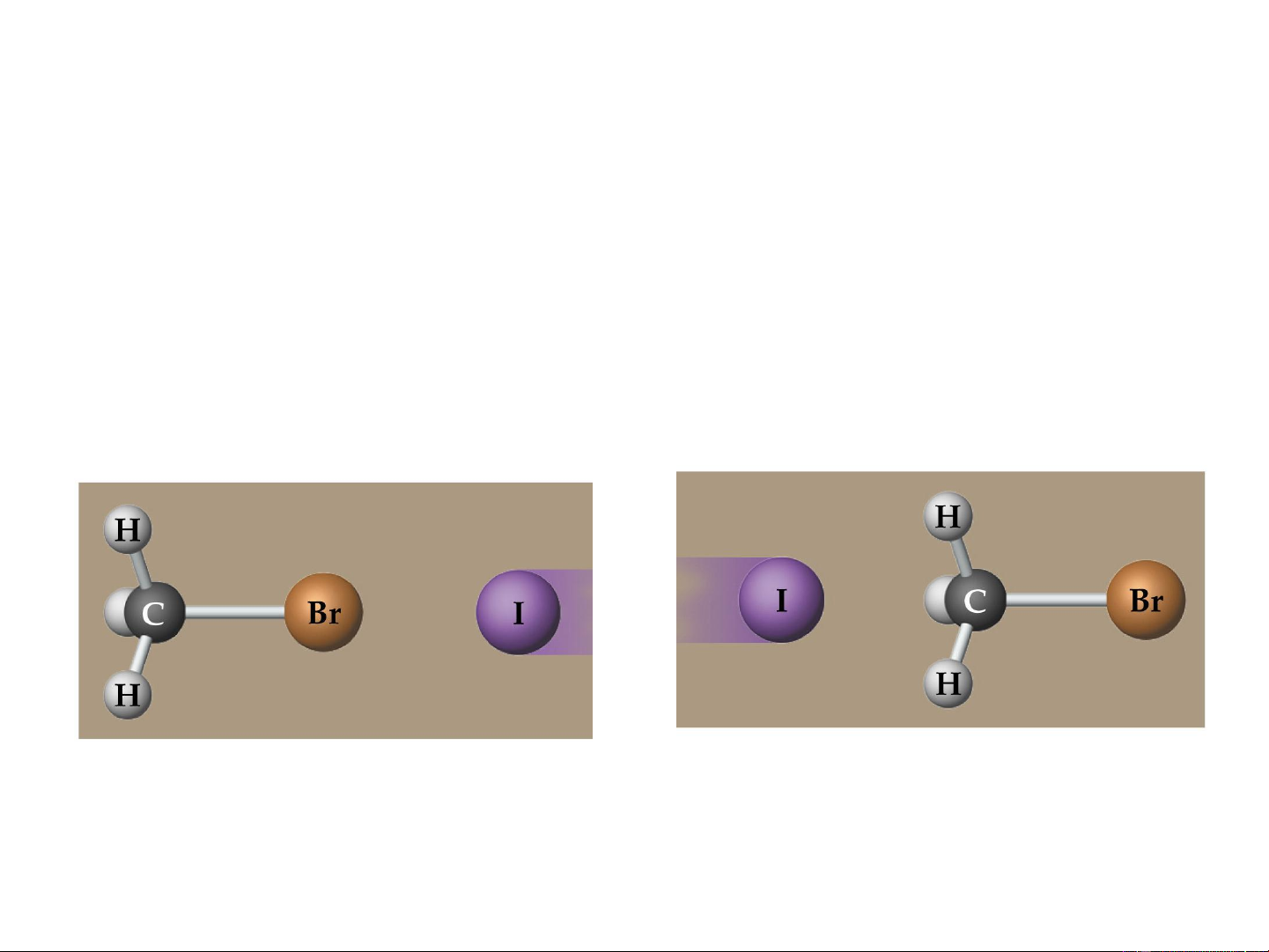
Sự định hướng không gian giữa các tiểu phân va chạm
cũng ảnh hưởng đến tốc độ phản ứng. I- + CH –Br
…….Br →I_ CH +Br- 3
→ I……. CH3 3 Chất phản ứng Phức chất hoạt động Sản phẩm
Định hướng không thuận lợi
Định hướng thuận lợi EOS 17 E a * E * N – số phân tử; N 0 RT e
N* - số phân tử hoạt động; N
E – năng lượng hoạt hóa, (J.mol-1); 0 a R = 8,314 J.mol-1.K-1; 18 T – nhiệt độ, K
Tiểu phân hoạt động – là tiểu phân có E E + E* Chỉ có va chạm giữa các tiểu phân E hoạt động mới tạo phản ứng. E*
E* ↓→ số tiểu phân
hoạt động ↑→ v↑. EOS 19
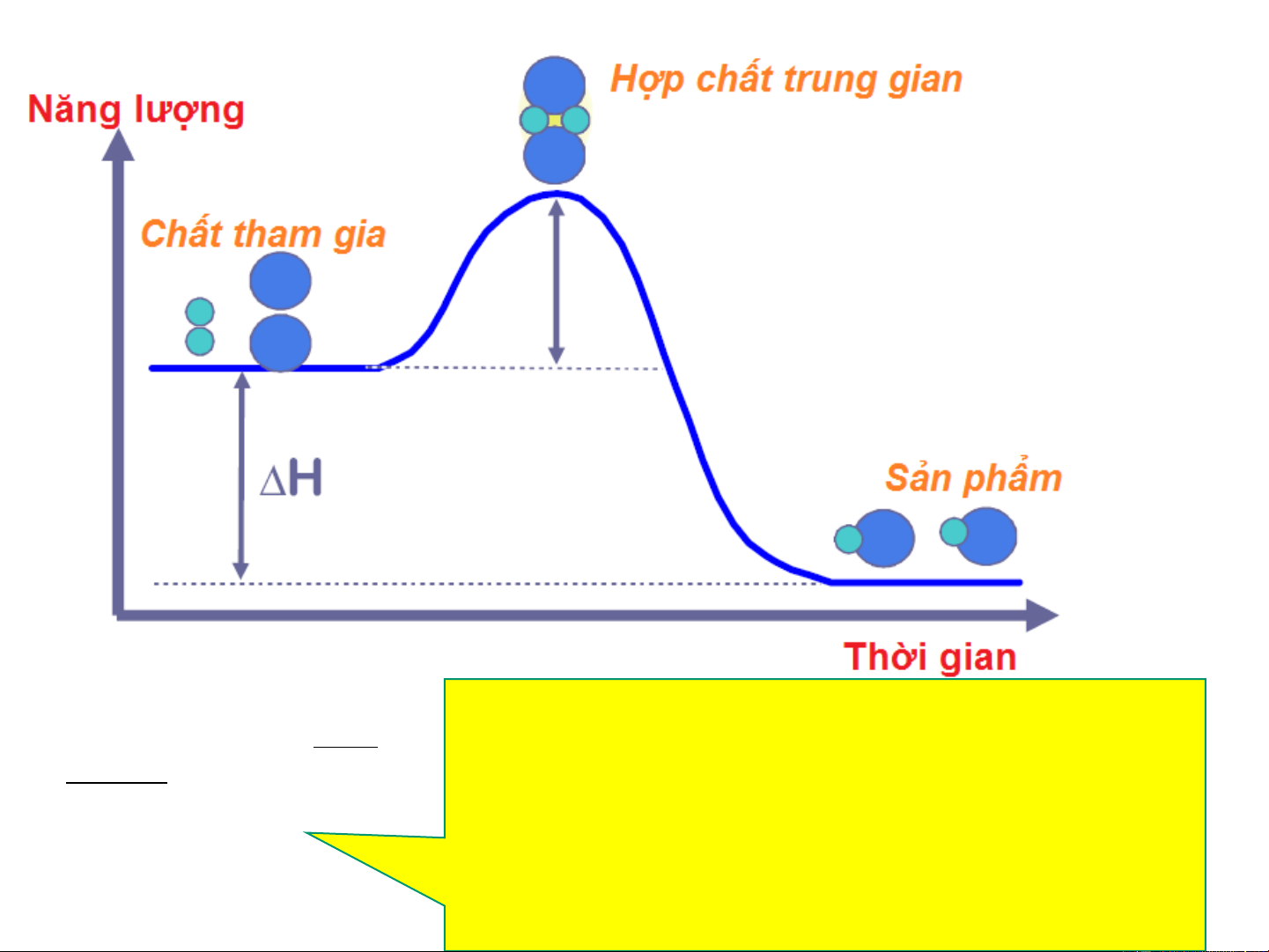
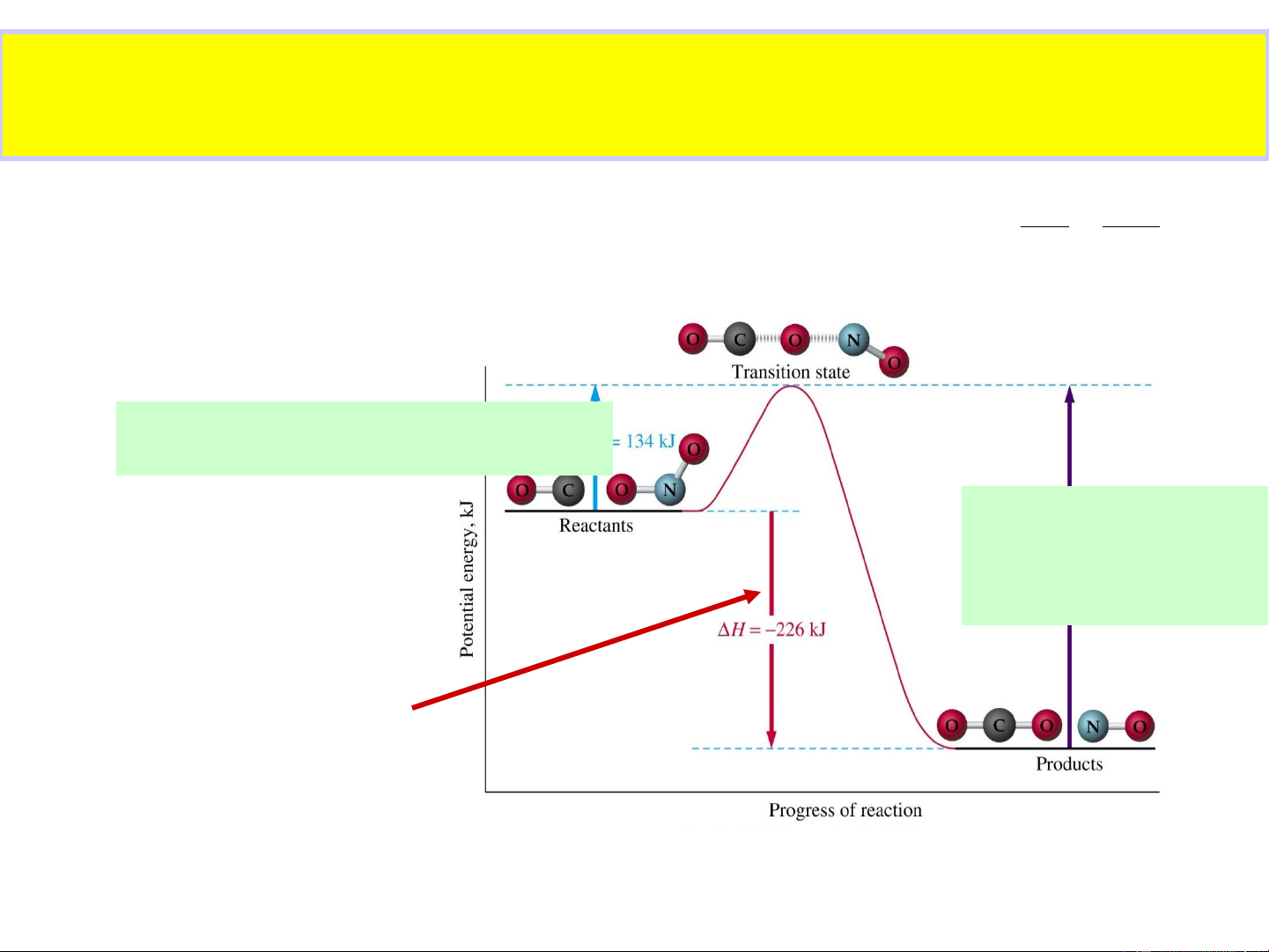
THUYẾT PHỨC CHẤT HOẠT ĐỘNG E* S* E*=H
-H → năng lượng hoạt hoá PCHD cđ RT R S*=S - S k Ze e PCHD
cđ → định hướng kgian
Phức chất hoạt động E* +E* =E* =134kJ CO NO2 t
E * < E* → H < 0 E* =360kJ n t n
CO+NO ↔ CO +NO 2 2
E* > E* → H > 0 = E* +E* t n CO2 NO Hiệu ứng nhiệt của phản ứng EOS
(H = E* –E* ) t n 20




