
















Preview text:
Phần II – ĐIỆN HÓA HỌC Chương I
DUNG DỊCH CÁC CHẤT ĐIỆN LY MỞ ĐẦU
Điện hóa học: N/cứu QT chuyển hóa NL hóa học thành điện năng và
ngược lại N/cứu mối liên hệ giữa hiện tượng hóa và hiện tượng điện.
Là cơ sở lý thuyết cho nhiều PP n/cứu, ngành công nghệ hóa học và luyện kim
Có vai trò quan trọng trong
Nghiên cứu ở phòng thí nghiệm Thực tế sản xuất NVA 2 ĐHBK-HN I. SỰ ĐiỆN LY
I.1. Chất điện ly và nguyên nhân của hiện tượng điện ly
I.2. Các đại lượng đặc trưng cho sự điện ly
I.3. Phân loại dung dịch điện ly
I.4. Tính chất nồng độ của dung dịch các chất điện ly
I.5. Hoạt độ và hệ số hoạt độ trung bình của chất điện ly mạnh NVA 3 ĐHBK-HN
I.1. Chất điện ly & nguyên nhân của sự điện ly
Nước đường và nước muối đều là các dd, nhưng có nhiều tính chất rất khác
nhau VD: độ dẫn điện, các tính chất nồng độ: điều này do trong dung dịch
muối có hiện tượng điện ly.
A) Chất điện ly: dẫn điện khi hòa tan trong dm (phân cực) hoặc ở trạng thái nóng chảy. hòa tan trong dm Chất điện ly cation + anion hoặc ở TT nóng chảy
Các chất điện ly thường gồm:
Chất có cấu trúc mạng tinh thể ion: muối vô cơ, một số bazơ tan
Chất có cộng hóa trị phân cực: HCl, H2SO4, NH3... NVA 4 ĐHBK-HN
I.1. Chất điện ly & nguyên nhân của sự điện ly
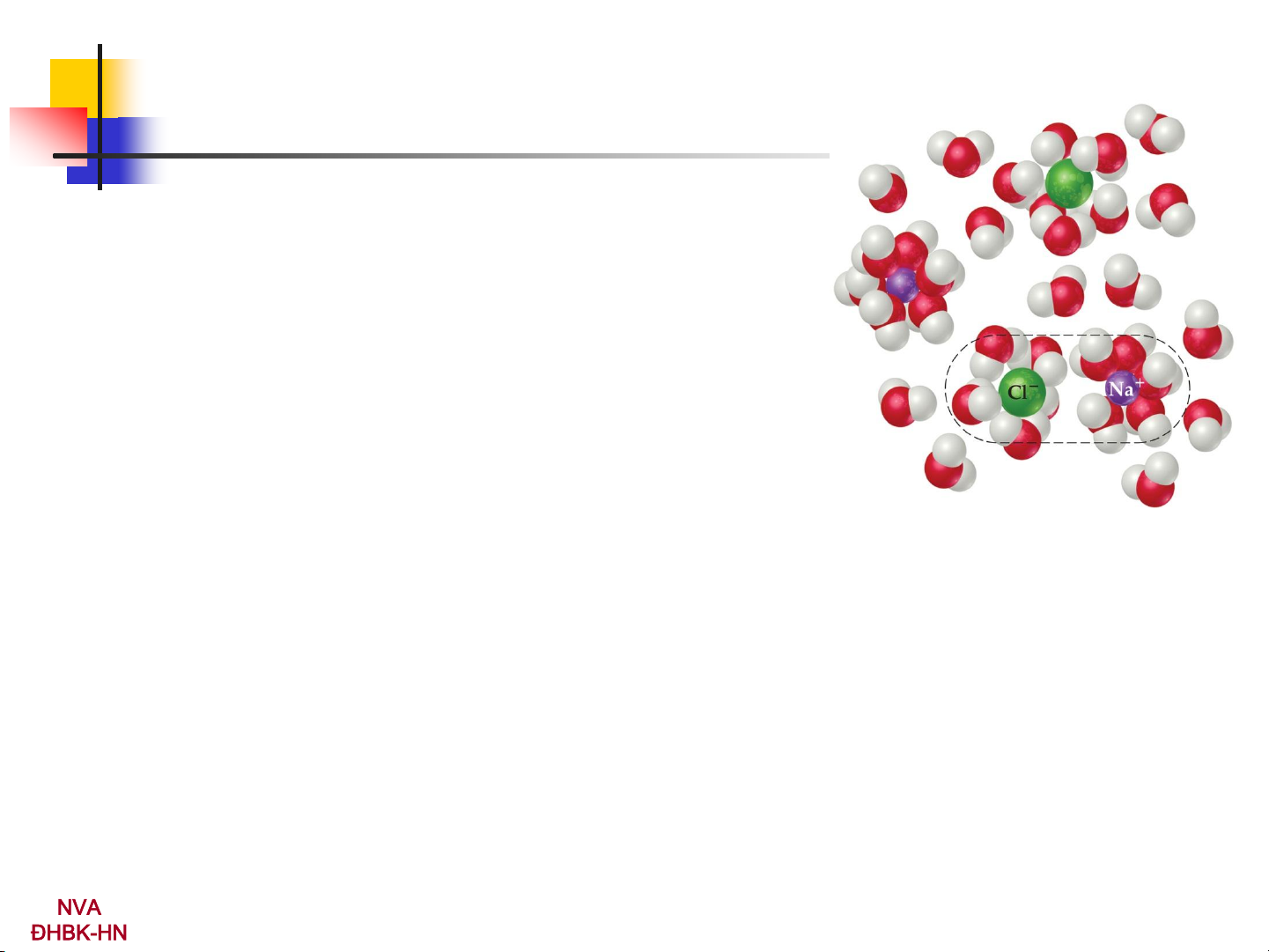
B) Nguyên nhân của hiện tượng điện ly: do tác dụng của dung môi
Xét chất điện ly có cấu trúc mạng tinh thể
Cấu trúc chất tan có LK ion: trong mạng
tinh thể chỉ có các ion khi hòa tan, chỉ
có sự tách ion ra khỏi mạng tinh thể.
Sự chuyển ion vào dung dịch:
do kết quả tương tác giữa các ion trong mạng lưới tinh thể với các phân
tử dung môi phá vỡ mạng lưới tinh thể
do sự tạo thành liên kết giữa các ion được giải phóng với các phân tử dung môi solvat hóa NVA 5 ĐHBK-HN
I.2. Các đại lượng đặc trưng cho sự điện ly
1. Hằng số phân ly (Kply):
Giả sử có phản ứng phân ly dạng: K +A - +KZ+ + -AZ- C Z C . K (1.1) K Z A C C K A a Z K a . (1.2) K Z A a K a A Trong đó:
- CK , CA , CK +A -: nồng độ của cation, anion và K +A - khi cân bằng;
- aK , aA , aK +A -: hoạt độ của cation, anion và phân tử K +A - khi cân bằng. NVA 6 ĐHBK-HN
I.2. Các đại lượng đặc trưng cho sự điện ly
K: đặc trưng cho mỗi chất điện ly, chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ.
Hệ thức (1.1): chỉ áp dụng cho chất điện ly yếu trong dung dịch loãng.
Hệ thức (1.2): áp dụng cho dd đậm đặc, hoặc dd chất điện ly mạnh
Nếu không có dữ kiện về hoạt độ, vẫn sử dụng (1.1) cho dung dịch đặc.
Kply của một số chất trong dung dịch nước: HCOOH: Kply = 1,765.10-4 (20oC) CH3COOH Kply = 1,76.10-5 (25oC) NH4OH Kply = 1,79.10-5 (25oC) NVA 7 ĐHBK-HN
I.2. Các đại lượng đặc trưng cho sự điện ly
2. Độ điện ly ( ): đặc trưng cho mức độ phân ly của chất điện ly Số phân tử phân ly = 1 (1.3) Số phân tử hòa tan 3.Hệ số Van’t Hoff (i):
Tổng số tiểu phân sau phân ly i = (1.4)
Tổng số tiểu phân ban đầu
dung dịch điện ly: i >1; dung dịch không điện ly: i =1.
i = f(C): nồng độ giảm i tăng tới giá trị tới hạn ứng với =1 NVA 8 ĐHBK-HN
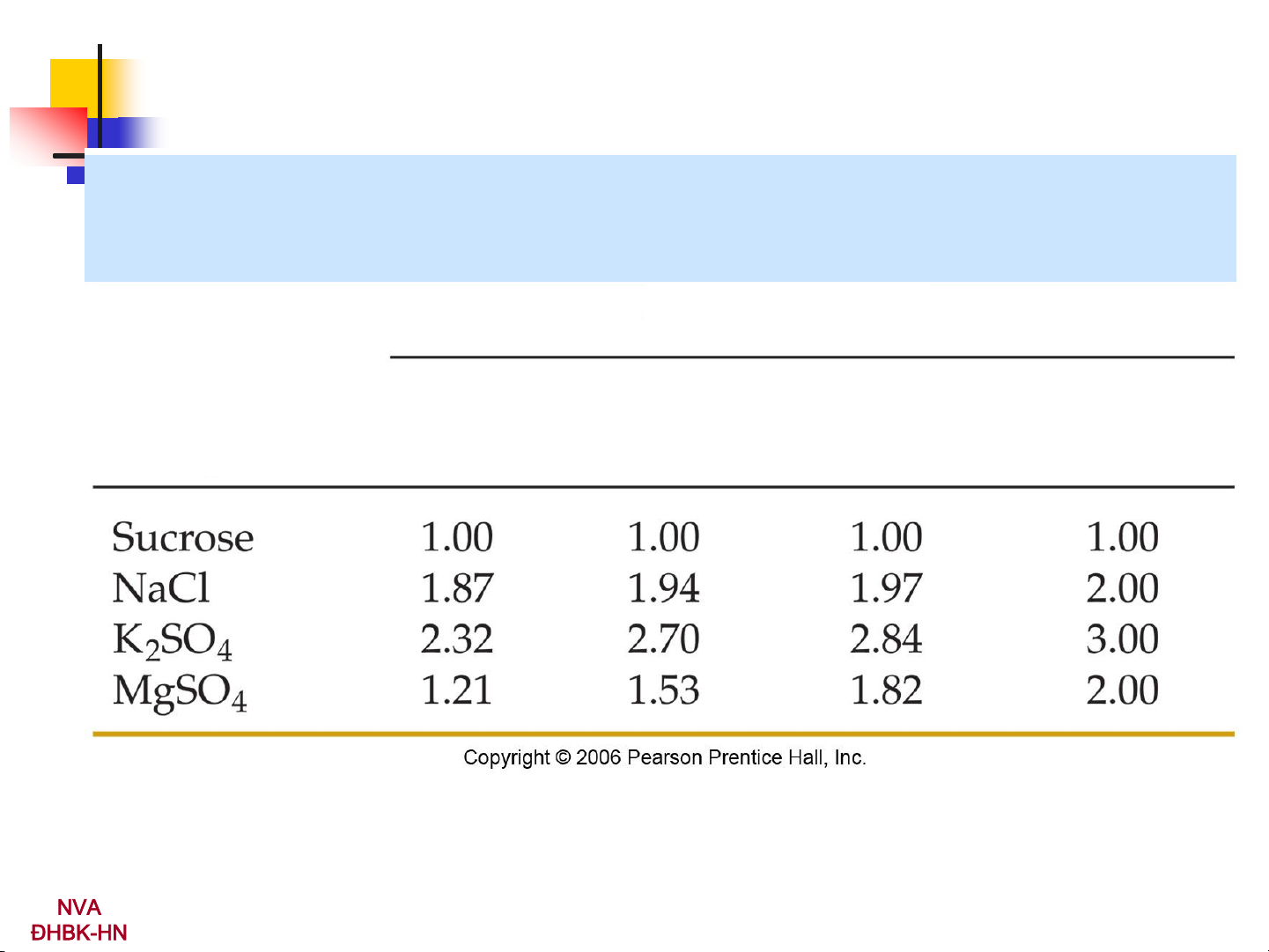
Hệ số Van’t Hoff của một số chất ở 25oC Nồng độ Chất 0.100m 0,010m 0,001m dd vô cùng loãng NVA 9 ĐHBK-HN
I.3. Phân loại dung dịch điện ly
Phân loại theo số và loại điện tích: Hóa trị điện hóa Chất điện ly Loại | +Z+| =| -Z-| NaCl 1 – 1 n = 1 BaCl 2 – 1 n = 2 2 AlCl 3 – 1 n = 3 3 CuSO 2 – 2 n = 2 4
KN: đương lượng của một chất điện ly: đlg = M n VD: đlg (H 98 2SO4) = = 49 (n =2) 2 NVA 10 ĐHBK-HN
I.3. Phân loại dung dịch điện ly
Phân loại dựa vào độ điện ly:
Chất điện ly mạnh: phân ly hoàn toàn ( 1)
Đa số các muối tan, một số axit mạnh và bazơ mạnh trong dd nước
Chất điện ly yếu: phân ly một phần ( < 1)
Chỉ mang tính chất tương đối: khả năng phân ly của chất điện ly tùy thuộc vào dung môi.
VD: N(CH3)4Cl phân ly hoàn toàn trong dung môi nước, không phân ly trong dung môi benzen
Sự khác nhau giữa chất điện ly yếu và mạnh còn ở nhiều t/chất khác. NVA 11 ĐHBK-HN 1. Chất điện ly mạnh
Tính chất khác xa với DD lý tưởng (cả dung dịch rất loãng)
Độ điện ly ( ) khác nhau nếu đo bằng các
PP khác nhau là đại lượng biểu kiến
Nồng độ cao: < 1 dù chất tan điện ly hoàn toàn.
Giải thích: Dù DD rất loãng, lực tương tác tĩnh điện vẫn đủ mạnh để gây những ản
h hưởng rõ rệt đối với dung dịch. Vì vậy:
Nồng độ vẫn phải thay bằng hoạt độ
Lực tương tác gây ra ảnh hưởng khác nhau đến các quá trình khác nhau,
đo bằng PP khác nhau (Phép nghiệm lạnh, nghiệm sôi, đo độ dẫn điện…) các giá trị khác nhau. NVA 12 ĐHBK-HN 2. Chất điện ly yếu
Quá trình phân ly chất điện ly yếu là một quá trình thuận nghịch, giữa
phân tử không phân ly và ion thiết lập cân bằng: K +A - ⇌ +Kz+ + -Az-
Ví dụ: Phản ứng phân ly axit axetic: CH3COOH ⇌ CH3COO- + H+
Dung dịch loãng: gần đúng định luật của DD lý tưởng
Độ điện ly trong dung dịch loãng đo bằng các phương pháp khác
nhau sẽ cho giá trị như nhau. NVA 13 ĐHBK-HN
a. Mối liên hệ giữa hằng số cân bằng KC và
DD đủ loãng thay hoạt độ bằng nồng độ; Giả sử + = - =1: Ví dụ CH3COOH ⇌ CH3COO- + H+ t = 0 Co 0 0 t 0 Co - C1 = Co(1- ) C1= Co C1= Co
(Co : nồng độ đầu của chất điện ly) 2 2 ( C ) K o C o C . (1.5) 1 ( o C ) 1 ( ) K
Nếu << 1 ( 10-5) thì: KC 2.Co C (1.6) Co
định luật pha loãng Ostwald: khi pha loãng thì độ phân ly tăng. NVA 14 ĐHBK-HN
b. Mối liên hệ giữa hệ số Van’t Hoff (i) và Quan hệ giữa i và : K +A - ⇌ +KZ+ + -AZ- t = 0 n (mol) 0 0 t 0 (1- )n + n - n ⇒ i 1 ( n ). n n - n đặt = + + -, ta có: i 1 (1.7) 1 NVA 15 ĐHBK-HN
c. Ảnh hưởng của chất điện ly lạ đến cân bằng ion (K)
Chất điện ly lạ có ion giống với chất khảo sát: chất đly mạnh hơn gây ảnh hưởng VD: CH3COOH : phân ly yếu hơn
CH2ClCOOH : phân ly mạnh hơn
CH3COOH ít ảnh hưởng đến độ phân ly của CH2ClCOOH;
CH2ClCOOH làm giảm nhiều độ phân ly của CH3COOH.
- Chất điện ly lạ có thành phần hoàn toàn khác làm thay đổi hoạt độ
ion của chất khảo sát (t/chất của dung dịch thay đổi). NVA 16 ĐHBK-HN
I.4. Tính chất nồng độ của dd chất điện ly
DD chất điện ly loãng: phải hiệu chỉnh bởi hệ số Van’t Hoff (i) do hiện tượng phân ly
+ Sự thay đổi nhiệt độ kết tinh và sôi T = i.K.mB
B: chất tan; mB: nồng độ molan chất tan;
+ Sự giảm áp suất hơi bão hòa PA = i PoA.xA
A: dung môi; xA: nồng độ phần mol của A
+ Sự tạo áp suất thẩm thấu = i.CBRT
CB nồng độ mol/L của chất tan NVA 17 ĐHBK-HN
I.5. Hoạt độ và hệ số hoạt độ trung bình (chất điện ly mạnh) Hoạt độ: ai = iCi
i: hệ số hoạt độ của ion i Ci: nồng độ của ion i
Ci là nồng độ mol/L; molan; đlg/L;..., i sẽ tương ứng với nồng độ
Hoạt độ và hệ số hoạt độ: chỉ có thể xác định bằng thực nghiệm
Mọi tính chất của dung dịch đều phụ thuộc vào hoạt độ của các cation và anion.
Không thể xác định được hoạt độ của từng ion riêng lẻ sd khái niệm
hoạt độ và hệ số hoạt độ trung bình. NVA 18 ĐHBK-HN
I.5. Hoạt độ và hệ số hoạt độ trung bình
Giả sử có chất điện ly mạnh phân ly theo phương trình: K +A - +KZ+ + -AZ- Có: = + RT ln a + = + + RT ln a+ - = - + RT ln a- = + RT ln a Mà: = + + + - - NVA 19 ĐHBK-HN
I.5. Hoạt độ và hệ số hoạt độ trung bình Suy ra:
= +( o+ +RTlna+) + -( o-+RTlna-) Điều kiện chuẩn: o o o = + + + - Suy ra: lna = +lna+ + -lna- Hay: a = a + - + .a-
Hoạt độ trung bình được định nghĩa: a a a a . trong đó: = + + - NVA 20 ĐHBK-HN



