







Preview text:
CH3061 HÓA LÝ II Phần 3-Hấp phụ Hóa keo 1 Chương II: HẤP PHỤ
I. Đại cương về hấp phụ
- Một số khái niệm về hấp phụ, chất hấp phụ
- Hấp phụ vật lý – hấp phụ hóa học
II. Hấp phụ trên bề mặt lỏng- khí. PT Hấp phụ Gibbs
III. Hấp phụ trên bề mặt rắn-khí 1. PT hấp phụ Langmuir 2. PT Hấp phụ BET 3. Ngưng tụ mao quản
III. Hấp phụ trên bề mặt rắn-lỏng
1. Hấp phụ phân tử trong dung dịch
2. Hấp phụ đặc biệt ion trong dung dịch 3. Hấp phụ trao đổi ion
IV. Giới thiệu một số chất hấp phụ rắn. 2 I. Một số khái niệm Hấp phụ R - K 3
I. Đại cương về hấp phụ
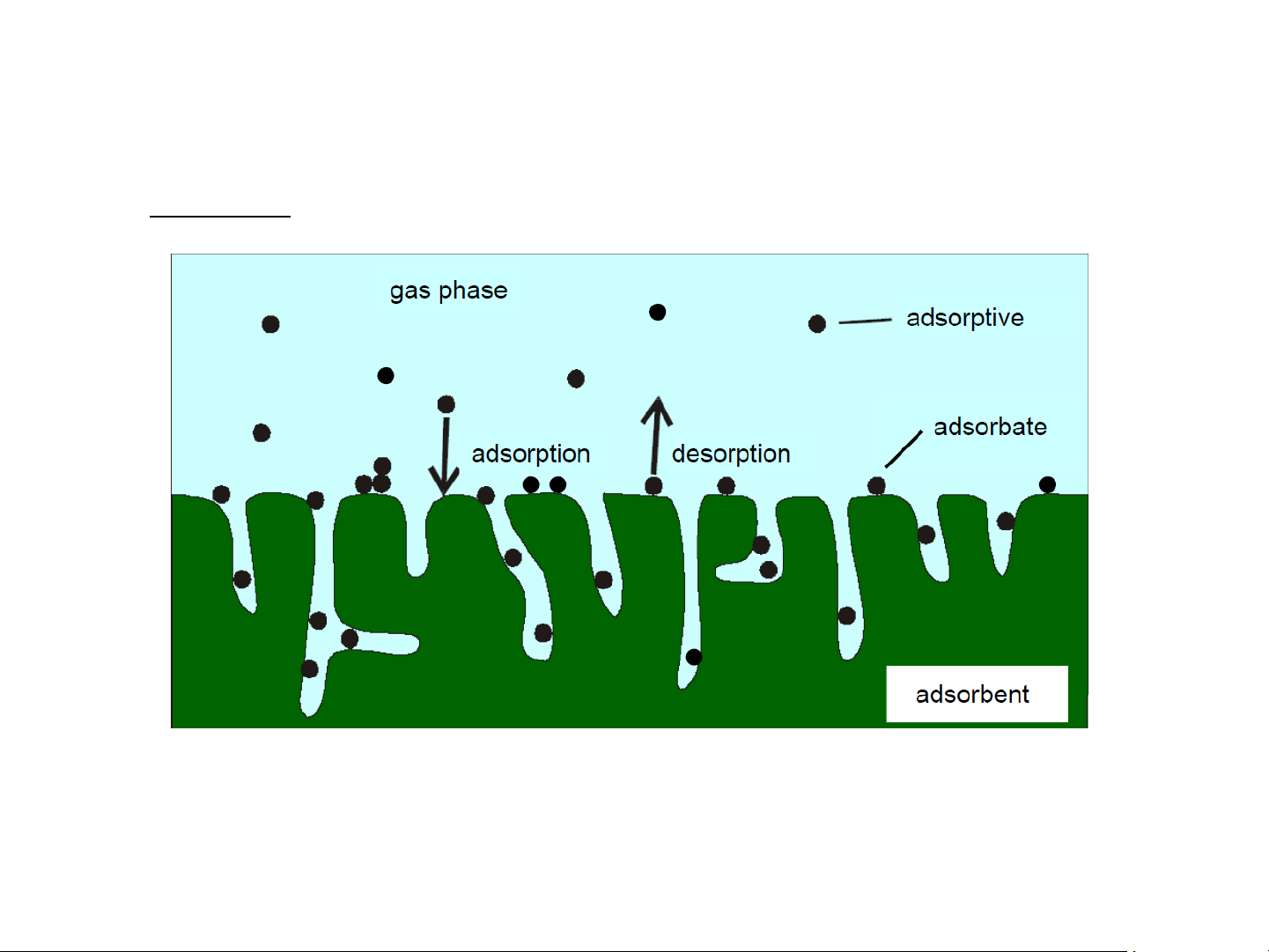
1. Hấp phụ (adsorption): qt tập trung chất lên lớp bề mặt phân
chia pha làm cho nồng độ chất ở đó lớn hơn trong thể tích mỗi
pha. Khử hấp phụ (de-adsorption): ngược lại với qt hấp phụ.
Chất hấp phụ (adsorbent): chất có bm thực hiện sự hấp phụ n
Chất bị hấp phụ (adsorbate): chất bị hút lên bm chất hấp phụ;
thường là chất lỏng, khí hay các chất tan trong dung dịch
2. Độ hấp phụ (a): Đặc trưng cho khả năng hấp phụ của một chất
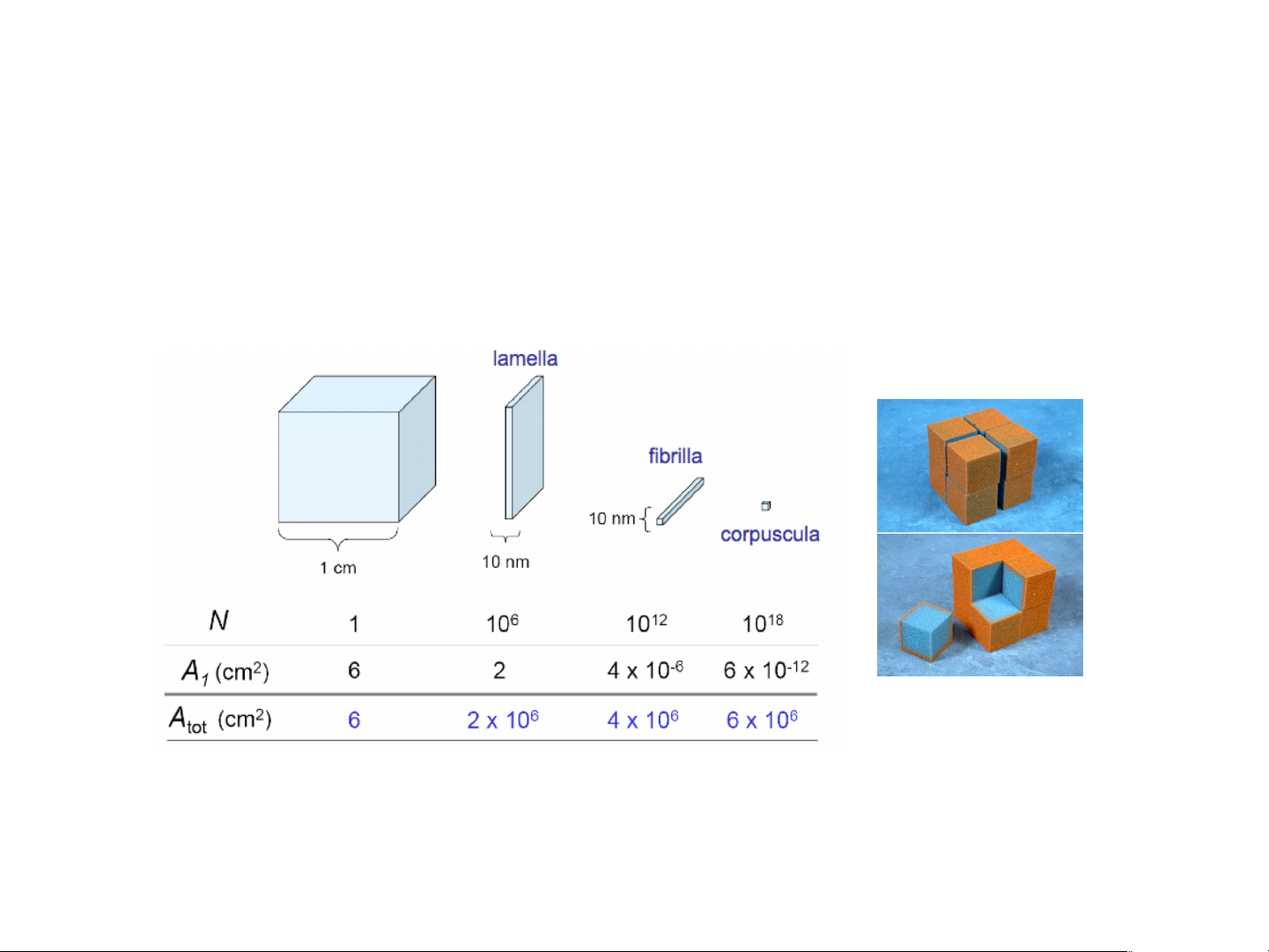
đơn vị: mol/m2 hoặc g/m2 (mol/g, g/g, m3/g, …) 4 Bề mặt riêng n Bề mặt riêng (so):
Diện tích BM ứng với 1 đơn vị khối lượng chất hấp phụ (chất rắn) m2/g
Cùng một thể tích, kích thước vật càng nhỏ à diện tích bề mặt càng tăng 5 Bề mặt riêng SEM image of NaX at 5,000X magnification Than hoạt tính: ~ 1000m2/g Zeolite 500÷ 800m2/g MOFs: ~ 10.000m2/g
Vật liệu có nhiều mao quản (xốp) à bề mặt riêng lớn 6
I. Một số khái niệm 3. Nhiệt hấp phụ:
Quá trình hấp phụ làm giảm entropy: DS < 0
Quá trình tự xảy ra: DG < 0 à DG= DH - TDS < 0
à DH < 0 để quá trình hấp phụ có thể tự xảy ra.
Một số ngoại lệ: VD sự hấp phụ H2 trên bề mặt thủy tinh : H2 (k) à 2H (glass)
TDS (> 0) đủ lớn để bù lại giá trị nhiệt hấp phụ dương (quá trình thu nhiệt)
4. Hấp phụ vât lý – Hấp phụ hóa học 7
4.Hấp phụ vật lý – Hấp phụ hóa học Hấp phụ vật lý Hấp phụ hóa học n Lực hấp phụ Lực Van der Waals (liên
Lực liên kết hóa học (liên kết yếu kết bền) nNhiệt hấp phụ < 100 kJ/mol > 100 kJ/mol n Năng lượng Rất nhỏ hoặc ~ 0 60 -100 kJ/mol hoạt hóa n Khoảng cách
Trong phạm vi kích thước
Trong phạm vi kích thước tương tác lớn (4 - 6Ao) phân tử (< 3Ao) nTính chọn lọc Không chọn lọc Có tính chọn lọc cao nSố lớp hấp phụ >1 1 n Sự phụ thuộc
Nhiệt độ tăng, sự hấp phụ
Phụ thuộc vào năng lượng vào nhiệt độ giảm. hoạt hóa (tốc độ) Hấp phụ thuận nghịch
Hấp phụ bất thuận nghịch 8
Ví dụ - Nhiệt hấp phụ, DHo (kJ.mol-1) Hấp phụ vật lý Hấp phụ hóa học Giá trị lớn Chất bị Chất hấp phụ (substrate) Chất bị nhất của hấp phụ hấp phụ nhiệt hấp Cr Fe Ni phụ vật lý CH C 4 -21 2H4 - 427 -285 -243 H CO -192 2 -84 H H2 -188 -134 2O -59 N NH3 -188 -155 2 -21
(bảng 28.1 và 28.2 , trang 857, sách Hóa lý- tái bản lần thứ 6 (1998), tác giả P.W. Atkins) 9
II. HẤP PHỤ TRÊN BỀ MẶT R-K
1. Phương trình hấp phụ đẳng nhiệt Langmuir a. Các giả thiết: •
Trên bề mặt chất hấp phụ tồn tại các trung tâm hấp phụ •
Bề mặt hấp phụ là đồng nhất, năng lượng hấp phụ trên mọi tâm là như nhau •
Các tâm đã bị hấp phụ không gây ảnh hưởng đến sự hấp
phụ của những tâm bên cạnh • Hấp phụ đơn lớp 10
1. Phương trình hấp phụ đẳng nhiệt Langmuir
b.Thiết lập phương trình: K + R (bề mặt) ⇄ [K-R] Tại cân bằng: p (1 - q) q
Khp: hằng số cân bằng hấp phụ q K = hp p(1-q ) q s
– phần bề mặt chất rắn bị hấp phụ, q = o s
so – diện tích bề mặt của chất rắn (chất hấp phụ)
s – diện tích bề mặt được che phủ bởi chất khí (hơi) 11
1. Phương trình hấp phụ đẳng nhiệt Langmuir K .p hp q = (1)
PT hấp phụ đẳng nhiệt Langmuir 1+ K .p (1916) hp a V
Biểu diễn PT theo các đại lượng khác: q = = m a m V
a - độ hấp phụ tại cân bằng; am: độ hấp phụ cực đại
V - thể tích chất khí ứng với áp suất cân bằng
Vm - thể chất khí ứng với bề mặt được che phủ hoàn toàn theo độ hấp phụ a: theo thể tích khí V: a K .p hp = V K .p hp = a 1+ K .p m hp V 1+ K .p m hp 12
1. Phương trình hấp phụ đẳng nhiệt Langmuir
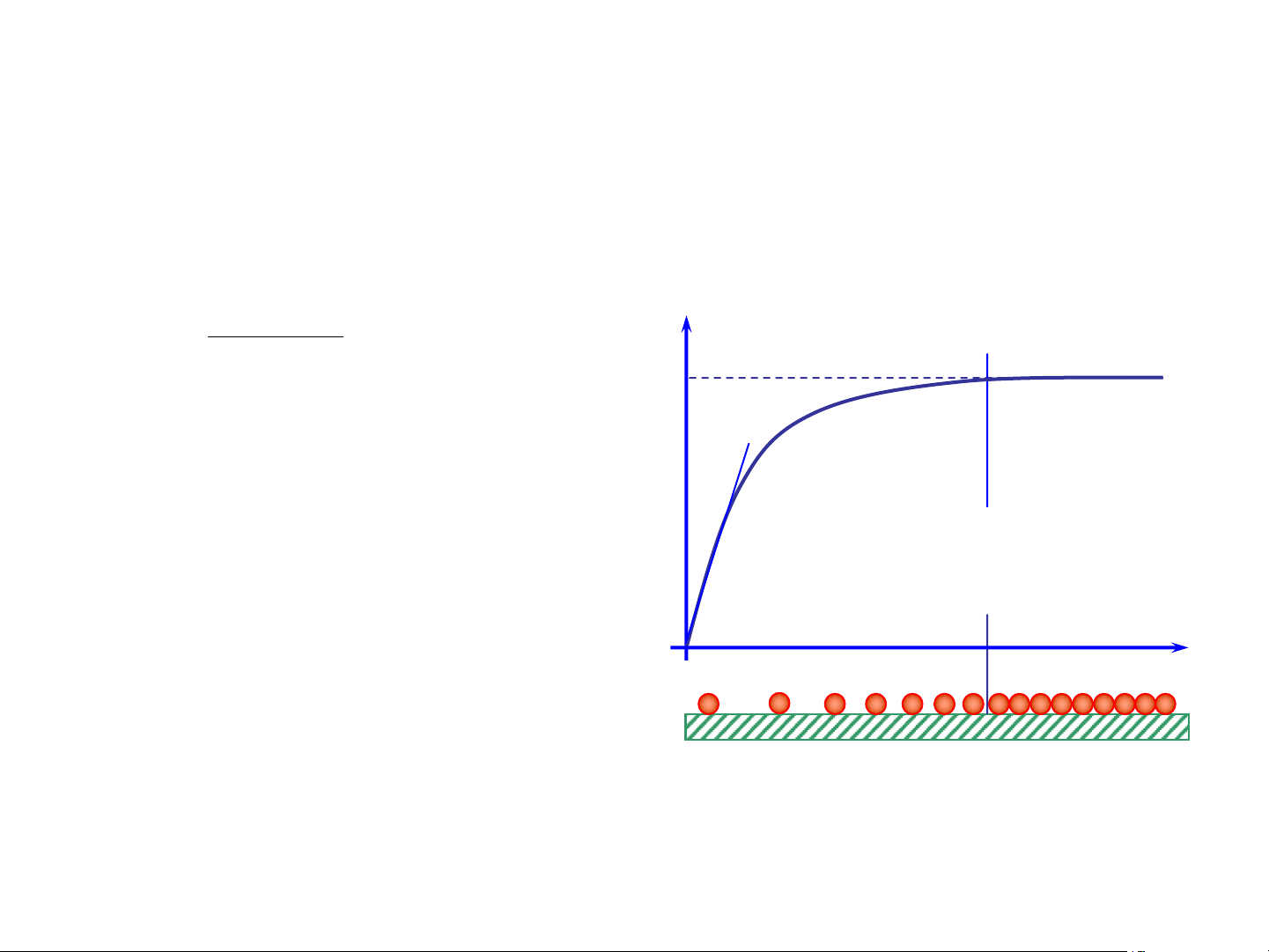
c. Đường hấp phụ đẳng nhiệt Langmuir: K .p a = a hp m a 1+ K .p hp am
•Vùng áp suất thấp: Khp.p <<1 a = am. Khp.p •Vùng áp suất cao: K p hpp >>1 a ®am
Hình 1.1 – Sơ đồ hấp phụ theo PT Langmuir 13
1. Phương trình hấp phụ đẳng nhiệt Langmuir
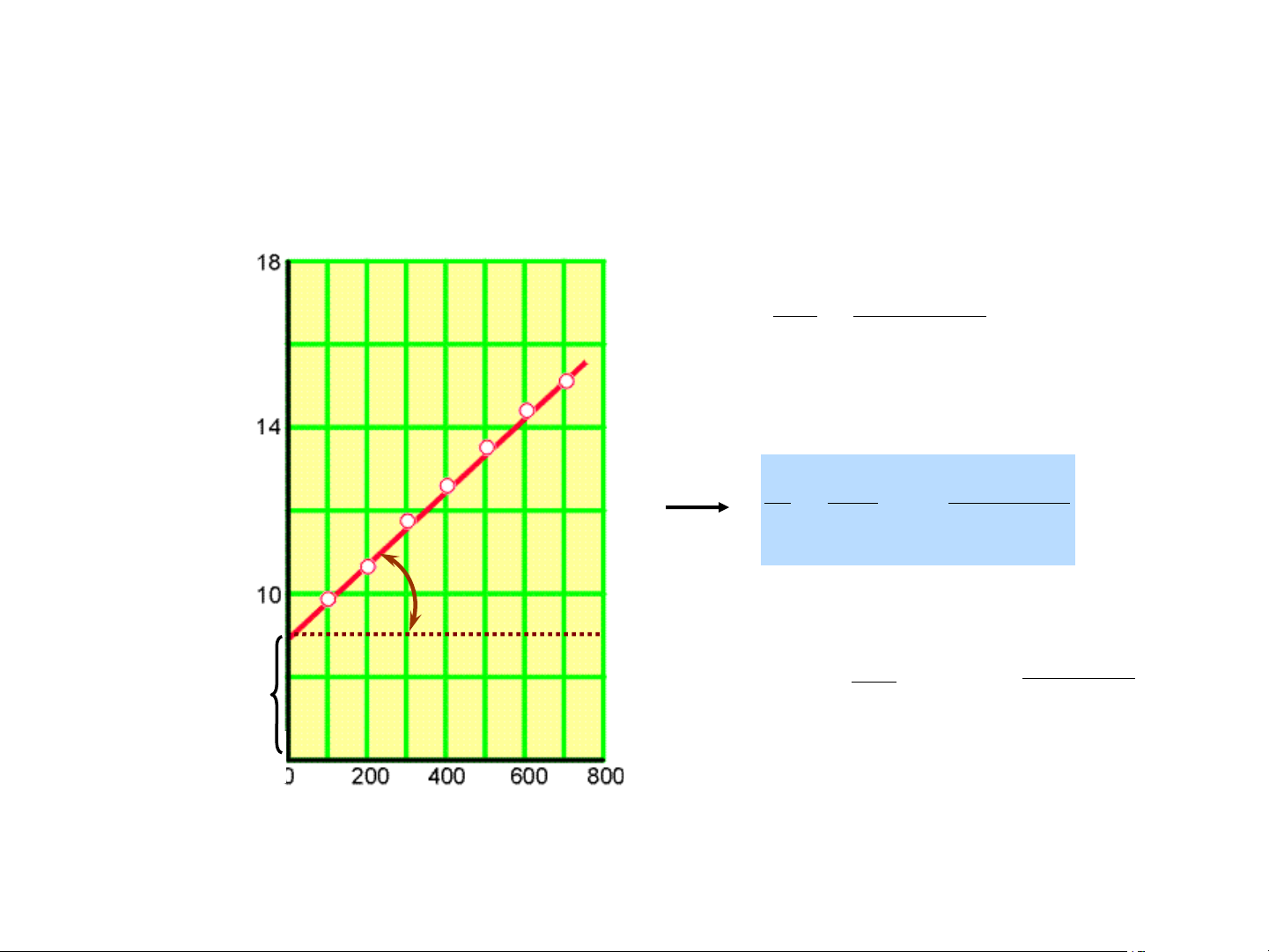
c. Đường hấp phụ đẳng nhiệt Langmuir: V K .p hp = ) V 1+ K .p m hp 3 g/cm H 1 m p 1 1 OA = = + (m . p V . m Khp V V V . m m Khp p/V a A 1 1 tga = OA = m V V . m Khp O p (mmHg)
Hình 1.2. Đồ thị dạng đường thẳng của PT Langmuir 14
1. Phương trình hấp phụ đẳng nhiệt Langmuir
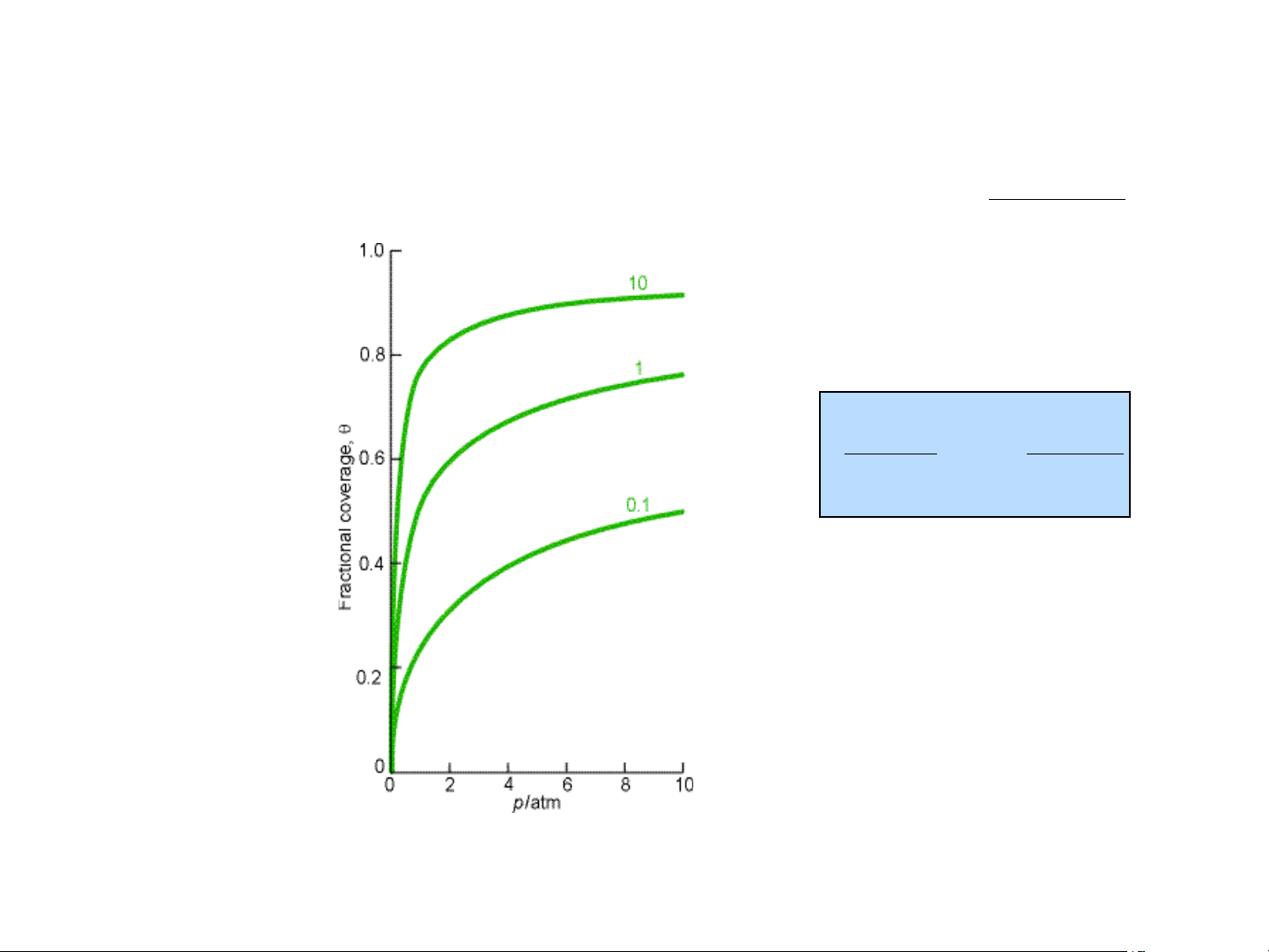
d.Ảnh hưởng của nhiệt độ đến sự hấp phụ: K .p hp q = 1+ K .p hp æ ¶lnK H D ö hp ç ÷ = 2 è T ¶ øq RT
Hình 1.3. PT hấp phụ đẳng nhiệt Langmuir ứng với các giá trị Khp khác nhau 15
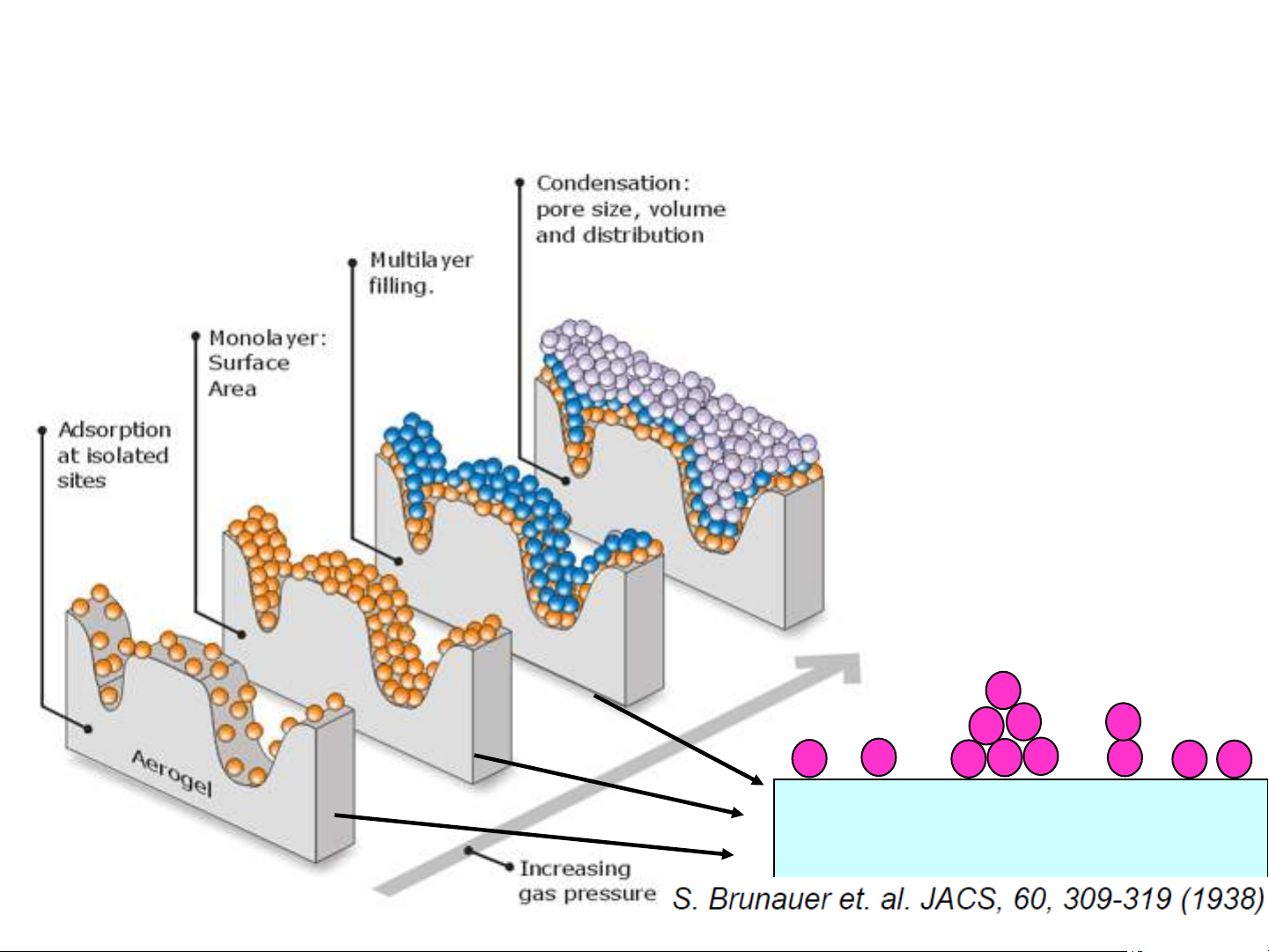
2. Phương trình hấp phụ đẳng nhiệt BET 16
2. Phương trình hấp phụ đẳng nhiệt BET BET equation Brunauer, Emmett and Tel er 17
2. Phương trình hấp phụ đẳng nhiệt BET a. Các giả thiết:
• Hấp phụ đa lớp. Lớp hấp phụ đầu tiên do lực Van der Waals
giữa chất hấp phụ và chất bị hấp phụ. Các lớp sau được tạo ra
do sự ngưng tụ các khí.
• Entanpy hấp phụ của các tiểu phân không thuộc lớp thứ nhất
được coi xấp xỉ bằng nhau và bằng entanpy hóa lỏng (nhiệt ngưng tụ).
• Các hằng số cân bằng K 1 i (i ³ 2), K = , po: áp suất hơi bão i p
hòa của chất bị hấp phụ o
•Số lớp hấp phụ trở nên vô cùng ở áp suất hơi bão hòa po 18
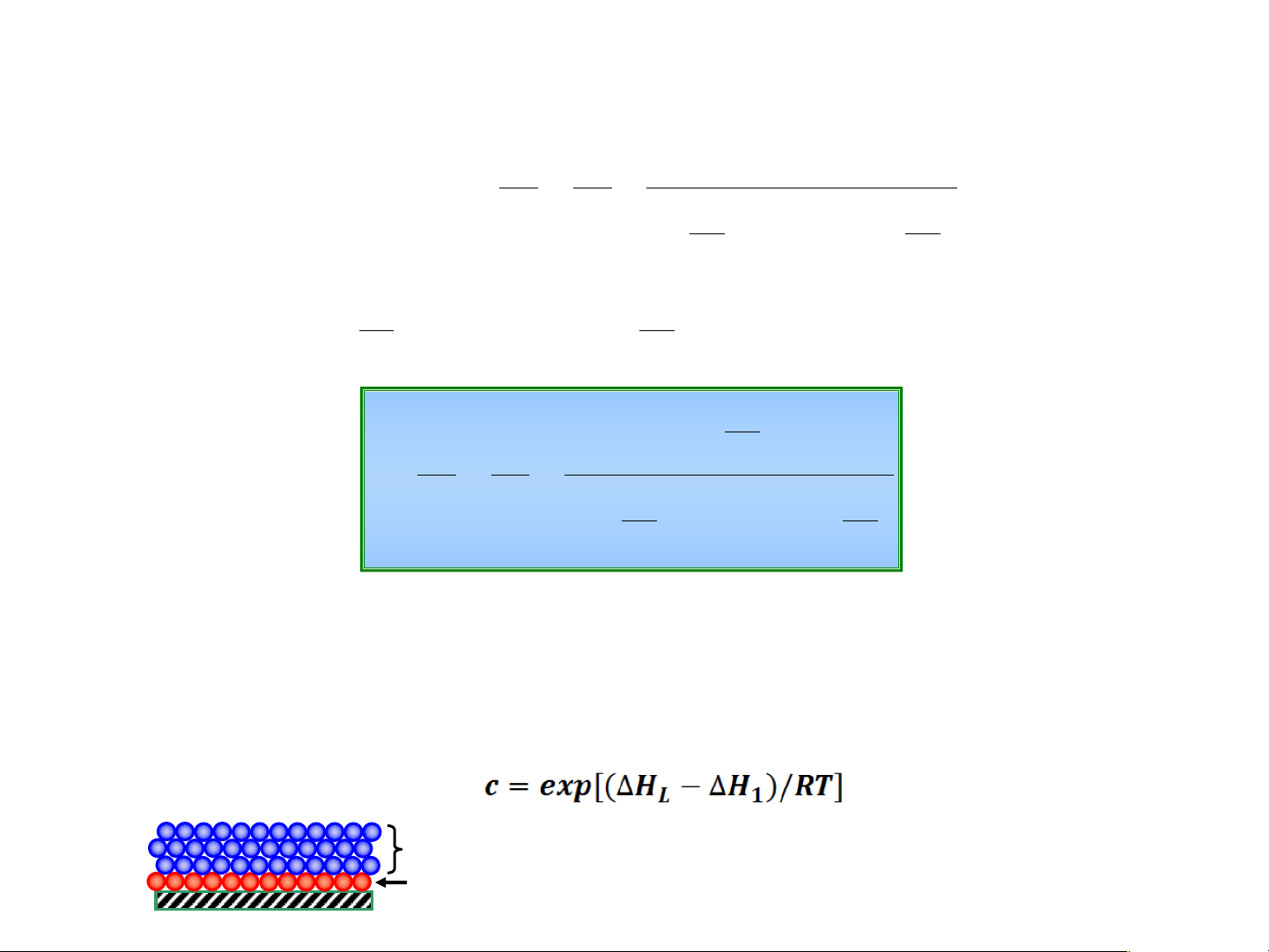
2. Phương trình hấp phụ đẳng nhiệt BET b. Phương trình q = a V K .p = = 1 a V æ p ö æ p ö m m çç1- çç.1+ ÷÷ K1.p - ÷÷ è o p ø è o p ø Đặt K1 1 c = trong đó K = K i i o p p c. q = a V p = = o (2) a V æ p ö æ p ö m m çç1-
÷÷ çç.1+ (c - ) 1 ÷÷ è o p ø è o p ø
Trong đó: po – áp suất hơi bão hòa của chất bị hấp phụ trên bm thoáng
V – thể tích chất bị hấp phụ ở áp suất p (cm3/g)
Vm – thể tích chất bị hấp phụ tạo ra đơn lớp hấp phụ đặc khít trên bề mặt vật rắn, (cm3/g) DH1 >> DHL
DHL nhiệt hấp phụ của các lớp ngoài = nhiệt ngưng tụ
DH1 nhiệt hấp phụ của đơn lớp đầu tiên 19
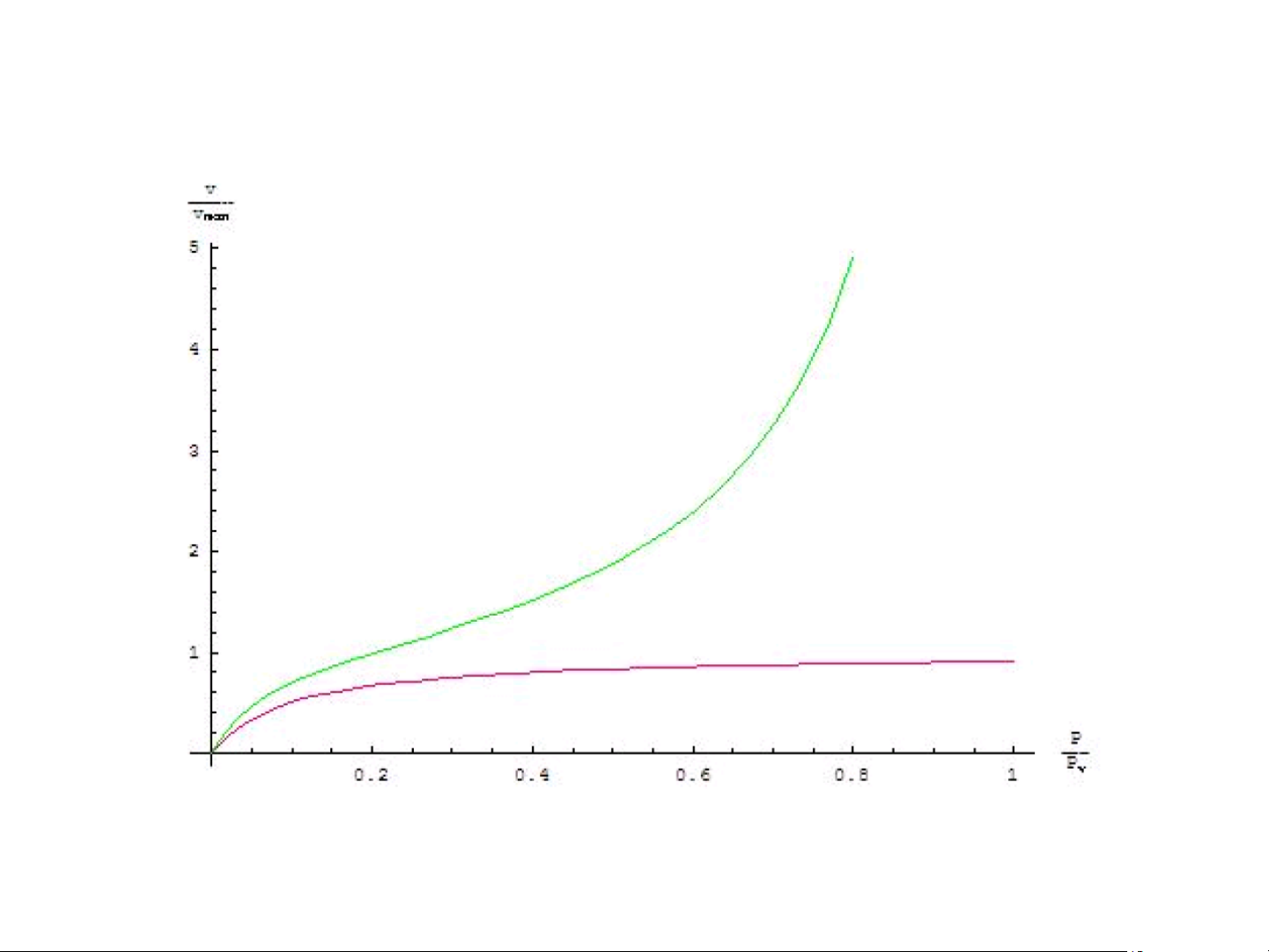
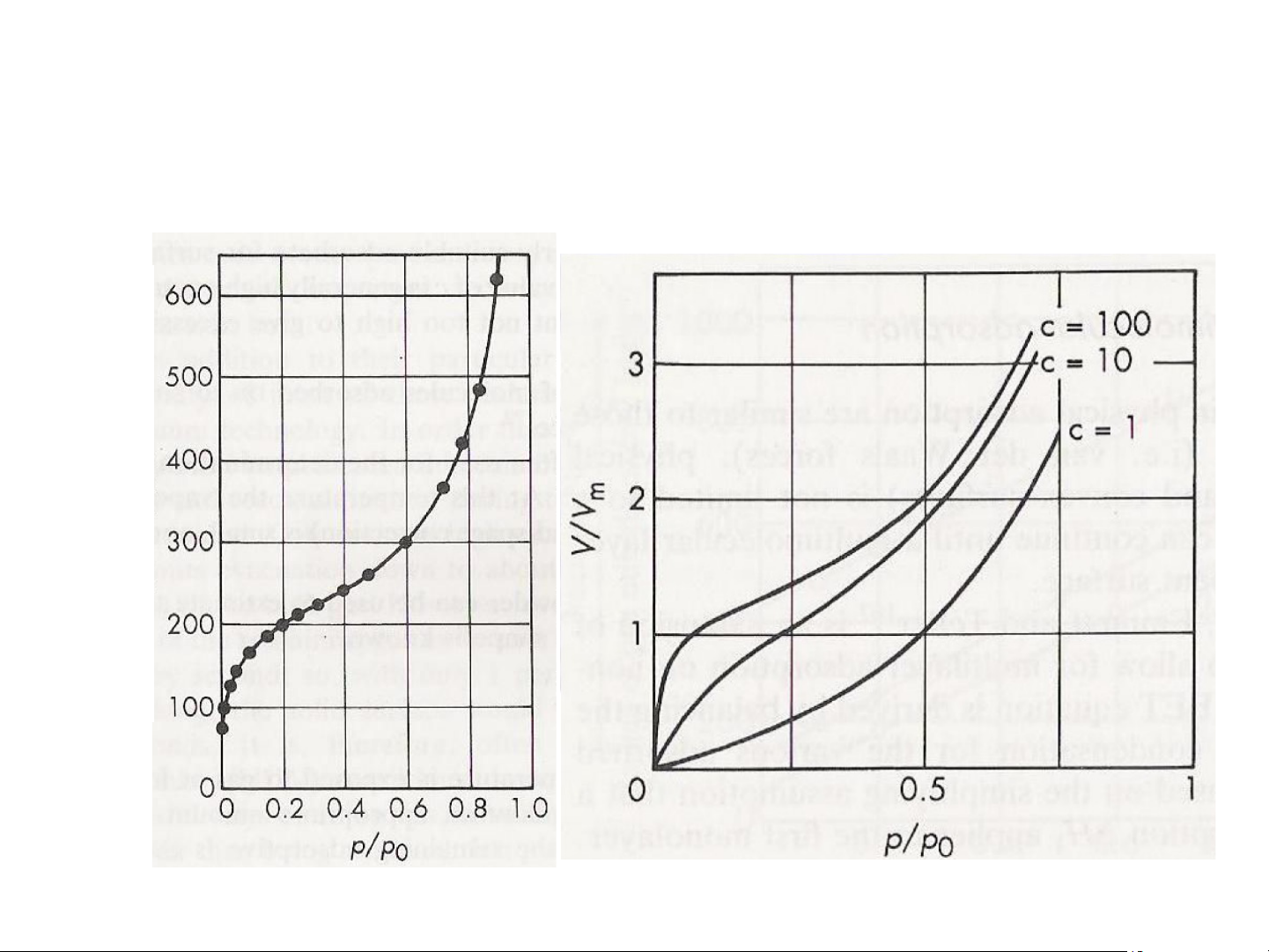
2. Phương trình hấp phụ đẳng nhiệt BET
c. Đường hấp phụ đẳng nhiệt BET ) /g3 (cm V 20



