



Preview text:
lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM
Chương 2. ĐÔNG HỌC CỦA PHẢN ỨNG ĐỒNG THỂ ĐƠN GIẢN MỘT CHIỀỤ
Phản ứng thuận nghịch và phản ứng không thuận nghịch. Bản chất của mọi phản ứng hoá học:
chất tham gia phản ứng được viết vào bên trái của phương trình phản ứng hoá học, còn sản phẩm của
phản ứng thì viết vào bên phải. Các chất tham gia và sản phẩm đều có tên gọi chung là các cấu tử của
phản ứng. Dựa vào dấu hiệu động học của phản ứng, người ta phân ra thành phản ứng thuận nghịch
và phản ứng không thuận nghịch.
Câu hỏi? Phát biểu khái niệm phản ứng hoá học và phương trình phản ứng hoá học?
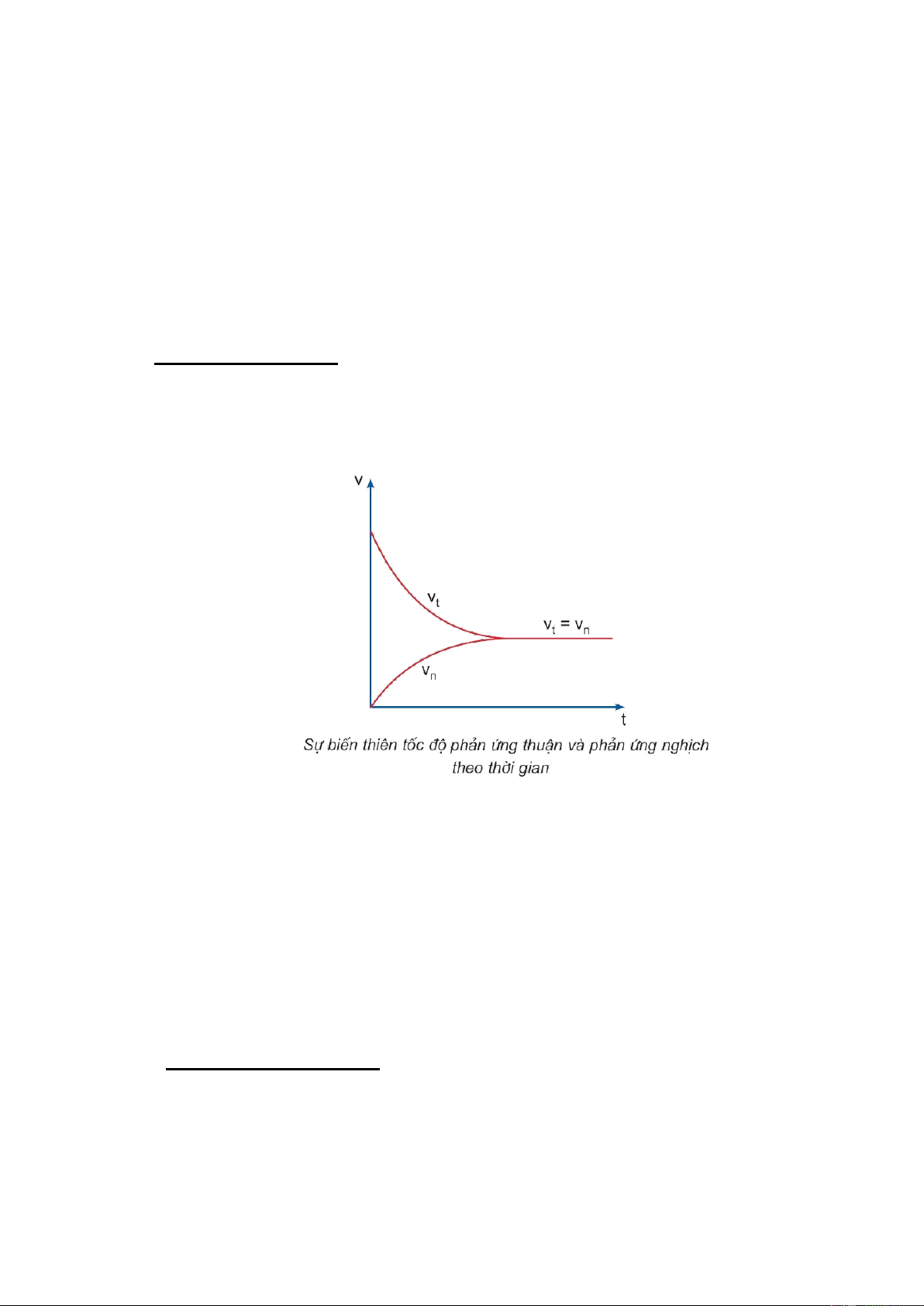
Phản ứng thuận nghịch – là phản ứng đồng thời xảy ra theo hai chiều ngược nhau (chiều thuận
và chiều nghịch). Lúc đầu tốc độ của phản ứng thuận và tốc độ của phản ứng nghịch là khác nhau,
nếu ta gọi tốc độ chung của phản ứng thuận nghịch là v , sau một thời gian: v , hệ đạt trạng thái tn t = vn cân bằng.
Tất cả các phản ứng hoá học đều là phản ứng thuận nghịch, nhưng trong những điều kiện xác
định một số phản ứng có thể xảy ra theo một chiều, thực tế làm biến đổi hết các chất đầu, còn tốc độ
của chiều kia rất nhỏ, ta có thể bỏ qua. Đó là những phản ứng bất thuận nghịch hay phản ứng một chiều.
Các phản ứng bất thuận nghịch thường gặp là những phản ứng mà sản phẩm của phản ứng có
thể tách ra khỏi môi trường phản ứng.
Ví dụ phản ứng trong dung dịch lỏng có sự tạo thành các chất khí, chất kết tủa hoặc các phản
ứng trao đổi ion tạo ra chất ít tan, chất ít điện li.
Phản ứng bất thuận nghịch – là phản ứng tự xảy ra theo một chiều xác định. Trong phương
trình phản ứng bất thuận nghịch người ta dùng mũi tên một chiều để chỉ chiều của phản ứng. Đối với
phản ứng một chiều các chất tham gia chuyển hoá hoàn toàn thành sản phẩm hay nói cách khác hiệu
suất của phản ứng là 100%.
Các dấu hiệu không thuận nghịch của phản ứng hoá học: lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM
1. Tạo thành sản phẩm bền trong điều kiện diễn ra phản ứng:
• các hợp chất có thể tách ra khỏi môi trường phản ứng (chất kết tủa hay còn gọi là chất ít tan,
chất khí bay ra khỏi hỗn hợp phản ứng).
• phức chất bền hay chất điện li yếu. BaCl ↓ + 2KCl 2 + K2SO4 → BaSO4 AgCl + 2NH3 → [Ag(NH3)2]Cl HCl + NaOH → NaCl + H2O
2. Đặc trưng tỏa nhiệt của phản ứng (∆ H < 0) hoặc phản ứng tạo thành sản phẩm có số mol lớn r
hơn số mol các chất tham gia, có nghĩa là phản ứng diễn ra theo chiều tăng entropi (∆rS > 0).
Ví dụ các phản ứng nhiệt phân các hợp chất:
2KMnO4(r) → K2MnO4(r) + MnO2(r) + O2(k)
2C6H6 + 15O2 → 12CO2 + 6H2O 2KClO3 → 2KCl + 3O2
là các phản ứng một chiều lí tưởng, bởi vì từ sản phẩm của các phản ứng này không thể điều chế được
các chất ban đầu bằng bất kì phương pháp nào đã biết.
Kết luận: phản ứng không thuận nghịch là các phản ứng trung hoà, phản ứng tạo phức chất
bền, phản ứng nhiệt phân các hợp chất, phản ứng giữa các kim loại hoạt động với oxygen, với nước, với acid, v.v.
Câu hỏi? Trong tự nhiên, các phản ứng bất thuận nghịch nhiều hơn các phản ứng thuận nghịch. Đúng hay sai?
Về nguyên tắc có thể lựa chọn những điều kiện thích hợp để các phản ứng diễn ra thuận nghịch. Ví
dụ, nếu trong hệ mở phản ứng diễn ra một chiều, thì trong điều kiện hệ kín nó có thể chỉ xảy ra đến trạng thái cân bằng.
Câu hỏi? Nhắc lại các khái niệm hệ mở, hệ kín, hệ cô lập. Cho ví dụ minh họa.
Thường các nhà hóa học thực nghiệm cố gắng tiến hành các phản ứng trong những điều kiện
sao cho chúng diễn ra theo một chiều xác định, hay nói cách khác tìm mọi điều kiện thích hợp nhất
để phản ứng diễn ra với hiệu suất tạo thành sản phẩm là cao nhất và tốc độ tạo tạo thành sản phẩm là nhanh nhất.
Nếu phản ứng một chiều diễn ra qua một giai đoạn và tốc độ của nó tuân theo định luật
tác dụng khối lượng thì nó được gọi là phản ứng đơn giản một chiều. Còn các phản ứng phức tạp
là do các phản ứng đơn giản một chiều tổ hợp thành.
Trong chương này, chúng ta xét kết quả giải các phương trình vi phân đối với các phản ứng
đơn giản một chiều với các bậc khác nhau. lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM
1. Phản ứng đơn giản một chiều bậc không (0)
Là phản ứng có tốc đô không pḥ ụ thuôc vào nồng độ các chất tham gia phản ứng mà chỉ phụ ̣
thuộc vào các yếu tố bên ngoài. Ví dụ, phản ứng thủy phân ester khó tan trong nước, để trong quá
trình phản ứng luôn có môt ḷ ớp ester dư thì sự tiêu thụ ester trong lớp nước luôn được bổ sung bởi
lớp ester dư này. Hay phản ứng quang hóa, phản ứng xúc tác đều thuôc ṿ ào loại phản ứng bâc 0 dọ
tốc đô c ̣ ủa phản ứng chỉ phụ thuôc ṿ ào lượng ánh sáng bị hấp thụ hay nồng đô c ̣ ủa chất xúc tác mà
không phụ thuôc ṿ ào nồng đô cḥ ất phản ứng.
Phản ứng bâc 0 c ̣ ó thể là phản ứng dị thể xảy ra trên bề măt ṛ ắn của chất xúc tác, ví dụ sự phân hủy NH
O trên dây Pt đốt nóng. Khi bề măt Pt ḅ 3 hoăc Ṇ 2
ão hòa chất khí không làm thay đổi nồng
đô chất khí trên ḅ ề măt c ̣ ủa Pt, lúc đó tốc đô c ̣ ủa phản ứng không phụ thuôc vào ṇ ồng đô c ̣ ủa các chất trong pha khí.
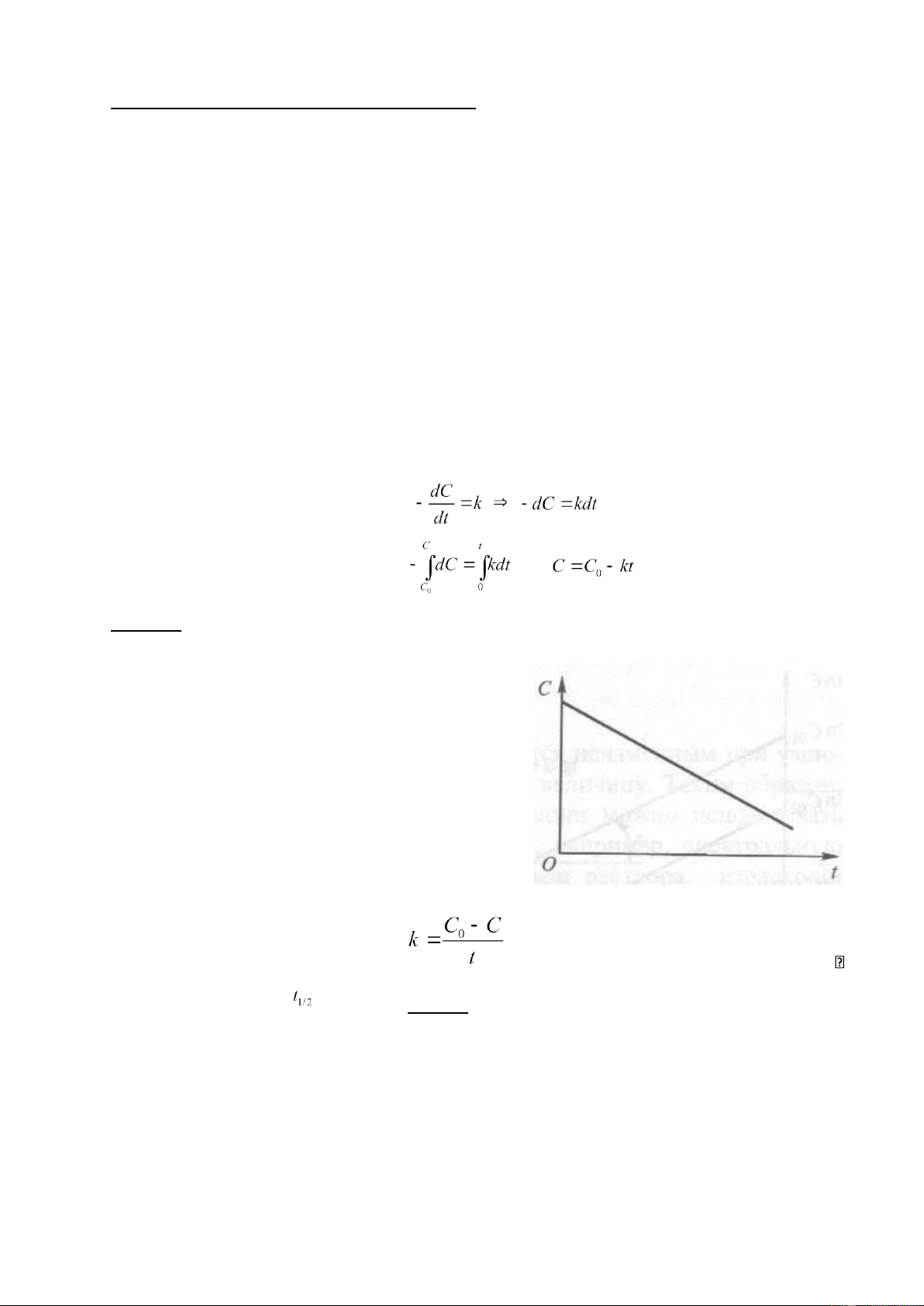
Phương trình động học đối với phản ứng một chiều bậc 0 có dạng: hay (1) Nhận xét:
• Theo phương trình (1) trong phản ứng đơn giản
một chiều bậc 0 thì nồng độ của chất tham gia
phản ứng giảm theo thời gian có đồ thị là một đường thẳng (hình 1).
Hình 1. Đồ thị phụ thuộc nồng độ
vào thời gian t đối với phản ứng bậc 0
• Đơn vị đo của hằng số tốc độ
giống với đơn vị đo của tốc độ phản ứng; Chu kỳ bán hủy
(C = C0/2) (half life): lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM • Để phản ứng xảy ra hoàn toàn (C→0): và Suy ra:
Ví dụ 1. Cho phản ứng xảy ra trong pha khí: N2O5 → N2O4 + ½ O2
ở 25°C người ta thu được các giá trị thực nghiệm như sau: t, phút 0 20 30 40 50 60 PO2, torr 0,0 7,0 11,9 16,9 21,2 25,1
a/ Hãy chứng minh phản ứng trên là phản ứng bậc 0; b/ Tìm giá trị
hằng số tốc độ k và cho biết đơn vị đo của k ở 25°C.
2. Phản ứng đơn giản một chiều bậc 1 Dạng tổng quát: A → B + C + D
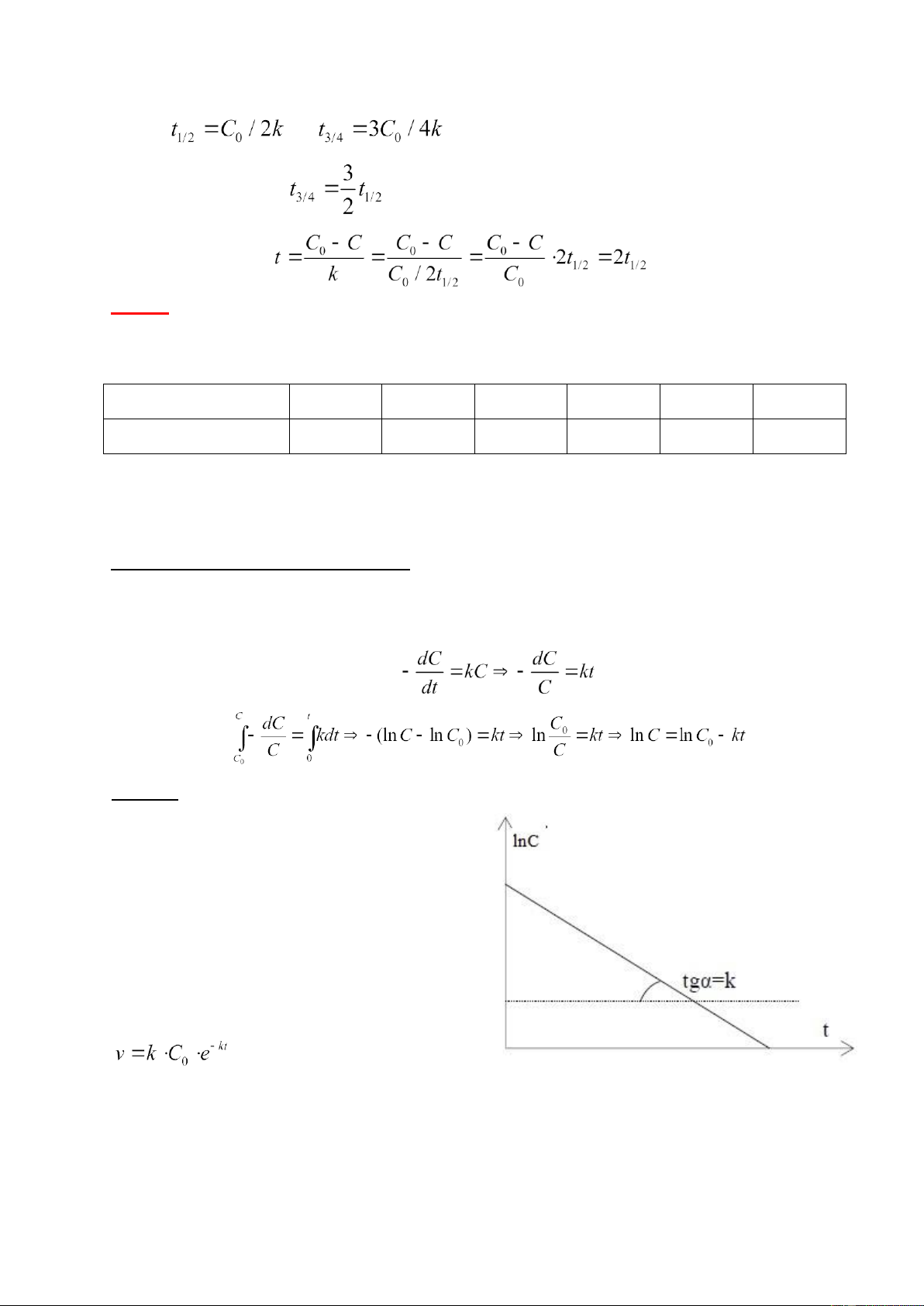
Đối với các phản ứng đơn giản một chiều bậc 1 phương trình động học có dạng: (2) Nhận xét: 1)
Theo phương trình (2) đồ thị biểu diễn
sự phụthuộc lnC vào thời gian t là một
đường thẳng (hình vẽ 2). 2)
Nồng độ của chất đầu tiến dần đến 0 khi
t →∞, nghĩa là phản ứng bâc 1 không c ̣
ó thời điểm kết thúc. 3) Tốc độ phản ứng: lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM 4) Từ phương trình (2) , như vậy đơn vị đo
của hằng số tốc độ phản ứng bậc 1
là nghịch đảo của đơn vị thời gian (s-1; phút-1). 5)
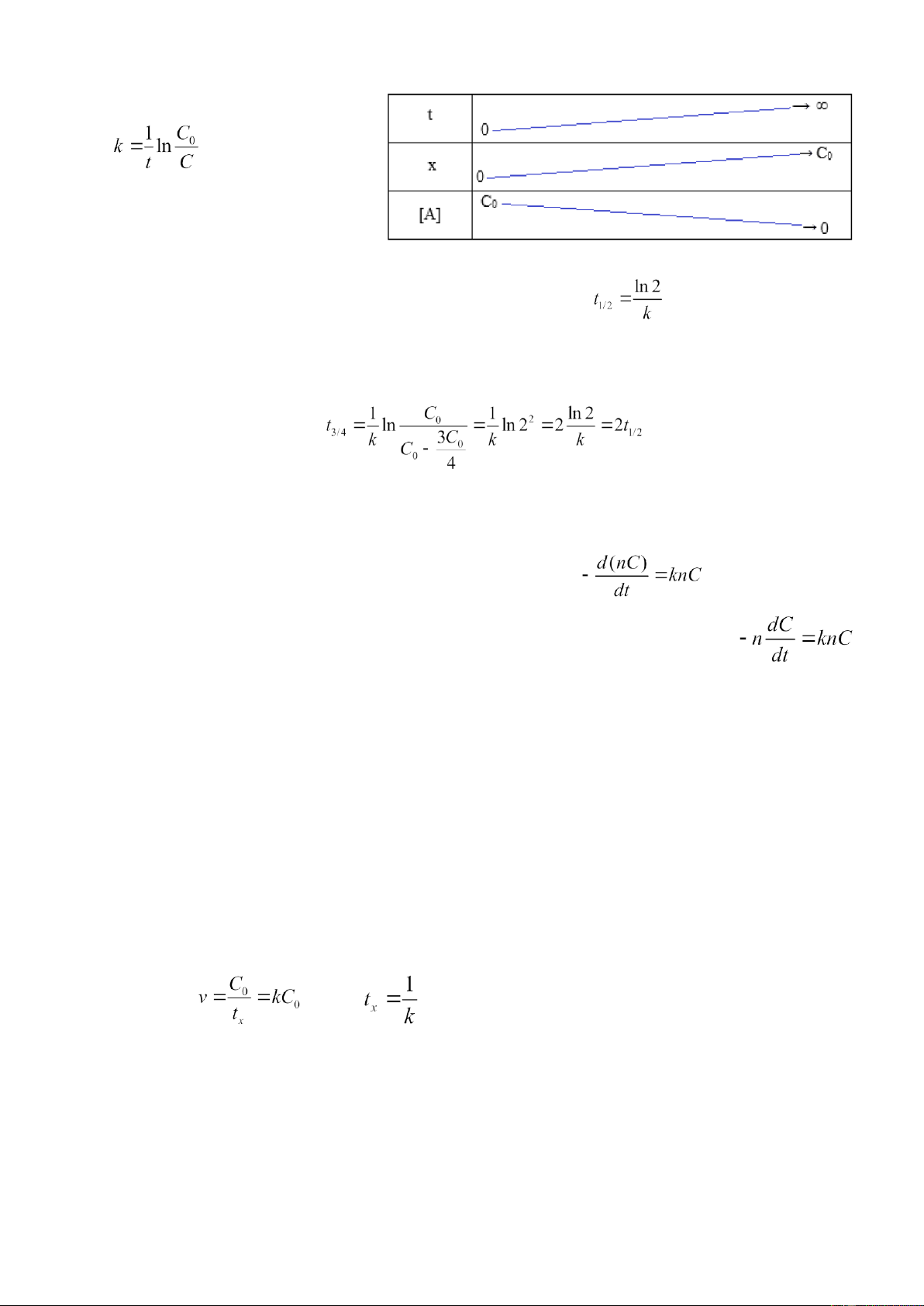
Chu kỳ bán hủy theo phương trình (2) nếu C = C0/2:
, như vậy chu kỳ bán hủy
không phụ thuộc vào nồng độ ban đầu của chất phản ứng. Đây là đăc đị ểm quan trọng chỉ
phản ứng bâc 1̣ mới có. 6)
Từ phương trình động học của phản ứng bậc 1, nếu ta thay nồng độ C bằng một đại lượng tỉ lệnC, ta có:
Do n là một hằng số, nên ta có thể đưa nó ra khỏi dấu vi phân:
Điều đó có nghĩa là phương trình động học không đổi nếu ta nhân nồng độ C với một hằng số nào
đó. Do vậy, để đánh giá tốc độ của phản ứng môt chị ều bậc 1, thay vì đánh giá sự thay đổi nồng độ
của chất tham gia, ta có thể sử dụng các đại lượng tỉ lệ thuận với chúng. Ví dụ như mât độ quang,̣ độ
dẫn điện, thể tích dung dịch. Logarit các đại lượng này cũng thay đổi theo thời gian là một đường thẳng và tgα = k. 7)
Tốc độ tức thời của phản ứng được xác định bởi tg góc tiếp tuyến với đường cong động
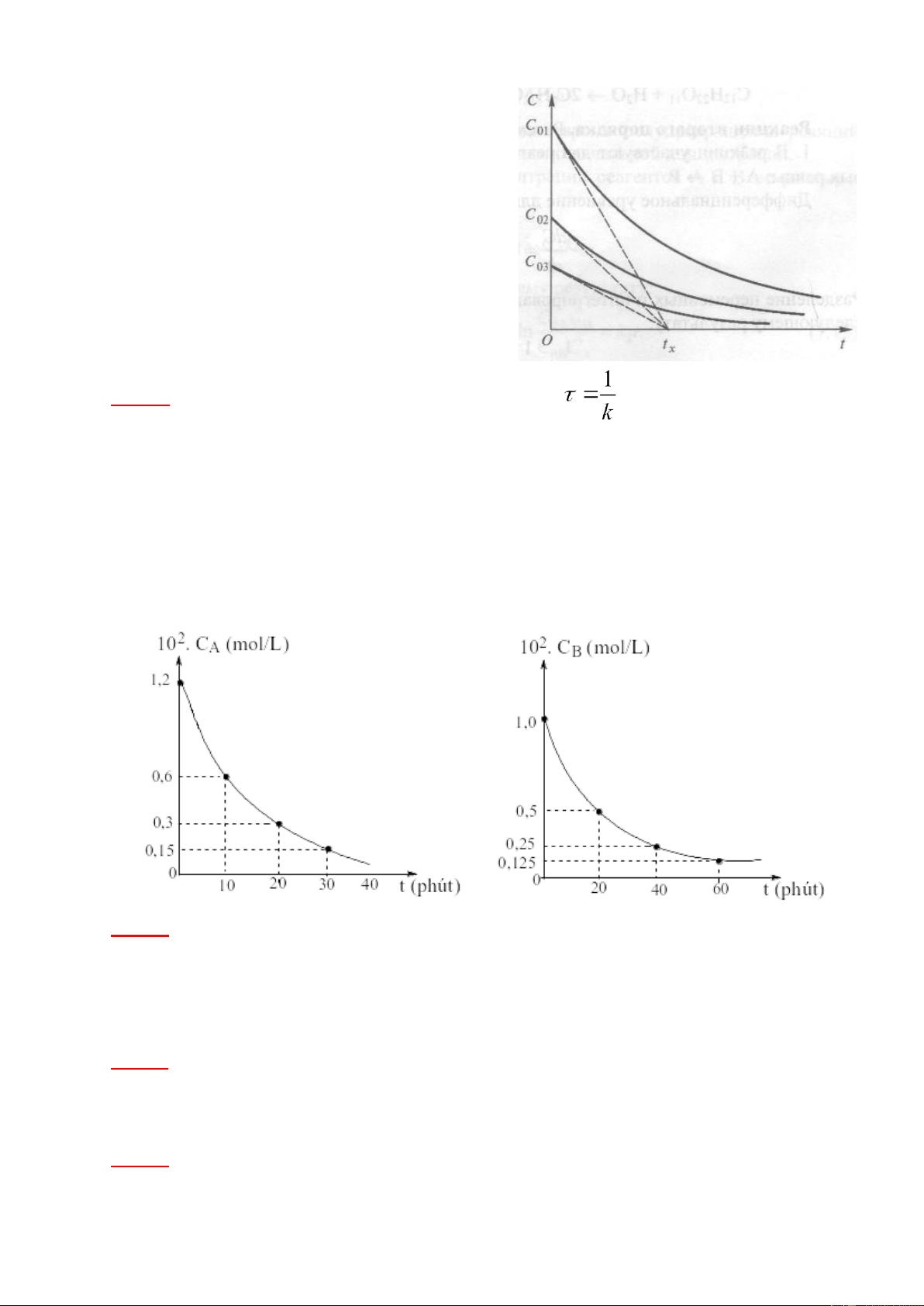
học. Tốc độ đầu của phản ứng v , trong đó t 0 = C0/tx
x – thời gian giao của tiếp tuyến tại điểm
đầu của đường cong động học với trục thời gian. Thay giá trị này vào phương trình động học, ta có: , suy ra
Cho nên với mọi giá trị nồng độ đầu C0 các tiếp tuyến đi qua điểm đầu (tốc độ đầu) giao với trục thời
gian tại một điểm thời gian tx (hình 3). lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM 8)
Thời gian sống trung bình của các phân tử chất tham gia:
và tương ứng với độ giảm nồng độ ban đầu e lần.
Ví dụ, đối với phản ứng nhiệt phân acetone ở T = 777 K (504°C) CH3COCH3 → C2H4 + H2 + CO
Hằng số tốc độ k = 4,27.10-4 (s-1). Khi T = 777 K thời
gian sống trung bình của phân tử acetone: τ = 1/k = 2342 (s) ≈ 39 (phút).
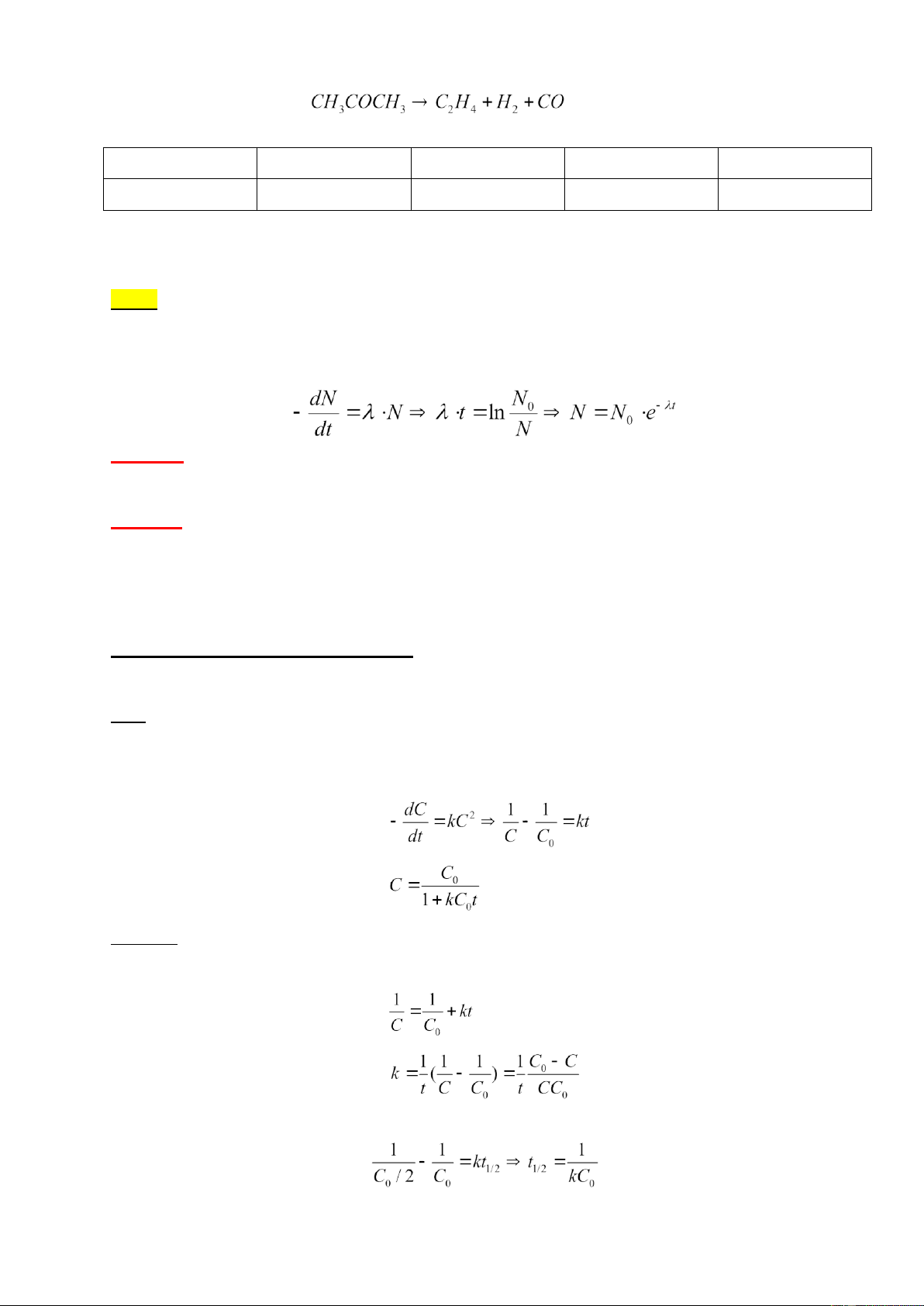
Ví dụ 2. Một phản ứng trong dung dịch diễn ra theo phương trình phản ứng: A + 2B → 2C + D
Để nghiên cứu động học của phản ứng, người ta tiến hành thí nghiệm ở 25°C với nồng độ ban đầu C0
của hai chất A và B như sau:
TN1. C0A = 0,012M; C0B = 6,00M
TN2. C0A = 3,00M; C0B = 0,01M.
Biến thiên nồng độ A và B theo thời gian trong 2TN trên được biểu diễn ở hình 1 và 2.
Tìm biểu thức tốc độ phản ứng và tính hằng số tốc độ k.
Ví dụ 3. Hằng số tốc độ của phản ứng bậc 1 trong pha khí C2H6 → C2H4 + H2
ở nhiệt độ T = 856 K bằng k = 4,83.10-4 s-1. Xác định % etan bị phân hủy ở nhiệt độ T = 856 K sau 120 phút.
Ví dụ 4. Cho phản ứng xảy ra trong pha khí: A → B + C. Giả sử phản ứng là bậc 1. Ở nhiệt độ không
đổi áp suất đầu P0 = 200 torr, sau 2 phút diễn ra phản ứng, áp suất chung của hệ Pt = 220 torr.
Hãy xác định hằng số tốc độ k của phản ứng và cho biết đơn vị đo của k.
Ví dụ 5. Sự phân hủy aceton xảy ra trong pha khí theo phản ứng: lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM (1) Áp
suất chung của hệ đo được theo thời gian phản ứng như sau: t, phút 0 6,5 13 19,9 P, mmHg 312 408 488 562
a) Hãy chứng minh phản ứng (1) tuân theo định luật động học bậc 1.
b) Tính chu kỳ bán hủy của phản ứng.
Chú ý: Áp dụng các qui luật động học của phản ứng bậc 1 cho một số quá trình phóng xạ: Nồng độ
(C) được thay bằng số nguyên tử (N), hằng số tốc độ (k) được thay bằng hằng số phóng xạ (λ); tốc
độ phản ứng (v) được thay bằng độ phóng xạ.
Ví dụ 6. 14C phân huỷ theo phản ứng bậc 1 có hằng số phóng xạ bằng 1,21x10-4 (năm-1). Tính thời
gian bán huỷ của một mẫu 14C.
Ví dụ 7. Cho biết đồng vị phóng xạ 14C có chu kì bán rã là 5727 năm, cho biết sự phân rã phóng xạ
tuân theo qui luật động học bậc 1. Một bộ xương người được phát hiện có hàm lượng 14C giảm chỉ
còn 1% so với thời điểm ban đầu. Hỏi người này sống cách tại thời điểm phát hiện là bao nhiêu năm?
3. Phản ứng đơn giản một chiều bậc 2: là phản ứng có tốc đô pḥ ụ thuôc bậ c 2 ṿ ào nồng đô cḥ ất
phản ứng. Ta xét 3 trường hợp:
TH1. Tham gia phản ứng có 2 cấu tử với nồng độ ban đầu bằng nhau: A + B → P
Như vậy, phương trình vi phân động học đối với phản ứng này có dạng: (3)
Từ phương trình (3) suy ra:
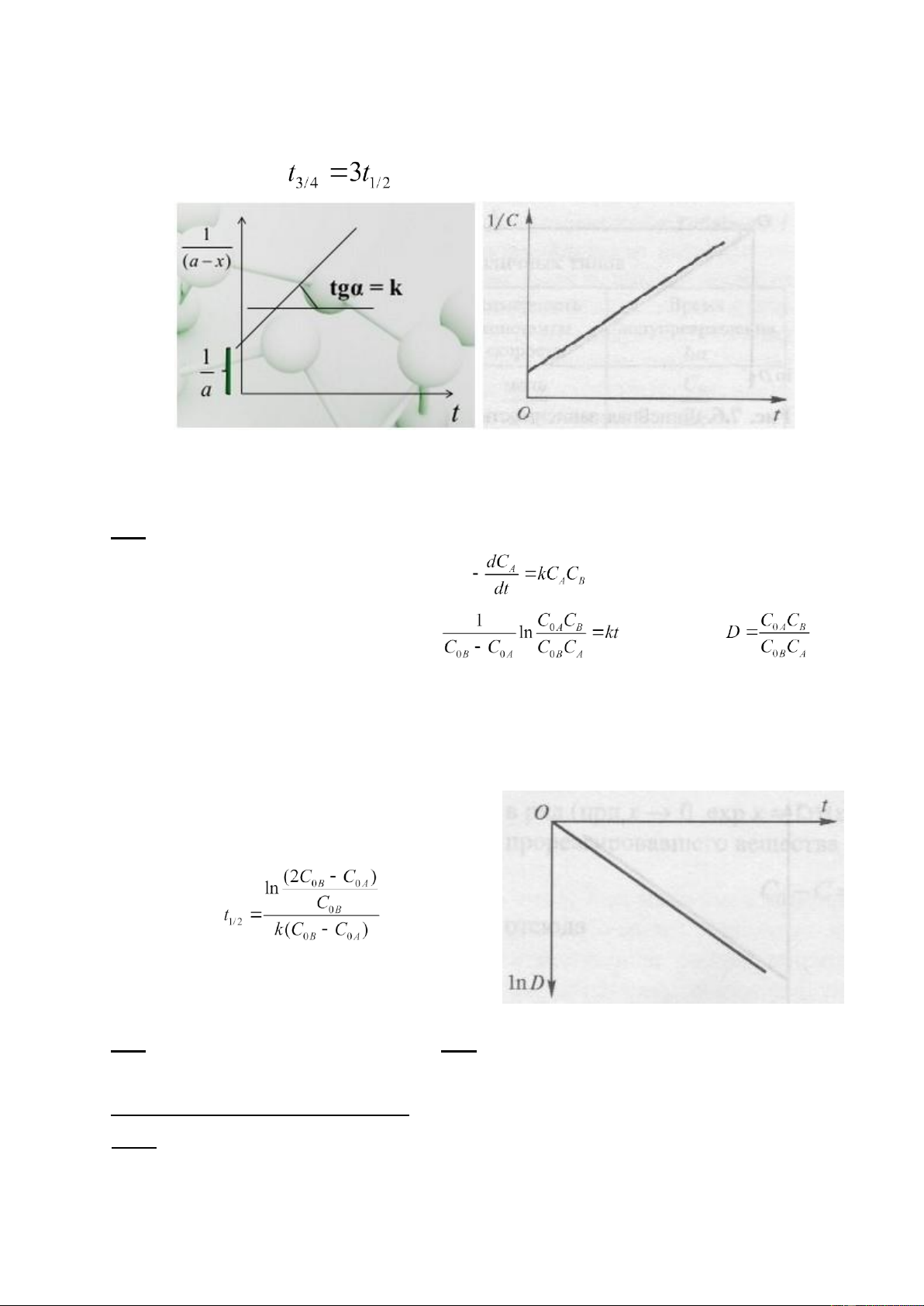
Nhận xét: a) Từ phương trình (3), đối với phản ứng bậc 2 khi nồng độ ban đầu của các chất tham gia
phản ứng bằng nhau thì nghịch đảo nồng độ phụ thuộc theo thời gian t là một đường thẳng (hình vẽ 4). b) Hằng số tốc độ , [l·mol-1·s-1]
c) Chu kỳ bán hủy (C = C /2) đối với phản ứng bậc 2 0 lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM
Khác với phản ứng một chiều bậc 1, chu kỳ bán hủy của phản ứng bậc 2 tỉ lệ nghịch với nồng độ ban
đầu của chất phản ứng. d) Hãy chứng minh:
Hình 4. Đồ thị phụ thuộc 1/C vào thời gian đối với phản ứng bậc 2
TH2. Trong phản ứng, nồng độ ban đầu của A và B khác nhau, phương trình động học có dạng:
Lấy tích phân 2 vế và đi đến kết quả sau: (4), gọi thì sự phụ
thuộc lnD vào thời gian là một đường thẳng (hình 5).
Trong quá trình phản ứng xảy ra luôn thực hiện một phương trình cân bằng vật chất: C0A – CA = C0B – CB
Kết hợp với biểu thức (4) ta có chu kỳ bán hủy của chất A (CA = C0A/2):
Hình 5. Đồ thì phụ thuộc tham số D vào thời gian
t đối với phản ứng bậc 2
TH3. Trường hợp: 2A → P sẽ tương tự như TH1: A + A → P
4. Phản ứng đơn giản môt chị ều
bâc 3̣ Có 3 trường hợp sau: lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM •
3A → P (CA = CB = CC = a), khi đó
. Trong thực tế hầu như không
găp pḥản ứng loại này. • 2A + B → P (C ), khi đó A = CB ≠ CC
Nếu nồng đô c ̣ ủa A và B là tỉ lượng (tức là a/2 = b) thì phương trình lại trở về bâc 3 ṿ à có dạng như trường hợp C . Phản ứng bâc A = CB = CC 3 ḍ
ạng này là phản ứng trong pha khí. Ví dụ: 2NO + O2 → 2NO2 2NO + Cl2 → 2NOCl 2NO + Br2 → 2NOBr
Thực nghiêm đ ̣ ã cho biết bâc c ̣ ủa phản ứng đối với NO là 2, đối với X2 (O2, Cl2, Br2) là 1. Phương
trình đông ḥ ọc dạng vi phân là: (kNO = 2kX)
Nếu nồng đô đ ̣ ầu của a và b là tỉ lượng (tức là a/b=2/1 hoăc b=a/2) tḥ ì phương trình trên trở về
trường hợp đầu CA=CB=CC và • Phản ứng bâc 3 ḍ ạng:A + B + C → P (C ≠ ≠ A CB CC) Vân ṭ ốc phản ứng
. Nếu a = b = c thì trở về trường hợp đầu.
5. Phản ứng bâc ṇ Ta xét phản ứng dạng: nA → P (1) A + B + C + … + → P. Khi C
thì phản ứng trở về trường hợp (1). A=CB=CC=..=Ci Khi đó:
k(a – x)n. Phân ly biến số và lấy tích phân ta có: hay
. Thay C v à o bi ể u th ứ c trên ta c ó : ; Khi t = 0 ; x = 0 thì
Như vây, tḥ ời gian bán hủy tỉ lê ngḥịch với an-1 hoăc ṭ1/2.an-1 = const lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM
6. Phản ứng có bâc là phân số: ½; 3/2; 5/2̣ là những phản ứng phức tạp, thường là các phản ứng
xảy ra theo cơ chế dây chuyền với sự tham gia của các gốc tự do. Ví dụ: CO + Cl2 → COCl2 có bâc
1 ṿ ới CO, bâc 3/2 ṿ ới Cl2
2O3 → 3O2 có bâc n = 3/2.̣
* Phản ứng có bâc ½̣ .
* Phản ứng bâc 3/2̣ :
Bảng 1. Các phương trình động học đối với các phản ứng bậc khác nhau Bậc
Phương trình vi Phương trình tích phân Đơn vị đo hằng Chu kỳ bán hủy (t1/2) phân số k 0 mol/l.s C 0/2k 1 s-1 Ln2/k1 2 l/mol.s 1/C0k2 3 n
7. Các phương pháp xác định bậc của phản ứng
Trong thực tế, người ta thường sử dụng các phương pháp đơn giản xác định bậc của phản ứng
dựa vào các giá trị thực nghiệm. 1)
Phương pháp thế. Nội dung của phương pháp thế là thế các giá trị thực nghiệm vào
một trong các phương trình động học của phản ứng bậc 0, 1, 2, 3, v.v. (xem bảng 1). Phương trình lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM
nào cho ta giá trị của k không đổi thì bậc của phản ứng chính là bậc của phương trình động học
đó. Phương pháp này có nhược điểm là nếu bậc của phản ứng là một phân số thì ta khó xác định
được giá trị thực của nó. 2)
Phương pháp đồ thị. Xây dựng đồ thị phụ thuộc: lnC – t; 1/C – t; 1/C2 – t. 3)
Dựa vào chu kỳ bán hủy :
(trừ phản ứng bâc 1)̣ Logarit 2 vế:
Nếu cùng môt cḥ ất nhưng lấy hai nồng đô ban đ ̣ ầu khác nhau C01, C02 thì ta có thể xác định được bâc c ̣ ủa phản ứng: 4)
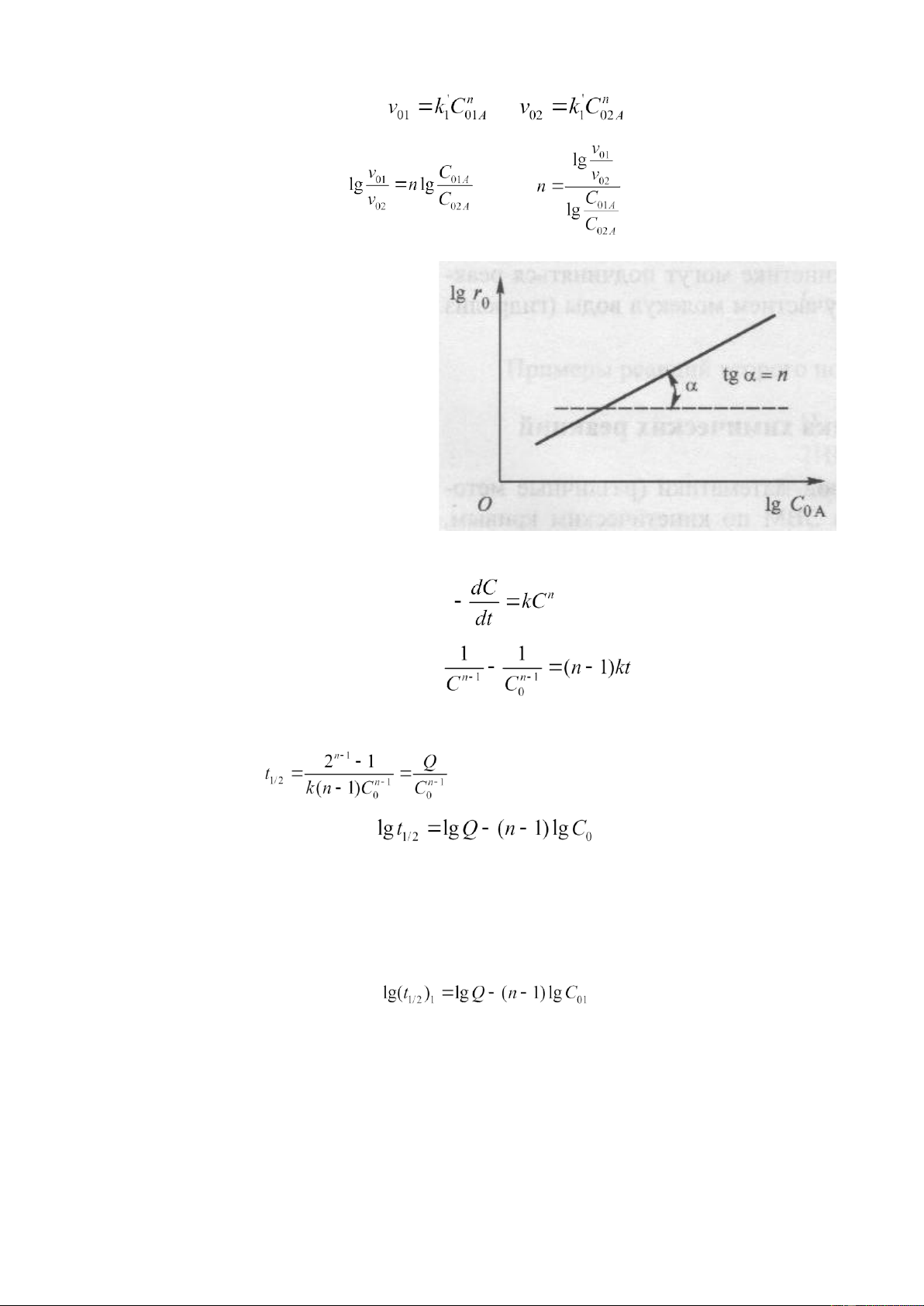
Phương pháp Van’t-Hoff (xác định bậc của phản ứng theo tốc độ ban đầu của phản ứng).
Cho phản ứng: A + B → P, theo định luật tác dụng khối lượng thì tốc độ ban đầu của phản ứng:
Để xác định tốc độ phản ứng theo chất A ta tiến hành một dãy các thí nghiệm với nồng độ ban
đầu của chất B là không đổi (C0B = const), còn nồng độ ban đầu của A thay đổi (C0A ≠ const). Như vậy: ( )
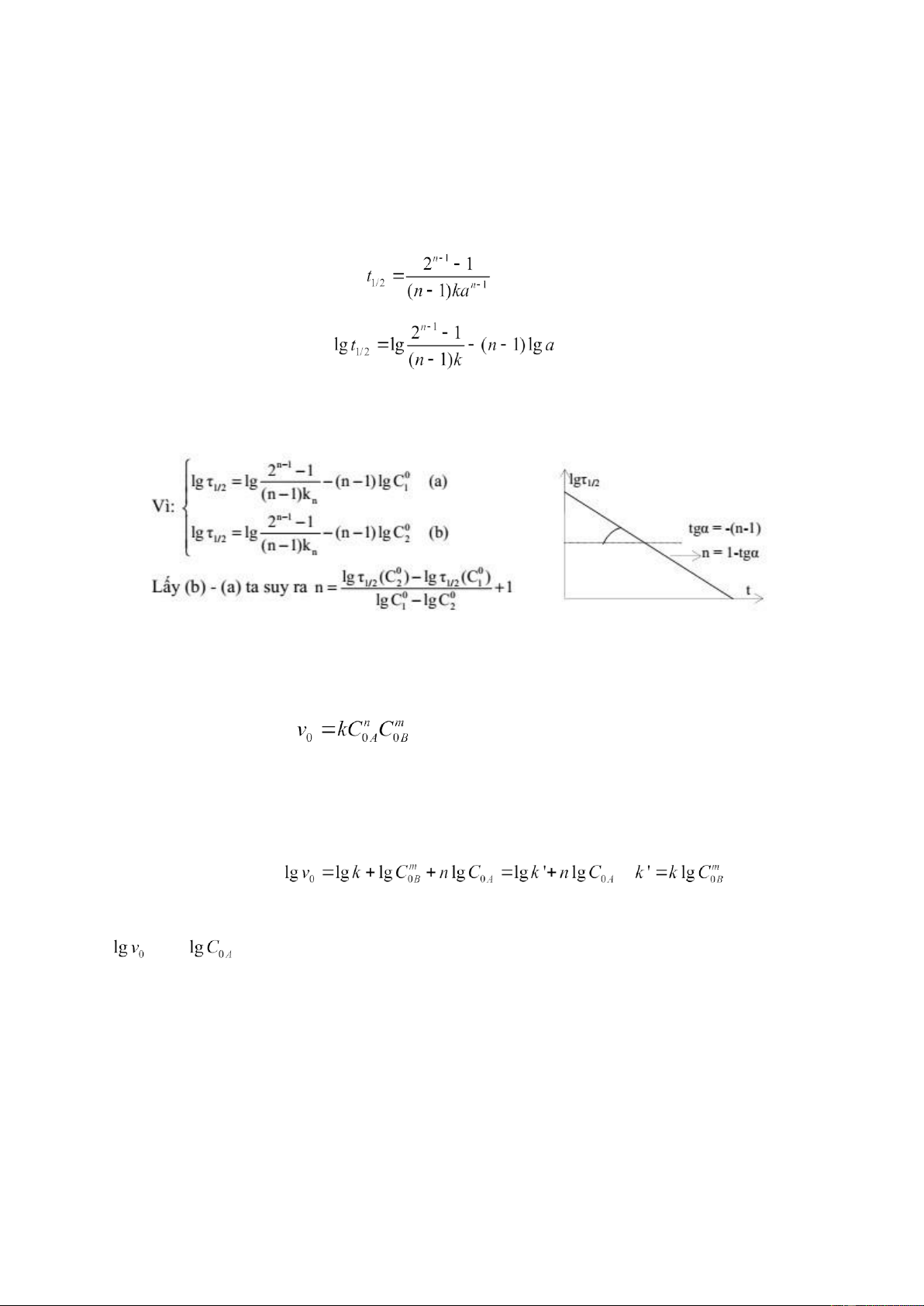
Với các giá trị C0A khác nhau ta xác định tốc độ phản ứng ban đầu và xây dựng đồ thì phụ thuộc vào
là một đường thẳng. tg của góc lệch đường thẳng bằng bậc của phản ứng theo chất
A (tg α = n) (hình 6). Làm thí nghiệm tương tự ta xác định được bậc m của phản ứng theo chất B khi
C0A = const, C0B ≠ const. Bậc toàn phần của phản ứng: (n + m).
Bậc của phản ứng cũng có thể xác định bằng phương pháp tính toán khi biết tốc độ ban đầu của
một chất nào đó ở 2 nồng độ ban đầu khác nhau. lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM và , suy ra
Ta lấy lg tỉ lệ của 2 tốc độ này:
Hình 6. Phương pháp đồ thị xác định bậc
phản ứng theo các tốc độ ban đầu (C0B = const; C0A ≠ const)
4) Phương pháp xác định bậc của phản
ứng dựa vào chu kỳ bán hủy. Phương pháp
này dựa vào sự phụ thuộc chu kỳ bán hủy
vào nồng độ ban đầu của chất phản ứng.
Đối với phản ứng bậc n phương trình động học có dạng. ,
lấy tích phân 2 vế ta đi đến kết quả:
Như vậy, chu kỳ bán hủy khi C = C0/2:
(*) (trong đó Q là hằng số đối với phản ứng).
Tg của góc lệch xác định bậc n của phản ứng theo chất ta chọn. Trong trường hợp đơn giản bậc của
phản ứng theo một chất nào đó có thể xác định dựa vào chu kỳ bán hủy ở 2 nồng độ ban đầu khác nhau. Khi đó: lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM ; suy ra ;
Phương trình (*) không sử dụng cho phản ứng bậc 1 (n = 1). Bởi vì đối với phản ứng bậc 1:
không phụ thuộc vào nồng độ ban đầu của chất phản ứng.
MỘT SỐ BÀI TẬP ÁP DỤNG CƠ BẢN
Bài tập 1. Đối với phản ứng thủy phân metyl axetat trong môi trường kiềm
CH3COOCH3 + NaOH → CH3COONa + CH3OH
có n = 2 và đối với nồng độ ban đầu của các chất đều bằng nhau và bằng C0 = 10-2 M, sau 10 phút có
20% lượng este phản ứng.
a) Hãy cho biết thời gian cần thiết để 50% lượng este chuyển hóa thành sản phẩm;
b) Hãy tính nồng độ ancol metylic thu được sau 30 phút.
Bài tập 2. Cho phản ứng đơn giản A + B → D + F với nồng độ ban đầu của các chất C 0A = C0B =
0,6 (mol/l). Sau 20 diễn ra phản ứng nồng độ chất A giảm đến giá trị C1A = 0,4 (mol/l). Hãy xác định
nồng độ chất A sau thời gian 60 kể từ lúc xãy ra phản ứng.
Bài tập 3. Hằng số tốc độ phản ứng thủy phân etyl axetat trong môi trường kiềm tuân theo định luật
động học bậc 2 ở T = 10°C là k = 2,38 (nồng độ là mol/l; thời gian tính bằng phút). Tính thời gian để
80% lượng este bị thủy phân nếu ở 10°C người ta trộn 1 lít dung dịch este 0,004M với 1 lít dung dịch
NaOH 0,004 M. Thời gian phản ứng thay đổi thể nào nếu dung dịch được pha loãng 10 lần.
Bài tập 4. Phản ứng chuyển hóa chất A thành sản phẩm diễn ra theo phương trình phản ứng sau: 3A → 2B + D
Biết phản ứng tuân theo định luật động học bậc 2 với hằng số tốc độ k2 = 9,3.10-4 (l/mol.s). Nồng độ
ban đầu của chất A là C0A = 0,1 mol/l. Tính thời gian để 30% lượng chất A chuyển hóa thành sản phẩm?
Bài tập 5. Đối với phản ứng hóa học giữa trietylamin [(C I) xảy ra trong 2H5)3N] và metyl iodua (CH3
dung dịch với nồng độ các chất ban đầu đều bằng nhau (C0 = 0,05M), người ta thu được các giá trị thực nghiệm sau: t, s 325 1295 1550 1975 lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM (C – 0 C)/C0, % 31,5 64,9 68,8 73,7
a) Hãy chứng minh đây là phản ứng bậc 2;
b) Hãy tính hằng số tốc độ của phản ứng này và cho biết đơn vị đo.
Bài tập 6. Vào năm 1824 nhà hóa học Đức Friedrich Wohler đã lật đổ thuyết “lực sống”. Thuyết này
cho rằng con người không thể tổng hợp được chất hữu cơ từ chất vô cơ mà không có sự trợ giúp của
“Thần”, nhưng Friedrich Wohler đã làm được. Ông đã điều chế ure từ amonixianat bằng
cách nhiệt phân ở 71°C: NH OCN → H 4 2NCONH2
-Hơn 150 năm sau, các nhà khoa học đã nghiên cứu phản ứng một cách cẩn thận hơn bằng các
phương pháp động học. Thí nghiệm bắt đầu từ lúc hòa tan 30,0g monixianat trong 1,00 lít nước.
Khối lượng ure thu được theo thời gian được miêu tả ở bảng dưới đây: t, (ph) 0 20 50 65 150 mure, (g) 0 9,40 15,9 17,9 23,2
a/ Tính nồng độ của amonixianat còn lại ở từng thời điểm trên.
b/ Chứng minh phản ứng tuân theo định luật động học bậc 2 và tính hằng số tốc độ k. c/
Khối lượng của amonixianat còn lại là bao nhiêu sau 30 phút?
Bài tập 7 . Một trong các phản ứng gây ra sự phá hủy tầng ozon của khí quyển là: NO + O3 → NO2 + O2
Trong 3 thí nghiệm, tốc độ phản ứng phụ thuộc vào nồng độ của các chất phản ứng như sau: Thí nghiệm [NO], mol/l [O3], mol/l Tốc độ v, mol/l.s-1 1 0,02 0,02 7,1.10-5 2 0,04 0,02 2,8.10-4 3 0,02 0,04 1,4.10-4
Xác định các bậc riêng phần (a, b) của phản ứng và hằng số tốc độ trung bình k của phản ứng v = k[NO]a . [O3]b
MỘT SỐ BÀI TẬP NÂNG CAO
Bài tập 1. Cho các phản ứng có bậc khác nhau diễn ra với nồng độ ban đầu của các chất là như
nhau (C0 = 1 M). Gọi t1/2 là thời gian để 50 % lượng chất ban đầu chuyển hoá thành sản phẩm.
Tính thời gian (thông qua t ) để tất cả lượng chất ban đầu chuyển hoá thành sản phẩm: 1/2 lOMoAR cPSD| 22014077
Bài giảng Đông hoá học và xúc ṭ ác Nguyễn Anh Tiến_Khoa Hoá học_ĐHSP Tp. HCM
a) Đối với phản ứng bậc 0;
b) Đối với phản ứng bậc 1;
c) Đối với phản ứng bậc 2;
d) Rút ra kết luận về tốc độ phản ứng (nhanh hay chậm) khi bậc của phản ứng tăng.
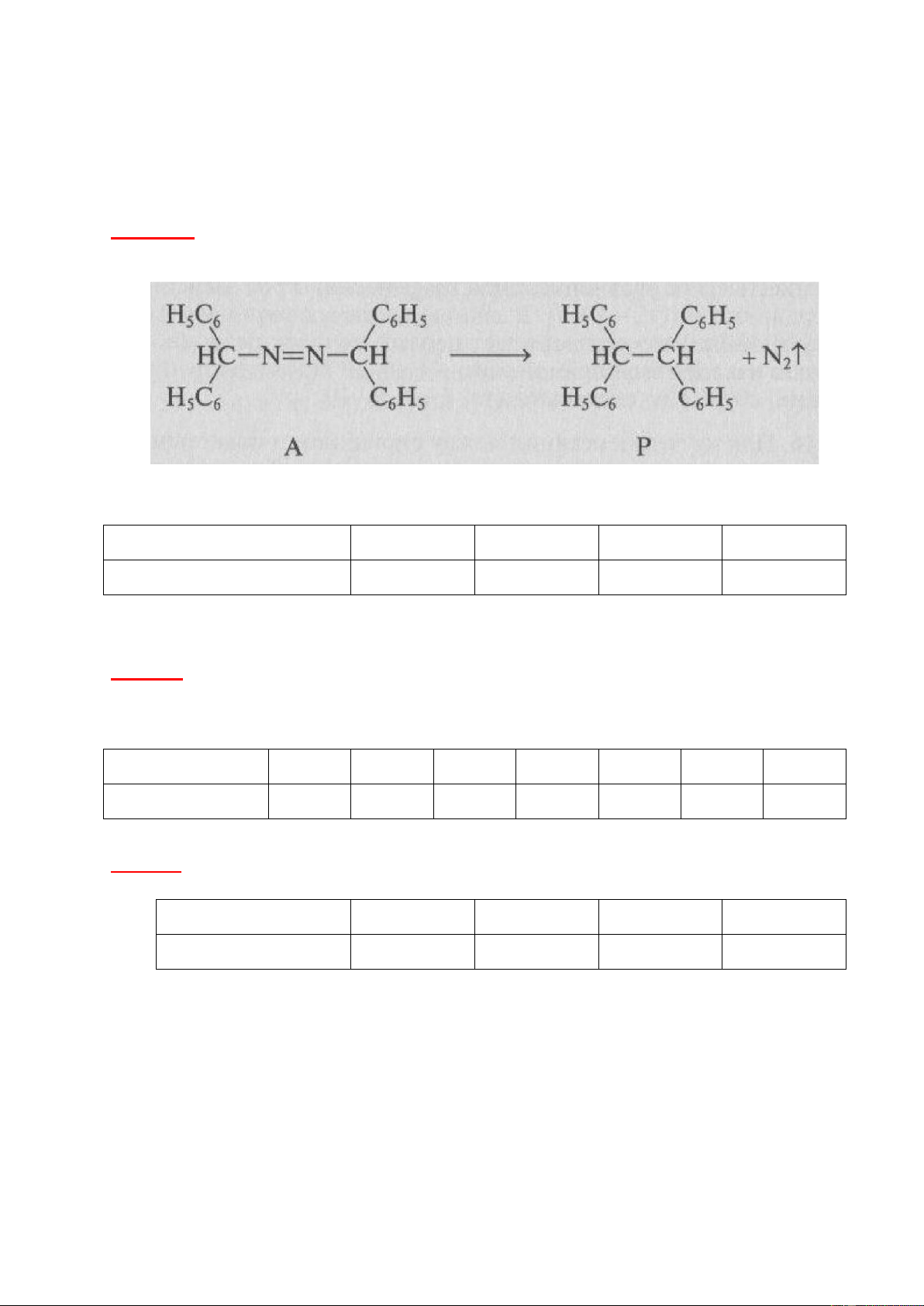
Bài tập 2. Azodiphenyl metan trong dung dịch toluen phân hủy để giải phóng khí nitơ theo phương trình phản ứng sau:
Nghiên cứu động học của phản ứng này ở 54°C (1 lít dung dịch chứa 0,01 mol chất A) người ta thu
được thể tích khí nitơ thoát ra ở áp suất khí quyển (P = 1 at) theo bảng sau: Thời gian, phút 20 34 100 200 Thể tích, cm3 30,6 49 121,8 188,2
Hãy chứng minh đây là phản ứng bậc 1, xác định hằng số tốc độ k của phản ứng và cho biết đơn vị đo của k.
Bài tập 3. Nghiên cứu phản ứng giữa pirimidin và etyl iodua với nồng độ ban đầu của các chất đều
bằng nhau và bằng C0 = 0,1 M người ta quan sát sự thay đôi được nồng độ ion I- theo thời gian như sau: C I → C 5H5N + C2H5 7H10N+ + I- t, s 235 465 720 1040 1440 1920 2370 [I-].103, M 15 26 35 44 52 59 64
Hãy xác định bậc của phản ứng và giá trị hằng số tốc độ k.
Bài tập 4. Tìm bậc của phản ứng nhiệt phân N O ở nhiệt độ 1030K trên cơ sở các giá trị thực nghiệm 2 sau: P0, torr 86,5 164,0 290,0 360,0 t1/2, s 634 393 255 212

