






Preview text:
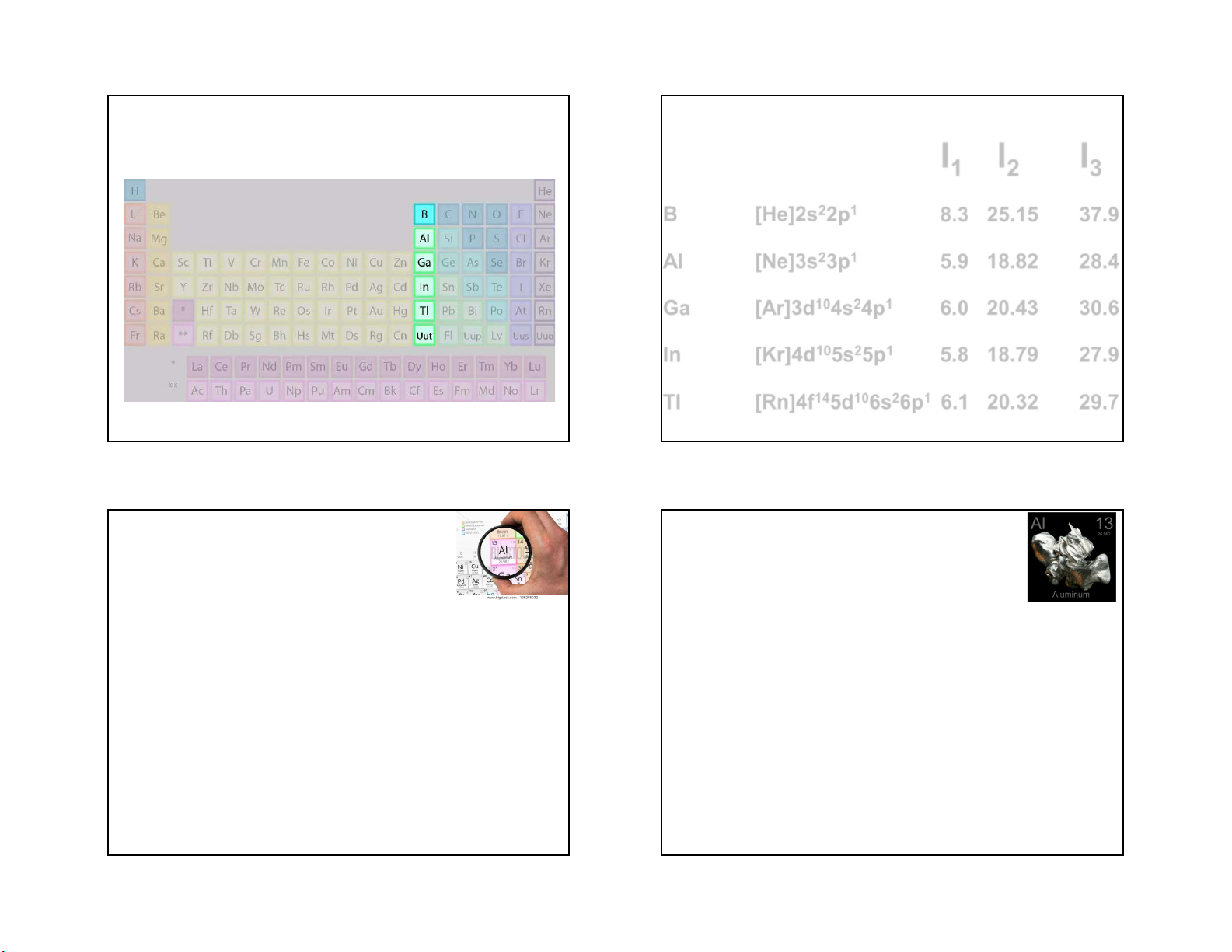
Chương IX Các nguyên tố nhóm IIIA I1 I2 I3 B [He]2s22p1 8.3 25.15 37.9 Al [Ne]3s23p1 5.9 18.82 28.4 Ga [Ar]3d104s24p1 6.0 20.43 30.6 In [Kr]4d105s25p1 5.8 18.79 27.9 Tl [Rn]4f145d106s26p1 6.1 20.32 29.7 1 1 2 Nhôm
Cấu tạo và tính chất lý học Nhôm
Cấu tạo và tính chất lý học
- Có màu trắng ánh bạc, mềm, dễ dát mỏng và kéo
-Chu kỳ III, cấu trúc vỏ electron lớp ngoài cùng:
thành sợi, dẫn nhiệt, dẫn điện tốt, tạo được hợp kim
3s23p1, là kim loại hoạt động. với nhiều đơn chất.
-Nhôm tạo được nhiều hợp chất với số phối trí lớn. Vì sao? 3 4 3 4 1 Tính chất hoá học
- Là chất khử mạnh, ở nhiệt độ cao khử được nhiều oxit kim loại:
-Nhôm là kim loại hoạt động. Vì sao đồ nhôm bền? 2Al + Cr2O3 = Al2O3 + 2Cr 2Al + Fe2O3 = Al2O3 + 2Fe
ở nhiệt độ thường nó phản ứng với oxi: 2Al + 1,5O 2
Al2O3 tạo ra một lớp oxit nhôm rất mỏng trên bề mặt, làm cho
- Phản ứng với các phi kim: ở nhiệt độ thường nhôm
nhôm trở nên kém hoạt động.
tương tác với Clo, Brôm, khi đun nóng phản ứng với I2,
với S và C xảy ra ở nhiệt độ khá cao và không tương
- Nhiệt độ cao: cháy trong không khí tạo thành oxit tác với hydro.
và phản ứng toả nhiều nhiệt 5 6 5 6 -o 3+
-Al dễ dàng tan trong kiềm: Al
/Al= -1,66V rất âm, nên Al dễ dàng đẩy được
hydro ra khỏi các axit và nước.
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2
-> Nhưng trên thực tế: Al + 3H2O = Al(OH)3 + 3H2, lớp
hydroxit tạo ra trên bề mặt ngăn cản phản ứng tiếp tục.
-Al dễ dàng phản ứng với các axit như H2SO4, HCl :
2Al + 6H3O+ + 6H2O = 2[Al(H2O)6]3+ + 3H2
Lịch sử và điều chế nhôm
- Al bị thụ động và không phản ứng với axit HNO3 đặc và nguội. 7 8 7 8 2
1808 Sir Humphry Davy (Britain) established the existence of aluminium and
1886 Two unknown young scientists, Paul Louis Toussaint Héroult named it.
(France) and Charles Martin Hall (USA), working separately and
1821 P. Berthier (France) discovers a hard, reddish, clay-like material
unaware of each other's work, simultaneously invent a new electrolytic
containing 52 per cent aluminium oxide near the vil age of Les Baux in southern
process, the Hal -Héroult process, which is the basis for al aluminium
France. He cal ed it bauxite, the most common ore of aluminium.
production today. They discovered that if they dissolved aluminium
oxide (alumina) in a bath of molten cryolite and passed a powerful
1825 Hans Christian Oersted (Denmark) produces minute quantities of
electric current through it, then molten aluminium would be deposited at
aluminium metal by using dilute potassium amalgam to react with anhydrous the bottom of the bath.
aluminium chloride, and distilling the resulting mercury away to leave a residue of slightly impure aluminium. Smelting Technology
1827 Friedrich Wöhler (Germany) describes a process for producing
1888 The first aluminium companies founded in France, Switzerland
aluminium as a powder by reacting potassium with anhydrous aluminium and the USA chloride.
1889 Karl Josef Bayer (Austria), son of the founder of the Bayer
1845 Wöhler establishes the specific gravity (density) of aluminium, and one
chemical company, invented the Bayer Process for the large scale
of its unique properties - lightness.
production of alumina from bauxite.
1854 Henri Sainte-Claire Devil e (France) improves Wöhler's method to
1900 Annual output 8 thousand tonnes.
create the first commercial process. The metal's price, initial y higher than that
1913 Annual output 65 thousand tonnes.
of gold and platinum, drops by 90% over the fol owing 10 years. The price is still
1920 Annual output 128 thousand tonnes.
high enough to inhibit its widespread adoption by industry.
1938 Annual output 537 thousand tonnes.
1855 A bar of aluminium, the new precious metal, is exhibited at the Paris
1946 Annual output 681 thousand tonnes. Exhibition. 1885
1999 Annual output 24 mil ion tonnes.
Hamilton Y. Cassner (USA) improves on Devil e's process. Annual output 15 tonnes! 9 10
The Bayer process is the principal industrial means of producing
alumina, itself important in the Hal -Héroult process for producing aluminum.
Bauxite, the most important ore of aluminum, contains only 40-
60% alumina, Al2O3, the rest being a mixture of silica, various iron
oxides, and titanium dioxide. The alumina must be purified before
it can be refined to aluminum metal. In the Bayer process, bauxite
is washed with a hot solution of sodium hydroxide, NaOH, at
250°C. This converts the alumina to aluminium hydroxide,
Al(OH)3, which dissolves in the hydroxide solution according to the chemical equation
Al2O3 + 2 OH- + 3 H2O → 2 [Al(OH)4]-
The other components of bauxite do not dissolve and can be
filtered out as solid impurities. Next, the hydroxide solution is
cooled, and the aluminium hydroxide dissolved in it precipitates
out as a white, fluffy solid. When then heated to 1050°C, the
aluminium hydroxide decomposes to alumina, giving off water vapor in the process: 2 Al(OH)3 → Al2O3 + 3 H2O 11 12 3 Hợp chất của nhôm Hydroxit nhôm Oxit nhôm
Có nhiều dạng thù hình, trong đó hai dạng bền nhất là: và
Là kết tủa keo có tính lưỡng tính Al(OH) -Al 3 + 3NaOH = Na3[Al(OH)6] + 3H2O
2O3-, tương đối bền, cấu trúc kiểu lập phương. Không tan
trong nước, trơ về mặt hoá học, ở t thường không tác dụng Al(OH)3 + 3HCl = AlCl3 + 3H2O
với axit và kiềm, ở t cao (khoảng 1000oC) nó phản ứng được
với hydroxit, cacbonat, hydrosunfat và disunfat của kim loại kiềm: Al Các muối nhôm
2O3 + Na2CO3 = 2NaAlO2 + CO2. Tồn tại trong thiên
nhiên dưới dạng đá corundum
AlCl3: tinh thể màu trắng ngậm 6 phân tử H2O, thăng -Al
hoa ở 179,7oC, nóng chảy ở 192,6oC, thể lỏng gồm
2O3- kém bền hơn, thu được khi nhiệt phân Al(OH)3 ở 500-
600oC, ở t=1000oC nó chuyển sang dạng thù hình Al các phân tử dime Al 2O3-.
2Cl6. Khi hoà tan trong nước sẽ Al
xảy ra phản ứng thuỷ phân tạo hydroxit nhôm
2O3- có bề mặt riêng lớn, thường được sử dụng làm chất
hấp phụ, chất xúc tác hay chất mang xúc tác. 13 14 13 14
Al2(SO4)3: thường tồn tại dưới dạng phèn nhôm
KAl(SO4)2.12H2O và Al2(SO4)3.18H2O, tinh thể không
màu, dễ tan trong nước và xảy ra sự thuỷ phân Al3+
Một số muối của nhôm như Al2(CO3)2, Al2S3 không
thể điều chế được vì tạo ra lại bị thuỷ phân với mức độ khá mạnh.
Al2(CO3)3 + 3H2O = 2Al(OH)3 + 3CO2 15 15 16 4 Nguyên tố B Tính chất hoá học
Cấu tạo và tính chất lý học
- Ở t thường B rất trơ về phương diện hoá học, chỉ tác dụng với F: 2B + 3F2 = 2BF3
- Ở nhiệt độ cao B hoạt động hơn:
- Cấu trúc vỏ electron lớp ngoài: 2s22p1, ở trạng thái + Tác dụng với O
kích thích có 3e độc thân tạo liên kết cộng hoá trị với 2 ở 700oC: các nguyên tố khác. 4B + 3O 2 = 2B2O3 Ho298 = -1263,6 KJ.mol-1
+ Ở t cao, tác dụng được với P, S, N: 120 C 0 o
- B là tinh thể không màu, nhưng thường có màu đen 2B + N 2 2BN
do lẫn tạp chất, rất rắn, khó nóng chảy, có tính bán dẫn,
- Với axit: B chỉ tác dụng được với các axit HNO3 và H2SO4 là chất nghịch từ.
đặc sản phẩm tạo thành là H3BO3:
B + 3H2SO4(đặc) = 2H3BO3 + 3SO2 17 18 B + 3HNO3 = H3BO3 + 3NO2 17 18 Hợp chất của B với H
- Công thức đơn giản nhất: BH Hợp chất của B với O
3, nhưng thực tế công thức
phân tử rất phức tạp: B - B
nHn+4 và BnHn+6. Các boran thông
2O3: Chất rắn, không màu, tnc= 450oC và ts= dụng là: B2H6, B4H10 (khí), B5H9, B6H10(lỏng),
2250oC, hút ẩm mạnh và tan trong nước tạo thành
B10H14(rắn)…Boran loại hợp chất thiếu e. axit boric:
B2O3 + 3H2O = 2H3BO3 - axit orthoboric H
-Axit boric là đơn axit yếu: H H - + H+; K B B H 3BO3 + HOH ⇆ B(OH)4 a= 5,6.10-10 H H
- Muối của axit boric thường dùng là borac H
Na2B4O7.10H2O, là chất rắn tinh thể, không màu, tan trong nước nóng 19 20 19 20 5 Gallium 21 22 21 22 23 24 23 24 6 Chương X Be, Mg, Ca, Sr, Ba và Ra. Các nguyên tố nhóm IIA 25 26 25 26 Đơn chất 2. Tính chất hoá học: 1.Tính chất lý học:
- Phản ứng với oxi: Ở nhiệt độ thường Be và
- Có màu trắng bạc hoặc xám nhạt, tuy nhiên trong
Mg bị bao phủ một lớp oxit rất mỏng và bền
không khí chỉ có Be và Mg giữ được ánh kim còn
ngăn cản chúng tiếp xúc với oxi, còn các kim
các kim loại khác mất ánh kim.
loại khác nhanh chóng bị oxi hoá. Ở nhiệt độ - Có t
cao trong không khí tất cả các kim loại kiềm thổ
nc, ts và tỷ khối cao hơn so với kim loại kiềm,
do liên kết kim loại trong kim loại kiềm thổ mạnh hơn
cháy tạo nên oxit MO, nitrua M3N2, đối với Ba
trong kim loại kiềm và do số e liên kết trong kim loại có tạo thêm một ít BaO2
kiềm thổ gấp đôi kim loại kiềm.
- Phản ứng với các halogen: ngay ở nhiệt độ
- Dễ tạo hợp kim với các kim loại khác, ví dụ các
thường, khi đun nóng thì phản ứng với lưu
hợp kim của magiê nhẹ và bền, được sử dụng trong
huỳnh, nitơ và một số phi kim khác
chế tạo tên lửa, công nghiệp máy bay, ôtô,… 27 28 27 28 7
- Phản ứng với nước: Vì có thế khử rất âm nên dễ
dàng tương tác với nước và axit không có tính oxi - Phản ứng điều chế:
hoá giải phóng hydro, nhưng Be không tác dụng với đpnc
nước vì có lớp oxit bảo vệ. Mg không tan trong nước MCl 2 M+ Cl2
lạnh, tan chậm trong nước nóng, do tạo thành lớp hydroxit ít tan: Mg + 2H Hợp chất: 2O = Mg(OH)2 + H2 Nếu thêm dung dịch NH * Các oxit MO:
4Cl lớp hydroxit này bị tan ra và Mg tiếp
tục phản ứng với nước: Mg(OH)2 + 2NH4Cl = MgCl2 +
Là chất rắn, màu trắng, khó nóng chảy và rất bền nhiệt. 2NH3 + 2H2O
BeO không tan trong nước, MgO phản ứng một phần với nước,
Ca, Sr, Ba đều phản ứng được với nước lạnh tạo
nhưng rất chậm, còn các oxit còn lại phản ứng mãnh liệt với
nước và phản ứng toả nhiều nhiệt, thành hydroxit tương ứng Ví dụ: CaO + H Ho -
Phản ứng với kiềm: Chỉ có Be khả năng hoà tan 2O = Ca(OH)2 298 = -65 KJ trong dung dịch kiềm: Be + 2NaOH + H 29 2O = Na2[Be(OH)4] + H2 30 29 30 * Các hydroxit M(OH)
- Các hydroxit có khả năng hấp thụ khí CO2 tạo 2:
thành cácbonat ít tan, dư CO - Be(OH) 2 tạo thành 2
và Mg(OH)2 rất ít tan trong nước, hydrocacbonat
Ca(OH)2 tương đối ít tan còn các hydroxit còn lại
tan nhiều trong nước và độ tan tăng dần từ trên Ca(OH)2 + CO2 = CaCO3 + H2O xuống trong nhóm.
CaCO3 + CO2 + H2O ⇆ Ca(HCO3)2
- Be(OH)2 có tính lưỡng tính, còn các hydroxit khác
có tính bazơ và tính bazơ tăng dần từ trên xuống
Khi đun nóng thì cân bằng dịch chuyển theo trong nhóm:
chiều nghịch tạo lại kết tủa CaCO3 Be(OH)
- Ứng dụng: CaO và Ca(OH)2 sử dụng nhiều 2 + 2NaOH = Na2[Be(OH)4]
trong xây dựng, điều chế Na2CO3, NaOH, đất đèn M(OH)2 + 2HCl = MCl2 + 2H2O CaC2, CaOCl2, xi măng. 31 32 31 32 8 -Điều chế BaO * Peoxit MO
2: Sục không khí qua BaO ở t= 2: 600oC:
- Khả năng tạo peoxit tăng dần từ trên xuống
theo chiều tăng kích thước nguyên tử. Be không
BaO + 0,5O2 = BaO2 ở t>600oC BaO2 sẽ bị
tạo được peoxit, Mg chỉ tạo được peoxit ở dạng
phân huỷ theo phản ứng nghịch.
hydroxit có lẫn peoxit MgO2, còn Ca, Sr, Ba tạo
được các peoxit MO2 là chất bột có màu trắng
- Điều chế SrO2: Tương tự BaO2 song cần áp và khó tan trong nước suất cao 125 atm
- Các peoxit có khả năng tan trong axit loãng giải - Điều chế CaO2: phóng H Ca(OH) 2O2: 2 + H2O2 + 6H2O = CaO2.8H2O 100-130oC BaO2 + H2SO4 = H2O2 + BaSO4 CaO2.8H2O CaO2 + 8H2O 33 34 33 34 * Các muối halogenua MX2:
- Các kim loại nhóm IIA đều tạo được các muối 260oC CaCl .6HO o 31 45,3oC 176oC trongHCl C C aCl .4H O C aCl .2H O C aCl .H O C aCl halogenua MX 2 2 2 2 2 2 2 2 2
2: Là chất rắn trắng, dễ tan trong nước, trừ các florua.
- Đa số đều hút ẩm mạnh tạo thành các tinh thể BaCl .2HO 6 0 o 65 C BaCl .HO o 121 C BaCl 2 2 2 2 2
không màu, ngậm nước: CaCl 2.6H2O, dễ hoà
tan trong nước, khi tăng nhiệt độ thì chúng mất
dần các phân tử nước, BaCl2.2H2O, bền trong
không khí, khi đun nóng nó mất nước. 35 36 35 36 9 Nước cứng
Có hai loại độ cứng: độ cứng tạm thời và độ cứng vĩnh * Các muối sunfat MSO4:
cửu, tổng của hai loại độ cứng này là độ cứng của nước.
- BeSO4 và MgSO4 tan rất nhiều trong nước, còn CaSO
-Độ cứng tạm thời là chỉ lượng muối hydrocacbonat như
4, SrSO4 ít tan, BaSO4 rất ít tan.
Ca(HCO3)2 và Mg(HCO3)2. Độ cứng tạm thời bị mất khi đun -BaSO
sôi nước, vì khi đó hydrocacbonat bị nhiệt phân tạo thành
4 rất ít tan trong axit và bền ở nhiệt độ cao.
cacbonat, lắng xuống thành cặn. Ca(HCO 3)2 CaCO3 + CO2 + H2O
-CaSO4.2H2O còn gọi là thạch cao, đây là chất
Mg(HCO3)2 MgCO3 + CO2 + H2O
rắn trắng ít tan trong nước, ở nhiệt độ cao nó
mất dần nước kết tinh:
- Độ cứng vĩnh cửu là chỉ lượng muối không bị kết tủa khi
đun sôi nước đó là muối sunfat, clorua của Ca và Mg. CaSO .2H O o 150 C 200o C 1100o C CaSO .0,5H O CaSO CaO SO
- Độ cứng của nước được tính bằng số milimol đlg của 4 2 4 2 4 3
các kim loại Ca và Mg trong một lít nước. 37 38 37 38
- Các phương pháp làm mềm nước: Tạo kết tủa hoặc trao đổi ion
-Nước rất mềm có độ cứng < 1,5 mđlg/l, nước mềm
có độ cứng khoảng 1,5- 4 mđlg/l, nước trung bình -
+ Để phá nước cứng tạm thời thường dùng vôi tôi
4-8 mđlg/l, nước cứng- 8- 12 và nước rất cứng > 12 Ca(OH)2: mđlg/l
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
-Nước cứng ảnh hưởng đến một số ngành
Mg(HCO3)2 + Ca(OH)2 = 2MgCO3 + 2H2O công nghiệp.
+ Để phá nước cứng vĩnh cửu thêm vào dung dịch Na
Ví dụ: Quá trình nhuộm và nồi hơi. Cặn tạo
2CO3 để tách kết tủa của Ca và Mg dưới dạng cacbonat
thành trong nồi hơi làm cho nồi hơi kém dẫn +
Một phương pháp được sử dụng rộng rãi là
nhiệt, dẫn đến tiêu tốn nhiều nhiên liệu hoặc
phương pháp trao đổi ion: cho nước đi qua lớp
nước cứng tạo kết tủa với xà phòng, kết tủa
catinonit, các catinonit (đó là zeolit có thành phần này làm bẩn quần áo.
Na2Al2Si2O8) sẽ giữ các ion Ca2+ và Mg2+ và nhả 39 40
các cation Na+ đi vào nước 39 40 10 Chương XI Các nguyên tố nhóm IA 41 42 41 42 Đơn chất 1. Tính chất lý học: 2. Tính chất hoá học:
- Các kim loại kiềm rất hoạt động hoá học, thể hiện • Mềm
tính khử mạnh và tính khử tăng đều đặn từ Li đến Cs •Tỉ trọng thấp
• Nhiệt độ nóng chảy và nhiệt độ sôi thấp
• Khả năng dẫn điện, dẫn nhiệt tốt (kém xa Ag) • Có ánh kim 43 44 43 44 11
- Phản ứng với N2 và C: chỉ có Li tác dụng trực tiếp với
N2 và C để tạo nên các hợp chất Li3N và Li2C
-Phản ứng với H2O: Có thế điện cực rất âm nên phản
ứng mãnh liệt với H2O giải phóng H2: 2M + 2HOH = MOH + H2 45 46 45 46
Occurrence, Preparation, Use, & Reactions of the Alkali Metals
Occurrence, Preparation, Use, & Reactions of the Alkali Metals
Liquid sodium is used as a heat transfer medium in some
types of nuclear reactors and in automobile engine valves,
Na và K chủ yếu được điều chế từ nước biển
and its vapor is used in lamps for outdoor lighting. (chứa NaCl và KCl).
Potassium is used in making KO2, used as an oxygen
source for miner’s “self-rescuers” and similar devices:
Li được điều chế chủ yếu từ khoáng spodumen, LiAl(SiO3)2.
Phương pháp điều chế chính là điện phân ( vì
là các chất khử mạnh). Na O 2KO 2CO Na CO K CO 2O 2 2 2 2 2 3 2 3 2
Lithium is used in lightweight batteries of the type
found in heart pacemakers, cellular telephones,
digital cameras, and portable computers. 47 48 12
Li2O phản ứng chậm với H2O, còn các M2O khác phản Hợp chất:
ứng rất mạnh với H2O và toả nhiều nhiệt * Các oxit M M 2O: 2O + HOH = 2MOH Li * Các hydroxit M(OH):
2O được điều chế bằng tác dụng trực tiếp
các đơn chất, còn các oxit khác M
- Là các chất rắn, màu trắng, nóng chảy ở t tương đối 2O chỉ
được tạo thành bằng phương pháp gián
thấp tạo nên chất lỏng linh động và trong suốt. Hút ẩm
mạnh trong không khí, hấp thụ khí CO tiếp: 2 tạo thành
cacbonat, tan trong rượu và nước. 2Li + 0,5O2 = Li2O
- Các hydroxit là các kiềm mạnh tương tác dễ dàng với Na
các axit và oxit axit tạo thành muối, phản ứng với một 2O2 + 2Na = 2Na2O KO
số kim loại lưỡng tính như Al, Zn, Sn và một số phi kim 2 + 3K = 2K2O như Si, halogen. 49 50 49 50 * Các peoxit và supeoxit:
- Trong các hydroxit chỉ có NaOH được sử
- Trừ Li tất cả các kim loại khác đều tạo được peoxit và supeoxit.
dụng nhiều trong các ngành công nghiệp: công
-Các peoxit và supeoxit khá bền nhiệt và không phân
nghiệp xà phòng, giấy, dệt,… huỷ khi nóng chảy.
- NaOH được điều chế bằng phương pháp điện
-Tất cả đều hút ẩm mạnh và chảy rữa khi để trong
phân muối ăn có màng ngăn hoặc được điều
không khí. Chúng phản ứng mạnh với nước giải
chế từ phản ứng trao đổi: phóng khí O2 Na2O2 + 2HOH = H2O2 + 2NaOH
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH 2H2O2 = 2H2O + O2
(Trong phòng thí nghiệm người ta dùng phản ứng này để điều chế O2) 51 52 51 52 13
- Phản ứng với CO2 giải phóng khí O2: 2Na2O2 + 2CO2 = 2Na2CO3 + O2 2KO2 + 2CO2 = 2K2CO3 + 3O2
- Trong số các peoxit và supeoxit thì Na2O2 có ứng
dụng nhiều nhất. Na2O2 được điều chế bằng đun nóng
Na nóng chảy trong dòng không khí đã được hút sạch CO2 và hơi ẩm: 2Na + O2 = Na2O2 Na2O2 + O2 = 2NaO2 (lẫn)
- Na2O2 là chất oxi hoá mạnh, nhiều chất hữu cơ bốc
cháy khi tiếp xúc với nó, được dùng để tấy trắng vải, 53 len, lụa… 53 14



