




Preview text:
C 1. Kiến thức cơ bản của quá trình truyền khối Khái niệm chung Cân bằng pha
Các định luật cân bằng pha
Động lực của quá trình
Phương pháp tính đường kính và chiều cao thiết bị truyền chất 14/01/2025 1 1 1.1 Khái niệm chung Quá trình truyền khối xảy ra trong cả 1 pha và 2 pha 1 14/01/2025 2 2 2 1.1 Khái niệm chung
Truyền khối là sự vận chuyển vật chất (cấu tử) từ điểm này sang điểm
khác trong một pha hoặc từ pha này sang pha khác khi hai pha tiếp xúc trực tiếp với nhau
Là kết quả của gradient nồng độ loài (chênh lệch nồng độ) động
lực của quá trình (Driving force)
𝐃𝐫𝐢𝐯𝐢𝐧𝐠 𝐟𝐨𝐫𝐜𝐞
𝐑𝐚𝐭𝐞 𝐨𝐟 𝐚 𝐭𝐫𝐚𝐧𝐬𝐟𝐞𝐫 𝐩𝐫𝐨𝐜𝐞𝐬𝐬 = 𝐑𝐞𝐬𝐢𝐬𝐭𝐚𝐧𝐜𝐞
Quá trình truyền khối là quá trình khuếch tán, có thể là khuếch tán
phân tử (molecular diffusion) hoặc đối lưu (convective diffusion),
Khuếch tán phân tử xảy ra khi không có bất kỳ chuyển động vĩ mô
nào trong môi trường (trong pha rắn: hệ vật liệu xốp)
Khuếch tán đối lưu xảy ra trong môi trường lưu chất và tùy thuộc vào chế độ dòng.
Oxy hòa tan trong nước tự nhiên cho đời sống thủy sinh
Loại bỏ độ ẩm từ hạt thực phẩm bằng cách sấy khô 14/01/2025 3 3 1.1 Khái niệm chung
Sự truyền khối khuếch tán xảy ra khi không có bất kỳ chuyển
động vĩ mô nào trong môi trường khuếch tán phân tử.
Sự vận chuyển các phân tử từ nơi có nồng độ cao hơn đến nơi
có nồng độ thấp hơn xảy ra trong môi trường tĩnh hoặc chuyển
động tầng động lực quá trình – chênh lệch nồng độ.
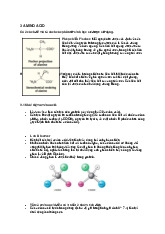
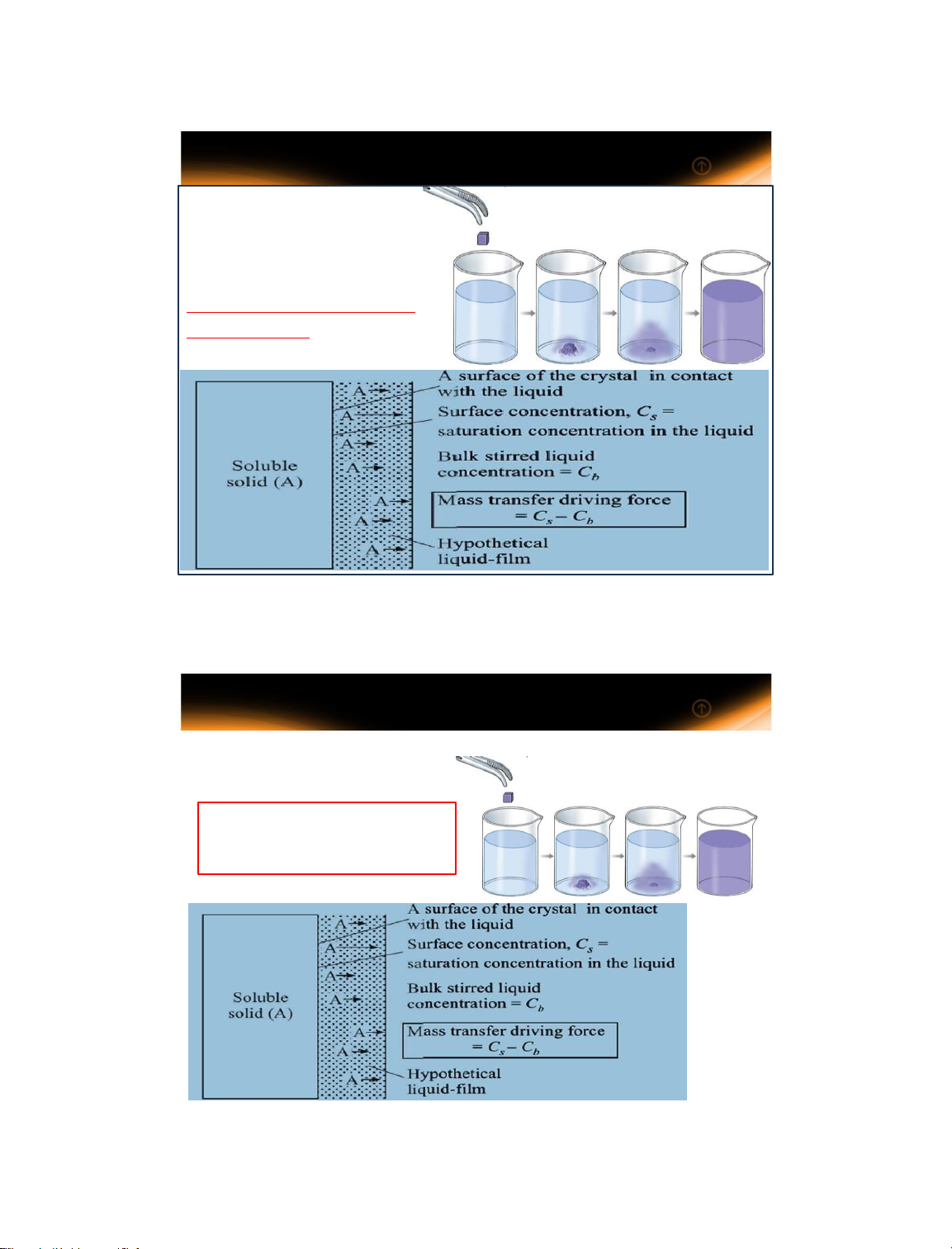
Một giọt mực rơi vào nước trong cốc lan dần làm cho nước có màu đồng nhất
Tốc độ khuếch tán phân tử có mối liên hệ chặt chẽ với vận tốc
phân tử và chênh lệch nồng độ. 14/01/2025 4 4 3 1.1 Khái niệm chung
Trong môi trường hỗn loạn, sự khuếch tán phân tử
không có vai trò quan trọng trong việc truyền khối,
ngoại trừ ở vùng rất gần
ranh giới pha (lớp phim của pha). 5 5 1.1 Khái niệm chung
Khuếch tán đối lưu xảy ra trong môi trường lưu chất và tùy
thuộc vào chế độ dòng chảy
Xét sự khác biệt về tốc độ hòa
tan của hạt đường trong nước
khi khuấy và không khuấy???? 6 6 4 1.1 Definitions
Khuếch tán đối lưu xảy ra trong môi trường lưu chất và tùy
thuộc vào chế độ dòng chảy
Khuếch tán đối lưu: đối lưu cưỡng bức và đối lưu tự do 14/01/2025 7 7 1.1 Definitions
Khuếch tán đối lưu xảy ra trong môi trường lưu chất và tùy
thuộc vào chế độ dòng
Xảy ra đối lưu tự nhiên
Không xảy ra đối lưu tự nhiên 14/01/2025 8 8 5 1.1 Khái niệm chung
Các quá trình truyền khối
Hấp thụ (Absorption): Gas Liquid
Chưng cất (Distillation): Liquid Vapor and Vapor Liquid
Hấp phụ (Adsorption): Gas), Liquid Solid
Trích ly (Extraction): Liquid Liquid
Chiết (Leaching): Solid Liquid
Hòa tan (dissolution): Solid Liquid
Kết tinh (Crystallization): Liquid Solid
Sấy (Drying): Solid, Liquid Gas
Trao đổi (Ion exchange): Liquid Liquid, Solid 14/01/2025 9 9 1.1 Khái niệm chung
Ký hiệu các pha trong quá trình truyền khối Phase x
– Lỏng/Liquid (distillation, absorption)
Pha phân tán/Dispersed phase (extraction liquid-liquid)
Rắn/Solid (adsorption, drying, leaching) Phase y
– Khí/Vapor, gas (distillation, absorption, adsorption, drying)
Pha liên tục/ Continuous phase (extraction, liquid-liquid)
Lỏng/Liquid (adsorption, leaching) 14/01/2025 10 10 6 1.1 Khái niệm chung
Các loại nồng độ Phần mol: x, y, kmol/kmol
Tỷ số mol: X(Y), kmol/kmol Nồng độ mol: C, kmol/m3
Nồng độ khối lượng: Cത, kg/m3
Mối quan hệ giữa các loại nồng độ Dalton-Clapeyron
Phương trình khí lý tưởng 14/01/2025 11 11 1.1 Khái niệm chung
Hỗn hợp khí gồm không khí và NH3, trong đó phần mol của NH3
trong hỗn hợp khí là 18%. Xác định tỷ số mol của NH3 và phần
khối lượng của NH3 trong hỗn hợp khí
y_NH3 = 0.18; y_K2 = 1 – 0.18 = 0.82
y_NH3 (KL) = m_NH3/(m_NH3+m_KK) M_KK = y_N2xM_N2 + y_O2xM_O2 14/01/2025 12 12 7 1.1 Khái niệm chung
Hỗn hợp khí 100 kmol·h⁻¹ gồm 64% khí N₂, 28% khí CO, và 8% khí CO₂. Xác định:
a/ Phần mol và phần khối lượng của các cấu tử trong hỗn hợp
b/ Thể tích của hỗn hợp (nhiệt độ 45 C, 850 mmHg)
c/ Lưu lượng khối lượng của hỗn hợp.
y_N2(KL) = m_N2/m_hh; 𝒚ഥ
m_N2 = y_N2*28; m_CO = y_CO*28; m_CO2 = y_CO2*44 𝑷𝑽 b/ 𝑮 =
; G (kmol/h) V(m3/h); P (atm) 𝑹𝑻
1 atm = 760 mmHg; 1 at = 735.5 mmHg; 850/760 (atm)
R = 22.4/273 (m3.atm/kmol.K) 14/01/2025 13 13 1.2 Cân bằng pha 14/01/2025 14 14 8 1.2 Cân bằng pha
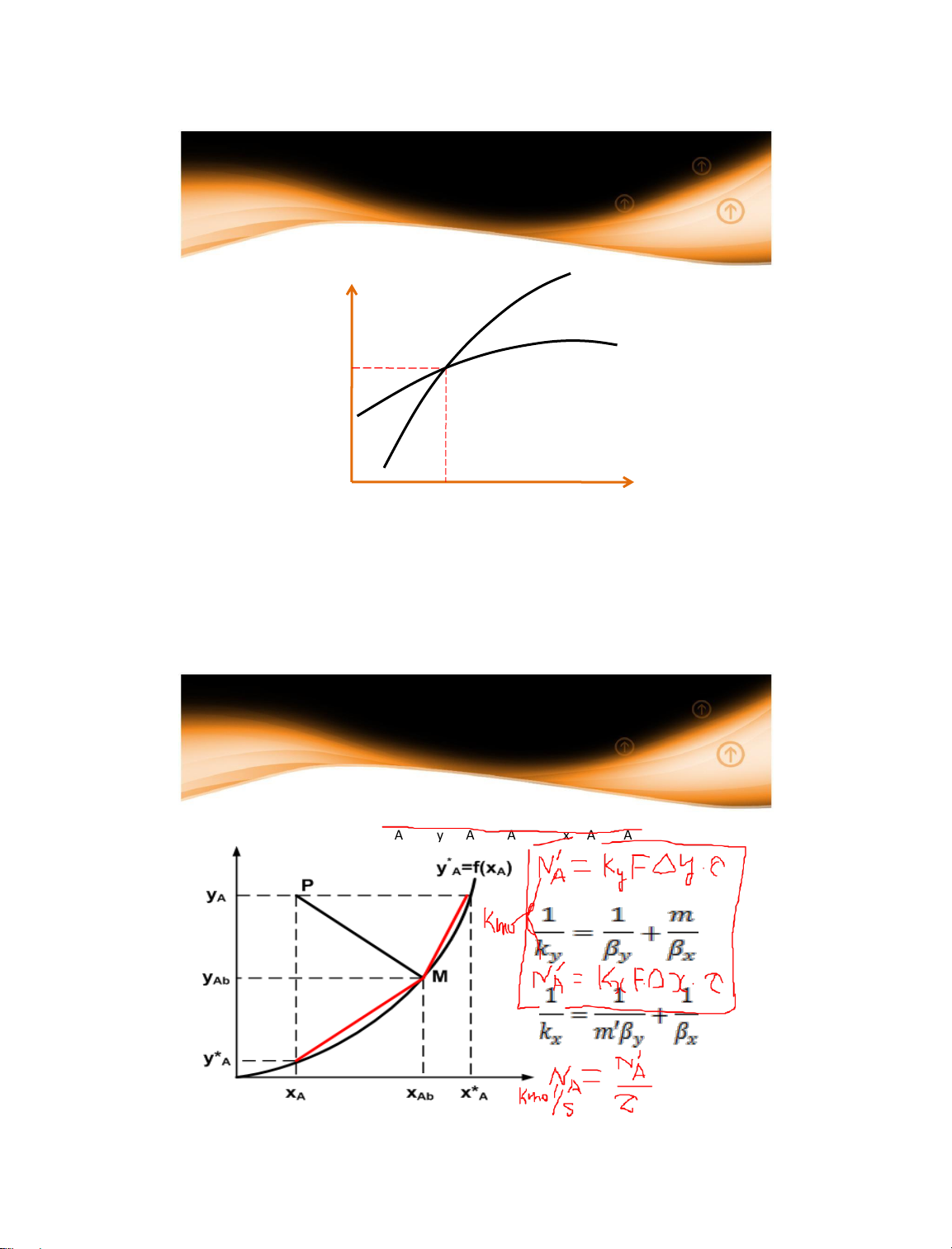
Nồng độ của cấu tử (NH3) trong mỗi pha tại cân bằng (nồng độ cấu tử không
thay đổi theo thời gian) được xác định. 14/01/2025 15 15 1.2 Cân bằng pha y x xo = 0 yoM>0 M=0 > 0 yiM giảm dần xi tăng dần M cb
yiM tiếp tục giảm xi tiếp tục tăng M = cb yiM const xiM = xmax (x*)= const
Vật chất dịch chuyển từ pha y x yo > y* 16 16 9 1.2 Cân bằng pha
Khi hai pha tiếp xúc nhau trực tiếp: xảy ra khuếch tán. Nếu có
đủ thời gian xảy ra → đạt cân bằng
Cân bằng được thiết lập tại điều kiện nhiệt độ, áp suất xác
định, và được biểu diễn bởi đường cân bằng y* = f(x) và x* = g(y).
Cân bằng đạt được: Cân bằng động. Tại cân bằng không
còn khuếch tán tổng giữa hai pha.
Tại cân bằng nồng độ hai pha không bằng nhau
Các thông số quan trọng ảnh hưởng đến cân bằng đối với
một cấu tử (chất tan): Nhiệt độ, áp suất, và nồng độ. 14/01/2025 17 17 1.2 Cân bằng pha
Các thông số ảnh hưởng đến cân bằng pha giữa 2 pha xác định được
xác định bởi quy tắc pha
Quy tắc pha: C = k - + n
C: bậc tự do (số biến số độc lập)
k: số cấu tử trong hệ (không có phản ứng hóa học xảy ra)
: số pha tồn tại trong hệ
n: số yếu tố bên ngoài ảnh hưởng lên cân bằng hệ
Với quá trình truyền khối n = 2 (nhiệt độ, áp suất) C = k - + 2
Quá trình truyền khối giữa hai pha (khí – lỏng) đối với hệ 3 cấu tử
CO2-Air-H2O (k = 3 & = 2) C = 3-2+2 = 3
Áp suất & nhiệt độ của hệ thống được xác định, nếu nồng độ CO2 trong pha lỏng (x
) được xác đị CO2
nh, nồng độ CO2 trong pha khí (yCO2) sẽ được xác định
theo. Giá trị yCO2 phải được xác định qua thực nghiệm 14/01/2025 18 18 10 1.2 Cân bằng pha
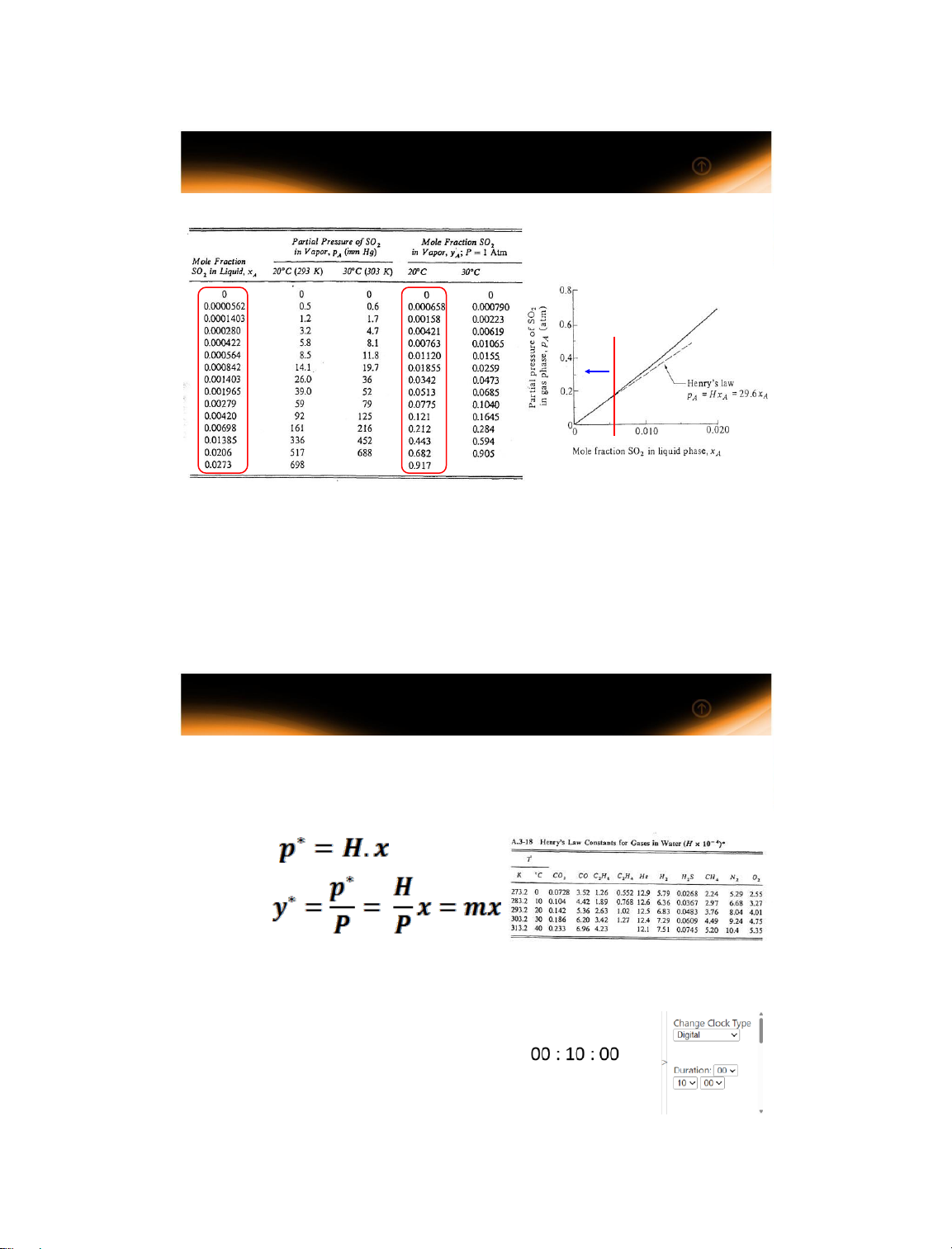
Dữ liệu cân bằng của hệ thống SO2-Air-H2O tại cân bằng
Có sự tương thích về số liệu thực nghiệm với số liệu tính toán từ định luật
Henry ở vùng có nồng độ thấp 14/01/2025 19 19
1.3 Các định luật cân bằng pha 1.3.1 Định luật Henry
Với khí lý tưởng, áp suất riêng phần (p) của khí trên dung
dịch tỷ lệ với nồng độ phần mol (x) của nó trong dung dịch. y* = mx x* = (1/m)y
Xác định lượng Oxy hòa tan vào trong nước tại cân bằng ở áp suất 760mmHg.
Biết rằng hàm lượng Oxy trong không khí chiếm 21% thể tích và quá trình hòa tan
tuân theo định luật Henry.
a/ ở 20 C (H = 4.01*10^4 atm - mmHg)
b/ ở 0 C (H = 2.55*10^4 atm)
yO2 = 0.21; m = H/P; x = (1/m)yO2 = 14/01/2025 2 0 20 11
1.3 Các định luật cân bằng pha Bai tap
Hàm lượng CO2 trong nước ở 30 C là 0.9104 kg CO2/kg H2O.
Xác định áp suất riêng phần của CO2 trong pha khí ở điều kiện
cân bằng, biết rằng quá trình hòa tan CO2 trong nước tuân theo
định luật Henry. [0.0684 at m] X_CO2(KL) = 9.10^-5 - x_CO2 =???? p* = Hx 14/01/2025 21 21
1.3 Các định luật cân bằng pha 1.3.2 Định luật Raoult
Với dung dịch lý tưởng, áp suất riêng phần (p) của một cấu
tử trên dung dịch bằng áp suất hơi bão hòa cấu tử đó (ở
cùng nhiệt độ) nhân với nồng độ phần mol (x) của nó trong dung dịch.
Xác định thành phần của Benzen và Toluene trong pha hơi và lỏng tại cân bằng ở
95 C ở áp suất 101.32 kPa. Biết rằng áp suất hơi bão hòa của Benzen và Toluene
ở 95 C 155.7 kPa và 63.3 kPa
Đáp án: x_Benzen = 0.411; y_Benzen = 0.632 14/01/2025 22 22 12
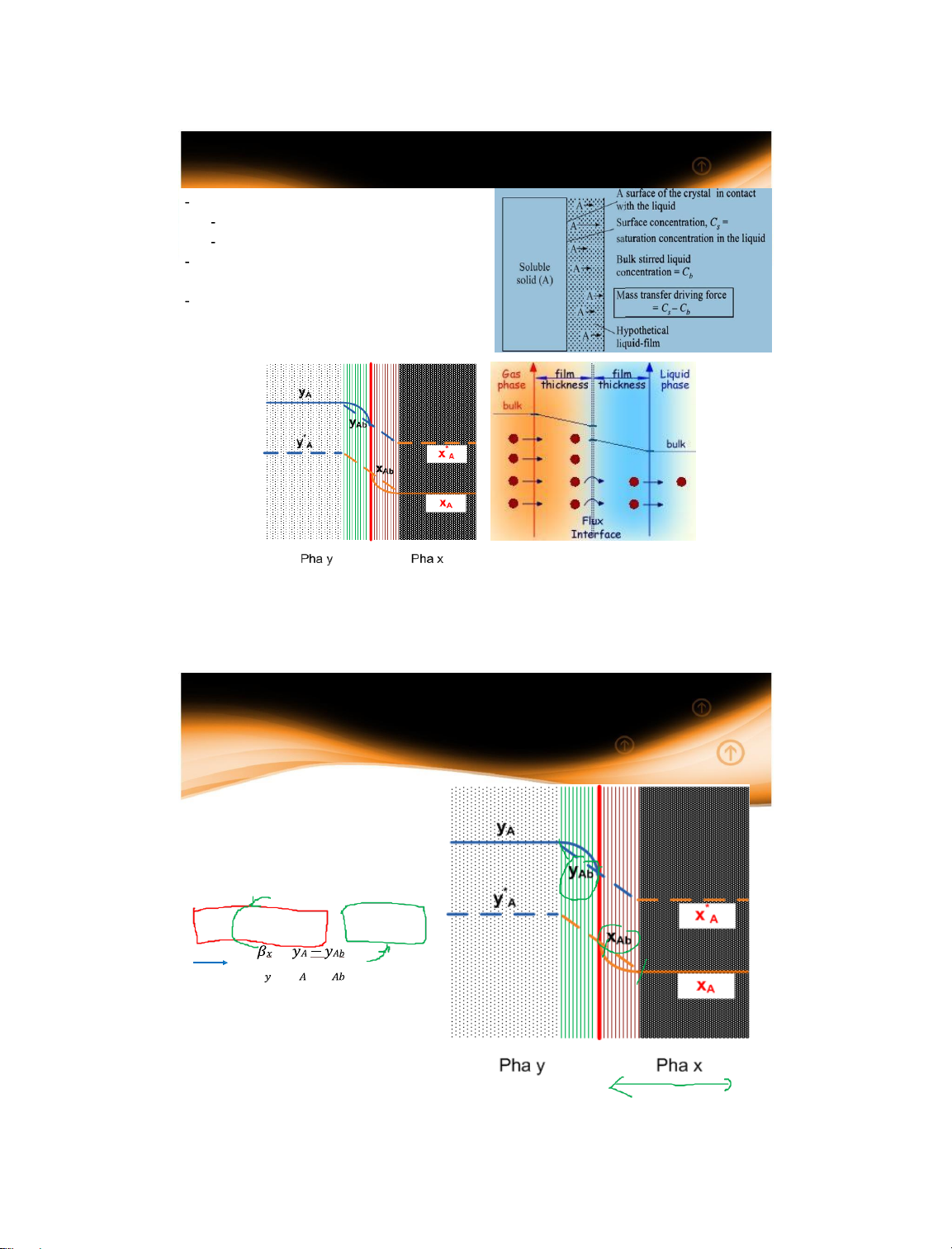
1.4 Động lực quá trình truyền khối giữa hai pha
Cơ chế quá trình truyền khối giữa hai pha Khuếch tán phân tử Khuếch tán đối lưu
Trở lực của quá trình khuếch tán: lớp phim mỗi pha
Không có trở lực qua bề mặt tiếp xúc pha
(trong đa số trường hợp) thiết lập mối quan hệ cân bằng 14/01/2025 23 23
1.4 Động lực quá trình
1.4.1 Phương trình cấp chất
- Quá trình ổn định, không
có phản ứng hóa học xảy
ra, để A không bị tích tụ
tại bề mặt phân pha thì:
NA = y(yA – yAb) = x(xAb-xA) − = 𝛽 𝑥 − 𝑥
NA – lượng vật chất truyền
được tính trên một đơn vị
diện tích trong một đơn vị thời gian 14/01/2025 24 24 13
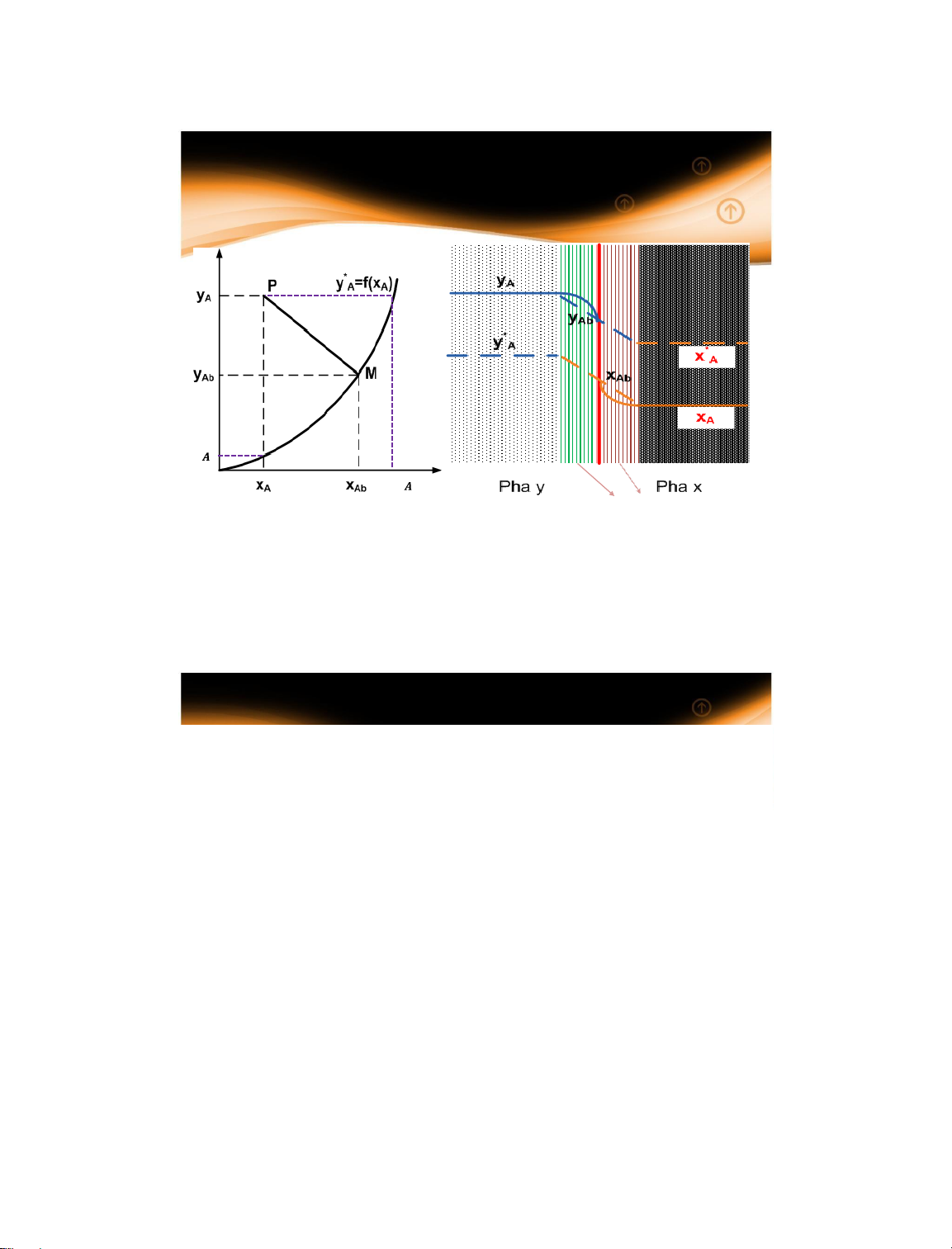
1.4 Động lực quá trình
1.4.1 Phương trình cấp chất
(x/y) 𝒚∗ 𝒙∗
Phim pha y và x
Nồng độ xAb & yAb có thể xác định được nếu biết giá trị của x & y (hệ số truyền khối
pha lỏng và pha khí) khó xác định x & y (trong lớp phim của mỗi pha) bằng thực nghiệm) 14/01/2025 25 25
1.4 Động lực quá trình
1.4.2 Động lực của quá trình truyền khối
Quá trình truyền khối giữa hai pha xảy ra một cách tự
nhiên khi nồng độ làm việc và nồng độ cân bằng của cấu tử
phân bố trong mỗi pha khác nhau.
Hiệu số giữa nồng độ làm việc và nồng độ cân bằng là
động lực quá trình truyền khối.
Động lực của quá trình có thể tính theo hai pha y hoặc x y = y- y* ; y = y*- y x = x*- x ; x = x- x*
Động lực tính cho toàn thiết bị: động lực trung bình 14/01/2025 26 26 14
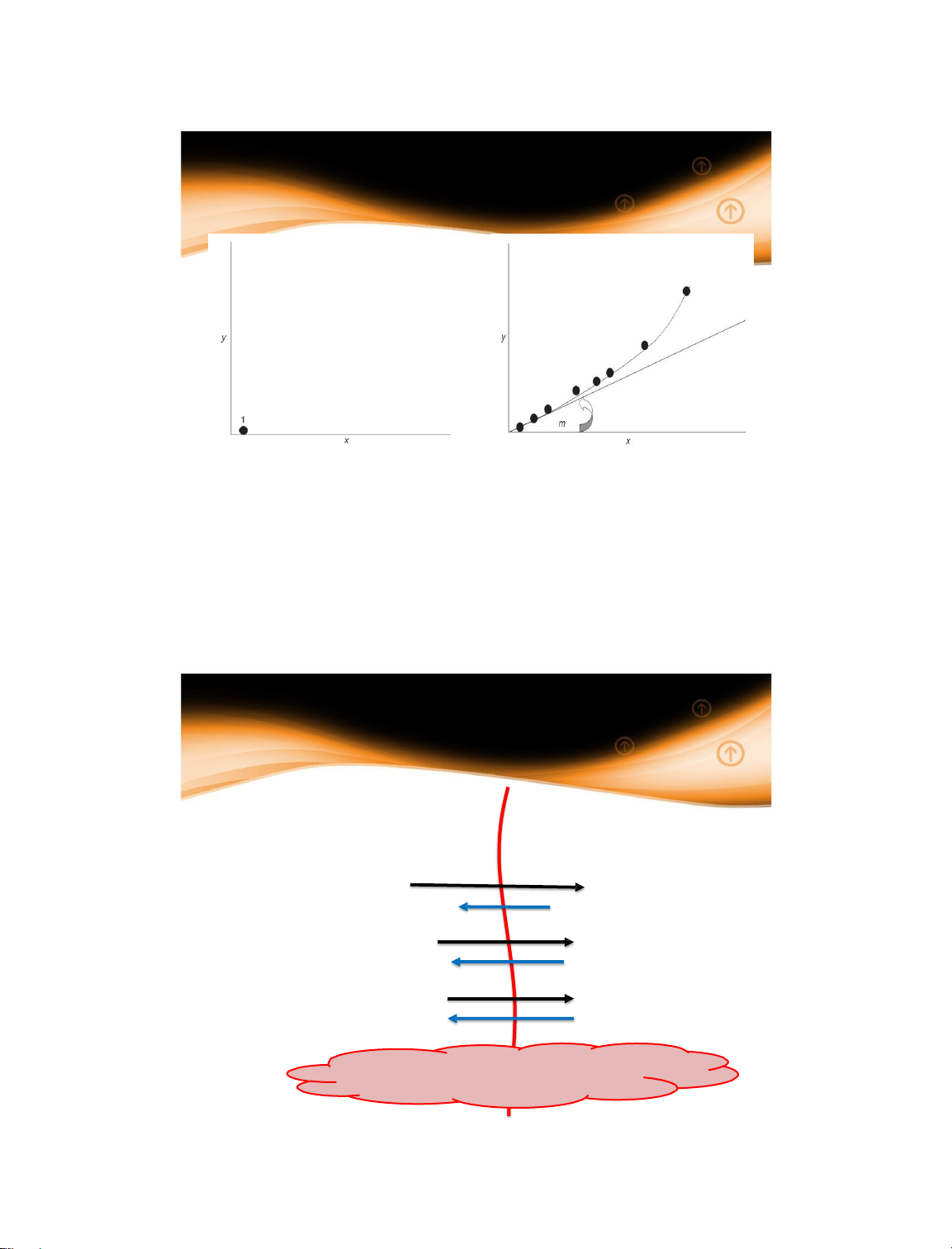
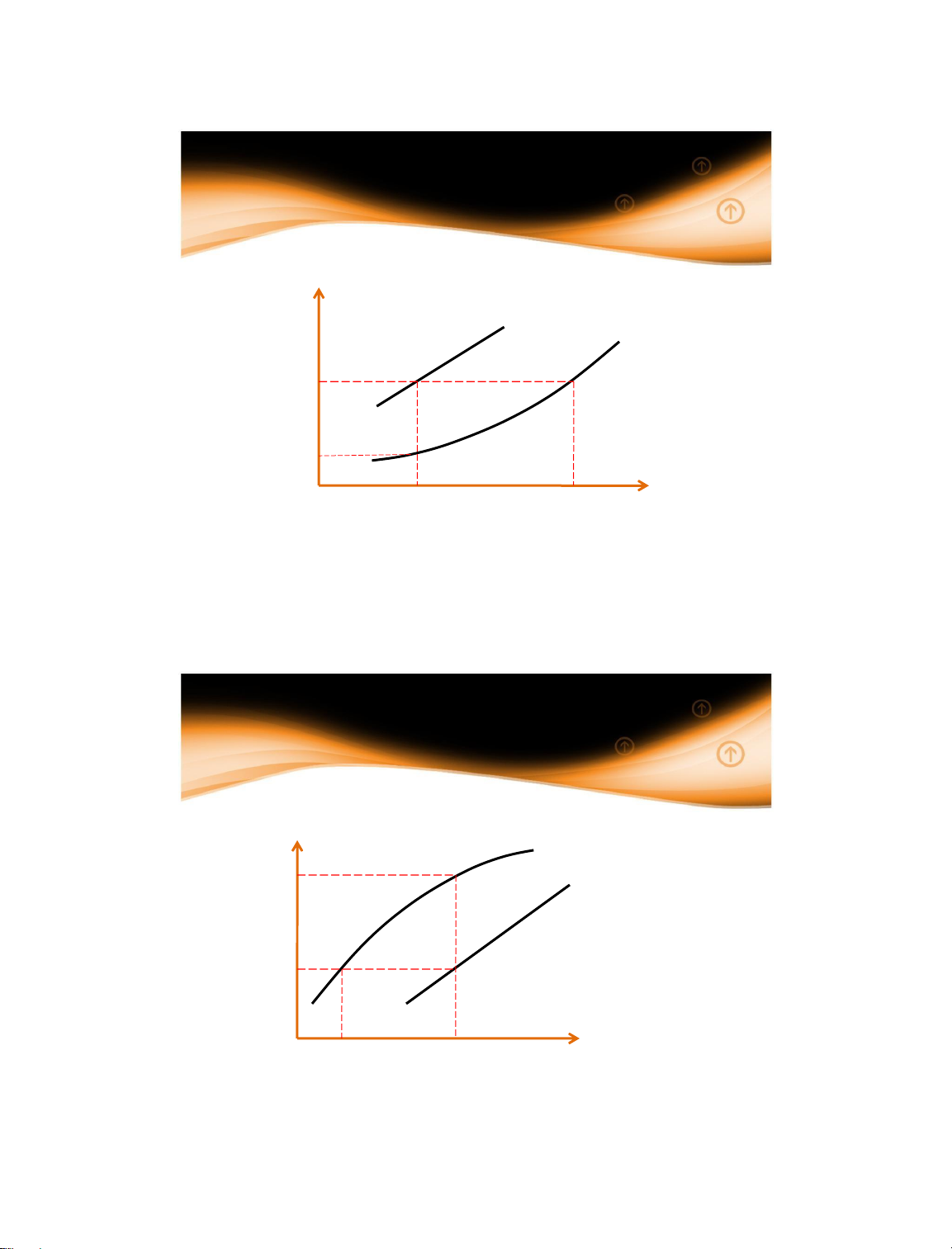
1.4 Động lực quá trình
1.4.2 Động lực của quá trình truyền khối y = f(x) y* = f(x) y Δx Δy y* x x* 14/01/2025 27 27
1.4 Động lực quá trình
1.4.2 Động lực quá trình truyền khối y* = f(x) y* Δ f(x) y y = y Δx x* x 14/01/2025 28 28 15
1.4 Động lực quá trình
1.4.2 Động lực quá trình truyền khối y = f(x) y = y* y* = f(x) x = x* 14/01/2025 29 29
1.4 Động lực quá trình
1.4.3 Phương trình truyền chất
Tốc độ truyền khối: NA = Ky (yA – yA*)= Kx(xA*-xA) m’
(x/y) m 14/01/2025 30 30 16
Cho hỗn hợp khí gồm Cl2 và khí trơ tạo thành 1 hỗn hợp
trong đó Clo chiếm 12%, cho hỗn hợp khí này tiếp xúc với
dung dịch nước clo. Quá trình này được thực hiện ở 15oC, áp
suất 0,93atm. Sau 2 phút, thể tích của hỗn hợp khí giảm
2,82cm3. Xác định thành phần của Clo có trong pha lỏng ban
đầu biết rằng diện tích tiếp xúc pha 36cm2, quá trình hòa tan
tuân theo định luật Henry và hệ số truyền khối theo pha khí
la 0,108[mol/m2s(phân mol)]. Giả thuyết sự biến đổi nồng
độ của Clo trong mỗi pha ảnh hưởng không đáng kể đến
quá trình truyền khối (H = 34600 mmHg) x_Cl2 = ? y* = (H/P)x 0.0024 molCl N 2/molhh
A [mol Cl2]= Ky[mol/m2s(phân mol)](yA – yA*)[phân mol]F[m2]t[s] 31
B1: N_Cl2 (mol), dựa vào G=PV/RT (V = 2.82 cm3) - G = Na (mol)
B2: Ap dung cong thuc NA [mol Cl2]= Ky[mol/m2s(phân mol)](yA – yA*)[phân
mol]F[m2]t[s] -- (yA – yA*) = ? --- yA* = 0.12 - ? = ??
B3: y* = (H/P)x -- x_Cl2 = ????
x = 0.0024 molCl2/molhh 14/01/2025 32 32 17
1.4 Động lực quá trình
1.4.4 Động lực trung bình
Vận tốc của quá trình tỷ lệ thuận với động lực và tỷ lệ
nghịch với trở lực của quá trình dNA = Ky.y = Kx.x
Nếu xét trên toàn bộ diện tích F ta được NA = Ky.ytb = Kx.xtb 14/01/2025 33 33
1.4 Động lực quá trình
1.4.4 Động lực trung bình
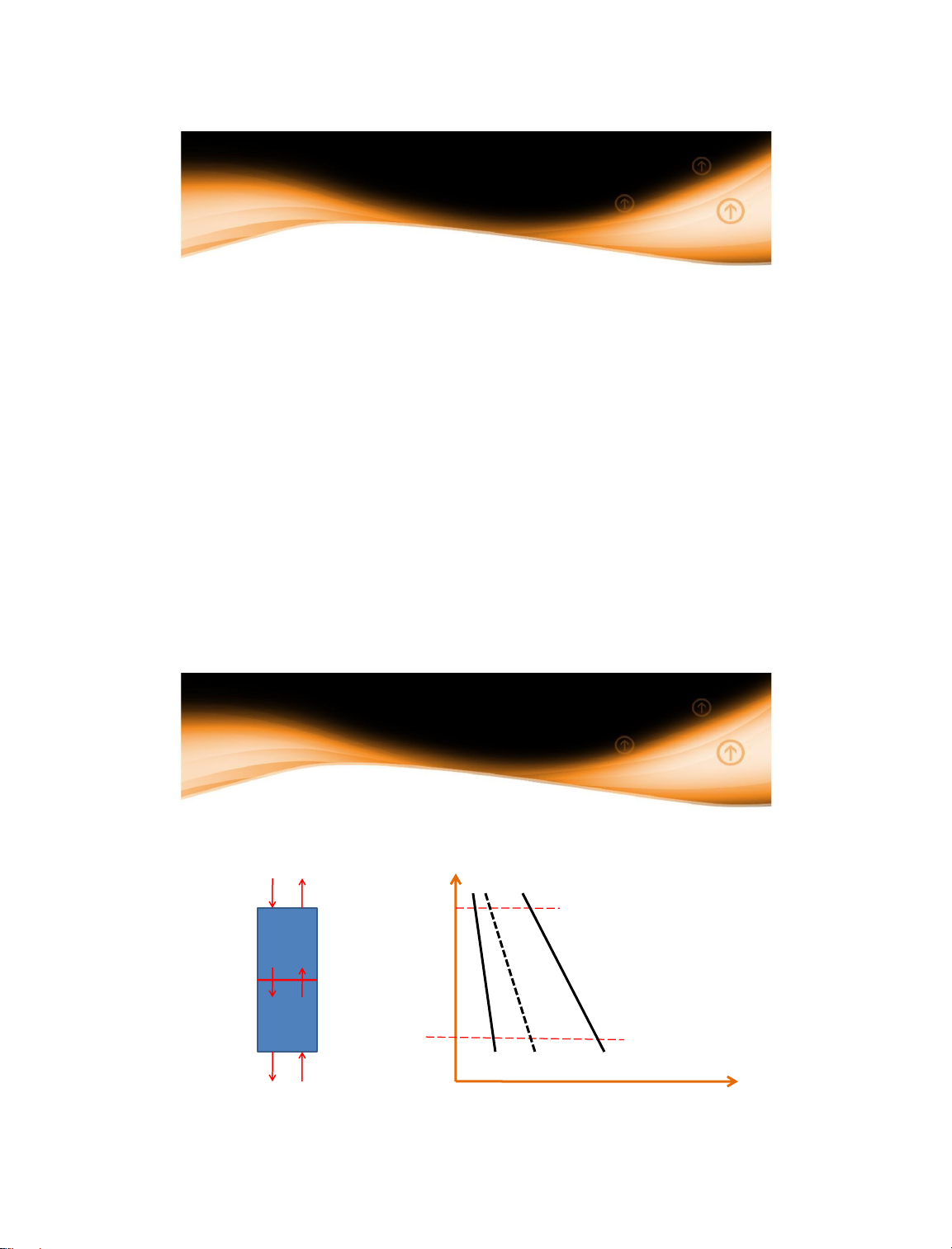
Giả thiết vật chất di chuyển từ pha y sang pha x trong
một thiết bị truyền khối ngược chiều H(m) y x1 y1 x 1 1 x2 y2 x2 y2 14/01/2025 x,y34 34 18
1.4 Động lực quá trình
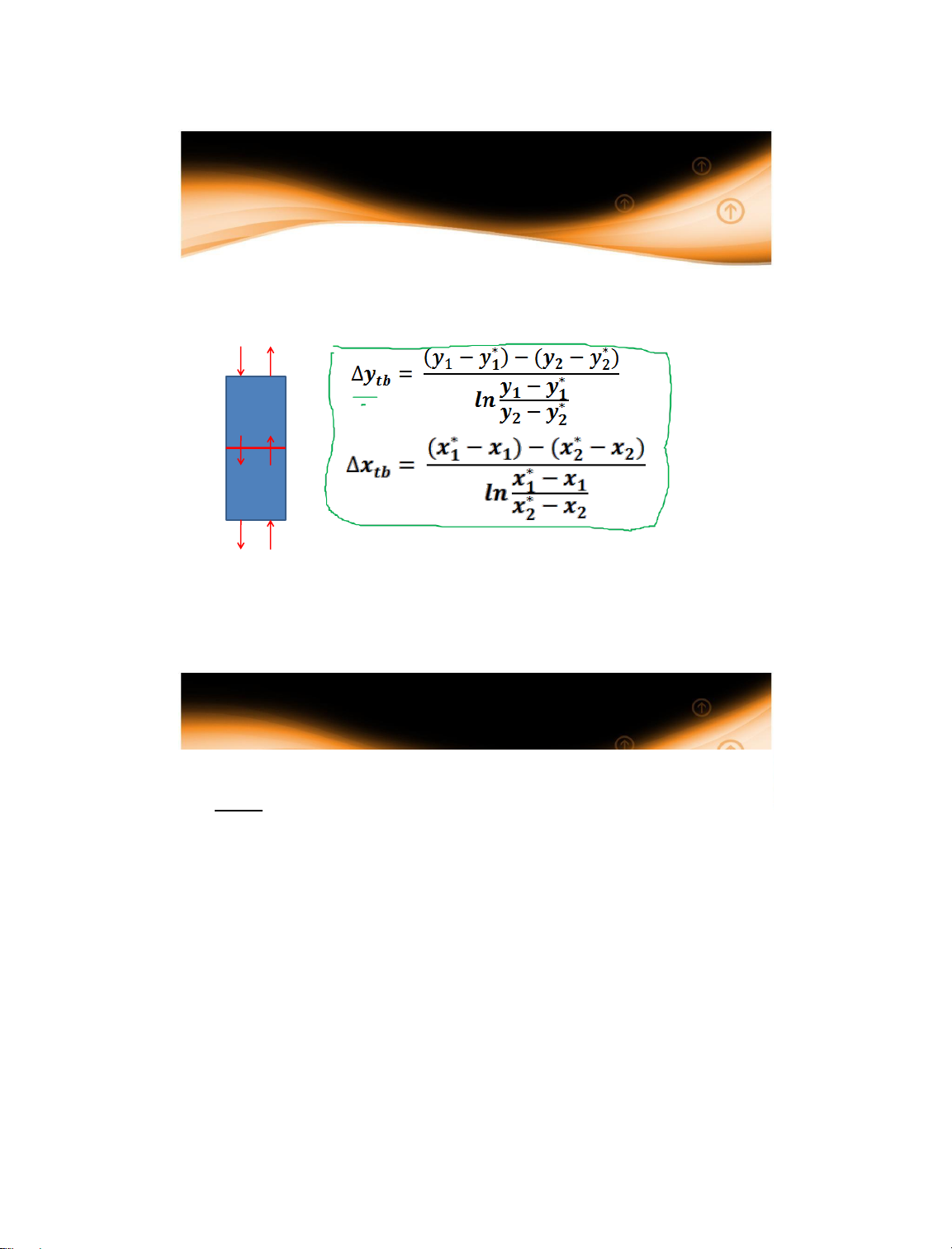
1.4.4 Động lực trung bình
Động lực trung bình quá trình truyền khối được xác
định theo hai pha như sau (trường hợp vật chất: y x) x y 1 1 x2 y2 35 35
1.4 Động lực quá trình
1.4.4 Động lực trung bình
Ví dụ: Quá trình truyền khối giữa hai pha trong thiết bị với
nồng độ phần mol của pha khí vào và ra thiết bị lần lượt là:
0,15mol/mol và 0,35mol/mol. Biết đường làm việc là y =
0,7x - 0,2; đường cân bằng y* = 1,15x. Xác định động lực
trung bình của quá trình truyền khối tính theo pha khí, và
pha lỏng trong hai trường hợp xuôi chiều và ngược chiều.
Ngược chiều: Pha x: 0.423; pha y: 0.486
Xuôi chiều: Pha x 0.38; Pha y: 0.437 36 36 19
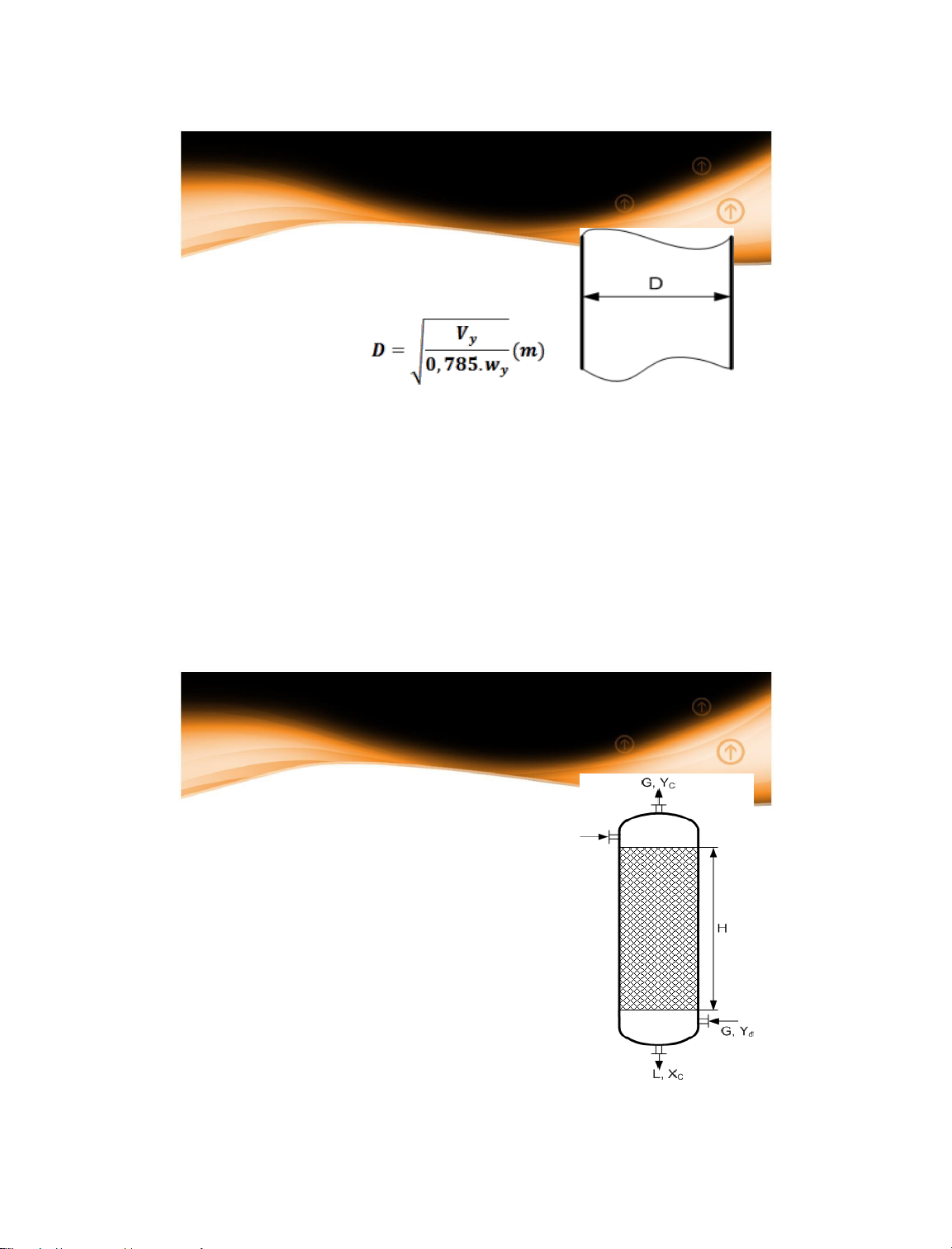
1.5 Phương pháp tính đường kính và chiều cao
thiết bị truyền chất
1.5.1 Xác định đường kính thiết bị
Vy – Lưu lượng thể tích của pha liên tục, m3/s
Wy – Vận tốc của pha liên tục đi trong tháp, m/s 14/01/2025 37 37
1.5 Phương pháp tính đường kính
và chiều cao thiết bị truyền chất
1.5.2 Xác định chiều cao thiết bị
Theo phương trình truyền khối
Theo số bậc thay đổi nồng độ
Theo số đơn vị truyền khối
Theo cách vẽ đường cong trung bình 14/01/2025 38 38 20