












Preview text:
Chương VI- Dung dịch các chất điện ly
1. Tính chất bất thường của dung
dịch axit, baz, muối.
2. Sự điện ly và thuyết điện ly.
3. Cân bằng trong dung dịch chất điện ly yếu.
4. Trạng thái của chất điện ly
mạnh trong dung dịch.
5. Điện ly của nước, acid, base
và muối – pH dung dịch
6. Hiện tượng thủy phân
7. Cân bằng trong dung dịch
chất điện ly khó tan và tích số tan.
……Hiện tượng điện ly
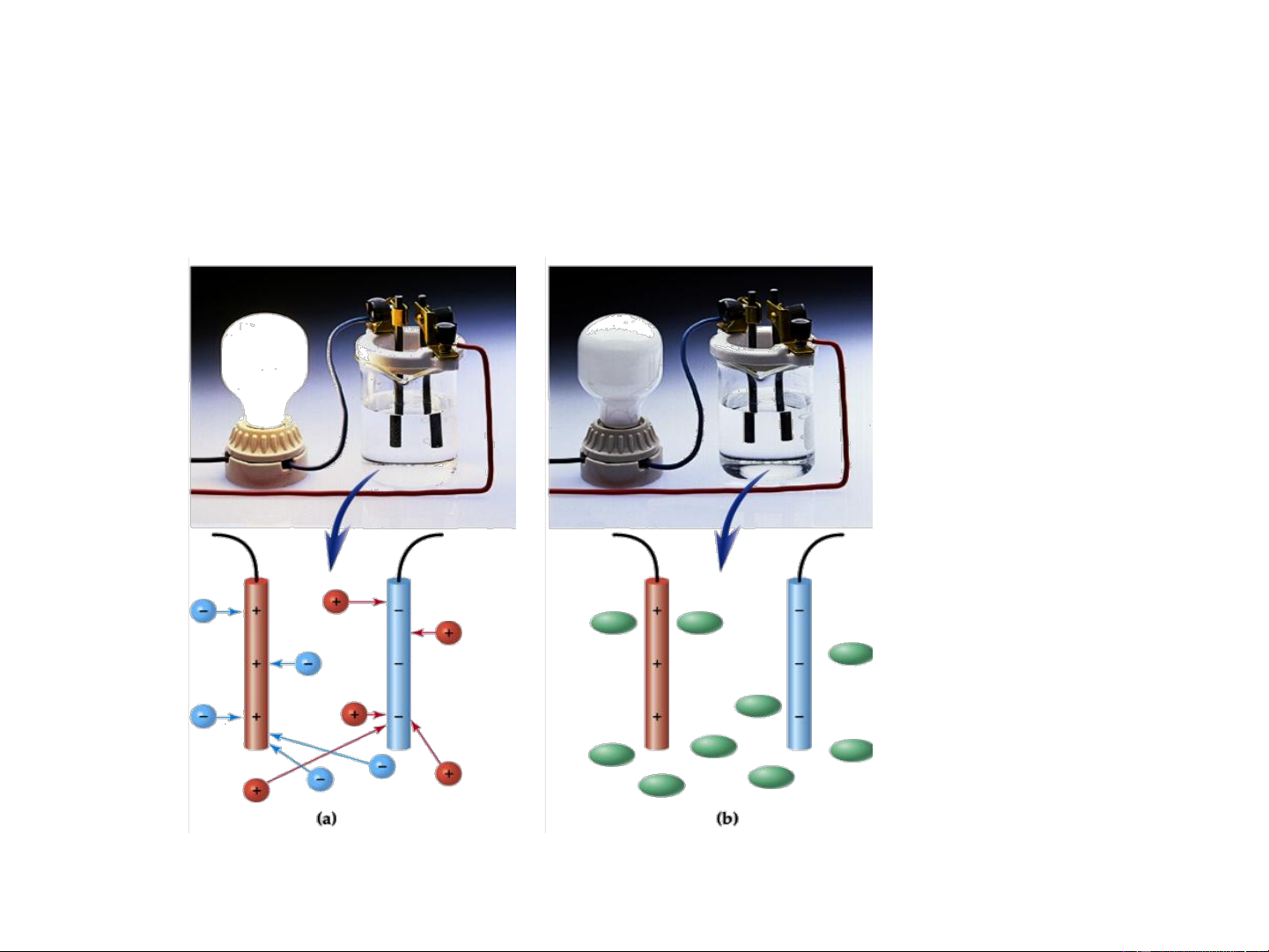
Hiện tượng dẫn điện của dung dịch chất điện ly.
1. Tính chất bất thường của dung dịch axit, bazơ, muối so với
dung dịch chất không điện ly ở cùng nồng độ
So với tính toán theo định luật Raoult và Vant’Hoff
Tăng độ giảm áp suất hơi bão hoà P ' i P iP X 0 ct
Tăng độ tăng nhiệt độ sôi và độ giảm nhiệt độ đông đặc T ' i T ikCm
Tăng áp suất thẩm thấu
' i iRTCM
P' T ' ' i P T
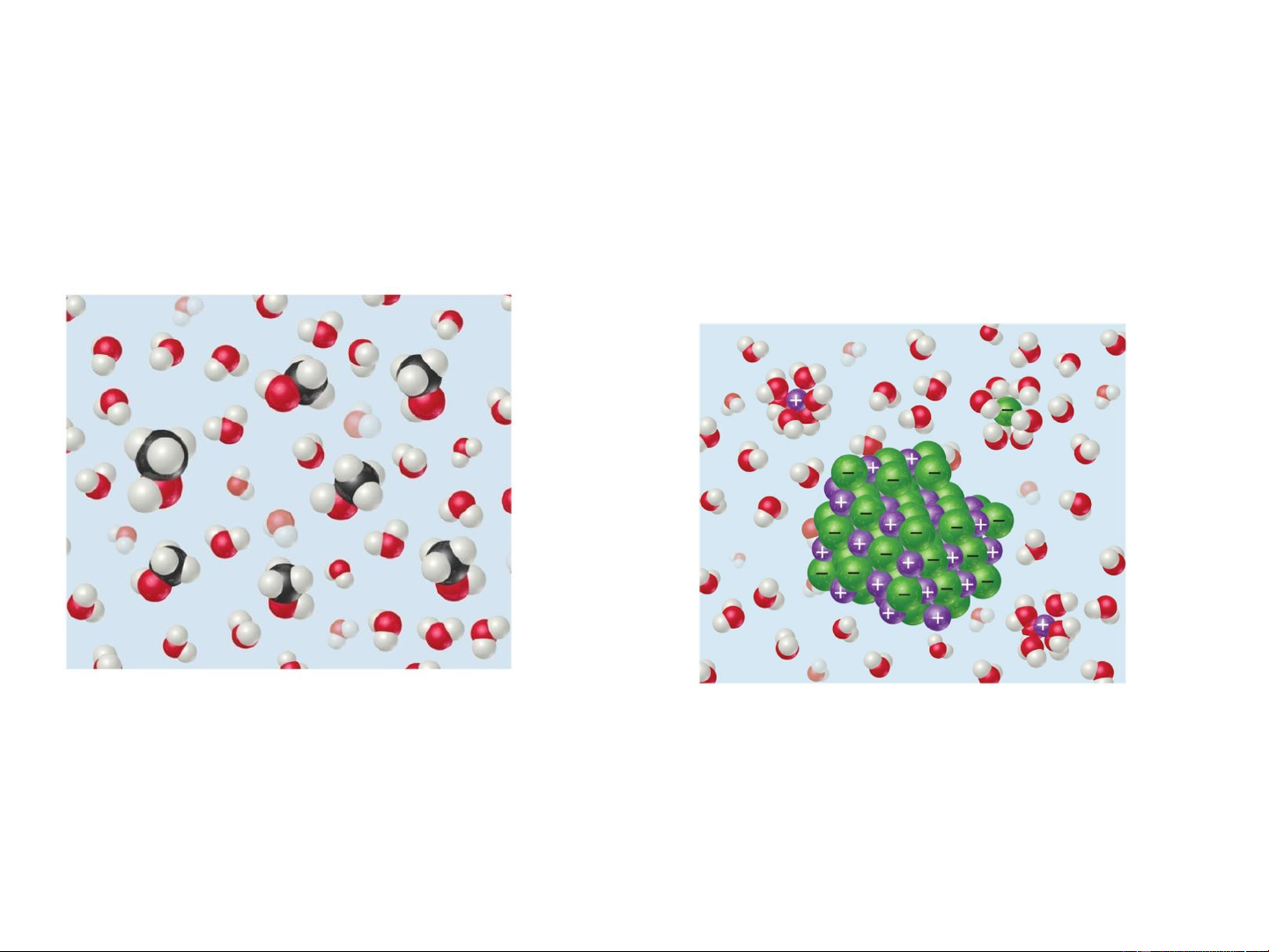
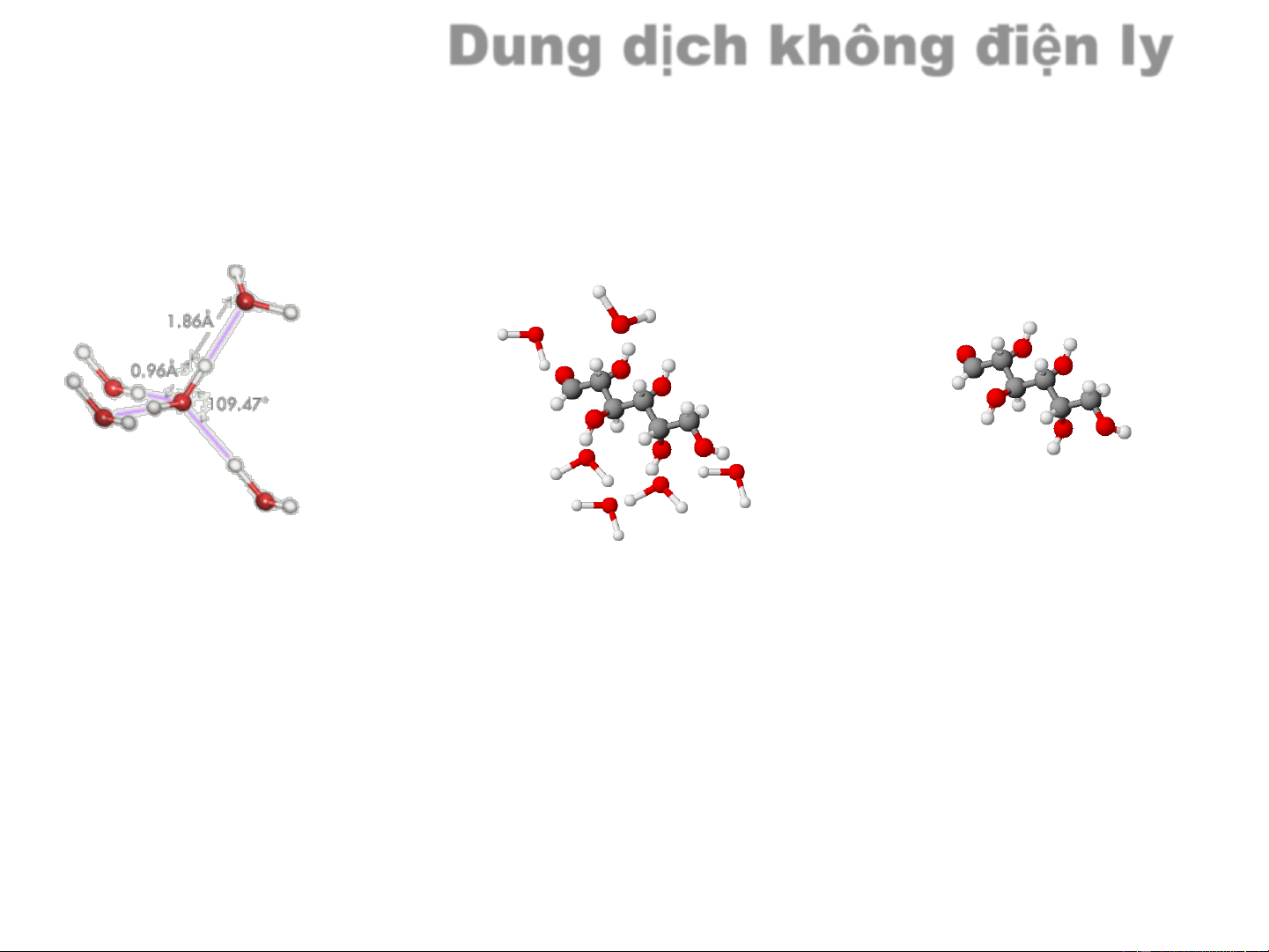
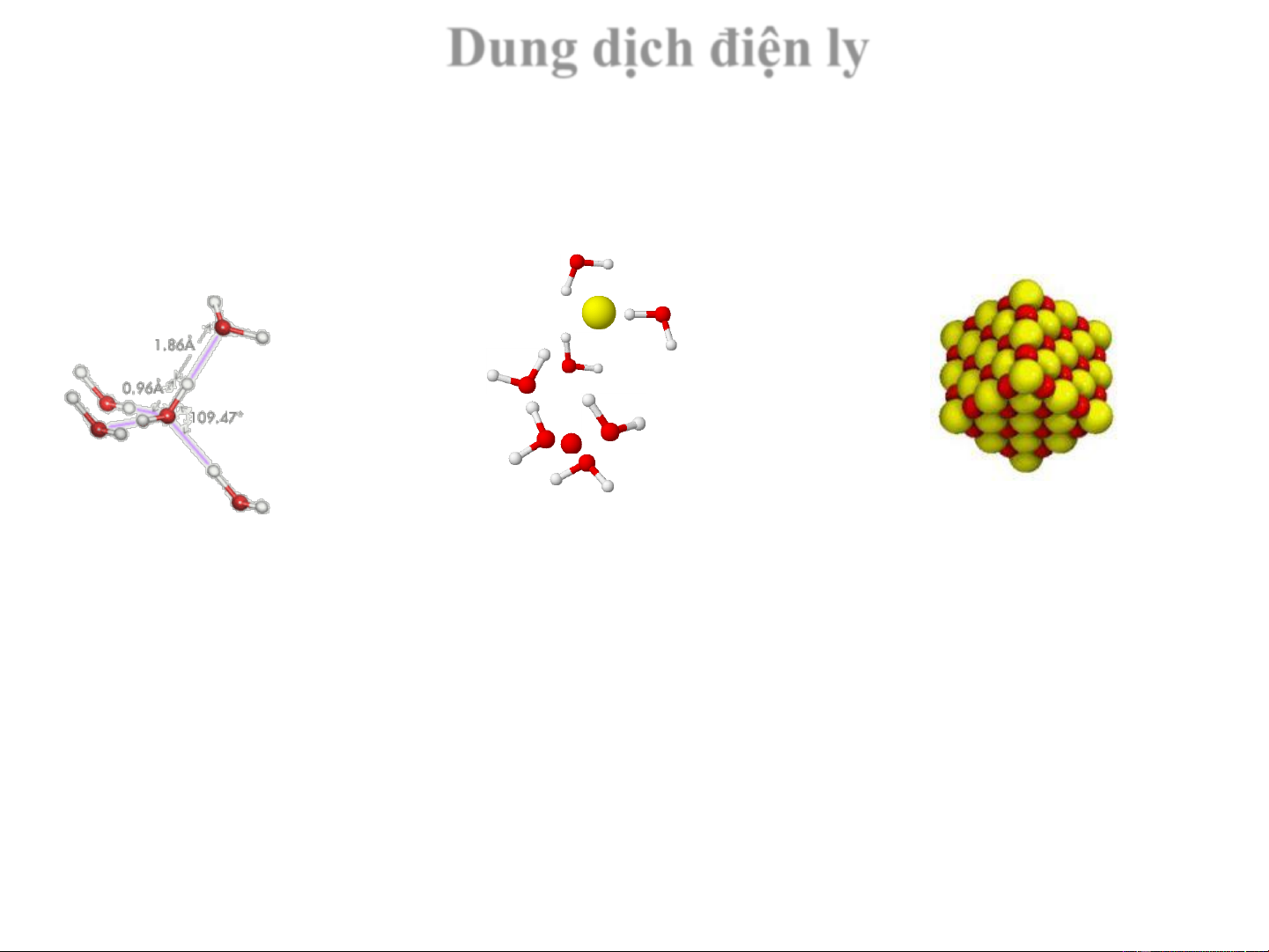
Chất điện ly và không điện ly
Chất không điện li Chất điện li Khi tan trong nước không Khi tan trong nước phân phân ly mà ở dạng phân ly tạo ra các ion tử
Dung dịch không điện ly Dung môi Chất tan H O glucose C H O 2 6 12 6 Liên kết H Liên kết H H+ O- H+ O-
C H O (r) + H O (l) C H O (dd) 6 12 6 2 6 12 6 Dung dịch điện ly Dung môi Dung dịch nước Chất tan H O NaCl 2 Liên kết H Ion-Lưỡng cực Ion-ion H+ O- Cl- H+ Na+ Cl- Na+ O- Quá trình hoà tan
NaCl (r) + H O (l) Na+ (dd) + Cl- (dd) 2
2. Sự điện ly và thuyết điện ly Thuyết điện ly
Ngay sau khi hoà tan vào nước, các chất acid,
base và muối phân li thành các ion dương (cation) và âm (anion)
Sự phân ly của các ion thành chất tan trong dung
dịch (hay khi nóng chảy) gọi là sự điện ly
Chất phân ly thành ion trong dung dịch hay khi Svante Arrhenius
nóng chảy gọi là chất điện ly HCl H+ + Cl- NaOH Na+ + OH- NaCl Na+ + Cl-
Thiếu sót: Không tính đến sự tương tác giữa các
tiểu phân trong dung dịch
Độ điện ly ()
Là tỷ số giữa các phân tử đã phân ly thành ion (N ) trên tổng số pl
phân tử đã hoà tan vào dung dịch (N ) 0 A B mAn+ + nBm- m n Ban đầu N 0 0 0 Điện ly N mN nN 0 0 0 N 0 ≤ ≤ 1 pl N = Số phần tử phân ly N pl 0 N = Số phần tử hoà tan 0
= 0: dung dịch phân tử
= 1: sự phân ly xảy ra hoàn toàn.
Độ điện ly phụ thuộc:
Bản chất dung môi: càng phân cực, độ điện ly càng lớn.
Nồng độ: càng lớn độ điện ly càng nhỏ.
Nhiệt độ: càng cao độ điện ly càng lớn.
Quy ước Trong dung dịch 0,1N:
Chất điện ly mạnh: 0,3
Chất điện ly trung bình 0,03 < < 0,3
Chất điện ly yếu: < 0,03 A B mAn+ + nBm- m n Ban đầu N 0 0 0 Điện ly N mN nN 0 0 0 Cân bằng (1 – a)N mN nN 0 0 0
' t' P' N i t P N 0
i: hệ số đẳng trương hay hệ số Van’t Hoff
N = Số phần tử dung dịch (chất đầu còn lại + ion) = (1 – a) N0 +(m + n)aN0
N0 = Số phần tử chất tan đầu. N
1 N m n N 0 0 i
1 m n 1 N N 0 0 i 1
m n 1 Coâng thöùc i = 1 + (m - 1) Chaát khoâng ñieän ly CH OH 0.00 1.00 3 C H OH 0.00 1.00 2 5 C H (O H) 0.00 1.00 3 5 3 C H O 0.00 1.00 12 22 11 C H OH 0.00 1.00 6 5 Chaát ñieän ly NaOH 0.88 1.88 NH 0.01 1.01 3 HCl 0.90 1.90 H SO 0.60 2.19 2 4 CH COOH 0.01 1.01 3KCl 0.86 1.86 Na CO 0.61 2.22 2 3 CuSO 0.35 1.35 4
Các chất điện ly mạnh là… Acid mạnh Base mạnh
Muối của các acid và base mạnh
HNO , HCl, H SO , KOH , NaOH, Ba(OH) , CuSO NaCl… 3 2 4 2 4
Dung dịch chất điện ly mạnh
Dung dịch chất điện ly yếu
Các chất điện ly yếu là…
Axít vô cơ yếu, axít hữu cơ, baseyếu, muối…Các chất này xem
như chỉ điện ly một nấc: HF, CH COOH, NH … 3 4
Hằng số điện ly: Hay hằng số ion hoá của chất điện ly A B là m n
nồng độ của ion (tính bằng ion gram/lit) và nồng độ chất điện ly lúc cân bằng AmBn mAn+ + nBm- m n C C n m A B K C m A Bn
Hằng số điện ly: chỉ phụ thuộc vào nhiệt độ
Mối quan hệ giữa K và : C
Xét phương trình điện ly: AB A+ + B- Ban đầu C 0 0 0 Điện ly aC aC aC 0 0 0 Cân bằng (1-a)C aC aC 0 0 0 Hằng số điện ly:
AB K C AB 2 2 C 2 K 0 C C C 0 1 0 1 Nếu K 5% K = C 2 C C 0 C0
Thuyết điện ly của Kablukov
Sự điện ly là sự phân ly các chất tan dưới tác dụng Каблуков
của các tiểu phân dung môi thành các ion solvat hoá Иван Алексеевич
Trong dung dịch nước các ion bị hydrat hóa
Chất tan là các ion - hiện tượng điện ly; nếu là hợp chất cộng
hóa trị phân cực mạnh - hiện tượng ion hóa;
Trong dung môi là chất ít phân cực: sự ion hóa không xảy ra.
Trong phân tử chất tan có nhiều kiểu liên kết:
liên kết ion: điện ly đầu tiên
liên kết cộng hóa trị phân cực mạnh: điện ly sau
liên kết cộng hóa trị phân cực yếu hoặc không phân cực: không điện ly. Ví dụ: NaHSO ↔ Na+ + HSO - 4 4 HSO - ↔ H+ + SO 2- 4 4
3. Cân bằng trong dung
dịch chất điện ly yếu
PHẢN ỨNG TRAO ĐỔI TRONG DUNG DỊCH ĐIỆN LY Xét một số phản ứng: AgNO + KCl = AgCl + KNO 3 3
2CH COOAg + CaCl = 2AgCl + (CH COO) Ca 3 2 3 2 AgNO
+ KClO = Không có kết tủa AgCl 3 2CH COOAg + Ca(ClO ) = Không 3. C có kết tủa ân bằng tr AgCl
ong d ung dịch chất 3 3 2
Tổng quát trong dung dịch có 4 ion A điện l + y , B+ yếu., X -, Y- thì sẽ hình thành cân bằng AX + BY AY + BX
Cân bằng sẽ lệch về phía có các hợp chất có tính chất sau:
Kém điện ly: KCN + HNO = HCN + KNO 3 3
Khó tan :Pb(NO ) + Na SO = PbSO + 2NaNO 3 2 2 4 4 3
Dễ bay hơi :Na S + 2HCl = 2NaCl + H S 2 2
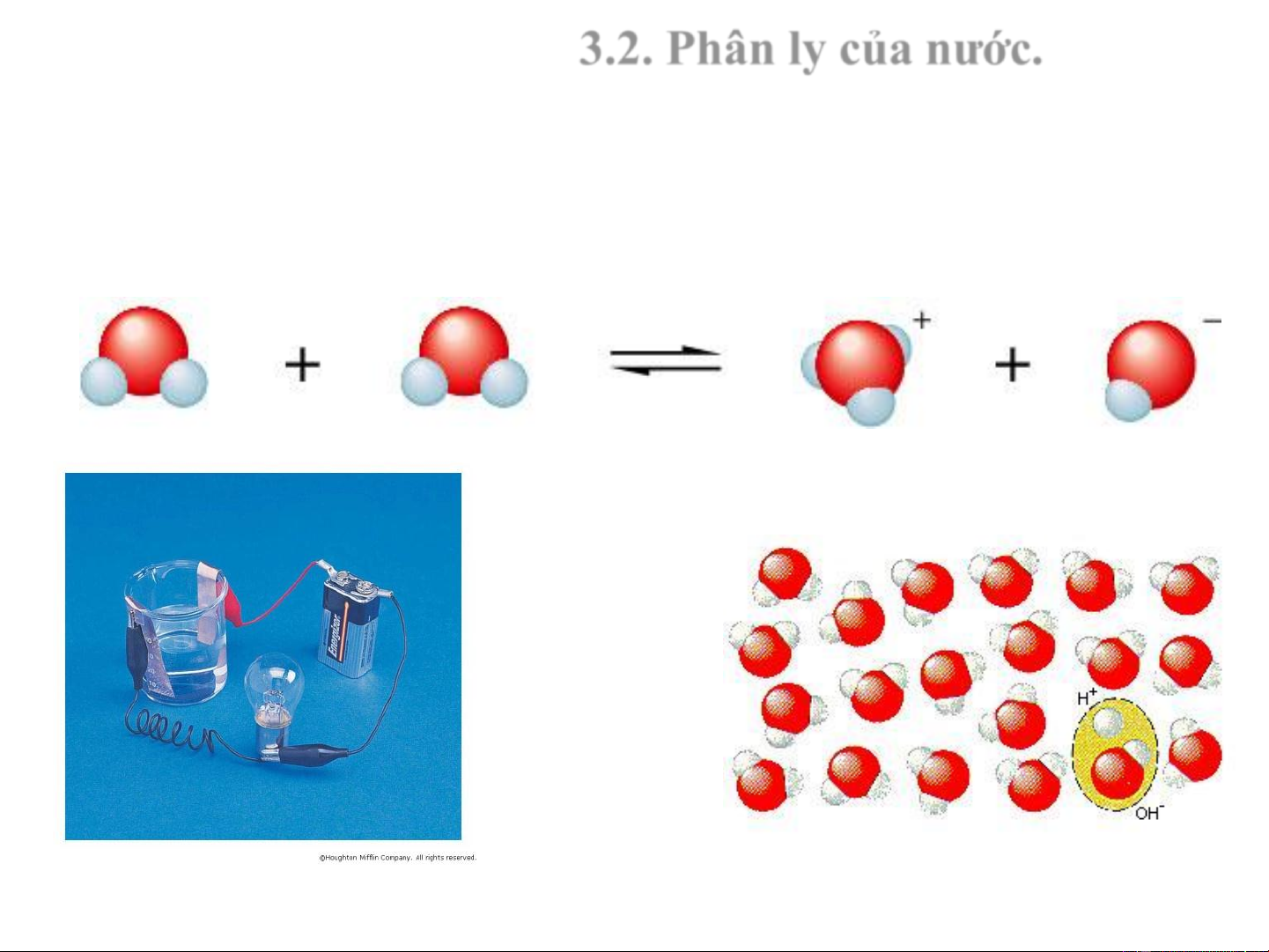
3.2. Phân ly của nước. Độ
dẫn điện của H O = 5,54.10-18-1.cm-1 2 H O H+ + OH- 2




