









Preview text:
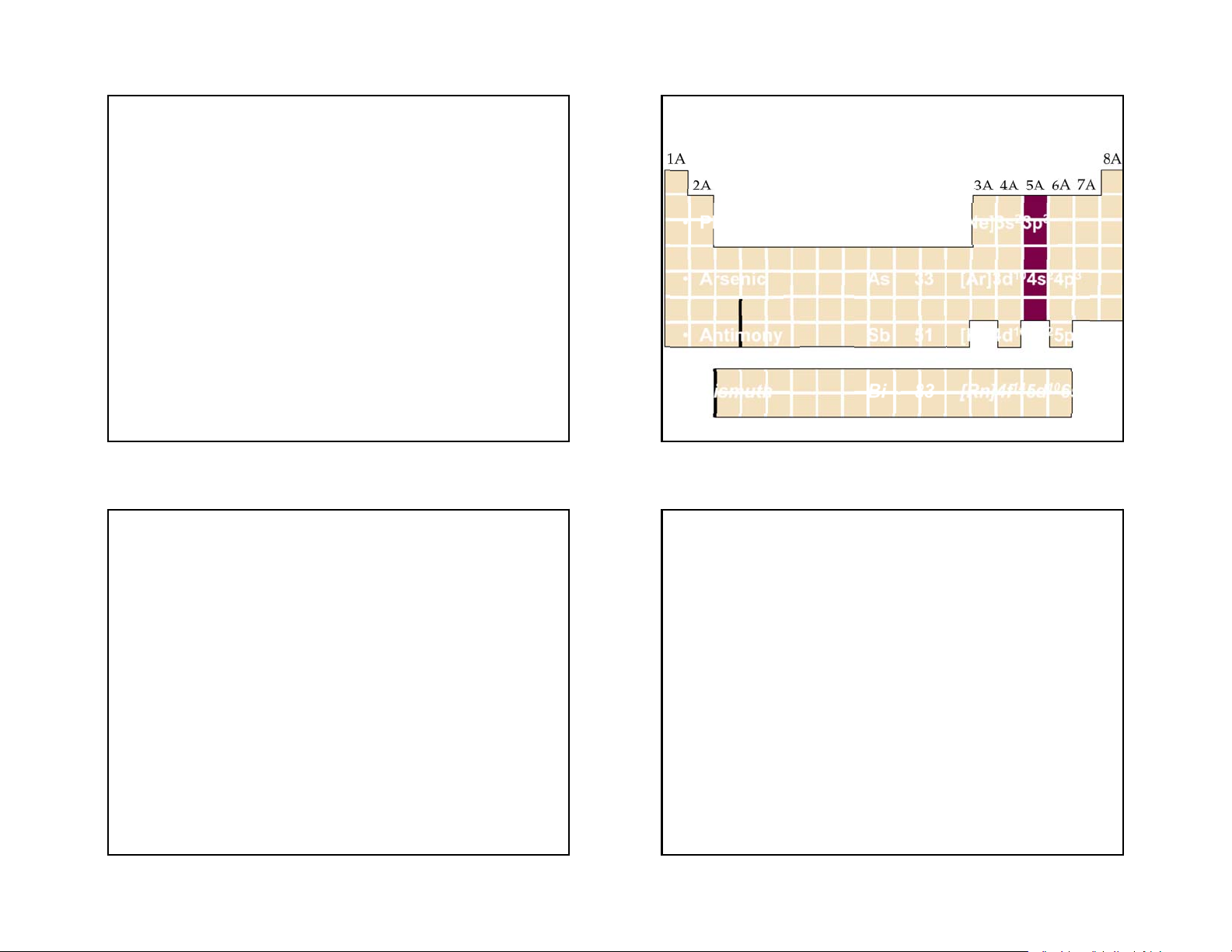
3/22/2018 GROUP VA • Nitrogen N 7 [He]2s22p3 Chương VII • Phosphorus P 15 [Ne]3s23p3 Các nguyên tố nhóm VA • Arsenic As 33 [Ar]3d104s24p3 • Antimony Sb 51 [Kr]4d105s25p3 • Bismuth Bi 83
[Rn]4f145d106s26p3 1
Department of Inorganic Chemistry - HUT Nitơ
N, P có tính phi kim, As thể hiện tính phi kim nhiều
Cấu tạo và tính chất lý học
hơn, Sb lưỡng tính, Bi tính kim loại
-Hai nguyên tử N trong phân tử liên kết với nhau bằng 3
- Số oxi hoá: +3 và +5, riêng N còn thêm (-3)
liên kết. Theo MO : (KK) 2 2 2 2 s s*2x =y z . Elk =941
- Độ bền của số oxi hoá + 3 và +5 tăng dần khi đi từ N KJ.mol-1. đến P
=>ở nhiệt độ thường N2 rất trơ về phương diện hoá học.
- Độ bền của số oxi hoá +3 tăng dần từ P đến Bi, còn
độ bền số oxi hoá +5 giảm dần.
- Ở điều kiện thường N2 là khí không màu, không mùi,
không vị, hoá lỏng ở -196oC và hoá rắn ở -210oC, ít tan
trong nước và dung môi hữu cơ, do có nhiệt độ sôi rất
thấp nên được sử dụng trong công nghiệp cũng như các
phòng thí nghiệm để tạo nhiệt độ thấp, tác nhân làm lạnh. 3 4 1 3/22/2018 Tính chất hoá học
- Ở nhiệt độ thường rất kém hoạt động hoá học chỉ
phản ứng với Li để tạo thành Li3N
- Ở nhiệt độ cao hoạt động hơn song vẫn kém, đa
số các phản ứng xảy ra phải có mặt xúc tác, ví dụ: N ⇄ 2 + 3H2
2NH3 xảy ra ở điều kiện nhiệt độ rất cao, có mặt xúc tác tcao N2+ O2 = 2NO 6 Điều chế N2
- Trong phòng thí nghiệm: NH 4NO2 N2 + 2H2O 2 o t C
NaN 3N 2 3 2 Na
- Trong công nghiệp: Hoá lỏng không khí và chưng cất phân đoạn 7 8 2 3/22/2018 Hợp chất NH3 Tính chất hoá học
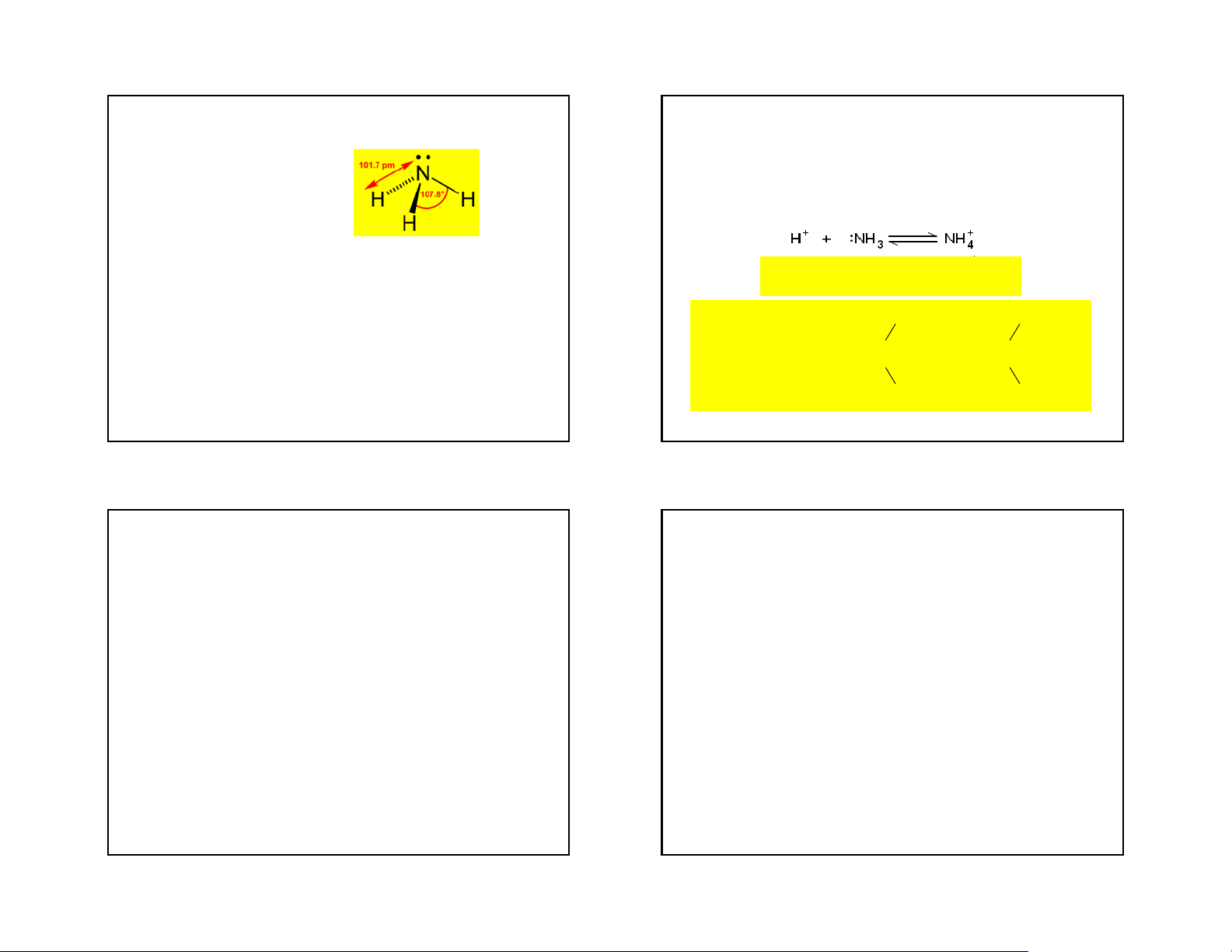
Cấu tạo và tính chất lý học -Có tính bazơ yếu NH +
3 + H2O ⇆ NH4 + OH-; Kb = 1,8.10-5 ở t= 25oC
- Phản ứng kết hợp: do N trong phân tử NH3 còn 1 cặp e chưa tham gia liên kết
-NH3 có tonc= -78oC và ts=-33oC (cao bất thường so với các
hợp chất khác trong cũng phân nhóm)
4NH Cu Cu(NH ) 2 2 3 3 4
- Độ hoà tan của NH3 trong nước cũng rất lớn. Ở điều kiện NH2 NH2
thường 1 lít nước có thể hoà tan được 700 lít khí NH3. Vì sao? 180 ,140 CO 2 o atm C 2 NH3 O C O C H2O
- Đây là khí không màu, mùi khai, xốc. NH3 lưu thông trên thị
trường thường ở dạng lỏng (nước) có nồng độ 25%, có khối ONH4 NH2 9
lượng riêng là 0,91 g/cm3. Amoni cacbamat Ure 10 Điều chế NH3
- Ph¶n øng thÓ hiÖn tÝnh khö: to -Trong phòng thí nghiệm: 4NH + 3O → 2N + H O 3 2 2 2 toC to= 800oC, Pt
NH Cl + Ca(OH) → 2NH + CaCl + 2H O 4 2 3 2 2 4NH + 5O → 4NO + 6H O 3 2 2 8NH + 3Br → N + 6NH Br 3(K,L) 2 2 4
-Trong công nghiệp: Đi từ N2 và H2 to,p,xt - Ph¶n øng thÕ: N (K) + 3H (K) → 2NH (K) to = 400oC 2 2 3 2Na + 2NH → 2NaNH + H 3 2 2 11 12 3 3/22/2018 380-450oC; 220atm
1/2N2(k) + 3/2H2(k) NH3(k)
Fe+1%K2O, CaO+3%Al2O3,SiO2,MgO o H 46.19 298 kJ o G 16.63 298 kJ
C 2 1 2 3 f (T , P, k N / H ) 2 2 P = 1 atm T thường
Hiệu suất chuyển hóa ~ 17 % Haber Process H ~ 100%
Department of Inorganic Chemistry - HUT Muối amoni:
-Không mầu, tan trong nước -Có chứa ion NH + 4 , có tính axít -Dễ bị nhiệt phân: to NH Cl(r) → NH (K) + HCl(K) 4 3 to
(NH ) CO → NH (K) + CO (K) + H O(h) 4 2 3 3 2 2 to NH NO → N + 2H O 4 2 2 2 to NH NO → N O + 2H O 4 3 2 2 16
Department of Inorganic Chemistry - HUT 4 3/22/2018 Các oxit của nitơ
+ Có khả năng tạo thành các dime N2O2 => vì sao?
Các oxit của nitơ đó là N2O, NO, N2O3, NO2, N2O5,
trong đó các oxit quan trọng đó là NO và NO2
+ Dễ dàng kết hợp với O2 tạo thành khí NO2: 2NO + O Khí NO 2 = 2NO2
- Không màu, rất độc, khó hoà tan trong nước, ở 0oC 1
lít nước hoà tan được 0,074 lít NO, to
+ Tương tác với Cl2, Br2 tạo thành nitrozoni halogenua: nc= -163oC, ts= - 150oC 2NO + Cl2 = 2NOCl
- Cấu hình electron của NO (KK) 2 2 2 2 s s*2x =y z *1,
có bậc liên kết là 2,5, có tính thuận từ.
- Phân tử NO tương đối bền và kém hoạt động hoá học 17 18 Mưa axit + Trong phòng thí nghiệm:
3Cu + 8HNO (loãng) = 3Cu(NO ) + 2NO + 4H O 3 3 2 2
2NaNO + 2NaI + 4H SO = 2NO + I + 2H O + 4NaHSO 2 2 4 2 2 4
+ NO tạo ra khi có sấm sét, hoặc từ các quá trình đốt
cháy các nhiên liệu hoá thạch, của các động cơ đốt trong.
+ Đây là một trong những khí gây khói mù quang
hoá, góp phần cùng với một số khí khác gây nên mưa axit. 19 20 5 3/22/2018 Khí NO2
- Ở điều kiện thường là chất khí màu nâu, nặng
hơn không khí có mùi khó chịu và rất độc, có cấu
- Điều chế trong phòng thí nghiệm:
tạo góc gẫy, góc liên kết ONO là 134o, cũng có 1e t=400oC
độc thân trong phân tử, nên có tính thuận từ 2Pb(NO 3)2 2PbO + 4NO2 + O2 -2NO ⇆ Cu + 4HNO 2 N2O4, ΔH < 0
3(đặc) = Cu(NO3)2 + 2NO2 + 2H2O -NO2 là oxit axit : + 2NO2 + H2O = HNO3 + HNO2 + phản ứng với kiềm:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O 21 22 Khí N2O Axit nitric Tính chất lý học
- Ở điều kiện thường là chất lỏng không màu, bốc
khói mạnh trong không khí, tnc=-41,6oC,ts= 82,6oC,
có khả năng hoà tan trong nước theo bất cứ tỷ lệ
nào, tạo với nước một hỗn hợp đồng sôi chứa 69,2% axit và sôi ở 122oC.
- Axit nitric kém bền, dễ bị phân huỷ dưới tác dụng
của ánh sáng và nhiệt độ:
4HNO3 = 4NO2 + O2 + 2H2O, NO2 sinh ra hoà tan
trong axit làm cho axit có màu vàng. 23 24 6 3/22/2018 Tính chất hoá học
- Có tính oxy hoá mạnh, HNO
+ Có khả năng oxi hoá được một số phi kim có độ 3 có thể oxi hoá được
hầu hết các kim loại, cả một số kim loại kém hoạt âm điện nhỏ như C, P, S
động hoá học như Cu, Ag, Hg
S + 6HNO3(đặc) = H2SO4 + 6NO2 + 2H2O
+ Kim loại + HNO3 …..NO2….
- Hỗn hợp 1V HNO3 đặc với 3V HCl đặc được gọi
+ Kim loại kém hoạt động + HNO
là nước cường toan (cường thủy). Nước cường 3 loãng => …. NO…
toan có thể hoà tan được các kim loại rất trơ như
+ Kim loại hoạt động + HNO3 loãng => …. NO… còn Au, Pt, Rh, Ir,…Ví dụ: có thể là N + 2O, N2, NH4
tuỳ thuộc vào nồng độ của
axit và độ hoạt động của kim loại:
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
4Zn + 10HNO3(loãng) = 4Zn(NO3)2 + NH4NO3 + 3H2O
(sản phẩm có thể là NO, N2, N2O) 25 26 Điều chế axit HNO3 - Muối nitrat:
-Trong công nghiệp axit HNO3 được điều chế đi từ NH3 :
+ Hầu hết các muối nitrat đều dễ tan trong nước, Pt-Rh,t=800-900oC
bền ở nhiệt độ thường. 4NH 3 + O2 4NO + 6H2O
+ Nitrat của các kim loại hoạt động như kim loại 2NO + O2 = 2NO2
kiềm khi nhiệt phân tạo thành nitrit:
3NO2 + H2O = 2HNO3 + NO, NO sinh ra do quá trình hoà
tan lại quay trở lại quy trình 2KNO 3 2KNO2 + O2
+ Nitrat của các kim loại kém hoạt động như bạc, - Trong phòng thí nghiệm:
thuỷ ngân khi nhiệt phân tạo thành kim loại:
Có thể điều chế HNO3 tinh khiết : Hg(NO Hg + 2NO 2N 3)2 2 + O2 2O4 + O2 + 2H2O = 4HNO3
+ Nitrat của các kim loại nằm giữa hai loại trên khi
nhiệt phân tạo thành oxit kim loại, ví dụ: 2Pb(NO 3)2 2PbO + 4NO2 + O2 27 28 7 3/22/2018 Axit nitrơ Axit yếu có K -Ion NO -
a= 4.10-4, có thể tồn tại ở trạng thái khí 3
và trong dung dịch nước. Ở trạng thái khí có cân
+ Trong môi trường trung tính hầu như không thể hiện bằng sau: tính oxi hoá 2HNO ⇋ 2 NO + NO2 + H2O
+ Trong môi trường axit nó có khả năng như axit HNO3, Dung dịch của axit HNO
sản phẩm của phản ứng khử còn tuỳ thuộc vào nồng độ
2 không bền, dễ bị phân huỷ,
nhất là khi được đun nóng:
axít, bản chất của chất khử (NO + 2, HNO2, NO, N2, NH4 ) 3HNO
+ Trong môi trường kiềm nó bị một số kim loại như Al, Zn 2 = HNO3 + H2O + 2NO khử đến NH
Do không bền nên axit nitrơ rất hoạt động hoá học, 3
vừa thể hiện tính oxi hoá và vừa thể hiện tính khử: NO -
3 + 4Zn + 7OH- + 6H2O = 4[Zn(OH)4]2- + NH3 HNO2 + e + H+ = NO + H2O o= 1,00V NO -
3 + 2e + 3H+ = HNO2 + H2O o = 0,94V 29 30 Phốt pho
* Axit HNO2 oxi hoá được HI đến I2, SO2 đến Tính chất lý học
H2SO4, Fe2+ đến Fe3+ và sản phẩm khử là NO
Có nhiều dạng thù hình: P trắng, P đỏ và P đen 2HI + 2HNO2 = 2NO + I2 + 2H2O
* Phản ứng với các chất oxi hoá mạnh như KMnO4,
MnO2, PbO2 axit HNO2 được oxi hoá thành axit HNO3:
2KMnO4 + 3H2SO4 + 5HNO2 = 2MnSO4 + 5HNO3 + K2SO4 + 3H2O
* Muối của axit nitrit bền hơn axit, hầu hết dễ tan
trong nước, trừ AgNO2 thường gặp ít tan. Trong môi trường axit NO -
2 có tính oxi hoá khử như HNO2. 31 32 8 3/22/2018 P4 Mp ~ 44.2 oC - Phốt pho trắng:
+ Cấu trúc kiểu mạng lưới, gồm những phân tử P4, tnc
= 44oC, ts = 257oC, dễ tan trong các dung môi: CS2 và benzen.
+ Ptrắng là dạng ít bền nhất của phốt pho về mặt nhiệt
động học. Tuy nhiên Ptrắng là trường hợp đặc biệt
được chọn làm trạng thái chuẩn của P (Ho298,s = 0
và Go298,s= 0). Ptrắng chuyển thành Pđỏ trong điều
kiện t= 270oC trong khoảng 48 giờ P∞ Mp ~ 600 oC o o o P P 270 C, h
48 P P 800 C P 3000 C P 34 ,black ,red 4 4,liquid 2
- Pđỏ là chất vô định hình gồm các phân tử P, tnc=
600oC, ở áp suất cao thăng hoa tạo thành hơi gồm Tính chất hoá học
các phân tử P4. Hơi này ngưng tụ tạo thành Ptrắng. Pđỏ
có những tính chất khác nhau, như tỉ khối của chúng - P hoạt động hơn N
biến đổi từ 2 đến 2,4 g/cm3, màu sắc biến đổi từ màu
- P tồn tại ở ba dạng thù hình, trong đó nâu đến đỏ rồi tím.
Ptrắng hoạt động nhất, Pđen kém hoạt động - P nhất.
đen được tạo ra khi đun nóng Ptrắng ở 220- 370oC
dưới áp suất 12.000 atm có Hg làm xúc tác. Pđen cũng
là chất vô định hình gồm các phân tử P.
- Pđỏ và Pđen bền hơn nhiều so với Ptrắng nên chúng có
nhiều tính chất khác so với Ptrắng: tnc cao hơn nhiều,
không tan trong các dung môi, ít độc và hoạt động hoá học yếu hơn. 35 36 9 3/22/2018 - Phản ứng với O2
+ Ptrắng bị oxi hoá chậm trong không khí ở nhiệt độ thường
kèm theo sự phát quang, ở 35oC Ptrắng tự bốc cháy, còn Pđỏ
ở t= 250oC, Pđen ở t= 400oC. Khi P cháy: 4P + 5O2 = 2P2O5 (P4O10) - dư O2 4P + 3O2 = P4O6 (2P2O3) - thiếu O2
+ Phản ứng tương tự với các halogen:
2P + 3Cl2 = 2PCl3 (thiếu Cl2) 4P + 5Cl2 = 4PCl5 (dư Cl2)
- Phản ứng với kim loại (thể hiện tính khử): 2P + 3Ca = Ca 37 3P2
Department of Inorganic Chemistry - HUT
Hợp chất với số oxi hoá (+5) của P * Axit orthophotphoric H3PO4 - Tính chất lý học:
P4O10 : Chất rắn trắng, thăng hoa ở 360oC dưới áp suất 1
+ là chất rắn không màu, t
atm, rất háo nước, hút nước của axit HNO nc=42,35oC, khi đó 3, H2SO4 tạo
chuyển thành chất lỏng sánh. H thành N 3PO4 bền hơn 2O5 và SO3.
nhiều so với axit HNO3, có thể là do ở P có các
ocbitan d cũng tham gia liên kết. Sự hydrat hoá của P
+ Khi đun nóng axit photphoric mất dần nước
4O10 tạo ra hỗn hợp các axit photphoric
có thành phần biến đổi phụ thuộc vào điều kiện thí nghiệm:
(quá trình ngược với quá trình tác dụng với P nước) 4O10 + 2H2O = (HPO3)n - axit metaphotphoric
P4O10 + 4H2O = 2H4P2O7 - axit diphotphoric P4O10 + 6H2O = 4H3PO4 - axit orthophotphoric 39 40 10 3/22/2018 - Tính chất hoá học:
+ Sự thuỷ phân của muối phốt phát:
+ Là axit ba lần axit, axit trung bình với hằng số cân Muối phốt phát PO 3- 4
của các kim loại kiềm thuỷ bằng axit tương ứng:
phân rất mạnh tạo ra môi trường kiềm H ⇆ - 3PO4 H+ + H2PO4 K1= 7,6.10-3 PO 3- 2- 4 + H2O ⇆ HPO4 + OH- H - ⇆ 2- 2PO4 H+ + HPO4 K2= 6,2.10-8
Muối hydrophotphat thuỷ phân yếu hơn, tạo ra môi HPO 2- ⇆ 3-
trường kiềm yếu (lưỡng tính): HPO 2- 4 H+ + PO4 K3= 4,4.10-13 4
Muối dihydrophotphat có tính axit vì phản ứng thể
hiện tính axit mạnh hơn so với phản ứng thể hiện tính bazơ.
Ví dụ: Dung dịch Na3PO4 1% có pH = 12,1,
Na2HPO4 1% có pH= 8,9, NaH2PO4 1% có pH = 6,4 41 42 * Axit photphorơ H3PO3
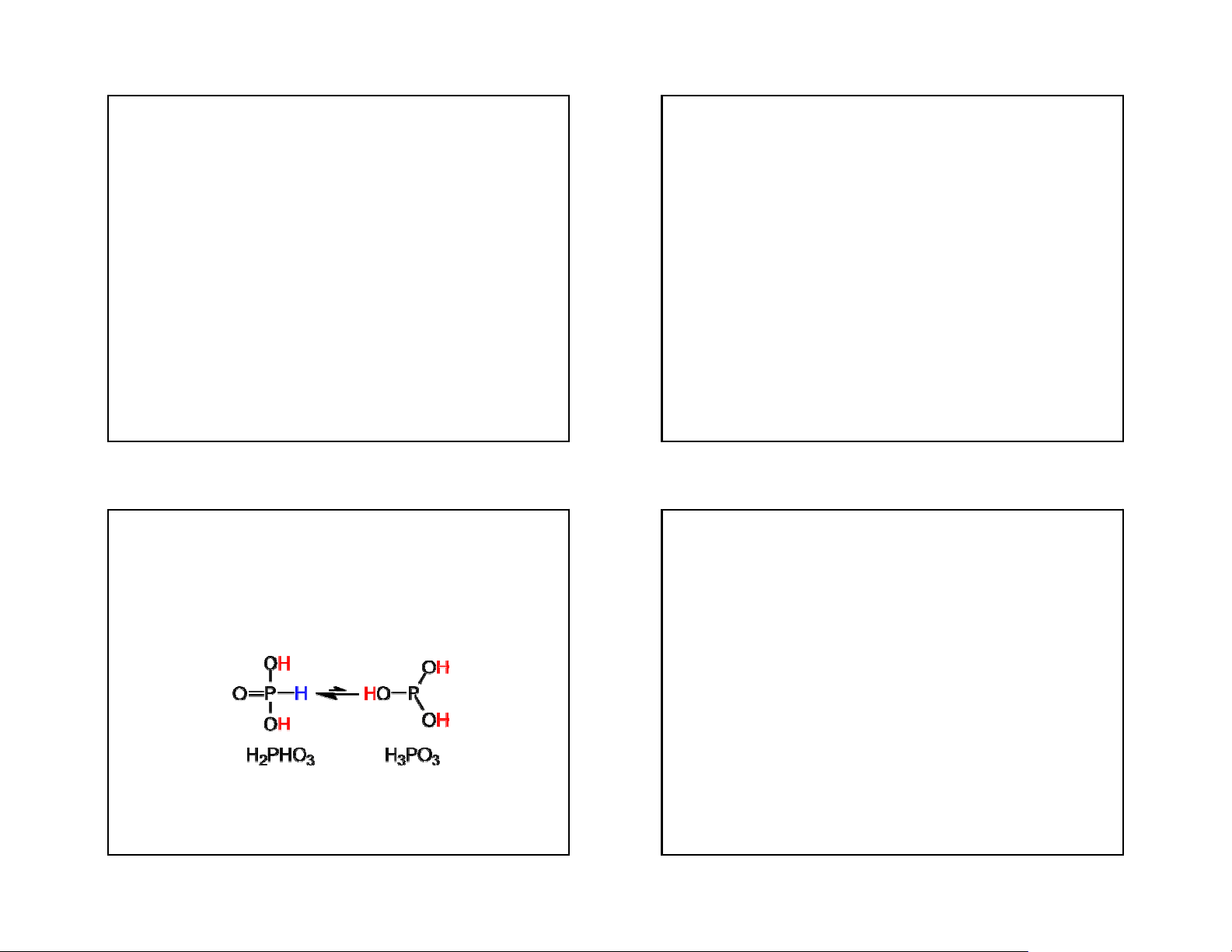
- Là chất rắn, không màu, tnc=70oC, dễ tan trong nước.
- H3PO3 có tính oxi hoá nhưng yếu. Khi bị đun
- Axit photphorơ là axit hai lần axit
nóng xảy ra phản ứng tự oxy hoá khử: 4H3PO3 = 3H3PO4 + PH3
- Là chất khử mạnh: Nó có thể khử được muối
của các kim loại yếu như Cu, Hg về kim loại, ví dụ:
H3PO3 + HgCl2 + H2O = H3PO4 + Hg + 2HCl 43 44 11 3/22/2018 ASEN, ANTIMON, BITMUS
1. Sb trong không khí ở nhiệt độ thường không biến đổi.
2. As, Bi bị oxi hóa trên bề mặt.
3. Khi đun nóng, đều tạo oxit với số OXH +III.
''Lập loè ngọn lửa ma chơi
Tiếng oan văng vẳng tối trời càng thương''
4. Ở dạng bột mịn đều cháy trong khí quyển Clo ở nhiệt
(Văn chiêu hồn - Nguyễn Du)
độ thường tạo triclorua XCl3.
Đó là ngọn lửa lập loè yếu nhạt, bập bùng lan toả theo chiều gió, chốc lại
5. Khi đun nóng phản ứng với cả Br, I, S và một số kim
biến mất rồi từ chỗ cũ, chốc chốc lại lập loè ngọn lửa xanh nhạt, loáng
thoáng bay lên. Theo các cụ già giải thích thì đó là oan hồn của những loại.
người chết trận, của những nắm xương vô thừa nhận không người chôn
cất, vất vưởng trên bãi chiến trường, trong bãi tha ma, hoặc trên cánh
Thể hiện tính khử. 45
đồng không mông quạnh….
Department of Inorganic Chemistry - HUT
3As 5HNO 2H O 3H AsO 5
Bi(OH ) Cl 3NaOH
NaBiO 2NaCl 3H O 3 2 3 4 NO 3 2 3 2
Bi3+ có tính khử yếu chỉ tạo Bi5+ với chất OXH mạnh
1.Không tác dụng với nước.
trong môi trường kiềm mạnh và đặc.
2.Không đẩy hidro ra khỏi axit. 2 3
5KBiO (r) 2Mn 14H Bi 2MnO 5K 7 3 4 H2O
3Sb 10HNO (x 5)H O
3Sb O .xH O 1 0 3 2 2 5 2 NO Bi5+ có tính oxi hóa mạnh
1. Tính bền số OXH +V giảm dần tính OXH tăng dần 2 2
2. Tính bền số OXH +III tăng dần tính KH giảm dần H AsO I H H AsO I H O 3 4 3 3 2 2
Tính OXH trung bình trong môi trường axit
Bi 4HNO
Bi(NO ) NO 2 3 3 3 H2O
Tính KH trung bình trong môi trường kiềm, trung tính
Department of Inorganic Chemistry - HUT
Department of Inorganic Chemistry - HUT 12 3/22/2018
As O 3H O 2 2 5 2 H3 As 4 O Axit asenic
SbCl H O SbOCl 2 HCl
As O 6H O 4H AsO 4H O 4 3 2 4 6 2 3 3 2 2 HAsO Axit asenơ Axit metaasenơ Antimonyl clorua (
Bi NO ) H O BiONO 2 3 3 2 3 3 HNO 3 X 3OH
X (OH ) XO(OH ) 3 Bitmutyl nitrate
Department of Inorganic Chemistry - HUT
Department of Inorganic Chemistry - HUT 13



