














Preview text:
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA Chuyên đề
PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHỨC TRONG TRONG DUNG DỊCH BỒI DƯỠNG HỌC SINH GIỎI Nhóm Hóa học
Trường THPT Chuyên Chu Văn An, Lạng Sơn I. ĐẶT VẤN ĐỀ
Trong chương trình phổ thông chuyên đặc biệt là trong ôn thi HSG, phần hoá học phức chất là một phần
khá trừu tượng và gây nhiều khó khăn cho học sinh để hiểu và vận dụng thành thạo. Khi học về phần này, nếu
chỉ sử dụng sách giáo khoa chuyên thì học sinh khó hình dung và khó áp dụng các kiến thức vào giải các BTHH
có liên quan. Do đó, để giúp hoc sinh tiếp cận kiến thức cơ bản về phức chất và biết áp dụng vào giải các bài
tập nhất là bài tập về cân bằng tạo phức trong dung dịch, chúng tôi xây dựng chuyên đề “PHỨC CHẤT VÀ
BÀI TẬP CÂN BẰNG TẠO PHỨC TRONG TRONG DUNG DỊCH BỒI DƯỠNG HỌC SINH GIỎI” II. NỘI DUNG A. Mục tiêu: * Về kiến thức:
- Biết được khái niệm về phức chất, thành phần phức chất
- Biết gọi tên và các loại đồng phân của phức chất
- Biết dùng thuyết liên kết hóa trị để giải thích cấu tạo phức chất * Kĩ năng:
- Vận dụng kiến thưc làm các bài tập về cân bằng tạo phức trong dung dịch.
B. Tài liệu tham khảo:
1. Hoá học vô cơ tập III. Hoàng Nhâm (trang 3 - 46)
2. Hoá học đại cương 1. Cấu tạo chất. Trần Thành Huế (397-422)
3. Hoá học phân tích. Câu hỏi và bài tập. Nguyễn Tinh Dung, Đào Thị Phương Diệp (167-177)
C. Tìm hiểu đại cương về phức chất: I. KHÁI NIỆM: 1. Khái niệm:
* Phức chất: là hợp chất phức tạp được tạo thành từ ion phức và ion trái dấu (hoặc các phân tử trung hoà).
* Ion phức: thường được hình thành bởi cation kim loại (thường là các ion kim loại chuyển tiếp) liên kết với
các ion trái dấu hoặc phân tử có cực. Trong phức chất ion phức được đặt trong dấu [ ].
Vd: [Ag(NH3)2]Cl; ion phức là [Ag(NH3)2]+ 2. Thành phần:
* Cầu nội: là ion phức được tạo bởi:
+ Ion (nguyên tử) trung tâm: là ion kim loại tạo phức
+ Phối tử: các ion trái dấu và phân tử phân cực liên kết trực tiếp với ion trung tâm
+ Số phối trí: số lượng phối tử liên kết trực tiếp với ion trung tâm
* Cầu ngoại: là phần ion trái dấu liên kết với ion phức:
Vd: phức chất [Ag(NH3)2]Cl có
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 1
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 2 cầu nội: [Ag(NH3)2]+ ion trung tâm là: Ag+ phối tử là: NH3
số phối trí của Ag+ là: 2 cầu ngoại: Cl- II. DANH PHÁP
* số phối tử:
- Phối tử 1 càng dùng tiếp đầu ngữ: đi, tri, tetra; penta, hexa…tương ứng với 2, 3, 4, 5, 6…
- Phối tử nhiều càng dùng tiếp đầu ngữ: bis; tris; tetrakis; pentakis; hexakis…tương ứng với 2, 3, 4, 5, 6…
* Tên phối tử:
- Nếu phối tử là anion: tên anion + “o” F- floro S 2- 2O3 tiosunfato Cl- cloro C 2- 2O4 oxalato Br- bromo CO 2- 3 cacbonato I- iođo HO- hiđroxo NO - 2 nitro CN- xiano ONO- nitrito SCN- tioxianato SO 2- 3 sunfito NCS- isotioxianato
- Nếu phối tử là phân tử trung hoà: tên của phân tử đó: C2H4: etylen; C5H5N: pyriđin; CH3NH2: metylamin…
- Một số phân tử trung hoà có tên riêng: H2O: aqua; NH3: ammin; CO: cacbonyl; NO: nitrozyl
Chú ý: tên phối tử trong phức: gọi tên theo trình tự chữ cái của anion rồi đến phối tử trung hoà.
1. Cation phức: phức chất với cầu nội là ion dương:
Số phối trí + tên phối tử + tên ion trung tâm (hoá trị) + tên cầu ngoại
Vd: [Ag(NH3)2]Cl: điamminbạc(I) clorua
[Cu(NH2CH2CH2NH2)2]SO4: bisetylenđiamin đồng (II) sunfat
[Co(H2O)5Cl]Cl2: cloropentaaquacoban(III) clorua
2. Anion phức: phức chất với cầu nội là anion:
Tên cầu ngoại + số phối tử + tên phối tử + tên ion trung tâm“at” (hoá trị) (tên latinh)
K3[Fe(CN)6]: Kali hexaxianoferat (III)
Na[Al(OH)4]: Natri tetrahiđroxoaluminat (III) 3. Phức trung hoà:
Gọi tương tự như cation phức nhưng tên ion trung tâm thì gọi theo tên latinh:
[Pt(NH3)2Cl2] điclođiamminplatin (II)
[Co(H2O)4Cl2] điclotetraaquacobant (II)
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA III. ĐỒNG PHÂN
1. Đồng phân hiđrat hóa: là những chất có cùng thành phần nhưng khác nhau về chức năng (đặc điểm liên
kết) của các phân tử nước trong thành phần của phức chất.
Vd: [Cr(H2O)6]Cl3: xanh hơi tím, tạo kết tủa với AgNO3 theo tỉ lệ số mol 1:3
[Cr(H2O)5Cl]Cl2: màu lục, tạo kết tủa với AgNO3 theo tỉ lệ số mol 1:2
[Cr(H2O)4Cl2]Cl: màu lục, tạo kết tủa với AgNO3 theo tỉ lệ số mol 1:1
2. Metame ion hoá: là những chất có cùng thành phần nhưng trong nước phân li thành các ion khác. Vd: [Co(NH 2-
3)5Br]SO4 [Co(NH3)5Br]2+ + SO4
[Co(NH3)5 SO4]Br [Co(NH3)5SO4]+ + Br-
3. Đồng phân muối: là các chất có cùng thành phần nhưng phối tử của chúng là đồng phân vô cơ của nhau.
Vd: [Co(NH3)5NO2]X: xanto màu vàng, không bị thuỷ phân trong môi trường axit
[Co(NH3)5ONO]X: isoxanto màu nâu tươi, thuỷ phân khi tác dụng với axit gp NO2
4. Đồng phân phối trí: là những chất có cùng khối lượng phân tử nhưng có sự phân bố khác nhau của các
phối tử trong thành phần của các ion phức tạo nên phân tử hợp chất.
[Co(NH3)6]Cl3 + K3[Cr(CN)6] 3KCl + [Co(NH3)6] [Cr(CN)6]
[Cr(NH3)6]Cl3 + K3[Co(CN)6] 3KCl + [Cr(NH3)6] [Co(CN)6]
5. Đồng phân hình học: là những hợp chất có cùng công thức phân tử nhưng có sự phân bố khác nhau của
các phối tử xung quanh ion trung tâm:
Vd: [Pt(NH3)2Cl2] tồn tại hai đồng phân cis – trans: H3N Cl- Cl- NH3 Pt2+ Pt2+ H3N Cl- H3N Cl-
Cis điclorođiammin platin (II)
Trans điclorođiammin platin (II) (da cam) (vàng nhạt)
6. Đồng phân quang học: là những chất có cùng khối lượng phân tử, các phân tử của chúng không có tâm đối
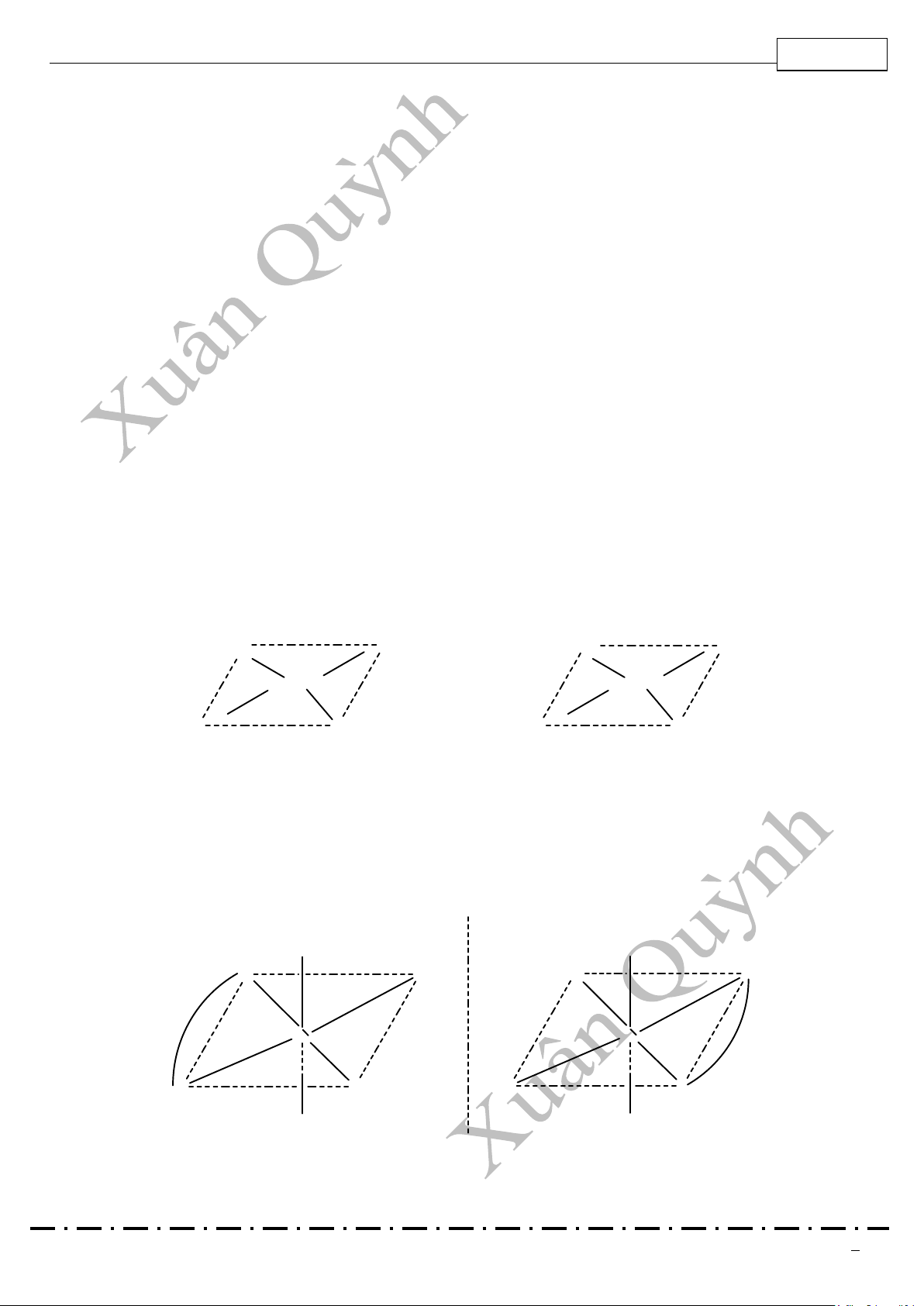
xứng và không có mặt phẳng đối xứng. Do đó chúng có khả năng làm quay mặt phẳng phân cực của ánh sang Vd: Cl Cl N Cl Cl N Co Co N NH3 H3N N NH3 NH3
IV. GIẢI THÍCH LIÊN KẾT TRONG PHỨC CHẤT
* Thuyết liên kết hoá trị
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 3
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 4 1. Luận điểm
Liên kết hoá học hình thành trong phức chất được thực hiện bởi sự xen phủ giữa AO chứa cặp e riêng
của phối tử với AO lai hoá trống có định hướng không gian thích hợp của hạt trung tâm.
2. Một số trường hợp lai hoá Dạng lai hoá Dạng hình học Một số ion trung tâm sp đường thẳng Ag+; Cu+… sp3 tứ diện
Fe3+; Al3+; Zn2+; Co2+; Ti3+… dsp2 vuông phẳng
Pt2+; Pd2+; Cu2+; Ni2+; Au3+… d2sp3 hoặc sp3d2 bát diện
Cr3+; Co3+; Fe3+; Pt4+; Rh3+…
3. Cường độ của phối tử
- Các phối tử có tương tác khác nhau đến ion trung tâm, nó ảnh hưởng đến trạng thái lai hoá của ion trung tâm
và từ tính của phức. Khả năng tương tác của các phối tử được xếp theo trình tự sau: I-2- -
2O4 - Dãy phối tử được gọi là dãy quang phổ hoá học, những phối tử đứng trước có trường yếu hơn phối tử đứng sau.
Thường những phối tử đứng trước NH3 gây trường yếu, đứng sau NH3 gây trường mạnh.
4. Các bước xác định cấu trúc ion phức
Bước 1: Xác định cấu hình của ion trung tâm
Bước 2: Dựa vào đặc điểm của phối tử (mạnh hay yếu) để xác định lai hoá của ion trung tâm.
Bước 3: Viết giản đồ lai hoá AO của ion trung tâm và sự phân bố e của ion phức
Bước 4: Trên cơ sở cấu hình e của phức, xác định các tính chất của phức theo VB.
- Từ tính: thuận từ có e độc thân; nghịch từ e đã ghép đôi
- Quang phổ của phức: màu của phức chất Vd: [Co(CN)6]3- Ion Co3+:
CN- là phối tử trường mạnh nên có sự dồn electron. Ion Co3+ ở trạng thái lai hoá d2sp3 d2sp3
Dạng hình học của ion phức: CN- CN- CN- Co3+ CN- CN- CN-
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA
Ion phức không còn electron độc thân nên có tính nghịch từ Vd 2: [CoF6]3- Ion Co3+:
F- là phối tử trường yếu không có hiện tượng dồn e. Ion Co3+ ở trạng thái lai hóa sp3d2 sp3d2
Dạng hình học của ion phức: F- F- F- Co3+ F- F- F-
Ion phức còn electron độc thân nên có tính thuận từ
5. Ưu điểm và hạn chế - Ưu điểm:
+ Giải thích đơn giản liên kết hình thành và dạng hình học của phức chất
+ Giải thích được từ tính của phức chất - Nhược điểm:
+ Không giải thích được màu của phức chất V. TÍNH CHẤT 1. Cân bằng ion:
Khi tan trong nước đa số các phức ion điện li ra ion phức và ion trái dấu:
[Cu(NH3)4](OH)2 [Cu(NH3)4]2+ + 2HO-
K3[Fe(CN)6] 3K+ + [Fe(CN)6]3-
[Co(NH3)5Cl]Cl2 [Co(NH3)5Cl]2+ + 2Cl-
2. Cân bằng sonvat. Hằng số không bền: a. Khái niệm
- Cân bằng sonvat là quá trình ion phức thay thế các phối tử ban đầu bằng phần tử dung môi: Vd:
[Ag(NH3)2]+ + 2H2O [Ag(H2O)2]+ + 2NH3
- Để đơn giản có thể bỏ qua sự có mặt của nước trong phương trình: [Ag(NH3)2]+ Ag+ + 2NH3 Ag NH32
- Biểu thức hằng số cân bằng của quá trình trên: K 10 Ag(NH ) 3 2 7,24
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 5
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 6
- Hằng số K là đại lượng đặc trưng cho độ bền của ion phức trong dung dịch, được gọi là hằng số không bền và kí hiệu là Kkb: 1 K K b kb
- Hằng số Kb càng lớn thì Kkb càng nhỏ, phức chất càng bền
- Quá trình tạo thành và phân li của ion phức xảy ra theo từng nấc, ứng với mỗi nấc có hằng số Kb và Kkb riêng: Vd: Ag+ + NH3 [Ag(NH3)] Kb1 = 103,32
[Ag(NH3)]+ + NH3 [Ag(NH3)2]+ Kb2 = 103,92
b. Các yếu tố ảnh hưởng tới độ bền của phức chất
- Bán kính, điện tích của ion trung tâm và của phối tử: bán kính càng nhỏ, điện tích càng lớn thì phức chất càng bền
Vd: [Co(NH3)6]2+ có Kb = 2,45.104; [Co(NH3)6]3+ có Kb=1,99.1035
- Tỉ lệ kích thước giữa ion trung tâm và phối tử: tỉ lệ càng tương đương phức chất càng bền
- Số phối trí: phức có số phối trí cực đại bền hơn có số phối trí thấp
- Spin của ion trung tâm trong phức: Phức spin thấp bền hơn phức spin cao:
Vd: [Co(SCN)4]2- có Kb= 1,8.102 ; [Co(CN)6]4- có Kb= 1019
3. Tính axit – bazơ của phức
- Sau khi hình thành liên kết trong phức chất, một phần mật độ e của phối tử di chuyển về phía ion trung tâm
làm cho các liên kết của phối tử phân cực hơn, nên một số phối tử RH có khả năng nhường proton lớn hơn phân
tử hoặc ion tự do, điển hình là nước:
[M(H2O)n]m+ + H2O [M(H2O)(n-1)(OH)](m-1)+ + H3O+
[M(H2O)(n-1)(OH)](m-1)+ + H2O [M(H2O)(n-2)(OH)](m-2)+ + H3O+ v.v…
Vd: [Al(H2O)6]3+ + H2O [Al(H2O)5(OH)]2+ + H3O+ Ka = 1,3.10-5
- Cường độ tính axit-bazơ của phức phụ thuộc vào kích thước, điện tích và tính chất phân cực của ion trung
tâm, điện tích của ion phức, độ phân cực của RH ở dạng tự do, độ bền của phức trong dd và ảnh hưởng tương hỗ của các phối tử. 4. Tính oxi hoá-khử
- Sự tạo phức có ảnh hưởng lớn đến thế điện cực của kim loại chuyển tiếp:
Vd: xét nửa phản ứng: Fe3+ + e Fe2+ E0 = 0,77V Trong dd có chứa ion CN-:
[Fe(CN)6]3- + e [Fe(CN)6]4- E0’= ?
Theo phương trình Nerst có: C 3 Fe 44 C 3 K , 1 10 . 25 E0' E Fe . 059 , 0 lg 3 0 V 36 , 0 với Fe kb C 2 Fe 37 C 2 K , 1 10 . 25 Fe 2 Fe kb
Trong dd có chứa orthophenatrolin (Phen). Tính toán tương tự có:
[Fe(phen)3]3+ + e [Fe(phen)3]2+ E0” = 1,12V
- Thế của cặp oxi hoá khử phụ thuộc nhiều vào bản chất của phối tử.
D. Bài tập về cân bằng tạo phức trong dung dịch trong đề thi học sinh giỏi
I. Nguyên tắc chung trong tính toán cân bằng
- Mô tả trạng thái ban đầu của dung dịch.
- Xét các tương tác hoá học Xác định thành phần giới hạn (TPGH).
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA
- Mô tả các cân bằng (tính toán các hằng số cân bằng nếu cần). So sánh các hằng số cân bằng để rút ra cân
bằng chủ yếu (bỏ qua các cân bằng không đáng kể so với cân bằng chính) Đánh giá bán định lượng bản chất
của phản ứng trong dung dịch
- Đluật tác dụng khối lượng + đluật bảo toàn vật chất khác thiết lập các phương trình liên hệ.
II. Một số bài tập bài tập về cân bằng tạo phức trong dung dịch
Bài 1. a. Giải thích các dữ kiện sau đây: Ag+ + e Ag E0 = 0,799V [Ag(NH3)2]+ + e Ag + 2NH3 E0 = 0,379V
b. Tính hằng số không bền tổng cộng của phức chất [Ag(NH3)2]+ (ở 25oC) từ các dữ kiện trên. Hướng dẫn giải: Ag+ + e Ag E 0 1 = 0,799V K1 = 1013,64 [Ag(NH 0 3)2]+ + e Ag + 2NH3 E2 = 0,379V K2 = 106,40 [Ag(NH -1 3)2]+ Ag+ + 2NH3 Kkb = K2.K1 = 10-7,24
Bài 2. Để tách vàng người ta ngâm hỗn hợp đất, đá, quặng chứa vàng được nghiền mịn trong dung dịch NaCN
(hoặc KCN) và sục không khí nén liên tục vào dung dịch phản ứng trong ít ngày. Sau đó lọc thu dung dịch và
cho tác dụng với kẽm bột.
Viết các phương trình phản ứng xảy ra trong qui trình tách vàng nêu trên và tính hằng số cân bằng của các phản ứng đó.Cho biết: Eo - 2-
O + 2H O/4OH = + 0,4V; E0Au(CN)2 /Au = -0,60V; E0Zn(CN)4 /Zn = -1,26V 2 2 Hướng dẫn giải:
4Au + O2 + 8NaCN + 2H2O 4Na[Au(CN)2] +4NaOH K1 Zn + 2 Na[Au(CN)2] Na2[Zn(CN)4] + 2Au K2 4 x | Au + 2CN- Au(CN) - 0 2 + 1e -E1 = 0,60V O 0 2 + 2H2O + 4e 4OH- E3 = 0,4V 4Au + O2 + 8NaCN + 2H2O 4Na[Au(CN)2] +4NaOH => K1 = 1047,458 Zn + 4CN- Zn(CN) 2- 0 4 + 2e E2 = 1,26V 2x |Au(CN) - 0 2 + 1e Au + 2CN- E1 = -0,60V Zn + 2 Na[Au(CN)2] Na2[Zn(CN)4] + 2Au => K2 = 101,02
Bài 3. Khi tráng phim “ đen - trắng ”, lượng dư AgBr được loại khỏi phim âm bản bằng dung dịch Na2S2O3 do
tạo thành ion phức tan [Ag(S2O3)2]3- . Hãy tính độ tan ( mol.l-1 ) của AgBr trong dung dịch Na2S2O3 1,0 M .
Cho biết tích số tan Ks của AgBr là 5.10-13 và hằng số tạo phức β2 của ion [Ag(S2O3)2]3- là 4,7.1013.
Hướng dẫn giải: AgBr Ag+ + Br- Ks = 5.10-13 S S Ag+ + 2 S 2- 3- 2O3 Ag(S2O3)2 β2 =4,7.1013
Áp dụng định luật bảo toàn nồng độ đầu, ta có: 3 C S Ag Ag(S O ) 2 3 2 Ag 2 2 2
Ag Ag . S O 2
Ag .(1 S O ) 2 2 3 = 2 2 3 S Ag 2 2 1 S O 2 2 3
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 7
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 8 S 2 S Mà Br S
Ks= Br .Ag = S. = =5.10-13 2 2 2 1 S O 2 1 S O 2 2 3 2 2 3 2 2 1 3 13 2
S K (1 S O ) 5.10 .(1 4,7.10 .1 ) 4,85M s 2 2 3
Vậy độ tan của AgBr trong Na2S2O3 1,0 M là 4,85M. Bài 4.
1. Cân bằng sau xảy ra trong dung dịch nước ở 25oC: 2Cu+ ⇌ Cu2+ + Cu (r) (1)
a. Tính hằng số cân bằng K1 của phản ứng (1)
b. Một dung dịch chứa CuSO4 0,10M và Cu (r) rất dư. Tính nồng độ Cu+ ở trạng thái cân bằng
2. Kd của ion phức [Cu(NH3)2]+ là 1,0.10-16. Hỏi dung dịch NH3 0,20M có hòa tan hoàn toàn được 0,10 mol CuI (r) không ?
Cho biết các số liệu sau ở 25oC: Eo(Cu+/Cu) = +0,522V ; Eo(Cu2+/Cu) = +0,34V ; Eo(I - 3 /I-) = +0,54V Eo(Cl2(k)/Cl-) = +1,36V ;
Tích số tan Ks (CuCl, r) = 1,0.10-16 Ks(CuI, r) = 5,0.10-12
Hướng dẫn giải: 1. a) 2Cu+ ⇌ Cu2+ + Cu Cu2+ + 2e → Cu ∆Go = ∆Goa + ∆Gob ∆Go ∆Goa ∆Gob Cu+ + e
-2FEo(Cu2+/Cu) = -FEo(Cu2+/Cu+) - FEo(Cu+/Cu)
Eo(Cu2+/Cu+) = 2.,034 – 0,522 = +0,158V F E o ( 5 , 96 522 , 0 ) 158 , 0 ∆Go298 = -F∆Eo = -RTlnK1 6 K exp exp , 1 10 . 44 1 3 RT 10 . 314 , 8 298 . b) 2Cu+ ⇌ Cu2+ + Cu 10 , 0 x
Nồng độ cân bằng: 2x 0,10 – x K 1 2 (2x)
Vì K1 rất lớn nên x << 0,10. Từ đó 10 , 0 6 , 1 10 . 44 x 4 10 . 32 , 1 Cu2 4 10 . 64 , 2 M 4x2
2. Để hoà tan hoàn toàn 0,10 mol CuI trong dung dịch NH3 0,20M phải có: 10 , 0 Kd ( ) 10 , 0
3 K (CuI ) . Thay Kd = 1,0.10-16 vào ta có: 4 s 16 10 . 10 , 0 3 21 3 12 3 34 ( ) 10 , 0 10 . 5 , 2 K (CuI) 10 . 0 , 5 ( ) , 1 10 . 25
nên 0,10 mol CuI không thể tan hoàn toàn 4 s trong dung dịch NH3 0,20M
Bài 5. Có thể hoà tan hoàn toàn 100mg bạc kim loại trong 100ml dung dịch amoniac nồng độ 0,1M khi tiếp xúc
với không khí được không?
Cho biết nguyên tử khối của Ag = 107,88; hằng số điện li bazơ của amoniac là Kb = 1,74.10-5; các hằng
số bền của phức [Ag(NH3)i]+ tương ứng là: lg1 = 3,32(i = 1) và lg2 = 6,23(i = 2).
Các thế khử (thế oxy hóa - khử) chuẩn ở 25oC: Eo(Ag+/Ag) = 0,799V; Eo(O2/OH-) = 0,401V. Áp suất
riêng phần của oxy trong không khí là 0,2095atm. Phản ứng được thực hiện ở 25oC. NAg = 0,100 : 107,88 = 9,27.10-4mol Hướng dẫn giải:
Số mol cực đại của NH3 cần để tạo phức là: 9,27.10-4 . 2 = 1,854.10-3M nghĩa là nhỏ hơn nhiều so với
số mol NH3 có trong dung dịch (10-2M). Vậy NH3 rất dư để hoà tan lượng Ag nếu xảy ra phản ứng.
Chúng ta sẽ kiểm tra khả năng hoà tan theo quan điểm điện hóa và nhiệt động: Ag+ + e Ag E1 = Eo1 + 0,059lg[Ag+]
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA o 059 , 0 P 2O O E E lg 2 + 4e + H2O 4OH- 2 2 4 OH 4
Khi cân bằng E1 = E2. Trong dung dịch NH3 = 0,1M (lượng NH3 đã phản ứng không đáng kể) ta có:
[OH-] = (Kb.C)1/2 = 1,32.10-3M E2 = 0,5607V.
Vì E2 = E1 nên từ tính toán ta có thể suy ra được [Ag+] = 9,12.10-5M
Nồng độ tổng cộng của Ag+ trong dung dịch: [Ag+] +
o = [Ag+] + [Ag(NH#)+] + [Ag(NH3)2 ]
= [Ag+](1 + 1[NH3] + 12[NH3]2) = 15,5M
Giá trị này lớn hơn nhiều so với lượng Ag dùng cho phản ứng. Vì vậy các điều kiện điện hóa và nhiệt
động thuận lợi cho việc hoà tan 0,100g Ag Bài 6.
Một dung dịch chứa 530 mmol Na2S2O3 và một lượng chưa xác định KI. Khi dung dịch này được chuẩn
độ với AgNO3 thì đã dùng được 20 mmol AgNO3 trước khi bắt đầu vẩn đục vì AgI kết tủa. Có bao nhiêu mmol
KI trong dung dịch đã được chuẩn độ. Biết thể tích sau cùng là 200ml. Cho các giá trị: Ag(S O )3 + 2 1 4 + 1 7 Ag + 2S O ; K = 6,0.10 . AgI Ag + I ; T = 8,5.10 2 3 2 3 (aq) kb (r) (aq) (aq) 2
Hướng dẫn giải:
Do hằng số tạo phức của Ag(S 3-
2O3)3 , Kf = (Kd)-1 = 1,667.1013 là rất lớn nên hầu hết Ag+ thêm vào sẽ tạo phức hết với S 2- 2O3 => [Ag(S 3- 2O3)2 ] = 0,100M Số mmol S 2- 2-
2O3 tự do = 530 – (2.20) = 490 mmol => [S2O3 ] = 2,450M
Nồng độ ion Ag+ tự do được tính từ Kd 2− K ] d = [Ag+][S2O3
= 6,0.10-14 => [Ag+] là 1,0.10-15 M [Ag(S2O3)3−]
Từ Ksp = [Ag+][I-] = 8,5.10-17 => [I-] = 8,5.10-2 M => mmol KI = 17,0 mmol
Bài 7. Cho NH3 vào 100 ml dung dịch X gồm Fe3+ 0,10M; Al3+ 0,10M; Zn2+ 0,20M; H+ 0,20M đến nồng độ
1,80M, thu được a gam kết tủa và dung dịch Y. Tính a và nồng độ các ion có trong dung dịch Y. Cho pKaNH + 4
= 9,24; βZn(NH 2+ = 108,89 ; pK = 10,90 3)4 sMg(OH)2
Hướng dẫn giải:
Số mol ban đầu của mỗi ion là:
nH+ = 0,1.0,2 = 0,02 mol ; nFe3+ = 0,1.0,1 = 0,01 mol ; nAl3+ = 0,1.0,1 = 0,01 mol ; nZn2+ = 0,1.0,2 = 0,02 mol Có các phản ứng: H+ + NH + 3 → NH4 (1) 0,02 0,18 - 0,16 0,02 Fe3+ + 3NH +
3 + 3H2O → Fe(OH)3 + 3NH4 (2) 0,01 0,16 0,02 - 0,13 0,01 0,05 Al3+ + 3NH +
3 + 3H2O → Al(OH)3 + 3NH4 (3) 0,01 0,13 0,05 - 0,10 0,01 0,08 Zn2+ + 4NH 2+ 3 → Zn(NH3)4 (4) 0,02 0,10 - 0,02 0,02 Có thể có: Mg2+ + 2NH +
3 + 2H2O → Mg(OH)2 + 2NH4 (5)
Từ (1) => (4) cho thấy TPGH của dung dịch gồm:
Tõ (2) vµ (3) cã khèi l-îng kÕt tña lµ: Zn(NH 2+ +
3)4 0,20M; Mg2+ 0,02M; NH3 0,20M; NH4 0,80M. Có các cân bằng:
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 9
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 10 NH +
3 + H2O ⇌ NH4 + OH- Kb = 10-4,76 (6) Zn(NH 2+
3)4 ⇌ Zn2+ + 2NH3 β-1 = 10-8,89 (7) Do phức bền, nên NH +
3 phân li ra từ phức là không đáng kể. Vậy pH của dung dịch Y là do hệ đệm NH4 /NH3
quyết định. Theo công thức tính: pH = pKa + lgCNH /C + = 9,24 + lg0,2/0,8 = 8,64 3 NH4
Vậy pH của dung dịch Y bằng 8,64.
+ Với [H+] = 10-8,64 => [OH-] = 10-14/10-8,64 = 10-5,36
=> CMg2+.(COH-)2 = 0,02.10-5,36.2 = 10-12,42 < 10-10,9, vì vậy không có kết tủa Mg(OH)2. Vậy kết tủa chi có
Fe(OH)3 và Al(OH)3 có khối lượng là:
a = 107.0,01 + 78.0,01 = 1,85 (gam)
Bài 8. Cho dung dịch X chứa Cu(NO3)2 0,10 mol/l, Cd(NO3)2 0,10 mol/l.
1. Axit hóa dung dịch X bằng HCl đến nồng độ 1,00 mol/l được dung dịch Z, giả sử thể tích dung dịch
không đổi khi axit hóa. Có thể tách hoàn toàn Cu2+ khi có Cd2+ trong dung dịch Z bằng cách điện phân dung
dịch Z trong bình điện phân với hai điện cực platin phẳng, được không?
2. Hòa tan 6,5 gam KCN vào 100 ml dung dịch X (coi thể tích không đổi khi hòa tan KCN vào dung dịch)
thu được dung dịch Y. Tiến hành điện phân dung dịch Y trong bình điện phân với hai điện cực platin phẳng.
Tính nồng độ cân bằng trong dung dịch khi thế đặt trên catot lúc này là –1,00 V.
Các quá trình đều thực hiện ở 25oC. Cho: o E = 0,337V; o E = 0,521V; o E = –0,402V; o E = 0,370V; 2 Cu 2 Cu 2 Cd (CN) ,2H Cu 2 Cu Cd 2HCN o E 1,360V ; o E = 1,230V; o E = 0,00V; 0,470V; 0,097 V; Cl 2 O ,H 2H O2 (Pt) H2 (Pt) - 2 2Cl H H 2O 2
Ksp(CuCN) = 3,5·10 –19; KHCN = 10 –9,31 lg =24,0; lg 28,59; lg 30,29; lg = 25,0. Cu(CN) 2 3 2 Cu(CN 3 ) Cu(CN)4 Cu(CN)2 lg 6,01; lg 11,12; lg 15,65; lg 17,92. Cd(CN) Cd(CN) 2 2 Cd(CN)3 Cd(CN)4
Hướng dẫn giải:
1. Dung dịch Z: Cu(NO3)2 0,10 mol/l, Cd(NO3)2 0,10 mol/l và HCl 1,0 mol/l.
Ta có nồng độ các ion trong dung dịch: Cu2+ 0,10 M; Cd2+ 0,10 M; H+ 1,0 M; Cl – 1,0 M.
Các phản ứng điện phân:
+ Tại catot điều kiện xảy ra các quá trình điện phân: 0,0592 2+ o 2 Cu +2e Cu E E E lg Cu 0,3074V 2+ 2+ C Cu Cu Cu Cu 2 0,0592 2+ o 2 Cd +2e Cd E E E lg Cd 0 ,4316V 2+ 2+ C Cd Cd Cd Cd 2 0,0592 o 2H +2e H E E E
lg H 0,097V + + 2 C H 2 H 2H 2H 2 H 1 2 H2
Thứ tự điện phân là Cu2+; H+ và cuối cùng là Cd2+. + Tại anot: 0,0592 o
O 4e 4H 2H O E E E
lg H 1,700V + + 2 2 A O 2 O 4H ;O 4H ;O 2 2 2 1 2H2O 2H2O 0,0592 1 o Cl 2e 2Cl E E E lg 1,360V 2 A Cl2 Cl2 2 2Cl 2Cl Cl
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA
xảy ra quá trình điện phân Cl –. – Khi điện phân Cu2+: Cu2+ + 2Cl – Cu + Cl2
Do đó nồng độ H+ không thay đổi.
– Khi bắt đầu điện phân H+ thì nồng độ của Cu2+ còn lại là: 0,0592 o 2 E E lg Cu 0,097V 2+ 2+ Cu Cu
[Cu2+] = 10 –8,11 M < 10-6. Nên khi chưa điện phân đến Cu Cu 2
Cd2+ thì Cu2+ đã bị điện phân hoàn toàn.
2. Nồng độ CN – trong dung dịch khi hòa tan KCN là 1,00 M rất lớn so với nồng độ của Cu2+ và Cd2+. Mặt
khác Cd2+ có khả năng tạo phức bền với CN – và có ; ; nên giả sử Cd2+ tạo phức Cd(CN) 2 – là chủ 4 3 2 1 4
yếu. Đối với Cu2+ là chất oxi hóa, trong khi CN – có tính khử và Cu+ tạo phức bền hơn Cu2+ nên có thể oxi hóa
CN – tạo Cu+; mặt khác ; nên chủ yếu tạo phức Cu(CN) 3 –. 4 3 2 4
Các quá trình trong dung dịch: Cd2+ + iCN – Cd(CN) 2 –i i i (1) Cu2+ + e Cu+ (2) Cu2+ + 2CN – Cu(CN)2 (3) Cu+ + 4CN – Cu(CN) 3 – 4 (4) HCN
H+ + CN – Ka = 10 –9,31 (5) (CN)2 + 2e + 2H+ 2HCN (6)
Tổ hợp các phương trình từ (2) đến (6) ta có: 2Cu(CN) 3 – 2 + 6CN – 2Cu(CN)4 + (CN)2 K = K 2 –2 2 –2 –2 2 .K3
.K4 .Ka .K6 = 2.1034 rất lớn nên phản ứng coi như hoàn toàn.
Trạng thái giới hạn của hệ là: Cd(CN) 2 – 3 – 4
0,1 M và Cu(CN)4 0,1 M và CN – 0,1 M.
– Phản ứng thủy phân của CN – không làm thay đổi nồng độ CN –: CN – + H2O HCN + OH – K = 10 –4,69
[OH –] = [HCN] = 1,419.10 –3
– Khi thế đặt trên catot là –1,0 V, khi đó nồng độ cân bằng của [Cd2+] và [Cu+] có thể được tính theo phương trình Nernst: 0,0592 o 2 E E lg Cd 2 2 Cd Cd
= – 1,00 V [Cd2+] = 10 –20,20 Cd Cd 2
– Đối với đồng: ta có Cu2+ + 2e Cu Eo = 0,337 V (7) và Cu2+ + e Cu+ Eo = 0,521 V (8) Cu+ + e Cu o E = 0,153 V Cu Cu Theo phương trình Nernst: o E [Cu+] = 10 –19,48 E 0,0592lg[Cu ]=-1,00V Cu Cu Cu Cu
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 11
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 12
– Giả sử nồng độ CN – không đổi 0,1 M ta có [Cd(CN) 2 – 4
] = 4.[Cd2+].[CN –]4 = 5,25.10 –7 M. Vậy có thể
coi Cd2+ đã bị điện phân hoàn toàn:
– Nếu Cu+ đã bị điện phân thi nồng độ Cu(CN) 3 – 4 phải nhỏ hơn 0,1 M. Ta có: [Cu(CN) 3 – 4
] = 4.[Cu+].[CN –]4 = 1030,29. 10 –19,48.0,14 >> 0,1 nên Cu+ chưa bị điện phân. + Tại catot: Cd(CN) 2 – 4 + 2e Cd + 4CN – + Tại anot: o E =0,370V < o E +
1,700V nên CN – bị oxi hóa: (CN) O (Pt) 2 ,2H O2 ,H 2 2HCN H2O 2CN – (CN)2 + 2e + Phản ứng điện phân: Cd(CN) 2 – 4 Cd + 2CN – + (CN)2
Nồng độ CN – lúc này là 0,1 + 2.0,1 = 0,3 M.
Vậy trong dung dịch chứa các cấu tử:
[Cd2+] = 10 –20,2 M; [Cd(CN)+] = 106,01.10 –20,2.0,3 = 1,94. 10 –15 M; [Cd(CN) –
2] = 1011,12.10–20,2.0,32 = 7,49.10 –11 M; [Cd(CN)3 ] = 1015,65.10 –20,2.0,33 = 7,61.10 –7 M; [Cd(CN) 2 – 4
] = 1017,92.10 –20,2.0,34 = 4,25.10 –5 M.
Tổng nồng độ Cd2+ còn lại: 4,33.10 –5 M chiếm 0,043% lượng Cd2+ ban đầu nên giả thiết bị điện phân hết
có thể chấp nhận được. 1 + 3 0 [Cu ]=0,1. 5,94.10 M 2 3 4
1 .CN .CN .CN 2 3 4 [Cu(CN) –
2 ] = 1024. 5,94.10 –30.0,32 = 5,436.10 –7 M; [Cu(CN) 2 – 3
] = 1028,59. 5,94.10 –30.0,33 = 6,24.10 –3 M [Cu(CN) 3 – 4
] = 1030,29. 5,94.10 –30.0,34 = 0,0938 M.
Kiểm tra tổng nồng độ CN –:
[CN –] = 1,0 – 0,1 – 0,2 – 2.5,436.10 –7 – 3.6,24.10 –3 – 4.0,0938 – 7,49.10 –11 – 2.7,49.10 –11 – 3. 7,61.10 –7 –
4.4,25.10 –5 = 0,306 M là chấp nhận được so với 0,3 M. Bài 9.
1. Điện phân dung dịch X chứa NiSO4 0,02M và CoSO4 0,01M trong axit H2SO4 0,5M ở 250C, dùng điện cực
Pt với dòng điện I = 0,2A.
a. Viết phương trình phản ứng xảy ra ở các điện cực, tính thế của các cặp oxi hóa khử ở từng điện cực và cho
biết hiệu thế tối thiểu phải đặt vào hai cực để quá trình điện phân bắt đầu xảy ra.
b. Cation nào bị điện phân trước? Khi cation thứ hai bắt đầu điện phân thì nồng độ của cation thứ nhất còn bao nhiêu?
2. Nếu điện phân dung dịch chứa NiSO4 0,02M; CoSO4 0,01M và NaCN 1M thì kim loại nào sẽ tách ra
trước? Có thể tách hai kim loại ra khỏi nhau bằng phương pháp điện phân dung dịch này không? Biết rằng
một ion được coi là tách hoàn toàn khỏi dung dịch khi nồng độ ion của nó còn lại trong dung dịch nhỏ hơn 10-6 M.
Cho biết ở 250C, Eo Ni2+/Ni = - 0,233V; Eo Co2+/Co = - 0,277V; Eo O2,H+/H2O = 1,23V; PO2= 0,2 atm.
Các phức chất: [Co(CN)6]4- có lg1 = 19,09; [Ni(CN)4]2- có lg2 = 30,22.
Quá thế của H2/Pt đủ lớn để quá trình điện phân H+ và nước tại catot không xảy ra.
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA
Hướng dẫn giải:
1.a) Tại catot (Katot): Ni2+ + 2e Ni (1)
ENi2+/Ni = E0Ni2+/Ni + (0,0592 : 2).lg[Ni2+] = - 0,283 V Co2+ + 2e Co (2)
ECo2+/Co = E0Co2+/Co + (0,0592 : 2).lg[Co2+] = - 0,336 V
Tại anot: 2H2O 4 H+ + O2 + 4e (3)
EO2, H+/H2O = E0 O2, H+/H2O + (0,0592 : 4).lg{[H+]4.PO2} = 1,22 V
Thế phân hủy tối thiểu Vmin = 1,22 – (-0,283) = 1,503 V
(ứng với phương trình điện phân: 2Ni2+ + 2H2O 2Ni + O2 + 4H+)
b) Từ kết quả phần a) nhận thấy Ni2+ điện phân trước. Khi Co2+ bắt đầu điện phân:
ENi2+/Ni = E0Ni2+/Ni + (0,0592 : 2).lg[Ni2+] = ECo2+/Co = - 0,336 V
[Ni2+] = 3,21.10-5 M ( hay 10-4,493M)
2. Nếu điện phân dung dịch chứa NiSO4 0,02M và CoSO4 0,01M có chứa NaCN 1M:
Có các cân bằng: Co2+ + 6CN- [Co(CN)6]4- (4) lg1 = 19,09
Ni2+ + 4CN- [Ni(CN)4]2- (5) lg2 = 30,22
Vì 1 và 2 rất lớn; C0Ni2+ và C0Co2+ << C0CN- nên sự tạo phức coi như hoàn toàn.
TPGH: [Ni(CN)4]2- = 0,02M; [Co(CN)6]4- = 0,01M; [CN-] = 0,86M được coi là thành phần cân bằng.
[Ni2+] = 2,20.10-32 M ENi2+/Ni = - 1,17 V.
[Co2+] = 2,01.10-21 M ECo2+/Co = - 0,883 V.
Từ kết quả trên ta thấy Co2+ bị điện phân trước tại catot.
(Có thể tính E thông qua cặp oxi hóa – khử: [Ni(CN)4]2-/Ni, CN- và [Co(CN)6]4-/ Co,CN-)
Co2+ điện phân được coi là hết khi: [Co2+] + [Co(CN) 4- 6 ] =10-6M [Co(CN) 4-
6 ] 10-6M ; [CN-] 0,92M [Co2+] = 1,34.10-25 M
ECo2+/Co = -1,013 V > ENi2+/Ni = - 1,17 V Ni2+ chưa điện phân.
Vậy có thể tách hai kim loại ra khỏi nhau bằng phương pháp điện phân trên.
Bài 10. Tính nồng độ cân bằng của các cấu tử trong dung dịch thu được khi trộn 10,0 ml dung dịch chứa
CuSO4 0,020 M; NH3 0,400 M với 10,0 ml dung dịch Na2H2Y 0,200 M.
Hướng dẫn giải Các cân bằng : Cu2+ + H + 2Y2- + 2NH3 CuY2- + 2NH4 H + 2Y2- + NH3 HY3- + NH4 Cu2+ + NH 2+ 3 Cu(NH3)i NH + 3 + H2O NH4 + OH- HY3- H+ + Y4- HY3- + jH2O Hj+1Y3-j + jOH- SO 2- - 4 + H2O HSO4 + OH-
Vì phức CuY2- bền và H2Y2- dư nên coi Cu2+ tạo phức CuY2- là chính;
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 13
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 14
EDTA có K3 >> 10-9,24 nên :
Thành phần giới hạn (TTGH): CuY2- 0,01M; HY3- 0,09M; NH + 2- 4 0,11; NH3 0,09M; SO4 0,01M
Lập phương trình điều kiện proton, mức 0 : NH 2- 3; HY3-; H2O và SO4 . Bỏ qua các thành phần H -
3Y-; H4Y và HSO4 vì môi trường bazơ : tính theo hệ đệm NH +
4 /NH3 : [H+] = hh= 7.033.10-10 3
K K HY 0,11h
thu được phương trình : W 4 h ; 1 3 1
1 K HY K NH 3 3 NH4 K h Tinh lặp với : 3 3 NH4 HY .0,09; HY .0, 2; 1 h K h K 4 NH4
1) [HY3-] = 8.347743E-0002; [NH3] = 9.000000E-0002 [H+] = 7.236322E-0010 pH = 9.1404821
2) [HY3-] = 8.364763E-0002; [NH3] = 8.859245E-0002
[H+] = 7.392708E-0010 pH = 9.1311965
3) [HY3-] = 8.377271E-0002; [NH3] = 8.753864E-0002
[H+] = 7.512914E-0010 pH = 9.1241916
4) [HY3-] = 8.386556E-0002; [NH3] = 8.674551E-0002
[H+] = 7.605216E-0010 pH = 9.1188884
anphaCu = 2.503118E-0008; anphaY = 6.506741E-0002 HSbendkien = 1.027649E+0010 Tính cân bằng : CuY
Cu2+ + Y4- õ’-1 = 10-10,01 0,01 0,09 0,01-x x 0,09 +x
x = 1,08.10-11 [Cu2+] = 2,7.10-19. [NH3] = 0,0867; [HY3-] = 0,0838
Bài 11. Có dung dịch A chứa Al3+ nồng độ 0,100 M và Fe3+ 0,050 M. Có thể chuẩn độ riêng Fe3+ bằng EDTA
được không nếu pH trong quá trình chuẩn độ được duy trì bằng 2 ? Tính nồng độ cân bằng của các cấu tử khi
đã thêm 25,0 ml và 75,0 ml dung dịch EDTA 0,050 M vào 25,0 ml dung dịch A (pH của dung dịch luôn duy trì bằng 2).
Biết : EDTA có pK1 = 2,0; pK2 = 2,67; pK3 = 6,16; pK4 = 10,26; lg 25,1; lg 16,13; lg* 2,15; lg* 4,3. 2 2 FeY AlY FeOH AlOH
Hướng dẫn giải
Mô tả các cân bằng trong dung dịch.
Tính hằng số bền điều kiện của các phức với EDTA
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA 1 1 3 0,597. 0,995 Fe 1 3 1 * Al 1 2 .h 1 * .h FeOH 2 AlOH 1 K .K2K3K4 K .K K K 1 2 3 4 3,671.10-14 4 Y 4 3 2 h 4 3 2 1 K .h 1 K .K2h 1 K .K2K3h 1 K .K2K3K4 h 1 K .h 1 K .K2h '
.Fe.Y 2,759.1011 = 1011,44; ' .
. 4,927.102 = 102,69. Hằng số bền điều FeY FeY Al Y AlY AlY
kiện của FeY lớn hơn của AlY 109 lần nên hoàn toàn có thể chuẩn độ riêng Fe3+ bằng EDTA.
- Khi thêm 25,0 ml dung dịch EDTA 0,05 M vào 25,0 ml dung dịch Al3+ 0,10 M và Fe3+ 0,05 M :
Vì CV = C01V0 nên chỉ chuẩn độ Fe3+
TTGH : FeY- 0,025 M, Al3+ 0,05 M
Trong dung dịch chỉ có phản ứng tạophức cạnh tranh : Al3+ + FeY AlY + Fe3+ K = 10-8,75 0,05 0,025 0,05-x 0,025-x x x x = 1,49.10-6 M
[Fe3+]' = 1,49.10-6 [Fe3+] = 8,9.10-7; [Al3+]' = 0,05 [Al3+] = 0,04975;
[Y4-]' = 6,092.10-8 [Y4-] = 2,236.10-21;
- Khi thêm 75,0 ml dung dịch EDTA 0,05 M vào 25,0 ml dung dịch Al3+ 0,10 M và Fe3+ 0,05 M :
Vì CV' = C01V0 + Co2Vo nên đã chuẩn độ hết cả Fe3+ và Al3+ .
Theo định luật bảo toàn nồng độ : CY = [Y]' + [FeY]' + [AlY]' CFe = [Fe]' + [FeY]' CAl = [Al]' + [AlY]'
Ta có [Y]' = [Al]' + [Fe]', có thể coi [Al]' >>[Fe]'.
Vậy có thể tính theo cân bằng : AlY Al3+ + Y4- K = 10-2,69 0,025 0,025 – y y y 2 y Ta có K =
y2 + 10-2,69y – 0,025.10-2,69 = 0 y = 6,196.10-3 M 0,025 y
[AlY] = 0,0188, [Al3+]' = 6,196.10-3 M [Al3+] = 6,138.10-3;
[Y4-]' = 6,196.10-3 M [Y4-] = 2,265.10-16;
[FeY] = 0,0125; [Fe3+]' = 7,325.10-12 [Fe3+] = 4,373.10-12;
Bài 12. (Câu VII đề thi chọn đội tuyển olympic quốc tế năm 2006)
Dung dịch A được tạo thành bởi CoCl2 0,0100 M, NH3 0,3600 M và H2O2 3,00.103 M.
1. Tính pH và nồng độ ion Co2+ trong dung dịch A.
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 15
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 16
2. Viết sơ đồ pin và tính sức điện động E của pin được hình thành khi ghép (qua cầu muối) điện cực Pt nhúng
trong dung dịch A với điện cực Ag nhúng trong dung dịch K2CrO4 8,0.103 M có chứa kết tủa Ag2CrO4. Cho: pK +
a: NH4 9,24; HCrO4 6,50; pKs (chỉ số tích số tan) Ag2CrO4: 11,89.
EO: Co3+/Co2+ 1,84V; H2O2/2OH 0,94V; Ag+/Ag 0,799V.
Log hằng số tạo phức: Co3+ + 6NH 3+ 3 Co(NH3)6 ; lg1 = 35,16 Co2+ + 6NH 2+ 3 Co(NH3)6 ; lg2 = 4,39 ln = 0,0592 lg RT F
Hướng dẫn giải: 1. CoCl2 Co2+ + 2Cl– 0,0100 ----- 0,0100
Tạo phức của ion coban với NH3 Co2+ + 6 NH 2+ 3 Co(NH3)6 ; 2 = 104,39 0,0100 0,3600 ----- 0,3000 0,0100 Oxi hoá Co(NH 2+ 3)6 bởi H2O2. 2 Co(NH 2+ 3+ 3)6 Co(NH3)6 + e H2O2 + 2e 2OH o 2 (0,94 – E2 ) 2 Co(NH 2+ 3+
3)6 + H2O2 2 Co(NH3)6 + 2OH ; K = 10 ( 0,0592 1)
Tính thế chuẩn E o 3+ 2+
2 của cặp Co(NH3)6 /Co(NH3)6 : Co(NH 3+ –1 o 3)6 Co3+ + 6 NH3 ; 1 E1 Co3+ + e Co2+ ; K 1 = 10 0,0592 Co2+ + 6 NH 2+ 3 Co(NH3)6 ; 2 E o 2 Co(NH 3+ 2+ 3)6 + e Co(NH3)6 ; K2 = 10 0,0592 o o K –1 2
2 = K1 1 2 E2 = E1 + 0,0592 lg 1 E o
2 = 1,84 + 0,0592 (4,39 35,16) = 0,0184 (V) o 2 (0,94 – E2 ) 2 (0,94 – 0,0184 K = 10 = ) 0,0592 K = 10 = 0,0592 1031 2 Co(NH 2+ 3+
3)6 + H2O2 2 Co(NH3)6 + 2OH ; K = 1031 (1) 0,0100 0,0030 0,0040 ----- 0,0060 0,0060
Thành phần giới hạn của hệ: Co(NH 2+ 3+ 3)6 Co(NH3)6 NH3 OH 0,0040 M 0,0060 M 0,3000 M 0,0060 M Tính pH của dung dịch:
Sự phân li của các phức chất trong dung dịch không lớn vì lớn và có NH3 dư. Tính pH theo cân bằng: NH + 3 + H2O NH4 + OH (2) C 0,3000 6.10-3
[ ] (0,3000 - x) x (6.10-3 + x) x (0,0060 + x) = 104,76
x = 7,682.104 << 0,3000 M 0,3000 - x [OH] = 6,768.103 pH = 11,83
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA
Tính nồng độ của Co2+ trong dung dịch:
Kết quả tính theo (2) cho thấy [NH3] 0,3000. Co(NH 2+ 3)6 Co2+ + 6 NH3 10-4,39 C 0,0040 [ ] (0,0040 - x) x 0,3000 x (0,3)6 = 10-4,39
x = [Co2+] = 2,117.10-4 << 0,3000 0,0040 - x
Vì vậy việc coi [NH3] 0,3000 là đúng. 2. Tính Epin E của điện cực Pt: [Co(NH 3+ 3)6 ] = C =
3+ 0,0060 M (vì 1 >> ; có dư NH3) Co(NH3)6 [Co(NH 2+
3)6 ] = 4.10-3 – 2,117.10-4 = 3,788.10-3 (M) E 6.10-3 Pt = E = 3+ 0,0184 + 2+ 0,0592 lg = 0,0320 (V) Co(NH3)6 / Co(NH3)6 3,788.10-3 Tính E c ủa
điện cực Ag: Thế của điện cực Ag do cặp Ag2CrO4/2Ag quyết định (hoặc Ag+/Ag). Ag 2– 2CrO4 + 2e 2Ag + CrO4 E 1 Ag = E o + lg 0,0592 Ag2CrO4/2Ag 2 CrO 2– Tính E 4 o 4 : Ag 2– 2CrO4 2Ag+ + CrO4 ; Ks = 10-11,89 2E o 3 2 Ag+ + 2e Ag ; K 2 3 0 ,= 0 10 592 o (E3 = 0,799 V) 2E o 4 Ag 2– 2CrO4 + 2e 2Ag + CrO4 ; K4 = 10 0,0592 K 2 o o 0,0592 4 = K3 . Ks E4 = E3 + lg Ks = 0,447 (V) 2 Tính nồng độ CrO 2– 4 : CrO 2– – 4 + H2O HCrO4 + OH ; Kb = 10-7,5 Co 8.10-3 C 8.10-3 - x x x x2 = 10-7,5 x = 1,6.10-5 << 8.10-3 8.10-3 - x Ag 2– 2CrO4 2Ag+ + CrO4 ; Ks = 10-11,89 C 8.10-3 [] 2x 8.10-3 + x
(2x)2 (8.10-3 + x) = 10-11,89
x = 6,3.10-6 << 8.10-3 [CrO 2– 4 ] = 8.10-3 M E 0,0592 1 Ag = 0,447 + lg = 0,5090 (V) 2– 2 CrO4 o
(Có thể tính theo EAg = E + 0,0592 lg [Ag+]) Ag+/Ag E Ag > EPt Ag là catot, Pt là anot. Sơ đồ pin: (a) Pt Co(NH 2+ 3+ 2– 3)6 , Co(NH3)6 , NH3 Ag2CrO4 , CrO4 Ag (c)
Epin = Ec – Ea = 0,5090 – 0,0302 = 0,479 (V)
Bài 13. (Câu V đề thi chọn đội tuyển olympic quốc tế năm 2008)
2. Để xác định hằng số tạo phức (hay hằng số bền) của ion phức [Zn(CN)4]2-, người ta làm như sau:
Thêm 99,9 ml dung dịch KCN 1M vào 0,1 ml dung dịch ZnCl2 0,1 M để thu được 100ml dung dịch ion
phức [Zn(CN)4]2- (dung dịch A). Nhúng vào A hai điện cực: điện cực kẽm tinh khiết và điện cực so sánh là điện
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 17
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”
Học để biết, học để làm, học để chung sống, học để làm người và để tự khẳng định mình 18
cực calomen bão hoà có thế không đổi là 0,247 V (điện cực calomen trong trường hợp này là cực dương). Nối
hai điện cực đó với một điện thế kế, đo hiệu điện thế giữa chúng được giá trị 1,6883 V.
Hãy xác định hằng số tạo phức của ion phức [Zn(CN)4]2-. Biết thế oxi hoá - khử tiêu chuẩn của cặp Zn2+/Zn bằng -0,7628 V.
Hướng dẫn giải:
2. Phản ứng tạo phức: Zn2+ + 4 CN- [[Zn(CN)4]2-] [[Zn(CN)4]2-] = β1,4 (1) [Zn2+][CN-]4
Theo đề bài, rất dư CN- nên sự tạo phức xảy ra hoàn toàn [[Zn(CN) 0,1 0,1 4]2-] = C = = 10-4 M Zn2+ 100 [CN-] = 1- 4 10-4 ≈ 1
Để tính β thì cần xác định nồng độ [Zn2+] 0,0592 EZn = Eo + lg [Zn2+] 2 E(đo được) = 1 , 6 8 8 3 = E C al – E Zn = 0,247 – EZn
EZn = 0,247 – 1,6883 = – 1,4413 V 0,0592 EZn = – 0,7628 +
2 lg [Zn2+] = –1,4413 (V) [Zn2+] = 10-22,92. T h a y v à o ( 1) tí nh
được β1,4 = 1018,92
Bài 14. (Câu VI đề thi chọn đội tuyển olympic quốc tế năm 2009)
1. Bạc tác dụng với dung dịch nước của NaCN khi có mặt không khí theo phản ứng:
4Ag + O2 + 2H2O + 16CN− 4[Ag(CN)4]3− + 4OH−
Để ngăn cản sự hình thành của axit HCN (một chất dễ bay hơi và rất độc) thì pH của dung dịch phải trên 10.
Nếu dung dịch chỉ có NaCN, pH = 10,7 thì nồng độ NaCN bằng bao nhiêu?
2. Một dung dịch chứa các ion Ag+ và 0,020 mol/L NaCN. So với ion bạc thì natri xianua rất dư. pH của dung dịch
này bằng 10,8. Trong dung dịch có cân bằng sau:
Ag+ + 4CN− [Ag(CN)4]3− ; hằng số cân bằng β1 = 5,00.1020 3- c([Ag(CN) ] ) Xác định tỉ số của 4 trong dung dịch. + c(Ag )
3. Để tăng nồng độ của ion Ag+ tự do (chưa tạo phức) phải thêm vào dung dịch đó NaOH hay HClO4? Vì sao?
4. Sau khi thêm axit/bazơ (dựa vào kết quả của 3.) để nồng độ ion Ag+ trong dung dịch tăng lên 10 lần so với
nồng độ ion Ag+ trong dung dịch cho ở 2.
Tính nồng độ ion CN− trong dung dịch mới này.
Sử dụng c(CN−) = 0,0196 mol/L (khi chưa thêm axit/bazơ). Thể tích của dung dịch coi như
không thay đổi sau khi thêm axit/bazơ. pKa (HCN) = 9,31.
Hướng dẫn giải: - c(HCN).c(OH )
1. CN− + H2O HCN + OH− ; K = ; K = K - c(CN ) w/Ka = 10−4,69 C0 = c(HCN) + c(CN−)
và c(HCN) c(OH−) = 10−3,3 mol/L -3,3 2 (10 ) 10−4,69 = C -3,3 2 0 = 0,0128 mol/L c - (10 ) 0
Biên soạn – giảng dạy: Thầy Ngô Xuân Quỳnh
ĐT: 0979.817.885 – E_mail: admin@hoahoc.org
Facebook: facebook.com/hoahoc.org (Ngô Xuân Quỳnh)
CHUYÊN ĐỀ: PHỨC CHẤT VÀ BÀI TẬP CÂN BẰNG TẠO PHÚC HSG HÓA 3- c([Ag(CN) ] ) 2. Ag+ + 4CN− [Ag(CN) 4 4]3− β1 = = 5,00.1020 + - 4 c(Ag ).c(CN ) 3- c([Ag(CN) ] ) 4 = β + c(Ag ) 1 × c(CN−)4
Vì CN− dư nên c(CN−) c(NaCN) – c(OH−)
c(CN−) (0,020 – 10−3,3) mol/L = 0,0194 mol/L 3- c([Ag(CN) ] ) 4
= 5,00.1020 × 0,01944 = 7,04.1013 + c(Ag )
3. c(Ag+) tăng nếu c(CN−) giảm và c(CN−) giảm nếu c(OH−) giảm. Vậy phải thêm axit HClO4.
4. Đặt v và n chỉ các nồng độ trước và sau khi tăng nồng độ của ion Ag+. c(Ag+) n = 10 và c([Ag(CN) c(Ag+)
4]3−) = c(Ag+) × β1 × c(CN−)4 v
c([Ag(CN)4]3−)v + c(Ag+)v = c([Ag(CN)4]3−)n + c(Ag+)n
c(Ag+)v × β1 × c(CN−)4v + c(Ag+)v = c(Ag+)n × β1 × c(CN−)4n + c(Ag+)n c(Ag+) - 4 β × c(CN ) + 1 n = 1 v = 10 c(Ag+) - 4 β × c(CN ) + 1 v 1 n - 4 - 4 β × c(CN ) 9 β × c(CN ) c(CN−)4 1 v 1 v n = - bởi vì β 10 × β 10 × β 10 × β 1 = 5,00.1020 1 1 1 c(CN−)n = c(CN−)v × -1 4 ( 10) = 0,0196 × -1 4 ( 10) = 0,0110 mol/L KẾT LUẬN
Trên đây là một số bài tập phần “cân bằng tạo phức trong dung dịch” mà chúng tôi đã áp dụng trong giảng
dạy. Nó có thể dùng làm tài liệu học tập cho học sinh các lớp chuyên Hoá học và tài liệu tham khảo cho các
thầy cô giáo trong giảng dạy và bồi dưỡng học sinh giỏi Hoá học ở bậc THPT góp phần nâng cao chất lượng
giảng dạy và học tập môn Hoá học.
Tuy nhiên, đây chỉ là một phần rất nhỏ trong chương trình ôn luyện. Vì vậy, chúng tôi rất mong các Thầy, Cô
đồng nghiệp góp ý kiến cho chúng tôi về chuyên đề này và cùng nhau phát triển sang các chuyên đề khác để
học trò chuyên Hoá ngày càng có nhiều tài liệu học tập một cách hệ thống hơn.
Tạp Chí Dạy & Học Hóa Học – www.hoahoc.org - 19
“Our goal is simple: help you to reach yours” - “Mục tiêu của chúng tôi rất đơn giản: giúp đỡ để bạn đạt được mục tiêu của mình”