
















Preview text:
VIETNAM NATIONAL UNIVERSITY-HCM CITY UNIVERSITY OF SCIENCE, HCM CITY FACULTY OF CHEMISTRY ---o0o---
GENERAL CHEMISTRY II –
EXERSICES – 2019 CHAPTER 1. THERMOCHEMISTRY /
Chương 1. NHIỆT HÓA HỌC
1. (EX7-1A) How much heat, in kilojoules (kJ), is required to raise the temperature of 237 g of cold water
from 4.0 to 37.0 °C (body temperature)?
Hãy tính lượng nhiệt bằng kilojoules (kJ) cần để tăng nhiệt độ của 237 g nước lạnh từ 4,0 oC lên 37,0 oC. ĐS: 32,7 kJ
2. (EX7-1B) How much heat, in kilojoules (kJ), is required to raise the temperature of 2.50 kg Hg(l) from –
20.0 oC to –6.0 oC? Assume a density of 13.6 g/mL and a molar heat capacity of 28.0 Jmol-1 °C–1 for Hg(l).
Hãy tính lượng nhiệt bằng kilojoules (kJ) cần để tăng nhiệt độ của 2,5 kg Hg(l) từ –20,0 oC lên –6,0 oC. Cho
biết tỷ trọng và nhiệt dung mol của Hg (l) lần lượt là 13,6 g/mL và 28,0 J mol–1 oC–1. ĐS: 4,89 kJ
3. (EX7-2A) When 1.00 kg lead (specific heat = 0.13 J g–1 oC–1) at 100.0 oC is added to a quantity of water at
28.5 oC, the final temperature of the lead-water mixture is 35.2 oC. What is the mass of water present?
Khi 1,00 kg chì ( nhiệt dung riêng = 0,13 J g–1 oC–1) tại 100,0 oC được nhúng vào nước có nhiệt độ 28,5 oC,
nhiệt độ sau cùng của hỗn hợp chì-nước là 35,2 oC. Hỏi khối lượng nước là bao nhiêu? ĐS: 300 g
4. (EX7-2B) A 100.0g copper sample (specific heat = 0.385 Jg–1 °C–1) at 100.0 oC is added to 50.0 g water at
26.5 °C. What is the final temperature of the copper-water mixture?
100 g đồng (nhiệt dung riêng = 0.385 J g–1 oC–1) tại 100,0 oC được nhúng vào 50.0 g nước có nhiệt độ 26.5
oC. Hỏi nhiệt độ sau cùng của hỗn hợp đồng–nước là bao nhiêu? ĐS: 37,9 oC
5. (EX7-3A) Vanillin is a natural constituent of vanilla. It is also manufactured for use in artificial
vanilla flavoring. The combustion of 1.013 g of vanillin, C8H8O3, in a bomb calorimeter causes the
temperature to rise from 24.89 to 30.09 oC. What is the heat of combustion of vanillin, expressed
in kilojoules per mole? (the heat capacity of the calorimeter assembly is 4.90 kJ/oC).
Vanil in là một thành phần tự nhiên trong vanil a. Nó cũng được sản xuất làm hương nhân tạo mùi vanilla.
Đốt cháy 1,013 g vanillin, C8H8O3, làm nhiệt độ trong nhiệt lượng kế tăng từ 24,89 lên 30,09 oC. Hỏi nhiệt
đốt cháy của vanillin là bao nhiêu kJ/mol? (biết nhiệt lượng kế có nhiệt dung là 4,90 kJ/ oC). ĐS: -3,83x103 kJ/mol
6. (EX7-3B) The heat of combustion of benzoic acid is –26.42 kJ/g. The combustion of a 1.176 g
sample of benzoic acid causes a temperature increase of 4.96 oC in a bomb calorimeter
assembly. What is the heat capacity of the assembly?
Nhiệt đốt cháy của acid benzoic là –26,42 kJ/g. Đốt cháy 1,176 g acid benzoic làm nhiệt độ trong một nhiệt
lượng kế tăng 4,96 oC. Tìm nhiệt dung của nhiệt lượng kế này. ĐS: 6,26 kJ/oC
7. (EX7-4A) Two solutions, 100.0 mL of 1.00 M AgNO3(aq) and 100.0 mL of 1.00 M NaCl(aq), both initially at
22.4 oC, are added to a Styrofoam-cup calorimeter and allowed to react. The temperature rises to 30.2
oC. Determine qrxn per mole of in the reaction.
Hai dung dịch 100,0 mL AgNO3(aq) 1,00 M và 100,0 mL NaCl(aq) 1,00 M đều ở nhiệt độ 22,4 oC được thêm
vào một nhiệt lượng kế cốc Styrofoam và để cho phản ứng xảy ra trong nhiệt lượng kế này. Nhiệt độ sau
đó tăng lên đến 30,2 oC. Hãy tìm nhiệt phản ứng (kJ/mol) của phản ứng sau:
Ag+ (aq) + Cl (aq) → AgCl(s) ĐS: -65 kJ/mol
8. (EX7-4B) Two solutions, 100.0mL of 1.020 M HCl and 50.0 mL of 1.988 M NaOH, both initially at
24.52 oC, are mixed in a Styrofoam-cup calorimeter and allowed to react. What will be the final
temperature of the mixture? The heat of neutralization reaction is –56 kJ/mol H2O.
Hai dung dịch 100,0 mL HCl 1,020 M và 50,0 mL NaOH 1,988 M đều ở nhiệt độ 24,52 oC được trộn lẫn
trong một nhiệt lượng kế cốc Styrofoam và để cho phản ứng xảy ra trong nhiệt lượng kế này. Hỏi nhiệt
độ sau cùng của hệ thống? Cho biết nhiệt phản ứng trung hòa là –56 kJ/mol H2O tạo thành. ĐS: 33,4 oC
9. (EX7-5A) How much work, in joules, is involved when 0,225 mol N2 at a constant temperature of
23 oC is allowed to expand by 1.50 L in volume against an external pressure of 0.750 atm?
Tính lượng công sinh ra (bằng J) khi 0,225 mol N2 tại nhiệt độ không đổi 23 oC giãn nở tới thể tích 1,50 L,
biết áp suất ngoài 0,750 atm? ĐS: -114 J
10. (EX7-5B) How much work is done, in joules, when an external pressure of 2.50 atm is
applied, at a constant temperature of to 20.0 °C, to 50.0 g N2(g) in a 75.0 L cylinder?
Tính lượng công sinh ra (bằng J) khi nén 50,0 g khí N2 ở nhiệt độ không đổi 20,0 oC trong xylanh thể tích
75,0 L, biết áp suất ngoài là 2,50 atm. ĐS: 14,6 kJ
11. (EX7-6A) In compressing a gas, 355 J of work is done on the system. At the same time, 185 J
of heat escapes from the system. What is ΔU for the system?
Khi nén một khí, lượng công 355 J được đưa vào hệ thống cùng lúc với 185 J nhiệt thoát ra từ hệ thống.
Hỏi ΔU của hệ thống la bao nhiêu? ĐS: 170 J
12. (EX7-6B) If the internal energy of a system decreases by 125 J at the same time that the system
absorbs 54 J of heat, does the system do work or have work done on it? How much?
Nếu nôi năng của một hệ thống giảm đi 125 J cùng lúc với việc hấp thu 54 J nhiệt lượng. Hỏi hệ thống này
nhận công hay sinh công? Lượng công là bao nhiêu? ĐS: -179 J
13. (EX7-7A) What mass of sucrose must be burned to produce 1.00 ×103 kJ of heat? The
heat of combustion of sucrose is –5,65 ×103 kJ/mol sucrose.
Hãy tính lượng sucrose cần đốt cháy để tạo ra 1,00 ×103 kJ nhiệt lượng. Cho biết nhiệt đốt cháy của
sucrose là –5,65 ×103 kJ/mol sucrose. ĐS: 60,6 g
14. (EX7-7B) A 25.0 mL sample of 0.1045 M HCl(aq) was neutralized by NaOH(aq). Determine
the heat evolved in this neutralization. The heat of neutralization reaction is –56 kJ/mol H2O.
25,0 mL HCl(aq) 1,045 M được trung hòa bằng NaOH(aq). Hãy tính lượng nhiệt tỏa ra của quá trình trung
hòa này. Biết nhiệt phản ứng trung hòa là –56 kJ/mol H2O tạo thành. ĐS: 0,15 kJ
15. (EX7-8A) What is the enthalpy change when a cube of ice 2.00 cm on edge is brought from –10.0
°C to a final temperature of 23.2 °C? For ice, use a density of 0.917 g/cm3 a specific heat of 2,01
J/g–1 oC–1, and an enthalpy of fusion of 6,01 kJ/mol.
Khi một khối băng lập phương cạnh dài 2,00 cm được đưa từ –10,0 oC lên 23,2 oC, biến thiên enthalpy của
quá trình la bao nhiêu? Cho biết tỷ khối của băng là 0,917 g/cm3, nhiệt dung riêng của băng là 2,01 J.g–1
oC–1 và nhiệt nóng chảy của băng là 6,01 kJ/mol. ĐS: 3,31 kJ
16. (EX7-8B) What is the maximum mass of ice at –15,0 oC that can be completely converted to
water vapor at 25 oC if the available heat for this transition is 5,00×103 kJ ?
Hỏi khối lượng tối đa băng tại nhiệt độ –15,0 oC có thể chuyển thành hơi nước tại 25 oC khi dùng lượng
nhiệt 5,00 ×103 kJ? ĐS: 1,72 kg
17. (EX7-9A) The standard heat of combustion of propene, C3H6(g), is –2058 kJ/mol. Use this value
and the standard enthalpy of formation of CO2(g) and water(l) to determine ΔHo for the
hydrogenation of propene to propane.
Nhiệt đốt cháy chuẩn của propene, C3H6(g), là –2058 kJ/mol C3H6(g), của propane C3H8(g), là -2219 kJ/mol
C3H8(g) Hãy sử dụng dữ liệu này và tra cứu thêm các dữ liệu nhiệt hình thành chuẩn của CO2(g) và
nước(l) để xác định ΔHo của quá trình hydrogen hóa của propene thành propane. ĐS: -124 kJ
18. (EX7-9B) From the data in Practice Example 17 and the following equation, determine the
standard enthalpy of combustion of one mole of 2-propanol, CH3CH(O)CH3(l).
Sử dụng các kết quả tính toán của bài tập 17 kết hợp với dữ liệu dưới đây để xác định nhiệt đốt cháy
chuẩn của một mole 2-propanol CH3CH(OH)CH3(l)
CH3CH=CH2(g) + H2O(l) → CH3CH(OH)CH3(l) ΔHo = –52,3 kJ ĐS: -2006 kJ
19. (EX7-10A) The standard enthalpy of formation for the amino acid leucine is –637,3 kJ/mol
C6H13O2N(s). Write the chemical equation to which this value applie
Nhiệt hình thành chuẩn của amino acid leucine là –637,3 kJ/mol C6H13O2N(s). Hãy viết phương trình hóa
học tương ứng với giá trị này.
20. (EX7-10B) How is ΔHo for the following reaction related to the standard enthalpy of formation of
NH3(g) listed in Appendix? What is the value of ΔHo = ?
Giá trị ΔHo của phản ứng dưới đây liên hệ như thế nào với nhiệt hình thành chuẩn của NH3(g) trong bảng
phụ lục? Giá trị của ΔHo là bao nhiêu? 2NH3(g) → N2(g) + 3 H2(g) ĐS: 92,22 kJ
21. (EX7-11A) Use data from Appendix to calculate the standard enthalpy of combustion of
ethanol, CH3CH2OH(l), at 298.15 K.
Sử dụng dữ liệu trong bảng phụ lục để tính nhiệt đốt cháy chuẩn của ethanol, CH3CH2OH(l), tại 298,15 K. ĐS:-1367 kJ
22. (EX7-11B) Calculate the standard enthalpy of combustion at 298.15 K per mole of a gaseous
fuel that contains C3H8 and C4H10 in the mole fractions 0.62 and 0.38, respectively.
Hãy tính nhiệt đốt cháy chuẩn tại 298,15 K cho 1 mol của một nhiên liệu khí chứa C3H8 và C4H10 với tỷ lệ
phân mol tương ứng là 0,62 và 0,38.
ĐS: -2,5x103 kJ/mol hỗn hợp
23. (EX7-12A) The overall reaction that occurs in photosynthesis in plants is:
6 CO2(g) + 6 H2O(l) → C6H12O6(s) + 6 O2(g) ΔHo = 2803 kJ
Use this value and the standard enthalpy of formation of CO2(g) and water(l) from Appendix to
determine the standard enthalpy of formation of glucose, C6H12O6(s) at 298 K
Phản ứng chung xảy ra trong quá trình quang hợp của thực vật là:
6 CO2(g) + 6 H2O(l) → C6H12O6(s) + 6 O2(g)
ΔHo = 2803 kJ
Hãy sử dụng dữ liệu này và tra cứu thêm các dữ liệu nhiệt hình thành mol chuẩn của CO2(g) và H2O(l) cần
thiết trong bảng phụ lục để xác định nhiệt hình thành chuẩn của glucose, C6H12O6(s) tại 298 K. ĐS: -1273 kJ/mol
24. (EX7-12B) A handbook lists the standard enthalpy of combustion of gaseous dimethyl ether at
298 K as – 31,70 kJ/g(CH3)2O (g). What is the standard molar enthalpy of formation of dimethyl
ether at 298 K? Use this value and the standard enthalpy of formation of CO2(g) and water (l) from Appendix.
Một handbook liệt kê nhiệt đốt cháy chuẩn của dimethyl ether tại 298 K là –31,70 kJ/g(CH3)2O (g). Hãy sử
dụng dữ liệu này và tra cứu thêm các dữ liệu nhiệt hình thành mol chuẩn của CO2(g) và H2O(l) cần thiết
trong appendix để xác định nhiệt hình thành mol chuẩn của khí dimethyl ether tại 298 K. ĐS: -184 kJ/mol
25. (E9) A 74.8 g sample of copper at 143,2 oC is added to an insulated vessel containing 165 mLof
glycerol, (C3H8O3, d=1,26 g/mL), at 24,8 oC. The final temperature is 31,1 oC. The specific heat of
copper is 0,385 J.g−1.oC−1. What is the heat capacity of glycerol in J.g−1.oC−1?
Một mẫu đồng có khối lượng 74,8 g ở nhiệt độ 143,2 oC được cho vào bình cách nhiệt có chứa sẵn 165 mL
glycerol (C3H8O3, d=1,26 g/mL) tại nhiệt độ 24,8 oC. Nhiệt độ cuối cùng thu được là 31,1 oC. Biết nhiệt
dung riêng của đồng là 0,385 J.g−1.oC−1. Hỏi nhiệt dung của glycerol tính theo đơn vị J.g−1.oC−1 là bao nhiêu? ĐS: 2,3 x 102 J mol-1 oC-1
26. (E22) The heat of solution of KI(s) in water is 20,3 kJ/mol KI. If a quantity of KI is added to
sufficient water at 23,5 oC in a Styrofoam cup to produce 150.0 mLof 2.50 M KI, what will be the
final temperature? (Assume a density of 1.30 g/mL and a specific heat of 2,7 J.g−1.oC−1 for 2.50 M KI.)
Nhiệt hòa tan KI rắn trong nước là 20,3 kJ/mol KI. Nếu một lượng KI cho vào lượng nước vừa đủ ở 23,5 oC
trong cốc Styrofoam để tạo thành 150,0 mL dung dịch KI có nồng độ 2,5 M. Tính nhiệt độ sau cùng của
hệ biết rằng dung dịch có d= 1,30 g/mL và nhiệt dung riêng của dung dịch KI 2,5 M là 2,7 J.g−1.oC−1. ĐS: 10oC
27. (E26) The heat of neutralization of HCl(aq) by NaOH(aq) is 55,84 kJ/mol H2O produced. If 50,00 mL of
1.05 M NaOH is added to 25.00 mLof 1.86 M HCl, with both solutions originally at 24.72 oC what
will be the final solution temperature? (Assume that no heat is lost to the surrounding air and that
the solution produced in the neutralization reaction has a density of 1.02 g/mL and a specific heat of 3.98 Jg−1oC−1)
Nhiệt trung hòa của dung dịch HCl và NaOH là 55,84 kJ/mol H2O tạo thành. Nếu cho 50,00 mL dung dịch
NaOH nồng độ 1,05 M vào 25,00 mL dung dịch HCl nồng độ 1,86 M có cùng nhiệt độ là 24,72 oC, thì nhiệt
độ sau cùng của hệ là bao nhiêu? Xem rằng không có sự thất thoát nhiệt ra bên ngoài và dung dịch sau
trung hòa có d= 1,02 g/mL và nhiệt dung riêng là 3,98 J.g−1.oC−1. ĐS: 33,26oC
28. (E33) The enthalpy of sublimation for dry ice (i.e., CO2) is ΔHo= 571 kJ/kg at −78,5 oC and 1 atm. If
125.0 J of heat is transferred to a block of dry ice that is −78,5 oC, what volume of CO2 gas (d =
1.98 g/L) will be generated?
Nhiệt thăng hoa của đá khô CO2 ∆𝐻𝐻= 571 kJ/kg ở nhiệt độ −78,5 oC và 1 atm. Nếu truyền một lượng nhiệt
125,0 J vào đá khô ở −78,5 oC, lượng thể tích khí CO2 tạo thành là bao nhiêu? (d = 1,98 g/L). ĐS: 0,111 L
29. (E46) We can determine the purity of solid materials by using calorimetry. A gold ring (for pure
gold, specific heat = 0.1291 J.g−1.K−1) with mass of 10.5 g is heated to 78,3 °C and immersed in 50.0 g of 23,7
°C water in a constant-pressure calorimeter. The final temperature of the water is 31,0 °C. Is this a pure sample of gold?
Phương pháp lượng nhiệt kế có thể sử dụng để xác định độ tinh khiết của kim loại. Một nhẫn vàng (vàng
nguyên chất, nhiệt dung riêng là 0,1291 J.g−1.K−1) có khối lượng 10,5 g được gia nhiệt đến 78,3 °C và cho
vào 50,0 g nước ở 23,7 °C trong nhiệt lượng kế đẳng áp. Nhiệt độ cuối cùng của nước là 31,0 °C. Đây có
phải là vàng nguyên chất. ĐS: 3,07 J g-1 K-1
30. (E51) In each of the following processes, is any work done when the reaction is carried out at
constant pressure in a vessel open to the atmosphere? If so, is work done by the reacting system
or on it? (a) Neutralization of Ba(OH)2 by HCl(aq); (b) conversion of gaseous nitrogen dioxide to
gaseous dinitrogen tetroxide; (c) decomposition of calcium carbonate to calcium oxide and carbon dioxide gas.
Hãy xác định quá trình nào sau đây sinh công, nhận công hay công bằng không ở điều kiện áp suất không
đổi và hệ thống mở (a) Sự trung hòa dung dịch Ba(OH)2 bằng dung dịch acid HCl; (b) khí NO2 chuyển
thành khí N2O4; (c) phân huỷ của canxi cacbonat thành oxit canxi và khí carbonic.
31. (E137) Write the balanced chemical equations for reactions that have the following as their
standard enthalpy changes.
Hãy viết các phương trình phản ứng hóa học tương ứng cho các nhiệt tiêu chuẩn sau a. ∆ 𝐻
𝐻𝐻= 82,05 kJ/mol N 2O (k) b. ∆𝐻𝐻𝐻 = −394,1 kJ/mol SO 2Cl2 (l) c. ∆ 𝐻𝐻𝐻 𝐻𝐻
= −1527 kJ/mol CH3CH2COOH (l) 𝐻
32. (E70) Given the following information: 1 3 𝐻
N2 (k) + H2 (k)→ NH3(k) ∆𝐻1 = −46.2 kJ 2 2 5 3 𝐻
NH3 (k) + O2 (k)→ NO (k) + H2O (l) ∆𝐻2 = −292.3 kJ 4 2 1 𝐻
H2 (k) + O2 (k)→H2O (l)
∆𝐻3 = −285.8 kJ 2
Determine ∆Ho for the following reaction: N2 (k) + O2 (k) →2 NO (k), expressed in term of ∆𝐻𝐻, ∆𝐻𝐻 1 2 and ∆𝐻𝐻. 3
Hãy xác định ∆𝐻𝐻 của phản ứng sau: N2 (k) + O2 (k) →2 NO (k)
33. (E77) One glucose molecule, C6H12O6 (s) is converted to two lactic acid molecules,
CH3CH(OH)COOH (r) during glycolysis. Given the combustion reactions of glucose and lactic
acid, determine the standard enthalpy for glycolysis.
Trong quá trình lên men, một phân tử glucose, C6H12O6 (r) sẽ chuyển hóa thành hai phân tử acid lactic,
CH3CH(OH)COOH (r). Cho biết nhiệt phản ứng đốt cháy của glucose và acid lactic, hãy xác định enthalpy
tiêu chuẩn của quá trình chuyển hóa trên.
C6H12O6 (r) + 6 O2 (k) →6 CO2 (k) + 6 H2O (l)∆𝐻𝐻 1
= 2808 kJ
CH3CH(OH)COOH (r) + 3 O2 (k) → 3 CO2 (k) + 3 H2O (l)∆𝐻𝐻
2 = 1344 kJ ĐS: -120 kJ
34. (E81) Use the information given here, data from Appendix D, and equation (7.21) to
calculate the standard enthalpy of formation per mole of ZnS(s).
Tra cứu bảng số liệu nhiệt tạo thành tiêu chuẩn, hãy tính nhiệt tạo thành mol tiêu chuẩn của ZnS rắn theo
phản ứng sau: 2 ZnS (r) + 3 O2 (k) →2 ZnO (r) + 2 SO2 (k)∆𝐻𝐻= 878,2 kJ ĐS: -206 kJ/mol
35. (E91) The decomposition of limestone, CaCO3 (s), into quicklime, CaO(s), and CO2 (g) is carried
out in a gas-fired kiln. Use data from Appendix D to determine how much heat is required to
decompose 1,35×103 kg CaCO3(s). (Assume that heats of reaction are the same as at and 1 bar.)
Nhiệt phân CaCO3 (r) cho ra CaO (r) và CO2 (k). Từ bảng số liệu nhiệt tạo thành tiêu chuẩn, hãy tính cần
cung cấp bao nhiêu nhiệt lượng để nhiệt phân 1,35×103 kg CaCO3 rắn ở điều kiện chuẩn. ĐS: 2,40 x 106 kJ
36. (E95) A British thermal unit (Btu) is defined as the quantity of heat required to change the
temperature of 1 lb of water by 1 oF. Assume the specific heat of water to be independent of
temperature. How much heat is required to raise the temperature of the water in a 40 gal water
heater from 48 to 145 °F in (a) Btu; (b) kcal; (c) kJ?
Btu hay BTU (viết tắt của British thermal unit, tức là đơn vị nhiệt Anh) là một đơn vị năng lượng được định
nghĩa là lượng nhiệt cần thiết để thay đổi nhiệt độ của 1 lb (pound) nước là 1 oF. Xem nhiệt dung riêng
không phụ thuộc vào nhiệt độ, hãy cho biết nhiệt lượng cần thiết để tăng nhiệt độ 40 gallon nước từ 48
đến 145 °F theo đơn vị (a) Btu, (b) kcal và (c) kJ. ĐS: 3,4 x 104 kJ
37. (E130) The temperature increase of 225 mLof water at 25 oC contained in a Styrofoam cup is
noted when a 125 g ample of a metal at 75 oC is added. With reference to Appendix, the greatest
temperature increase will be noted if the metal is (a) lead; (b) aluminum; (c) iron; (d) copper.
Cho một mẫu kim loại có khối lượng là 125 g ở 75 oC vào 225 mL nước ở 25 oC trong cốc Styrofoam. Dựa số
liệu nhiệt dung riêng của một số chất: Cu (0,385 J g-1 oC-1), Fe (0,449 J g-1 oC-1), Al (0,879 J g-1 oC-1), Pb
(0,130 J g-1 oC-1) hãy cho biết nhiệt độ hệ sẽ tăng cao nhất khi là kim loại nào: chì, nhôm, sắt hay đồng?
38. (E101) A particular natural gas consists, in mole percents, of 83.0% CH4, 11.2% C2H6 and 5.8%
C3H8. A 385 L sample of this gas, measured at 22.6 oC and 739 mmHg, is burned at constant
pressure in an excess of oxygen gas. How much heat, in kilojoules, is evolved in the combustion reaction?
Một hỗn hợp khí gồm 83,0 % CH4, 11,2% C2H6 và 5,8 % C3H8 theo số mol. Một thể tích 385 L hỗn hợp khí có
nhiệt độ 22,6 oC và áp suất là 739 mmHg được đốt cháy với oxy dư ở điều kiện đẳng áp. Vậy có bao
nhiêu nhiệt (kJ) tỏa ra khi đốt lượng hỗn hợp khí trên? ĐS: 1,61 x 104 kJ
39. (E104) A calorimeter that measures an exothermic heat of reaction by the quantity of ice that can
be melted is called an ice calorimeter. Now consider that 0.100 L of methane gas, at and 744
mmHg is burned at constant pressure in air. The heat liberated is captured and used to melt 9.53
g ice at 0 oC (∆Ho of ice is 6,01 kJ/mol). Write an equation for the complete combustion of and fusion
show that combustion is incomplete in this case.
Khí metan có thể tích 0,1 L tại 25 oC và 744 mmHg được đốt cháy ở áp suất không đổi trong không khí.
Lượng nhiệt giải phóng được sử dụng để làm nóng chảy 9,53 g băng ở 0 oC𝐻 (∆𝐻𝐻 của băng là ó𝐻g 𝐻 ℎả𝐻
6,01 kJ/mol). Vậy quá trình đốt cháy CH4 trong trường hợp này là hoàn toàn hay không? Viết phương
trình phản ứng thích hợp của phản ứng đốt cháy khí metan ở điều kiện trên.
40. (E138) The standard molar heats of combustion of C(graphite) and CO(g) are −393.5 and −283.0 kJ/mol
respectively. Use those data and that for the following reaction
CO (k) + Cl2 (k) → COCl2 (k) có ∆Ho = −108 kJ to calculate the standard molar enthalpy of formation of COCl2(g).
Nhiệt đốt cháy mol tiêu chuẩn của carbon graphite là −393,5 kJ/mol và của khí carbon monoxide là −283,0
kJ/mol. Hãy tính nhiệt tạo thành mol tiêu chuẩn của khí phosgene (COCl2), biết phản ứng: CO (k) + Cl2 (k)
→ COCl2 (k) có ∆𝐻𝐻 = −108 kJ ĐS: -218 kJ/mol
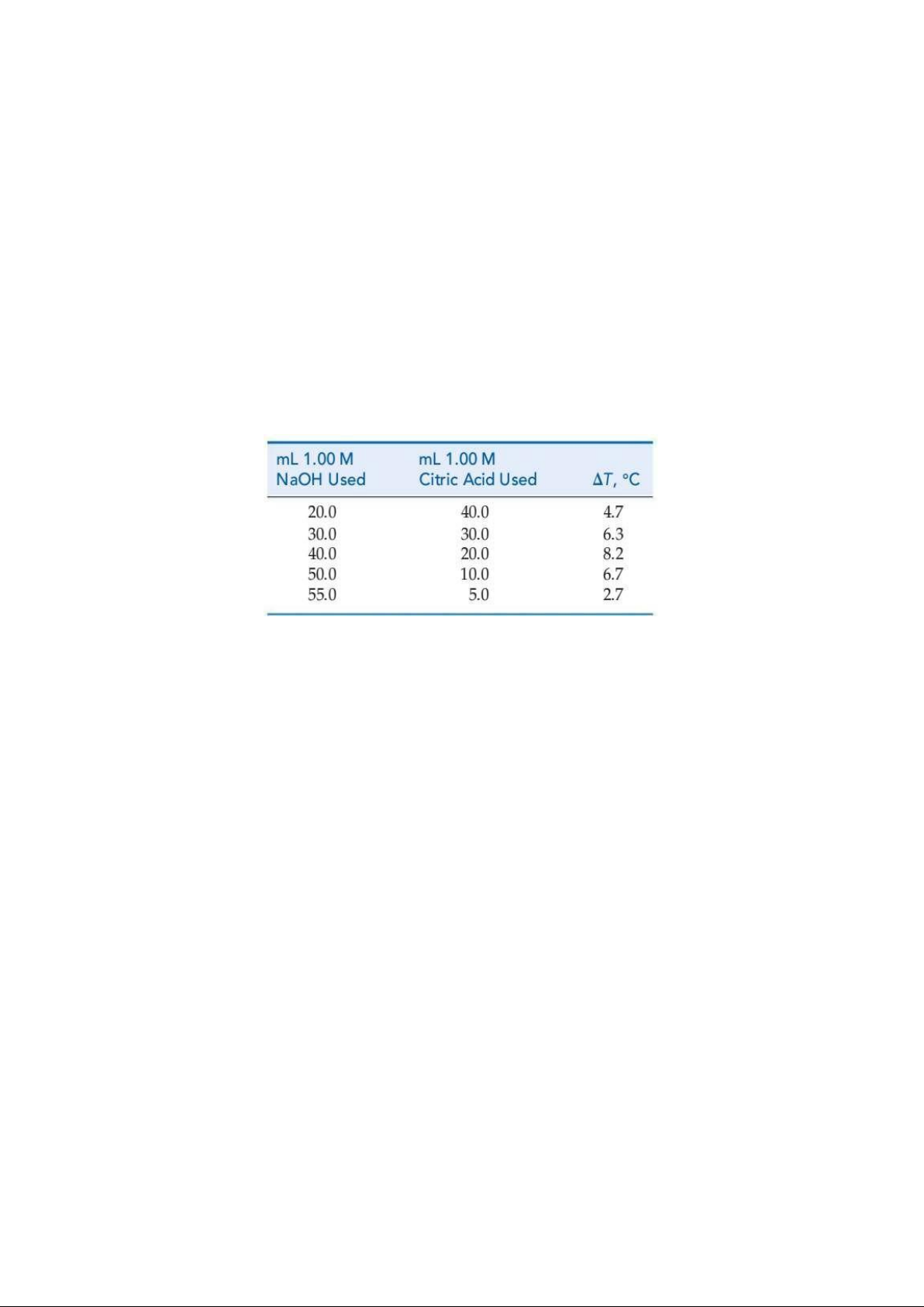
41. (E122) We can use the heat liberated by a neutralization reaction as a means of establishing the
stoichiometry of the reaction. The data in the appendix are for the reaction of 1.00 M NaOH with
1.00 M citric acid, C6H8O7, in a total solution volume of 60.0 mL.
(a) Why is the temperature change in the neutralization greatest when the reactants are in their
exact stoichiometric proportions? That is, why not use an excess of one of the reactants to
ensure that the neutralization has gone to completion to achieve the maximum temperature increase.
(b) Rewrite the formula of citric acid to reflect more precisely its acidic properties. Then write a
balanced net ionic equation for the neutralization reaction.
Phản ứng trung hòa giữa các lượng thể tích khác nhau của NaOH nồng độ 1,00 M với acid citric C6H8O7
nồng độ 1,00 M được ghi nhận ở bảng bên dưới.
a. Tại sao nhiệt độ của phản ứng thay đổi nhiều nhất khi phản ứng trung hòa xảy ra hoàn toàn.
b. Hãy viết công thức cấu tạo thể hiện tính acid của acid citric. Từ đó viết phương trình phản ứng
trung hòa trên.
CHAPTER 2. THERMODYNAMIC CHEMISTRY: ENTROPY–GIBBS ENERGY / CHƯƠNG 2.
NHIỆT ĐỘNG HỌC: ENTROPY – NĂNG LƯỢNG GIBBS 1. (EX 19.1)
A. Predict whether entropy increases or decreases in each of the following reactions.
(a) The Claus process for removing H2S from natural gas: 2 H2S (g) + SO2(g) → 3 S(s) + 2 H2O(g)
(b) the decomposition of mercury(II) oxide: 2 HgO (s) → 2 Hg(l) + O2(k)
B. Predict whether entropy increases or decreases or whether the outcome is uncertain ineach of the following reactions.
(a) Zn(s) + Ag2O(s) → ZnO(s) + 2 Ag(s)
(b) the chlor-alkali process, 2 Cl–(aq) + 2 H2O(l) → 2 OH–(aq) + Cl2(g) + H2(g)
Dự đoán entropy tăng, giảm hay không thể dự đoán (kèm giải thích) cho các phản ứng sau:
a. 2 H2S (k) + SO2(k) → 3 S(r) + 2 H2O(k)
b. 2 HgO(r) → 2 Hg(l) + O2(k)
c. Zn(r) + Ag2O(r) → ZnO(r) + 2 Ag(r)
d. 2 Cl–(dd) + 2 H2O(l) → 2 OH–(dd) + Cl2(k) + H2(k)
2. (EX 19.2) A. What is the standard molar entropy of vaporization, for a chlorofluorocarbon that once was
heavily used in refrigeration systems? Its normal boiling point is −29,79 oC and ∆H°vap = 20.2 kJ.mol–1.
Hãy tính entropy mol chuẩn ∆Sovap cho quá trình bay hơi của CCl2F2, cho biết nhiệt độ sôi của CCl2F2 là
−29,79 oC và nhiệt hóa hơi ∆Hovap = 20,2 kJ.mol−1. ĐS: 83 J mol-1 K-1
3. (EX 19.2) B. The entropy change for the transition from solid rhombic sulfur to solid monoclinic sulfur at
95.5 oC is ∆Sotr = 1,09 J.mol−1K−1. What is the standard molar enthalpy change, ∆Hotr, for this transition
Sự thay đổi entropy mol chuẩn cho quá trình chuyển trạng thái thù hình từ rhombic sulfur rắn sang
monoclinic sulfur rắn ở 95,5 oC là ∆Sotr = 1,09 J.mol−1K−1. Hãy tính enthalpy mol chuẩn ∆Hotr cho quá trình
chuyển trạng thái trên. ĐS: 402 J mol-1
4. (EX 19.3) A. Use data from Appendix D to calculate the standard molar entropy change for the
synthesis of ammonia from its elements. N2(k) + 3 H2(k) → 2 NH3(k) ∆So298K = ?
Sử dụng các số liệu entropy mol chuẩn của các chất (tra cứu trong Handbook) để tính biến thiên entropy
mol chuẩn cho phản ứng tổng hợp ammonia ở 25 oC: N2(k) + 3 H2(k) → 2 NH3(k) ĐS: -361,1 J mol-1K-1
5. (EX 19.3) B. N2O3 is an unstable oxide that readily decomposes. The decomposition of 1.00 mol
of to nitrogen monoxide and nitrogen dioxide at is accompanied by the entropy change ∆S° = 138.5
J K-1. What is the standard molar entropy of at 25 °C?
N2O3 là một oxid không bền, dễ bị phân hủy theo phương trình phản ứng sau:
N2O3(k) → NO(k) + NO2(k) có ∆So298K = 138,5 J.K−1. Hãy tính entropy mol tiêu chuẩn của N2O3(k) ở 25 oC. ĐS: 312,3 J mol-1K-1
6. (EX 19.4) A. Which of the four cases in Table 19.1would apply to each of the following reactions:
(a) N2(g) + 3 H2(g) → 2 NH3(g) ∆Ho298K = −92,22 kJ
(b) 2 C(graphite) + 2 H2(g) → C2H4(g) ∆Ho298K = 52,26 Kj
Dự đoán các phản ứng sau có xảy ra tự nhiên ở nhiệt độ thường hay không?
a. N2(k) + 3 H2(k) → 2 NH3(k) ∆Ho298K = −92,22 kJ
b. 2 C(graphite) + 2 H2(k) → C2H4(k) ∆Ho298K = 52,26 kJ ĐS: a. Có b. không
7. (EX 19.4) B. Under what temperature conditions would the following reactions occur
spontaneously? (a) The decomposition of calcium carbonate into calcium oxide and carbon
dioxide. (b) The roasting of zinc sulfide in oxygen to form zinc oxide and sulfur dioxide. This
exothermic reaction releases 439.1 kJ for every mole of zinc sulfide that reacts.
Ở điều kiện nhiệt độ nào để các phản ứng sau xảy ra tự nhiên?
a. CaCO3(r) → CaO(r) +CO2(k)
b. ZnS(r) + 3/2 O2(k) → ZnO(r) + SO2(k) ∆Ho298K = −439,1 kJ
8. (EX 19.5) A. Determine ∆Go at 298.15 K for the reaction 4 Fe(r) + 3 O2(k) → 2 Fe2O3(r) ∆Ho298K =
−1648 kJ and ∆So298K = −549.3 J K−1
Tính ∆Go ở 298 K cho phản ứng sau: 4 Fe(r) + 3 O2(k) → 2 Fe2O3(r) ∆Go298K = ? Cho biết ∆Ho298K = −1648 kJ
và ∆So298K = −549,3 J K−1 ĐS: -1484.3 kJ
9. (EX 19.5) B. Determine for the reaction in Example 19–5 by using data from Appendix D. Compare the two results.
Tính ∆Go ở 298 K cho phản ứng sau bằng cách sử dụng năng lượng tự do mol chuẩn của các chất (tra
trong Handbook) 2 NO (k) + O2 (k) → 2 NO2 (k)∆Go298K = ? ĐS: -70.48 kJ 10. (EX 19.7)
A. Use the data in Appendix D to decide whether the following reaction is spontaneous under
standard conditions at 298.15 K. N2O4(g) → 2 NO2(g)
B. If a gaseous mixture of and both at a pressure of 0.5 bar, is introduced into a previously
evacuated vessel, which of the two gases will spontaneously convert into the other at 298.15 K.
a. Sử dụng các số liệu nhiệt động cần thiết của các chất (tra cứu trong Handbook, cho biết
phản ứng sau có xảy ra tự nhiên ở nhiệt độ 298K không? N2O4(k) → 2 NO2(k)
b. Nếu ban đầu trong bình có hỗn hợp hai khí N2O4 và NO2 với áp suất mỗi khí là 0,5 bar thì
phản ứng trên sẽ xảy ra tự nhiên theo chiều nào? Giải thích.
ĐS: a. ∆G>0; b.chiều nghịch vì Q>Kp
11. (EX 19.8) A. Determine the equilibrium constant at 298.15 K for AgI(s) ⮀ Ag+(aq) + I−(aq)
Compare your answer to the for AgI in Appendix D.
Sử dụng các số liệu nhiệt động cần thiết của các chất (tra cứu trong Handbook) tính hằng số cân bằng cho
quá trình sau ở 298K: AgI(r) ⮀ Ag+(dd) + I−(dd). So sánh với trị số Ksp của AgI tra trong bảng. ĐS: 8.3x10-17
12. (EX 19.8) B. At 298.15 K, should manganese dioxide react to an appreciable extent with 1 M
HCl(aq), producing manganese(II) ion in solution and chlorine gas?
Tại 25 oC, mangan dioxit có phản ứng với một mức độ đáng kể với dung dịch HCl 1 M để tạo ra ion
mangan (II) trong dung dịch và khí chlorine không?
ĐS: ∆G>0 phản ứng không xảy ra
13. (EX 19.9) A. At what temperature will the formation of NO (g) from NO(g) and O2(g) have Kp =
1.50×102? For the reaction 2 NO(g) + Cl2(g) ⮀ 2 NOCl(g)at 25 oC, ∆Ho = −114,1 kJ.mol−1 và ∆So = −146,5 J.mol−1.K−1.
Tại 25 oC phản ứng: 2 NO(k) + O2(k) ⮀ 2 NO2(k) có ∆Ho = −114,1 kJ.mol−1 và ∆So = −146,5 J.mol−1.K−1. Hãy
xác định nhiệt độ mà tại đó cân bằng trên có Kp = 1,5×102 ĐS: 1698 K
14. (EX 19.9) B. For the reaction 2 NO(g) + Cl2(g) ⮀ 2 NOCl(g), what is the value of K at (a) 25 oC
(b) 75 oC Use data from Example 19–9. [Hint: The solution to part (a)can be done somewhat more simply than that for (b)].
Xét cân bằng sau ở 25 oC: 2 NO(k) + Cl2(k) ⮀ 2 NOCl(k) có ∆Ho = −114,1 kJ.mol−1 và ∆So = −146,5
J.mol−1.K−1. Tính hằng số cân bằng KP cho phản ứng trên ở 25 oC và ở 75 oC. ĐS: 2,22x1012 và 2,97x109 15. (EX 19.10)
A. Estimate the temperature at which for the reaction in Example 19-10. Use data from Appendix and Figure 19-12.
B. What is the value of for the reaction 2 SO2(g) + O2(g) ⮀ 2 SO3(g) at 235 oC. Use data from
Appendix, Figure 19-12 and the van’t Hoff equation (19.15)
Cho phản ứng: 2 SO2(k) + O2(k) ⮀ 2 SO3(k) có ∆Ho = −1,8×102 kJ.mol−1
a. Tại 900K phản ứng trên có Kp = 42. Hãy xác định nhiệt độ mà tại đó phản ứng có Kp = 5,8×10−2
b. . Tính Kp cho phản ứng trên ở nhiệt độ 235 oC? ĐS: 1239 K
16. (E.2) Arrange the entropy changes of the following processes, all at 25 oC, in the expected order of
increasing ∆S and explain your reasoning:
(a) H2O (l, 1 atm) → H2O (k, 1 atm)
(b) CO2 (s, 1 atm) → CO2 (k, 10 mmHg)
(c) H2O (l, 1 atm) → H2O (k, 10 mmHg)
Sắp xếp sự biến đổi entropy (∆S) của các quá trình (tại 25 oC) sau đây theo thứ tự tăng dần:
a. H2O (l, 1 atm) → H2O (k, 1 atm)
b. CO2 (s, 1 atm) → CO2 (k, 10 mmHg)
c. H2O (l, 1 atm) → H2O (k, 10 mmHg) ĐS: b-c-a
17. (E.10) Pentane is one of the most volatile of the hydrocarbons in gasoline. At 298.15 K, the
following enthalpies of formation are given for pentane ∆𝐻𝐻C5H12 (l): -173,5 kJ mol-1; ∆𝐻𝐻C5H12 (k) = –146,9 kJ 𝐻 𝐻
(a) Estimate the normal boiling point of pentane.
(b) Estimate for the vaporization of pentane at 298 K.
(c) Comment on the significance of the sign of ∆𝐻𝐻 at 298 K.
Pentane là một trong những hydrocarbon dễ bay hơi trong xăng. Tại 298.15 K, các giá trị enthalpy tạo
thành của pentane có giá trị sau: ∆𝐻𝐻C5H12 (l) = –173,5 kJ mol–1; ∆𝐻𝐻C5H12 (k) = –146,9 kJ mol–1. 𝐻 𝐻
a. Ước lượng nhiệt độ sôi của pentane.
b. Ước lượng giá trị ∆𝐻𝐻 cho quá trình hóa hơi của pentane tại 298 K.
c. Rút ra nhận xét từ giá trị ∆𝐻𝐻 tại 298 K thu được. ĐS: a. 305,7 K b.0,674 kJ
18. (E.31) Assess the feasibility of the reaction N2H4 (k) + 2 OF2 (k) → N2F4 (k) + 2 H2O (k) by
determining each of the following quantities for this reaction at 25 oC
(a) ∆So (The standard molar entropy of N2F4 (g) is 301.2 J K–1)
(b) ∆Ho (Use data from Appendix and FO and NF bond energies of 222 and respectively) (c) ∆G°
Cho phản ứng: N2H4 (k) + 2 OF2 (k) → N2F4 (k) + 2 H2O (k). Xác định các giá trị sau và nhận xét chiều phản
ứng tại 25 oC.
a. ∆So (biết So298 N2F4 (k) = 301,2 J.K–1).
b. ∆Ho (sử dụng số liệu trong bảng phụ lục và năng lượng liên kết của F–O và N–F tương ứng là 222 và
301 kJ mol–1. c. ∆Go.
ĐS: a. -54.78 J b. -616 kJ c. -600 kJ
19. (E.68) Following are some standard Gibbs energies of formation, per mole of metal oxide at 1000
K: NiO –115 kJ; MnO, –280 kJ; TiO2, –630 kJ. The standard Gibbs energy of formation of CO at
1000 K is –250 kJ per mol CO. Use the method of coupled reactions (page 851) to determine
which of these metal oxides can be reduced to the metal by a spontaneous reaction with carbon
at 1000 K and with all reactants and products in their standard states.
Cho giá trị ∆𝐻𝐻𝐻 của các oxit kim loại tại 1000 K là: NiO, –115kJ; MnO
2, –280 kJ; TiO2, –630 kJ. Năng lượng
tự do Gibb tạo thành của CO là –250 kJ/mol. Xác định oxit kim loại nào sẽ bị khử bởi C tại 1000 K. (Các
chất đều ở trạng thái chuẩn). ĐS: NiO
20. (E.68) Consider the vaporization of water: at with in its standard state, but with the partial pressure of at
2.0 atm. Which of the following statements about this vaporization at are true? (a) ∆Go = 0; (b) ∆G = 0;
(c) ∆Go > 0; (d) ∆G > 0. Explain
Xem xét quá trình hóa hơi nước: H2O(l) → H2O (k) tại 100 oC, với H2O(l) trong trạng thái chuẩn, H2O (k)
có áp suất riêng phần là 2,0 atm. Phát biểu nào sau đây về quá trình trên là đúng? (a) ∆Go = 0; (b) ∆G = 0;
(c) ∆Go > 0; (d) ∆G > 0. Giải thích. ĐS: b
21. (E.6) Which substance in each of the following pairs would have the greater entropy? Explain. (a)
at and 1 atm: 1 mol H2O (l) or 1 mol H2O (g)
(b) at and 1 atm: 50.0 g Fe(s) or 0.80 mol Fe(s)
(c) 1 mol Br2 (l, 1 atm, 8 oC) or 1 mol Br2 (s, 1 atm, –8 oC)
(d) 0.312 mol SO2 (g, 0.110 atm, 32.5 oC) or O2 0.284 mol (g, 15.0 atm, 22.3 oC)
So sánh giá trị entropy trong mỗi cặp chất sau:
a. Tại 75 oC và 1 atm: 1 mol H2O(l) và 1 mol H2O (k)
b. Tại 5 oC và 1 atm: 50,0 g Fe(r) và 0.80 mol Fe(r)
c. 1 mol Br2 (l, 1 atm, 8 oC) và 1 mol Br2 (s, 1 atm, –8 oC)
d. 0,312 mol SO2 (k, 0,110 atm, 32,5 oC) hay 0,284 mol O2 (k, 15,0 atm, 22,3 oC).
22. (E.8) By analogy to and how would you define entropy of formation? Which would have the
largest entropy of formation: CH4 (g), CH3CH2OH (l), or CS2(l)? First make a qualitative
prediction; then test your prediction with data from Appendix D.
Dự đoán chất nào trong các chất sau có entropy tạo thành lớn nhất: CH4 (k), CH3CH2OH (l), hay CS2(l). Sau
đó kiểm tra bằng các số liệu tra trong phụ lục D. ĐS: CH4(k)
23. (E.36) Calculate the equilibrium constant and Gibbs energy for the reaction CO (k) + 2 H2 (k) →
CH3OH (k) tại 483 K by using the data tables from Appendix D. Are the values determined here
different from or the same as those in exercise 35? Explain.
Tính năng lượng tự do Gibbs của phản ứng sau CO (k) + 2 H2 (k) → CH3OH (k) tại 483 K. (Tra các số liệu trong phụ lục D).
24. (E.41) Use thermodynamic data at 298 K to decide in which direction the reaction 2 SO2 (g) +
O2 (g) 2 SO3 (g) is spontaneous when the partial pressures of SO2, O2 and SO3 are 1,0×10–4,
0.20, and 0.10 atm, respectively.
Dùng các số liệu nhiệt động tại 298 K xác định chiều tự diễn ra của phản ứng sau: 2 SO2 (k) + O2 (k) 2 SO3
(k) tại áp suất riêng phần của SO2, O2 và SO3 lần lượt là 1,0×10–4; 0,20 và 0,10 atm. ĐS: chiều thuận
25. (E.55) Use data from Appendix D to establish at 298 K for the reaction: 2 NaHCO3(s) → Na2CO3(s) + H2O(l)
+ CO2 (g) (a) ∆So (b) ∆Ho (c) ∆Go (d) K.
Cho phản ứng: 2 NaHCO3(r) → Na2CO3(r) + H2O(l) + CO2 (k). Tính các giá trị ∆So, ∆Ho, ∆Go, K.
ĐS: 334,2 J/K; 129,1 kJ và 29,45 kJ
26. (E.86) The decomposition of the poisonous gas phosgene is represented by the equation COCl2 (k) CO
(k) + Cl2. Values of for this reaction are Kp = 6.7×10–9 at 99.8 oC and 4.44×10–2 at 395 oC. At
what temperature is 15% dissociated when the total gas pressure is maintained at 1.00 atm?
Sự phân hủy của khí độc phosgene được minh họa qua phương trình: COCl2 (k) CO (k) + Cl2 (k). Giá trị KP
của phương trình là 6,7×10–9 tại 99,8 oC và 4,44×10–2 tại 395 oC. Khi áp suất tổng được duy trì là 1 atm,
xác định nhiệt độ tại đó 15% COCl2 bị phân hủy. ĐS: 756,5K
27. (E.109) A handbook lists the following standard enthalpies of formation at 298 K for cyclopentane
∆𝐻𝐻C5H10 (l) = –105.9 kJ mol–1, and ∆𝐻𝐻C5H10 (k) = –77.2 kJ mol–1 𝐻 𝐻
a. Estimate the normal boiling point of cyclopentane.
b. Estimate ∆𝐻𝐻 for the vaporization of cyclopentane at 298 K
c. Comment on the significance of the sign of ∆𝐻𝐻 at 298 K
Cho các số liệu ∆𝐻𝐻C5H10 (l) = –105,9 kJ mol–1; ∆𝐻𝐻C5H10 (k) = –77,2 kJ mol–1 𝐻 𝐻
a. Ước lượng nhiệt độ sôi của cyclopentane.
b. Ước lượng ∆Go cho quá trình hóa hơi của cyclopentane tại 298 K.
c. Nhận xét về dấu của ∆Go tại 298 K. ĐS: a. 329.9K b. 2,77 kJ
28. (E.110) Consider the reaction: NH4NO3 (s) N2O (g) + 2 H2O(l) at 298 K.
(a) Is the forward reaction endothermic or exothermic?
(b) What is the value of ∆Go at 298 K?
(c) What is the value of K at 298 K?
(d) Does the reaction tend to occur spontaneously at temperatures above 298 K, below 298 K, both, or neither
Xét phản ứng NH4NO3(r) N2O (k) + 2 H2O(l) tại 298 K.
a. Phản ứng thuận thu nhiệt hay tỏa nhiệt?
b. Tính giá trị ∆Go tại 298 K.
c. Tính K tại 298 K.
29. (E.112) At room temperature and normal atmospheric pressure, is the entropy of the universe
positive, negative, or zero for the transition of carbon dioxide solid to liquid?
Tại nhiệt độ phòng và áp suất thường, entropy của vũ trụ âm, dương hay bằng không cho sự chuyển pha
của CO2 rắn thành lỏng?
CHAPTER 3. CHEMICAL KINETICS / Chương 3. ĐỘNG HÓA HỌC
1. (EX-14-1A) At some point in the reaction 2 A + B → C + D, [A] = 0.3629 M. At a time 8.25 min
later [A] = 0.3187. What is the average rate of reaction during this time interval, expressed in M s– 1?
Xét phản ứng 2 A + B C + D ở tại thời điểm [A] = 0,3629 M. Sau 8,25 phút [A] = 0,3187 M. Tính tốc độ
trung bình của phản ứng (theo đơn vị M/s) trong khoản thời gian trên.
2. (EX–14-1B) In the reaction 2 A → 3 B, [A] drops from 0.5684 M to 0.5522 M in 2.50 min. What is
the average rate of formation of B during this time interval, expressed in M s–1?
Trong phản ứng 2 A → 3 B, [A] giảm từ 0,5684 M đến 0,5522 M trong 2,50 phút. Tính tốc độ trung bình
của sự hình thành B (theo đơn vị M/s) trong khoản thời gian trên.
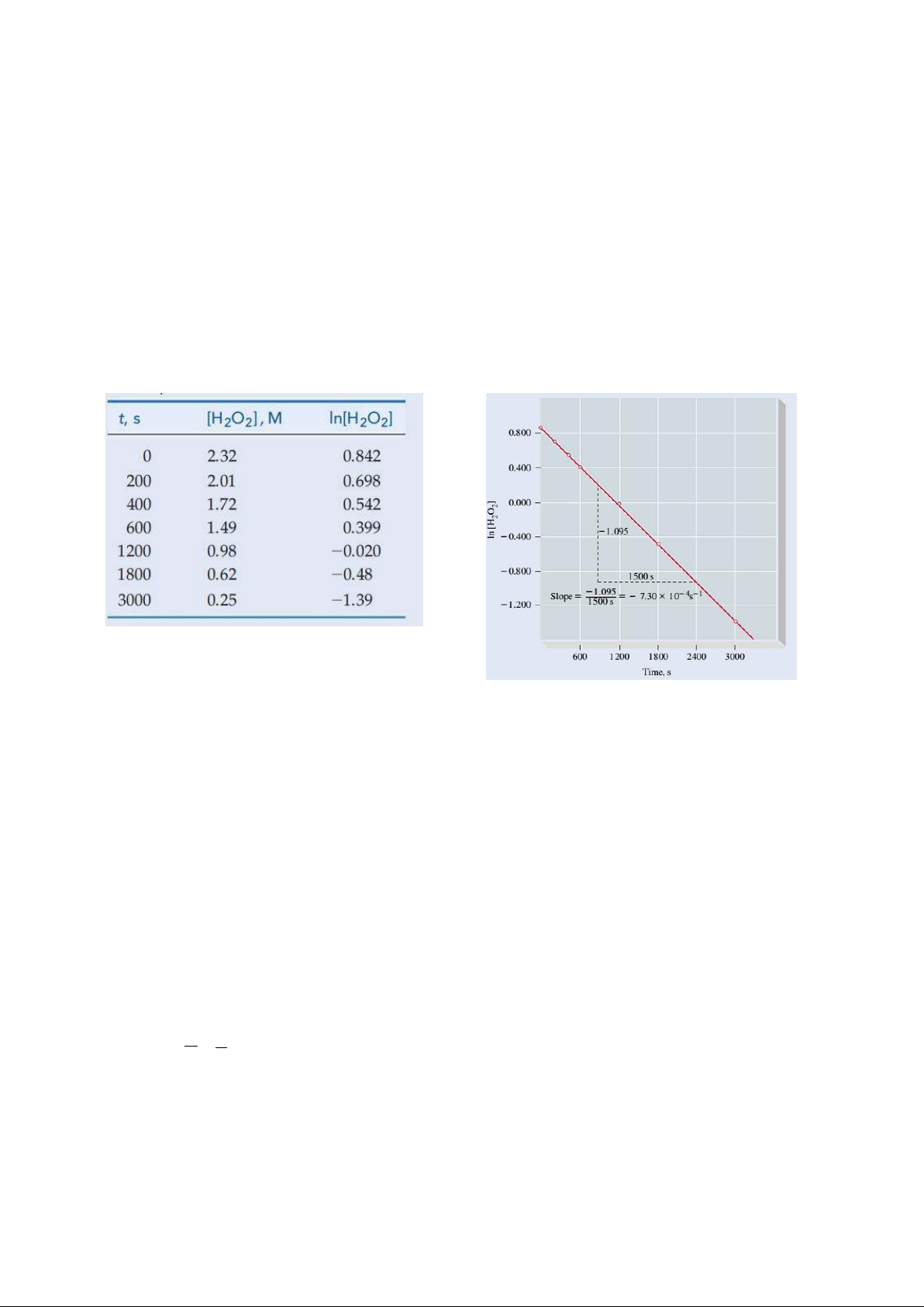
3. (EX-14-2A) For reaction H O (aq) → H O(l) + ½ O (g), determine (a) the instantaneous rate of 2 2 2 2
reaction at 2400 s and (b) [H2O2] at 2450 s. [Hint: Assume that the instantaneous rate of reaction
at 2400 s holds constant for the next 50 s.]
Xét phản ứng: H O (aq) → H O(l) + ½ O (g) và số liệu trong bảng bên dưới. Xác định: 2 2 2 2
(a) Tốc độ tức thời của phản ứng ở 2400 s
(b) Nồng độ [H O ] ở 2450 s (Giả sử tốc độ tức thời của phản ứng ở 2400 s giữ không đổi trong vòng 50 s 2 2 kế tiếp). Time, s [H2O2], M 0 2.32 200 2.01 400 1.72 600 1.49 1200 0.98 1800 0.62 3000 0.25
4. (EX-14-2B) Use data only from the following table to determine [H O ] at t = 100 s. Compare this value 2 2
with the one calculated in Example 14-2(b). Explain the reason for the difference?
Xét phản ứng phân hủy H O . Sử dụng bảng dữ liệu sau xác định [H O ] ở t = 100 s. 2 2 2 2
Time (s) t (s) [H O2] (M) [H O 2] (M) [H O2]/t (M s1) 2 2 2 0 400 2.32 0.60 15.0 ×104 400 400 1.72 0.42 10.5 ×104 800 400 1.30 0.32 8.0 ×104 1200 400 0.98 0.25 6.3 ×104 1600 400 0.73 0.19 4.8 ×104 2000 400 0.54 0.15 3.8 ×104 2400 400 0.39 0.11 2.8 ×104 2800 400 0.28
5. (EX-14-3A) The decomposition of N O is given by the following equation: –5 –1 2 5
2 N O → 4 NO + O . At an initial [N
= 3.15 M, the initial rate of reaction = 5.45×10 M and O ] s 2 5 2 2 2 5 0 –5 –1
when [N O = 0.78 M, the initial rate of reaction =
M s . Determine the order of this ] 1.35×10 2 5 0 decomposition reaction.
Xét phản ứng phân hủy N O theo phương trình sau: 2 N O → 4 NO + O 2 5 2 5 2 2 –5 –1
Khi nồng độ đầu của [N O ] = 3,15 M tốc độ đầu của phản ứng = 5,45×10 Ms và khi [N O ] = 0,78 M 2 5 0 2 5 0 –5 –1
tốc độ đầu của phản ứng = 1,35×10 Ms . Xác định bậc của phản ứng phân hủy này.
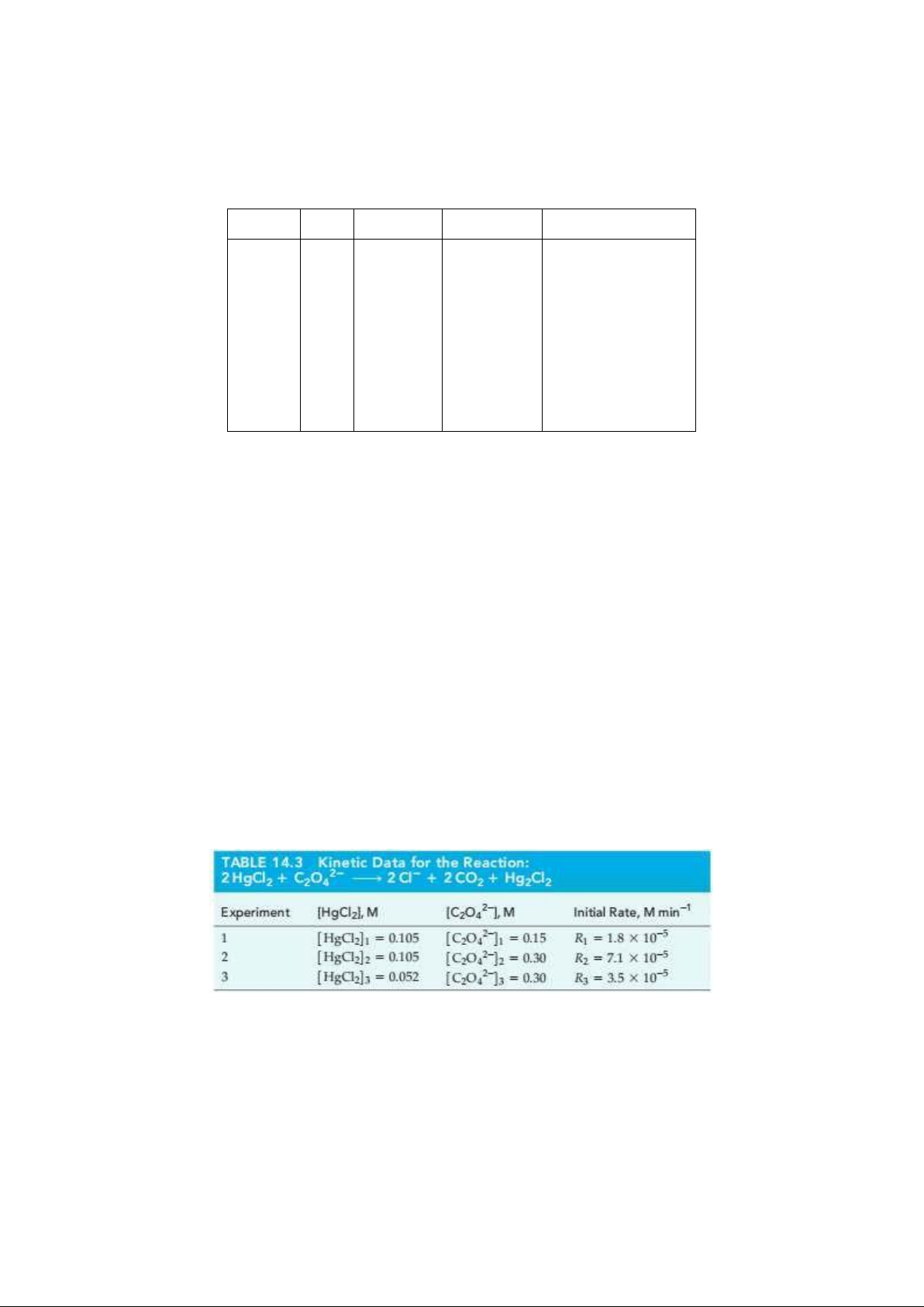
6. (EX-14-3B) Consider a hypothetical Experiment 4 in Table 14.3, in which the initial conditions are 2– 2– 2
[HgCl ] = 0.025 M and [C O ] = 0.045, v = k [HgCl [C
] . Predict the initial rate of reaction. 2 0 2 4 0 ] O 2 2 2 2– 4 –
Dự đoán tốc độ đầu của phản ứng: 2 HgCl + C O
2Cl + 2CO + Hg Cl 2 2 4 2 2 2 2–
Biết nồng độ đầu của [HgCl ] = 0,025 M và [C O ] = 0,045. 2 0 2 4 0 2
7. (EX-14-4A) A reaction has the rate law: v = k [A] [B]. When [A] = 1.12 M and [B] = 0.87 M and the rate of –2 –1
reaction = 4.78×10 M s . What is the value of the rate constant, k? 2
Một phản ứng có phương trình động học v = k [A] [B]. Khi nồng độ [A] = 1,12 M và [B] = 0,87 M, tốc độ của –2 –1
phản ứng = 4,78×10 Ms . Xác định hằng số tốc độ k của phản ứng. 2– – 2– 2
8. (EX-14-4B) What is the rate of reaction 2 + C 2 + 2 + Hg Cl , v = k [C ] , HgCl O Cl CO [HgCl ] O 2 2 4 2 2 2 2 2 4 2– 2
at the point where [HgCl ] = 0.050 M and [C O ] = 0.025 M. 2 2 4 0 2– – 2– 2
Phản ứng 2HgCl + C O
2Cl + 2CO + Hg Cl . Có phương trình động học là: v = k [HgCl ] [C O ] . Xác 2 2 4 2 2 2 2 2 2 4 2–
định tốc độ của phản ứng khi [HgCl ] = 0,050 M và [C O ] = 0,025 M. 2 2 4 0 –3 –1
9. (EX-14-5A) The reaction
A 2 B + C is first order. If the initial [A] = 2.80 M and k = 3.02×10 s , what is the value of [A] after 325 s? – 3 –1
Phản ứng A
2B + C là phản ứng bậc 1. Nếu nồng độ đầu của [A] = 2,80 M và k = 3,02×10 s . Xác định
[A] sau 325 s.
10. (EX-14-5B) Use data in the following Figure and Table, together with equation 𝐻𝐻[𝐻]𝐻 = −𝐻𝐻 +
ln[𝐻]0, to show that the decomposition of H O is a first-order reaction. [Hint: Use a pair of data points for 2 2 H
2O2 0 and H2O2 t and their corresponding times to solve for k. Repeat this calculation using
other sets of data. How should the results compare?]
Chứng tỏ phản ứng phân hủy H O là phản ứng bậc 1, H O (aq) H O (l) + ½ O (k). Sử dụng đồ thị và 2 2 2 2 2 2
bảng dữ liệu động học sau. –3 –1
11. (EX-14-6A) Consider the first-order reactio n
A P with k = 2.95×10 s . What percent of A remains after 150 s? – 3 –1
Xét phản ứng bậc 1: A
P với k = 2,95×10 s . Sau 150 s, % còn lại của A bao nhiêu?
12. (EX-14-6B) At what time after the start of the reaction is a sample of [H O ] two–thirds decomposed? 2 2
Mất bao lâu để lượng mẫu [H O ] bị phân hủy 2/3 so với thời điểm bắt đầu phản ứng. Biết phản ứng phân 2 2
hủy H O tuân theo động học bậc 1. H O (aq) H O(l) + 1/2O (k) 2 2 2 2 2 2
13. (EX-14-7A) Di-t-butyl peroxide (DTBP) is used as a catalyst in the manufacture of
polymers. In the gaseous state, DTBP decomposes into acetone and ethane by a first-order reaction.
C H O (g) 2 CH COCH (g) + CH CH (g) 8 18 2 3 3 3 3
Start with DTBP at a pressure of 800.0 mmHg at 147 °C. What will be the pressure of DTBP at t = 125, if –1 t =
min. [Hint: Because 125 min is not an exact multiple of the half-life, you must use 1/2 8,0×10 ln(𝐻 equation
𝐻)𝐻 = −𝐻𝐻. Can you see that the answer is between 200 and 400 mmHg?] (𝐻𝐻)0
Di-t-butyl peroxide (DTBP) được dùng như một chất xúc tác trong sản xuất polymer. Ở trạng thái khí, DTBP
phân hủy thành acetone và ethane theo phản phản ứng bậc 1.
C H O (k) 2 CH COCH (k) + CH CH (k) 8 18 2 3 3 3 3
Nếu bắt đầu DTBP với áp suất 800,0 mmHg ở 147 °C thì áp suất của DTBP ở t = 125 phút là bao nhiêu? –1
Nếu biết t = 8,0×10 phút. 1/2
14. (EX-14-7B) Use data from Table 14.4 to determine (a) the partial pressure of ethylene oxide, and
(b) the total gas pressure after 30.0 h in a reaction vessel at 415 °C, if the initial partial pressure of (CH2)2O is 782 mmHg.
Sử dụng bản dữ liệu động học sau, xác định áp suất riêng phần của ethylene oxide và áp suất khí tổng
cộng sau 30,0 giờ trong bình phản ứng ở 415 °C, biết áp suất riêng phần ban đầu của ethylene oxide là 782 mmHg.
15. (EX-14-8A) In the decomposition reaction B products, the following data are
obtained. What are the order of this reaction and its rate constant k?
Xét phản ứng phân hủy B Sản phẩm, với dữ liệu động học theo sau. Xác định bậc và hằng số tốc độ
phản ứng k? t (s) 0 25 50 75 100 150 200 250 [B] (M) 0.88 0.74 0.62 0.52 0.44 0.31 0.22 0.16
16. (EX-14-8B) The following data are obtained for the reaction A P. What are the order of this
reaction and its rate constant, k?
Xác định bậc và hằng số k của phản ứng A P, với dự liệu động học sau: t (phút) 0 4.22 6.6 10.61 14.4 18.00 8 [A] (M) 0.250 0.210 0.188 0.15 0.11 0.083 0 4
17. (EX-14-9A) What is the half-life of the first-order decomposition of N O at 75.0 °C? With E 2 5 a
=1,06×105 J/mol and k = 3,46×10–5 s–1 at 298 K.
Phản ứng phân hủy N O trong CCl 2 5
4 tuân theo động học bậc 1. Có Ea =1,06×105 J/mol,k = 3,46×10–5s–1 ở 298
K. Tìm thời gian bán hủy của phản ứng phân hủy N O ở 75,0 °C. 2 5
N2O5 (in CCl4) N2O4 (in CCl4) + ½ O2 (g)
18. (EX-14-9B) At what temperature will it take 1.50 h for two-thirds of a sample of N O in to 2 5 decompose in Example 17.
Phản ứng phân hủy N O trong CCl 2 5
4 tuân theo động học bậc 1. Có Ea =1,06×105 J/mol,k = 3,46×10-5 s–1 ở 298
K. Xác định nhiệt độ phản ứng để 2/3 lượng mẫu N O trong CCl 2 5
4 phân hủy trong 1,5 h?
19. (EX-14-10A) In a proposed two-step mechanism for the reaction CO(g) + NO (g) CO (g) + 2 2
NO(g), the second, fast step is NO (k) + CO(k) → CO (k) + NO (k). What must be the slow step? 2 2 2
What would you expect the rate law of the reaction to be? Explain.
Cơ chế của phản ứng CO(k) + NO (k) CO (k) + NO(k) được đề xuất gồm 2 giai đoạn. Giai đoạn nhanh là 2 2
NO (k) + CO(k) CO (k) + NO (k). Theo bạn, phản ứng giai đoạn chậm xảy ra như thế nào? Phương 2 2 2
trình động học của phản ứng này là gì?
20. (EX-14-10B) Show that the proposed mechanism for the reaction 2 NO (g) + F (g) 2 NO F (g) 2 2 2
is plausible. The rate law is rate = k[NO ][F ]. 2 2 NO (g) + F (g) NO F (g) : 2 2 2 2 fast NO F (g) NO F(g) + 2 2 2 F(g) : slow F(g) + NO (g) 2 NO F(g) : fast 2
Chứng tỏ cơ chế đề nghị của phản ứng 2 NO (k) + F (k) 2 NO F (k) phù hợp với phương trình động học v 2 2 2
= k[NO ][F ] . 2 2
NO (k) + F (k) NO F (k) : nhanh 2 2 2 2
NO F (k) NO F(k) + F(k) : chậm 2 2 2
F(k) + NO (k) NO F(k) : nhanh 2 2
21. (E5) In the reaction A products, 4.40 min after the reaction is started, A = 0.588 M. The rate
of reaction at this point is rate = –At = 2.2×10–2 M min–1. Assume that this rate remains
constant for a short period of time.
a) What is A 5.00 min after the reaction is started?
b) At what time after the reaction is started will A = 0.565 M?
Cho phản ứng A sản phẩm, nồng độ của A là 0.588 M tại thời điểm 4,40 phút sau khi phản ứng bắt đầu.
Vận tốc phản ứng tại thời điểm đó là 2,2×10–2 Mph–1. Biết rằng tốc độ phản ứng không đổi trong khoảng
thời gian ngắn.
(a) Xác định nồng độ A sau khi phản ứng được 5 phút.
(b) Phản ứng xảy ra được được bao lâu khi nồng độ A 0,565 M?
22. (E10) At the half-life for the first-order decomposition of N2O5(g) is 2.38 min.
N2O5(g) 2 NO2(g) + 1/2 O2(g)
If 1.00 g of N2O5(g) is introduced into an evacuated 15 L flask at 65 °C,
(a) What is the initial partial pressure, in mmHg, of N2O5(g)?
(b) What is the partial pressure, in mmHg, of N2O5(g) after 2.38 min?
(c) What is the total gas pressure, in mmHg, after 2.38 min?
Tại nhiệt độ 65 oC, thời gian bán hủy của phản ứng phân hủy bậc 1 của N2O5(g) là 2,38 phút.
N2O5(g) 2NO2(g) + 1/2 O2(g)
Nếu 1,00 g N2O5 được cho vào bình kín có dung tích 15 L (không trao đổi chất với môi trường ngoài) tại
nhiệt độ 65 oC
(a) Tính áp suất riêng phần của N2O5 tại thời điểm ban đầu (t=0)?
(b) Tính áp suất riêng phần của N2O5 tại thời điểm sau khi phản ứng được 2,38 phút?
(c) Tính áp suất tổng trong bình kín tại thời điểm sau khi phản ứng được 2,38 phút? Tất cả đơn vị áp suất
được tính bằng mm Hg.
23. (E20) In the first-order reaction A products, A = 0.816 M initially and 0.632 M after 16.0 min.
(a) What is the value of the rate constant, k?
(b) What is the half-life of this reaction?
(c) At what time will A = 0.235 M?
(d) What will A be after 2.5 h?
Cho phản ứng bậc một A sản phẩm, nồng độ ban đầu của A là 0,816 M và giảm còn 0,632 M sau 16,0 phút.
(a) Tính hằng số tốc độ k của phản ứng?
(b) Tìm thời gian bán hủy của phản ứng bậc 1?
(c) Tìm thời gian phản ứng tại đó nồng độ A là 0,235 M?
(d) Tính nồng độ A tại thời điểm phản ứng được 2,5 giờ?
24. (E22) The half-life of the radioactive isotope phosphorus-32 is 14.3 days. How long does it take
for a sample of phosphorus-32 to lose 99% of its radioactivity?
Thời gian bán hủy của đồng phân phóng xạ 32P (phốt pho) là 14,3 ngày. Tính khoảng thời gian cần thiết để
lượng phốt pho phân hủy hết 99%?
25. (E23) Acetoacetic acid, CH3COCH2COOH, a reagent used in organic synthesis,
decomposes in acidic solution, producing acetone and CO2(g).
CH3COCH2COOH(aq) CH3COCH3(aq) + CO2(g)
This first-order decomposition has a half-life of 144 min.
a) How long will it take for a sample of acetoacetic acid to be 65% decomposed?
(b) How many liters of CO2(g), measured at 24.5 °C and 748 Torr, are produced as a 10.0 g sample
of CH3COCH2COOH decomposes for 575 min? [Ignore the aqueous solubility of CO2(g).
Axít acetoacetic, CH3COCH2COOH, tiền chất được sử dụng nhiều trong tổng hợp hữu cơ. Chúng phân hủy
trong môi trường axít để hình thành acetone và CO2(g).
CH3COCH2COOH(aq) CH3COCH3(aq) + CO2(g)
Thời gian bán hủy của phản ứng phân hủy bậc 1 này là 144 phút tại nhiệt độ 24,5oC.
(a) Tìm thời gian để axít acetoacetic phân hủy 65%?
(b) Tính thể tích khí CO2 sinh ra sau khi phản ứng xảy ra được 575 phút khi lượng axít acetoacetic ban đầu
là 10,0 g (đo thể tích tại điều kiện 24,5oC và 748 Torr). Bỏ qua sai xót do lượng CO2 tan trong nước.
26. (E26) The decomposition of dimethyl ether at 504 °C is (CH3)2O(g) CH4(g) + H2(g) + CO(g)
The following data are partial pressures of dimethyl ether (DME) as a function of time: t = 0, PDME =
312 mmHg; 390 s, 264 mmHg; 777 s, 224 mmHg; 1195 s, 187 mmHg; 3155 s, 78.5 mmHg.
(a) Show that the reaction is first order.
(b) What is the value of the rate constant, k?
(c) What is the total gas pressure at 390 s?
(d) What is the total gas pressure when the reaction has gone to completion?
(e) What is the total gas pressure at = 1000 s?
Sự phân hủy dimethyl ether xảy ra tại nhiệt độ 504 oC như sau
(CH3)2O(g) CH4(g) + H2(g) + CO(g)
Áp suất riêng phần của dimethyl ether (DME) là hàm theo thời gian đo được như trong bảng sau t(giây) P(mmHg) 0 312 390 264 777 224 1195 187 3155 78,5
(a) Chứng minh rằng phản ứng phân hủy này có bậc phản ứng là một.
(b) Tính giá trị của hằng số tốc độ phản ứng k?
(c) Tính áp suất tổng của phản ứng tại thời điểm phản ứng xảy ra được 390 giây?
(d) Tính áp suất tổng khi phản ứng phân hủy xảy ra hoàn toàn?
(e) Tính áp suất tổng của phản ứng tại thời điểm phản ứng xảy ra được 1000 giây?
Biết phản ứng xảy ra trong hệ kín với thể tích và nhiệt độ không đổi.
27. (E36) For the disproportionation of p-toluenesulfinic
acid 3ArSO2H ArSO2Ar + ArSO3H + H2O
(where Ar = p-CH3C6H4–), the following data were obtained: t = 0 min, ArSO2H = 0,100 M; 15
min, 0.0863 M; 30 min, 0.0752 M; 45 min, 0.0640 M; 60 min, 0.0568 M; 120 min, 0.0387 M; 180
min, 0.0297 M; 300min, 0.0196 M.
(a) Show that this reaction is second order.
(b) What is the value of the rate constant, k?
(c) At what time would ArSO2H = 0.0500 M
(d) At what time would ArSO2H = 0.2500 M
(e) At what time would ArSO2H = 0.0350
M Phản ứng phân hủy p-toluenesulfinic
acid, 3ArSO2H ArSO2Ar + ArSO3H + H2O
(Với Ar = p-CH3C6H4–), ghi nhận được nồng độ của ArSO2H theo thời gian như sau t(phút)
ArSO2H (M) 0 0,100 15 0,0863 30 0,0752 45 0,0640 60 0,0568 120 0,0387 180 0,0297 300 0,0196
(a) Chứng tỏ phản ứng có bậc là 2.
(b) Tìm hằng số tốc độ của phản ứng k?
(c) Tìm thời gian phản ứng khi nồng độ của ArSO2H là 0,0500M?
(d) Tìm thời gian phản ứng khi nồng độ của ArSO2H là 0,0250M?
(e) Tìm thời gian phản ứng khi nồng độ của ArSO2H là 0,0350M?
28. (E38) The following data were obtained for the dimerization of 1,3-butadiene, 2 C4H6(g) C
8H12(g), at 600 K: t = 0 min, C4H6 =0,0169 M; 12.18 min, 0.0144 M; 24.55 min, 0.0124 M; 42.50 min, 0.0103 M; 68.05 min, 0.00845 M.
(a) What is the order of this reaction?
(b) What is the value of the rate constant, k? (c) At what time would C 4H6 =0.0423 M? (d) At what time would C 4H6 =0.0050 M?
Nghiên cứu phản ứng dime hóa 1,3-butadiene, 2 C4H6(g) C8H12(g), tại nhiệt độ 600 K thu được kết quả sau t(phút)
C4H6 (M) 0 0,0169 12,18 0,0144 24,55 0,0124 42,50 0,0103 68,05 0,00845
(a) Xác định bậc phản ứng tổng quát.
(b) Tìm hằng số tốc độ của phản ứng k?
(c) Tìm thời gian phản ứng khi nồng độ của C4H6 là 0,0423M?
(d) Tìm thời gian phản ứng khi nồng độ của C4H6 là 0,0050M?
29. (E41) In three different experiments, the following results were obtained for the reaction A products:
A0 = 1.00 M, t1/2 = 50 min; A0 = 2.00 M, t1/2 = 25 min; A0 = 0.50 M, t1/2 = 100 min. Write the rate
equation for this reaction, and indicate the value of k?
Trong 3 thí nghiệm khác nhau, kết quả thu được của phản ứng A sản phẩm cho trong bảng sau
A0 (M) t1/2(min) 1,00 50 2,00 25 0,50 100
Với A0 là nồng độ đầu của A tại các thí nghiệm khác nhau, t1/2 thời gian bán hủy. Xác định phương trình
tốc độ của phản ứng, và tính giá trị k của phản ứng.
30. (E43) The half-lives of both zero-order and second-order reactions depend on the initial
concentration, as well as on the rate constant. In one case, the half-life gets longer as the initial
concentration increases, and in the other it gets shorter. Which is which, and why isn’t the situation the same for both?
Thời gian bán hủy của phản ứng bậc 0 và bậc 2 phụ thuộc vào nồng độ ban đầu của tác chất với hằng số
tốc độ tương ứng. Trong một trường hợp, thời gian bán hủy tăng khi tăng nồng độ ban đầu, trường hợp
còn lại thì ngược lại khi tăng nồng độ thời gian bán hủy giảm. Tại sao hai phản ứng bậc 0 và 2 lại không giống nhau? 31. (E45) Explain why
(a) Areaction rate cannot be calculated from the collision frequency alone.
(b) The rate of a chemical reaction may increase dramatically with temperature, whereas the
collision frequency increases much more slowly.
(c) The addition of a catalyst to a reaction mixture can have such a pronounced effect on the rate
of a reaction, even if the temperature is held constant.
Giải thích tại sao
a. Tốc độ phản ứng không thể được tính chỉ với tần số va chạm.
b. Tốc độ phản ứng có thể tăng nhanh khi tăng nhiệt độ, trong khi đó tần số va chạm tăng rất ít.
c. Khi xúc tác được thêm vào hỗn hợp của phản ứng nó làm tăng vận tốc phản ứng tương ứng, khi giữ nguyên nhiệt độ?
32. (E54) The reaction C2H5I + OH- C2H5OH + I-, was studied in an ethanol solution, and the
following rate constants were obtained:
(a) Determine for this reaction by a graphical method.
(b) Determine by the use of equation (14.22).
(c) Calculate the value of the rate constant k at 100.0 °C.
Phản ứng C2H5I + OH– C2H5OH + I– xảy ra trong môi trường ethanol, hằng số tốc độ phụ thuộc vào nhiệt
độ như trong bảng sau
a. Tính năng lượng hoạt hóa của phản ứng Ea bởi phương pháp đồ thị.




